我也来问问,有没有柠檬黄检测用标准品或试剂?柠檬黄标准品对氨基苯磺酸钠1-(4’-磺酸基苯基)-3-羧基-5-吡唑啉酮二钠盐1-(4’-磺酸基苯基)-3-羧酸甲(乙)酯基-5-吡唑啉酮钠盐4,4-(重氮亚氨基)二苯磺酸二钠盐R盐苯胺
柠檬醛标准品为液体,0.25g,请问如何建立柠檬醛标准曲线?
样品中加入的柠檬酸钠,检测的时候用的是柠檬酸标准品,检测结果如何计算?需要转为柠檬酸钠吗?
请问化妆品中香柠檬烯测定有什么标准?
请问化妆品中香柠檬烯的测定有什么标准?
各位 谁有羟基柠檬酸钾的 质量标准 检测指标 操作规程 都可以 羟基柠檬酸钾里面含有羟基柠檬酸 羟基柠檬酸钠 羟基柠檬酸钙 等 如何检测?谢谢
请问一下柠檬酸铅染色的原理是什么?是选择染含羧酸类的物质吗? 酰胺会被染色吗?如果酰胺类高分子材料, 如何进行染色? 是将超薄片浸到柠檬酸铅的溶液中还是熏啥的?时间多长?有高手了解这种制样条件吗?
添加剂-柠檬酸在日本笋及笋制品的标准中有没有什么限量规定?国内好像对这个没有限量有求哦。哪位达人帮忙下,或者哪里可以查得到的。谢谢啦。
食品安全国家标准 食品添加剂 柠檬酸钾
求助在钨精矿的钼含量测定中,柠檬酸铵屏蔽钨的原理,对于60-70品位的钨需要多少柠檬酸铵屏蔽?在加了2毫升50%柠檬酸,5毫升的样液与加了4毫升50%柠檬酸,10毫升样液的读数不一致,差别很大,其中5毫升的读数比10毫升的读数高,样液中钨的含量在50左右,请问这是为啥啊,求好心的哥哥姐姐帮偶啊
求气质联用仪检测柠檬烯和柠檬醛的国标方法。。。我们用柠檬烯的标准品走图,但是出来的峰没有一个是显示是柠檬烯的。(柠檬醛也是一样)是方法有问题吗?求气质联用仪检测柠檬烯和柠檬醛的国标方法。。。谱图库里是可以找到柠檬烯和柠檬醛的。。。而且分流衬管是刚换,载气没有问题,老化了两次柱子这是为什么?
求柠檬酸新版国家标准GB/T 8269-2006柠檬酸,谢谢!
本标准代替GB 6772-1986本标准规定了食品添加剂冷磨柠檬油的要求、试验方法、检验规则、标志、包装、运输、贮存及保质期。
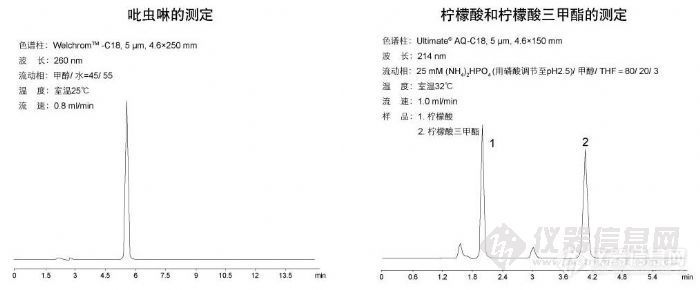
吡虫啉的测定与柠檬酸和柠檬酸三甲酯的测定http://ng1.17img.cn/bbsfiles/images/2009/11/200911131345_184266_1896702_3.jpg
GB 4481.1-2010 食品安全国家标准 食品添加剂 柠檬黄.pdf
请告知氨水及柠檬酸钠国家标准。3820209000@163.com
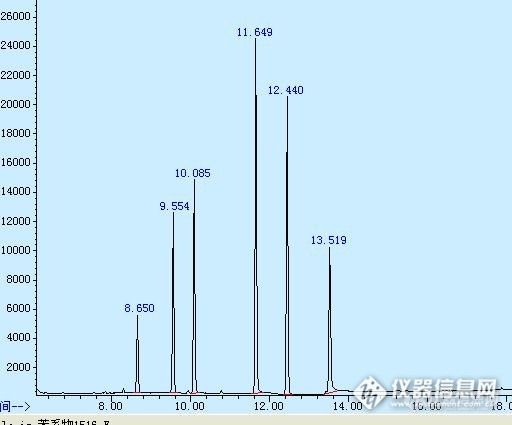
1.最近测试购买的标准品柠檬醛(Citral)时,发现有两组成分,上网查阅和ms谱图检索得知是柠檬醛a和b,而标准品的标签中并没有说明柠檬醛a和b,笼统说Citral。那么如何知道柠檬醛a和b的比例呢?通过gc-ms发现柠檬醛a和b的面积比为0.4299(全扫描得到面积a/b=0.4299),这样计算可靠吗?2.在SIM过程中,如何选择两者的定量和定性离子呢?3.假如称取0.1g柠檬醛标准品,那么如何制作柠檬醛a和b标准曲线呢?http://ng1.17img.cn/bbsfiles/images/2015/06/201506171542_550495_1794257_3.jpg附图中8.65min为柠檬醛a(cas 141-27-5);9.554min为柠檬醛b(cas 106-26-3)急盼老师指导,谢谢!
【序号】:1【作者】: 刘瑞雪李迎博李义梦【题名】:壳聚糖-柠檬酸/聚丙烯酰胺双网络水凝胶的构筑与性能研究【期刊】:轻工学报. 【年、卷、期、起止页码】:2020,35(01)【全文链接】:[url]https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CJFD&dbname=CJFDLAST2020&filename=ZZQB202001010&uniplatform=NZKPT&v=Pvt8fcHLmb1juBYZRNvOvaQSp75QdFQX9gM12w06v6xUnnsnHkRZeMCSj2-PFys4[/url]
谁有柠檬酸铵的测试标准或方法?急!
[color=#444444]鸡精里的柠檬黄和日落黄色素检测按哪个标准?用5009.35可以测吗?[/color]
GB 1987-2007 食品添加剂 柠檬酸本标准适用于由淀粉或糖质原料发酵制得的柠檬酸产品,在食品加工中用于酸味剂、抗氧化增效剂及调味剂。
络合滴定法测定柠檬酸电解液中游离柠檬酸根的浓度,采用过量亚铁离子(Fe2+)与柠檬酸根离子络合,用标准EDTA溶液滴定过量亚铁离子,应该用什么指示剂呢?
求助在钨精矿的钼含量测定中,柠檬酸铵屏蔽钨的原理,对于60-70品位的钨需要多少柠檬酸铵屏蔽?在加了2毫升50%柠檬酸,5毫升的样液与加了4毫升50%柠檬酸,10毫升样液的读数不一致,差别很大,其中5毫升的读数比10毫升的读数高,样液中钨的含量在50左右,请问这是为啥啊,求好心的哥哥姐姐帮偶啊
本人最近刚好在做色素分析,就申请了本次实验室比对,感谢仪器信息网组织本次实验室比对活动,同时也感谢北京曼哈格生物科技有限公司和北京振翔科技有限公司为本次活动提供样品和聚酰胺固相萃取柱(7月4号收到样品和固相萃取柱)。因为我的图片上传不了,我就不上传图片了。本次实验参照《GB 5009.35-2016 食品安全国家标准食品中合成着色剂的测定》来进行。样品前处理方法完全按照GB 5009.35-2016前处理方法,分析仪器为安捷伦1290 Infinity LC,色谱柱为迪马Spursil C18-EP柱(4.6mm×250mm,5μm),柱温35℃,流速0.8mL/mL,进样量10μL,DAD检测器波长254nm。梯度洗脱条件如下: [table=64%][tr][td] [align=center]时间[/align] [align=center]min[/align] [/td][td] [align=center]流速[/align] [align=center]mL/min[/align] [/td][td] [align=center]0.02mol/L乙酸铵[/align] [align=center]%[/align] [/td][td] [align=center]甲醇[/align] [align=center]%[/align] [/td][/tr][tr][td] [align=center]0[/align] [/td][td] [align=center]0.8[/align] [/td][td] [align=center]95[/align] [/td][td] [align=center]5[/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]0.8[/align] [/td][td] [align=center]95[/align] [/td][td] [align=center]5[/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]0.8[/align] [/td][td] [align=center]65[/align] [/td][td] [align=center]35[/align] [/td][/tr][tr][td] [align=center]13[/align] [/td][td] [align=center]0.8[/align] [/td][td] [align=center]5[/align] [/td][td] [align=center]95[/align] [/td][/tr][tr][td] [align=center]16[/align] [/td][td] [align=center]0.8[/align] [/td][td] [align=center]5[/align] [/td][td] [align=center]95[/align] [/td][/tr][tr][td] [align=center]16.10[/align] [/td][td] [align=center]0.8[/align] [/td][td] [align=center]95[/align] [/td][td] [align=center]5[/align] [/td][/tr][tr][td] [align=center]21[/align] [/td][td] [align=center]0.8[/align] [/td][td] [align=center]95[/align] [/td][td] [align=center]5[/align] [/td][/tr][/table]通过上述条件得到的标准曲线如下表所示。 [table][tr][td] [align=center]组分[/align] [/td][td] [align=center]校正曲线[/align] [/td][td] [align=center]浓度范围(μg/mL)[/align] [/td][td] [align=center]相关系数R[sup]2[/sup][/align] [/td][/tr][tr][td] [align=center]柠檬黄[/align] [/td][td] [align=center]Y=19.927X+2.229[/align] [/td][td] [align=center]1.96~19.56[/align] [/td][td] [align=center]0.9999[/align] [/td][/tr][tr][td] [align=center]日落黄[/align] [/td][td] [align=center]Y=15.048X+0.913[/align] [/td][td] [align=center]1.46~14.58[/align] [/td][td] [align=center]1.0000[/align] [/td][/tr][/table]通过样品和标准品色谱图比较可以发现,苹果汁样品经过前处理后杂质峰已经很少,说明此前处理手段对色素测定有很好的效果。同时,我也利用寄送过来的聚酰胺固相萃取柱来进行同样过程的样品前处理,利用相同测定方法进行分析,得出结果与聚酰胺粉前处理的结果相吻合。本次草根能力对比给我印象最深的就是利用聚酰胺固相萃取柱来进行样品前处理相比于聚酰胺粉来做前处理要简单方便很多,不需要再进行减压过滤等操作,大大提高工作效率,并且对测定结果无影响。以后做色素分析的话可以考虑利用聚酰胺固相色谱柱来进行样品前处理。以上就是我做此次草根比对的过程和一点点小的体会,有什么不对的地方望广大坛友批评指正!谢谢大家!
根据中国《食品添加剂使用卫生标准》,允许使用的合成色素有苋菜红、胭脂红、柠檬黄、日落黄和靛蓝。它们分别用于果味水、果味粉、果子露、汽水、配制酒、红绿丝、罐头,以及糕点表面上彩等。这些合成色素的确把食品表面装扮的格外惹人喜爱,但是,它们禁止用于下列食品:肉类及其加工品(包括内脏加工品)、鱼类及其加工品、水果及其制品 (包括果汁、果脯、果酱、果子冻和酿造果酒、调味品、婴幼儿食品、饼干等。请问:为什么不能用于肉类?(如果在吃肉的时候喝了含柠檬黄的饮料,混在肚子里不是一样了吗?)
菜市场买的藕带白白嫩嫩,于是有市民质疑其被商贩“美容”了,商贩们也坦承:的确美容过,用的就是柠檬酸。然后柠檬酸就此被妖魔化了,近期,关于柠檬酸泡藕带的事情,已经广泛引起市民关注。柠檬酸喊屈:我本安全,何毒之有?武汉市食品药品监督管理局专家站出来了,明确表示,柠檬酸泡过的藕带是安全的,可以放心食用,同时也提醒市民,请分清食品添加剂以及违规添加剂的区别,不要妖魔化食品添加剂。

[align=center]草根能力比对之果汁中柠檬黄、日落黄的检测能力验证经验分享[/align][align=left]一、前言 6月底报名参加了仪器信息网组织的第四十期草根能力比对:果汁中柠檬黄、日落黄的检测,7月3日收到组织方寄来的包裹,主要包含一瓶果汁样品和一包聚酰胺固相萃取柱(500mg/6mL×6支)(以下简称试用柱)。按照惯例,先检查样品的外包装、瓶口的密封性、核对实验室代码、样品编号等信息;测试之前认真阅读参试指导书和测试结果报告单,了解组织方对测试和结果报告的要求,例如测试方法、对数据结果的要求、检测结果上报日期等。[/align][align=center][img=,568,270]http://ng1.17img.cn/bbsfiles/images/2017/09/201709301245_01_1669358_3.jpg[/img][/align][align=left] 食品中合成着色剂的测定对我们而言是非常常规的项目,几乎每周都会有样品要求做此类检测,之前也多次参加过类似项目的能力验证,因此对于此次的能力验证还是胸有成竹的。 能力验证样品非常规食品,样品中待测物质的浓度可能超过或者低于常规样品的检测浓度,因此需要先对样品中待测物质的浓度做个粗略的测试,以确定后期前处理过程的取样量和标准溶液的浓度范围。此次能力验证的基质为果汁,依据以往的经验,果汁测定合成着色剂时的干扰组分较少,因此采取直接稀释、过滤膜的方式对样品进行粗略的测定。其目的有两个,一是计算待测组分的大概浓度范围;二是检查待测组分附近是否有干扰物。二、材料与方法 仪器条件:按照GB/T 5009.35-2003中的液相条件进行测试 色谱柱:CNW Athena C18-WP(250mm×4.6mm ,5μm) 流动相:甲醇:乙酸铵(0.02mol/L) 梯度洗脱:甲醇:20%~35%,3%/min;35%~98%,9%/min;98%继续保持2min 流速:1.0mL/min 柱温:30℃ 检测器:测试波长为254nm三、实验与讨论[/align][align=left] 实验一:样品稀释后直接进样 称取约5g果汁样品于25mL容量瓶中,用水稀释、混匀、定容,经0.45μm滤膜过滤后进样测定,测定结果见下图。[/align][align=center][img=,588,323]http://ng1.17img.cn/bbsfiles/images/2017/09/201709301248_01_1669358_3.jpg[/img][/align][align=left] 通过测试可以发现,果汁样品中待测组分柠檬黄的浓度较小,且附近有干扰物质存在,日落黄的浓度较高,不存在干扰峰,计算后得到果汁样品中柠檬黄的浓度大约为28mg/kg,日落黄的浓度大约为98mg/kg。 有些版友看了果汁样品稀释后进样的色谱图,可能觉得待测组分与干扰峰的分离度和峰形都还不错,应该可以直接定量了,如果真的这么做,很可能会出错,原因有两点:(1)果汁中不仅含有着色剂,通常还会含有甜味剂、防腐剂等添加剂,在此色谱条件下,这些物质也会出峰,如果仪器或者色谱柱等原因导致两者出峰完全重叠,则可能会出现定量不准确;(2)着色剂包含人工合成着色剂和天然着色剂两大类,GB 5009.35 测定的是人工合成着色剂,如果有天然着色剂也会产生干扰,从而引起定量的不准确,GB 5009.35中采用甲醇-甲酸混合溶液和水洗涤就是为了去除天然着色剂和一些水溶性的干扰物。实验二:参照GB 5009.35的方法进行样品前处理 称取约5g果汁样品于100mL烧杯中,加入少量水,加热到60℃,将1g聚酰胺粉倒入样品溶液中,搅拌,以G3垂融漏斗抽滤,然后用甲醇-甲酸(V:V=6:4)混合溶液洗涤,再用水洗至中性,抽干后用乙醇-氨水(V:V=7:3))混合溶液解析,直到色素完全解析,收集解析液,60℃砂浴中氮吹至近干,加水溶解并定容至25mL,经0.45μm微孔滤膜过滤后进样分析。[/align][align=center][img=,583,647]http://ng1.17img.cn/bbsfiles/images/2017/09/201709301251_01_1669358_3.jpg[/img][/align][align=left] 果汁样品经GB 5009.35方法处理后,4.3min的干扰峰明显变小,5.7min的干扰峰完全消失,5.0min和9.6min的色谱峰略有减小。[/align][align=left] 实验三:CNW Poly-sery PA SPE柱净化样品[/align][align=left] 尽管此次草根能力比对的组织者提供了聚酰胺固相萃取柱,但是数量有限,没敢轻易使用,而实验室备有从上海安谱实验科技股份有限公司(以下简称上海安谱)采购的CNW Poly-sery PA SPE固相萃取柱,数量充足,而且在平时测定人工合成着色剂时也有很好的表现,因此先用上海安谱的CNW Poly-sery PA SPE固相萃取柱对样品进行前处理。 称取约1g果汁样品于5mL试管中,用水将果汁样品转移至聚酰胺固相萃取柱中,并用水洗涤试管2~3次,洗涤液一并转移到固相萃取柱中,抽滤至近干,用甲醇-甲酸(V:V=6:4)混合溶液洗涤,再用水洗至中性,抽干后用乙醇-氨水(V:V=7:3)混合溶液解析,直到色素完全解析,收集解析液,60℃砂浴中氮吹至近干,加水溶解并定容至5mL,经0.45μm微孔滤膜过滤后进样分析。[/align][align=center][img=,580,702]http://ng1.17img.cn/bbsfiles/images/2017/09/201709301255_01_1669358_3.jpg[/img][/align][align=left] 测试结果见下图,仪器条件同实验一。[/align][align=center][img=,578,333]http://ng1.17img.cn/bbsfiles/images/2017/09/201709301256_01_1669358_3.jpg[/img][/align][align=left]实验四:试用柱净化样品 样品净化过程和仪器条件同实验三,实验过程和实验结果见下图。[/align][align=center][img=,580,611]http://ng1.17img.cn/bbsfiles/images/2017/09/201709301258_01_1669358_3.jpg[/img][/align][align=left]实验五:自制聚酰胺固相萃取柱净化样品 实验中用到的样品量很少,做完上述实验还剩许多样品,而且距离上报结果的时间还很宽裕,于是突发奇想,决定利用实验室采购的聚酰胺粉自制聚酰胺固相萃取柱,并对样品进行测定,一方面考察自制聚酰胺固相萃取柱的性能,另一方面与上述实验结果进行比对验证。 聚酰胺固相萃取柱的制作过程如下: 1、准备好原材料:锋利的剪刀、废弃的固相萃取柱、同规格的针筒、聚酰胺粉[/align][align=center][img=,586,286]http://ng1.17img.cn/bbsfiles/images/2017/09/201709301300_01_1669358_3.jpg[/img][/align][align=left] 2、用剪刀或美工刀等工具对固相萃取柱进行破拆,取出固相萃取柱中的筛板。筛板在使用前需要用甲醇、水、氨化乙醇等溶液进行清洗,防止有污染,同时防止之前使用过程中筛板有堵塞,影响后续的过柱。筛板烘干后装入合适的针筒中。 3、依据实验用量,称重装入适量的聚酰胺粉,夯实针筒中的聚酰胺粉,此次实验装入的聚酰胺粉质量为500mg。可以在聚酰胺粉上端再装入一个筛板,防止在使用和存放过程中填料发生松动。[/align][align=center][img=,578,293]http://ng1.17img.cn/bbsfiles/images/2017/09/201709301301_01_1669358_3.jpg[/img][/align][align=left] 到此,仅仅简单的几步就将聚酰胺固相萃取柱制作完成了,效果如何呢,用实验数据进行验证。样品净化过程和仪器条件同实验三,实验过程和实验结果见下图。[/align][align=center][img=,588,246]http://ng1.17img.cn/bbsfiles/images/2017/09/201709301302_01_1669358_3.jpg[/img][/align][align=left] 从上述实验可以看出:(1)三款聚酰胺固相萃取柱对待测人工合成着色剂均具有很好的吸附作用;(2)上样量选择1g时未发生柱容量饱和的现象;(3)乙醇-氨水(V:V=7:3)对待测人工合成着色剂具有很好的解析效果,解析液颜色为下深上浅,而且经过解析后聚酰胺固相萃取柱又恢复了原来的本色,解析非常完全;(4)采用聚酰胺固相萃取柱净化后5.7min的干扰峰完全消失,5.0min和9.6min处色谱峰的测定结果相近;(5)不同聚酰胺固相萃取柱对样品的净化效果略有差别,主要体现在4.3min干扰峰的净化效果方面,自制的聚酰胺固相萃取柱净化后4.3min处的干扰峰仍然很大,其峰高和峰面积与采用聚酰胺粉净化的结果相近,试用装聚酰胺固相萃取柱净化后4.3min处干扰峰明显减小,而用CNW Poly-sery PA SPE柱净化后4.3min处干扰峰完全消失,同时不影响5.0min和9.6min处待测组分的峰面积。实验六:标准曲线的绘制与含量计算 根据上述测定结果重新配制标准溶液,绘制标准曲线,进行含量计算。[/align][align=center][img=,588,535]http://ng1.17img.cn/bbsfiles/images/2017/09/201709301303_01_1669358_3.jpg[/img][/align][align=left]实验七:回收率实验 取实验室中不含待测组分的果汁样品,称取一定质量的果汁样品5份,往样品中加入一定体积的柠檬黄、日落黄标准溶液,然后分别按照实验一、实验二、实验三、实验四和实验五的方法进行样品前处理,测定方法的回收率,测定结果如下表。[/align][align=center][img=,690,130]http://ng1.17img.cn/bbsfiles/images/2017/09/201709301305_01_1669358_3.jpg[/img][/align][align=left] 回收率测定结果表明,直接稀释进样和聚酰胺固相萃取柱净化样品后的回收率较高,聚酰胺粉吸附净化样品的回收率略低于其他两种方法。聚酰胺粉净化样品回收率低的原因有以下4种:(1)上样量或者聚酰胺粉的用量不合适,出现聚酰胺粉吸附过载或不完全吸附;(2)聚酰胺粉的质量要求不合适,未达到标准要求,从而出现不完全吸附;(3)解析过程中未完全解析;(4)其他操作过程中的损失,如样品转移、定容、酸洗、水洗等。 本次能力验证样品基质相对简单,而且实验一表明样品直接稀释后进样待测组分与干扰物质的分离度达到检测要求,实验三、实验四和实验五表明待测组分保留时间处没有其它成份的干扰,因此最终决定采用实验一的方法进行测定,并采用实验一的数据做为最终结果,避免做的多错的多,减少操作过程中的损失。 能力验证的实验到此结束,然而爱折腾的人会折腾个没完没了。测完柠檬黄、日落黄后想知道其他两个干扰峰是什么物质。凭借以往的经验,这两种物质为色素、甜味剂和防腐剂的可能性比较大,这三类物质是果汁中的常见添加剂。人工合成着色剂的可能性排除,原因为:(1)与5种人工合成着色剂的保留时间不一致;(2)酸洗、水洗后峰面积明显变小,GB 5009.35中除了赤藓红,其它人工合成着色剂不会出现这种情况。 排除了其他人工合成着色剂存在的可能,于是在上述仪器条件下测定甜味剂糖精钠和安赛蜜,防腐剂山梨酸和苯甲酸的单标及混合标准溶液,测定结果如下图。[/align][align=center][img=,588,854]http://ng1.17img.cn/bbsfiles/images/2017/09/201709301307_01_1669358_3.jpg[/img][/align][align=left] 通过上述测定,依据保留时间定性,4.4min的干扰物质可能为安赛蜜,5.7min的干扰物质可能是苯甲酸或糖精钠。实验室没有质谱,因此只能通过保留时间做个简单的判断。在此仪器条件下,糖精钠和苯甲酸的色谱峰发生了重叠,从而进一步表明,测定人工合成着色剂时需要通过酸洗和水洗来排除干扰,避免出现类似于糖精钠和苯甲酸重叠的现象。 8月初收到结果通知单,两种待测物质的结果评价均为满意,其中柠檬黄的测定值与指定值相同,进一步表明上述实验方法与结果的正确性。[/align][align=center][img=,407,419]http://ng1.17img.cn/bbsfiles/images/2017/09/201709301309_01_1669358_3.jpg[/img][/align][align=left]四、小结 针对此次能力验证做个简单的小结,小结如下: (1)采用聚酰胺固相萃取柱净化样品测定人工合成着色剂时回收率高,试剂用量少,适用于样品的批量处理; (2)样品处理过程中吸附和解析的时候控制流速,可以先让其吸附/解析一会再抽滤,以保证吸附/解析完全; (3)不同聚酰胺固相萃取柱对样品的净化效果产生差别的原因,一方面可能与填料有关,因为实验二和实验五采用的是相同填料,4.3min处都存在较大的干扰峰,另一方面可能与水洗有关,标准中要求水洗至中性,因此水洗的次数会有差别,而安赛蜜是水溶性的,不同剂量的水对安赛蜜的去处能力也是不同的; (4)自制聚酰胺固相萃取柱的填料松散不一,填料上端不加筛板时,在样品前处理以及存放的过程中容易出现填料松动,以及填料随着试剂浮动的现象,可能会影响实验到实验数据的重复性; (5)破拆筛板的过程需要注意安全,如果想省事,可以直接购买筛板或者带筛板的空柱,然后自行装填填料; (6)GB/T 5009.35-2003方法已经失效,但是前处理方法与新标准相似,梯度方法略有差别,以往实验中采用旧标准的梯度洗脱条件对人工合成着色剂的分离状况可以满足实验要求,因此本次试验方法依然采用了GB/T 5009.35-2003的分析方法。[/align]
[align=center][b][font=宋体]柠檬酸含量的测定方法及注意事项[/font][/b][/align][align=center][b][font=宋体] [/font][/b][/align][font=宋体]1.[/font][font=宋体]概述[/font][font=宋体]柠檬酸是一种果酸,也叫枸橼酸,能够加快更新皮肤角质,其具备的酸性特质可用做调味剂、日化用品、防腐剂等,主要作用如下:[/font][font=宋体]食品添加剂:柠檬酸是一种有机酸,酸味较强,在柑橘、菠萝、柠檬等水果中含量较高,口感较好。可以适量加入到饮料、食品中,具有增进食欲、提高口感的作用。[/font][font=宋体]防腐剂:柠檬酸属于酸类,且酸性较强,其形成的酸性环境可以抑制细菌的生长,从而避免食物变质,达到防腐的效果。[/font][font=宋体]2.仪器[/font][font=宋体][font=宋体]三角瓶:[/font][font=宋体]150mL[/font][/font][font=宋体]碱式滴定管。[/font][font=宋体]3.试剂和溶液[/font][font=宋体][font=宋体]氢氧化钠标准滴定溶液[/font][font=宋体][c(NaOH)=0.5mol/L]:按GB/T601配制与标定。[/font][/font][font=宋体][font=宋体]酚酞指示液([/font][font=宋体]10g/L):按GB/T603配制。[/font][/font][font=宋体][font=宋体]无二氧化碳的水:按[/font][font=宋体]GB/T603配制。[/font][/font][font=宋体]4.分析步骤[/font][font=宋体][font=宋体]称取试样[/font][font=宋体]1g(精确至0.0001g)于三角瓶内,加入无二氧化碳水50 mL溶液,加酚酞指示液3滴,用氢氧化钠标准滴定溶液滴定至粉红色为终点。同时作空白试验。[/font][/font][font=宋体]5.计算[/font][font=宋体][font=宋体]一水柠檬酸的含量按式([/font][font=宋体]1)计算,无水柠檬酸的含量按式(2)计算。[/font][/font][font=宋体] [font=宋体]X1=(V1-V0)×c×0.06404 ×100 (1)[/font][/font][font=宋体] [font=宋体]m1×(1-0.08566)[/font][/font][font=宋体] [font=宋体]X2= (V1-V0)×c×0.06404 ×100 (2)[/font][/font][font=宋体] [font=宋体]m1[/font][/font][font=宋体]式中:[/font][font=宋体]X1─一水柠檬酸的含量,%;[/font][font=宋体]V1─试样滴定所耗氢氧化钠标准滴定溶液的体积,[/font][font=宋体]mL;[/font][font=宋体]V0[/font][font=宋体]─空白滴定所耗氢氧化钠标准滴定溶液的体积,[/font][font=宋体]mL;[/font][font=宋体]c[/font][font=宋体]─氢氧化钠标准滴定溶液的浓度,[/font][font=宋体]mol/L;[/font][font=宋体]0.06404[/font][font=宋体]─与1.00[/font][font=宋体] [font=宋体]ml氢氧化钠[c(NaOH)=1.000mol/L]相当的以克表示的无水柠檬酸的克数[/font][/font][font=宋体]m1[/font][font=宋体]─试样质量,g;[/font][font=宋体]0.08566─ 一水柠檬酸中水理论含量,即18/210.14=0.08566[/font][font=宋体]X2─无水柠檬酸的含量%。[/font][font=宋体]6.注意事项[/font][font=宋体]1)[/font][font=宋体][font=宋体]根据酸碱中和原理[/font][font=宋体],用碱标准溶液滴定试样液中的酸时,以酚酞为指示剂。当滴定至终点溶液呈浅红色,且30s不褪色时,根据滴定时消耗的标准NaOH溶液的体积。[/font][/font][font=宋体]对于褪色大家要仔细查看,必要的找一个背板观察。[/font][font=宋体]2)在重复性条件下获得的两次独立测定结果的绝对差值不大于算术平均值的0.2%[/font][font=宋体],个人认为滴定过程很是看眼一个实验人员的手法。精密度不好实验不通过。[/font][font=宋体]3)建议滴定管使用时,利用同一个刻度线的方法确定起始点,这样滴定的体积计算更准确。[/font][font=宋体] [/font][font=宋体] [/font]
1 柠檬酸科技名词定义中文名称:柠檬酸 英文名称:citric acid 定义:三羧酸循环中从草酰乙酸与乙酰辅酶A首先合成的三羧酸化合物。 所属学科:生物化学与分子生物学(一级学科);新陈代谢(二级学科) 百科名片柠檬酸是一种重要的有机酸,又名枸橼酸,无色晶体,常含一分子结晶水,无臭,有很强的酸味,易溶于水。其钙盐在冷水中比热水中易溶解,此性质常用来鉴定和分离柠檬酸。结晶时控制适宜的温度可获得无水柠檬酸。在工业,食品业,化妆业等具有极多的用途。理化特性 中文名称: 柠檬酸 英文名称: citric acid 中文名称2: 2-羟基丙烷-1,2,3-三羧酸 英文名称2: 2-hydroxy-1,2,3-propanetricarboxylic acid CAS No.: 77-92-9 分子式: C6H8O7 分子量: 192.14 外观与性状: 白色结晶粉末,无臭。 柠檬酸分子式熔点(℃): 153 沸点(℃): (分解) 相对密度(水=1): 1.6650 闪点(℃): 100 引燃温度(℃): 1010(粉末) 爆炸上限%(V/V): 8.0(65℃) 离解常数(25℃):Ka1=7.4×10^-4,Ka2=1.7×10^-5,Ka3=4.0×10^-7 溶解性:溶于水、乙醇、丙酮,不溶于乙醚、苯,微溶于 柠檬酸氯仿。水溶液显酸性。 物理性质 :在室温下,柠檬酸为无色半透明晶体或白色颗粒或白色结晶性粉末,无臭、味极酸,在潮湿的空气中微有潮解性。它可以以无水合物或者一水合物的形式存在:柠檬酸从热水中结晶时,生成无水合物;在冷水中结晶则生成一水合物。加热到78 °C时一水合物会分解得到无水合物。在15摄氏度时,柠檬酸也可在无水乙醇中溶解。 柠檬酸结晶形态因结晶条件不同而不同,有无水柠檬酸C6H8O7也有含结晶水的柠檬酸2C6H8O7.H2O、C6H8O7.H2O或C6H8O7.2H2O。 化学性质:从结构上讲柠檬酸是一种三羧酸类化合物,并因此而与其他羧酸有相似的物理和化学性质。加热至175 °C时它会分解产生二氧化碳和水,剩余一些白色晶体。柠檬酸是一种较强的有机酸,有3个H+可以电离;加热可以分解成多种产物,与酸、碱、甘油等发生反应。 编辑本段天然存在 天然柠檬酸在自然界中分布很广,天然的柠檬酸存在于植物如柠檬、柑橘、菠萝等果实和动物的骨骼、肌肉、血液中。人工合成的柠檬酸是用砂糖、糖蜜、淀粉、葡萄等含糖物质发酵而制得的,可分为无水和水合物两种。纯品柠檬酸为无色透明结晶或白色粉末,无臭,有一种诱人
SPME-[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]GC-MS[/color][/url]测试问题:八份样品,每一份样都是12颗山苍子果实,用液氮充分研磨混匀后,先称一次测试,剩余磨好的样品装于2mL离心管超低温保存。过一礼拜,再剩余样品补做两个平行,结果出峰跟第一次比,差异很大。图一是第一次,19.16出峰处柠檬烯,27.17和28.11是柠檬醛两个异构体,单个柠檬醛是柠檬烯六七倍左右峰面积,出峰正常合理。图二是补做的平行,柠檬烯峰面积大于柠檬醛,很异常。两次实验都是一样操作:每一个顶空瓶里加了10ug/mL癸酸乙酯乙醇溶液100uL作为内标,仪器条件也相同,都是50度加热振摇吸附45min,分流100:1进样。不知道啥原因导致的?问题还没解决,请各位专家指点。类似的问题在常规液体进样出现过:以前用无水乙醇稀释山苍子精油,常规液体1uL上机,分流比20:1进样,大部分时候都正常的,柠檬醛峰面积占70-80%左右。有一次,同一个序列里前面样品也是差不多这样比例,后面的样品出峰,柠檬醛比例下降幅度很大。重新吸取同样的山苍子精油,用无水乙醚稀释上机恢复正常了。当时怀疑不同批次的乙醇导致,但是不确定,也不知道原理,当时解决了就没再纠结。[img=图一:正常出峰比例,690,517]https://ng1.17img.cn/bbsfiles/images/2024/07/202407250909384282_7513_1912751_3.jpg!w690x517.jpg[/img][img=图二:异常出峰比例,690,517]https://ng1.17img.cn/bbsfiles/images/2024/07/202407250909495999_7556_1912751_3.jpg!w690x517.jpg[/img]