自制杂质对照品,新药申报时杂质含量方面需要做哪些工作?按照CTD格式要求,对于自制对照品应该“简述含量和纯度标定的方法及结果”,具体做应该怎么做?请各位专家指导,谢谢!
[color=#DC143C]请问大家在用TLC测定有关物质的时候,有没有遇到过把供试品溶液稀释N倍后作为对照溶液的情况?我很疑惑:供试品溶液的浓度比对照溶液深,为什么杂质斑点不得比对照溶液深呢?这样的对照能说明什么问题呢?谢谢![/color]我是在中国药典上见到的这种方法:乙胺嘧啶的有关物质(05版CP第3页):取本品,加三氯甲烷-甲醇(9:1)制成每1ml中含20mg的溶液,作为供试品溶液;精密量取适量,加同一溶剂稀释成每1ml中含50ug的溶液,作为对照溶液。照薄层色谱法检验,……供试品溶液如显杂质斑点,与对照溶液的主斑点比较,不得更深。
如题,请知道的朋友告诉我,先谢谢了! 我即将参与做的一个3.1类新药项目,其杂质定量研究正需要考虑这个响应因子的问题,以前做的都是补充申请,还没有考虑响应因子不一致的情况,现在考虑了一个方案,那就是液相色谱检测,液相色谱和紫外同步进行,如果我们这个新药项目杂质可得,并且有对照品,那么就可以绘制杂质和对照品的标准曲线,杂质标准曲线的斜率除以对照品标准曲线的斜率的比值就是响应因子吧?我想参照指导原则确定到底什么范围时可以用主成分的自身对照法计算含量,什么范围时,宜用杂质对照品法计算含量,也可用加校正因子的主成分自身对照法?您有好的建议吗?期待您的帮助。
相关物质检测的时候通常会用到杂质对照品,关于这个杂质对照品你是如何管理的?对它的含量与纯度有木有做过分析检测?有效期是怎么规定的?
一直很纠结,杂质对照品的稳定性需要做吗?我曾请教过别人说是不用作,可是如果不做,当作为对照品时,无论结构还是浓度一旦发生变化,岂不是杂质的检测就受影响吗?
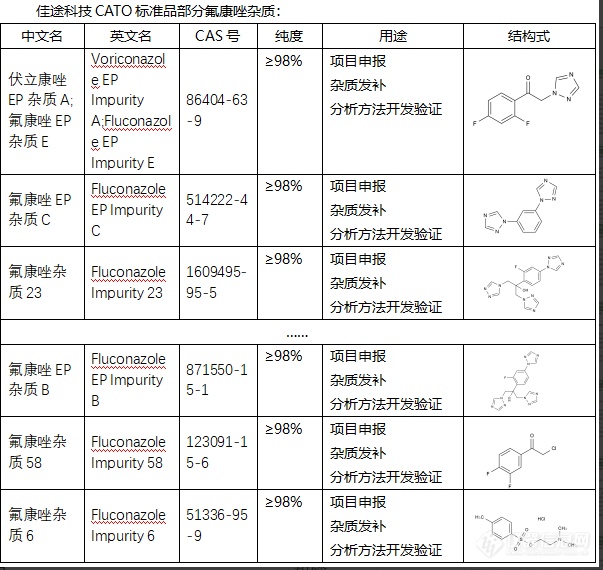
氟康唑杂质可能来自原料药、副反应产物或分解产物,以及其在存储过程中可能发生的变化。这些杂质如果未被及时检测和控制,可能对药物的效力和安全性产生影响,包括药效降低、不良反应增加等。因此,检测和控制氟康唑中的杂质是药品生产过程中的重要环节,对药物质量、安全性以及疗效的保证至关重要。研究分析这些杂质,还可以优化生产工艺,减少杂质产生,提高药物的质量和疗效。CATO标准品对沙格列汀杂质的研究也能帮助优化制药流程,找出产生过多杂质的环节,从而改进工艺,提高药品的质量和疗效。[img=,603,570]https://ng1.17img.cn/bbsfiles/images/2024/02/202402052101491000_1515_6381668_3.png!w603x570.jpg[/img]
请教专家:如何用HPLC准确定量样品中的一个杂质,目前有样品、杂质对照品,样品中的杂质已用百分比法测出。如用外标法,溶剂及波长是否要一致。谢谢!
按《中国药典》2010年版甘油挥发性杂质项下方法检测乙二醇、二甘醇,对照品乙二醇、二甘醇浓度0.1mg/ml进样量1ul,结果图谱中除了溶剂峰外,没有任何峰出现。当把乙二醇、二甘醇浓度5提高到5mg/ml时,才出现5-10个电压的峰高,是不是药典方法不正确啊,有做过这个实验的指导下,我们的仪器是SP6800A。
丙谷二肽杂质对照品名称 环-(L-丙氨酰-L-谷氨酰胺) 规格:0.25gL-焦谷氨酰-L-丙氨酸 规格1g"N-(2)-D-丙氨酰-L-谷氨酰胺" 规格:0.25gL-丙氨酰-L-谷氨酸 规格:1gL-焦谷氨酸 规格:125mg
依据中国药典要检测乙醇挥发性杂质,要求以6%氰丙基苯基-94%二甲基聚硅氧烷为固定液;起始温度40℃,维持12分钟,以每分钟10℃的速率升温至240℃,维持10分钟;进样口温度为200℃;检测器温度为280℃。对照溶液(b)中乙醛峰与甲醇峰之间的分离度应符合要求。因是第一次。色谱柱是用的DB-624,[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]为安捷伦6820。想请教一下经验。分流比,流速怎么设置比较好。1微升的进样量会不会引起过载的问题图谱处理的时候还有什么注意点
液相分析时,对照浓度一般是多少,根据什么来定?杂质对照呢?
[font=宋体]1.用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]做对照品的分子量的确认(scan模式),[/font][font='Times New Roman',serif] [img=,159,138]file:///C:/Users/ADMINI~1/AppData/Local/Temp/msohtmlclip1/01/clip_image002.png[/img][/font][font=宋体]杂质[/font][font='Times New Roman',serif]-B [/font][font=宋体]测得[/font][font='Times New Roman',serif]m/z[/font][font=宋体]是[/font][font='Times New Roman',serif]314.0[/font][font=宋体](最高响应峰)[/font][font=宋体],与实际相差[/font]17[font=宋体],而本该有的[/font][font='Times New Roman',serif]m/z331[/font][font=宋体]的峰很小[/font]2.[font=宋体]用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]做对照品的分子量的确认(scan模式),[/font][font='Times New Roman',serif][img=,136,110]file:///C:/Users/ADMINI~1/AppData/Local/Temp/msohtmlclip1/01/clip_image002.png[/img][/font][font=宋体]杂质[/font][font='Times New Roman',serif]-L [/font][font=宋体]测得[/font][font='Times New Roman',serif]316.1、347.1(两个响应高的峰),[font=&]347.1是对的上,[font=&]316.1不知道怎么产生的?[/font][/font][/font]
借贵版人气问一个问题:测定样品中的杂质时,什么情况下不用杂质标准品做对照,而采取把样品稀释后做自身对照?能给出自己工作中具体例子的,给悬赏分。谢谢!我说的是药品中的有关物质(生产过程中带来的有机杂质),无机杂质和残留溶剂不算。有关物质包括已知杂质和未知杂质,二者加起来是总杂质。我在中国药典上见到过这样的方法:乙胺嘧啶的有关物质(05版CP第3页):取本品,加三氯甲烷-甲醇(9:1)制成每1ml中含20mg的溶液,作为供试品溶液;精密量取适量,加同一溶剂稀释成每1ml中含50ug的溶液,作为对照溶液。照薄层色谱法检验,……供试品溶液如显杂质斑点,与对照溶液的主斑点比较,不得更深。详见下面的帖子:http://www.instrument.com.cn/bbs/shtml/20070831/964769/[color=#DC143C]我在5楼举了几种情况,都是我翻译资料时遇到的。[/color]药品审评中心的老师也发过相关的讨论,见下:[color=#00008B]关于HPLC主成分自身对照法检查有关物质时检测波长确定的讨论[/color]http://www.cde.org.cn/page/framelimit.cbs?ResName=dzkw据说这种稀释后自身对照的方法应用得挺多,但[color=#DC143C]我不知道为什么要这样用。[/color]
《中国药典》2015年版收载的品种总计5608个,其中,二部化学药新增品种492个,修订品种415个。在化学药标准制修订过程中坚持“科学、先进、实用、规范”相结合的原则,注重借鉴国外先进标准,积极推进药物分析新方法、新技术的应用,加强对药品安全性、有效性控制的要求,促使化学药质量标准达到或接近国际先进标准,部分品种已有赶超。为使广大《中国药典》(二部)的使用者更好地理解和执行本部药典,本文择要介绍其主要特点以及增修订概况。1遴选品种更加严格新版药典在品种遴选方面更加严格。在严把新增品种医学遴选关的同时,对《中国药典》2010年版二部已收载品种也进行了药学遴选及标准的科学性再审评。只有标准比较完善,且通过医学和药学遴选的品种方可收入《中国药典》。主要体现在:①原料药:对于多酸根的原料药,一般仅收载与原研药相同的酸根。如盐酸托烷司琼和甲磺酸托烷司琼,由于甲磺酸易与低级醇形成基因毒性物质,故新版药典仅收载了盐酸托烷司琼;再如阿奇霉素以及盐酸阿奇霉素、乳糖酸阿奇霉素、马来酸阿奇霉素与富马酸阿奇霉素等,新版药典收载了阿奇霉素;对于疗效尚不明确的原料药暂未收载。②制剂:重点关注剂型的合理性。如醋酸可的松滴眼液、眼膏,鉴于醋酸可的松本身为非活性物质,需经肝脏转化为氢化可的松才能起效,眼用剂型不合理,故新版药典未增收滴眼液,不再收载眼膏剂;奥沙普秦分散片,奥沙普秦对胃的刺激性很大,《中国药典》仅收载了肠溶片和肠溶胶囊,分散片则不予增收;再如三磷酸腺苷二钠,遇水易分解为二磷酸腺苷和单磷酸腺苷,其注射液和冻干粉针均不具有优势,故新版药典均未继续收载;其他注射液和粉针剂并存的品种如亚叶酸钙等,粉针剂因不具有更优的临床价值而又增加了质量保证难度,故新版药典未予增收;阿奇霉素有小水针、粉针和大输液等剂型,但因阿奇霉素在水中的稳定性较差,新版药典仅增收了粉针剂,注射液剂型不予收载。另外,国家食药监总局发文撤销文号停止生产的品种亦均不予收载。经过严格遴选,《中国药典》2015年版二部共收载品种2603个,其中新增品种492个,保留《中国药典》2010年版二部品种2110个,不收载《中国药典》2010年版二部品种共28个。国家标准制修订一般以注册标准为基础,而部分企业产品的注册标准存在规格计量方式不同的现象,如盐酸特拉唑嗪片和胶囊,规格有以特拉唑嗪计和以盐酸特拉唑嗪计两种方式,新版药典暂收载与原研药相同的规格;又如注射用苯磺酸顺阿曲库铵,原研产品规格按顺阿曲库铵计,而我国仿制产品有按顺阿曲库铵计和按苯磺酸顺阿曲库铵计两种方式。在苯磺酸顺阿曲库铵的分子量中,苯磺酸约占25%,规格计量方式不同,可能造成临床用药剂量不足,故新版药典本品种仅收载了按顺阿曲库铵计的规格。2药品通用名称更加规范药品通用名称是药品生产、使用和监督管理的基础,是药品标准的重要组成部分。药典委员会的名词与术语专业委员会负责药品通用名称命名原则的制修订、世界卫生组织(WHO)的国际非专利药(INN)中文名称的命名以及中国上市药品的命名工作。药品通用名称的命名一般遵循命名原则进行。随着新剂型的不断出现,药品通用名称的命名原则也在不断更新,使命名工作的科学性不断提高。为更好地与国际接轨,化学药品活性成分的通用名称一般按照INN中文名称命名。如“埃索美拉唑钠”修订为“艾司奥美拉唑钠”,“还原型谷胱甘肽”修订为“谷胱甘肽”等;制剂一般遵循“活性成分+给药途径+剂型”的原则命名。如“丙酸倍氯米松气雾剂”更名为“丙酸倍氯米松吸入气雾剂”,“硫酸特布他林气雾剂”修订为“硫酸特布他林吸入气雾剂”。新版药典按照上述原则对所涉及的收载品种进行了相应的修订。3药典凡例更加科学严谨药典凡例是正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、通则及与质量检定有关的共性问题的统一规定,故正确理解和使用凡例非常重要。新版药典二部凡例主要有以下几个方面的修订:3.1凡例第二条由“本部药典收载的凡例、附录对药典以外的其他化学药品国家标准具同等效力”改为“本版药典二部收载的凡例与四部收载的通则对未载入本部药典但经国务院药品监管部门颁布的其他化学药品标准具同等效力”。这一规定说明了凡例与通则的重要性和适用范围。尤其需要指出的是,由于新版药典中制剂通则的修订,对于未收载入新版药典的国家药品标准其他品种的质量提升,具有整体的促进作用。3.2凡例第九条关于正文体例的描述增加“(16)杂质信息”的规定,并增加“原料药与制剂中已知杂质的名称与结构式等信息一般均在原料药正文中列出,相应制剂正文直接引用。复方制剂中活性成分相互作用产生的杂质,一般列在该品种正文项下”的描述。新版药典补充了近500个杂质的结构信息,有助于对标准正文的理解以及检验过程中杂质的确认,同时还有助于指导如何使用杂质信息。3.3凡例第十三条增加“放射药集中编排”的描述,由于放射药属于特殊管理和使用的药品,集中编排方便使用,故新版药典对编排体例进行了调整。3.4凡例第十七条主要有三个方面的修订:①增加了“对生产过程中引入的有机溶剂”的规定,即生产企业如有足够的证据证明在生产过程中并未使用标准中规定的部分残留溶剂,可不予检查。②增加了“采用色谱法检测有关物质时,杂质峰(或斑点)不包括溶剂、辅料或原料药的非活性部分等产生的色谱峰(或斑点)。必要时,可采用适宜的方法对上述非杂质峰(或斑点)进行确认”。虽然按照有关物质的定义,溶剂、辅料或原料药的非活性部分等产生的色谱峰(或斑点)均不应包括其中,但是,部分检验、检测机构对此仍有困惑,尤其是当杂质与上述物质未达到良好分离时,药典委曾于2007年发文对此类问题进行说明,凡例中增加此规定进一步明确了此类问题的处理办法。③增加“处方中含有抑菌剂的注射剂和眼用制剂,应建立适宜的检测方法对抑菌剂的含量进行控制。正文已明确列有抑菌剂检查的品种必须依法对产品中使用的抑菌剂进行该项检查,并应符合相应的限度规定”的要求。目前,已上市部分产品中存在防腐剂滥用现象,滥用防腐剂可能会造成一定的安全性影响,应避免并严格控制。3.5凡例第二十一条增加“避光”的定义。3.6凡例第二十二条增加“采用本版药典规定的方法进行检验时,应对方法的适用性进行确认”,指导如何正确使用药典方法。3.7凡例第二十六条完善对照品的定义,增加对“标准品与对照品应按其标签所示的内容贮藏和使用”的要求。由于化学药品的标准品与对照品均有其适用范围,未经适用性确认就扩大适用范围有可能带来检测结果的误差;标准品与对照品必须在适宜的条件下贮藏,偏离规定的贮藏条件有可能使其特性量值发生改变,从而也有可能带来检测结果的误差。4药品的安全性保障得到进一步提高标准中与药品安全性有关的项目主要有制法要求、有关物质、颜色与澄清度、残留溶剂、重金属、可见异物、渗透压、细菌内毒素、微生物限度或无菌等。新版药典结合各品种的生产工艺和剂型特点,针对性地对上述各项目进行了增修订。4.1有关物质我国同品种多家企业生产的现象比较突出,同一品种有十几或二十多家企业生产的现象普遍存在,个别品种则有上百家企业拥有批准文号,每个企业的生产工艺、处方等均有可能不同,这些因素都会给国家标准的制订带来挑战,这一点在色谱法检测有关物质方面尤其突出。在对杂质结构进行研究确认的基础上,新版药典中“有关物质”检测方法的科学性进一步增强。根据被分析物的结构特点选择不同原理的分析方法,如纸色谱、薄层色谱和高效液相色谱(HPLC)均有应用;现在广泛使用的反相高效液相色谱法,在固定相、流动相、洗脱方式和检测器的选择上,都更趋于科学合理。除十八烷基硅烷键合硅胶的填充剂外,辛烷基硅烷键合硅胶和氨丙基硅烷键合硅胶等填充剂也均有使用;由于固定相丰富的选择性,流动相组成趋于简单,梯度洗脱方式更多地被采用;检测器是分析方法的眼睛,紫外检测器、电化学检测器、电导检测器也都有使用。方法的系统适用性要求更科学合理。由于我国同品种多企业生产的现象,以及全国有省市级、地市级药检所近三百家,如何保证色谱方法在不同质控实验室测定结果的重现性和准确性,对分析方法制订科学合理的系统适用性要求至关重要。分离度即为色谱方法准确性的基础。采用杂质对照品法、混合对照品法、化学破坏法和相对保留时间法等增加对分离度的要求,同时通过配制灵敏度溶液增加了对方法灵敏度和报告限的要求,规范了部分积分参数的合理设置。在限度方面,作为国家标准,新版药典对原料药和制剂均要求控制工艺杂质和降解杂质,且一般对已知杂质、特定杂质、未知杂质和总杂质分别设定限度控制,这一点更与过去惯例趋同。4.2其他项目新版药典中对上版药典约三分之一的品种标准进行了提高,对涉及到安全性的项目进行了增修订,如雷米普利标准中采用原子吸收分光光度法对催化剂钯进行控制;肝素钠标准中增订了对蛋白质和多硫酸软骨素的控制;盐酸利多卡因注射液因存在椎管给药方式,标准中增加了渗透压的控制,而且限度严格;手性固定相的高效液相色谱和手性添加剂的毛细管电泳在光学异构体杂质的控制中均有应用,如伏立康唑标准中采用了前者,佐米曲普坦标准中采用了后者。5药品的有效性控制进一步完善标准中与药品有效性有关的项目有鉴别、含量或效价测定、组分测定、晶型、含量均匀度、溶出度与释放度以及其他与剂型特点相关的项目,现择要述之。5.1含量或效价测定活性成分的含量或效价测定是药品有效性最重要的指标。新版药典优化了含量或效价测定方法,提高了限度要求,对于保障产品的有效性具有
我公司求购下列对照品:USP Gabapentin Related Compound D RS [(1-(3-oxo-2-aza-spiro[4.5]dec-2-ylmethyl)-cyclohexyl)-acetic acid] (C18H29NO3 307.43) . 1S (USP29)联系方式: wdzhang@du-hope.com

[align=center][b]2015年版《中国药典》数据:头孢氨苄有关物质的分析[/b][/align]客户提供了头孢氨苄工作对照品、杂质7-氨基去乙酰氧基头孢烷酸、α-苯甘氨酸、△-2-头孢氨苄对照品和80℃条件下破解供试品溶液所得的分离度溶液。现要求本实验室选择合适的C[sub]18[/sub]色谱柱,实现头孢氨苄的有关物质分析。在头孢氨苄有关物质分析中,流动相为高水相条件,故本实验室首先尝试使用能在高水相下稳定使用的高极性色谱柱CAPCELL PAK C[sub]18 [/sub]AQ S5 4.6 mm i.d. × 250 mm(柱号:A6AD04229),对80℃破解所得分离度溶液进行分析,结果见图1。[align=center][img=,567,357]http://ng1.17img.cn/bbsfiles/images/2017/11/201711161024_01_2222981_3.png!w567x357.jpg[/img][/align][align=center]图1 80℃破解溶液及空白溶液分析所得色谱图(C[sub]18 [/sub]AQ色谱柱)[/align][align=left]*注:峰上所标数字为分离度,下同。[/align][img=,581,192]http://ng1.17img.cn/bbsfiles/images/2017/11/201711161024_02_2222981_3.png!w581x192.jpg[/img]如图1,头孢氨苄主峰保留时间为21.09min,主峰与前后杂质分离度分别为2.42和3.37,达到药典要求的基线分离。进一步分析杂质对照品溶液和供试品溶液,如图2,杂质7-氨基去乙酰氧基头孢烷酸(7-ADCA)和α-苯甘氨酸的分离度为11.19,符合药典要求。[align=center][img=,566,359]http://ng1.17img.cn/bbsfiles/images/2017/11/201711161025_01_2222981_3.png!w566x359.jpg[/img][/align][align=center]图2 杂质对照品溶液分析所得色谱图(C[sub]18[/sub] AQ色谱柱)[/align][img=,684,231]http://ng1.17img.cn/bbsfiles/images/2017/11/201711161025_02_2222981_3.png!w684x231.jpg[/img]如图3,对供试品溶液进行分析,各杂质间分离度良好。[align=center][img=,554,362]http://ng1.17img.cn/bbsfiles/images/2017/11/201711161026_01_2222981_3.png!w554x362.jpg[/img][/align][align=center]图3 头孢氨苄供试品溶液分析所得色谱图(C[sub]18 [/sub]AQ色谱柱)[/align][img=,585,192]http://ng1.17img.cn/bbsfiles/images/2017/11/201711161026_02_2222981_3.png!w585x192.jpg[/img]客户要求考察低浓度(10 μg/mL)下头孢氨苄与其异构体△-2-头孢氨苄的分离情况,在客户允许调整柱温(30℃~40℃)的前提下进行分析,如图4,当柱温设定为30℃时,头孢氨苄与△-2-头孢氨苄的分离度最佳,为1.17。[align=center][img=,566,371]http://ng1.17img.cn/bbsfiles/images/2017/11/201711161028_01_2222981_3.png!w566x371.jpg[/img][/align][align=center]图4 头孢氨苄及△-2-头孢氨苄混合溶液分析所得色谱图(C[sub]18[/sub] AQ色谱柱)[/align][img=,583,193]http://ng1.17img.cn/bbsfiles/images/2017/11/201711161028_02_2222981_3.png!w583x193.jpg[/img]为使客户有更多色谱柱选择,本实验室又进一步尝试了资生堂中等极性色谱柱CAPCELL PAK C[sub]18 [/sub]MGII以及高碳载量色谱柱SUPERIOREX ODS进行分析。使用CAPCELL PAK C[sub]18[/sub] MGII色谱柱在30℃条件下对头孢氨苄及其异构体△-2-头孢氨苄进行分离,分离度为1.05,分离效果不及CAPCELL PAK C[sub]18 [/sub]AQ;使用SUPERIOREX ODS色谱柱进行分析,分离度为1.18,分离效果略优于AQ柱,但在分析破解所得分离度溶液时,杂质峰形及分离效果不佳。在对头孢氨苄及其异构体△-2-头孢氨苄的分离中,本实验室也尝试使用键和金刚烷基团的高表面极性色谱柱CAPCELL PAK ADME和键合五氟苯丙基、对同分异构体有良好分离能力的CAPCELL PAK PFP色谱柱进行尝试。由于ADME色谱柱保留较强,在原梯度条件下未得到待测物洗脱,提高梯度条件中有机相比例后,亦未得到理想的分离效果;而使用CAPCELL PAK PFP S5 4.6 mm i.d. × 250 mm(TQAD01002)色谱柱进行分析,能得到4.84的分离度(见图5)。表1为各色谱柱分离度结果对比。[align=center][img=,554,357]http://ng1.17img.cn/bbsfiles/images/2017/11/201711161030_01_2222981_3.png!w554x357.jpg[/img][/align][align=center]图5 头孢氨苄及△-2-头孢氨苄混合溶液结果(PFP色谱柱)[/align][img=,582,190]http://ng1.17img.cn/bbsfiles/images/2017/11/201711161030_03_2222981_3.png!w582x190.jpg[/img][align=center]表1 各色谱柱分离度结果对比(色谱柱规格S5 4.6 mm i.d. × 250 mm)[/align][align=center][img=,471,160]http://ng1.17img.cn/bbsfiles/images/2017/11/201711161030_04_2222981_3.png!w471x160.jpg[/img][/align][align=center][/align][align=left]进一步,使用PFP色谱柱在原色谱条件下对供试品溶液、杂质对照溶液、△-2-头孢氨苄对照溶液、高温破解溶液及空白溶液进行分析。供试品溶液中各杂质能得到良好分离,主峰头孢氨苄与杂质△-2-头孢氨苄分离度为1.78(见图6),杂质对照品溶液中7-ADCA和α-苯甘氨酸的分离度为[b]7.28[/b](见图7)。[/align][align=left][/align][align=center][img=,568,372]http://ng1.17img.cn/bbsfiles/images/2017/11/201711161031_02_2222981_3.png!w568x372.jpg[/img][/align][align=center]图6 供试品溶液、空白及△-2-头孢氨苄溶液分析所得色谱图(PFP色谱柱)[/align][align=center][img=,572,376]http://ng1.17img.cn/bbsfiles/images/2017/11/201711161031_01_2222981_3.png!w572x376.jpg[/img][/align][align=center]图7 80℃破解溶液及杂质对照溶液分析所得色谱图(PFP色谱柱)[/align][align=center] [/align][align=left]综上实验结果,在C[sub]18[/sub]系列色谱柱中,使用资生堂CAPCELL PAK C[sub]18 [/sub]AQ S5 4.6 mm i.d. × 250 mm(A6AD04229)色谱柱分析头孢氨苄有关物质结果最优,能够实现杂质对照溶液及高温破解所得分离度溶液的分离。在供试品溶液分析中,由于浓度较高,△-2-头孢氨苄被包于主峰中,客户反馈属正常现象,单独考察低浓度头孢氨苄与其异构体△-2-头孢氨苄的混合溶液分离情况,能够达到1.17的分离度结果。[/align][align=left]在头孢氨苄及其异构体△-2-头孢氨苄的分离中,相比C[sub]18[/sub]柱,资生堂CAPCELL PAK PFP S5 4.6 mm i.d. × 250 mm(TQAD01002)色谱柱能够达到分离度为4.84的良好分离结果,在杂质对照溶液及供试品溶液的分析中,能够得到满足药典分离要求的良好结果,供客户参考。[/align]
[B][center]药物中杂质的来源及杂质限量检查[/center] [/B]药物只有合格品与不合格品;一般化学试剂分为4个等级(基准试剂、优级纯、分析纯、化学纯) [B]药物中一般杂质检查 [/B][B]氯化物为一指示性杂质。[/B] 通过对氯化物的控制,可同时控制与氯化物结合的一些阳离子以及某些同时生成的副产物。可从氯化物检查结果显示药物的纯度,间接考核生产、贮藏过程是否正常。 1. 原理 药物中微量的氯化物在硝酸酸性条件下与硝酸银反应,生成氯化银的胶体微粒而显白色浑浊,与一定量的标准氯化钠溶液在相同条件下产生的氯化银浑浊程度比较,判定供试品中氯化物是否符合限量规定。 Ag+ + Cl- → AgCl ↓ [B]硫酸盐检查法 [/B] 1. 原理 药物中微量的硫酸盐在稀盐酸酸性条件下与氯化钡反应,生成硫酸钡的微粒而显白色浑浊,与一定量的标准硫酸钾溶液在相同条件下产生的硫酸钡浑浊程度比较,判定供试品中硫酸盐是否符合限量规定。 [B]铁盐检查法 [/B]硫氰酸盐法 巯基醋酸法 砷盐检查法 1. 古蔡氏法 1. 原理 金属锌与酸作用产生新生态的氢,与药物中微量砷盐反应生成具挥发性的砷化氢,遇溴化汞试纸产生黄色至棕色的砷斑,与同条件下一定量标准砷溶液所生成的砷比较斑,判断砷盐的含量。 [B]硒、氟及硫化物检查法 [/B]1. 氧瓶燃烧法 适用于以共价键结合的卤素、硫、硒的有机药物。 本法系将有机药物防入充满氧气的密闭燃烧瓶中进行燃烧,将燃烧所产生的欲测组分吸收于适当的吸收液中,然后根据欲测组分的性质,选用合适的分析方法进行鉴别、检查或含量测定。 [B]注意事项及讨论 [/B]1. 根据被燃烧分解的样品量选用适宜大小的燃烧瓶。 2. 测定氟化物时应改用石英燃烧瓶。 1. 硒检查法 (1). 操作方法 样品与对照品液,调节Ph2.0±0.2,加盐酸羟胺,二氨基萘,比色。 [B]硫化物检查法 [/B] 方法同砷盐检查第一法,不装醋酸铅棉花,以醋酸铅试纸代替溴化汞试纸。 标准液取1ml 5/ml [B]澄清度检查法 [/B]将一定浓度的供试品溶液与浊度标准液分别置于配对的比浊用玻璃管,同置黑色背景上,在漫射光下观察。浊度标准液 硫酸肼与乌洛托品溶液混合分五个等级,未超过0.5等级即为澄清。BP98规定未超过1等级即为澄清。 [B]溶液颜色检查法 [/B]CHP2000 [B]1. 比色法[/B] 色调标准贮备液 黄色液 重铬酸钾液(BP98用氯化铁) 红色液 氯化钴液 蓝色液 硫酸铜液 配成各种色调色号标准比色液共50种。 [B]2. 分光光度法 [/B] [B]易碳化物检查法 [/B]检查药物中含有的遇硫酸易碳化或易氧化而呈色的有机杂质。 对照品液 样品液 加硫酸5后,加供试品。 [B]炽灼残渣检查法[/B] 取供试品1.0~2.0g或个药品项下规定的重量,置已炽灼至恒重的坩埚中,精密称定,缓缓炽灼至完全碳化,放冷至室温;除另有规定外,加硫酸使湿润,低温加热至硫酸蒸气除尽后,在700~800炽灼使完全灰化,移至干燥器内,放冷至室温,精密称定,再在700~800炽灼至恒重,即得。残渣限量一般为0.1~0.2% 一般应使炽灼残渣量为1~2mg 若需将炽灼残渣留作重金属检查时,炽灼温度必须控制在500~600。 [B]干燥失重测定 [/B]1. 常压恒温干燥法 2. 干燥剂干燥法 3. 减压干燥法 [B]水分测定法 [/B][B]费休氏法 [/B] 本法是根据碘和二氧化硫在吡啶和甲醇溶液中能与水起定量反应的原理以测定水分。 [B]甲苯法[/B] 在加热状态下,甲苯夹带着水分蒸出,收集蒸出的水分测定。 [B]药物中特殊杂质检查 [/B] [B]一、物理法 [/B] [B]二、化学反应法 [/B](一)容量分析法 (二)重量分析法 (三)比色法和比浊法 [B]三、色谱法 [/B]1.纸色谱法 薄层色谱法 TLC是药典中最常用的特殊杂质限量检查方法。 1.在一定供试品及检查条件下,不允许有杂质斑点存在 2.以待测杂质对照品检测 3.将供试品稀释到适当浓度作为杂质对照品溶液 4.选用质量符合规定的与供试品相同的药物作为杂质对照品 [B]高效液相色谱法 [/B] [B][url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法 [/B] 1.面积归一化法 2.主成分自身对照法 3.内标法测定 4.内标法加校正因子法 5.外标法 有机溶剂残留量测定法 [B]分光光度法 紫外分光光度法 比色法 [url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]分光光度法[/B]
[B][center]药品研发如何确定杂质限度[/center][/B][B]国家食品药品监督管理局药品审评中心 黄晓龙[/B] 在药品研发中,如何证实药品安全有效应该是研发人员始终关注的问题;而药品质量的稳定可控又是保证其安全有效的前提与基础。如果一个药品的质量不能达到稳定与可控,在使用时这一药品就不可能始终安全、有效,也就不能被批准上市。保证药品质量稳定可控,药品的纯度是一个重点。如何确定杂质的限度是药学研究人员与审评人员不能回避的关键问题,该限度的制订是否科学、合理,直接关系到药品的安全性与质量。药品在临床使用中产生的不良反应除与该药品本身的药理活性有关外,也有一部分与药品中所混入的其它杂质有关。例如,通过我国药学科技工作者数十年的努力,基本上确定青霉素等抗生素中的多聚物等高分子杂质是引起过敏的主要原因。所以在研发过程中一定要对药品中的杂质进行全面研究,并将杂质完全准确地控制在一个合理的范围之内。 尽管杂质限度的确定对于药品研发非常重要,但国内药品研发的现实情况并不令人乐观。从近几年的新药申报情况分析,在杂质的研究与限度确定方面存在着较多的问题,主要表现为:部分药品研究单位对杂质研究的重要性了解不深;标准中对杂质的控制不够全面与准确;制订杂质限度时考虑问题不够全面,很少考虑杂质对药品安全性的不良影响;即使在杂质的含量明显超出正常工艺所允许的范围时,也不注意对现有的处方与工艺进行必要的优化,以降低杂质的限度。◆杂质的分类 药品中的杂质一般分为三类:有机杂质、无机杂质及残留溶剂。 有机杂质是指在药品的生产与储存过程中产生的杂质,这些杂质可以是已知的、未知的、挥发性的或不挥发性的杂质,主要包括:降解产物、聚合物、原料药与辅料或内包材的反应产物、以及原料药制备过程中引入的起始原料、副产物、中间体、反应试剂、配位体与催化剂。由于这些杂质的化学结构与产品分子类似或具渊源关系,所以通常称之为有关物质。 无机杂质是指在药品的生产过程中产生的杂质,这些杂质通常是已知的,主要包括:反应试剂、配位体与催化剂、重金属或其它残留的金属、无机盐、过滤助剂、活性炭等其它物质。 残留溶剂是指在原料药及制剂的生产过程中使用的有机溶剂。 对于生产过程中引入的外来污染物,可通过“良好的生产规范”(GMP)来控制,故不属于本文所说的杂质范畴。原料药的不同晶型也不属于本文的讨论范畴。本文只谈有机杂质与无机杂质的限度确定。
药品名称:橙皮苷外文名称:HesperidinCAS号:520-26-3溶解性:易溶于吡啶、氢氧化钠溶液,溶于二甲基甲酰胺,微溶于甲醇和热冰醋酸,极微溶于乙醚,丙酮、氯仿和苯。该品1g溶于50L水。无臭、无味。植物来源:芸香科柑桔属植物甜橙、柠檬。以下为使用资生堂色谱柱对橙皮苷检测得到的谱图,请参考。http://ng1.17img.cn/bbsfiles/images/2016/12/201612151447_02_2222981_3.jpgA. 供试品溶液 B. 对照品溶液【色谱条件】色谱柱:CAPCELL PAK C18 S5; 4.6 mm i.d.×150 mm流动相:0.1%磷酸溶液/乙腈/甲醇=74/14/12流 速 : 1.0mL/min温 度 : 25 °C检 测 : UV284nm进样量:10μL注:文献中液相方法与《中国药典(2015)》中小儿至宝丸项下橙皮苷分析方法一致。如图,对照品溶液有较好峰形,供试品溶液中的橙皮苷峰能与其他杂质峰获得较好分离,分离度大于1.50。
现有一原料药,已知其杂质为abcde,并有相应的杂质对照品,请教大家怎么测定杂质的校正因子?
[font=宋体][font=宋体]原料药,杂质含量测定,内标法,分析方法[/font][font=Calibri]---[/font][font=宋体]准确度。[/font][/font][font=宋体]1. [/font][font=Calibri]6[/font][font=宋体]份样品测定或[/font][font=Calibri]3[/font][font=宋体]种浓度各进[/font][font=Calibri]3[/font][font=宋体]针,再[/font][font=Calibri]5针[/font][font=宋体]对照品溶液求校正因子,得出杂质含量,求回收率[/font][font=宋体]或者[/font][font=宋体][font=宋体]2 向原料药样品加入已知杂质对照品,进样:[/font][font=宋体]①[/font][font=Calibri]5[/font][font=宋体]针对照品求校正因子,②样品溶液,③加入对照品的样品溶液。[/font][/font]是这样的吗?

中国药典:http://ng1.17img.cn/bbsfiles/images/2011/12/201112240913_340831_1827385_3.jpg美国药典:Chromatographic system (see Chromatography 621)— The gas chromatograph is equipped with a flame-ionization detector, maintained at about 280, and a 0.32-mm × 30-m fused silica capillary column bonded with a 1.8-µm layer of phase G43. The carrier gas is helium with a linear velocity of about 35 cm per second and a split ratio of 1:20. The column temperature is maintained at 40 for the first 12 minutes after an injection is made and is increased from 40 to 240 from 12 to 32 minutes after injection. During the period of 32 to 42 minutes after an injection is made, the column temperature is maintained at 240. The injection port temperature is maintained at 200. Chromatograph Standard solution B, and record the peak responses as directed for Procedure: the resolution, R, between the first major peak (acetaldehyde) and the second major peak (methanol) is not less than 1.5. 两者规定基本一致,美国药典进一步细化规定了色谱柱的规格为30m×0.32mm×1.8μm、载气为氦气、线速度为35cm/s、分流比为1:20。检验主要问题是,甲醇峰异常拖尾,乙醛峰和甲醇峰分离度在1.5左右。
1 准确度可由精密度,线性和专属性推算出来,是不是这三项合格,准确度必定合格,没必要算;或者算的话,怎么计算呢?2准确度应该用样品做还是标准品?2.1可向原料药中加入已知量杂质对照品进行测定;我做的是内标法,然后配6个100%的标准品溶液,或者80% 100% 120%,,是不是这样进样,:①5进针对照品溶液算校正因子,②进样品溶液,②进加对照品的样品溶液。
请问农药残留分析样品中的杂质对分析和检测会有哪些影响?
(1)基准标准品又分为法定基准标准品和内部基准标准品两类。法定标准品包括:中国药品生物制品检定所(NICPBP)提供的国家标准品(CP 标准品)、美国药典委员会(USP)提供的USP标准品、欧洲EDQM委员会提供的EP标准品、JP标准品、BP标准品及其它WHO、ISA标准品等官方渠道得到的标准品。(2)工作标准品包括:企业内部标定的工作标准品、科研单位或合同实验室标定的工作标准品、其他厂家在认证实验室标定的标准品。(3)杂质标准品分为定性用杂质标准品及定量用杂质标准品,来源于法定标准品或自制杂质对照品。【来源:实验与分析】
[font=Calibri][font=宋体]仪器信息网于[/font]5[/font][font=Calibri][size=10.5pt][font=宋体]月[/font]22[font=宋体]日组织召开[/font][b] [size=18px][b]新药研发申报与质控专家论坛[/b][/size][/b][/size][/font][font=Calibri][size=10.5pt][font=宋体],特邀嘉宾[url=https://www.instrument.com.cn/webinar/meetings/News/expert?id=6560]龙志敏(SCIEX中国药物市场应用支持经理)[/url][/font][font=宋体],带来报告[b]《[url=https://www.instrument.com.cn/webinar/meetings/News/expert?id=6560]SCIEX [url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]技术在杂质及基因毒性杂质分析中的解决方案[/url]》[/b];[/font][/size][/font][font=宋体]欢迎感兴趣的你,报名参会![/font][b][font='Times New Roman'][color=#0563c1][url]https://www.instrument.com.cn/webinar/meetings/SCIEX522/[/url][/color][/font][/b]
普拉克索杂质A,B,C,D,E欧洲药典标准。进口注册标准中代码【BI-II751XX】 【BI-II786BS】 【BI-II820BS】BI-II 546 CL】常用杂质对照品
求助一下: 今天发现中国药典2005版红外光谱图集中“组氨酸”的对照图谱为什么有两个,一个是光谱号785,另一个是光谱号981。高手回答一下,两者有什么区别? 组氨酸的专论中红外鉴别是要求与981一致,而没有提到785.http://simg.instrument.com.cn/bbs/images/brow/emyc1010.gif
[size=4]1.所用对照品(标准品)中检所已经发放提供(可参阅中国药典2005年版二部附录ⅩⅤG),且使用方法相同时,应使用中检所提供的现行批号对照品(标准品),并提供其标签和使用说明书,说明其批号,不应使用其他来源者;如使用方法与说明书使用方法不同(如定性对照品用作定量用、效价测定用标准品用作理化测定法定量、UV法或容量法对照品用作色谱法定量等),应采用适当方法重新标定,并提供标定方法和数据;若色谱法含量测定用对照品用作UV法或容量法,定量用对照品用作定性等,则可直接应用,不必重新标定。 2.申报临床研究时,如中检所尚无供应,为不影响注册进度,可先期与中检所接洽制备和标定,申报时提供标定报告、标签(应标明效价或含量、批号、使用效期)和使用说明书;也可与省所合作标定,申报时提供标准品或对照品研究资料,“说明其来源、理化常数、纯度、含量及其测定方法和数据”;标定有困难时,可使用国外药品管理当局或药典委员会发放的对照品(标准品)或国外制药企业的工作对照品(标准品),进行标准制订和其他基础性研究,但应提供其标签(应标明其含量)和使用说明书,能保证其量值溯源性;也可使用国外试剂公司(如sigma公司等)提供的对照品(标准品),但应提供试剂公司该批对照品(标准品)的检测报告(用作含量测定时,应有确定的含量数据),如为高纯度试剂,提供了国外试剂公司检测报告(用作含量测定时,应有确定的含量数据)时,也可使用,并应能保证其量值溯源性,但申请人应及时与中检所接洽对照品(标准品)的标定事宜,临床研究期间完成此工作。 3.直接申报生产品种,如中检所尚无供应,可参照2中要求进行,并提供相应研究资料,但申请人在标准试行期间应与中检所接洽并完成的标定事宜。 4.对照品(标准品)标定的技术要求: 4.1.创新药物 应说明对照品(标准品)原料的制备路线、精制方法、质检报告,提供理化常数和纯度的测定数据及分析结果(包括相关图谱),提供标定方法的研究和验证资料(如与原料药质量研究项下相同,可不再提供)、含量测定数据及经统计分析得到的对照品(标准品)含量结果,并说明进行临床前药学研究、药理毒理学研究所用样品的含量是否用该批对照品(标准品)确定或可用该批对照品(标准品)进行量值溯源。 ●纯度测定方法应选用色谱法,并采用两种以上不同分离机理或不同色谱条件并经验证的色谱方法相互验证比较,同时采用二极管阵列检测器或其它适宜方法检测HPLC法的色谱峰纯度,而后根据测定结果经统计分析确定对照品(标准品)原料的纯度。 ●对于组份单一、纯度较高的药物,对照品(标准品)标定方法宜首选可进行等当量换算、精密度高、操作简便快速的容量法。可根据药物分子中所具有的官能团及其化学性质,选用不同的容量分析方法,但应符合如下条件:(1)反应按一个方向进行完全;(2)反应迅速,必要时可通过加热或加入催化剂等方法提高反应速度;(3)共存物不得干扰主药反应,或能用适当方法消除;(4)确定等当点的方法要简单、灵敏;(5)标化滴定液所用基准物质易得,并符合纯度高、组成恒定且与化学式符合、性质稳定(标定时不发生副反应)等要求。 标定方法的选择要关注如下事项:(1)供试品的取用量应满足滴定精度的要求(消耗滴定液约20ml);(2)滴定终点的判断要明确,提供滴定曲线。如选用指示剂法,应考虑其变色敏锐,并用电位法校准其终点颜色。(3)为排除因加入其它试剂而混入杂质对测定结果的影响,或便于剩余滴定法的计算,可采用“将滴定的结果用空白试验校正”的办法;(4)要给出滴定度(采用四位有效数字)的推导过程。 标定结果要根据3个以上实验室各不少于15组测定结果经统计分析,去除离群值和可疑值后的结果,并报告可信限。 ●如该药物没有可进行等当量换算并符合要求的容量法时,可采用反复纯化的原料,色谱法确定纯度后扣除有关物质、炽灼残渣、水分和挥发溶剂等后的理论含量确定为标准品含量,以此为基准进行对照品(标准品)的换代和量值传递。 ●用于抗生素微生物检定法的第一代基准标准品可参照上述方法标定,如为多组份抗生素,其组份比例应与拟上市产品组份比例一致或接近,或以其中某一组份纯品为基准标准品,但要注意标准品换代时量值传递的恒定。 ●仅用于鉴别定性的化学对照品,注重其结构确证的研究资料,纯度和含量的要求一般可适当降低。 ●杂质对照品,用作限度要求时,应提供其来源(合成路线)、结构确证的研究资料,应具备较高的纯度和含量,并提供纯度和含量的的测定结果,提供质量控制标准。 4.2其他类别药物,可参照4.1要求进行。 ●用于抗生素微生物检定法的标准品须用上市国的国家标准品或原发厂的工作标准品为基准标准品进行标定。标定时采用的原料药应符合相应要求,并提供原料的制备路线、精制方法、质检报告,提供理化常数和纯度的测定数据及分析结果(包括相关图谱)。标定须用现行版中国药典附录收载的“抗生素微生物检定法”-三剂量法,并提供详细的方法学研究,包括检定菌和培养基的选择、剂量和剂距选择、缓冲液选择(如与质量研究项下相同,可不再提供)。每次标定结果均应照“生物检定统计法-量反应平行线测定法(3.3)”法进行可靠性测验及效价计算。按照《药品注册管理办法》,上市药品质量标准所用标准物质均须由中检所负责标定和管理,药品研发过程中,研制单位应注意及时与中检所联系标定事宜,以保证研发工作的连续性。[/size]
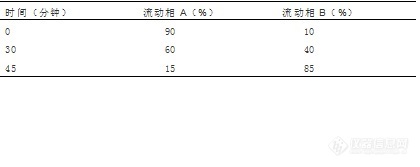
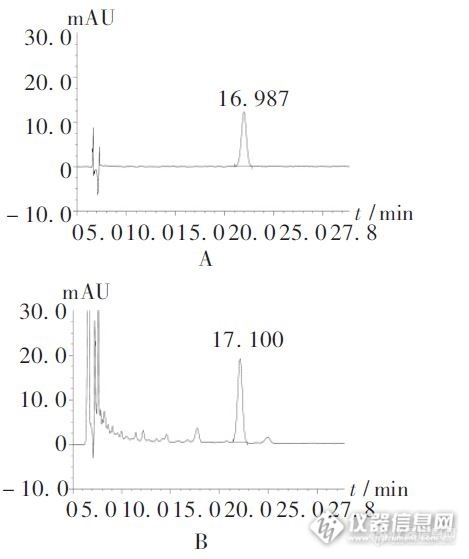
[b]泮托拉唑钠肠溶胶囊有关物质-2015中国药典[/b][color=#333333]色谱条件[/color][color=#333333]色谱柱:[/color][color=#333333]Kromasil 100-5-C18[/color][color=#333333],[/color][color=#333333]4.6x250mm[/color][color=#333333]货号:M05CLA[/color][color=#333333]25[/color][color=#333333]流动相A:[/color][color=#333333]0.01mol/L[/color][color=#333333]磷酸氢二钾溶液(用磷酸调节[/color][color=#333333]pH[/color][color=#333333]值至[/color][color=#333333]7.0[/color][color=#333333])[/color][color=#333333]流动相B:乙腈[/color][color=#333333]柱温:40℃[/color][color=#333333]检测波长:289mm[/color][color=#333333]进样量:20[/color][color=#333333]μL[/color][color=#333333]梯度程序:[/color][color=#333333][img=,420,167]https://ng1.17img.cn/bbsfiles/images/2018/12/201812271544240467_6987_2428063_3.jpg!w420x167.jpg[/img][/color][color=#333333][/color][color=#333333][img=,441,355]https://ng1.17img.cn/bbsfiles/images/2018/12/201812271544547827_7491_2428063_3.jpg!w441x355.jpg[/img][/color][align=center][color=#333333][/color][/align][align=center]供试溶液的色谱图单个杂质峰面积小于对照溶液主峰面积的0. 4 倍(0. 2% ),各杂质峰面积的和小于对照溶液主峰面积(0 . 5% ) 。[/align]以上指标均符合2015中国药典