实验数据中各变量的关系可表示为列表式,图示式和函数式。 列表式:将实验数据制成表格。它显示了各变量间的对应关系,反映出变量之间的变化规律。它是标绘曲线的基础。图示式:将实验数据绘制成曲线。它直观地反映出变量之间的关系。在报告与论文中几乎都能看到,而且为整理成数学模型(方程式)提供了必要的函数形式。 函数式:借助于数学方法将实验数据按一定函数形式整理成方程即数学模型。 熟悉相关和回归的定义,相关系数的定义,直线回归的最小二乘法。 熟悉药品质量标准分析方法验证中各项指标的定义和考察方法。 含量测定方法的评价 (效能指标—分析品质因数) 一般常用的分析效能评价指标包括:精密度、准确度、检测限、定量限、选择性、线性与范围、重现性、耐用性等;测定法的效能指标可评价分析测定方法,也可作为建立新的测定方法的实验研究依据。 1.精密度系指用该法测定同一匀质样品的一组测量值彼此符合的程度。它们越接近就越精密。在药物分析中,常用标准(偏)差(SD或S); 相对标准(偏)差(RSD),也称变异系数(CV),表示。 生物样品分析时,常用RSD表示精密度,并可细分为批内(或日内)精密度及批间(或日间)精密度。 批内精密度:是同一次测定的精密度。通常采用高、中、低三种浓度的同一样品各7-10份,每种浓度的样品按所拟定的分析方法操作,一次开机后,一一测定。计算每种浓度样品的SD值及RSD值。批内精密度也可视为日内精密度。所得RSD应争取达到5%以内,但不能超过10%。 批间精密度:是不同次测定的精密度。通常采用高、中、低三种浓度的同一样品,每种浓度配制7-10份,置冰箱冷冻。自配制样品之日开始,按所拟定的分析方法操作,每天取出一份测定,计算每种浓度样品的SD值及RSD值。批间精密度也可视为日间精密度。所得RSD应控制在15%以内。 2.准确度是指测得结果与真实值接近的程度,表示分析方法测量的正确性。 由于“真实值”无法准确知道,因此,通常采用回收率试验来表示。 制剂的含量测定时,采用在空白辅料中加入原料药对照品的方法作回收试验及计算RSD,还应作单独辅料的空白测定。每份均应自配制模拟制剂开始,要求至少测定高、中、低三个浓度,每个浓度测定三次,共提供9个数据进行评价。 回收率=(平均测定值M -空白值B)/ 加入量A×100% 回收率的RSD一般应为2%以内。 3.检测限(LOD)是指分析方法能够从背景信号中区分出药物时,所需样品中药物的最低浓度,无需定量测定。 LOD是一种限度检验效能指标,它既反映方法与仪器的灵敏度和噪音的大小,也表明样品经处理后空白(本底)值的高低。要根据采用的方法来确定检测限。当用仪器分析方法时,可用已知浓度的样品与空白试验对照,记录测得的被测药物信号强度S与噪音(或背景信号)强度N,以能达到S/N=2或S/N=3时的样品最低药浓为LOD;也可通过多次空白试验,求得其背景响应的标准差,将三倍空白标准差(即3δ空或3S空)作为检测限的估计值。为使计算得到的LOD值与实际测得的LOD值一致,可应用校正系数来校正,然后依之制备相应检测限浓度的样品,反复测试来确定LOD。如用非仪器分析方法时,即通过已知浓度的样品分析来确定可检出的最低水平作为检测限。 4.定量限 (LOQ)是指在保证具有一定可靠性(一定准确度和精密度)的前提下,分析方法能够测定出的样品中药物的最低浓度。 它反映了分析方法测定低药物浓度样品时具有的可靠性。它与上述的检测限的差别在于:定量限要定量测定某一药物在样品介质中的最低浓度,且定量限规定的最低浓度应该符合一定的精密度和准确度的要求。确定定量限的方法也因所用方法不同而异。当用非仪器分析方法时,与上述检测限的确定方法相同;如用仪器分析方法时,则往往将多次空白试验测得的背景响应的标准差(即空白标准差)乘以10,作为定量限的估计值,继之,再通过分析适当数量已知接近定量限或以定量限制备的样品来验证。 5.选择性是指在样品介质中有其他组分共存时该分析方法对供试物质准确而专属的测定能力。 它与专属性的含义稍有不同。专属性是指一种方法仅对一种分析成分产生唯一信号;选择性则可对多种化学成分产生不同响应,而主要成分的响应可与其它响应区分。 因此,选择性是指该法用于复杂样品分析时相互干扰程度的量度。 在药物分析中考察一个分析方法的选择性时,应着重考虑杂质、降解产物、相关化合物以及制剂辅料等其他组分是否对被测药物的测定有干扰。一般,通过添加上述物质的样品与未曾添加的样品所得分析结果进行比较而确定。 6.线性与范围 分析方法的线性是在给定范围内获取与样品中供试物浓度成正比的试验结果的能力。换句话说,就是供试物浓度的变化与试验结果(或测得的响应信号)成线性关系。 所谓线性范围是指利用一种方法取得精密度、准确度均符合要求的试验结果,而且成线性的供试物浓度的变化范围,其最大量与最小量之间的间隔,可用mg/L ~ mg/L、 ug/ml ~ ug/ml等表示。 线性与范围的确定可用作图法(响应值Y/浓度X)或计算回归方程(Y=a+bX)来研究建立。 测定样品时所有生物药物分析方法都必须同时作标准曲线。每次作标准曲线时,方法应与分析方法考核时完全一致。标准浓度应包括一定梯度的5-8个浓度(非线性者如免疫分析可适当增加),每个浓度只需测定一次(免疫分析可测定两次并取均值);标准曲线应覆盖样品可能的浓度范围,对于含量测定要求一般浓度上限为样品最高浓度的120%,下限为样品最低浓度的80% (但应高于LOQ);目前仍广泛采用相关系数(r)表示标准曲线的线性度、并控制r≥0.9900。对照品的LOQ必须包括在线性范围。 7.耐用性 是指利用相同的方法在各种正常实验条件下对同一样品进行分析所得结果的重现程度。 所谓各种正常实验条件,包括不同的实验室、不同的分析人员、不同的仪器、不同批号的试剂、不同的测试耗用时间、不同的分析温度、不同的测定日期等等。分析方法重现性的测定是通过在不同实验室由不同的实验者(操作和环境条件虽有差别但仍在规定的分析参数内)对同一样品的分别测试而获得的。 重现性 即是指在不同实验室中使用此种分析方法的精密度。是评价其保持不受参数微小变差影响的能力,并可作为正常使用的一个可靠性指标。 8. 与参比方法测得结果的相关程度的比较 由于生物样品中含有许多干扰测定的杂质,特别是与原型药物相似的代谢物常对药物的测定有影响。因此,除考察选择性外,有时还用参比方法对实际生物样品同时测定并进行比较。比较试验时,取若干份实际样品 (如病人服药后采取的血样),用一个已证明有相当专属性和可靠性的方法与新建立的方法同时进行测定,以参比方法测得的药浓为横坐标(X),以新建立方法测得的药浓为纵坐标(Y)作成散布图,并求出直线回归方程 (y=a+bx)及相关系数 (r)。r最大值为1,表示两法完全相关(结果完全吻合);r=0时,表示两法完全不相关。一般要求两法的相关系数r>0.95,而相关直线的斜率 应接近于1。 评价一种分析方法的效能,一般根据方法的使用对象区别。有以下四种情况: A.用于原料药中主要组分或制剂中有效组分含量测定的方法:除了检测限和定量限二项指标外,对精密度、准确度、选择性、线性与范围、耐用性等均应有所要求; B.用于原料药中杂质测定或制剂中降解产物测定的方法又可分为两种: ①用于含量测定;要求是:除检测限和精密度指标不必要求外,对准确度、选择性、线性与范围、定量限、耐用性等均应有所要求; ②用于限度检查。要求是:只对检测限、选择性和耐用性三项指标有所要求,其余均无需要求。 C.用于溶出度测定的方法及药物释放度测定的方法,只有精密度和耐用性有所要求,其余项目均不作要求。 D.用于生物样品中药物测定的方法,对精密度、准确度、检测限、选择性、可测线性范围、定量限、对生物样品的耐用性以及与参比方法测得结果的相关程度的比较等指标应有所要求。
热分析技术在药物分析中的应用进展热分析技术是研究物质在加热或冷却过程中产生某些物理变化和化学变化的技术。自1887年Lechatelier提出差热分析至今已发展成为一门专门的热分析技术。因其具有方法灵敏、快速、准确等优点,该技术及其分析仪器也得到快速发展。不久Sadtler的DTA标准图谱集,热分析专著《Thermal analysis》也相继面世。热分析技术在药物分析领域也广泛应用,如化学药品的鉴别、理化常数测定、纯度考查、稳定性考察以及近年来对中药活性成分的研究、中药材真伪品的鉴别、中药制剂质量分析等。目前,一些发达国家已把热分析方法作为控制药品质量的主要方法之一,美国药典23版与英国药典1993年版均已收载了热分析方法。1 热分析技术的方法分类1.1 差热分析(differential thermal analysis,DTA) DTA是最先发展起来的热分析技术。当给予被测物和参比物同等热量时,因二者对热的性质不同,其升温情况必然不同,通过测定二者的温度差达到分析目的。以参比物与样品间温度差为纵座标,以温度为横座标所得的曲线,称为DTA曲线。1.2 差示扫描量热法(differential scanning calorimentry, DSC) DSC是在DTA基础上发展起来的一种热分析方法。由于被测物与参比物对热的性质不同,要维持二者相同的升温,必然要给予不同的热量,通过测定被测物吸收(吸热峰)或放出(放热峰)热量的变化,达到分析目的。以每秒钟的热量变化为纵座标,温度为横座标所得的曲线,称为DSC曲线,与DTA曲线形状相似,但峰向相反。1.3 热重分析(thermogravimetry,TGA) TGA是一种通过测量被分析样品在加热过程中重量变化而达到分析目的的方法。即将样品置于具有一定加热程序的称量体系中,测定记录样品随温度变化而发生的重量变化。以被分析物重量(%)为纵座标,温度为横座标的所得的曲线即TGA曲线。其它尚有导数热重量分析、热机械分析(TMA)、质谱差示分析等。2 热分析技术在药物分析中的应用 热分析技术常用于新药研究中。药物分析中应用最多的是将TGA与DSC联合使用。热分析技术可用于判断药物的熔点,确定药物的结晶水,测定药物的纯度,处方及辅料筛选等。2.1 药品熔点的判断 熔点是衡量药物质量的重要指标之一。确定药物的熔点需确定这个药物是熔融同时分解还是熔点,再确定其熔融同时分解或熔点的具体温度。如果采用历版中国药典收载的毛细管测定法,很难作到准确判断。如采用DSC与TGA相结合进行测定,则可对其作出准确的判断。80年代初重庆市药品检验所曾用DSC和TGA确定磷酸氯喹的熔点,1986年杨腊虎又用DSC测定九种熔点标准品物质的熔点。2.2 药品的纯度测定 利用热分析技术测定药品纯度的理论依据是范德霍夫方程,即药品熔点的下降与杂质存在的克分子分数成正比。采用逐步加热程序技术(step heating programming technique)可扩大测定范围简化测定过程并缩短测定时间。但此方程的适用条件为被测药物不能熔融同时分解,并药物与共存杂质之间不得形成固溶剂。当不需要得到药物的准确纯度时,可采用与对照品同时测定DSC或TGA曲线,通过分析热分析曲线来确定药物的纯度。文献报道了用热分析技术测定药物的纯度和用DSC测定硝苯地平的纯度。2.3 药物的多晶型分析 不同晶型的药物具有不同的生物利用度,因而具不同疗效。区别药物的晶型,过去通常采用红外分光光度法和X-射线衍射法。后来常用DSC或DTA分析法。用热分析技术不仅可区别同一药物的不同晶型,而且还可提供其热力学变化过程,为选择转晶条件提供依据。如对甲苯咪唑、多沙唑喹、法莫替丁、头孢新酯等的多晶型研究。徐坚等还用热分析技术研究了甲氧氯普胺两种晶型的互变条件及各自的溶解热。2.4 差向异构体的分析 不少的药物存在差向异构体,同一药物不同的差向异构体之间,其生物利用度不同。侯美琴等报导了用DTA和DSC分析双炔失碳的差向异构体,测定出其中α体的纯度,并为其制剂的剂量调整提供依据。2.5 药物中结晶水与吸附水的确定 确定药物分子中有无结晶水和结晶水的个数,过去常用卡氏水份测定法或在一定条件下测定干燥失重来决定。这些方法很难区分是分子中的结晶水还是吸附水。采用DSC-TG技术则可解决此问题。2.6 药物制剂中活性成份分析 热分析技术可用于药物制剂中活性成分的定性分析、定量分析和药物与辅料间的相互作用以及处方的设计。1980年有人报道不经分离直接用DSC技术测定磺胺类药物、硝基呋喃类药物以及解热镇痛类药物的胶囊剂和片剂。近年有文献报道用DSC考察了制剂中,活性成份间及活性成份与辅料间是否发生反应,即通过观察各活性成份、辅料以及制剂的DSC曲线的差异,发现是否出现新峰,以达到考察它们间是否相容,可否进行配伍的目的。2.8 药物的稳定性研究 汤启昭利用热分析技术研究了葡萄糖酸亚铁固体的稳定性,并与气相色谱分析结合,提高了热分析的研究水平;武凤兰用热分析技术研究了固体药物对乙酰氨基酚的分解动力学。
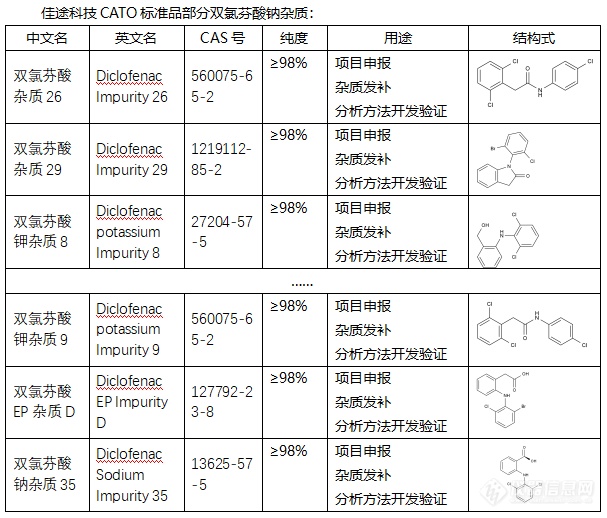
◇双氯芬酸钠杂质在双氯芬酸钠的生产和储存过程中,可能会产生一些杂质,双氯芬酸钠的杂质有多种,包括但不限于以下几种:双氯芬酸钠杂质A:这是一种具有特定CAS号(15362-40-0)和分子式(C14H9Cl2NO2)的杂质。其分子量为278.13,密度为1.4±0.1 g/cm3,沸点为488.6±45.0°C at 760 mmhg,熔点为115-119°C;双氯芬酸钠杂质(1-(2,6-DICHLOROPHENYL)INDOLIN-2,3-DIONE):这是一种具有CAS号的杂质,其化学式为C14H7Cl2NO2。双氯芬酸钠的其他杂质:除了上述两种杂质外,双氯芬酸钠还可能存在其他杂质,如乙酰氯芬酸杂质、醋氯芬酸杂质等。CATO标准品提供的双氯芬酸钠全套的杂质,这些杂质对于药物的纯度和稳定性研究至关重要,也是药物研发过程中不可或缺的一部分。[img=,607,518]https://ng1.17img.cn/bbsfiles/images/2024/02/202402192056045756_8062_6381607_3.png!w607x518.jpg[/img]广州佳途科技股份有限公司深知药物研发与质量控制的重要性,CATO标准品厂家,提供双氯芬酸钠全套的杂质,为客户提供更加精准、可靠的分析标准品,助力药物研发事业的快速发展,以满足客户在药物研发和质量控制方面的需求。
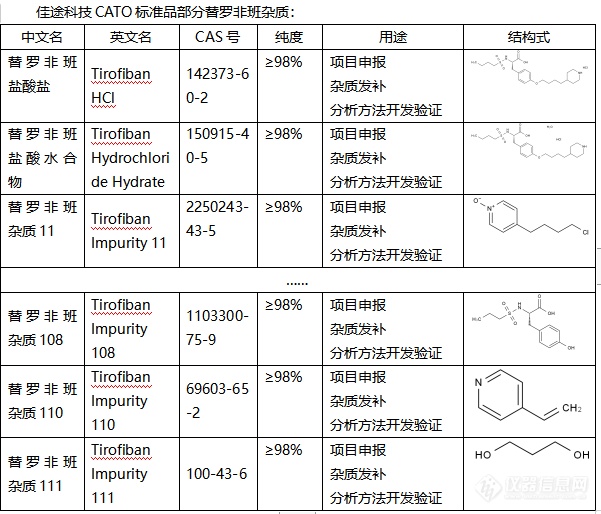
在当今的医疗领域,药物的质量控制至关重要,直接关系到患者的生命健康。替罗非班是一种广泛应用于心血管疾病治疗的药品,其质量控制尤为重要。而杂质分析作为药物质量控制的关键环节,能够准确评估药物的安全性和有效性。本文将重点探讨替罗非班杂质分析与CATO标准品应用研究的重要性。首先,杂质分析是确保药物质量的重要手段。在替罗非班的制备过程中,可能会产生一系列杂质,这些杂质的存在可能对药物的疗效和安全性产生不良影响。CATO标准品作为一种有效的分析工具,能够准确鉴定和量化替罗非班中的杂质,为药物的质量控制提供科学依据。其次,CATO标准品的应用有助于深入了解杂质的来源和性质。通过与标准品的比对分析,研究人员可以追溯杂质的产生途径,从而优化生产工艺,降低杂质的产生。此外,CATO标准品还可以用于评估杂质的毒性和风险,为药物的安全性评价提供有力支持。此外,CATO标准品在指导药物生产和改进方面也具有重要意义。通过对替罗非班中杂质的准确分析,生产商可以针对性地优化生产工艺、加强质量控制,从而提高药物的纯度和安全性。这不仅有助于保障患者的用药安全,还有助于提升企业的生产效益和市场竞争力。综上所述,替罗非班杂质分析与CATO标准品应用研究在药物质量控制中发挥着关键作用。通过深入研究替罗非班中的杂质,并借助CATO标准品这一强大工具,我们能够更好地了解杂质的来源、性质和影响,从而优化药物的生产工艺、提升药物的安全性和有效性。[img=,601,514]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021849065001_3752_6381568_3.png!w601x514.jpg[/img]欢迎有需要的各位联系
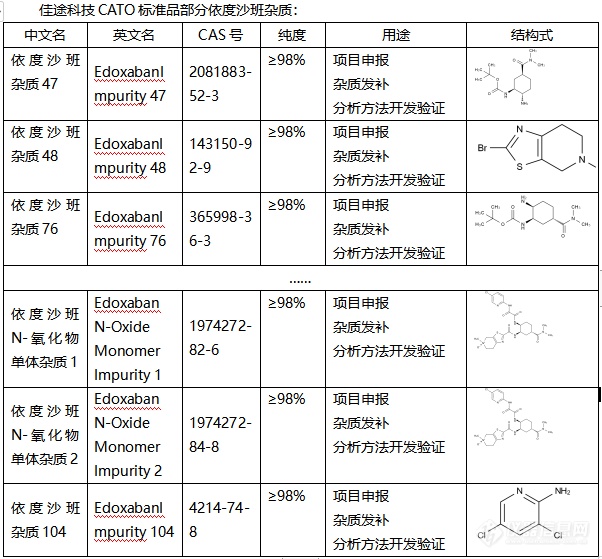
依度沙班,作为一种抗凝药物,被广泛应用于预防和治疗血栓形成。然而,与其他药物一样,依度沙班在生产过程中也可能产生杂质。这些杂质的存在可能会影响药物的安全性和有效性。为了确保依度沙班的质量,科学家们引入了CATO标准进行杂质分析。CATO标准是一种先进的分析方法,可以帮助研究人员准确地检测和衡量依度沙班中的杂质。通过对比和分析,我们可以清楚地了解杂质的种类、数量以及可能对药物产生的影响。这一标准的应用,不仅提高了依度沙班的生产质量,也为我们提供了一种有效的质量控制手段。在实际应用中,CATO标准品发挥着重要的作用。首先,它能够准确鉴定和量化依度沙班中的杂质,为药物的质量控制提供科学依据。其次,通过与标准品的比对分析,研究人员可以深入了解杂质的来源和性质,从而优化生产工艺,降低杂质的产生。此外,CATO标准品还可以用于评估杂质的毒性和风险,为药物的安全性评价提供有力支持。随着研究的深入,CATO标准在依度沙班杂质分析中的应用将不断优化和完善。通过科学的分析和严格的控制,我们能够确保依度沙班的安全性和有效性,为患者的健康提供更好的保障。同时,这也将推动药物生产的科技进步,造福更多患者。[img=,602,559]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021907159831_6894_6381568_3.png!w602x559.jpg[/img]广州佳途科技股份有限公司是一家专业的CATO标准品生产厂家,目前公司库存有全套乐伐替尼杂质,能够提供相应的系列图谱和产品COA证书,并且支持买家溯源。
质谱技术是抗体药物分析最重要的技术手段之一。本文简述了抗体药物的发展和质谱技术的原理。对于质谱技术在抗体药物的分析中应用进行了归类整理,主要分为在一级结构和高级结构分析中的应用。抗体类药物是指含有抗体片段的蛋白类药物,所以在恶性肿瘤、自身免疫性疾病、心血管疾病、感染和器官移植排斥等重大疾病上得到了快速的发展,是当前生物药物领域增长最快的一类药物.1.抗体药物发展新趋势在生物药物领域,抗体药物占据着越来越重要的地位,全球销售排名前10位的药物中有6个为抗体药物,抗体药物按来源分类可以分为:鼠源单克隆抗体、人鼠嵌合抗体、人源化抗体和全人源抗体。目前,批准的单克隆抗体药物中,人源化单抗和全人源单抗数量已占据大多数。1.1 抗体药物偶联物(ADC)抗体药物偶联物(ADC)由单克隆抗体和小分子化合物两部分组成。通过抗体的靶向作用,ADC 的抗体部分和肿瘤细胞表面抗原特异性识别并结合,通过细胞内吞作用,将抗体和小分子化合物一起带进肿瘤细胞内部,释放出小分子化合物。这样既可以降低小分子药物的毒性,同时具有靶向结合的作用。已经上市的两个ADC 是Kadyla 和Adcetris。1.2 双特异性抗体(BsAb)双特异性抗体(BsAb)是含有两种特异性抗原结合位点的人工抗体,能在靶细胞和功能分子(细胞)之间架起桥梁,由于基因工程的发展,目前双特异性抗体已经研发出多种类型,主要类型有三功能双特异性抗体、IgG-scFv、三价双特异性分子、串联单链抗体(串联scFv)、DVD-Ig 等多种形式。2.质谱技术近年来质谱仪性能的显著改进主要基于开发出的两种离子化技术:一种是介质辅助的激光解吸/离子化技术。另一种是电喷雾离子化技术。由于这两种电离技术的出现,使原本只能检测小分子的质谱技术,可以运用于检测生物大分子。在过去质谱技术主要运用于对一级结构和序列的表征,而现在质谱技术越来越多地运用于高级结构的分析,而高级结构对于抗体药物的生物活性至关重要。3.质谱技术在抗体药物一级结构分析中的应用3.1 完整抗体药物精确分子量测定当得到抗体药物时,可以直接通过高分辨率的MALDI-TOF或者ESI-MS进行分子量的检测。通过对于脱糖后分子量的检测,可以对于抗体药物进行初步定性分析,并将可以作为药物常规放行的分析方法。对于脱糖前的抗体药物进行分析,可以得到抗体药物的糖基化类型的信息及糖基化水平的分布,对于快速了解生产工艺与药物质量的关系具有十分重要的意义。3.2 药物抗体偶联比(DAR)对于赖氨酸链接的抗体偶联药物,采用C4色谱柱及联用的质谱对去糖基化样品进行分析,根据偶联不同数目药物分子的质量数增加判断偶联数目。对于质谱测定的结果,不仅可以给出确切的药物抗体偶联比值,更能够给出链接不同个小分子药物的分布情况,及反应过程副产物空链接头的分布情况。3.3 肽图谱分析蛋白被特异酶切后的蛋白酶水解后得到的肽片段质量图谱。由于不同的抗体药物具有不同的氨基酸序列,蛋白质被酶水解后,产生的肽片段也各不相同,肽混合物的质量数具有唯一特征。可以通过LC-ESI-MS进行肽片段的一级质量数的鉴定,也可以通过LC-ESI-MS/MS对于每个肽片段进行进一步确证,提高肽图谱的准确性。3.4 翻译后修饰研究蛋白质的翻译后修饰(PTM)对于抗体药物的生物学功能十分重要。常见的翻译后修饰有:磷酸化、脱酰胺、甲硫氨酸氧化、糖基化修饰、N端焦谷氨酸环化,C端赖氨酸切除等。质谱分析仪检测蛋白和肽片段的分子量偏差,可以实现高灵敏、高通量和高精确地鉴别蛋白质的翻译后修饰的种类。3.5 N端氨基酸序列检测常规N端氨基酸检测用Edman降解法进行检测,但是抗体药物有时候会出现N 端环化的现象,在这种情况下用Edman降解法需要先对抗体进行去封闭处理,而直接使用质谱可以直接测出N端的氨基酸序列,同时可以检测出N端环化的相对比例。4.质谱技术在抗体药物高级结构分析中的应用4.1 氢/氘交换质谱(HDX-MS)常规的质谱只能获得蛋白的一级结构信息。氢/氘交换质谱(HDX-MS)可以进行蛋白质构象,溶液动力学和表位映射进行分析。在能够调查的蛋白质的高阶结构和动态结构技术中,HDX-MS已经证明适合单克隆抗体和单克隆抗体-抗原复合物的构象分析。4.2 离子淌度质谱法(IM-MS)离子淌度是根据蛋白的电荷和形状选择性分离的方法,可以区分相同分子量的蛋白和肽段,可用于检测蛋白的简单高级结构。4.3 高分辨率傅立叶变换离子回旋共振质谱(FTICR-MS)高分辨率傅立叶变换离子回旋共振质谱(FTICR-MS)能够检测最高质量数的质谱仪器,并且有着很高的分辨率。FTICR-MS 是目前被公认为是蛋白质组学研究的有力工具,特别是和完整的蛋白质鉴定和上/下调翻译后修饰(PTM)蛋白质的鉴定。
看到一个专利名称:用于药物分析的称样瓶 ,不知道这个瓶子有什么特点?
药物分析的基础知识 第一节 药品检验工作的基本程序 一般为取样、鉴别、检查、含量测定、写出报告。 取样: 鉴别:判断真伪。 检查:称纯度检查,判定药物优劣。 含量测定:测定药物中有效成分的含量。 检验报告必须明确、肯定、有依据。 计量仪器认证要求:县级以上人民政府计量行政部门负责进行监督检查。符合经济合理、就地就近。 第二节 药品质量标准分析方法验证 目的是证明采用的方法适合于相应的检测要求。 验证内容:准确度、精密度(包括重复性、中间精密度和重现性)、专属性、检测限、定量限、线性、范围和耐用性。 一、准确度: 是指用该方法测定的结果与真实值或参考值接近的程度,一般以百分回收率表示。 至少用9次测定结果进行评价。 二、精密度: 是指在规定的条件下,同一个均匀样品,经过多次取样测定所得结果之间的接近程度。 用偏差、标准偏差或相对标准偏差表示。 1、 重复2、 性:相同3、 条件下,4、 一个分析人员测定所得结果的精密度称为重复5、 性。至少9次。 6、 中间精密度:同7、 一个实验室,8、 不同9、 时间不同10、 分析人员用不同11、 设备12、 测定结果的精密度。 3、重现性:不同实验室,不同分析人员测定结果的精密度。分析方法被法定标准采用应进行重现性试验。 三、专属性:指在其他成分可能存在的情况下,采用的方法能准确测定出被测物的特性,用于复杂样品分析时相互干扰的程度。鉴别反应、杂质检查、含量测定方法,圴应考察专属性。 四、检测限:指试样中被测物能被检测出的最低量,无须定量。用百分数、ppm或ppb表示。 五、定量限:指样品中被测物能被定量测定的最低量,测定结果应具一定的精密度和准确度。 六、线性:系指在设计的范围内,测试结果与试样中被测物浓度直接呈正比关系的程度。 七、范围:能达到一定的精密度、准确度和线性的条件下,测试方法适用的高低限浓度或量的区间。 八、耐用性:指在一定的测定条件稍有变动时,测定结果不受影响的承受程度。第三节 药物分析的统计学知识 测量误差:测量值和真实值之差。 绝对误差和相对误差。 真实值:是有经验的人用最可靠的方法对试样进行多次测定所得的平均值。 系统误差:(1)方法误差 (2)试剂误差 (3)仪器误差 (4)操作误差 偶然误差:不可定误差或随机误差,由偶然原因引起。可增加平得测定次数。 测量值的准确度表示测量的正确性,测量值的精密度表示测量的重现性。精密度是表示准确度的先决条件,只有在消除了系统误差后,才可用精密度同时表达准确度。 提高分析准确度方法:1、选择合适的分析方法 2、减少测量误差 3、增加平行测定次数 4、消除测量过程中的系统误差(校准仪器、做对照试验、做回收试验、做空白试验) 有效数字的处理:0.05060g是四位有效数字。首位是8或9,有效数字可多记一位。PH=8.02是两位有效数字。四舍六入五成双原则。修约标准偏差或其他表示不确定度时,修约结果可使准确度估计值变得差一点。S=2.13——2.2 G检验法、4d法,%26gt;舍去。
资料来自丁香园实验数据中各变量的关系可表示为列表式,图示式和函数式。 列表式:将实验数据制成表格。它显示了各变量间的对应关系,反映出变量之间的变化规律。它是标绘曲线的基础。图示式:将实验数据绘制成曲线。它直观地反映出变量之间的关系。在报告与论文中几乎都能看到,而且为整理成数学模型(方程式)提供了必要的函数形式。 函数式:借助于数学方法将实验数据按一定函数形式整理成方程即数学模型。 熟悉相关和回归的定义,相关系数的定义,直线回归的最小二乘法。 熟悉药品质量标准分析方法验证中各项指标的定义和考察方法。 含量测定方法的评价 (效能指标—分析品质因数) 一般常用的分析效能评价指标包括:精密度、准确度、检测限、定量限、选择性、线性与范围、重现性、耐用性等;测定法的效能指标可评价分析测定方法,也可作为建立新的测定方法的实验研究依据。 1.精密度系指用该法测定同一匀质样品的一组测量值彼此符合的程度。它们越接近就越精密。在药物分析中,常用标准(偏)差(SD或S); 相对标准(偏)差(RSD),也称变异系数(CV),表示。 生物样品分析时,常用RSD表示精密度,并可细分为批内(或日内)精密度及批间(或日间)精密度。 批内精密度:是同一次测定的精密度。通常采用高、中、低三种浓度的同一样品各7-10份,每种浓度的样品按所拟定的分析方法操作,一次开机后,一一测定。计算每种浓度样品的SD值及RSD值。批内精密度也可视为日内精密度。所得RSD应争取达到5%以内,但不能超过10%。 批间精密度:是不同次测定的精密度。通常采用高、中、低三种浓度的同一样品,每种浓度配制7-10份,置冰箱冷冻。自配制样品之日开始,按所拟定的分析方法操作,每天取出一份测定,计算每种浓度样品的SD值及RSD值。批间精密度也可视为日间精密度。所得RSD应控制在15%以内。 2.准确度是指测得结果与真实值接近的程度,表示分析方法测量的正确性。 由于“真实值”无法准确知道,因此,通常采用回收率试验来表示。 制剂的含量测定时,采用在空白辅料中加入原料药对照品的方法作回收试验及计算RSD,还应作单独辅料的空白测定。每份均应自配制模拟制剂开始,要求至少测定高、中、低三个浓度,每个浓度测定三次,共提供9个数据进行评价。 回收率=(平均测定值M -空白值B)/ 加入量A×100% 回收率的RSD一般应为2%以内。 3.检测限(LOD)是指分析方法能够从背景信号中区分出药物时,所需样品中药物的最低浓度,无需定量测定。 LOD是一种限度检验效能指标,它既反映方法与仪器的灵敏度和噪音的大小,也表明样品经处理后空白(本底)值的高低。要根据采用的方法来确定检测限。当用仪器分析方法时,可用已知浓度的样品与空白试验对照,记录测得的被测药物信号强度S与噪音(或背景信号)强度N,以能达到S/N=2或S/N=3时的样品最低药浓为LOD;也可通过多次空白试验,求得其背景响应的标准差,将三倍空白标准差(即3δ空或3S空)作为检测限的估计值。为使计算得到的LOD值与实际测得的LOD值一致,可应用校正系数来校正,然后依之制备相应检测限浓度的样品,反复测试来确定LOD。如用非仪器分析方法时,即通过已知浓度的样品分析来确定可检出的最低水平作为检测限。 4.定量限 (LOQ)是指在保证具有一定可靠性(一定准确度和精密度)的前提下,分析方法能够测定出的样品中药物的最低浓度。 它反映了分析方法测定低药物浓度样品时具有的可靠性。它与上述的检测限的差别在于:定量限要定量测定某一药物在样品介质中的最低浓度,且定量限规定的最低浓度应该符合一定的精密度和准确度的要求。确定定量限的方法也因所用方法不同而异。当用非仪器分析方法时,与上述检测限的确定方法相同;如用仪器分析方法时,则往往将多次空白试验测得的背景响应的标准差(即空白标准差)乘以10,作为定量限的估计值,继之,再通过分析适当数量已知接近定量限或以定量限制备的样品来验证。 5.选择性是指在样品介质中有其他组分共存时该分析方法对供试物质准确而专属的测定能力。 它与专属性的含义稍有不同。专属性是指一种方法仅对一种分析成分产生唯一信号;选择性则可对多种化学成分产生不同响应,而主要成分的响应可与其它响应区分。 因此,选择性是指该法用于复杂样品分析时相互干扰程度的量度。 在药物分析中考察一个分析方法的选择性时,应着重考虑杂质、降解产物、相关化合物以及制剂辅料等其他组分是否对被测药物的测定有干扰。一般,通过添加上述物质的样品与未曾添加的样品所得分析结果进行比较而确定。 6.线性与范围 分析方法的线性是在给定范围内获取与样品中供试物浓度成正比的试验结果的能力。换句话说,就是供试物浓度的变化与试验结果(或测得的响应信号)成线性关系。 所谓线性范围是指利用一种方法取得精密度、准确度均符合要求的试验结果,而且成线性的供试物浓度的变化范围,其最大量与最小量之间的间隔,可用mg/L ~ mg/L、 ug/ml ~ ug/ml等表示。 线性与范围的确定可用作图法(响应值Y/浓度X)或计算回归方程(Y=a+bX)来研究建立。 测定样品时所有生物药物分析方法都必须同时作标准曲线。每次作标准曲线时,方法应与分析方法考核时完全一致。标准浓度应包括一定梯度的5-8个浓度(非线性者如免疫分析可适当增加),每个浓度只需测定一次(免疫分析可测定两次并取均值);标准曲线应覆盖样品可能的浓度范围,对于含量测定要求一般浓度上限为样品最高浓度的120%,下限为样品最低浓度的80% (但应高于LOQ);目前仍广泛采用相关系数(r)表示标准曲线的线性度、并控制r≥0.9900。对照品的LOQ必须包括在线性范围。 7.耐用性 是指利用相同的方法在各种正常实验条件下对同一样品进行分析所得结果的重现程度。 所谓各种正常实验条件,包括不同的实验室、不同的分析人员、不同的仪器、不同批号的试剂、不同的测试耗用时间、不同的分析温度、不同的测定日期等等。分析方法重现性的测定是通过在不同实验室由不同的实验者(操作和环境条件虽有差别但仍在规定的分析参数内)对同一样品的分别测试而获得的。 重现性 即是指在不同实验室中使用此种分析方法的精密度。是评价其保持不受参数微小变差影响的能力,并可作为正常使用的一个可靠性指标。 8. 与参比方法测得结果的相关程度的比较 由于生物样品中含有许多干扰测定的杂质,特别是与原型药物相似的代谢物常对药物的测定有影响。因此,除考察选择性外,有时还用参比方法对实际生物样品同时测定并进行比较。比较试验时,取若干份实际样品 (如病人服药后采取的血样),用一个已证明有相当专属性和可靠性的方法与新建立的方法同时进行测定,以参比方法测得的药浓为横坐标(X),以新建立方法测得的药浓为纵坐标(Y)作成散布图,并求出直线回归方程 (y=a+bx)及相关系数 (r)。r最大值为1,表示两法完全相关(结果完全吻合);r=0时,表示两法完全不相关。一般要求两法的相关系数r>0.95,而相关直线的斜率 应接近于1。 评价一种分析方法的效能,一般根据方法的使用对象区别。有以下四种情况: A.用于原料药中主要组分或制剂中有效组分含量测定的方法:除了检测限和定量限二项指标外,对精密度、准确度、选择性、线性与范围、耐用性等均应有所要求; B.用于原料药中杂质测定或制剂中降解产物测定的方法又可分为两种: ①用于含量测定;要求是:除检测限和精密度指标不必要求外,对准确度、选择性、线性与范围、定量限、耐用性等均应有所要求; ②用于限度检查。要求是:只对检测限、选择性和耐用性三项指标有所要求,其余均无需要求。 C.用于溶出度测定的方法及药物释放度测定的方法,只有精密度和耐用性有所要求,其余项目均不作要求。 D.用于生物样品中药物测定的方法,对精密度、准确度、检测限、选择性、可测线性范围、定量限、对生物样品的耐用性以及与参比方法测得结果的相关程度的比较等指标应有所要求。
药物分析实验数据处理实验数据中各变量的关系可表示为列表式,图示式和函数式。 列表式:将实验数据制成表格。它显示了各变量间的对应关系,反映出变量之间的变化规律。它是标绘曲线的基础。图示式:将实验数据绘制成曲线。它直观地反映出变量之间的关系。在报告与论文中几乎都能看到,而且为整理成数学模型(方程式)提供了必要的函数形式。 函数式:借助于数学方法将实验数据按一定函数形式整理成方程即数学模型。 熟悉相关和回归的定义,相关系数的定义,直线回归的最小二乘法。 熟悉药品质量标准分析方法验证中各项指标的定义和考察方法。 含量测定方法的评价 (效能指标—分析品质因数) 一般常用的分析效能评价指标包括:精密度、准确度、检测限、定量限、选择性、线性与范围、重现性、耐用性等;测定法的效能指标可评价分析测定方法,也可作为建立新的测定方法的实验研究依据。 1.精密度系指用该法测定同一匀质样品的一组测量值彼此符合的程度。它们越接近就越精密。在药物分析中,常用标准(偏)差(SD或S); 相对标准(偏)差(RSD),也称变异系数(CV),表示。 生物样品分析时,常用RSD表示精密度,并可细分为批内(或日内)精密度及批间(或日间)精密度。 批内精密度:是同一次测定的精密度。通常采用高、中、低三种浓度的同一样品各7-10份,每种浓度的样品按所拟定的分析方法操作,一次开机后,一一测定。计算每种浓度样品的SD值及RSD值。批内精密度也可视为日内精密度。所得RSD应争取达到5%以内,但不能超过10%。 批间精密度:是不同次测定的精密度。通常采用高、中、低三种浓度的同一样品,每种浓度配制7-10份,置冰箱冷冻。自配制样品之日开始,按所拟定的分析方法操作,每天取出一份测定,计算每种浓度样品的SD值及RSD值。批间精密度也可视为日间精密度。所得RSD应控制在15%以内。 2.准确度是指测得结果与真实值接近的程度,表示分析方法测量的正确性。 由于“真实值”无法准确知道,因此,通常采用回收率试验来表示。 制剂的含量测定时,采用在空白辅料中加入原料药对照品的方法作回收试验及计算RSD,还应作单独辅料的空白测定。每份均应自配制模拟制剂开始,要求至少测定高、中、低三个浓度,每个浓度测定三次,共提供9个数据进行评价。 回收率=(平均测定值M -空白值B)/ 加入量A×100% 回收率的RSD一般应为2%以内。 3.检测限(LOD)是指分析方法能够从背景信号中区分出药物时,所需样品中药物的最低浓度,无需定量测定。 LOD是一种限度检验效能指标,它既反映方法与仪器的灵敏度和噪音的大小,也表明样品经处理后空白(本底)值的高低。要根据采用的方法来确定检测限。当用仪器分析方法时,可用已知浓度的样品与空白试验对照,记录测得的被测药物信号强度S与噪音(或背景信号)强度N,以能达到S/N=2或S/N=3时的样品最低药浓为LOD;也可通过多次空白试验,求得其背景响应的标准差,将三倍空白标准差(即3δ空或3S空)作为检测限的估计值。为使计算得到的LOD值与实际测得的LOD值一致,可应用校正系数来校正,然后依之制备相应检测限浓度的样品,反复测试来确定LOD。如用非仪器分析方法时,即通过已知浓度的样品分析来确定可检出的最低水平作为检测限。 4.定量限 (LOQ)是指在保证具有一定可靠性(一定准确度和精密度)的前提下,分析方法能够测定出的样品中药物的最低浓度。 它反映了分析方法测定低药物浓度样品时具有的可靠性。它与上述的检测限的差别在于:定量限要定量测定某一药物在样品介质中的最低浓度,且定量限规定的最低浓度应该符合一定的精密度和准确度的要求。确定定量限的方法也因所用方法不同而异。当用非仪器分析方法时,与上述检测限的确定方法相同;如用仪器分析方法时,则往往将多次空白试验测得的背景响应的标准差(即空白标准差)乘以10,作为定量限的估计值,继之,再通过分析适当数量已知接近定量限或以定量限制备的样品来验证。 5.选择性是指在样品介质中有其他组分共存时该分析方法对供试物质准确而专属的测定能力。 它与专属性的含义稍有不同。专属性是指一种方法仅对一种分析成分产生唯一信号;选择性则可对多种化学成分产生不同响应,而主要成分的响应可与其它响应区分。 因此,选择性是指该法用于复杂样品分析时相互干扰程度的量度。 在药物分析中考察一个分析方法的选择性时,应着重考虑杂质、降解产物、相关化合物以及制剂辅料等其他组分是否对被测药物的测定有干扰。一般,通过添加上述物质的样品与未曾添加的样品所得分析结果进行比较而确定。 6.线性与范围 分析方法的线性是在给定范围内获取与样品中供试物浓度成正比的试验结果的能力。换句话说,就是供试物浓度的变化与试验结果(或测得的响应信号)成线性关系。 所谓线性范围是指利用一种方法取得精密度、准确度均符合要求的试验结果,而且成线性的供试物浓度的变化范围,其最大量与最小量之间的间隔,可用mg/L ~ mg/L、 ug/ml ~ ug/ml等表示。 线性与范围的确定可用作图法(响应值Y/浓度X)或计算回归方程(Y=a+bX)来研究建立。 测定样品时所有生物药物分析方法都必须同时作标准曲线。每次作标准曲线时,方法应与分析方法考核时完全一致。标准浓度应包括一定梯度的5-8个浓度(非线性者如免疫分析可适当增加),每个浓度只需测定一次(免疫分析可测定两次并取均值);标准曲线应覆盖样品可能的浓度范围,对于含量测定要求一般浓度上限为样品最高浓度的120%,下限为样品最低浓度的80% (但应高于LOQ);目前仍广泛采用相关系数(r)表示标准曲线的线性度、并控制r≥0.9900。对照品的LOQ必须包括在线性范围。 7.耐用性 是指利用相同的方法在各种正常实验条件下对同一样品进行分析所得结果的重现程度。 所谓各种正常实验条件,包括不同的实验室、不同的分析人员、不同的仪器、不同批号的试剂、不同的测试耗用时间、不同的分析温度、不同的测定日期等等。分析方法重现性的测定是通过在不同实验室由不同的实验者(操作和环境条件虽有差别但仍在规定的分析参数内)对同一样品的分别测试而获得的。 重现性 即是指在不同实验室中使用此种分析方法的精密度。是评价其保持不受参数微小变差影响的能力,并可作为正常使用的一个可靠性指标。 8. 与参比方法测得结果的相关程度的比较 由于生物样品中含有许多干扰测定的杂质,特别是与原型药物相似的代谢物常对药物的测定有影响。因此,除考察选择性外,有时还用参比方法对实际生物样品同时测定并进行比较。比较试验时,取若干份实际样品 (如病人服药后采取的血样),用一个已证明有相当专属性和可靠性的方法与新建立的方法同时进行测定,以参比方法测得的药浓为横坐标(X),以新建立方法测得的药浓为纵坐标(Y)作成散布图,并求出直线回归方程 (y=a+bx)及相关系数 (r)。r最大值为1,表示两法完全相关(结果完全吻合);r=0时,表示两法完全不相关。一般要求两法的相关系数r>0.95,而相关直线的斜率 应接近于1。 评价一种分析方法的效能,一般根据方法的使用对象区别。有以下四种情况: A.用于原料药中主要组分或制剂中有效组分含量测定的方法:除了检测限和定量限二项指标外,对精密度、准确度、选择性、线性与范围、耐用性等均应有所要求; B.用于原料药中杂质测定或制剂中降解产物测定的方法又可分为两种: ①用于含量测定;要求是:除检测限和精密度指标不必要求外,对准确度、选择性、线性与范围、定量限、耐用性等均应有所要求; ②用于限度检查。要求是:只对检测限、选择性和耐用性三项指标有所要求,其余均无需要求。 C.用于溶出度测定的方法及药物释放度测定的方法,只有精密度和耐用性有所要求,其余项目均不作要求。 D.用于生物样品中药物测定的方法,对精密度、准确度、检测限、选择性、可测线性范围、定量限、对生物样品的耐用性以及与参比方法测得结果的相关程度的比较等指标应有所要求。
一般常用的分析效能评价指标包括:精密度、准确度、检测限、定量限、选择性、线性与范围、重现性、耐用性等;测定法的效能指标可评价分析测定方法,也可作为建立新的测定方法的实验研究依据。 1.精密度系指用该法测定同一匀质样品的一组测量值彼此符合的程度。它们越接近就越精密。在药物分析中,常用标准(偏)差(SD或S); 相对标准(偏)差(RSD),也称变异系数(CV),表示。 生物样品分析时,常用RSD表示精密度,并可细分为批内(或日内)精密度及批间(或日间)精密度。 批内精密度:是同一次测定的精密度。通常采用高、中、低三种浓度的同一样品各7-10份,每种浓度的样品按所拟定的分析方法操作,一次开机后,一一测定。计算每种浓度样品的SD值及RSD值。批内精密度也可视为日内精密度。所得RSD应争取达到5%以内,但不能超过10%。 批间精密度:是不同次测定的精密度。通常采用高、中、低三种浓度的同一样品,每种浓度配制7-10份,置冰箱冷冻。自配制样品之日开始,按所拟定的分析方法操作,每天取出一份测定,计算每种浓度样品的SD值及RSD值。批间精密度也可视为日间精密度。所得RSD应控制在15%以内。 2.准确度是指测得结果与真实值接近的程度,表示分析方法测量的正确性。 由于“真实值”无法准确知道,因此,通常采用回收率试验来表示。 制剂的含量测定时,采用在空白辅料中加入原料药对照品的方法作回收试验及计算RSD,还应作单独辅料的空白测定。每份均应自配制模拟制剂开始,要求至少测定高、中、低三个浓度,每个浓度测定三次,共提供9个数据进行评价。 回收率=(平均测定值M -空白值B)/ 加入量A×100% 回收率的RSD一般应为2%以内。 3.检测限(LOD)是指分析方法能够从背景信号中区分出药物时,所需样品中药物的最低浓度,无需定量测定。 LOD是一种限度检验效能指标,它既反映方法与仪器的灵敏度和噪音的大小,也表明样品经处理后空白(本底)值的高低。要根据采用的方法来确定检测限。当用仪器分析方法时,可用已知浓度的样品与空白试验对照,记录测得的被测药物信号强度S与噪音(或背景信号)强度N,以能达到S/N=2或S/N=3时的样品最低药浓为LOD;也可通过多次空白试验,求得其背景响应的标准差,将三倍空白标准差(即3δ空或3S空)作为检测限的估计值。为使计算得到的LOD值与实际测得的LOD值一致,可应用校正系数(f)来校正,然后依之制备相应检测限浓度的样品,反复测试来确定LOD。如用非仪器分析方法时,即通过已知浓度的样品分析来确定可检出的最低水平作为检测限。 4.定量限 (LOQ)是指在保证具有一定可靠性(一定准确度和精密度)的前提下,分析方法能够测定出的样品中药物的最低浓度。 它反映了分析方法测定低药物浓度样品时具有的可靠性。它与上述的检测限的差别在于:定量限要定量测定某一药物在样品介质中的最低浓度,且定量限规定的最低浓度应该符合一定的精密度和准确度的要求。确定定量限的方法也因所用方法不同而异。当用非仪器分析方法时,与上述检测限的确定方法相同;如用仪器分析方法时,则往往将多次空白试验测得的背景响应的标准差(即空白标准差)乘以10,作为定量限的估计值,继之,再通过分析适当数量已知接近定量限或以定量限制备的样品来验证。 5.选择性是指在样品介质中有其他组分共存时该分析方法对供试物质准确而专属的测定能力。 它与专属性的含义稍有不同。专属性是指一种方法仅对一种分析成分产生唯一信号;选择性则可对多种化学成分产生不同响应,而主要成分的响应可与其它响应区分。 因此,选择性是指该法用于复杂样品分析时相互干扰程度的量度。 在药物分析中考察一个分析方法的选择性时,应着重考虑杂质、降解产物、相关化合物以及制剂辅料等其他组分是否对被测药物的测定有干扰。一般,通过添加上述物质的样品与未曾添加的样品所得分析结果进行比较而确定。 6.线性与范围 分析方法的线性是在给定范围内获取与样品中供试物浓度成正比的试验结果的能力。换句话说,就是供试物浓度的变化与试验结果(或测得的响应信号)成线性关系。 所谓线性范围是指利用一种方法取得精密度、准确度均符合要求的试验结果,而且成线性的供试物浓度的变化范围,其最大量与最小量之间的间隔,可用mg/L ~ mg/L、 ug/ml ~ ug/ml等表示。 线性与范围的确定可用作图法(响应值Y/浓度X)或计算回归方程(Y=a+bX)来研究建立。 测定样品时所有生物药物分析方法都必须同时作标准曲线。每次作标准曲线时,方法应与分析方法考核时完全一致。标准浓度应包括一定梯度的5-8个浓度(非线性者如免疫分析可适当增加),每个浓度只需测定一次(免疫分析可测定两次并取均值);标准曲线应覆盖样品可能的浓度范围,对于含量测定要求一般浓度上限为样品最高浓度的120%,下限为样品最低浓度的80% (但应高于LOQ);目前仍广泛采用相关系数(r)表示标准曲线的线性度、并控制r≥0.9900。对照品的LOQ必须包括在线性范围。 7.耐用性 是指利用相同的方法在各种正常实验条件下对同一样品进行分析所得结果的重现程度。 所谓各种正常实验条件,包括不同的实验室、不同的分析人员、不同的仪器、不同批号的试剂、不同的测试耗用时间、不同的分析温度、不同的测定日期等等。分析方法重现性的测定是通过在不同实验室由不同的实验者(操作和环境条件虽有差别但仍在规定的分析参数内)对同一样品的分别测试而获得的。 重现性 即是指在不同实验室中使用此种分析方法的精密度。是评价其保持不受参数微小变差影响的能力,并可作为正常使用的一个可靠性指标。 8. 与参比方法测得结果的相关程度的比较 由于生物样品中含有许多干扰测定的杂质,特别是与原型药物相似的代谢物常对药物的测定有影响。因此,除考察选择性外,有时还用参比方法对实际生物样品同时测定并进行比较。比较试验时,取若干份实际样品 (如病人服药后采取的血样),用一个已证明有相当专属性和可靠性的方法与新建立的方法同时进行测定,以参比方法测得的药浓为横坐标(X),以新建立方法测得的药浓为纵坐标(Y)作成散布图,并求出直线回归方程 (y=a+bx)及相关系数 (r)。r最大值为1,表示两法完全相关(结果完全吻合);r=0时,表示两法完全不相关。一般要求两法的相关系数r>0.95,而相关直线的斜率 (b) 应接近于1。 评价一种分析方法的效能,一般根据方法的使用对象区别。有以下四种情况: A.用于原料药中主要组分或制剂中有效组分含量测定的方法:除了检测限和定量限二项指标外,对精密度、准确度、选择性、线性与范围、耐用性等均应有所要求; B.用于原料药中杂质测定或制剂中降解产物测定的方法又可分为两种: ①用于含量测定;要求是:除检测限和精密度指标不必要求外,对准确度、选择性、线性与范围、定量限、耐用性等均应有所要求; ②用于限度检查。要求是:只对检测限、选择性和耐用性三项指标有所要求,其余均无需要求。 C.用于溶出度测定的方法及药物释放度测定的方法,只有精密度和耐用性有所要求,其余项目均不作要求。 D.用于生物样品中药物测定的方法,对精密度、准确度、检测限、选择性、可测线性范围、定量限、对生物样品的耐用性以及与参比方法测得结果的相关程度的比较等指标应有所要求。 [color=#DC143C][B]讨论:你在对实验结果一般采取什么方法?[/B][/color]
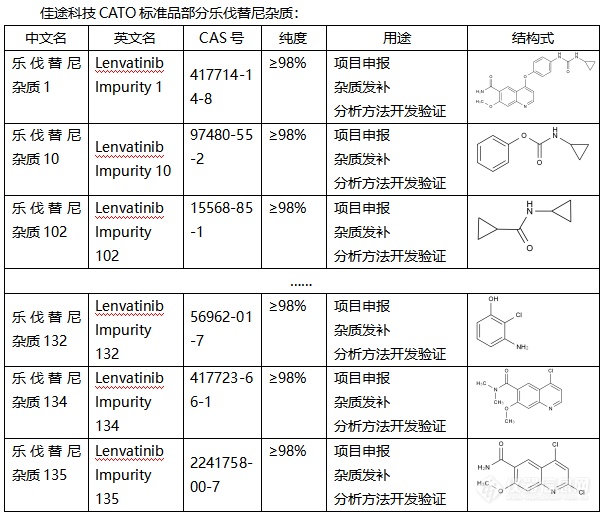
乐伐替尼,作为现代医学的瑰宝,广泛应用于肿瘤治疗领域。然而,就像其他药物一样,乐伐替尼在生产过程中也可能会产生杂质。这些微小的杂质,虽然量少,却可能对药物的疗效和安全性产生不可忽视的影响。为了确保乐伐替尼的纯净与安全,科学家们引入了CATO标准品进行杂质分析。CATO标准品,就像一把精准的尺子,能够帮助研究人员准确地检测和衡量乐伐替尼中的杂质。通过对比和分析,我们可以清楚地了解杂质的种类、数量以及可能对药物产生的影响。这项应用研究不仅提升了乐伐替尼的生产质量,更为患者的安全用药提供了有力保障。借助CATO标准品,我们能够及时发现并控制杂质,确保每一颗乐伐替尼都是纯净、有效的。未来,随着科学技术的不断进步,我们期待看到更多关于乐伐替尼杂质分析的研究成果,为患者带来更加安全、可靠的治疗方案。同时,也期待CATO标准品在更多药物杂质分析中发挥重要作用,守护人类的健康与安全。[img=,603,515]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021836237186_8744_6381568_3.png!w603x515.jpg[/img]广州佳途科技股份有限公司是一家专业的CATO标准品生产厂家,我们目前库存有全套乐伐替尼杂质,能够提供相应的系列图谱和产品COA证书,并支持溯源。我们公司已经通过了国内外双ISO 17034质量体系认证,欢迎广大客户选购。
化学药物分析方法验证一、概述 保证药品安全、有效、质量可控是药品研发和评价应遵循的基本原则,其中,对药品进行质量控制是保证药品安全有效的基础和前提。为达到控制质量的目的,需要多角度、多层面来控制药品质量,也就是说要对药物进行多个项目测试,来全面考察药品质量。一般地,每一测试项目可选用不同的分析方法,为使测试结果准确、可靠,必须对所采用的分析方法的科学性、准确性和可行性进行验证,以充分表明分析方法符合测试项目的目的和要求,这就是通常所说的对方法进行验证。方法验证的目的是判断采用的分析方法是否科学、合理,是否能有效控制药品的内在质量。从本质上讲,方法验证就是根据检测项目的要求,预先设置一定的验证内容,并通过设计合理的试验来验证所采用的分析方法能否符合检测项目的要求。方法验证在分析方法建立过程中具有重要的作用,并成为质量研究和质量控制的组成部分。只有经过验证的分析方法才能用于控制药品质量,因此方法验证是制订质量标准的基础。方法验证是药物研究过程中的重要内容。本指导原则重点探讨方法验证的本质,将分析方法验证的要求与所要达到的目的结合起来进行系统和规律性的阐述,重点阐述如何科学合理地进行论证方案的设计。本指导原则主要包括方法验证的一般原则、方法验证涉及的三个主要方面、方法验证的具体内容、对方法验证的评价等内容。本原则与其他相关技术指导原则一起构成较完整的质量控制指导原则。随着我国新药研发水平的不断提高,对方法验证的认识也会不断深入,本指导原则将会逐步完善和修订。由于生物制品和中药的特殊性,本原则主要适用于化学药品。二、方法验证的一般原则原则上每个检测项目采用的分析方法,均需要进行方法验证。方法验证的内容应根据检测项目的要求,结合所采用分析方法的特点确定。同一分析方法用于不同的检测项目会有不同的验证要求。例如,采用高效液相色谱法用于制剂的鉴别和杂质定量试验应进行不同要求的方法验证,前者重点要求验证专属性,而后者重点要求验证专属性、准确度、定量限。三、方法验证涉及的三个主要方面 (一)需要验证的检测项目检测项目是为控制药品质量,保证安全有效而设定的测试项目。根据检测项目的设定目的和验证内容的不同要求,本指导原则将需验证的检测项目分为鉴别、杂质检查(限度试验、定量试验)、定量测定(含量测定、溶出度、释放度等)、其他特定检测项目等四类。鉴别的目的在于判定被分析物是目标化合物,而非其它物质,用于鉴别的分析方法要求具有较强的专属性。杂质检查主要用于控制主成分以外的杂质,如有机杂质、无机杂质等。杂质检查可分为限度试验和定量试验两种情况。用于限度试验的分析方法验证侧重专属性和检测限。用于定量试验的分析方法验证强调专属性、准确度和定量限。定量测定包括含量测定、制剂的溶出度测定等,由于此类项目对准确性要求较高,故所采用的分析方法要求具有一定的专属性、准确度和线性。其他特定检测项目包括粒径分布、旋光度、分子量分布等,由于这些检测项目的要求与鉴别、杂质检查、定量测定等有所不同,对于这些项目的分析方法验证应有不同的要求。(二)分析方法本指导原则所指分析方法是为完成上述各检测项目而设定和建立的测试方法,一般包括分析方法原理、仪器及仪器参数、试剂、系统适用性试验、供试品溶液制备、对照品溶液制备、测定、计算及测试结果的报告等。测试方法可采用化学分析方法和仪器分析方法。这些方法各有特点,同一测试方法可用于不同的检测项目,但验证内容可不相同。(三)验证内容验证内容包括方法的专属性、线性、范围、准确度、精密度、检测限、定量限、耐用性和系统适用性等。四、方法验证的具体内容 (一)专属性专属性系指在其他成分(如杂质、降解物、辅料等)可能存在下,采用的分析方法能够正确鉴定、检出被分析物质的特性。(二)线性线性系指在设计的测定范围内,检测结果与供试品中被分析物的浓度(量)直接呈线性关系的程度。(三)范围范围系指能够达到一定的准确度、精密度和线性,测试方法适用的试样中被分析物高低限浓度或量的区间。(四)准确度准确度系指用该方法测定的结果与真实值或认可的参考值之间接近的程度。有时也称真实度。 (五)精密度精密度系指在规定的测试条件下,同一均质供试品,经多次取样进行一系列检测所得结果之间的接近程度(离散程度)。(六)检测限检测限系指试样中的被分析物能够被检测到的最低量,但不一定要准确定量。 (七)定量限定量限系指试样中的被分析物能够被定量测定的最低量,其测定结果应具有一定的准确度和精密度。(八)耐用性耐用性系指测定条件发生小的变动时,测定结果不受影响的承受程度。(九)系统适用性试验对一些仪器分析方法,在进行方法验证时,有必要将分析设备、电子仪器与实验操作、测试样品等一起当作完整的系统进行评估。系统适用性便是对整个系统进行评估的指标。系统适用性试验参数的设置需根据被验证方法类型而定。

[b]保健食品中“药物添加”那些事近日,原国家食品药品监督管理总局(以下简称国家总局)发布了2018年第36号公告。公告中指出,河南洛阳鼎康生物科技有限公司在销售山药枸杞压片糖果(标识生产企业为郑州天龙杏泽食品有限公司,生产许可证号为SC11341019400147)过程中,同时搭售无标示胶囊或标识“降糖专用”胶囊,并宣称所售产品具有降糖功能,搭售的胶囊产品中检出格列本脲、盐酸苯乙双胍和盐酸二甲双胍等药物成分。公告详见本公号发表的文章“总局关于立即停止销售山药枸杞子压片糖果和济茂堂牌赛舞胶囊等问题食品的公告(2018年第36号)”近年来,在保健品中非法添加化学药品的案例时有发生,而且添加的成分种类繁多、手法越来越隐蔽,对人民群众的用药安全产生了潜在的威胁。什么是保健品保健品是保健食品的通俗说法。GB16740-2014《食品安全国家标准 保健食品》第2.1条对保健食品定义为:声称并具有特定保健功能或者以补充维生素、矿物质为目的的食品。既适用于特定人群食用,具有调节机体功能,不以治疗疾病为目的,并且对人体不产生任何急性、亚急性或慢性危害的食品。因此,保健食品属于食品,其标志俗称"蓝帽子"(图1),与药品标志(图2,图3)完全不同,最近网络很火的“鸿茅药酒事件”中的鸿茅药酒就属于图2标志中的甲类非处方药,而不属于保健品。[img=,690,212]http://ng1.17img.cn/bbsfiles/images/2018/05/201805051126565445_3320_2166779_3.png!w690x212.jpg[/img][color=#000000]近年来在保健食品中非法添加化学药品事件屡禁不止,补肾壮阳类保健品因其庞大的服用人群和巨大的市场销售量,更是成为非法添加的重灾区。补肾壮阳类保健品中非法添加药物包括PDE-5抑制剂、蛋白同化制剂、α-肾上腺素受体阻滞剂、多巴胺(DA)受体激动剂和天然前列腺素(PG)类5类物质,而最为常见的是 PDE-5抑制剂。[/color]目前,临床上常用的PDE-5抑制剂主要有西地那非、伐地那非和他达拉非,而大多数PDE-5抑制剂类衍生物的有效性和安全性并不被人了解。2相关检测方法国内外报道西地那非及其类似物的检测主要有分光光度法、拉曼光谱法、[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]法、毛细管电泳法、色谱法等。其中色谱法是目前西地那非及其类似物检测分析中使用最多的方法,主要有薄层色谱法(TLC)、高效液相色谱法(HPLC)、液相色谱-串联质谱法([url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS)。对于实验室的精确筛查和定量分析,目前发布的相关标准是一般是先用HPLC法对非法添加的化学药物进行初步确定,再用选择性好、灵敏度高、较强抗干扰能力的[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS技术对化学成分做最终的确证。[/b][align=center][b]相关标准[/b][/align][b]为了加强监管,2012 年3月16 日国家总局发布了保健食品中可能非法添加的物质名单(第一批),列出 6类保健食品中可能添加的化学药品。其中声称缓解体力疲劳(抗疲劳)功能产品中可能非法添加的物质有那红地那非、红地那非、伐地那非、羟基豪莫西地那非、西地那非、豪莫西地那非、氨基他打拉非、他达拉非、硫代艾地那非、伪伐地那非和那莫西地那非等 11 种PDE-5 型抑制剂,按照国家食品药品监督管理局药品检验补充检验方法和检验项目批准件(2008016,2009030)进行检测。2016年,国家总局发布公告(2016年第196号),其中附件1:《食品中那非类物质的测定》(BJS201601),不仅适用于保健食品,还适用于酒、咖啡、功能饮料、玛咖片,扩大了适用范围。2017年,国家总局发布公告(BJS 201704),增加了对保健食品中去甲基他达拉非和硫代西地那非两种药物的检测,适用于酒和牡蛎粉。4近年来,国家对保健品非法添加的行为进行持续重点打击,常规的非法添加物已逐渐被不法分子淘汰,取而代之的是添加一些现有药物的合成类似物或衍生物以逃避国家监管。这些衍生物通常是由常见的 PDE-5抑制剂类药物(西地那非、他达拉非、伐地那非、红地那非、艾地那非)进行化学结构修饰得到,如果被盲目服用后可能存在更大的安全隐患。同时,此类物质未经批准而合成生产,结构未知且缺乏标准品,给执法部门的监管带来了难度,对筛查检测方法的广泛性和准确性提出了更高的要求。因此,利用高分辨质谱进行非定向高通量筛查,已成为目前研究的热点。相信在不久的将来,国家总局会发布更多关于PDE-5抑制剂的检测标准。[/b]
帕潘立酮是一种用于治疗精神疾病的药物,主要用于治疗精神分裂症和双相障碍等病症。在药品生产过程中,可能会产生一些杂质,这些杂质可能源自原料药合成步骤中的副反应、储存条件不当或者是制剂过程中的污染等。帕潘立酮的杂质主要包括以下两种:1. 帕潘立酮杂质H 或称帕潘立酮Z-肟(Paliperidone Z-Oxime),CAS号为1388021-47-3,这是帕潘立酮的一个已知工艺杂质或降解产物,需要在质量控制过程中严格监控,确保药品符合安全和质量标准。2. 另一种提及的杂质是6'7'8'9-脱氢帕潘立酮盐酸盐(6,7,8,9-Dehydro Paliperidone Hydrochloride),这是一种帕潘立酮的代谢产物或降解产物,分子式为C23H23FN4O3.2 HCl,分子量为422.46,CAS号为170359-61-2。杂质的存在可能会影响药物的安全性和有效性,因此在药品生产和质控阶段,药企会通过严格的检测方法对杂质进行定量和定性分析,确保药品质量达标。对于患者而言,使用杂质含量低、纯度高的药品有助于减少不良反应的发生风险。[font=-apple-system, BlinkMacSystemFont, &][back=#fdfdfe]CATO标准品提供[font=-apple-system, BlinkMacSystemFont, &]帕潘立酮杂质的研究,需要采用先进的分离技术和检测手段来检测和鉴定杂质的种类和含量。同时,也需要加强生产过程中的管理和监督,确保产品质量和安全。[/font][/back][/font]
执业药师考试《药物分析》模拟试题及答案来源:东方教育 讨论:考试社区 一、A型题(最佳选择题)每题1分。每题的备选答案中只有一个最佳答案。1. 用于原料药或成药中主药含量测定的分析方法验证不需要考虑A. 定量限和检测限 B. 精密度 C. 选择性 D. 耐用性 E. 线性与范围2. 回收率属于药物分析方法验证指标中的A. 精密度 B. 准确度 C. 检测限 D. 定量限 E. 线性与范围3. 方法误差属A. 偶然误差 B. 不可定误差 C. 随机误差 D. 相对偏差 E. 系统误差4. 0.119与9.678相乘结果为A. 1.15 B. 1.1516 C. 1.1517 D. 1.152 E. 1.1515. 鉴别是A. 判断药物的纯度 B. 判断已知药物的真伪 C. 判断药物的均一性 D. 判断药物的有效性 E. 确证未知药物6. 取样要求:当样品数为x时,一般应按A. x≤300时,按x的1/30取样 B. x≤300时,按x的1/10取样 C. x≤3时,只取1件 D. x≤3时,每件取样 E. x>300件时,随便取样7. 中国药典主要由哪几部分内容组成A. 正文、含量测定、索引 B. 凡例、制剂、原料 C. 凡例、正文、附录、索引 D. 前言、正文、附录E. 鉴别、检查、含量测定8. 对药典中所用名词(例:试药,计量单位,溶解度,贮藏,温度等)作出解释的属药典哪一部分内容A. 附录 B. 凡例 C. 制剂通则 D. 正文 E. 一般试验9. 日本药局方与USP的正文内容均不包括A. 作用与用途 B. 性状 C. 参与标准 D. 贮藏 E. 确认试验10. 药典所指的“精密称定”,系指称取重量应准确至所取重量的A. 百分之一 B. 千分之一 C. 万分之一 D. 十万分之一 E. 百万分之一11. 中国药典规定,称取“2.00g”系指A. 称取重量可为1.5~2.5g B. 称取重量可为1.95~2.05g C. 称取重量可为1.995~2.005g D. 称取重量可为1.9995~2.0005g E. 称取重量可为1~3g12. 药典规定取用量为“约”若干时,系指取用量不得超过规定量的A.±0.1% B.±1% C.±5% D.±10% E.±2%13. 原料药含量百分数如未规定上限,系指不超过A. 100.1% B. 101.0% C. 100.0% D. 100% E. 110.0%14. 药品质量标准的基本内容包括A. 凡例、注释、附录、用法与用途 B. 正文、索引、附录 C. 取样、鉴别、检查、含量测定 D. 凡例、正文、附录 E. 性状、鉴别、检查、含量测定、贮藏15. 原料药物分析方法的选择性应考虑下列哪些物质的干扰A. 体内内源性杂质 B. 内标物 C. 辅料 D. 合成原料、中间体 E. 同时服用的药物16. 药典规定“按干燥品(或无水物,或无溶剂)计算”是指A. 取经干燥的供试品进行试验 B. 取除去溶剂的供试品进行试验 C. 取经过干燥失重的供试品进行试验 D. 取供试品的无水物进行试验 E. 取未经干燥的供试品进行试验,再根据测得的干燥失重在计算时从取样量中的扣除
一、概述 保证药品安全、有效、质量可控是药品研发和评价应遵循的基本原则,其中,对药品进行质量控制是保证药品安全有效的基础和前提。为达到控制质量的目的,需要多角度、多层面来控制药品质量,也就是说要对药物进行多个项目测试,来全面考察药品质量。一般地,每一测试项目可选用不同的分析方法,为使测试结果准确、可靠,必须对所采用的分析方法的科学性、准确性和可行性进行验证,以充分表明分析方法符合测试项目的目的和要求,这就是通常所说的对方法进行验证。 方法验证的目的是判断采用的分析方法是否科学、合理,是否能有效控制药品的内在质量。从本质上讲,方法验证就是根据检测项目的要求,预先设置一定的验证内容,并通过设计合理的试验来验证所采用的分析方法能否符合检测项目的要求。 方法验证在分析方法建立过程中具有重要的作用,并成为质量研究和质量控制的组成部分。只有经过验证的分析方法才能用于控制药品质量,因此方法验证是制订质量标准的基础。方法验证是药物研究过程中的重要内容。 本指导原则重点探讨方法验证的本质,将分析方法验证的要求与所要达到的目的结合起来进行系统和规律性的阐述,重点阐述如何科学合理地进行论证方案的设计。 本指导原则主要包括方法验证的一般原则、方法验证涉及的三个主要方面、方法验证的具体内容、对方法验证的评价等内容。 本原则与其他相关技术指导原则一起构成较完整的质量控制指导原则。 随着我国新药研发水平的不断提高,对方法验证的认识也会不断深入,本指导原则将会逐步完善和修订。 由于生物制品和中药的特殊性,本原则主要适用于化学药品。
药物分析的基础知识 第一节 药品检验工作的基本程序 一般为取样、鉴别、检查、含量测定、写出报告。 取样: 鉴别:判断真伪。 检查:称纯度检查,判定药物优劣。 含量测定:测定药物中有效成分的含量。 检验报告必须明确、肯定、有依据。 计量仪器认证要求:县级以上人民政府计量行政部门负责进行监督检查。符合经济合理、就地就近。 第二节 药品质量标准分析方法验证 目的是证明采用的方法适合于相应的检测要求。 验证内容:准确度、精密度(包括重复性、中间精密度和重现性)、专属性、检测限、定量限、线性、范围和耐用性。 一、准确度: 是指用该方法测定的结果与真实值或参考值接近的程度,一般以百分回收率表示。 至少用9次测定结果进行评价。 二、精密度: 是指在规定的条件下,同一个均匀样品,经过多次取样测定所得结果之间的接近程度。 用偏差、标准偏差或相对标准偏差表示。 1、 重复2、 性:相同3、 条件下,4、 一个分析人员测定所得结果的精密度称为重复5、 性。至少9次。 6、 中间精密度:同7、 一个实验室,8、 不同9、 时间不同10、 分析人员用不同11、 设备12、 测定结果的精密度。 3、重现性:不同实验室,不同分析人员测定结果的精密度。分析方法被法定标准采用应进行重现性试验。 三、专属性:指在其他成分可能存在的情况下,采用的方法能准确测定出被测物的特性,用于复杂样品分析时相互干扰的程度。鉴别反应、杂质检查、含量测定方法,圴应考察专属性。 四、检测限:指试样中被测物能被检测出的最低量,无须定量。用百分数、ppm或ppb表示。 五、定量限:指样品中被测物能被定量测定的最低量,测定结果应具一定的精密度和准确度。 六、线性:系指在设计的范围内,测试结果与试样中被测物浓度直接呈正比关系的程度。 七、范围:能达到一定的精密度、准确度和线性的条件下,测试方法适用的高低限浓度或量的区间。 八、耐用性:指在一定的测定条件稍有变动时,测定结果不受影响的承受程度。
了解不同时间药物在血浆或血清中的浓度,对于计算一种药物的代谢动力学很有必要;反之,药物动力学也是药物吸收、分布、代谢和排泄过程的一部分。准确了解药物在体内吸收、分布、代谢和排泄的规律,便于精确地计算所需药物剂量,既能保持有效的药物浓度,同时避免用药过量致毒。预先对多屏深孔Solvinert(MultiScreen Deep Well Solvinert )和多屏Solvinert滤板进行了验证,进行血浆或血清中蛋白质的板内沉淀,以便展开总药物分析。在滤板上可以快速、细致并完整地转移滤液,这样就可以在进行总药物分析之前为样品制备提供一个自动化兼容的平台。Solvinert滤板过滤的滤液中不含蛋白质,这与质谱分析法和紫外线分析法的结果一致。使用多屏深孔和多屏Solvinert滤板可产生有复验性的结果,它是一个稳定且可靠的平台。血清中的蛋白质被这些滤板过滤并沉淀之后,得到的样本中基本上不含蛋白质,回收率很高,便于萃取。药物动力学特性可以让新药开发商更了解药物的有效性和安全性,而这在新药的注册审批中是必要的。为了更好地了解候选药物的代谢动力,金斯瑞( GenScript)建议用动物来做药物分布及其代谢的研究,分析在不同时间段、不同组织或血清中,药物及其代谢物的情况。金斯瑞进行精确的药物和药物代谢动力学研究,涉及两个主要方面:药物分布及其代谢动力研究和抗体药物的代谢动力研究。群体药代动力学研究的是个体之间药物浓度变异来源及其相关性,这些个体是指按临床上相关剂量接受候选药物的目标患者人群。患者的某些人口统计学特征、病理生理特征以及治疗方面的特征,比如体重、排泄和代谢功能、以及接受其他治疗,都能够有规律地改变药物剂量-浓度关系。例如,主要由肾脏排除的药物,在接受同样剂量的情况下,在肾功能衰竭患者体内的稳态浓度,通常高于肾功能正常的患者体内的稳态浓度。群体药代动力学的研究目的就是找出那些使剂量-浓度关系发生变化的、可测定的病理生理因素,确定剂量-浓度关系变化的程度,当这些变化与临床上有意义的治疗指数改变相关的情况下,能够恰当地调整剂量。在药品开发中使用群体PK方法,使获得完整的药代动力学资料有了可能,不但能从来自研究受试者的相对稀疏的数据中获取资料,而且还能从相对密集的数据或从稀疏数据和密集数据的组合中获取资料。群体PK方法能够分析来自各种不均衡设计的数据,也能分析因为不能按常用的药代动力学分析方式分析而通常被排除的研究数据,比如从儿科患者和老年患者获取的浓度数据,或在评价剂量或浓度与疗效或安全性之间的关系时所获取的数据。传统药代动力学研究的受试者通常是健康的志愿者或特别挑选的患者,一组成员的平均情况(即平均血浆浓度-时间曲线)一直是关注的主要焦点。许多研究将个体之间药代动力学的变异作为一个需要降到最低的因素进行观察,通常是通过复杂的研究设计和对照方案,或通过有严格限制的入选标准/排除标准,将其降到最低。事实上,这些资料对在临床应用期间可能会出现的变异至关重要,但是却被这些限制所掩盖。而且,传统药代动力学研究只关注单个变量(例如肾功能)的作法,还使其难以研究变量之间的交互作用。
国家药监局有个检测13种降糖类药物的标准,包括格列本脲、丁二胍等等,绝大多数组分是微溶或难溶于甲醇,基本不溶于水。而标准是用甲醇来溶解。有人做过吗,标准品的溶解是如何解决的?
包括很多内容:体内药物分析方法的设计与评价,理化分析,方法认证认可,药物鉴别,制定标准原则[url=https://insevent.instrument.com.cn/t/Mp]气相色谱仪[/url]器故障的诊断与排除药物质量标准,药典,样品前处理与测定方法离子阱动画,离子阱演示,[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]气质联用[/color][/url]培训班讲义,药物仪器分析方法的应用与展望,质谱分析法幻灯片有需要的到我的资料库去下栽啊!认证会员免积分下载!
第一章 药物分析的基础知识第一节 药品的质量标准掌握药品质量标准的定义、主要内容和制订的原则。 一、药品质量标准的制订 药品(质量)标准是国家对药品质量、及检验方法所作的技术规定,是药品生产、经营、使用、检验和药品监督管理部门共同遵循的法定依据。我国现行的药品标准有:国家药典(中国药典)、局标准(国家食品药品监管局药品标准)。制订药品质量标准应遵循的原则:1、必须坚持质量第一的原则。2、制订质量标准要有针对性。3、检验方法的选择应根据“准确,灵敏,简便,快速”的原则。4、质量标准中限度的规定,即保证质量和符合生产实际来制订。 总之要体现“安全有效,技术先进,经济合理”的方针。二、药品质量标准的主要内容:(一)名称1、质量标准中药品的名称包括中文和英文名称,中文是按照CADN命名原则命名的;英文名称原则上按照INN命名原则确定英文名或拉丁文名,再译成中文正式品名。药品名称应明确、简短、发音清晰,全名最好不超过4个音节或四个字母。2、对属于某一相同药效的药物命名,应采用该类药物的词干。3.避免采用给患者以暗示的有关药理学、解剖学、生理学、病理学或治疗学的药品名称,并不得用代号命名。(二)性状1.外观、臭、味:具有鉴别意义,在一定程度上反映药物内在质量2.溶解性:药物重要物理性质,在质量标准中用术语表示,药典凡例对术语有明确规定。3.物理常数:熔点、沸点、比旋度、折光率、粘度等(三)鉴别利用药物分子结构表现出来的特殊化学行为或光谱特征,是鉴别药物真伪的重要依据。鉴别方法有物理方法、化学方法和生物学方法等。(四)检查包括有效性、均一性、纯度要求和安全性四个方面内容。1.有效性检查指和疗效相关,但在鉴别、纯度检查和含量测定中不能有效控制的项目。2.均一性主要是检查制剂的均匀程度。3.纯度要求是对药物中的杂质进行检查,一般为限量检查,不需要测定其含量。(五)含量测定用规定方法测定药物中有效成分的含量,常用方法有化学分析法、仪器分析法、生物学方法和酶化学方法等。使用化学分析法、仪器分析法测定称为“含量测定”,结果一般用含量百分率(%)表示。使用生物学方法和酶化学方法测定称为“效价测定”,结果一般用效价(国际单位IU)表示。
为什么要进行样品前处理?1、富集浓缩被测痕量组分(ppm,ppb, ppt 级)的作用,提高方法的灵敏度,降低最小检测限。2、消除基体对测定的干扰,提高方法的选择性3、使被测组分从复杂的样品中分离出来,制成便于测定的溶液形式4、通过衍生化的前处理方法,可以使一些在正常检测器上没有响应或响应值较低的化合物转化为具有很高效应值的化合物。5、样品经前处理后就变得容易保存和运输6、可以除去对仪器或分析系统有害的物质,如强酸或强碱性物质,如生物大分子等,延长仪器使用寿命,使分析测定能长期保持在稳定、可靠的状态下进行。有哪些要求?1.样品是否要预处理,如何进行预处理,采样何种方法,应根据样品的性状、检验的要求和所用分析仪器的性能第方面加以考虑。 2.应尽量不用或少使用预处理,以便减少操作步骤,加快分析速度,也可减少预处理过程中带来的不利影响,如引入污染、待测物损失等。3.分解法处理样品时,分解必须完全,不能造成被测组分的损失,待测组分的回收率应足够高。4.样品不能被污染,不能引入待测组分和干扰测定的物质。5.试剂的消耗应尽可能少,方法简便易行,速度快,对环境和人员污染少。食品样品前处理 样品前处理为食品检验的关键步骤,直接影响分析结果的精密度和准确度,选择合适的前处理方法,缩短样品的前处理时间,是在保证检验质量的同时提高检验效率的一个重要方法。本文主要针对食品中重金属检测前的前处理方法进行总结。分析了四种方法在食品金属检验中的应用和注意事项,为食品检验工作者选取合适的样品前处理方法提供一定的参考。1、湿消化法 湿消化法是在适量的食品样品中,加入氧化性强酸,加热破坏有机物,使待测的无机成分释放出来,形成不挥发的无机化合物,以便进行分析测定。湿法消化是目前应用比较广泛的一种食品样品前处理方法,该方法实用性强,几乎所有的食品都可以用该方法消化。 在实验过程中,只要控制好消化温度,大部分元素一般很少或几乎没有损失。例如,在测定酱油中的砷含量时采用湿法消化加入了硝酸高氯酸混合酸和硫酸,加标回收率为95%以上。即便像“汞”等极易挥发的元素,只要正确掌握消化温度,也不会有损失。 但是湿消化法也有一定的缺陷:样品氧化时间较长,且实验过程中一次不能消化超过10个样品。其次,样品消化时常使用的试剂硝酸、高氯酸、过氧化氢,硫酸都是具有腐蚀性且比较危险的。由于氧化反应过程中加入了浓酸,这些酸可能会对仪器产生损害进而影响试验结果,因此消解结束后需要排酸。2、干法灰化法 干法灰化具有操作简单,并且可以一次处理大批量样品的优点。但是干法灰化也有其局限性,首先,由于灰化温度比较高,一般都在500摄氏度左右,可能会有部分元素因为蒸发而损失掉,从而导致元素的部分损失。其次,实验过程比较长,样品碳化时间需要1个小时左右,灰化时间在4-6小时之间,中途如果灰化效果不好还需要加入助灰化剂。3、微波消解法 微波消解是指利用微波的穿透性和激活反应能力,使样品温度升高,同时采用密封装置,在加入一定量的酸溶液,达到使样品中有机物质分解的目的。 消化时间短,比传统的加热方式既快速又效率高,消化时间只需数十分钟,大大提高了反应速率,缩短样品制备的时间,与此同时微波消解还可以控制反应条件,使制样精度更高; 微波消化是在密闭容器内进行,易挥发元素损失少,回收率高,耗酸量减少(3-5ml),空白值大为降低,从而挺高了结果的准确性。最值得注意的是由于使用的是微波加热,实验过程中要防止微波的泄露。4、酸提取法 酸提取是指选用某种酸将样品中的待测元素提取出来。与上面三种方法不同的是,这种方法并没有破样品里的有机物质,而是直接用酸提取,因此该方法具有速度快、操作简便的优点 同时由于该方法不需要加热,因此也就避免了待测元素的损失。 总的来说,湿消化法为经典的消化方法,灰化法耗时长,且易引起待测元素的污染和损失,微波消解法具有待测元素不易损失的优点,但是处理成本较高,同时应注意操作安全。酸提取法直接进样技术具有操作简便、速度快、不污染环境、避免被测元素的挥发损失等优点,但只能应用于部分分析技术,食品检验工作者可以根据样品种类和实验室条件综合考虑采用何种前处理方法。生物样品分析前处理 生物样品的前处理涉及很多方面,但主要应考虑生物样品的种类,被测定药物的性质和测定方法三个方面的问题。1.样品的分离、纯化技术应该依据生物样品的类型。例如,血浆或血清需除蛋白,使药物从蛋白结合物中释出;唾液样品则主要采用离心沉淀除去粘蛋白;尿液样品常采用酸或酶水解使药物从缀合物中释出,当原型药物排泄在尿中时,可简单地用水稀释一定倍数后进行测定。2.样品于测定前是否需要纯化以及纯化到什么程度均与其后采用的测定方法的不同而不同。一般说来,放射免疫测定法由于具有较高的灵敏度和选择性,因此当初步除去主要干扰物质之后即可直接测定微量样品;而对灵敏度和专属性较差的紫外分光光度法,分离要求就要相应高一些;至于常用的高效液相色谱法,为防止蛋白质等杂质沉积在色谱柱上,上柱前需对生物样品进行去蛋白,有时对被测组分进行提取、制备衍生物等前处理。药物分析中样品前处理 根据被测定药物的结构、理化及药理性质、存在形式、浓度范围等,采取相应的前处理方法。药物在样品中的浓度相差很大,浓度大的样品,对前处理要求可稍低;浓度越低则样品前处理要求越高。在测定药物及其代谢物时,样品的前处理是十分重要的。除了少数情况,将体液经简单处理后进行直接测定外,一般要在测定之前进行样品的前处理,即进行分离、纯化、浓集,必要时还需对待测组分进行化学衍生化,从而为测定创造良好的条件。1.GC中化学衍生化法:药物的化学衍生化前处理对GC十分必要,衍生化可使药物分子中的极性基团,如羟基、氨基、羧基等变成无极性的、易于挥发的药物,从而使GC的温度不必很高即可适合GC的分析要求。主要的衍生化反应有烷基化、酰化、硅烷化等。其中已硅烷化用得最广泛。 异构体的分离也是十分重要的。分离光学异构体的方法之一,就是采用不对称试剂,使其生成非对映异构体衍生物,然后用GC法或HPLC法进行分析测定。2.HPLC中化学衍生化法:当采用HPLC法时,其衍生化目的是为了提高药物的检测灵敏度。一些在紫外、可见光区没有吸收或者摩尔吸收系数小的药物,可以使其与衍生成对可见-紫外检测器、荧光检测器及电化学检测器等具有高灵敏度的衍生物。、环境样品前处理 在现代环境检测和分析领域中,各种现代化分析仪器和测试手段的不断更新,使得环境样品的分析检测已经可以做到即时、在线、灵敏地分析痕量的多种环境样本,这充分得益于环境样品前处理技术的快速发展。样品采集及预处理一直是制约环境化学发展的瓶颈。传统的前处理方法存在耗时长、精密度及重现性差、难于自动化、智能化,并且大量使用有毒溶剂等不利因素。环境化学工作者经过不懈的探索和努力,改进并创新了一系列的环境样品预处理技术,这些方法有不同的适用范围,有各自不同的应用和发展前景。本文主要介绍具有代表性的吹扫捕集、加速溶剂萃取等现已应用较多的现代环境前处理方法。1、吹扫捕集(PT) 吹扫捕集技术的主要优点是不使用有机溶剂,不污染环境,操作简便,取样少,富集效率高,适合于大多数挥发性和半挥发性有机物的分离富集。 吹扫
药物是预防、治疗、诊断疾病和帮助机体恢复正常机能的物质。药品质量的优劣直接影响到药品的安全性和有效性,关系到用药者的健康与生命安危。虽然药品也属于商品,但由于其特殊性,对它的质量控制远较其他商品严格。因此,必须运用各种有效手段,包括物理、化学、物理化学、生物学以及微生物学的方法,通过各个环节全面保证、控制与提高药品的质量。传统的药物分析,大多是应用化学方法分析药物分子,控制药品质量。在80年代以前,容量分析法在药物分析方法中一直占有主导和统治地位。然而,现代药物分析无论是分析领域,还是分析技术都已经大大拓展。从静态发展到动态分析,从体外发展到体内分析,从品质分析发展到生物活性分析,从单一技术发展到联用技术,从小样本分析发展到高通量分析,从人工分析发展到计算机辅助分析。可以说,哪里有药物,哪里就有药物分析。随着科学技术的发展,药物分析新技术在不断涌现,以求满足药物科学发展的需要。如手性色谱学、高效毛细管电泳、色谱与光谱联用、色谱与质谱联用(LC/MS)、色谱与核磁共振谱联用技术(LC/NMR)、近红外光谱以及计算机辅助药物分析,使药物分析方法向自动化、智能化和微量化发展。其中毛细管电泳法是一种将电泳技术与色谱技术相结合的新型分离分析方法,可以分离、分析从离子到中性分子,从小分子到大分子的各种化合物,具有分离效率高、速度快及分析仪器自动化程度高等特点。毛细管电泳法可用于多种药物分离、手性药物拆分和血药浓度测定等。药物分析联用技术如LC/MS,LC/NMR 等,将色谱的高分离性能与NMR、MS强大的结构确证能力相结合,具有快速、灵敏和高通量的特点。LC/MS 已成为药物分析、药物体内外代谢研究、药物及其代谢物的高通量分析、药物杂质和降解物的鉴别、手性杂质分析等方面,应用最广泛和最有价值的技术之一。LC/NMR也已用于药物杂质、反应混合物、降解产物、天然产物、体内体外代谢物的分离与结构分析。以上可以看出,我国药物分析方法虽然已有了长足的进步,但是与国外相比还有一定的差距。药物分析要发展,就必须重视新仪器、新技术、新方法的研究和开发,提高药物分析工作者的素质,以缩短与世界先进水平的差距。随着电子技术和计算机技术的发展,药品质量控制方法的种类不断推陈出新、数量日益增长,药物分析技术势必向微量、灵敏、准确、简便、快速、自动化的方向发展
小妹急需美国食品中药物残留最大限量标准,谁有啊,发一份给我吧万分感谢万分感谢!!!!!
薄层色谱(TLC)法,系将供试品溶液点样于薄层板上,经展开,检视所得的色谱图与适宜的对照物按同法所得的色谱图作对比,用于药品的鉴别或杂质检查的方法。TLC法是一种快 速、灵敏、高效地分离微量物质的方法,是最简单的色谱技术之一,具有操作方便,设备简单,分离效率高,专属性好,分析速度快,色谱参数易调整等特点,在药物分析中应用较为广泛。 1 用于药品真伪鉴别 1.1 化学药品及其复方制剂 TLC法用于阿片类药物及其代谢产物的检测,以硅胶为吸附剂,以乙酸乙酯-甲醇-氨水(85 : 10 : 5)和甲醇-氨水(100 : 1.5)为展开剂,显色方法为254nm紫外灯、碘化钾试剂、酸性碘铂酸钾试剂、碘蒸气等。通过选择适当的薄层板、展开剂、显色剂,与标准对照品比较比移值(Rf)和斑点大小,可初步确定阿片类药物的种类。复方降压胶囊中,组成成分近十余种,TLC法可同时鉴别处方中利血平、利眠宁和盐酸异丙嗪3种成分,取3种对照品及供试品制成溶液,分别点于硅胶GF254板上,以苯-丙酮(3 : 2)为展开剂,展开后,晾干,置254nm紫外光灯下检视,供试品与对照品 3个斑点位置一致,Rf值适中,斑点明显。薄层色谱中展开剂应尽量不使用毒性很大的溶剂,苯毒性较大,有致癌作用。因此,不是十分必要,尽量用其它溶剂代替。此方法展开剂中的苯,如能以其它溶剂替代则更好。采用薄层色谱法在同一薄层板上对抗结核类药物中的四种主要成分利福平、异烟肼、盐酸乙胺丁醇、吡嗪酰胺进行快速分离鉴别,使用硅胶GF254板,以甲醇-水-浓氨水(30 : 1 : 0.3)为展开剂,点样量为2μl,展开晾干后,先在紫外灯(254nm)下检视,可见利福平、异烟肼、吡嗪酰胺三个斑点,再进行碘熏蒸,可见利福平、异烟肼、盐酸乙胺丁醇三个斑点,Rf值适中,分离效果和重现性好。 1.2 抗生素及其制剂 麦迪霉素片原标准TLC法操作中受温度影响较大,所需硅胶H板较为特殊,显色剂配制繁琐,有研究通过试验,改吸附剂为硅胶GF254,在室温下展开即可,样品展开后,置紫外光灯254nm下检视,供试液所显斑点的位置与颜色和对照液所显斑点的位置与颜色相同,Rf值为0.5,斑点清晰,无拖尾现象,且灵敏度高,分离效果好。 1.3 中药材 采用TLC法鉴别牡丹皮及其伪品芍药根皮,取牡丹皮、芍药根皮粉各1g,用乙醚提取后挥发,残渣加丙酮溶解,作为供试液;另取丹皮酚、芍药苷分别加丙酮溶解制成对照液,分别点于同一硅胶G板上,以环己烷-乙酸乙酯(3 : 1)为展开剂,展开后,晾干,喷以2%三氯化铁乙醇溶液,牡丹皮供试液与丹皮酚对照液位置上显相同的紫色斑点,芍药根皮供试液与芍药苷对照液相应的位置上显相同的蓝色斑点。 1.4 中成药及其复方制剂 采用TLC鉴别方法,对益康胶囊方中组成药物人参、黄芪、何首乌、丹参及甲基橙皮苷进行鉴别,结果斑点清晰,分离效果好,专属性强,阳性对照无干扰。破壁灵芝孢子粉胶囊的TLC鉴别方法,通过对集中提取及展开系统的比较,发现最佳方法,对破壁灵芝孢子粉的鉴别选择GF254板,用石油醚(60~90℃)-甲酸乙酯-甲酸(15 : 5 : 1)的上层溶液为展开剂,结果鉴别效果好,能很好地把破壁灵芝孢子粉和灵芝区别开来。 1.5 基层药品快速检验 大环内酯类抗生素主要是十四元环和十六元环,其中十四元环大环内酯类抗生素结构相近,以红霉素、琥乙红霉素、阿齐霉素、克拉霉素及罗红霉素为代表,这一大环内酯类抗生素的鉴别方法主要是颜色反应和TLC鉴别,已有的TLC鉴别方法由于展开系统复杂,对环境要求高,难于在基层药品快速检验中推广应用。有研究建立了一种简单的薄层色谱系统,用于十四元环大环内酯类抗生素快速鉴别,采用硅胶GF254板,以醋酸乙酯-正己烷-氨水(10 : 1.5 : 1.5)为展开剂,碘蒸气中显色,通过对全国30家生产企业的样品分析,方法的Rf值适中,且实验室重现性好,所建立的方法适宜于基层现场快速鉴别。此外,TLC法作为一种快速鉴别方法被配备在药品检测车上,在基层药品现场打假中发挥着重要作用。 2 用于药品中杂质检查 有关物质检查通常采用色谱法,可根据有关物质的性质选用专属性好,灵敏度高的薄层色谱、高效液相色谱(HPLC)及[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url](GC)法。薄层色谱法设备简单,操作简便,但因影响重现性和精密度的因素较多,可用作一般有关物质检查。采用反相薄层色谱法,建立了阿德福韦酯有关物质检查法。以反相高效F254薄层板(HPTLC RP18F254)为吸附剂,以甲醇-水(3:1)为展开剂,在紫外光灯254nm下检视,阿德福韦酯与其有关物质的分离状况良好,检测灵敏度高,最小检测限为0.1μg。采用薄层色谱法,建立了雌三醇栓中有关物质的检查方法,以硅胶G板为吸附剂,以氯仿-甲醇-丙酮-冰醋酸(9:0.5 :0.5 :0.5)为展开剂,展开后,晾干,喷以30%硫酸乙醇液,在100℃加热至斑点清晰。结果3种有关物质与原药完全分离,Rf值适中,最低检出量为0.2μg,且重复性好。采用薄层色谱法检查复方氨酚烷胺颗粒中的有关物质(对氯苯乙酰胺),使用0.5%羧甲基纤维素钠(CMC) GF254硅胶板,以氯仿-丙酮-甲苯(13 : 5 : 2)为展开剂,紫外光灯254nm下检视,结果检出对氯苯乙酰胺杂质斑点与其它主药成分斑点分离良好,空白样品溶液的斑点对杂质斑点无干扰,重现性好,Rf值适中,能有效检出有关物质。 3 用于中药指纹图谱分析 中药指纹图谱在有效反映中药成分的复杂性,表征中药质量的宏观综合方面,有其特殊价值,中药指纹图谱作为中药质量标准的一个方面,可广泛用于鉴别样品的真伪或产地,有效成分的研究等方面。色谱法是中药指纹图谱的主流方法,主要有GC、HPLC、TLC法。TLC法因其便宜、快速、开放性、灵活性等特点,被用于中药指纹图谱分析中。 3.1 中药薄层图像指纹图谱 TLC一大优势是提供直观形象的可见光或荧光图像,特征图像非常直观,专属性好,判断速度快,非常适合基层日常分析与现场检验使用。广藿香主要含萜类、黄酮类、醇、酸、铜、醛类等化合物,广藿香不同提取部位具有不同的药物效应。3.2 薄层扫描指纹图谱 薄层扫描仪具有原位扫描功能,通过测量薄层色谱Rf值,原位紫外-可见吸收光谱,结合板上化学特征反应形成薄层扫描中药指纹图谱。使用薄层扫描法测定不同品种和产地的甘草并建立了指纹图谱,可以快速地对药材品质作出判断,有效地控制甘草的质量。4 结语 薄层色谱法作为最简便的色谱技术,不仅被广泛应用于药物分析中的鉴别和杂质检查,因其专属性好,分析速度快,设备简单,操作方便等特点,且被用于基层快检,大大提高了药品抽样阳性率。随着现代薄层色谱技术的发展,在每一个环节都实现了自动化,部分弥补了其重现性与分辨率的不足,使得薄层色谱在中药指纹图谱及手性药物拆分等方面的研究倍受关注,对薄层色谱技术研究的领域也将更加广阔。
前言:GC[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url] 进样口衬管是进样口系统的核心部件,样品在其中汽化,与载气混合并且进入毛细管色谱柱。由于玻璃毛能促进样品均匀混合和更好的定量,因此带玻璃毛的进样口衬管得到了广泛使用。玻璃毛提供了较大的表面积有助于液体样品的汽化。它也可以作为一个捕集阱,捕集样本中的非挥发性残留物,从而保护[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff] GC [/color][/url]色谱柱不受样品基质产生的负面影响。玻璃毛衬管也防止样品在汽化前触及进样口底部从而减少样品的损失。安捷伦 MS 认证的带玻璃毛衬管能够提供满足一般应用要求的优良性能。然而,对于活性化合物分析的特殊应用,要得到可靠的结果就需要使用具有超高惰性的衬管。GC/MS 筛查方法对毒理学实验室是重要的。随着新药物和毒物不断出现,要进行筛选的目标化合物数以百计。因为这些化合物可使用[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff] GC [/color][/url]分析,采用电子轰击电离(EI)全扫描模式的 GC/MS 非常适合来完成这些分析[1]。为保留目标分析物,筛查样品通常需要最少的样品制备,甚至是没有经过净化的。然而,复杂基质样品,如血浆或尿液提取物,会破坏分析柱和检测器的性能,缩短色谱柱的寿命并导致频繁的 MS 源维护。因此,使用带玻璃毛的进样口衬管有利于保护整个 GC/MS 系统。但是,如果带玻璃毛的衬管去活程度较差,就可能导致对碱性滥用药物中目标分析物的吸附或分解。如图 1 所示,这些药物通常含有杂原子,能与玻璃毛中的自由硅醇基 (Si-OH) 产生强烈相互作用 [2]。由此产生的化合物的吸附和分解将导致色谱问题,如峰展宽或变形,峰拖尾,鬼峰以及响应变低。带玻璃毛衬管由于玻璃毛的大表面积和难以进行*去活会放大这些负面影响。在法医/毒理学应用当中,如需得到准确、重现的理想色谱分离,正确而有效去活的带玻璃毛进样口衬管是必须的。安捷伦超高惰性衬管去活技术极大的提高了玻璃毛去活的效率和耐用性。表面*去活。这是带玻璃毛衬管第一次可以用于GC/MS 分析碱性滥用药物。带玻璃毛衬管采用安捷伦法医/毒理学分析测试标准品进行评估,样品中包括 28 种常见的和复杂的碱性药物化合物。化合物涵盖了各种保留洗脱范围的化合物,并含有不同类别的药物包括安非他命、生物碱和苯丙二嗪。图 1 显示了一些分析物的化学结构。所有衬管测试同时使用GC/MS 扫描和 SIM 进行数据采集。使用 5 微克/毫升的标准品进行色谱评价。使用 500 纳克/毫升的标准品对(10 倍稀释)超过50 次进样的重复性进行评价。[img=11.png]https://img63.chem17.com/9/20220926/637998239834127541110.png[/img]实验部分化学品和试剂安捷伦 GC/MS 法医/毒理学分析测试混合标准品(部件号 5190-0471)用于评估超高惰性带玻璃毛衬管的性能。 HPLC 级甲苯和甲醇购自霍尼韦尔 B&J (Muskegon, MI, USA) ,乙腈 (ACN) 购自Sigma - Aldrich 公司(圣路易斯,密苏里州,美国)。内标物 (IS)购自 AccuStandard(纽黑文, CT, USA),包含 0.5 毫克/毫升苊-D10,菲-D10,三芳烷基磷酸酯, -D12 和 -D12 的丙酮溶液。溶液和标样原始校验标准品是比例为 90/5/5 的甲苯/甲醇/乙腈溶液。该空白混合溶剂由 90 毫升甲苯,5 毫升甲醇和 5 毫升乙腈来制备,并作为试剂空白。5 微克/毫升原始标准品直接进样,并用空白溶剂稀释 10 倍制成 500 纳克/毫升溶液。取 4 微升内标储备溶液加入到 1 毫升的标准品溶液中,如有需要,将样品中的内标浓度制成 2微克/毫升。[img=12.png]https://img66.chem17.com/9/20220926/637998240262989378994.png[/img]使用反吹系统,因为它能缩短含高沸点基质干扰物的分析时间、减少柱头修剪并降低 MSD 源的清洗 [3,4] 频率。仪器配置除了没有保留间隙,类似于图 1 B 中以前的配置 [4]。保留时间锁定 (RTL)是用来消除单个保留时间和如 SIM 基团的定时事件的再校正 [5]。结果与讨论试验的目的是评估使用超高惰性去活带玻璃毛衬管和 GC/MS 筛查分析滥用药物的效果。使用安捷伦法医/毒理学分析测试标准品进行评估(见表 3)。超高惰性带玻璃毛衬管性能由色谱性能、衬管间重复性和多次进样重复性决定。同时,与来自多个来生产商的带玻璃毛衬管进行测试比较。[img=132.png]https://img61.chem17.com/9/20220926/637998240623252129522.png[/img]色谱性能碱性药物化合物的吸附或分解可能会导致各种色谱问题,包括峰展宽、峰变形、峰拖尾、鬼峰以及灵敏度降低。这些问题在使用检测标准品对衬管进行测试的实验中都能出现。早洗脱化合物如MDA 和 MDMA 通常会出现峰形问题。由于灵敏度的降低,晚洗脱化合物如可能消失。图 2 显示了使用类似衬管得到的问题色谱图与用带玻璃毛超高惰性衬管得到的色谱图的对比。如图 2 所示,进样 5 纳克,其他衬管去活导致如峰展宽或峰变形和响应严重降低等色谱问题。而安捷伦超高惰性去活衬管得到的相应色谱图则显示出更好的峰形及更高的响应。图 3 显示了进样 5 纳克测定标准品时,使用安捷伦超高惰性玻璃毛不分流衬管进行的 GC/MS 全色谱图。图 3 表明,带玻璃毛超高惰性衬管为所有测试的分析物提供了色谱分离,即使是某些化合物也出现了小的拖尾峰或展宽。对六个超高惰性衬管进行了重复测试,每个均能提供相似的色谱性能,显示了优异的衬管间重复性。由于超高惰性衬管去活工艺为衬管和玻璃毛提供足够的惰性,因而能获得满意的色谱图,并防止滥用药物的吸附和分解。[img=13.png]https://img62.chem17.com/9/20220926/637998241310533105779.png[/img][align=center][img=14.png]https://img62.chem17.com/9/20220926/637998241664708679657.png[/img][/align]随着样品进样量的增加,响应降低,这样产生了高的进样 RSD。这种现象在所有的测试衬管中都存在,并且其它衬管响应降低的更为明显。当西泮是目标分析物且浓度在 ppb 水平时,强烈推荐使用超高惰性带玻璃毛衬管,且每根衬管的分析不能超过 30 个样品。真正的基质样品分析所有用于 GC/MS 分析的全血提取物由 NMS 实验室 (Willow Grove,PA) 提供。全血样品通过溶液的液/液萃取、蒸发干燥及以 1/10的体积再溶解于甲苯中制成。图 5 显示使用安捷伦超高惰性带玻璃毛衬管的 GC/MS 分析 2 ppm 基质加入样品中的色谱图,对于早洗脱化合物的峰形和晚洗脱化合物的灵敏度能令人满意。有一些来自于基质的小干扰峰出现结论安捷伦超高惰性带玻璃毛衬管对碱性滥用药物的分析表现出了优异的惰性。超高惰性带玻璃毛衬管为选定常见和复杂的碱性药物化合物提供了满意的色谱分析结果。衬管间性能表现出了优异的重复性,这些活性化合物 RF 值的平均 RSD 为 5%。由于玻璃毛的去活效率和耐用性很高,使安捷伦超高惰性带玻璃毛衬管为法医和毒理学筛查提供了惰性。获得了由带玻璃毛衬管提供的诸如均一的样品混合和汽化、非挥发性残留物捕集以及对色谱柱和检测器的保护等优点,而不损害色谱或活性分析物的灵敏度。超高惰性带玻璃毛衬管是用于滥用药物筛查分析的选择。
体内药物分析方法的设计与评价 一、分析方法的设定依据:(一)重视并做好文献总结、整理工作;(二)充分了解待测药物的特性及体内存在状况;(三)明确测定的目的要求;(四)实验室条件。二、方法建立的一般实验步骤:(一)以纯品进行测定:以一定量纯品按拟定方法进行测定。求得浓度与测定响应值之间(如吸收度、色谱峰高或面积等)的关系,浓度线性范围,最适测定浓度,检测灵敏度,测定的最适条件(pH、温度、反应时间)等等。(二)以经过纯化处理过的空白样品进行测定;(三)空白样品添加标准后的测定:血样等样品中添加一定量标准品后进行测定,求得样品回收率数据,检验生物样品对测定有无干扰等。(四) 体内实际样品测定:有时用体外建立的方法去测定体内取得的实样时,会得出错误的结论。故要强调对药物体内过程有一定程度的了解。有时也采用专属性强、已证明适用于体内实样测定的步骤和方法作为对照测定,并以此来检验所建立的方法的实际可行性。三、方法的评价:(一)准确度(Accuracy):测定结果与真值的符合程度。常用回收率(Recovery)数值间接反映测定的准确程度;也可通过与其他已建立的方法进行比较的办法(参比方法)来加以反映。回收率100%当然好,但很难达到。重要的是每次测定要保持稳定。(二)精密度(Precision):测定结果与平均值的偏离程度。测定间偏差越小,对测定的要求也越高(花费大);浓度与RSD值间存在反比关系,RSD在10%以内的方法可认为是可接受的。(三)灵敏度(Sensitivity):“一种方法可以检测出有关化合物的最小量”。常用最低检测限(Limit of detection,LOD)或最低检测量(Limit of quantification;LOQ)来表示。LOD范围在ng(10-9g)~10-18g。(四)专属性或选择性(Specificity or Selectivity):是指测定的信号(响应)是属于被测药物所特有的。若有干扰就需改进测定方法或改用具有分离能力(如色谱法的专属性较吸收光度法为高)的方法或专属性较强的方法进行。(五)不同方法测得结果的相关程度(Degree of correlation)的比较:用一有相当专属性和可靠性的方法与新建方法同量测定,以相关系数γ(Correlation coefficient)表示相关程度。γ一般要求在0。95以上。此外,还应从方法的可靠性、每个样品测定耗时多少、操作的难易及技术要求及仪器、设备要求、费用多少等等方面加以考虑。
一、案例磺胺类药物是一类应用最早的人工合成抗菌药物,能抑制革兰阳性菌及一些阴性菌,可以治疗多种细菌感染,具有抗菌谱广、疗效强等优点。磺胺类药物特别是磺胺嘧啶、磺胺甲基嘧啶、磺胺二甲氧嘧啶、磺胺甲基异嗯唑等作为饲料添加剂或动物疫病治疗药物被广泛应用。然而磺胺类药物在体内作用时间和代谢时间较长,过量使用必会导致磺胺类药物在食用动物产品中的蓄积。食品磺胺类药物残留,可引起过敏、中毒和导致耐药性菌的产生,它还能引起造血系统障碍,发生急性溶血性贫血、粒细胞缺乏症、再生障碍性贫血等。二、选用的标准农业部1025号公告-7—2008动物性食品中磺胺类药物残留检测——酶联免疫吸附法。三、测定方法1.样品的制备与保存取新鲜或解冻的空白或供试动物组织,剪碎,置于组织匀浆机中高速匀浆。取鸡蛋去除壳后用均质器500r/min匀浆20s,使蛋清和蛋黄充分混合。将已制备的样品在-20℃冰箱中储存备用。2.提取称取样品(2.00±0.02)g于50ml离心管中,加乙腈8mL,振荡20min,4000r/min离心5min:分取上清液2.5ml。于10mL离心管中,于50℃水浴下用氮气吹干;加正己烷1mL,涡动20s溶解残留物,再加缓冲液工作液1mL,涡动1min,4000r/min离心10min,取下层水相20μL分析。3.测定①使用前将试剂盒于室温(19~25℃)下放置1~2h。②每个标准溶液和试样溶液按两个或两个以上平行计算,将所需数目的酶标板条插入板架。③加系列标准溶液或试样液20μL于对应的微孔中,随即加酶标记物工作液50μL/孔,再加磺胺类药物抗体工作液80μL/孔,轻轻振荡混匀,用盖板膜盖板,置25℃避光反应60min。④倒出微孔中的液体,将酶标板倒置在吸水纸上拍打,以保证完全除去孔中的液体。再加洗涤工作液250μL/孔,重复操作两遍以上(或用洗板机洗涤)。⑤加底物液A液和B液各50μl/孔,轻轻振荡混匀,用盖板膜盖板,室温下避光反应30min。⑥加终止液50μL/孔,轻轻振荡混匀,置酶标仪于450nm波长处测量吸光度值。4.结果判定和表述用所获得的标准溶液和试样溶液吸光度值的比值进行计算。相对吸光度值(%)=B/B0×100%式中 B一一标准(试样)溶液的吸光度值;B0——空白(浓度为0的标准溶液)的吸光度值。将计算的相对吸光度值(%)对应磺胺类药物标准品浓度(μg/L)的自然对数作半对数坐标系统曲线图,对应的试样浓度可从校正曲线算出。方法筛选结果为阳性的样品,需要用确证的方法进行确证。5.竞争物的交叉反应率见表1。表1竞争物的交叉反应率竞争物交叉反应率/%竞争物交叉反应率,%磺胺二甲嘧啶磺胺二甲氧嘧啶磺胺二甲基嘧啶磺胺嘧啶磺胺甲基异毂唑10023121%1%磺胺噻唑磺胺吡啶磺胺喹彀啉磺胺问甲氧嘧啶1%1%1%6.试剂①乙腈②正已烷③十二水合磷酸氢二钠。④二水合磷酸氢二氢钾。⑤氯化钠。⑥氯化钾⑦磺胺类药物快速检测试剂盒:2~8℃保存。a.系列标准工作溶液:O、1μg/L、3μg/L、9μg/L、27μg/L、81μg/L。b.包被有磺胺类药物偶联抗原的96孔板,12×8孔。c.磺胺类药物抗体工作液。d.酶标记物工作液。e.底物液A液。f.底物液B液。g.终止液。h.20倍浓缩洗涤液。i.20倍浓缩缓冲液。⑧洗涤工作液:用水将20倍浓缩液按1:19的体积比进行稀释(1份20倍浓缩洗涤液+19份水),用于酶标板的洗涤。2~8℃保存,有效期1个月。⑨缓冲工作液:用水将20倍浓缩缓冲液按1:19的体积比进行稀释(1份20倍浓缩洗涤液+19份水),用于酶标板的洗涤。2~8℃保存,有效期1个月。7.仪器①酶标仪(配备有450nm滤光片)。②氮气吹干装置。③均质器。④振荡器。⑤离心机。⑥天平(感量0.01g)。⑦微量移液器(单道20~200/μl、100~1000μL;多道250μL)。
[font=&][size=16px][color=#333333]点击链接查看更多:[url]https://www.woyaoce.cn/service/info-38603.html[/url]服务背景[/color][/size][/font][font=&][color=#333333][/color][/font][size=16px]现行有效的《化妆品安全技术规范》(2015版)明确规定激素类、抗生素类、抗真菌类等药物为化妆品禁用成分,且给出了相应的检测方法。[/size][size=16px]卫生部印发的《消毒产品生产企业卫生规范(2009年版)》第三十条规定:消毒产品禁止使用抗生素、抗真菌药物、激素等物料。2020年12月,国家市监总局和标准化委员会发布《GB 38456-2020 抗菌和抑菌洗剂卫生要求》,该标准将于2021年12月01日正式实施,标准中4 原料要求规定抗抑菌洗剂(液体制剂)产品不得添加药物、生物制剂、列入现行有效的《化妆品安全技术规范》(碘除外)的禁用物质以及其他卫生健康部门规定的禁用物质。[/size][font=&][size=16px][color=#333333]检测内容[/color][/size][/font][font=&][color=#333333][/color][/font]护肤乳液、润肤膏霜、抗(抑)菌膏霜等儿童护理产品相关法规标准,对产品使用的原料测试;筛查产品中的违禁成分,保障产品上市流通及营销的成功率。[font=&][size=16px][color=#333333]检测标准[/color][/size][/font][font=&][color=#333333][/color][/font][table][tr][td]产品名称[/td][td]检测项目[/td][td]检测标准[/td][/tr][tr][td]护肤乳液、润肤膏霜、抗(抑)菌膏霜等儿童护理产品[/td][td]63种激素类成分、41种糖皮质激素、92种糖皮质激素、7种性激素、7种抗生素、9种抗真菌类物质、36种抗感染类药物[/td][td]消毒产品生产企业卫生规范(2009年版)[/td][/tr][tr][td]护肤乳液、润肤膏霜、抗(抑)菌膏霜等儿童护理产品[/td][td]63种激素类成分、41种糖皮质激素、92种糖皮质激素、7种性激素、7种抗生素、9种抗真菌类物质、36种抗感染类药物[/td][td]GB 38456-2020 抗菌和抑菌洗剂卫生要求[/td][/tr][tr][td]护肤乳液、润肤膏霜、抗(抑)菌膏霜等儿童护理产品[/td][td]63种激素类成分、41种糖皮质激素、92种糖皮质激素、7种性激素、7种抗生素、9种抗真菌类物质、36种抗感染类药物[/td][td]消毒产品生产企业卫生规范(2009年版)[/td][/tr][/table][font=&][size=16px][color=#333333]我们的优势[/color][/size][/font][font=&][color=#333333][/color][/font]CTI每年出具约200万份具有公信力的检测认证报告。CTI已服务9万家客户,其中五百强客户近百家。CTI具有60多个分支机构及130多个不同专业领域实验室。CTI目前参与制定国家/行业标准400多项,申请国家专利300余项。CTI具有全球先进的实验室信息管理系统,确保每个服务环节的高效运转。