请问营养液中的乙二胺四乙酸二钠铁是如何配置的啊?我再网上也没有找到。谢谢!
我急切想要一份用硫代硫酸钠滴定法测定乙二胺四乙酸铁钠中铁的方法,能告诉我标准号也行。我记得有这么个方法,可是找了半天也找不到,谢谢各位。
请问检测软水硬度,EDTA标液可以用乙二胺四乙酸代替乙二胺四乙酸二钠使用吗?
[b][color=#444444]请问检测软水硬度,[/color][color=#444444]EDTA[/color][color=#444444]标液可以用乙二胺四乙酸代替乙二胺四乙酸二钠使用吗?[/color][/b]
在食品中加入乙二胺四乙酸二钠有什么用?
用乙二胺四乙酸二钠基准试剂配标准溶液。要不要再加热干燥呢?乙二胺四乙酸二钠热稳定性怎样?
乙二胺四乙酸二钠按照5009.278连标曲都跑不出来,请教一下各位老师这个项目有没有什么特别需要注意的点呢,万分感谢!
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=28256]乙二胺四乙酸铁钠中铁在人体吸收率的研究[/url]
本标准规定了食品添加剂乙二胺四乙酸铁钠的技术要求、试验方法、检验规则、标志、包装、运输和贮存及保质期。
[color=#00008B][size=4][em09508]乙二胺四乙酸钙钠怎么分析其主含量?考虑用络合滴定,想请教下各位经验丰富的老师,又和更好的方法?感激不尽![/size][/color]
采用:生活饮用水标准检验方法 消毒副产物指标 GB/T 5750.10-2006 中AHMT法检测甲醛标准中提到:10.0g乙二胺四乙酸二钠溶于氢氧化钾溶液(5 mol/L),并稀释至100 mL这个要怎么操作?因为氢氧化钾(5 mol/L)的体积没给出。谢谢!PS:替某同行问;个人用乙酰丙酮法,对这个方法不了解。
请问乙二胺四乙酸分析纯能直接配制EDTA标准溶液吗?请如果能配制有方法吗,比如配0.1mol/L的,请各位帮忙,我手里现在只有乙二胺四乙酸分析纯
在配制氨-氯化铵锾冲溶液中所加的乙二胺四乙酸镁二钠盐,测定水样硬度之前,对所用Na2MgY必须进行鉴定,以免对分析结果产生误差。鉴定方法:取一定量的Na2MgY溶于除盐水中,按硬度测定方法测定其中Mg2+或EDTA是否有过剩量,根据分析结果精确地加入EDTA或Mg2+,使溶液中EDTA和Mg2+均无过剩量”。在上面所说的测定Mg2+或EDTA是否有过剩量,是否是说:取一定体积V1的除盐水,测其除盐水的硬度为YD1。按上面所说在同样体积V1的除盐水中加入Na2MgY,测量硬度为YD2。然后根据YD1和YD2硬度比较,所消耗EDTA标准溶液体积变化,来说明Mg2+或EDTA谁多,如果EDTA标准液消耗体积变大,说明Mg2+离子多。我的理解对不对,大家告诉下我好吗。再问下市售的乙二胺四乙酸镁二钠盐中的Mg2+和EDTA含量是不是1:1呀?除
请问哪儿有乙二胺四乙酸四钠镁(Mg-EDTA)
[font=SimSun, STSong, &]我的食品生产许可证上的执行标准是SB/T10439-2007产品分类是酱腌菜产品明细是盐水食用菌,请问的我生产的盐水食用菌允许使用乙二胺四乙酸二钠吗?2760上边按照酱腌菜的标准是允许的,按食用菌制品的标准是不允许使用的,我是应该按照食用菌制品的标准不允许使用呢还是应该按照生产许可证上的酱腌菜标准允许使用呢?有没有专业人士帮忙解答啊?[/font]
问题: 请教下各位,有没有做过乙二胺四乙酸二钠的测定的?[img]http://ng1.17img.cn/bbsfiles/images/2017/06/201706022342_01_3114888_3.jpg[/img]
请问各位大佬为啥会这样。走的是乙二胺四乙酸二钠条件是15:85(甲醇:四丁基溴化铵-乙酸钠混合溶液)等度洗脱其中混合液ph值是4.0 流速0.8 进样量10ul 波长254nm 柱子c18柱250×4.6 mm 5.0um 柱温35[img=,690,517]https://ng1.17img.cn/bbsfiles/images/2023/02/202302211443435195_7256_5517077_3.png[/img]
[color=#444444]沛欧的消化炉和定氮仪用乙二胺四乙酸二钠无法验证,验证回收率只有5%,是怎么回事?[/color]
地下水质检验方法 乙二胺四乙酸二钠-钡滴定法测定硫酸根 DZ/T 0064.64-1993中V1,V2,V3,各自滴定的是什么东西?别这个搞蒙了?求大神指导
地瓜干中的加入二氧化硫和乙二胺四乙酸二钠各起什么作用,为什么要加入这二种物质,其检测方法呢?二氧化硫是为了防腐和增色之用,检测方法GB/T5009.34,那乙二胺四乙酸二钠的作用和检测方法呢
GB5009.278—2016中乙二胺四乙酸二钠标准工作液有两种配制方式,用哪种?
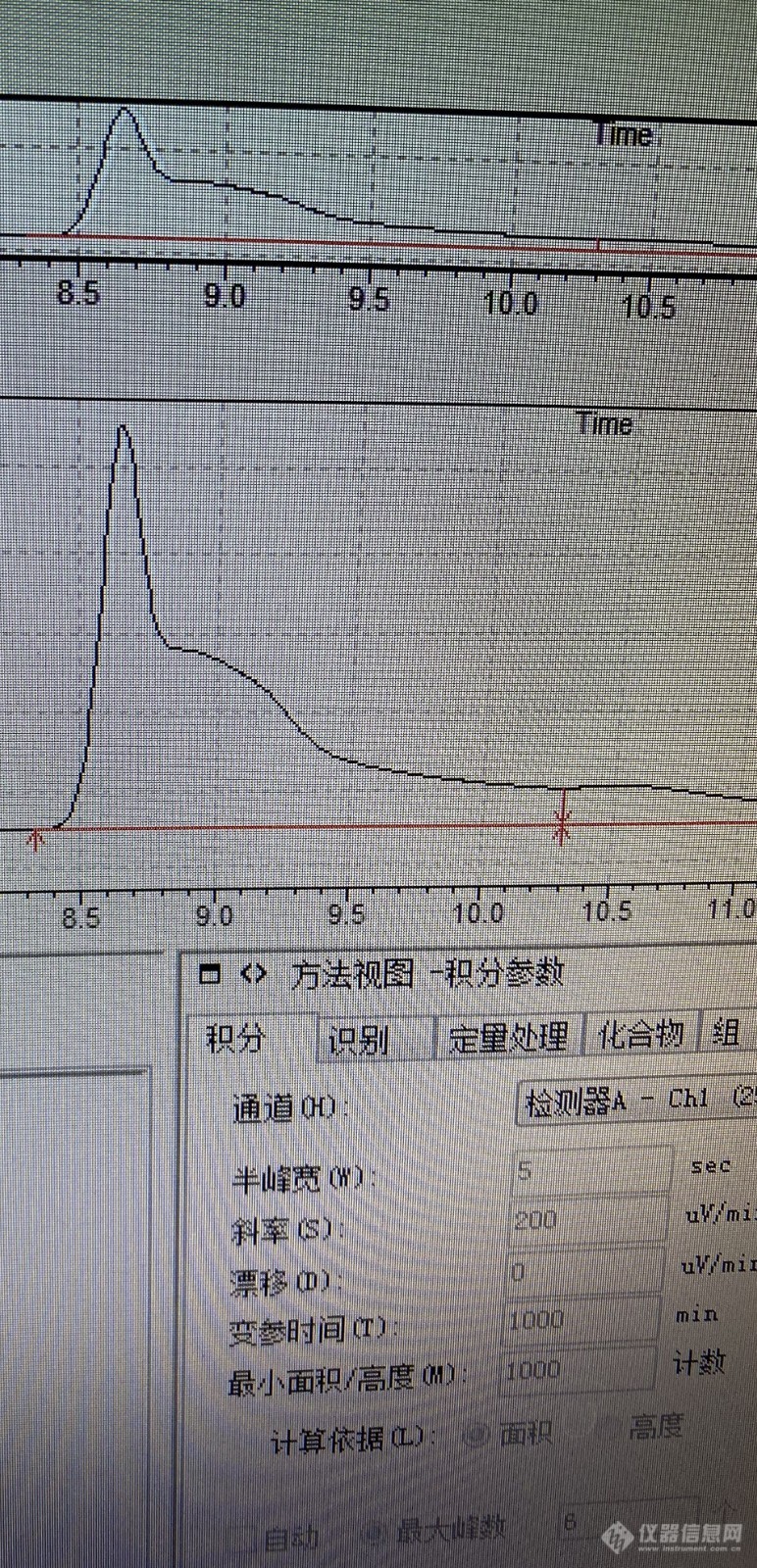
做乙二胺四乙酸二钠钙,标准是[font=Verdana, Arial][size=20px][color=#333333]GB 5009.278-2016 食品安全国家标准 食品中乙二胺四乙酸盐的测定,峰拖尾,如图:[/color][/size][/font][font=Verdana, Arial][color=#333333][size=20px]液相条件:流速:0.8ml/min,流动相:甲醇∶四丁基溴化铵-乙酸钠混合溶液(pH2.5)=15∶85,进样量:10ul[/size][/color][/font][font=Verdana, Arial][size=20px][color=#333333][/color][/size][/font][font=Verdana, Arial][size=20px][color=#333333][img=,690,1430]https://ng1.17img.cn/bbsfiles/images/2021/05/202105270928407755_1345_3983205_3.jpg!w690x1430.jpg[/img][img=,690,1430]https://ng1.17img.cn/bbsfiles/images/2021/05/202105270928407755_1345_3983205_3.jpg!w690x1430.jpg[/img][img=,690,1430]https://ng1.17img.cn/bbsfiles/images/2021/05/202105270928407755_1345_3983205_3.jpg!w690x1430.jpg[/img][img=,690,1430]https://ng1.17img.cn/bbsfiles/images/2021/05/202105270928407755_1345_3983205_3.jpg!w690x1430.jpg[/img][/color][/size][/font]
[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]检测乙二胺四乙酸二钠钙用什么柱子不拖尾?
磷钼蓝分光光度法测定磷酸根含量的抗坏血酸可否用乙二胺四乙酸代替EDTA?
中文名称: 乙二胺四乙酸二钠镁盐 中文别名: EDTA 镁钠盐 英文名称: EDTA magnesium disodium 英文别名: Ethylenediaminetetraacetic acid magnesium disodium salt Magnesium sodium ethylenediaminetetraacetate CAS号: 14402-88-1 分子式: C10H12N2O8MgNa2 分子量: 358.50 产品名称:乙二胺四乙酸镁二钠CAD登记号:14402-88-1英文名:Magnesium disodium ethylenedi amine tetraacetate别名:EDTA镁二钠分子式:C10H12M2O8MgNa2用途:是一种稳定的可溶于水的金属嫠合物,主要作为微营养素,应用于农业,园艺等方面这是我在网上看到的 但不知道是否为同一物质,希望大家不吝赐教
0.78g的硫酸镁和1.179g的乙二胺四乙酸二钠在水中溶合发生反应后,摩尔数是按1:1接合吗?我怎么按质量除以摩尔质量感觉,两个物质的摩尔数不是1:1呀?
一. EDTA的离解平衡在水溶液中,2个羧基 H+转移到氨基N上,形成双极离子:[IMG]http://www.chemcn.org/upload_files/57/20060304091228426.gif[/IMG]EDTA 常用 H4Y 表示,由于其在水及酸中的溶解度很小,常用的为其二钠盐:Na2H2Y2H2O ,也简写为EDTA 。 当溶液的酸度很高时,两个羧基可再接受H+,形成H6Y2+,相当于一个六元酸,有六级离解常数: Ka1=10-0.9 Ka2=10-1.6 Ka3=10-2.1 Ka4=10-2.8 Ka5=10-6.2 Ka6=10-10.3七种形式: H6Y2+、H5Y+、H4Y 、H3Y-、H2Y2-、HY3-、Y4- 当 pH 11 时,主要以Y4-形式存在——配位离子二. M-EDTA 的特点1. EDTA具有广泛的配位性能,几乎能与所有的金属离子形成稳定的螯合物 有利之处:提供了广泛测定元素的可能性(优于酸碱、沉淀法) 不利之处:多种组分之间易干扰——选择性2. EDTA与形成的M- EDTA 配位比绝大多数为1:13. 螯合物大多数带电荷,故能溶于水,反应迅速三. EDTA配合物的配?span href="tag.php?name=%BB%C6%BD%BA" onclick="tagshow(event)" class="t_tag"黄胶饧捌溆跋?span href="tag.php?name=%D2%F2%CB%D8" onclick="tagshow(event)" class="t_tag"因素(一) EDTA配合物的稳定常数 为简便,金属离子与EDTA的反应常将电荷略去写成通式: 配位平衡 M + Y == MY在配位滴定过程中,当溶液中没有副反应发生时,当反应达平衡时,用绝对稳定常数 KMY 衡量配位反应进行的程度: 稳定常数 (KMY越大,配合物越稳定) (1)(KMY 不因浓度、酸度及其它配位剂或干扰离子的存在等外界条件而改变)(二)影响配位平衡的主要因素 配位滴定中所涉及的化学平衡比较复杂,由于某些干扰离子或分子的存在(如溶液中的H+、OH-,其它共存离子、缓冲剂、掩蔽剂等),常伴随有一系列副反应发生:[IMG]http://www.chemcn.org/upload_files/57/20060304091230807.gif[/IMG] 各种副反应进行程度可由其相应的副反应系数表示(a)。 在大多数情况下,影响配位平衡的主要因素为“酸效应”和“配位效应”。1. 酸效应(质子效应或pH 效应) M + Y == MY ⇅ H+ HY, H2Y, H3Y …… 显然,溶液的酸度会影响Y 与M 离子配位能力,酸度愈大,Y 的浓度愈小,愈不利于MY 的形成。由溶液酸度(H+)引起的副反应称为“配位效应”。 其发生程度与 [H+] 有关,由酸效应系数来表示: ¬ 未与M配位的EDTA的各种形式总浓度 (2) [H+] [Y]¯ aY(H) 副反应越严重已知:CY’ = [H6Y]+[H5Y]+[H4Y]+[H3Y]+[H2Y]+[HY]+[Y] 所以: 类同于酸分布系数的推导: (3)因此: 已知 [H+] 计算出aY(H),不同pH 值下的log aY(H) 见教材表 8-2一般情况下:aY(H) 1,当pH ³ 12时,aY(H)» 12. 配位效应 Y + M == MY ⇅ L ML, ML2… … 这种由于其它配位剂存在使金属离子参加主反应能力降低的现象称为配位效应。 配位效应对主反应的影响程度可用配位效应系数表示: ¬ ¬ 未与Y 配位的M 总浓度 (4)M 与L 形成的配合物大多数是分步形成 MLn CM’ = [M] + [ML] + [ML2] +¼ ¼ [MLn] 由各级平衡: M+L=ML [ML]= k1[M][L] = b1[M][L] ML+L=ML2 [ML2]= k2[ML][L] = b2[M] [L]2 ┇ ┇ ┇MLn-1+L=MLn [MLn]= bn[M][L] n\可得到:(5) [L] [M]¯ aM(L) 副反应越严重。例:将100 ml 0.02mol/L Cu2+ 溶液与100ml 0.28mol/L 氨水相混合,求混合溶液中 Cu2+ 的平衡浓度为多少?解:查表可得各级b值aCu(NH3)=1 + 1.4 ´ 104 ´ 0.14 + 4.3 ´ 107 ´ 0.142 + 3.4 ´ 1010 ´ 0.143+ 4.7 ´ 1012 ´ 0.144 = 4.8´ 108(三)配合物的条件稳定常数 在滴定过程中,当溶液中无副反应发生时;当反应达平衡时,用绝对稳定常数KMY 衡量此配位反应进行的程度:当溶液中有副反应发生时,溶液的组成发生变化,此时: [M] cM’; [Y ] cY’ ; KMYK’MY 而 cM’ =[M]• aM(L); cY’ =[Y]• aY(H); (6)取对数得: (7) K ’——条件稳定常数。当溶液中无其他配位剂存在时: aM(L) =1, log K’MY = log KMY -log aY(H) (8) 当溶液中无其他配位剂存在, 且pH 12时: aY(H) =1, log K’MY = log KMY (9) 一般情况下: K’MY 12时: aY(H) =1, log K’MY = log KMY 一般情况下: K’MY KMY
二氧化硫的测定中,吸收液配制中环己二胺四乙酸二钠溶液的问题!反式1,2环己二胺四乙酸似乎不是很溶于1.5mol/L的氢氧化钠溶液!解决办法是什么呢?加热??
一. EDTA 的离解平衡 在水溶液中, 2 个羧基 H + 转移到氨基 N 上,形成双极离子: EDTA 常用 H 4 Y 表示,由于其在水及酸中的溶解度很小,常用的为其二钠盐: Na 2 H 2 Y 2H 2 O ,也简写为 EDTA 。 当溶液的酸度很高时,两个羧基可再接受 H + ,形成 H 6 Y 2+ ,相当一. EDTA的离解平衡在水溶液中,2个羧基 H+转移到氨基N上,形成双极离子: http://www.foodmate.net/jianyan/lihua/fenxi/5.files/image001.gif EDTA 常用 H4Y 表示,由于其在水及酸中的溶解度很小,常用的为其二钠盐:Na2H2Y·2H2O ,也简写为EDTA 。 当溶液的酸度很高时,两个羧基可再接受H+ ,形成H6Y2+ ,相当于一个六元酸,有六级离解常数: Ka1=10-0.9 Ka2=10-1.6 Ka3=10-2.1 Ka4=10-2.8 Ka5=10-6.2 Ka6=10-10.3 七种形式: H6Y2+ 、H5Y+ 、H4Y 、H3Y- 、H2Y2- 、HY3- 、Y4- 当 pH 11 时,主要以 Y4- 形式存在——配位离子二. M-EDTA 的特点1. EDTA具有广泛的配位性能,几乎能与所有的金属离子形成稳定的螯合物 有利之处:提供了广泛测定元素的可能性(优于酸碱、沉淀法) 不利之处:多种组分之间易干扰——选择性2. EDTA与形成的M- EDTA 配位比绝大多数为1:13. 螯合物大多数带电荷,故能溶于水,反应迅速三. EDTA配合物的配位平衡及其影响因素(一) EDTA配合物的稳定常数 为简便,金属离子与EDTA的反应常将电荷略去写成通式: 配位平衡 M + Y == MY在配位滴定过程中,当溶液中没有副反应发生时,当反应达平衡时,用绝对稳定常数 KMY 衡量配位反应进行的程度: 稳定常数 http://www.foodmate.net/jianyan/lihua/fenxi/5.files/image003.gif (KMY 越大,配合物越稳定) (1)(KMY 不因浓度、酸度及其它配位剂或干扰离子的存在等外界条件而改变)
本研究对盐酸副玫瑰苯胺法测定食品中SO2进行改进,以EDTA-2Na代替剧毒试剂四氯汞钠,建立了超声波浸提、无汞盐吸收液检测干果SO2残留的方法,二氧化硫含量在0~10.0μg范围内与吸光度呈良好的线性关系(R2=0.9995),方法的检出限为0.8mg/kg。测定样品的相对标准偏差在3.29%~7.42%之间,回收率在89.17%~104.72%之间。该方法操作简便、重现性好、线性范围宽、减小了对环境的污染,可用于干果中亚硫酸盐的测定。