
[align=center][b][font='times new roman'][size=18px]卷柏[/size][/font][font='times new roman'][size=18px]中[/size][/font][font='times new roman'][size=18px]穗花杉双黄酮[/size][/font][font='times new roman'][size=18px]测定[/size][/font][/b][/align][font='tahoma'][size=14px]小记:[/size][/font][font='tahoma'][size=14px]我们当时接收到客户样品,进行测定出现[/size][/font][font='tahoma'][size=14px]跟之前[/size][/font][font='tahoma'][size=14px]枳壳的问题,发现样品有可能是被提取过又卖出的,含量没测到,后来去药店买来饮片测[/size][/font][font='tahoma'][size=14px] [/size][/font][font='tahoma'][size=14px]是没有问题的[/size][/font][font='tahoma'][size=14px][color=#000000]。[/color][/size][/font][align=center][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211231829035304_6700_1858223_3.jpeg[/img][/align][font='times new roman']1 [/font][font='times new roman']材料与试剂[/font][font='times new roman']乙腈(色谱级)、[/font][font='times new roman']甲醇、磷酸[/font][font='times new roman'](分析纯)、[/font][font='times new roman']穗花杉双黄酮[/font][font='times new roman'](购自中检院)、[/font][font='times new roman']卷柏[/font][font='times new roman']药材[/font][font='times new roman']样品(送检样品)[/font][font='times new roman']和药店购买[/font][font='times new roman']。[/font][font='times new roman']2 [/font][font='times new roman']色谱条件[/font][font='times new roman']LC-20AT[/font][font='times new roman'][url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱仪[/color][/url](日本岛津),色谱柱:[/font][font='times new roman']Zorbax[/font][font='times new roman'] [/font][font='times new roman']SB[/font][font='times new roman'] [/font][font='times new roman']C18(250mm*4.6μm*5μm)[/font][font='times new roman'](安捷伦),流动相:以[/font][font='times new roman']甲醇[/font][font='times new roman']-[/font][font='times new roman']0.1%[/font][font='times new roman']磷酸水[/font][font='times new roman']梯度洗脱[/font][font='times new roman'];[/font][font='times new roman']柱温[/font][font='times new roman']3[/font][font='times new roman']5[/font][font='times new roman'] [/font][font='times new roman']℃[/font][font='times new roman']。[/font][font='times new roman']检测波长为[/font][font='times new roman']33[/font][font='times new roman']0nm[/font][font='times new roman'],流动相如下表:[/font][align=center][img=,690,152]https://ng1.17img.cn/bbsfiles/images/2022/11/202211231831114264_3477_1858223_3.jpg!w690x152.jpg[/img][/align][align=left][font='times new roman']3[/font][font='times new roman']溶液制备[/font][font='times new roman'](按照中国药典[/font][font='times new roman']2[/font][font='times new roman']020[/font][font='times new roman']年版一部[/font][font='times new roman']卷柏[/font][font='times new roman']项下测定)[/font][/align][font='times new roman']对照品溶液的制备[/font][font='times new roman'] [/font][font='times new roman']取穗花[/font][font='times new roman']杉双黄酮对照品适量,精密称定,加甲醇制成每[/font][font='times new roman']1m[/font][font='times new roman']L[/font][font='times new roman']含[/font][font='times new roman']0.1[/font][font='times new roman']5[/font][font='times new roman']mg[/font][font='times new roman']的溶液,即得。[/font][align=center][font='times new roman'] [img=,671,183]https://ng1.17img.cn/bbsfiles/images/2022/11/202211231832332250_1831_1858223_3.jpg!w671x183.jpg[/img][/font][/align][align=center][font='times new roman'] [/font][font='times new roman']穗花杉双黄酮[/font][font='times new roman']对照品色谱图[/font][/align][font='times new roman'] [/font][font='times new roman']供试品溶液[/font][font='times new roman']的制备[/font][font='times new roman'] [/font][font='times new roman']取本品粉末(过三号筛)约[/font][font='times new roman']0.2g[/font][font='times new roman'],精密称定,[/font][font='times new roman']置具塞[/font][font='times new roman']锥形瓶中,精密加入甲醇[/font][font='times new roman']50m[/font][font='times new roman']L[/font][font='times new roman'],称定重量,加热回流[/font][font='times new roman']5[/font][font='times new roman']小时,放冷,再称定重量,用甲醇[/font][font='times new roman']补足减失的[/font][font='times new roman']重量,摇匀,滤过,[/font][font='times new roman']取续滤液[/font][font='times new roman'],即得。分别精密吸取对照品溶液[/font][font='times new roman']10[/font][font='times new roman']μ[/font][font='times new roman']L[/font][font='times new roman'],注入[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱仪[/color][/url],测定,即得。[/font][align=center][img=,683,186]https://ng1.17img.cn/bbsfiles/images/2022/11/202211231832537485_797_1858223_3.jpg!w683x186.jpg[/img][/align][font='times new roman'][/font][align=center]卷柏药材色谱图[/align][font='times new roman']结果:客户送检样品[/font][font='times new roman']穗花杉双黄酮[/font][font='times new roman']未检出,药店购买卷柏药材[/font][font='times new roman']穗花杉双黄酮[/font][font='times new roman']含量为[/font][font='times new roman']0.[/font][font='times new roman']41%[/font][font='times new roman']注:[/font][font='times new roman']因为卷柏回流时间比较长,要多关注冷凝水及水浴锅,以免冷凝不及时,溶液挥干,影响提取效果。[/font][font='times new roman']我们再购买药材时不仅要从性状进行鉴别,更要根据中国药典进行含量检测,有必要的可以要求出示相关检测报告,以免买到劣药或者假药。[/font]

黄酮类化合物在自然界分布非常广泛,是一类非常重要的天然有机化合物。传统意义上黄酮类化合物主要是指基本母核为2-苯基色原酮类化合物,现在泛指两个具有酚羟基的苯环(A-与B-环)通过中央三碳原子相互连接而成的一系列化合物。根据黄酮类化合物结构特点,可分为黄酮、黄酮醇、二氢黄酮、二氢黄酮醇、黄烷醇、查耳酮、异黄酮、双黄酮、花色素等种类。黄酮类化合物具有多方面的生物活性,如葛根总黄酮及葛根素(puerarin)、银杏叶总黄酮等具有扩张冠状血管作用,临床用于治疗冠心病;水飞蓟素(silymarin)、异水飞蓟素( silydianin)及次水飞蓟素(slychristin)等有肝脏保护作用,临床上用于治疗急、慢性肝炎、肝硬化及多种中毒性肝损伤等;木犀草素(luteolin)、黄芩苷( baicalin)、黄芩素(baicalein)以及槲皮素等具有抗菌、抗病毒作用;牡荆素( vitexin)、桑色素、儿茶素等具有抗肿瘤作用等。游离黄酮类化合物一般难溶或不溶于水,易溶于甲醇、乙酸乙酯、氯仿、乙醚等有机溶剂及稀碱水溶液中。黄酮苷一般易溶于水、甲醇、乙醇等强极性溶剂中。花色苷及其苷元以离子形式存在具有盐的通性,亲水性较强,水溶度较大。黄酮化合物单体的分离主要依靠各种色谱方法来实现,除经典的柱色谱法和薄层色谱法、HPLC外,近年来HSCCC已经得到广泛的应用。对于多数极性较弱的黄酮苷元,在进行HSCCC分离实验时,通常可以选用氯仿-甲醇-水的溶剂系统,而氯仿-甲醇-水(4:3:2或5:3:2)则是最常用的溶剂系统。根据被分离样品的具体情况,在上述溶剂系统的基础上,对组成诸元的比例进行适当的调整,就能获得良好的分离效果。还有些苷元也可采用正己烷(石油醚)-乙酸乙酯-甲醇-水的溶剂系统,通过调整溶剂的组成比例来实现有效分离。对于极性较强的黄酮糖苷类成分的HSCCC分离,通常使用的是乙酸乙酯–水为基本结构的溶剂系统,可以通过添加正丁醇、甲醇、乙醇、乙酸来调节溶剂系统的极性。分离这类化合物的典型性溶剂系统有:氯仿-[color
谁有黄酮纯化的资料,具体怎么做?在纯化黄酮的时候
【作者】 姜泓; 白丽萍; 康廷国;【机构】 辽宁中医学院; 辽宁中医学院 110032; 辽宁沈阳; 110032; 辽宁沈阳;【摘要】 目的:对紫穗槐果实的中5,7-二羟基-8-牻牛儿基双氢黄酮进行含量测定,初步探讨其在紫穗槐果实中的变异规律及其与地理分布的关系。方法:色谱柱:迪马公司Diamonsil C18柱(200×4.6mm,5μm);流动相:甲醇-0.025mol/L磷酸水(90:10);流速:1ml/min;柱温:35℃;检测波长:293nm。结果与结论:首次对紫穗槐果实中的5,7-二羟基-8-牻牛儿基双氢黄酮进行含量测定,确定其定量方法。测定结果发现,土质肥沃地区的果实中5,7-二羟基-8-牻牛儿基双氢黄酮的含量较高。 更多还原【Abstract】 Objectve To determine its contents and to find out the variation regularity in fruits of Amorpha frutioosa L.. Methods Diamonsil C18 (2004.6mm, 5μm)column was used with the mixture of 0.025mol/L H3PO4 water and methanol as the mobile phase, and the UV absorbance detection was set at 270nm. Results and Conclusion The content of 5,7 - di-hydroxy - 8 - geranylflavanone in many samples collected with localities were determined by HPLC for the first time. The variation of tephrosin in the fruits was ... 更多还原【关键词】 紫穗槐; 5,7-二羟基-8-牻牛儿基双氢黄酮; 高效液相色谱法; 【Key words】 Amorpha fruticosa L.; 5,7 - dihydroxy - 8 - geranylflavanone; HPLC;
[color=#333333]甘草是一种药食同源的草本植物,广泛用于中药处方与食品工业中。现今使用的甘草主要为其根与根状茎,而地上部分却作为畜牧饲料或燃料低值化处理。目前关于甘草根及根状茎的成分及生理活性研究已相当充分,而对甘草地上部分却研究较少。本论文通过对比分析光果甘草(Glycyrrhiza glabra L.)叶与根中物质组成和生理活性,确定光果甘草叶的研究价值 通过色谱分离和光谱技术分离并鉴定了光果甘草叶中的黄酮并对其活性进行评价 优化了光果甘草叶黄酮的测定和提取方法,并通过大孔树脂对光果甘草叶黄酮进行富集研究 研究了光果甘草叶黄酮对猪肉及其制品储藏过程中油脂氧化和蛋白氧化的抑制作用,以期为甘草叶的高值利用提供理论指导。[/color]
我的样品是枸杞,测了四个品种枸杞的总酚和总黄酮含量,三个品种总酚含量高于总黄酮(但是差的不多,大概只高1mg),另外一个品种测了几次,抽了一天同时测定,数据就是总黄酮比总酚高!!! 但是总黄酮是总酚的一种,按理说应该总酚比较高,不知道为什么会有这种结果? 黄酮标品是芦丁,总酚是没食子酸 还有就是,我的样品直接用80%乙醇提取就开始测定,没有进行脱脂脱色等处理,因为也只是粗略测一下进行比较,会不会是因为没有脱色导致的?但是总黄酮含量高的那个品种没有太大的颜色,反而另外三种有颜色,如果不脱色影响会很大吗?不想脱色......没有试剂没有设备
国内最大最专业的国家标准物质服务平台坛墨质检-国家标准物质中心(北京坛墨质检科技有限公司),是国家质检总局指定的国家标准物质研制单位,是国内最大最专业的食品、环境、职业卫生标准物质生产商和服务商。BW5543 牡荆素葡萄糖苷对照品,有报告 HPLC≥98% BW5544 毛蕊异黄酮对照品,有报告 HPLC≥98% BW5546 黄柏碱对照品,有报告 HPLC≥98% BW5547 朝藿定A1对照品,有报告 HPLC≥98% BW5548 莪术二酮; 姜黄二酮; 莪二酮对照品,有报告 HPLC≥98% BW5549 氧化槐果碱对照品,有报告 HPLC≥98% BW5550 杨梅苷对照品,有报告 HPLC≥98% BW5551 灰毡毛忍冬皂苷乙对照品,有报告 HPLC≥98% BW5552 银杏内酯J; 白果苦内酯J对照品,有报告 HPLC≥98% BW5553 川续断皂苷乙对照品,有报告 HPLC≥98% BW5554 山栀苷甲酯对照品,有报告 HPLC≥98% BW5555 表告依春对照品,有报告 HPLC≥98% BW5556 8-O-乙酰山栀苷甲酯对照品,有报告 HPLC≥98% BW5557 水晶兰苷; 水晶兰甙对照品,有报告 HPLC≥98% BW5558 黄杞苷对照品,有报告 HPLC≥98% BW5559 沙苑子苷A对照品,有报告 HPLC≥98% BW5560 阿曼托黄酮; 穗花杉双黄酮对照品,有报告 HPLC≥98% BW5561 土荆皮乙酸(土荆乙酸)对照品,有报告 HPLC≥98% BW5562 去甲异波尔定; 去甲基异波尔定对照品,有报告 HPLC≥98% BW5563 鲁斯考皂苷元; 鲁斯可皂苷元对照品,有报告 HPLC≥98% BW5564 6-姜烯酚; 姜烯酚对照品,有报告 HPLC≥98% BW5565 白绵马素AA对照品,有报告 HPLC≥98% BW5566 白绵马素AP对照品,有报告 HPLC≥98% BW5567 知母皂苷B对照品,有报告 HPLC≥98% BW5568 知母皂苷E; 知母皂苷BI对照品,有报告 HPLC≥98% BW5569 牛蒡苷元; 牛蒡子苷元对照品,有报告 HPLC≥98% BW5570 苯甲酰芍药苷对照品,有报告 HPLC≥98% 坛墨质检现有员工79人,办公室面积450平米,实验室1650平米;销售、客服、财务及行政人员35人,实验室工作人员21人,库房14人,市场部8人。实验仪器设备:气相色谱、液相色谱、气质联用、液质联用、离子色谱、紫外分光光度计,原子吸收、ICP-OES和ICP-MS;库房面积450平米,库房工作人员12人,现货产品5万个,坛墨质检自主研发的产品近3000个,已申报国标345项,填补国内空白的产品达到65项。坛墨质检是国内唯一提供标准溶液定制服务的标准物质研制单位,定制范围:特殊浓度定制、特殊溶剂定制、混标定制。
洋葱含有大量的类黄酮抗氧化物,对心脏健康极为有利。类黄酮化合物在保护心血管系统方面起着关键作用,建议可常吃凉拌洋葱黑木耳。
[size=4]我的实验室用乙醇溶液提取黄酮,我们学校紫外不方便用,我就先做好单因素是30 60 90 120 分钟,60 90 120是前3天作的实验,今天测结果0.2094A 0.2182A 0.3642A,30分钟时今天做的实验,结果是0.3831A这是为什么?黄酮提取液是不是容易氧化大家是怎样做的是?[/size][color=red][size=6][/size][/color]
黄酮具有强抗氧化作用,对食物中脂肪、蛋白质、矿物质及其它微量元素有很好的分解消化吸收作用。黄酮的特性包括利肺、润肺、养肺,提升人体免疫力等。黄酮能被人体迅速吸收,能通过血脑屏障,能时入脂肪组织,进而体现出如下功能:帮助人体防御辐射、消除疲劳、保护血管、防动脉硬化、扩张毛细血管、疏通微循环、活化大脑及其他脏器细胞的功能、抗脂肪氧化、抗衰老。
黄酮总量检测和单个黄酮分析。黄酮总量分析依据到底是依据芦丁还是其他黄酮参加显色反应,测试波长410还是中510nm。而单个黄酮测试,必须用响应黄酮作标曲还是其他也可以参考。谢谢!
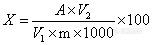
[align=center]胶囊中总黄酮的测定方法验证[/align][align=center]西安国联质量检测技术股份有限公司[/align][align=center]食品事业部:肖颖[/align]一、目的:对《保健食品检验与评价技术规范》(2003版)中总黄酮测定方法进行方法适用性验证。二、验证内容:方法适用性验证包括检出限、线性范围、重复性、回收率、耐用性。三、验证方法:1 范围 本标准适用于胶囊中总黄酮的含量测定。2 原理 试样中黄酮经乙醇提取,聚酰胺粉吸附,以苯除去杂质,用甲醇洗脱黄酮后,在360nm有最大吸收,其吸收值与黄酮量在一定范围内成正比,与标准系列比较定量。3 试剂和材料3.1 试剂实验室用水为双蒸馏水,所用试剂为分析纯级。3.1.1 无水乙醇:分析纯。(来源:天津奥普升化工有限公司 批号:20161019)3.1.2 芦丁标准溶液:(来源:上海金穗生物科技有限公司 批号:20161027)称取5.0芦丁,加甲醇溶解并定容至100mL。3.1.3 甲醇(来源:天津市天力化学试剂有限公司 批号:20150408 )3.1.4 聚酰胺粉(来源:浙江省台州市路桥四甲生化塑料厂 批号:201600409 )3.1.5 苯(来源:天津市科密欧化学试剂有限公司 批号:20140510 )以上试剂符合检测要求4 仪器和设备4.1超声波清洗器:昆山市超声仪器有限公司 型号:KQ5200B4.2电子天平:沈阳龙腾电子有限公司 型号:JM-B10002 精度:0.0001g4.3分光光度计:北京普析通用仪器有限责任公司 型号:TU-1901或同等程度仪器 以上仪器符合检测要求5 波长选择专属性实验取芦丁标准溶液(3.1.2)1.0mL加乙醇(3.1.1)定容至25mL,摇匀后,超声20min,吸取上清液1.0mL于蒸发皿中,加1g聚酰胺粉(3.1.4)吸附,于水浴上挥去乙醇,然后转入层析柱。先用20mL苯(3.1.5)洗,苯液弃去,然后用甲醇(3.1.3)洗脱,定容至25mL,以甲醇(3.1.3)为参比,进行紫外可见光谱扫描,同时对样品空白进行扫描。6 试样处理样品提取:称取1.0g左右试样,加乙醇(3.1.1)溶解并定容至25mL,摇匀后,超声提取20min,吸取上清液1.0mL于蒸发皿中,加1g聚酰胺粉(3.1.4)吸附,于水浴上挥去乙醇,然后转入层析柱。先用20mL苯(3.1.5)洗,苯液弃去,然后用甲醇(3.1.3)洗脱黄酮,定容至25mL,为待测液。7 测定:标准曲线绘制:分别移取0、1.0、2.0、3.0、4.0、5.0mL芦丁标准溶液于10mL比色管中,加甲醇(3.1.3)至刻度,摇匀。用1cm石英比色皿在360nm处比色,测其吸光度。以吸光度为横坐标,总黄酮含量为纵坐标绘制校正曲线。同时取待测液在360nm测定吸光度,计算试样中总黄酮含量。8 公式试样总黄酮含量按下式进行计算。[img=,153,45]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091803387785_8072_2904018_3.png!w153x45.jpg[/img]式中:X—样品中总黄酮的含量,mg/100g; A—样品测定液中黄酮的含量,μg;m—样品质量,g;V[sub]1[/sub]-测定用样品液体积,mL;V[sub]2[/sub]-试样定容体积,mL。计算结果保留二位有效数字。四、验证数据1.波长选择经过全波长扫描,芦丁标准溶液在360nm处有最大吸收峰,且试剂空白和样品空白在此波长处无干扰,故选择360nm为最佳测定波长。[img=,690,546]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091803507036_5107_2904018_3.png!w690x546.jpg[/img]2.线性范围以总黄酮含量(C)为横坐标,吸光度值(A)为纵坐标,绘制标准曲线,进行线性回归,得回归方程:A=0.0029C-0.0069 R[sup]2[/sup]为0.999。[table][tr][td][align=center]总黄酮含量(μg)[/align][/td][td]0[/td][td]52[/td][td]104[/td][td]156[/td][td]208[/td][td]260[/td][/tr][tr][td][align=center]A[/align][/td][td]0[/td][td]0.133[/td][td]0.284[/td][td]0.445[/td][td]0.598[/td][td]0.730[/td][/tr][/table][align=center][img=,482,290]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091803598216_9725_2904018_3.png!w482x290.jpg[/img] [/align]以上结果表明总黄酮在0-260μg范围内,吸光值与总黄酮含量线性良好,符合要求。3. 检出限以甲醇(3.1.3)为参比,同时在360nm处对标准曲线0管进行20次测定,计算标准偏差,以3倍标准偏差值与斜率的比值为最低检出含量,利用公式计算出检出限。经测定,标准偏差为0.000366,最低检出含量为0.379μg,检出限为1.0mg/100g,满足胶囊中对检出浓度的要求。4.重复性称取6份试样按照上述处理方法进行试样处理,分别吸取适量样液进行比色,求得样液中总黄酮含量。[table][tr][td][align=center]测定编号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][td][align=center]6[/align][/td][/tr][tr][td][align=center]样品含量mg/100g[/align][/td][td]323.1[/td][td]318.9[/td][td]320.2[/td][td]326.1[/td][td]324.6[/td][td]322.7[/td][/tr][tr][td][align=center]平均值mg/100g[/align][/td][td=6,1][align=center]322.6[/align][/td][/tr][tr][td][align=center]相对标准偏差%[/align][/td][td=6,1][align=center]0.831[/align][/td][/tr][/table]由上表可知,试样中总黄酮测定的重复性均值为322.6,RSD值为0.831%,符合规定。5.回收率在进行重复性试验基础上,同时进行加标试验,加标量分别为1.2倍,1.0倍,0.8倍,结果见下表:[table][tr][td][align=center]测定编号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][td][align=center]6[/align][/td][/tr][tr][td][align=center]样品含量mg/100g[/align][/td][td]323.1[/td][td]318.9[/td][td]320.2[/td][td]326.1[/td][td]324.6[/td][td]322.7[/td][/tr][tr][td][align=center]加标量mg/100g[/align][/td][td][align=center]347.30[/align][/td][td][align=center]354.98[/align][/td][td][align=center]304.81[/align][/td][td][align=center]309.28[/align][/td][td][align=center]251.82[/align][/td][td][align=center]258.99[/align][/td][/tr][tr][td][align=center]加标样品含量mg/100g[/align][/td][td]651.22[/td][td]659.02[/td][td]630.58[/td][td]649.8[/td][td]549.98[/td][td]567.79[/td][/tr][tr][td][align=center]加标回收率%[/align][/td][td]94.48 [/td][td]95.81 [/td][td]101.83 [/td][td]104.66 [/td][td]89.50 [/td][td]94.63 [/td][/tr][/table]由上表可以看出胶囊中总黄酮测定的加标回收范围在80%-120%,符合规定。6.耐用性同时进行人员比对和仪器比对检测胶囊中总黄酮,结果见下表。[table][tr][td]编号[/td][td]人员1[/td][td]人员2[/td][td]仪器1[/td][td]仪器2[/td][/tr][tr][td]样品含量mg/100g[/td][td]322.8[/td][td]325.7[/td][td]322.1[/td][td]323.7[/td][/tr][tr][td]相对误差%[/td][td=2,1][align=center]0.89[/align][/td][td=2,1][align=center]0.50[/align][/td][/tr][/table]由上表可知,胶囊中总黄酮测定耐用性符合要求综上所述:从波长选择、检出限、线性范围、重复性、回收率、耐用性测试结果可知,均符合方法要求,本实验方法符合胶囊中总黄酮测定。
[color=#444444]利用高效液相色谱检测黄芩黄酮类根茎叶中的有效成分,色谱峰均出现拖尾现象,尝试过的流动相有甲醇和0.1%磷酸水,甲醇和0.2%磷酸水,乙腈和0.2%磷酸水,甲酸和1%甲酸水,乙腈和1%甲酸水等色谱条件,但是色谱峰均出现拖尾现象,[/color][color=#444444]求助各位大神,有木有什么好的办法拯救色谱峰拖尾现象!!!谢谢大家!![/color]

中药复方口服溶液中总黄酮含量的测定 将传统中药复方加工制成口服溶液,不但可以保留传统中药的临床药效,还极大的方便了患者的携带及服用,并且可以通过改善口感提高患者的顺应性。口服液始于上世纪60年代,当时有人将竹沥灌装于安瓶中制成口服安瓶剂,这是口服液的初步尝试,中国药典77年版首次收载了口服液安瓶剂(即口服液),到了八九十年代,随着中药制药工业的发展,口服液已被广为推崇。 本研究将传统中药汤剂经工艺设计制成口服液作为保健食品,现进行质量研究中,经文献调研该方中其主要功效作用的成分为总黄酮,现将制得的成品进行总黄酮含量测定。 黄酮类化合物广泛存在于药用植物、水果和蔬菜等中,是植物在长期自然选择过程中产生的一些次级代谢产物,它们是一类以2-苯基色原酮为母核的多酚化合物,现代医学研究表明,黄酮类化合物具有降低心肌耗氧量,使冠脉、脑血管流量增加,抗心律,软化血管,降血糖、血脂等作用,同时它还是一种天然的抗氧化剂,具有清除人体中超氧离子自由基,抗衰老,增加机体免疫力的生理活性作用,对总黄酮测定方法的研究报道较多,但基本都是对单一植物中总黄酮的测定,而我国大多中药制剂均为复方制剂,基于中草药复方制剂中总黄酮含量测定的研究还较少,本实验以复方中药为研究对象,来测定总黄酮的含量。试验仪器及试剂:电子天平紫外可见分光光度计100conc(瓦里安)数控超声波清洗器KQ-500DE(昆山市超声仪器有限公司)SHH.W21.420型三用电热恒温水箱芦丁对照品内径1.5cm试管试剂均为分析纯试验样品的制备:首先将口服液取出与小烧杯中,移取3ml于25ml容量瓶中,乙醇定容,摇匀后,超声提取20Min,放置,移取1ml于蒸发皿中,加入1g的聚酰胺(80-100目),搅拌使均匀吸附,(如图):http://ng1.17img.cn/bbsfiles/images/2013/12/201312221536_483960_2217446_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/12/201312221536_483959_2217446_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/12/201312221536_483961_2217446_3.jpg置于水浴上(50℃)挥去乙醇(如图):http://ng1.17img.cn/bbsfiles/images/2013/12/201312221536_483963_2217446_3.jpg将挥好的聚酰胺转移入层析柱中,先用20ml苯液洗脱,弃去苯液,(如图:)然后用甲醇进行洗脱,并将洗脱液接入25ml的容量瓶中,甲醇定容。摇匀后,以0.45微米滤膜过滤与刻度管中。(如图:)http://ng1.17img.cn/bbsfiles/images/2013/12/201312221536_483964_2217446_3.jpg标准曲线的制作:称取5mg芦丁,加甲醇溶解并定容至100mL容量瓶中,即得50微克每毫升的标准溶液。http://ng1.17img.cn/bbsfiles/images/2013/12/201312221536_483958_2217446_3.jpg吸取芦丁标准溶液0、1.0、2.0、3.0、4.0[size=12
在作毕业课题,快到最后了,但是现在遇到了难题,我的课题是枣核中黄酮类物质的纯化,现在是用聚酰氨薄膜来进行薄层层析,但是总是找不到合适的展开剂和显色剂,我现在用的是乙醇:水:甲酸(4:1:0.1)这个为展开剂作的,但是效果很不好,卢丁标液总是出现脱尾现象,而且黄酮根本就不显色,帮帮忙,看看我这个问题应该怎么解决,谢谢啊!
各位朋友,请问怎么判断我提取的黄酮是否氧化啦?谢谢大家!!
实验原理黄酮类化合物是植物的重要次生代谢产物,也是一些保健品和中药材的有效成分之一。黄酮类化合物的定量方法常用的有HPLC法和分光光度法,在实际生产和科研过程中,对于黄酮单体的定量常采用HPLC法,而对总黄酮的测定,考虑到方法的简便、快捷以及可行性,多采用在碱性介质中加铝盐显色的分光光度法。在碱性条件下黄酮类化合物与铝盐形成络合物、在500nm波长处有最大吸收峰。标准品选用芦丁。试剂和器材一、试剂芦丁标准品。5%NaNO2;10%A1(NO3)3;5%NaOH;70%乙醇。二、材料新鲜银杏叶。三、器材容量瓶10ml(×7),25ml(×1),100ml(×2);吸管 0.5ml(×2),1ml(×2),2ml(×1),5ml(×1);分光光度计。操作方法一、制作标准曲线精密称取芦丁标准品5mg,用70%乙醇溶解,定容于25mL容量瓶中,摇匀,得0.2mg/mL的标准溶液。精确吸取标准溶液0.0、0.2、0.4、0.6、0.8、1.0、1.2mL,分别置于10mL容量瓶中,加入 5%NaNO20.4mL,摇匀,放置6min;加入10%A1(NO3)3 0.4mL,摇匀,放置6min;加入5%NaOH4.0mL,再加水至刻度,摇匀,放置15min。以试剂空白作为参比溶液。用1cm比色皿,在500nm波长处测定吸光度,绘制标准曲线。二、总黄酮的提取把新鲜的银杏叶低温烘干,使水分小于8%,制成干粉。精确称取干粉1.0g,置于 100mL容量瓶中,加入70%乙醇30mL,浸泡24h。超声波提取30min,过滤,滤液用70%乙醇定容于100mL容量瓶中,得到黄酮提取液,待用。三、测定吸取黄酮提取液1.00mL, 置于10mL容量瓶中,加入5%NaNO30.4mL,摇匀,放置6min;加入10%A1(NO3)3 0.4mL,摇匀,放置6min;加入5%NaOH4.0mL,再加水至刻度,摇匀,放置15min。以试剂空白作为参比溶液。用1cm比色皿,在500nm波长处测定吸光度,由标准曲线法计算总黄酮含量。注意事项对于某些热敏成分的提取,采用超声波破碎法效果较为理想。由于此过程是一个物理过程,浸提过程中无化学反应,被浸提的生物活性物质在一定时间内保持不变。
国内最大最专业的国家标准物质服务平台坛墨质检-国家标准物质中心(北京坛墨质检科技有限公司),是国家质检总局指定的国家标准物质研制单位,是国内最大最专业的食品、环境、职业卫生标准物质生产商和服务商。 产品编号 产品名称 标准值 BW5899瑟丹内酯对照品,有报告HPLC≥98%BW5915番茄红素对照品,有报告HPLC≥98%BW5472异槲皮苷对照品,有报告HPLC≥98%BW5437圣草酚;毛纲草酚对照品,有报告HPLC≥98%BW5917(标定)矢车菊素-3-O-半乳糖苷,花青素对照品,有报告HPLC≥98%BW5920多西他赛;多烯紫杉醇对照品,有报告HPLC≥98%BW5496异甘草素对照品,有报告HPLC≥98%BW5540豆甾醇对照品,有报告HPLC≥98%BW5285D-(-)-奎宁酸;右旋奎宁酸对照品,有报告HPLC≥98%BW5539异阿魏酸; 3-羟基-4-甲氧基肉桂酸对照品,有报告HPLC≥98%BW5492高香草酸对照品,有报告HPLC≥98%BW5215烟碱(尼古丁)对照品,有报告HPLC≥98%BW54588-甲氧基补骨脂素(花椒毒素)对照品,有报告HPLC≥98%BW5457D-松醇95%对照品,有报告HPLC≥98%BW5942密蒙花苷(刺槐素)对照品,有报告HPLC≥98%BW5945高香草酸对照品,有报告HPLC≥98%BW5949桉叶油醇对照品,有报告HPLC≥98%BW5654香紫苏醇对照品,有报告HPLC≥98%BW5436圣草次苷对照品,有报告HPLC≥98%BW5960知母皂苷C对照品,有报告HPLC≥98%BW5961睾酮对照品,有报告HPLC≥98%BW5962茵陈色原酮对照品,有报告HPLC≥98%BW5560阿曼托黄酮; 穗花杉双黄酮对照品,有报告HPLC≥98%BW5963戈米辛J,对照品,有报告对照品,有报告HPLC≥98%BW5542没食子儿茶素(棓儿茶酸、没食子酰儿茶素)对照品,有报告HPLC≥98% 坛墨质检现有员工79人,办公室面积450平米,实验室1650平米;销售、客服、财务及行政人员35人,实验室工作人员21人,库房14人,市场部8人。实验仪器设备:气相色谱、液相色谱、气质联用、液质联用、离子色谱、紫外分光光度计,原子吸收、ICP-OES和ICP-MS;库房面积450平米,库房工作人员12人,现货产品5万个,坛墨质检自主研发的产品近3000个,已申报国标345项,填补国内空白的产品达到65项。坛墨质检是国内唯一提供标准溶液定制服务的标准物质研制单位,定制范围:特殊浓度定制、特殊溶剂定制、混标定制。
有高手做过黄酮醇苷的检测嘛??我现在要做,难做吗??急........我要用液相测定的是银杏提取液中的黄酮总量,包括槲皮素,异鼠李素,山奈素.....因为课题比较急,希望高手伸出援手,谢谢.......
有关二氢黄酮的质谱裂解问题,数据如下: MS: 316(100) 298(9) 283(10) 269(3) 255(3) 196(34) 181(25) 170(34) 153(10) 这是全部的裂解数据。 化合物的结构式在附件里面,希望谁能帮我分析下怎么脱去一分子水和一个甲基,谢谢啦!

大家好,我是新手,最近想要用气质检测一个黄酮苷元组分,我查了些资料,有报道表明HP-5-MS(长30m,膜厚0.25um,内径0.25mm)可用于分析BSTFA+1%TMCS衍生化的黄酮苷元(见附件),我们学校的气质柱为Rtx-5MS(长30m,膜厚0.25um,内径0.25mm),似乎HP-5-MS和Rtx-5MS都是非极性的?所以我就用Rtx-5MS进行了分析,结果如下:黄酮苷元不经过衍生化直接进样1ul,GC/MS只出现一个黄酮苷元峰(之前我HPLC-DAD分析过有15-20左右黄酮苷元);经过衍生化后进样1ul分析,一个峰都没有;非常郁闷,不知道啥原因?是柱子不适合分析黄酮苷元?还是其他参数条件设置有问题?希望各位高手多多指教!http://ng1.17img.cn/bbsfiles/images/2011/06/201106010914_297216_1736519_3.jpg
请教各位有没有用保健食品检测方法做黄酮检测的。我最近做黄酮总是不太好,不知道是不是因为换了聚酰胺粉。请问有没有什么重要的注意事项,大家做回收率一般能做到多少?
维权声明:本文为xiaodu2007693原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。黄酮类化合物的分离体会 【黄酮类化合物简介】 黄酮类化合物(flavonoids)是一类存在于自然界的、具有2-苯基色原酮(flavone)结构的化合物。它们分子中有一个酮式羰基,第一位上的氧原子具碱性,能与强酸成盐,其羟基衍生物多具黄色,故又称黄碱素或黄酮。黄酮类化合物在植物体中通常与糖结合成苷类,小部分以游离态(苷元)的形式存在。绝大多数植物体内都含有黄酮类化合物,它在植物的生长、发育、开花、结果以及抗菌防病等方起着重要的作用。【本人研究内容】 我做的是某中药的化学成分研究,该中药中主要为黄酮类成分,遵循传统用药原则,我采取水煎煮,之后水提液浓缩至一定体积,过大孔吸附树脂,乙醇水梯度洗脱,梯度:水、20%乙醇、40%乙醇、60%乙醇、80%乙醇。每个梯度做为一个流分,再进行细分。下一步主要是运用聚酰胺柱色谱,中低压ODS,Sephadex LH20进一步分离,最后制备液相得到单体化合物。【经验分享】 主要和大家分享我使用聚酰胺柱的经验,我一般是聚酰胺薄膜结合聚酰胺柱,类似于硅胶板结合硅胶柱。所用的聚酰胺为30-60目,聚酰胺薄膜一盒50片,规格为8cm x 8cm,70块钱左右,可以根据需要剪成条状使用。聚酰胺薄膜常用的溶剂系统说明书上有,我常用甲醇-水,因为黄酮类化合物有一定的酸性,展开剂要加点酸,甲酸乙酸都可以,抑制其解离,保持游离状态的话,样品成点性好,否则拖尾很严重。在此需要指出的是,聚酰胺可以用反相溶剂系统,如甲醇水;也可以用正相溶剂系统,如二氯甲烷甲醇。要根据自己样品的极性来定。以我的80%乙醇洗脱物为例,进行详细的叙述。此部分极性较小。我用二氯甲烷溶解,拌样,挥干。洗脱系统为甲醇水,聚酰胺柱起始用水装柱,上样,上面要放一块棉花,然后用玻璃塞子压住(聚酰胺比较轻,防止加溶剂时冲起来),甲醇水梯度洗脱。之前点板显示,50%甲醇水刚刚展开一点,因此起始用50%甲醇水洗脱,然后梯度设为55%、60%、65%、70%、75%、80%、85%、90%、最后甲醇冲柱。过程中每100mL一接,蒸干转移至小瓶。最后用一大块聚酰胺对得到的流分进行合并。得到大概9-10个流分,HPLC-DAD分析,找到合适的液相色谱条件之后,用制备液相进行制备。【部分聚酰胺薄层谱图展示】http://ng1.17img.cn/bbsfiles/images/2010/09/201009211940_245940_2160661_3.jpg http://ng1.17img.cn/bbsfiles/images/2010/09/201009211940_245941_2160661_3.jpg左图:展开剂:(甲醇:水90:10)+2滴乙酸; 右图:展开剂:(甲醇:水80:10)+2滴乙酸,最右边的点为总样显色剂为:三氯化铁乙醇溶液【体会和教训】 黄酮类化合物用聚酰胺分离效果非常好,但是死吸附较严重,样品比较多时可以使用,少就算了。凝胶Sephadex LH20效果也非常好,建议多使用。黄酮类成分溶解性比较折磨人,但提醒一点在进行制备液相时,样品一定要用流动相溶解,或接近流动相,多加点总会溶解的,然后用0.45μm滤膜过滤。不用流动相溶解很容易把柱子弄裂分。原因在于,进样之后,样品析出,堵了柱塞板,导致局部流速过快,冲塌固定相。我就把老师的预柱整裂分了,多亏了预柱啊,保护了柱子,要不然老师肯定疯了,但是后来寄出去修预柱,别人检测又很神奇地自动好了,这有点解释不了,呵呵,这事也不是常能碰到的,最好按规矩来,否则耽误别人实验不太好。先就写这么多,实验也不是那么成功,但拿出来和大家交流,不对的地方请批评指正。【样品导致预柱裂分的后果-色谱图展示】http://ng1.17img.cn/bbsfiles/images/2010/09/201009212004_245944_2160661_3.jpg http://ng1.17img.cn/bbsfiles/images/2010/09/201009212007_245946_2160661_3.jpg左图为:样品制备时色谱图,当时已裂分右图为:预柱用纯品检测色谱图,连续进样2针,可见预柱裂分严重。
我在测蜂胶黄酮时,色谱图上出了接近30几个峰,请问这些峰在相同的波长下都是黄酮类物质吗?是不是其他的物质?
[font=楷体_GB2312[size=4]]我看大部分文献是用显色反应,试剂是(亚硝酸钠,硝酸铝,氢氧化钠)第一个问题是他们与总黄酮含量关系怎样确定,及怎样的情况使显色剂过量?参比溶液一般是试剂空白(亚硝酸钠,硝酸铝,氢氧化钠)第二个问题是我觉得用乙醇,水,还是试剂空白,影响不大吧?因为在510出他们没有吸收第三个问题是参比溶液是试样空白更科学吧,既参比溶液为(样品+溶剂(水或乙醇溶液))?我看有一篇文献于村俞莎沈向红的《中草药总黄酮的提取和含量测定》他们选择的参比溶液是样品+氢氧化钠他们说考虑到某些中草药(如大黄等)遇碱也显红色,应从样品中扣除,故本法选择样品加碱作为样品空白扣除。我的疑问是在黄酮的定性上(加氢氧化钠,也是显红色),因为是在可见光驱,这样不就都扣除了,他们这样做行吗?请高人指点,谢谢[/size][/font]
黄酮高效液相提取洗脱我是做黄酮提取的,将原料用超声波辅助提取,温度60℃,提取液为60%乙醇,然后过滤,取滤液过0.45um膜,流动相A甲醇,B0,1%甲酸。梯度洗脱0min 5%A 10min 10%A 20min 40%A 25min 40%A 30min 60%A 35min 60%A 45min 90%A 47min 100%A 60min 100%A ,这样跑出来的峰只是在三分钟左右有一个峰(有点像溶剂峰,但是峰很高,后面还有小峰,没分离开)还有就是在50-60分钟有一些峰,请问下,我该怎么样去调整我的梯度呢?
硝酸铝显色法测定总黄酮的原理为:在中性或弱碱性及亚硝酸钠存在条件下,黄酮类化合物与铝盐生成螯和物,加入氢氧化钠溶液后显红橙色,在510nm波长处有吸收峰且符合定量分析的比尔定律,一般以芦丁标准品定量。 先用亚硝酸钠还原黄酮, 然后加入硝酸铝络合,最后加氢氧化钠溶液使黄酮类化合物开环,生成 2''''羟基查耳酮而显色。显色原理发生在黄酮醇类成分邻位无取代的邻二酚羟基部位,不具有邻位无取代邻二酚羟基的黄酮醇类成分加入上述试剂时不显色。用亚硝酸钠还原黄酮,还原那个基团?硝酸铝络合,与那个基团?
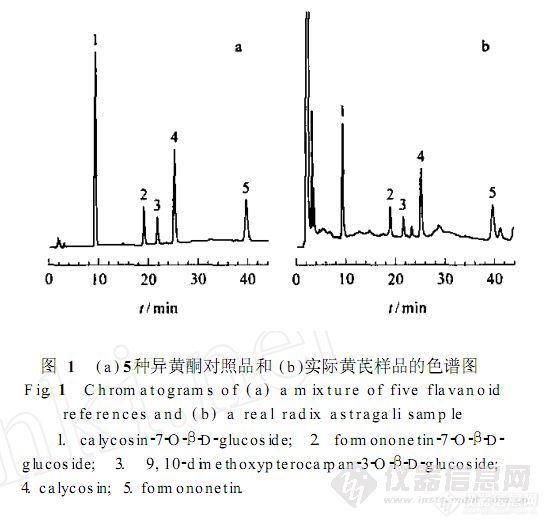
【作者】 王晓辉; 刘涛; 李清; 陈晓辉; 毕开顺;【Author】 WANG Xiaohui,LIU Tao,LI Qing,CHEN Xiaohui,BI Kaishun(School of Pharmacy,Shenyang Pharmaceutical University,Shenyang 110016,China)【机构】 沈阳药科大学药学院; 沈阳药科大学药学院 辽宁沈阳110016; 辽宁沈阳110016;【摘要】 对蒙古黄芪中5种异黄酮类成分的含量进行了反相高效液相色谱法测定。色谱柱为D iam ons il C18柱,流动相为乙腈-水系统,梯度洗脱,检测波长230nm,柱温35℃。毛蕊异黄酮-7-O-β-D-葡萄糖苷在20.12~201.2m g/L、芒丙花素-7-O-β-D-葡萄糖苷在4.62~46.2m g/L、9,10-二甲氧基紫檀烷-3-O-β-D-葡萄糖苷在4.86~48.6m g/L、毛蕊异黄酮在9.24~92.4m g/L、芒丙花素在6.92~69.2m g/L时峰面积与浓度呈良好的线性关系,相关系数分别为0.999 2,0.999 7,0.999 7,0.999 5和0.999 5。5种成分的加样回收率均高于94%,相对标准偏差(RSD)小于3.2%(n=9)。该法简便快速,重复性良好,结果准确可靠,可用于黄芪药材中5种主要异黄酮类成分的含量测定。 http://ng1.17img.cn/bbsfiles/images/2012/07/201207301613_380608_2379123_3.jpg
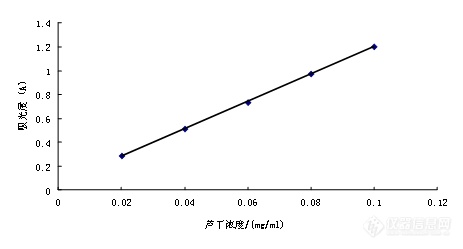
[align=center]从黄芩中提取黄酮类化合物的工艺研究[/align][align=center]西安国联质量检测技术股份有限公司[/align][align=center]食品事业部:李灿[/align][b]摘要:[/b]探讨超声波辅助法提取黄芩中总黄酮的最佳提取条件及对提取物的抗氧化性活性研究,这为黄芩作为天然抗氧化剂和功能性食品的开发利用提供理论基础和实验依据。[b][/b] 通过设计正交试验,采用超声波辅助法提取黄芩中总黄酮的最佳工艺条件条件,并通过对羟自由基、超氧自由基和DPPH自由基的清除效果研究其抗氧化活性。[b][/b]超声波辅助提取黄芩中总黄酮的最佳条件为:乙醇浓度为50%,时间为25min,料液比为1∶10,温度为30℃,黄芩总黄酮的提取率为3.25%。并且研究了黄芩提取物中的黄酮类物质对O[sub]2[/sub]-• 、• OH和DPPH自由基的抗氧化性能。研究结果表明洋葱提取物中黄酮类物质的抗氧化性较VC强。在浓度为0.0125mg/ml下,对羟基自由基的清除率为88.30%,对超氧基自由基的清除率为90.01%,对DPPH自由基的清除率为93.87%。[b]关键词[/b]:黄芩;超声波提取;总黄酮;抗氧化活性 [align=center][b] Study on extraction technology of flavonoids from Scutellaria[/b][/align][align=center]Li Can[/align][align=center] (Department of Chemistry and Chemical Engineering, Xi′an University of [/align][align=center]Arts and Science, Xi′an 710065)[/align][b]Abstract: [/b]To investigate the ultrasonic assisted extraction optimum extraction conditions of total flavonoids from Scutellaria and to extract antioxidant activity, which is a skullcap as a natural antioxidant and functional food development and utilization of theoretical and experimental evidence provided . [b][/b] Through orthogonal experiment, the optimum conditions using ultrasonic assisted extraction conditions of total flavonoids from Scutellaria, and to study its antioxidant activity by hydroxyl radicals, superoxide radicals and DPPH radical scavenging effect. Optimal conditions . [b] [/b]Ultrasonic assisted extraction of total flavonoids from Scutellaria: ethanol concentration of 50%, the time is 25min, solid-liquid ratio of 1:10, the temperature is 30 ℃, extraction of total flavonoids was 3.25%. And studied the extract of Scutellaria flavonoids on O2-• , • OH and DPPH radical antioxidant properties. The results show that the onion extract antioxidant flavonoids than VC strong. At a concentration of under 0.0125mg/ml, hydroxyl radical scavenging rate of 88.30% for super-group was 90.01% scavenging of DPPH radical scavenging rate was 93.87%.[b][color=#2b2b2b]Key Words[/color][/b][color=#2b2b2b]:[/color][color=#2b2b2b] [/color][color=#2b2b2b]Skullcap [/color][color=#2b2b2b]U[/color][color=#2b2b2b]ltrasonic extraction [/color][color=#2b2b2b]T[/color][color=#2b2b2b]otal flavonoids [/color][color=#2b2b2b]A[/color][color=#2b2b2b]ntioxidant activity[/color][b]1 前言[/b]黄岑主要生长在陕西秦岭,为常用中草药之一,性寒,味苦。具有清热燥湿,泻火解毒,止血安胎[sup][/sup]等功效,它的主要成分为黄酮类化合物[sup][/sup],黄酮类化合物主要存在于双子叶及裸子植物的叶、果、实、根、皮中,在植物中主要与糖结合成苷的形式存在[sup][/sup]。目前从黄酮类物质有很多种,黄酮类化合物的结构特点是具有 C[sub]6[/sub]- C[sub]3[/sub]- C[sub]6[/sub]的基本骨架,根据中间三碳链的氧化程度、B 环( 苯基) 连接位置( 2-或3-位) 以及三碳链是否呈环状等特点,主要有黄酮醇,二氢黄酮,二氢黄酮醇,黄烷,黄烷醇,异黄酮等,被广泛应用在医药、功能食品添加剂、兽药和农药等领域。在医药方面,根据其在心血管系统、内分泌系统、抗肿瘤方面的药理作用,很多以黄酮类成分为主的制剂已作为成药上市[sup][/sup]。在食品中它们应用于功能性食品添加剂,如天然甜味剂、天然抗氧化剂、天然色素等;应用于功能食品,如生物类黄酮口香糖、银杏叶袋泡茶等防衰、抗癌、提高免疫力食品;在兽药、农药等领域,现已开发出些具有特效功能的含有黄酮类化合物药品和驱虫、杀虫剂等[sup][/sup]。目前国内侧重于对黄酮类化合物的研究,但他们常被当作残渣而扔掉,因而就造成了黄芩的浪费,没有使黄芩得到充分利用,本文主要针对黄芩总黄酮的提取方法及其抗氧化能力测定方法进行研究,以期为黄芩黄酮类成分的进一步开发利用从黄岑中提取黄酮类化合物的方法有很多种,传统提取方法有煎煮法[sup][/sup]、有机溶剂提取法[sup][/sup]、浸渍法、渗漉法、回流提取法[sup][/sup]、水提法等,新的提取方法有超声波提取法、微波提取法、索氏提取法、超临界萃取法、大孔树脂吸附法、酶解法提取[sup][/sup]。黄芩黄酮的提取主要为溶剂萃取法,包括无机溶剂萃取法和有机溶剂萃取法。其主要原理是利用黄芩黄酮能溶于碱水或甲醇等有机溶剂的特性来提取黄芩中的黄酮[sup][/sup],考虑到该法提取时间长,提取率较低的缺点,我们采用超声波辅助提取法。因为超声波提取法是一种新型方法,它具有能耗低、效率高、不破坏有效成分的特点,在低温下可以强化水浸提效率,达到省时高效节能的目的,而且是目前广泛使用的方法。超声提取的主要理论依据是超声的空化效应、热效应和机械作用。当大能量的超声波作用于介质时,介质被撕裂成许多小空穴,这些小空穴瞬时闭合,并产生高达几千个大气压的瞬间压力,即空化现象。超声空化中微小气泡的爆裂会产生极大的压力,使植物细胞壁及整个生物体的破裂在瞬间完成,缩短了破碎时间,同时超声波产生的振动作用加强了胞内物质的释放、扩散和溶解,从而显著提高提取效率。因此本实验拟决定用超声波提取法来提取黄酮类化合物。黄酮类化合物的测定方法也多种多样,目前有薄层扫描法、紫外分光光度法、液相色谱法等[sup][/sup]。但是以上方法测定黄芩提取液中总黄酮的含量都比较繁琐,非黄酮类物质干扰比较大。由于Al[sup]3+[/sup]仅与黄酮类物质有特征反应,使用这种显色方法可以使黄酮类化合物溶液在510nm左右出现吸收峰,采用紫外分光光度法测定黄芩提取液中总黄酮含量,方法简单快速[sup][/sup]。对于黄酮类化合物的抗氧化性研究,国内外所做研究也比较多。方法可分为体外抗氧化与体内抗氧化,其中体外抗氧化运用较为广泛,体外抗氧化还可分为直接清除活性氧自由基、抑制油脂过氧化反应[sup][/sup]等;体内抗氧化是用受试物连续喂饲大鼠或小鼠1个月~3个月,然后处死动物,测定其血或组织(如肝、脑)中各物质的含量,同对照组进行比较,间接地说明受试物的抗氧化活性。采用体外抗氧化性研究,常用到的自由基有OH[sup] [/sup],O[sub]2[/sub][sup]-[/sup], DPPH等,由于直接清除活性自由基的方法易行且效果直观,本次实验采用该种方法。本实验将从两个方面研究黄芩黄酮类化合物。第一部分为黄芩总黄酮最佳提取方法的研究。本环节采取超声辅助提取法,采用料液比(A),乙醇浓度(B), 超声时间(C),超声温度(D)作为研究因素,采用四因素三水平,选择L[sub]9[/sub](3[sup]4[/sup])设计正交试验。用芦丁做标准曲线测定黄芩提取液中总黄酮的含量。第二部分为总黄酮类化合物抗氧化性的研究,采用对OH,O[sub]2[/sub][sup]-[/sup]自由基和DPPH自由基的清除作用研究其抗氧化性。[b]2 实验部分2.1 材料与仪器2.1.1 材料和试剂[/b] 黄芩(购于西安同仁堂大药房),芦丁(分析纯,上海试剂药品厂),亚硝酸钠(分析纯,成都市科龙化工试剂厂),硝酸铝(分析纯,成都市科龙化工试剂厂),氢氧化钠(分析纯,成都市科龙化工试剂厂),邻苯三酚(分析纯,成都市科龙化工试剂厂),盐酸(分析纯,天津市天力化学试剂有限公司),双氧水(天津市天力化学试剂有限公司),硫酸亚铁(分析纯,成都市科龙化工试剂厂),水杨酸(分析纯,天津市天力化学试剂有限公司),无水乙醇(分析纯,天津市天力化学试剂有限公司),三羟基甲基氨基甲烷(分析纯,天津市福晨化学试剂厂),邻二氮菲(分析纯,天津市福晨化学试剂厂),DPPH(购于阿拉丁试剂)。[b]2.1.2 仪器[/b] 高速粉碎机(FW80型,北京中兴伟业仪器有限公司);紫外可见分光光度计(722N,上海精密科学仪器有限公司) 电子天平(YP202W,上海精密科学仪器有限公司);循环水式多用真空泵(SHB-Ⅲ,郑州长城科工贸有限公司);超声波清洗机(11—1404,宁波新芝生物科技股份有限公司);智能型恒温鼓风干燥箱(CMD-20X型,上海琅轩试验设备有限公司);玻璃仪器气流烘干器(TH48SYBQ-1型,北京中兴伟业仪器有限公司)。[b]2.2实验方法2.2.1黄芩样品的制备[/b] 将黄芩在烘箱中60℃干燥8h,干燥后的黄芩用粉碎机粉碎成粉末,用分样筛(40目)筛分黄芩粉末,保证粉末均匀一致,密封保存,待用。[b]2.2.2 总黄酮的测定方法2.2.2.1 芦丁标准曲线的绘制[/b] 准确称取干燥至恒重的芦丁4.0mg 于小烧杯中,用50%乙醇溶解,并定容于25ml的容量瓶,摇匀,得浓度0.16mg/ml的标准液。准确吸取标准应用液0、1.0、2.0、3.0、4.0、5.0ml 于6 个10ml容量瓶中,与上述容量瓶中分别加入5% NaNO[sub]2[/sub]0.3ml,摇匀,放置6min后,分别加入10% Al(NO[sub]3[/sub])[sub]3[/sub] 溶液0.3ml,摇匀,放置6min后,再分别加入4% NaOH 溶液4ml,加50%乙醇定容至10ml,摇匀,以试剂空白为参比,放置10~15min,用紫外可见分光光度计进行全波长扫描,在最大吸收波长510nm处测定吸光度,得到吸光度Y与芦丁浓度X(mg/ml)间标准曲线回归方程。[b]2.2.2.2 提取液总黄酮含量的测定 [/b]准确称取1.00g黄芩粉末,在不同的提取条件下提取黄芩总黄酮,提取液用乙醇稀释定容至50ml。准确吸取提取液1.0ml于25ml容量瓶,按上述方法显色后测定吸光度,代入标准曲线回归方程中可以得到黄芩中黄酮类物质的含量(mg/ml),从而计算出黄芩中黄酮类物质的提取率,即:黄芩中黄酮类物质的提取率= ×100%[b]2.2.3 单因素试验[/b] 主要研究料液比、乙醇浓度、超声波时间、超声波温度4个因素,在保持其他因素相同的条件下分别进行单因素试验,研究各因素对黄芩总黄酮提取效果的影响,筛选最佳的提取条件。 准确称取黄芩粉末,在不同的条件下进行超声提取,提取液冷却后用乙醇定容,按照2.2.2的测定方法,计算黄芩中总黄酮的含量。[b]2.2.4 正交试验[/b]在单因素试验基础上,选择料液比、乙醇浓度、超声时间、超声温度4因素,设计L[sub]9[/sub](3[sup]4[/sup])正交试验,以总黄酮的含量为评价指标,确定黄芩总黄酮超声辅助法的最佳提取工艺。[b]2.2.5 总黄酮体外抗氧化性的研究2.2.5.1 对羟自由基清除作用的研究[sup][/sup][/b]原理:通过反应所产生的羟基自由基可将Fe[sup]2+[/sup]氧化为Fe[sup]3+[/sup], Fe[sup]2+[/sup]和邻二氮菲反应可产生有色络合物,向有色沉淀加入抗氧化剂后,其反应效果会相对减弱。羟基自由基对二价铁离子的氧化作用,会导致吸光值不断变化,从而评价样液消除羟基自由基的能力。步骤:取0.75 mmoL/L邻二氮菲溶液1 mL,加入不同浓度的样液,再加0.75 mmoL/L硫酸亚铁1 mL混匀,加0.75mmol/l的过氧化氢1 mL,于37 ℃ 水浴下,水浴60 min后,在536 nm处测其吸光度,所得吸光度A[sub]b[/sub]。 反应方程式:H[sub]2[/sub]O[sub]2[/sub] + Fe[sup]2+[/sup]=OH[sup]-[/sup] +OH + Fe[sup]3+ [/sup]清除率S(%)=「Ax- A[sub]b[/sub]]/[As- A[sub]b[/sub]] ×100% 其中 A[sub]b[/sub]:标准体系的吸光度 Ax:不含黄芩提取液的吸光度As:不含过氧化氢的标准体系吸光度本底吸光度[b]2.2.5.2 对超氧自由基清除作用的研究 [sup][/sup][/b] 原理:在碱性条件下,邻苯三酚能迅速发生自氧化反应,生成超氧阴离子自由和有色中间产物,且邻苯三酚自氧化速率与生成超氧阴离子自由基的浓度呈正相关,该有色中间产物在300nm处有一特征吸收峰。当加入抗氧化剂能催化超氧阴离子自由基与H[sup]+[/sup]结合生成O[sub]2[/sub]和H[sub]2[/sub]O[sub]2[/sub] ,从而阻止了中间有色产物积累,溶液在320nm 处的吸收减弱。因此可通过测定添加试样前后吸光度[i]A[/i]的变化来表示抗氧化剂对超氧阴离子自由基的清除效果。步骤:取0.05mol/L三羟甲基氨基甲烷盐酸缓冲液(pH =8.2)4.5mL,置于25℃水浴中预热20min,分别加入0.1mL试样和0.4mL2.5mmol/L邻苯三酚溶液,混匀后于25℃水浴中反应4min,加入8mol/L HCl溶液两滴终止反应,于波长299nm处测定吸光度As,空白对照组以相同体积的蒸馏水代替样品,并计算清除率。 清除率计算公式: S(%)=[(1-(As-A[sub]0[/sub] )/A[sub]b[/sub]]×100%其中 A[sub]b[/sub]:不含黄芩提取物的标准体系吸光度 As:标准体系的吸光度值 Ao:不含邻苯三酚的标准体系吸光度[b]2.2.5.3 对DPPH自由基清除作用的研究[sup][/sup] [/b]原理:DPPH 在有机溶液中是一种稳定的自由基,其乙醇溶液呈深紫色,当 DPPH 溶液中加入自由基清除剂时,其孤对电子被配对,溶液颜色变浅,可由此来检测自由基的清楚状况,从而评价物质的抗氧化能力。步骤:将样品储备液适当稀释得到不同浓度的黄芩黄酮溶液。 向一系列 10 mL比色管中加入 3.5 mL 1.0×10[sup]-4[/sup]mol/L 的 DPPH 溶液和 0.5 mL 样品液,摇匀避光反应30 min,与波长517 nm下测定吸光度 A s。空白对照组以无水乙醇代替样品,并计算清除率。清除率计算公式: 清除率S(%)=[(1-(As-A[sub]0[/sub] )/A[sub]b[/sub]]×100% 其中 A[sub]b[/sub]:不含黄芩提取物的标准体系吸光度 A[sub]s[/sub]:标准体系的吸光度值 A[sub]0[/sub]:不含DPPH的标准体系吸光度[b]3. 结果与分析 3.1 芦丁标准曲线[/b]由图可得,芦丁在0.02—0.10mg/ml浓度范围内与吸光度呈良好的线性关系,R[sup]2[/sup]= 0.9998。回归方程为Y= 11.47X+ 0.0554 [align=center]表1 芦丁浓度与吸光度的关系[/align][table][tr][td][align=center]序号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]芦丁浓度/(mg/ml)[/align][/td][td][align=center]0.02[/align][/td][td][align=center]0.04[/align][/td][td][align=center]0.06[/align][/td][td][align=center]0.08[/align][/td][td][align=center]0.10[/align][/td][/tr][tr][td][align=center]吸光度(A)[/align][/td][td][align=center]0.288[/align][/td][td][align=center]0.514[/align][/td][td][align=center]0.736[/align][/td][td][align=center]0.976[/align][/td][td][align=center]1.204[/align][/td][/tr][/table][align=center] [/align][align=center] [/align][align=center] [/align][align=center][img=,463,249]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091813421003_7187_2904018_3.png!w463x249.jpg[/img] [/align][align=center]图1 芦丁标准曲[/align]Fig.1 Standard curve of rutin[b]3.2 总黄酮提取条件的优化3.2.1 料液比对黄酮类化合物提取效果的影响[/b]在料液比为1:6,1:8,1:10,1:12,1:14时,50%乙醇作为提取剂,超声波时间为20min,超声波温度为60℃,冷却后采用超声波提取法提取黄芩中黄酮类化合物含量,研究料液比对提取效果的影响。[align=center]表2 料液比与提取率的关系[/align][align=center][img=,394,250]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091815178933_5515_2904018_3.png!w394x250.jpg[/img][/align][align=center] 图2 料液比对黄芩黄酮提取的影响[/align][align=center]Fig.2 Solid-liquid ratio on the extraction of flavonoids from Scutellaria impact[/align]由图2可见,随着料液比的增加,黄酮类化合物的提取率也逐渐升高,当料液比为1:10时,黄酮类化合物的提取率达到最高值,继续增加料液比,提取率会有一定的降低。在一定范围内料液比的增加有利于物料中黄酮类物质的溶出,但料液比过大的时候,会导致溶液浓度太小,从而影响到黄酮类物质对超声波能的吸收,导致黄酮得率下降。因此选定料液比在1:10的条件下进行实验。[b]3.2.2 乙醇浓度对黄酮类化合物提取效果的影响[/b]当乙醇浓度为30%,40%,50%,60%,70%时作为提取剂,超声波时间为20min,超声波温度为60℃,料液比为1:10的条件下,冷却后采用超声波提取法提取液中总黄酮含量,研究料液比对提取效果的影响。结果如图2所示[align=center]表3 乙醇浓度与提取率的关系[/align][table][tr][td][align=center]序号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]乙醇浓度(%)[/align][/td][td][align=center]30[/align][/td][td][align=center]40[/align][/td][td][align=center]50[/align][/td][td][align=center]60[/align][/td][td][align=center]70[/align][/td][/tr][tr][td][align=center]提取率(%)[/align][/td][td][align=center]2.08[/align][/td][td][align=center]2.44[/align][/td][td][align=center]3.18[/align][/td][td][align=center]2.15[/align][/td][td][align=center]1.28[/align][/td][/tr][/table][align=center][img=,457,289]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091815413326_3128_2904018_3.png!w457x289.jpg[/img][/align]图3 乙醇浓度对黄芩总黄酮提取的影响[align=center] Fig.3 The effect of ethanol concentration on the extraction of flavonoids from Scutellaria[/align]由图3可见,随着乙醇浓度的增加,黄酮类化合物的提取率逐渐升高,在乙醇浓度为50%时提取率最高,再增加乙醇浓度,提取率逐渐降低。这主要是随着乙醇浓度的增加导致溶液极性的改变,使提取液中杂质含量增加,因此选择50%的乙醇溶液作为提取剂。[b]3.2.3 超声波时间对黄酮类化合物提取效果的影响[/b]当超声波时间为5min,10min,15min,20min,25min,料液比为1:10,乙醇浓度为50%,超声波温度为60℃的条件下,冷却后采用超声波提取法提取液中总黄酮含量,研究料液比对提取效果的影响。[align=center]表4 超声波时间与提取率的关系[/align][table][tr][td][align=center]序号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]超声波时间(min)[/align][/td][td][align=center]5[/align][/td][td][align=center]10[/align][/td][td][align=center]15[/align][/td][td][align=center]20[/align][/td][td][align=center]25[/align][/td][/tr][tr][td][align=center]提取率(%)[/align][/td][td][align=center]1.67[/align][/td][td][align=center]1.82[/align][/td][td][align=center]1.93[/align][/td][td][align=center]2.19[/align][/td][td][align=center]2.08[/align][/td][/tr][/table][align=center][img=,420,258]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091815572952_9256_2904018_3.png!w420x258.jpg[/img][/align]图4 超声时间对黄芩总黄酮提取的影响[align=center]Fig.4 Ultrasonic time of total flavonoids extracted[/align]由图4可见,随着超声波时间的延长,黄酮类化合物提取率逐渐升高,在20min时提取率最高,继续延长超声波提取时间提取率几乎不变,主要是因为在初期,黄芩中黄酮类化合物没有完全浸提到溶剂中,而随着时间的增加,黄酮类化合物逐渐完全溶于提取剂中,因此提取率几乎不变。所以选择超声波时间为20min时进行实验。[b]3.2.4 超声波温度对黄酮类化合物提取效果的影响[/b]当超声波温度为20℃,30℃,40℃,50℃,60℃,料液比为1:10,乙醇浓度为50%,超声波时间为20min的条件下,冷却后采用超声波提取法提取液中总黄酮含,研究料液比对提取效果的影响。[align=center]表5 超声波温度与提取率的关系[/align][table][tr][td][align=center]序号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]超声波温度(℃)[/align][/td][td][align=center]20[/align][/td][td][align=center]30[/align][/td][td][align=center]40[/align][/td][td][align=center]50[/align][/td][td][align=center]60[/align][/td][/tr][tr][td][align=center]提取率(%)[/align][/td][td][align=center]1.87[/align][/td][td][align=center]2.34[/align][/td][td][align=center]2.44[/align][/td][td][align=center]2.25[/align][/td][td][align=center]2.31[color=#ff0000] [/color][/align][/td][/tr][/table][align=center][img=,360,256]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091816171242_5784_2904018_3.png!w360x256.jpg[/img][/align][align=center] [/align][align=center] [/align]图5 超声温度对黄芩黄酮提取的影响[align=center]Fig.5 Skullcap ultrasonic extraction temperature on impact[/align] 由图5可见,随着超声波温度的升高,黄酮类化合物提取率逐渐升高,在40℃时提取率最高,继续升高超声波提取温度,提取率反而略有下降。高温提取的过程是先使物料升温,保持一定时间后,利用温度使细胞壁破碎,乙醇溶剂溶入细胞内部,黄酮充分溶解,再继续升高温度,反而使更多的杂质释放出来,导致黄酮提取率不再上升。所以选择超声波温度为40℃进行实验。[b]3.3 正交试验确定最佳工艺3.3.1 正交试验结果[/b]通过上述单因素试验,得出各个单因素的最佳条件,其中料液比为1:10,乙醇浓度为50%,超声时间为20min,超声温度为40℃。选择料液比、乙醇浓度、超声波时间、超声波温度4因素3水平,设计L[sub]9[/sub](3[sup]4[/sup])正交试验,因素与水平见表1,试验结果见表2为了进一步判断上述4类因素对试验结果的影响是否存在,将以正交试验数据进行方差分析,找出这些因素中起主导作用的来源。表1 正交试验因素及水平表Tab 1 Factors and levels of the orthogonal tests[table][tr][td=1,2]水平[/td][td] 因素[/td][/tr][tr][td]A B C D料液比(g/ml) 乙醇浓度(%) 超声时间(s) 超声温度(℃)[/td][/tr][tr][td=2,1]1 1:8 40 15 302 1:10 50 20 403 1:12 60 25 50[/td][/tr][/table]表2 正交试验结果及分析 Tab 2 The results and analysis of orthogonal tests [table][tr][td=1,2]试验号[/td][td] 因素[/td][td=1,2]提取量(%)[/td][/tr][tr][td]A B C D料液比(g/ml) 乙醇浓度(%) 超声时间(s) 超声温度(℃)[/td][/tr][tr][td=3,1]1 1:8 40 15 30 2.622 1:8 50 20 40 2.903 1:8 60 25 50 2.764 1:10 50 25 30 3.255 1:10 60 15 40 2.626 1:10 40 20 50 2.507 1:12 60 20 30 2.408 1:12 40 25 40 2.589 1:12 50 15 50 2.85K[sub]1[/sub]/3 2.76 2.57 2.70 2.76K[sub]2[/sub]/3 2.79 3.00 2.60 2.70K[sub]3[/sub]/3 2.61 2.59 2.86 2.70R 0.18 0.43 0.26 0.06[/td][/tr][/table]由表1、2可知,主次因素由极差大小确定:B>C>A>D,即影响黄芩总黄酮提取效率的因素贡献率为乙醇浓度>超声时间>料液比>超声温度。以总黄酮含量为评价指标,得最佳提取工艺条件为A[sub]2[/sub]B[sub]2[/sub]C[sub]3[/sub] D[sub]1[/sub],即乙醇浓度为50%、超声时间为25min、料液比为1∶10、超声温度为30℃。最佳条件为正交表中的第四组,因此测抗氧化性实验选择此组数据。[b]3.4 总黄酮的抗氧化性3.4.1 对羟自由基的清除作用[/b][align=center]表6 提取液浓度对羟基自由基清除率[/align][table][tr][td][align=center]序号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]提取液浓度/(mg/ml)[/align][/td][td][align=center]0.0025[/align][/td][td][align=center]0.0050[/align][/td][td][align=center]0.0075[/align][/td][td][align=center]0.0100[/align][/td][td][align=center]0.0125[/align][/td][/tr][tr][td][align=center]VC清除率(%)[/align][/td][td][align=center]20.54[/align][/td][td][align=center]42.88[/align][/td][td][align=center]59.39[/align][/td][td][align=center]74.44[/align][/td][td][align=center]79.09[/align][/td][/tr][tr][td][align=center]黄酮清除率(%)[/align][/td][td][align=center]40.39[/align][/td][td][align=center]67.21[/align][/td][td][align=center]78.42[/align][/td][td][align=center]85.29[/align][/td][td][align=center]88.30[/align][/td][/tr][/table][align=center][img=,360,256]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091816376703_5430_2904018_3.png!w360x256.jpg[/img][/align]图6 黄芩总黄酮对羟自由基的清除Fig.6 Scutellaria Flavonoids on Scavenging of Hydroxyl Radicals黄芩总黄酮对羟自由基的清除作用,结果见图6。由图6可知,黄芩总黄酮对羟基自由基具有一定的清除作用。在相同的浓度范围下,清除能力大小为:提取物VC溶液。在0.0025—0.0125mg/ml浓度下,各溶液的清除能力都随浓度的增大而增大。当提取液浓度为0.0125mg/ml下,黄芩提取液的清除率达到了88.30%。3.4.2 [b]对超氧自由基的清除作用[/b][align=center]表7 提取液浓度对超氧基自由基清除率[/align][table][tr][td][align=center]序号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]提取液浓度/(mg/ml)[/align][/td][td][align=center]0.0025[/align][/td][td][align=center]0.0050[/align][/td][td][align=center]0.0075[/align][/td][td][align=center]0.0100[/align][/td][td][align=center]0.0125[/align][/td][/tr][tr][td][align=center]VC清除率(%)[/align][/td][td][align=center]26.77[/align][/td][td][align=center]43.09[/align][/td][td][align=center]61.73[/align][/td][td][align=center]78.69[/align][/td][td][align=center]80.20[/align][/td][/tr][tr][td][align=center]黄酮清除率(%)[/align][/td][td][align=center]49.81[/align][/td][td][align=center]75.29[/align][/td][td][align=center]84.38[/align][/td][td][align=center]89.21[/align][/td][td][align=center]90.01[/align][/td][/tr][/table]黄芩总黄酮对超氧自由基的清除作用,结果见图7。由图7可知,黄芩总黄酮对邻苯三酚自氧化产生的超氧自由基有一定的清除作用,其清除率随浓度的增大而增大。在相同的浓度范围下,清除能力大小为:提取物VC溶液。各溶液的清除能力都随浓度的增大而增大。当提取液浓度为0.0125mg/ml下,黄芩提取液的清除率达到了90.01%。3.4.3 [b]对DPPH自由基的清除作用[/b][align=center]表8 提取液浓度对DPPH自由基清除率[/align][table][tr][td][align=center]序号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]提取液浓度/(mg/ml)[/align][/td][td][align=center]0.0025[/align][/td][td][align=center]0.0050[/align][/td][td][align=center]0.0075[/align][/td][td][align=center]0.0100[/align][/td][td][align=center]0.0125[/align][/td][/tr][tr][td][align=center]Vc清除率(%)[/align][/td][td][align=center]27.36[/align][/td][td][align=center]52.41[/align][/td][td][align=center]79.98[/align][/td][td][align=center]80.49[/align][/td][td][align=center]81.31[/align][/td][/tr][tr][td][align=center]黄酮清除率(%)[/align][/td][td][align=center]55.7[/align][/td][td][align=center]82.3[/align][/td][td][align=center]89.78[/align][/td][td][align=center]93.74[/align][/td][td][align=center]93.81[/align][/td][/tr][/table][b] [/b]黄芩总黄酮对DPPH的清除作用,结果见图8。由图8可知,黄芩总黄酮对DPPH有一定的清除作用,其清除率随浓度的增大而增大。相同的浓度范围下,清除能力大小为:提取物VC溶液。各溶液的清除能力都随浓度的增大而增大。当提取液浓度为0.0125mg/ml下,黄芩提取液的清除率达到了93.81%。[b]4.总结[/b]1.通过单因素实验,得出各个单因素的最佳条件,其中料液比为1:10,乙醇浓度为50%,超声时间为20min,超声温度为40℃,为正交试验奠定了基础。然后用设计正交试验,确定了超声辅助法提取黄芩总黄酮的最佳工艺条件:乙醇浓度为50%、超声时间为25min、料液比为1∶10、超声温度为30℃。黄芩总黄酮的提取率为3.25%。2.本实验分别就黄芩提取物对羟基自由基,超氧阴离子自由基和DPPH自由基的抗氧化性进行了测定,并与VC进行了对比实验,得到如下结论:在0.0025—0.0125mg/ml浓度下,提取物对各自由基清除能力为:DPPH O[sub]2[/sub][sup]-[/sup]• • OH ,同浓度黄芩提取物清除能力普遍高于VC溶液,黄芩黄酮提取液和VC溶液对自由基清除率随其浓度的增大而增大。在浓度为0.0125mg/ml下,对羟基自由基的清除率为88.30%,对超氧基自由基的清除率为90.01%,对DPPH自由基的清除率为93.87%,由此可知黄芩总黄酮是一种天然有效的自由基清除剂。黄芩中黄酮类化合物的利用已经有一定的规模,但黄芩中黄酮化合物的提取方法和工艺尚未成熟,所以充分利用黄芩资源是我国药用研究的科学发展方向。基于提取率、成本等因素的影响,通过对各种因素的比较分析,从而探索开发出适合工业化生产应用的方案,提高黄芩利用率,仍是研究工作的重点之一。随着人们对健康的日渐重视,因黄芩中的黄酮化合物有着极高的药用营养及良好的保健作用,具有极为广阔的市场前景[b]。[/b]本文旨在研究黄芩中黄酮类物质的提取工艺及其体外抗氧化活性,为黄芩中黄酮类化合物作为天然抗氧化剂和功能性药品得到开发利用提供理论基础和实验依据。[align=center][b] [/b][/align] 刘雄,高建德.黄芩研究进展.甘肃中医学院,2007,24(2):46-50. 罗小文.黄芩中黄酮类成分提取工艺研究进展.中国现代中药.2010,12(7):5-8. 张睿,徐雅琴,时阳.黄酮类化合物提取工艺研究.食品与机械.2003,15(1):21-22. 梁丹,张保东.黄酮类化合物提取和分离方法研究进展.周口师范学院学报,2007,24(5):87-89. 龙春,高志强,陈凤鸣,等.黄酮类化合物的结构-抗氧化活性研究进展.重庆文理学院学报.2006,5(2):13-15. 刘雄,高建德.黄岑研究进展.甘肃中医学院学报,2007,24(2):46-50. 郭雪峰, 岳永德. 黄酮类化合物的提取-分离纯化和含量测定方法的研究进展. 安徽农业科学. 2007, 35(26): 8083- 8086.. 唐德智.黄酮类化合物的提取、分离、纯化研究进展.中药与天然产物,2009,21(12):101-104.. 张岩, 曹国杰, 张燕,等. 黄酮类化合物的提取以及检测方法的研究进展.天食品研究与开发,2008,29(1):154-157. 韩雅慧,陶宁萍.甘草黄酮提取及其抗氧化能力测定方法研究进展.山西农业科学,2010, 38(11):89- 93. 崔永明,余龙江,等. 甘草总黄酮的提取技术及其抑菌活性研究.中药材,2006, 29(8): 838-840. 孙墨珑, 宋湛谦, 方桂珍. 核桃楸总黄酮的提取工艺.东北林业大学学报, 2006, 34 (1) : 38 - 39. 徐清萍,钟桂,芳孟君. 抗氧化剂抗氧化方法研究进展.食品工程,2007,6(7):23-25. 安卓,贾昌喜.苦苣菜总黄酮提取、纯化工艺优化抗氧化活性研究.食品科学. 赵新淮.大黄醇提取物对三种自由基的清除能力的研究.东北农业大学学报.1998,29(3):284-288 杨立琛,李荣.花椒叶黄酮的微波提取及其成分分析.食品科学. CHI Ru-an,ZHOU Fang,HUANG Kun,ZHANG Yue-fei.Separation of baicalin form Scutellaria Baicalensis Georgi with polyamide.Key Laboratory for Green Chemical Process of Ministry of Education.2008,15(1):606-611.
食用以苹果、茶、西兰花等为代表富含类黄酮的食物,可预防癌症和心脏病,特别是对吸烟和饮酒者更有效果。