克百威和丙硫克百威是同一种物质吗?有的资料上是测克百威的。而日本有限制的是丙硫克百威。
第一次做农残中丁硫克百威的检测。质谱优化的离子对的质量数跟标准上的一致,质谱段进丁硫克百威的标准品可以正常出峰。再用液相进样的时候丁硫克百威的两个离子对都不出峰,反而出的是克百威的离子对。我又用克百威单标、丁硫克百威单标和两者的混标进样,出的峰都是克百威。各位老师帮忙看一下是哪里除了问题?流动相: 乙腈 0.2%乙酸水 梯度洗脱 采集时间20min质谱是 AB 5500

[align=center]蔬菜中敌百虫、丙溴磷、灭多威、克百威、[/align][align=center]敌敌畏残留的快速检测[/align][align=center]1 范围[/align]本方法规定了蔬菜中敌百虫、丙溴磷、灭多威、克百威、敌敌畏残留的快速检测方法。本方法适用于油菜、菠菜、芹菜、韭菜等蔬菜中敌百虫、丙溴磷、灭多威、克百威、敌敌畏残留的快速测定。[align=center]酶抑制(率)法(分光光度法)[/align]2 原理在一定条件下,有机磷和氨基甲酸酯类农药对胆碱酯酶正常功能有抑制作用,其抑制率与农药的浓度呈正相关。正常情况下,酶催化神经传导代谢产物(乙酰胆碱)水解,其水解产物与显色剂反应,产生黄色物质,用分光光度计在412nm处测定吸光度随时间的变化值,计算出抑制率。3 试剂和材料除另有规定外,本方法所用试剂均为分析纯,水为GB/T 6682规定的二级水。3.1 试剂3.1.1 丙酮(CH[sub]3[/sub]COCH[sub]3[/sub])。3.1.2 磷酸氢二钾(K[sub]2[/sub]HPO[sub]4[/sub])。3.1.3 磷酸二氢钾(KH[sub]2[/sub]PO[sub]4[/sub])。3.1.4 5,5-二硫代双(2-硝基苯甲酸)(C[sub]14[/sub]H[sub]8[/sub]N[sub]2[/sub]O[sub]8[/sub]S[sub]2[/sub])。3.1.5 碳酸氢钠(NaHCO[sub]3[/sub])。3.1.6 碘化乙酰硫代胆碱( C[sub]7[/sub]H[sub]16[/sub]INOS)。3.1.7 pH8.0缓冲溶液:分别称取11.9 g无水磷酸氢二钾及3.2 g磷酸二氢钾,溶解于1000 mL水中,混匀。3.1.8 显色剂:分别取160 mg 5,5-二硫代双(2-硝基苯甲酸)(DTNB)和15.6 mg碳酸氢钠,用20 mL缓冲溶液溶解,4 ℃冰箱中保存。3.1.9 底物:取125 mg碘化乙酰硫代胆碱,加15 mL蒸馏水溶解,摇匀后置于4 ℃冰箱中保存备用。保存期不超过两周。3.1.10 乙酰胆碱酯酶:4 ℃冰箱中保存备用。3.2 参考物质3种有机磷和2种氨基甲酸酯类农药参考物质的中文名称、英文名称、CAS登录号、分子式、相对分子质量见表1,纯度均≥98%。[align=center]表1 有机磷和氨基甲酸酯类参考物质中文名称、英文名称、[/align][align=center]CAS登录号、分子式、相对分子质量[/align] [table][tr][td] [align=center]序号[/align] [/td][td] [align=center]中文名称[/align] [/td][td] [align=center]英文名称[/align] [/td][td] [align=center]CAS登录号[/align] [/td][td] [align=center]分子式[/align] [/td][td] [align=center]相对分子质量[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]克百威[/align] [/td][td] [align=center]Carbofuran[/align] [/td][td] [align=center]1563-66-2[/align] [/td][td] [align=center]C[sub]12[/sub]H[sub]15[/sub]NO[sub]3[/sub][/align] [/td][td] [align=center]221.25[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]灭多威[/align] [/td][td] [align=center]Methomyl[/align] [/td][td] [align=center]59669-26-0[/align] [/td][td] [align=center]C[sub]5[/sub]H[sub]10[/sub]N[sub]2[/sub]O[sub]2[/sub]S[/align] [/td][td] [align=center]162.23[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]丙溴磷[/align] [/td][td] [align=center]profenofos[/align] [/td][td] [align=center] 41198-08-7[/align] [/td][td] [align=center]C[sub]11[/sub]H[sub]15[/sub]BrClO[sub]3[/sub]PS[/align] [/td][td] [align=center]373.63[/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]敌敌畏[/align] [/td][td] [align=center]Dichlorvos[/align] [/td][td] [align=center]62-73-7[/align] [/td][td] [align=center] C[sub]4[/sub]H[sub]7[/sub]Cl[sub]2[/sub]O[sub]4[/sub]P [/align] [/td][td] [align=center]220.98[/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]敌百虫[/align] [/td][td] [align=center]Dipterex[/align] [/td][td] [align=center]52-68-6 [/align] [/td][td] [align=center]C[sub]4[/sub]H[sub]8[/sub]Cl[sub]3[/sub]O[sub]4[/sub]P[/align] [/td][td] [align=center]257.44[/align] [/td][/tr][/table]3.3 标准溶液的配制3.3.1 克百威、灭多威、敌敌畏、敌百虫标准储备液(1000 μg/mL):冷藏、避光、干燥条件下保存。3.3.2 丙溴磷标准储备液(100 μg/mL):冷藏、避光、干燥条件下保存。3.3.3 克百威、灭多威、敌敌畏、敌百虫标准中间液A(100 μg/mL):精密移取上述标准储备液(1000 μg/mL)(3.3.1)各1mL,分别置于10mL容量瓶中,用丙酮(3.1.1)稀释至刻度,摇匀,制成浓度为100μg/mL的标准液A。3.3.4 克百威、灭多威、敌敌畏、敌百虫、丙溴磷标准中间液B(1 μg/mL):精密移取标准中间液A(100 μg/mL)(3.3.3)及丙溴磷标准储备液(100μg/mL)(3.3.2)各1 mL,分别置于100 mL容量瓶中,用缓冲溶液(3.1.7)稀释至刻度,摇匀,制成浓度为1μg/mL的标准中间液B。4 仪器和设备4.1 恒温水浴锅。4.2 天平:感量为0.1g。4.3 分光光度计或相应商品化测定仪。4.4 环境条件:温度15℃~35 ℃,湿度≤80%。5 分析步骤5.1 试样的提取5.1.1 整株提取法选取韭菜、芹菜有代表性的样品,擦去表面泥土,称取试样3 g(精确至0.1g)置于表面皿中,加入10 mL缓冲液(3.1.7),残缺面不得接触缓冲液,轻轻振摇50 次,静置2 min以上,取上清液备用。5.1.2 整体测定法选取油菜、菠菜有代表性的样品,擦去表面泥土,剪成1 cm左右见方碎片,称取3 g(精确至0.1 g)放入离心管中,加入10 mL缓冲溶液(3.1.7),振摇50 次,静置2min以上,倒出提取液,静置3 min~5 min,待用。5.2 测定步骤5.2.1 对照液的测定先于反应管中加入3 mL缓冲溶液(3.1.7),再加入适量酶液、0.1 mL显色剂,摇匀后于37 ℃水浴锅中放置15 min。加入0.1 mL底物摇匀,立即测定吸光度,3min后再测定一次,记录反应3min的吸光度值的变化∆ A[sub]0[/sub]。5.2.2 样品液的测定先于反应管中加入3 mL提取液,其他操作与对照液操作(5.2.1)相同,记录反应3 min的吸光度值的变化∆ A[sub]t[/sub]。5.3 质控试验每次测定应同时进行空白试验和加标质控试验。5.3.1 空白试验称取空白试样,按照5.1和5.2步骤与样品同法操作。5.3.2 加标质控试验5.3.2.1 韭菜、芹菜加标实验取空白试样,擦去表面泥土,称取5份试样各3g(精确至0.1 g)置于表面皿中,分别加入检出限水平的有机磷和氨基甲酸酯类标准中间液B(1μg/mL)(3.3.4),加入10mL缓冲液(3.1.7),残缺面不得接触缓冲液,轻轻振摇50 次,静置2min以上,取上清液备用。其余操作按照5.2步骤同法操作。5.3.2.2 油菜、菠菜加标实验取空白试样,擦去表面泥土,剪成1 cm左右见方碎片,称取5 份试样各3 g(精确至0.1g)放入小离心管中,分别加入检出限水平的有机磷和氨基甲酸酯类标准中间液 B(1μg/mL)(3.3.4),加入10mL缓冲溶液(3.1.7),振摇50 次,静置2min以上,倒出提取液,静置3 min~5 min,待用。其余操作按照5.2步骤同法操作。6 结果的表述6.1 结果计算抑制率(%)=[(∆ A[sub]0[/sub]-∆ A[sub]t[/sub])/∆ A[sub]0[/sub]]×100式中:∆ A[sub]0[/sub][sub]───[/sub]对照溶液反应3 min吸光度的变化值;∆ A[sub]t[/sub][sub]───[/sub]样品溶液反应3 min吸光度的变化值;6.2 结果判定结果以酶被抑制的程度(抑制率)表示。当抑制率≥50%时,表示蔬菜中有机磷和氨基甲酸酯类农药残留高于检测限,判定为阳性,阳性结果的样品需要重复检验2 次以上。6.3 质控试验要求空白试验测定结果应为阴性,加标质控试验测定结果应均为阳性。7 结论当检测结果为阳性时,应采用其他分析方法进行确证,进一步确定农药品种和含量。8 性能指标8.1 检测限:敌百虫0.1mg/kg,丙溴磷0.5 mg/kg,灭多威0.2 mg/kg,克百威0.02 mg/kg,敌敌畏0.2 mg/kg。8.2 灵敏度:灵敏度应≥95%8.3 特异性:特异性应≥85%。8.4 假阴性率:假阴性率应≤5%。8.5 假阳性率:假阳性率应≤15%。注:1.性能指标计算方法见附录A。 2.吸光度变化∆ A[sub]0[/sub]值应控制在0.2~0.3之间。具体的酶量,应根据产品说明书上标识的使用量,测定∆ A[sub]0[/sub]值。根据测定值,增加或减少酶量,使∆ A[sub]0[/sub]值控制在0.2~0.3之间。[align=center]检测卡法[/align]9 原理样品中的有机磷和氨基甲酸酯类农药残留经缓冲液提取,有机磷和氨基甲酸酯类农药对胆碱酯酶(白色药片)有抑制作用,抑制胆碱酯酶催化靛酚乙酸酯(红色药片)水解为乙酸与靛酚(蓝色),从而导致速测卡颜色深浅的变化。通过空白颜色比较,对样品中有机磷和氨基甲酸酯类农药进行定性判定。10 试剂和材料除另有规定外,本方法所用试剂均为分析纯,水为GB/T 6682规定的二级水。10.1 试剂10.1.1 丙酮(CH[sub]3[/sub]COCH[sub]3[/sub])。10.1.2 磷酸氢二钾(K[sub]2[/sub]HPO[sub]4[/sub])。10.1.3 磷酸二氢钾(KH[sub]2[/sub]PO[sub]4[/sub])。10.1.4 pH8.0缓冲溶液:分别称取11.9 g无水磷酸氢二钾及3.2 g磷酸二氢钾,溶解于1000 mL水中,混匀。10.2 参考物质同3.2。10.3 标准溶液的配制同3.3。10.4 固化有胆碱酯酶和靛酚乙酸酯试剂的纸片(检测卡)。11 仪器和设备11.1 恒温水浴锅。11.2 天平:感量为0.1 g。11.3 环境条件:温度15℃~35 ℃,湿度≤80%。12 分析步骤12.1 试样的提取12.1.1 整株提取法选取韭菜、芹菜有代表性的样品,擦去表面泥土,称取试样3 g(精确至0.1g)置于表面皿中,加入10mL缓冲液(10.1.4),残缺面不得接触缓冲液,轻轻振摇50 次,静置2min以上。12.1.2 整体测定法选取油菜、菠菜有代表性的样品,擦去表面泥土,剪成1 cm左右见方碎片,称取3 g(精确至0.1 g)放入小离心管中,加入10 mL缓冲溶液(10.1.4),振摇50 次,静置2min以上。12.2 测定步骤吸取2 滴左右待测液于白色药片反应区域,在37 ℃恒温装置中放置15 min进行预反应,预反应后的药片表面必须保持湿润。将速测卡对折,手捏3 min或置于37 ℃恒温装置3min,保证红色药片反应区域与白色药片反应区域完全叠合发生反应。每次测定需有一个缓冲溶液的空白对照。12.3 质控试验每次测定应同时进行空白试验和加标质控试验。12.3.1 空白试验称取空白试样,按照 12.1 和 12.2 步骤与样品同法操作。12.3.2 加标质控试验12.3.2.1 韭菜、芹菜取空白试样,擦去表面泥土,称取5份试样各3g (精确至0.1g)置于表面皿中,分别加入检出限水平的有机磷和氨基甲酸酯类标准中间液B(1μg/mL)(3.3.4),按照12.1和12.2步骤与样品同法操作。12.3.2.2 油菜、菠菜选取空白试样,擦去表面泥土,剪成1 cm左右见方碎片,称取5份试样各3 g(精确至0.1g)放入小离心管中,分别加入检出限水平的有机磷和氨基甲酸酯类标准中间液 B(1μg/mL)(3.3.4),按照12.1和12.2步骤与样品同法操作。13 结果判定白色药片区域不变色或略有浅蓝色为阳性结果;白色药片区域变为天蓝色或与空白对照卡相同,为阴性结果。通过对比空白和样品白色药片区域的颜色变化进行结果判定。目视判定示意图见图1。[img=,524,323]https://ng1.17img.cn/bbsfiles/images/2019/04/201904161528477750_5223_2166779_3.png!w524x323.jpg[/img]13.1 无效白色药片区域干燥,表明取样量偏少,检测结果无效。13.2 阴性样品白色药片区域颜色比空白对照卡颜色颜色相当或为天蓝色,表明样品中有机磷和氨基甲酸酯类农药残留低于方法检测限,判定为阴性。13.3 阳性样品白色药片区域不变色或略有浅蓝色,表明样品中有机磷和氨基甲酸酯类农残高于检测限,判定为阳性。1.1 质控试验要求空白试验测定结果应为阴性,加标质控试验测定结果应均为阳性。2 结论当检测结果为阳性时,应采用其他分析方法进行确证,进一步确定农药品种和含量。3 性能指标3.1 检测限:敌百虫0.1mg/kg,丙溴磷0.5 mg/kg,灭多威0.2 mg/kg,克百威0.02 mg/kg,敌敌畏0.2 mg/kg。3.2 灵敏度:灵敏度应≥95%3.3 特异性:特异性应≥85%。3.4 假阴性率:假阴性率应≤5%。3.5 假阳性率:假阳性率应≤15%。注:性能指标计算方法见附录A。4 其他葱、蒜、萝卜、韭菜、芹菜、香菜、茭白、蘑菇及番茄汁液中,含有对酶有影响的植物次生物质,容易产生假阳性。处理这类样品时,采取整株蔬菜浸提。对一些含叶绿素较高的蔬菜,也可采取整株蔬菜浸提的方法,减少色素的干扰。本方法所述试剂、试剂盒信息及操作步骤是为给方法使用者提供方便,在使用本方法时不做限定。方法使用者在使用替代试剂、试剂盒或操作步骤前,须对其进行考察,应满足本方法规定的各项性能指标。本方法参比标准为 NY/T 761—2008 《蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》。
对天敌和有益生物毒性较低,即克百威农药低毒化衍生物,属高效安全、使用方便的杀虫杀螨剂,是剧毒农药克百威较理想的替代品种之一。其杀伤力强,见效快,具有胃毒及触杀作用。特点是脂溶性、内吸性好、渗透力强、作用迅速、残留低、有较长的残效、使用安全等,对成虫及幼虫均有效,对作物无害。可防治柑橘等水果及蔬菜、玉米、棉花、水稻、甘蔗等多种经济作物害虫,对蚜虫的防治效果尤为优异。如:柑桔锈壁虱、蚜虫、潜叶娥、介壳虫,棉花蚜虫、棉铃虫、棉叶蝉,果树蚜虫,蔬菜蚜虫、蓟马,甘蔗蔗螟、玉米蚜虫、蝽蟓、茶树蚜虫、小绿叶蝉,水稻蓟马、螟虫、叶蝉、飞虱,麦类蚜虫等。 问题是:丁硫克百威是由二丁胺与二氯化硫反应制得二丁氨基氯化硫,再与克百威反应而得。能保证丁硫克百威是纯品?
农业部种植管理司发布了中华人民共和国农业部公告 第2552号,原文如下:根据《中华人民共和国食品安全法》《农药管理条例》有关规定和履行《关于持久性有机污染物的斯德哥尔摩公约》《关于消耗臭氧层物质的蒙特利尔议定书(哥本哈根修正案)》的相关要求,经广泛征求意见和全国农药登记评审委员会评审,农业部决定对硫丹、溴甲烷、乙酰甲胺磷、丁硫克百威、乐果等5种农药采取以下管理措施。[color=#000080]一、自2018年7月1日起,撤销含硫丹产品的农药登记证;自2019年3月26日起,禁止含硫丹产品在农业上使用。 [/color][color=#000080]二、自2019年1月1日起,将含溴甲烷产品的农药登记使用范围变更为“检疫熏蒸处理”,禁止含溴甲烷产品在农业上使用。 [/color][color=#000080]三、自2017年8月1日起,撤销乙酰甲胺磷、丁硫克百威、乐果(包括含上述3种农药有效成分的单剂、复配制剂,下同)用于蔬菜、瓜果、茶叶、菌类和中草药材作物的农药登记,不再受理、批准乙酰甲胺磷、丁硫克百威、乐果用于蔬菜、瓜果、茶叶、菌类和中草药材作物的农药登记申请;自2019年8月1日起,禁止乙酰甲胺磷、丁硫克百威、乐果在蔬菜、瓜果、茶叶、菌类和中草药材作物上使用。 [/color][align=right] 农业部 [/align][align=right] 2017年7月14日[/align]

[align=center][url=https://insevent.instrument.com.cn/t/Mp]gc[/url]-MS法定性食品中的克百威方法探讨[/align][align=center]西安国联质量检测技术股份有限公司[/align][align=center]食品事业部:何孟孟[/align]1.方法简介本法利用乙腈对样品进行提取,经旋转蒸发后,用正己烷定容,进行[url=https://insevent.instrument.com.cn/t/Mp]gc[/url]-MS上机分析。2 原理样品经过乙腈提取浓缩后经[url=https://insevent.instrument.com.cn/t/Mp]gc[/url]-MS进行分析,通过离子峰进行定性。3 试剂和样品处理3.1 试剂3.1.1 乙腈:色谱纯3.1.2 氯化钠:分析纯3.1.3 丙酮:色谱纯3.1.4 正己烷:色谱纯3.2 样品前处理称取约25g样品,加入50mL乙腈,匀浆5min,过滤到盛有10g氯化钠的具塞量筒中,剧烈振荡1min,取10mL有机相部分于100mL烧杯中,在60℃水浴上蒸发近干,分三次加入丙酮10mL,继续浓缩近干,用色谱纯正己烷定容至5mL,经注射器过0.22μm的有机滤膜,待上机[url=https://insevent.instrument.com.cn/t/Mp]gc[/url]-MS进行检测。4 仪器条件 色谱柱:SH-Rxi-5-silMS(30.0m×0.25mm×0.25μm);进样口温度:280℃;升温程序:80℃保留2min,以10℃/min升温到230℃保留10min,再以10℃/min升温到260℃保留10min;分流比:9:1;柱流量:1.5mL/min;离子源温度:230℃;接口温度:280℃。检测方式:选择离子监测方式(SIM);克百威定量离子m/z:164;定性离子m/z:149,122,131。5 [url=https://insevent.instrument.com.cn/t/Mp]gc[/url]-MS分析结果[align=center][img=,690,184]http://ng1.17img.cn/bbsfiles/images/2017/09/201709111055_01_2904018_3.png[/img] [/align][align=center][img=,607,106]http://ng1.17img.cn/bbsfiles/images/2017/09/201709111056_02_2904018_3.png[/img][/align]6 小结a.本文建立了一种[url=https://insevent.instrument.com.cn/t/Mp]gc[/url]-MS法定性克百威的新方法。b.通过使用不同种极性的色谱柱对出峰效果进行统计分析,最终筛选出合适的色谱柱(SH-Rxi-5-silMS(30.0m×0.25mm×0.25μm))c. 目前克百威的检测方法主要为液相色谱法,本法通过尝试[url=https://insevent.instrument.com.cn/t/Mp]gc[/url]-MS对其检测取得了良好的分离分析以及定性效果。
用NY/T761-2008的方法进了丁硫克百威标样,居然不出峰,其他几个氨基甲酸酯类农药都出峰了,是不是丁硫克百威不能用荧光检测器检测啊?
今年我单位做丁硫克百威残留登记试验,不知道有没有试验单位有3-羟基克百威和3-乙基克百威,如能提供少许(几十毫克就行),真的不胜感激,联系人:万宇 0551-5854938 /0551-5851928 /13866151614
购买克百威的标液,除了买克百威,还要买三羟基克百威,那么丁硫克百威和他们之间的关系是什么呢?
[url=https://insevent.instrument.com.cn/t/Mp]gc[/url]-CI-MS/MS技术用于蔬菜中痕量甲胺磷、氧乐果和克百威的确认 佟玲 李重九 中国农业大学 100094摘要:本文采用[url=https://insevent.instrument.com.cn/t/Mp]gc[/url]-CI-MS/MS技术研究了蔬菜中三种农药(甲胺磷、氧乐果、克百威)残留的确认方法。在共振方式下,对三种农药的分子离子进行MS/MS分析,其碰撞诱导电压分别为0.3v, 0.28v,0.8v,鉴定用子离子分别为94,125(甲胺磷);183,196(氧乐果)123,165(克百威)。对抽检的阳性样品确认分析,得到了准确的结果。研究表明,串联质谱能够排除背景干扰,定性准确。关键词:甲胺磷、氧乐果、克百威,[url=https://insevent.instrument.com.cn/t/Mp]gc[/url]-CI-MS/MS,定性确认。近年来,甲胺磷、氧乐果、克百威等高毒药剂,因急性毒性问题,已被禁止在蔬菜和水果上使用。(1)所以为了确保人们的饮食安全,建立准确有效的残留分析方法势在必行。有机磷等农药在各种农作物样品中残留量很低,且样品中(如蔬菜、水果、茶叶等)的基质干扰较大,使得目标化合物易被基质掩盖。仅用传统的[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]方法难以排除干扰。即使用[url=https://insevent.instrument.com.cn/t/Mp]gc[/url]/MS选择离子监测(SIM)技术(2),选取的特征离子也容易被杂质掩盖,出现定性误差问题。而MS/MS的方法是对母离子进一步碰撞,子离子图谱中只有来自母离子的碎片离子,排除了其他杂质的干扰,定性更为准确。(3-4)本文采用[url=https://insevent.instrument.com.cn/t/Mp]gc[/url]-CI-MS/MS的方法对蔬菜农药残留抽检中的阳性样品进行了进一步定性确证,得到了较好的结果。1. 实验部分1.1 仪器与试剂 仪器:[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]:Varian [url=https://insevent.instrument.com.cn/t/Mp]gc[/url]-3800;质谱:Varian Satrun 2000;自动进样器:8410;Saturn WS 5.52工作站;离子阱检测器;色谱柱:VF-5MS 毛细管柱 30m×0.25mm×0.25μm。 标准品:甲胺磷,氧乐果,克百威(农业部农药检定所提供)。试剂: 丙酮,二氯甲烷,乙酸乙酯,NaCl,无水Na2SO4等试剂,均为分析纯。样品种类:番茄、甘蓝、尖椒,均为市场上抽检的阳性样品。1.2 [url=https://insevent.instrument.com.cn/t/Mp]gc[/url]-MS/MS 分析条件的选择[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]条件:初始温度60℃,保持2.0min,20℃/min,终止260℃,保持20min。(分析甲胺磷时:初始温度60℃→150℃(5℃/min)→280(20℃/min),保持10min。) 进样口温度:260℃;载气流速:1mL/min;进样量:1μL。质谱条件:离子阱温度:190 ℃,歧管温度:80℃,传输线温度:260℃。MS/MS条件的优化:以甲胺磷、氧乐果、克百威的分子离子为母离子,分别用EI、CI电离方式对它们进行MS/MS分析,并比较共振、非共振方式的分析结果,选择合适的电离方式和碰撞方式;进而选用自动方法开发(AMD)功能确定CID电压,计算离子存储水平,优化MS/MS分析条件,确定鉴定用子离子。1.3 抽检蔬菜样品的定性确证 主要参照德国S-19方法处理蔬菜样品(5):准确称取蔬菜样品10 g,加入70 mL丙酮:二氯甲烷(4:3),10 g 氯化钠,匀浆提取,取上清液50 mL,过无水硫酸钠漏斗脱水,浓缩后过活性碳SPE柱进行净化,浓缩定容后,用已优化的[url=https://insevent.instrument.com.cn/t/Mp]gc[/url]-CI-MS/MS条件进行分析,确认蔬菜中农药残留。2. 结果与讨论 2.1 MS/MS方法优化采用EI 、CI电离方式对甲胺磷、氧乐果、克百威标准品分别进行[url=https://insevent.instrument.com.cn/t/Mp]gc[/url]-MS全扫描分析,结果表明化学电离方式下样品中的分子离子及高质量数的碎片离子丰度较高,在CI方式下,分别对甲胺磷、氧乐果、克百威的分子离子选用共振/非共振的碰撞方式进行MS/MS分析。由于非共振方式能量较低,母离子较难击碎,子离子丰度不高。而采用共振方式,其子离子信息较为丰富。因此以下研究均选用共振碰撞方式。逐渐增大CID电压,观察母离子及子离子的丰度,直至子离子图谱中含有两个相对强度50%的碎片离子,并有少量(5-15%)母离子。(6)根据上述实验,确定化合物的MS/MS分析条件见表12.2蔬菜中残留农药的确证蔬菜阳性样品经提取、净化后,用上述所建立的[url=https://insevent.instrument.com.cn/t/Mp]gc[/url]-CI-MS/MS分析方法进行分析。图1为番茄中克百威的残留分析结果。由于克百威含氮原子,标准品色谱峰有拖尾现象,而样品中保留时间相同的峰却不拖尾,因此[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]方法很难确认。而用MS/MS分析方法分别对标准品和样品进行分析,发现它们的子离子质谱图一致(见下图右)。向样品中添加克百威标准品,发现添加后色谱峰的保留时间和形状不变,只是峰高增加,进一步确认了样品中克百威的存在;也说明了是由于样品的基质效应使色谱柱对克百威的吸附减弱,在番茄样品中克百威峰不拖尾。尖椒样品中甲胺磷的分析结果见图2。同样由于基质作用,标准品严重拖尾的现象在样品中不存在,二者不但峰形不一样,保留时间也稍有差别。但通过MS/MS分析,发现质谱图中都含有 m/z125,94特征子离子,说明该样品中确实含有甲胺磷。甘蓝中氧乐果的残留分析结果见图3。色谱(NPD)分析中标准品和样品保留时间一致,为阳性。但对它们进行MS/MS分析,发现其子离子不含氧乐果的特征离子。 可确认样品中不含氧乐果,为假阳性。2.4 结论样品中存在大量的基质易掩盖目标化合物的响应信号;另一方面,所分析的三种农药—甲胺磷、氧乐果、克百威,都含有氮原子,易与色谱柱固定液吸附,造成拖尾现象,而样品中共萃基质与待测物竞争吸附,使拖尾现象减弱,造成标准品和样品的色谱峰形状和保留时间都可能发生变化,很难做出定性判断。因此用[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]方法和[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]气质联用[/color][/url]-选择离子检测方法难以准确分析上述样品。而串联质谱可以从复杂的化学基质中鉴别出目标化合物,根据母离子和子离子定性更加准确,所以串联质谱分析方法必将在农药残留检测方面发挥更加重要的作用。
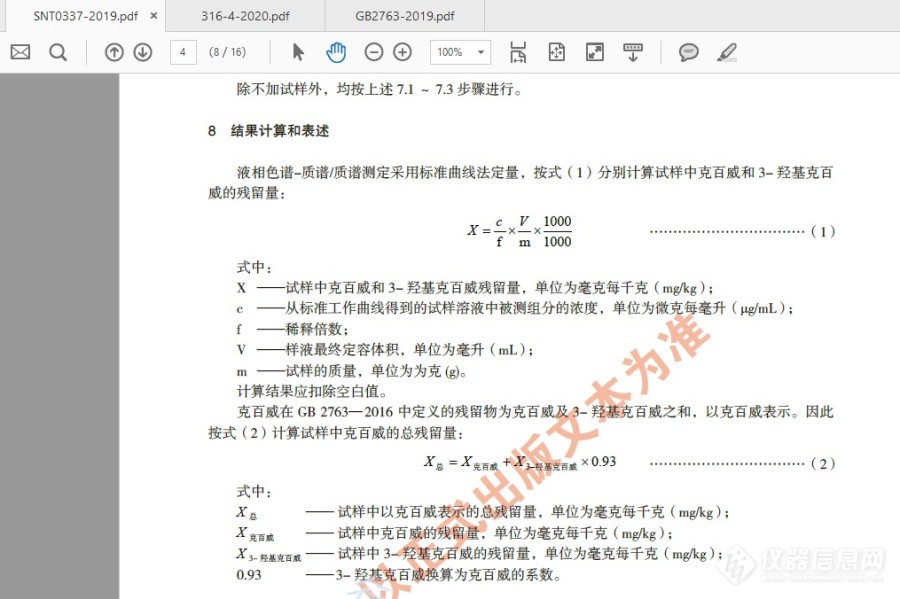
关于克百威(以克百威和3-羟基克百威之和计)结果计算问题的请教。想请教一下:当样品中克百威,3羟基克百威都有检出的情况下,按照GB 2763-2019的要求,克百威是“以克百威和3-羟基克百威之和计”,请问是直接将两者进行求和,还是进行换算后再求和。例如:某蔬菜样品中克百威检出值为 A mg/Kg,3-羟基克百威检出值为 B mg/Kg,现在要填报“克百威(以克百威和3-羟基克百威之和计)”的结果,应该怎样计算才正确。计算方式一:样品中 克百威(以克百威和3-羟基克百威之和计)含量=(A+B)mg/Kg,计算方式一:参照 SN/T 0337-2019标准中的计算方式,样品中 克百威(以克百威和3-羟基克百威之和计)含量=(A+B*0.93)mg/Kg。请各位老师指教。附:SN/T 0337-2019 部分截图:[img=,690,459]https://ng1.17img.cn/bbsfiles/images/2021/04/202104301427586649_3321_3463672_3.jpg!w690x459.jpg[/img][img=,690,459]https://ng1.17img.cn/bbsfiles/images/2021/04/202104301427586649_3321_3463672_3.jpg!w690x459.jpg[/img]
2763 中克百威和3羟基克百威都用克百威表示!这样还有必要在资质认定的时候把3羟基克百威当参数来认证吗?
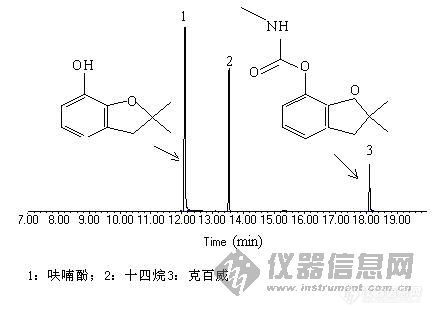
哪位高手帮我做个克百威分解总离子流图(Agilent5973),小弟想比较以下,不甚感激!克百威标液加内标(正十四烷,没有也可以,主要是想看看分解情况)我做的色谱图在附件中色谱分析条件:色谱柱:DB-5MS石英毛细管柱,30m×0.25mm×0.25µ m;氦气作载气,恒流1.0mL/min,采用常规进样口,进样量1µ L,不分流。柱温程序升温条件:起始温度45℃,以5℃/min升至80℃,再以20℃/min升至180℃,保持12 min;离子源为EI源,能量70 eV。离子源温度230oC。传输线温度280oC,四极杆温度150oC。Scan全扫描模式。溶剂延迟4 min。联系方式:QQ:3733818E-mail:yardin@126.com[img]http://ng1.17img.cn/bbsfiles/images/2008/01/200801072111_75839_1640263_3.jpg[/img]
我单位新买了一台VARIAN Saturn 2200 [url=https://insevent.instrument.com.cn/t/Mp]gc[/url]/MS/MS,我用VF-5ms柱做克百威,条件为:进样口270度、氦气流量1ml/min、柱箱80度1分钟-20度/分钟-230度3分钟、把溶剂延迟设为6min、传输线280度、阱150度,总离子流图在8.42min出现164的离子流峰,当我把溶剂延迟改为4.5min时,在5.65min又发现一个一样的164的离子流峰,请问各位,在5.65min出现的是否也是克百威?
它虽然毒性不大,但是可以转化为毒性较高的克百威。研究它在叶菜类上的残留意义大不大?对敌百虫和灭多威也比较有兴趣,因为一些欧美及亚洲国家已经禁用,应该是危害比较大的吧。目前正处于选题阶段,大家帮着出出主意。谢谢啦!
下周实验室要做克百威的残留啦,好像是水稻和土壤中的,求大家给个可行的方法呀~谢谢啦~[em0808]
如题,以水为溶剂测定产品中的残留丙酮,丙酮的沸点为56.5℃,我以样品平衡温度为60℃试验了下,精密度、线性均良好(相关系数为0.9996);但我试验了一下80℃的平衡温度,发现同量的对照品溶液 峰面积增加了一倍,我就疑虑了:是否有必要将温度设高点,顶空进样时,平衡温度一般要比待测成分沸点高多少呢?大家都来说说看
W46.jpg 二硫化碳中丙酮,用填充柱分离好的,就是丙酮有点拖尾,怎么办柱温60进样口120检测器160,天美7890
各位老师,克百威(克百威和三羟基克百威)检出限怎么写,两者之和么么
(一)原理在磷酸酸性条件下进行蒸馏,使样品中的甲醛分解出来,被水吸收,吸收液中的甲醛与乙酰丙酮反应,生成黄色物质与标准比较定理。(二)试剂(1)20%磷酸。(2)乙酰丙酮溶液:取乙酸铵150g溶于水中,加入3mL冰乙酸和2mL乙酰丙酮(重蒸馏过),用水定容至1000mL。(3)甲醛标准溶液:称取特级六次甲基四胺O.3112g,溶于水后,定容至l000mL,此液甲醛浓度为400μg/mL。(4)甲醛标准使用液(临用时现配):取甲醛标准溶液2.5mL加水至100mL,此溶液每毫升相当于lOμg甲醛。(三)仪器(1)水蒸气蒸馏水装置。(2)水浴。(3)紫外一可见分光光度计。(四)操作方法1.样品处理取切碎的面制食品2g,加30mL蒸馏水于蒸馏瓶中,加20%磷酸3mL,先在接收瓶中加10mL蒸馏水,冷凝管下端浸入水中,通水蒸气蒸馏至蒸馏液约200mL时,停止蒸馏,准确加水定容至200mL。2.测定取5mL上述试液,同时取甲醛标准使用液0.0O、O.20、0.40、O.60、O.80、1.O0、2.00mL,分别置于25mL比色管中,加水至5mL,各管分别加5mL乙酰丙酮溶液,混匀,置沸水浴中加热10min后,于波长415nm处测量。(五)注意事项本法最低检测质量为0.52 μg;对甲醛含量1.5~2.0μg的6份样品,每份样品连续测定6次,平均相对标准偏差(RSD)为3.3%;取含吊白块的样品为本底样品,分别加入5.Oμg、10.0 μg甲醛标准使用液,其回收率在86.8%~100.6%。样品中存在的NaHSO3是否来自于甲醛次硫酸氢钠的分解产物。虽然目前尚未找到允许在面制品制作过程中使用亚硫酸氢钠作为漂白剂的国家标准,但亚硫酸氢钠、亚硫酸钠、硫磺可被应用在饼干、干果、干菜、粉丝等数类食品的加工制作过程,从而也有可能被应用在面制食品的加工过程中。故采用以上定量、定性两方法结果综合起来判定面制食品中是否存在吊白块时,应将亚硫酸氢钠和甲醛的测定结果综合起来判定,若同时测定面制食品中亚硫酸氢钠(以SO2计),以了解二氧化硫与甲醛实测值之比是否较接近理论上的质量比即相对分子质量之比2.1:1.O。若接近此比值,更可断定吊白块的存在,这样得出的结论应是比较科学、准确的。
各位老师,农药中克百威用什么方法做?网上查了,方法都作废了
顶空进样器中残留乙醇、丙酮的去除方法
顶空进样器中残留乙醇、丙酮的去除方法?
顶空进样器中残留乙醇、丙酮的去除方法
群友提问:丙酮中的百菌清走不出峰,很奇怪,有谁做过这个?有人回复:1. 你可以吹干(氮吹)后 用1ml正己烷定荣。可以吸取1ml配好的标液 氮吹干后 用1ml正己烷定容 上机就可以了。你也可以100的标液 直接吹干 在定容。2. 23204那个方法感觉不错,就是不知道气相上机怎么样。
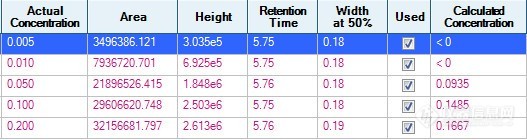
仪器为AB 4500 克百威的离子对是222 165/123 DP:70 CE:17/291. 克百威标液浓度为0.005ug/mL、0.01ug/mL、0.05ug/mL、0.1ug/mL、0.2ug/mL。直线r=0.98 混标24种标液,其它直线可以达到0.995以上2. 流动相为纯水+0.005%甲酸+1mM甲酸铵,有机相为纯甲醇。3. 用纯甲醇配制直线,用样品基质配制直线,直线都很差。4. 同时做不直的还有速灭威、辛硫磷,负离子模式下有氟甲腈、氟虫腈硫醚、氟虫腈砜等。5. 不用怀疑配直线的手法,因为其它农药直线很好,做的是24种混标。6. 进样量为5uL。进样量为1uL时也试过,也是这个样子。[img=,527,140]https://ng1.17img.cn/bbsfiles/images/2022/04/202204071148489957_5150_1645480_3.jpg!w527x140.jpg[/img][img=,690,246]https://ng1.17img.cn/bbsfiles/images/2022/04/202204071148496446_2797_1645480_3.jpg!w690x246.jpg[/img]
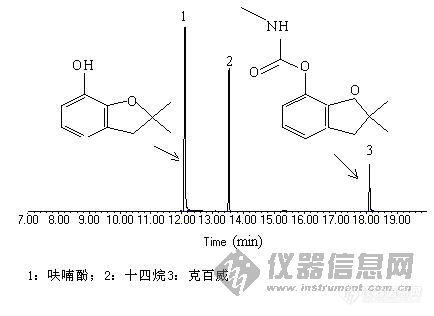
哪位高手帮我做个克百威分解总离子流图(Agilent5973),小弟想比较以下,不甚感激!克百威标液加内标(正十四烷,没有也可以,主要是想看看分解情况)我做的色谱图在附件中色谱分析条件:色谱柱:DB-5MS石英毛细管柱,30m×0.25mm×0.25µ m;氦气作载气,恒流1.0mL/min,采用常规进样口,进样量1µ L,不分流。柱温程序升温条件:起始温度45℃,以5℃/min升至80℃,再以20℃/min升至180℃,保持12 min;离子源为EI源,能量70 eV。离子源温度230oC。传输线温度280oC,四极杆温度150oC。Scan全扫描模式。溶剂延迟4 min。联系方式:QQ:3733818E-mail:yardin@126.com[img]http://ng1.17img.cn/bbsfiles/images/2008/01/200801072116_75841_1640263_3.jpg[/img]
5009.218水果蔬菜中的克百威,氧乐果,甲拌磷国标上说的是让用-5ms柱子了,请问可以用1701ms柱吗?
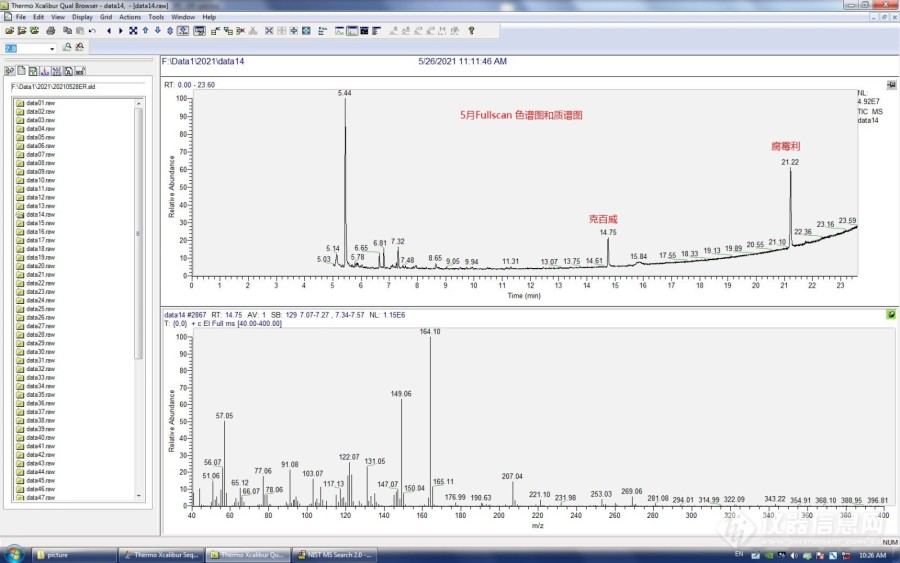
[align=left][b][font=宋体][/font][/b][/align][align=center][b][font=宋体] [size=16px]“探秘”消失的农残克百威组分到哪里去了?[/size][/font][/b][/align][size=16px]一、摘要:[font=宋体]采用[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url][/font][font='Times New Roman','serif']-[/font][font=宋体]质谱分析农药残留组分时,一般做法,先配制好各组分标液,按照规范方法进行测定,得到图谱后先进行定性分析,谱库检索,再可以提取各组分特征离子,以其保留时间定性。以此确定各组分的出峰时间,确定好各组分峰后再进行定量分析,拟合曲线,达标后就可以开始进行样品测试了。小编在一次克百威(呋喃丹)农残检测时,根据年度监测方案要求,上下半年各进行一次采样检测,其中上半年克百威标准组分做得很正常,但到下半年再次做时,却发现克百威组分在原来出峰的位置上消失不见了!所有实验条件都是一样的,而且同时测定其他农残组分都正常,就偏偏克百威组分峰不见了!百思不得其解!下面就跟随小编一起“探秘”解析消失的克百威到哪里去了呢?看看我们能不能成功把它找回来![/font][b][font=宋体]二、实验过程[/font][/b][/size][align=left][size=16px][b][font='Times New Roman','serif']1[/font][font=宋体]、[/font][/b][font=宋体]监测方案:小编的实验室负责食品安全风险检测任务,每年都会进行一些蔬菜水果类型样品的农药残留检测,分批按上下半年进行两次检测,今年监测任务如下表。三月份收到监测任务后,制定试剂耗材采购计划,申报,四月底左右实验物资采购到位,五月开始按方案实施检测工作。其中[/font][font=宋体]采购的克百威(呋喃丹)标物如下图,因为要分上下半年监测,所以同一个批号购买了两支,有效期限为[/font][font='Times New Roman','serif']2[/font][font=宋体]年。[img=,690,361]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021656347539_2906_2694188_3.png!w690x361.jpg[/img][img=,690,517]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021700398354_673_2694188_3.png!w690x517.jpg[/img][img=,690,517]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021701121334_6415_2694188_3.png!w690x517.jpg[/img][/font][/size][/align][align=left][size=16px][b][font='Times New Roman','serif']2[/font][font=宋体]、[/font][/b][font=宋体]实验操作:[/font][font=宋体]按照监测手册方法要求进行操作,使用设备、仪器条件、标准物质如下表。仪器操作软件为[/font][font='Times New Roman','serif'] Xcalibur [/font][font=宋体]谱库检索库为[/font][font='Times New Roman','serif'] NIST MS search2.0[img=,690,545]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021702088719_7524_2694188_3.png!w690x545.jpg[/img][b][font=宋体]三、五月份的实验结果[/font][/b][/font][/size][/align][align=left][size=16px][b][font='Times New Roman','serif']1[/font][font=宋体]、[/font][/b][font=宋体]五月中旬上半年采样一半量送检,具体实验结果分析如下:[/font][font=宋体]([/font][font=&]1[/font][font=宋体])稀释配制好标准系列溶液,按方法进行仪器设置,调谐,达到最佳状态后开始实验。进样测定,先进中间[/font][font=&]0.5ug/ml[/font][font=宋体]标液,进行[/font][font=&]Fullscan[/font][font=宋体]([/font][font=&]40-400[/font][font=宋体])检测,得到如下色谱图和质谱图。克百威组分在[/font][font=&]14.75min[/font][font=宋体]处出峰,[/font][font=&]21.22min[/font][font=宋体]为腐霉利。[img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021703586897_8935_2694188_3.jpg!w690x431.jpg[/img][/font][/size][/align][align=left][size=16px][font=宋体]([/font][font='Times New Roman','serif']2[/font][font=宋体])对[/font][font='Times New Roman','serif']14.75min[/font][font=宋体]峰进行定性谱库检索,结果如下图。右上框为实测标液的质谱图,右下框为谱库匹配度最高物质的谱图。[img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021705163915_213_2694188_3.jpg!w690x431.jpg[/img][/font][font=宋体]([/font][font='Times New Roman','serif']3[/font][font=宋体])提取克百威三个特征离子[/font][font='Times New Roman','serif']164[/font][font=宋体],[/font][font='Times New Roman','serif']149[/font][font=宋体],[/font][font='Times New Roman','serif']221[/font][font=宋体],得到色谱图如下。可以明显看到三个特征离子的保留时间均一致。综合这些信息判断[/font][font='Times New Roman','serif']14.75min[/font][font=宋体]峰为克百威组分峰。同法得出[/font][font='Times New Roman','serif']21.22min[/font][font=宋体]为腐霉利组分峰。[img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021706572612_3011_2694188_3.jpg!w690x431.jpg[/img][/font][font=宋体]([/font][font='Times New Roman','serif']4[/font][font=宋体])再进行[/font][font='Times New Roman','serif']SIM[/font][font=宋体]([/font][font='Times New Roman','serif']164[/font][font=宋体],[/font][font='Times New Roman','serif']149[/font][font=宋体],[/font][font='Times New Roman','serif']221[/font][font=宋体])检测,得到色谱图和质谱图如下。出峰时间与全扫描完全一致。[img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021707598290_6320_2694188_3.jpg!w690x431.jpg[/img][/font][font=宋体]([/font][font='Times New Roman','serif']5[/font][font=宋体])最后对标准系列图谱进行数据处理,拟合标准曲线,结果如下图。[img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021709171133_6340_2694188_3.jpg!w690x431.jpg[/img][/font][/size][/align][align=left][size=16px][b][font='Times New Roman','serif']2[/font][font=宋体]、[/font][/b][font=宋体]综合分析,五月份做的农残组分分析过程都比较顺利,按照方法进行各个组分识别,图谱解析,都符合预期。让我们觉得挺有成就感的,然而到了下半年再次进行测定时,却出现了一些意想不到的情况,几番波折。[b][font=宋体]四、九月份的实验结果[/font][/b][/font][font='Times New Roman','serif']1[/font][font=宋体]、[/font][font=宋体]九月中旬下半年采样另一半量送检,具体实验结果分析如下:[/font][font=宋体]([/font][font='Times New Roman','serif']1[/font][font=宋体])九月再测,按照完全相同的方法,仪器设置状态也是完全一样,实验结果,标准溶液图谱如下。同一批的另一支克百威标液配制标准系列,相同的浓度,相同的仪器方法。最后做出来的结果却不一样了!出现异常情况!在全扫描中克百威组分在[/font][font='Times New Roman','serif']14.75min[/font][font=宋体]处消失不见了!其他组分如腐霉利却正常还是[/font][font='Times New Roman','serif']21.22min[/font][font=宋体]!真是太奇怪了![img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021712282188_7927_2694188_3.jpg!w690x431.jpg[/img][/font][/size][/align][align=left][size=16px][font=宋体]([/font][font='Times New Roman','serif']2[/font][font=宋体])再进行[/font][font='Times New Roman','serif']SIM[/font][font=宋体]([/font][font='Times New Roman','serif']164[/font][font=宋体],[/font][font='Times New Roman','serif']149[/font][font=宋体],[/font][font='Times New Roman','serif']221[/font][font=宋体])检测,也没有在[/font][font='Times New Roman','serif']14.75min[/font][font=宋体]处找到克百威组分!图谱如下。真是大惑不解啊!克百威怎么就不翼而飞了?到底怎么回事?反思实验过程都和五月做的完全一样啊?为什么得到不同的结果?挠头![img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021713243112_5137_2694188_3.jpg!w690x431.jpg[/img][font=宋体]([/font][font='Times New Roman','serif']3[/font][font=宋体])对无端消失的克百威组分进行查因,先是检查仪器状态都是正常;再是检查标液都是在有效期限内使用,配制过程也没发现异常;最后又更换寸管、隔垫,再次测定,结果还是异常!就是找不到克百威组分!虐心啦[/font][font='Times New Roman','serif']……[/font][font=宋体]改进一个大浓度的标液,结果稍微好一点,[/font][font='Times New Roman','serif']14.75[/font][font=宋体]处有一个很小的峰![/font][font='Times New Roman','serif']……[/font][font=宋体]这似乎看到了一些希望?![/font][font='Times New Roman','serif']……[/font][font=宋体]再次对图谱进行分析,发现端倪了!!结果在[/font][font='Times New Roman','serif']7.32min[/font][font=宋体]处发现有一个比较大的异常的未知峰,对其进行谱库检索,结果如下图。[/font][img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021714351977_5610_2694188_3.jpg!w690x431.jpg[/img][/font][font=宋体]([/font][font='Times New Roman','serif']4[/font][font=宋体])检索结果显示[/font][font='Times New Roman','serif']7.32min[/font][font=宋体]匹配度最高的化合物是呋喃酚![/font][font='Times New Roman','serif']……[/font][font=宋体]呋喃酚([/font][font='Times New Roman','serif']CAS[/font][font=宋体]号[/font][font='Times New Roman','serif']1563-38-8[/font][font=宋体])?呋喃丹([/font][font='Times New Roman','serif']CAS[/font][font=宋体]号[/font][font='Times New Roman','serif']1563-66-2[/font][font=宋体])?两者看着很相似!到底怎么关系?通过[/font][font='Times New Roman','serif']CAS[/font][font=宋体]化合物号码查询,两者谱库里的标准质谱图如下。查资料结果如下:[img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021715584878_1169_2694188_3.jpg!w690x431.jpg[/img][img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021716053486_9007_2694188_3.jpg!w690x431.jpg[/img][/font][font=宋体]([/font][font='Times New Roman','serif']5[/font][font=宋体])网上查询资料,显示呋喃酚是合成呋喃丹的中间体!!一定条件下,呋喃丹的首步降解途径为氨基甲酸酯键发生水解断裂生成呋喃酚!!!综合上述实验资料,至此,终于恍然大悟,原来是标准溶液克百威发生了降解,变成新的组分呋喃酚!新的化合物!分子结构不一样了,所以在相同的色谱质谱条件下,当然不会在原来位置上出峰了!!所以标准峰“漂移”到[/font][font='Times New Roman','serif']7.32min[/font][font=宋体]处出现!!原本应该出峰的位置[/font][font='Times New Roman','serif']14.75min[/font][font=宋体]处就没有了!!至于后面高浓度标液该处又有峰,说明呋喃丹大部分降解变成呋喃酚!但扔有少许未降解,浓度较低[/font][font='Times New Roman','serif'],[/font][font=宋体]所以加大浓度测定后才在[/font][font='Times New Roman','serif']14.75min[/font][font=宋体]处出现小峰!标液此时是大部分呋喃酚和少许呋喃丹的混合状态!——如此理解,之前的所有异常现象就都可以解释得通了!!!为印证此想法,我们又对五月份做的全扫描质谱图进行解析,发现五月做的图谱,虽然克百威在[/font][font='Times New Roman','serif']14.75min[/font][font=宋体]处正常出峰,但在[/font][font='Times New Roman','serif']7.32min[/font][font=宋体]处也存在呋喃酚组分峰出现!只是峰很小!当时做完没注意到而已!!提取特征离子图,如下图(呋喃丹[/font][font='Times New Roman','serif']164[/font][font=宋体]、[/font][font='Times New Roman','serif']149[/font][font=宋体]、[/font][font='Times New Roman','serif']221[/font][font=宋体]保留时间均一致,而呋喃酚[/font][font='Times New Roman','serif']164[/font][font=宋体]、[/font][font='Times New Roman','serif']149[/font][font=宋体]时间一致,[/font][font='Times New Roman','serif']221[/font][font=宋体]不一致时间有偏差,因为呋喃酚没有该特征离子)。说明克百威标液从四月购买到五月第一次测定,再到九月第二次测定,一直有在降解,只是五月降解少,没有出现异常,一直到九月降解很多了,再做就出现这种异常情况!!如此解释,感觉所有的实验异常情况都豁然而通了!所有的疑惑都解除了![img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021717345001_3752_2694188_3.jpg!w690x431.jpg[/img][/font][font=宋体][b][font=宋体]五、追根究底[/font][/b][font=宋体] 最后总结分析,五月九月前后两次做的克百威(呋喃丹)组分实验出现反差的原因,最大可能就是标液保存不当造成的待测组分降解导致结果异常!经查克百威(呋喃丹)标液一直保存在冰箱冷藏柜[/font][font='Times New Roman','serif']4[/font][font=宋体]度左右!查看标液证书说明,建议保存条件为[/font][font='Times New Roman','serif']-18[/font][font=宋体]度!如此才最低减少呋喃丹的降解!最后我们还就此问题咨询了上级监测部门,说起此“灵异”事件,不巧他们以前也曾经发生过类似问题![/font][font='Times New Roman','serif']……[/font][font=宋体]一语言之,要多交流学习,才能少走弯路啊![/font][b][font=宋体]六、[/font][font=宋体]后记[/font][/b][font='Times New Roman','serif'] [/font][font=宋体]话说,既然克百威(呋喃丹)较易降解,那我们日常监测的水果蔬菜样品中的农残呋喃丹组分,会不会也降解了?那我们只检测呋喃丹组分会不会造成偏差导致结果误判呢?或者还是需要增加做一下降解物呋喃酚?[/font][/font][font=宋体][/font][/size][/align][size=16px][font=宋体][/font][font=宋体][b][font=宋体][/font][/b][/font][/size][font=宋体][/font]
电极沥青甲苯不溶物的测定(ISO6376-1980)为什么用甲苯洗涤过滤液后还要用丙酮洗涤?丙酮洗涤是什么目的?操作过程称取沥青试样约1克,准至0.001g,测定前于105-110℃电路烘箱内加热过滤坩埚一小时,将其放入干燥器内冷却至室温,并称重准至0.001g。把试样放入锥形瓶中。加入100mL热甲苯(大约80℃)并摇动锥形瓶以溶解试样。注:为了防止因为软质沥青成型而造成在热甲苯中难以溶解,当沥青还是液体时移入锥形瓶是非常必要的。把冷凝器安装在锥形瓶上并打开循环。使甲苯稳定回流30分钟。停止加热并移开冷凝器。使用微弱的抽滤,立即用干燥且称重过的过滤坩埚过滤锥形瓶内液体。大约10毫升80℃的热甲苯洗涤锥形瓶并过滤洗液,过滤完成后,再用10mL热甲苯重复以上洗涤及过滤操作,直到所有锥形瓶内残渣都转移到过滤坩埚且使滤液无色。用大约10mL丙酮洗涤过滤坩埚,洗完以后,再用10mL丙酮重复以上操作。处理过滤坩埚:将过滤坩埚置入105-110℃恒温干燥箱内大约一小时,然后将其放入干燥器内冷却至室温并称准至0.001g。