硫代硫酸钠标准滴定溶液的标定,用硫代硫酸钠标准滴定溶液测定食盐中碘离子含量。有谁做过啊?怎么做有那些标准参考?做的过程中要注意那些事项.如果有的发一份给我谢谢:308775746@qq.com
滴定分析中硫代硫酸钠标准溶液用棕色滴定管还是用白色滴定管?

我需要测次氯酸钠中有效氯的含量,首先就得要标定硫代硫酸钠,然而我滴定的时候25ml左右就到终点了,计算出来的硫代硫酸钠结果也偏大(0.14434mol/L),现将我的步骤说明一下。首先用天平称取26g五水合硫代硫酸钠(精确至0.02g),再加入0.2g碳酸钠,加入1000ml纯水(不是新煮沸的无二氧化碳水),然后在电炉上煮沸10min,冷却(没有盖保鲜膜),置于空调底下冷却。放置2周后过滤。重铬酸钾已干燥至恒重,称取的质量也在0.1800-0.1805g之间,溶于25ml水,加入2g碘化钾及20ml 20%硫酸溶液,在暗处放置10min后,加150ml纯水,用硫代硫酸钠滴定,近终点(网上说的是尿黄色及有点发绿的颜色)及2管(100ml滴瓶)淀粉指示剂,继续滴定溶液由蓝色变成亮绿色。疑问:1、称取26g五水合硫代硫酸钠,一定要精确至26.0000g吗? 2、硫代硫酸钠加入1000ml水煮沸的时候,水会蒸发掉一部分,我是否像网上说的那样加水稀释至1000ml?? 3、近终点的颜色(尿黄色及发绿的颜色我不太好掌控),滴多了会对后续加淀粉继续滴定有影响吗?[img=这是我滴定至亮绿色的颜色,690,920]https://ng1.17img.cn/bbsfiles/images/2021/07/202107121740498372_4709_5190005_3.jpg!w690x920.jpg[/img][img=这是近终点(尿黄色),690,920]https://ng1.17img.cn/bbsfiles/images/2021/07/202107121741269073_6910_5190005_3.jpg!w690x920.jpg[/img]
国家标准中过程描述:在碘量瓶中加入1g碘化钾和50ml水,加15ml重铬酸钾标准溶液c(1/6)=0.1mol/L,振荡至完全溶解,加5ml硫酸溶液(1+5),立即密塞摇均,于暗处放置5min,用待标定的硫代硫酸钠标准溶液滴定至淡黄色,加1ml淀粉溶液(1g/100ml),继续滴定至蓝色刚好消失为终点.我在滴定的时候,前面都没问题,就是最后的蓝色消失这个终点没办法确定,不知道最后的溶液是变成无色还是其他,我已经滴到溶液呈浑浊状,颜色为浅绿色,是不是已经过了终点了??望有经验的指点!!
溶解氧测定,用重铬酸钾做基准溶液,滴定硫代硫酸钠的步骤,有没有人能教教我[合十R]

[img=,690,388]https://ng1.17img.cn/bbsfiles/images/2018/11/201811151136051349_4779_3354568_3.jpg!w690x388.jpg[/img]我在标定硫代硫酸钠的时候,过程是10mL0.1003mol/L的重铬酸钾溶液和5mL的1+5硫酸溶液 40mL水和1g的碘化钾。加入1.00mL5g/L淀粉溶液之后,无论加入多少mL的硫代硫酸钠溶液 颜色都无法变成绿色,而是绿中带有蓝色 这是为什么?我使用的硫代硫酸钠溶液是买有证标物,重铬酸钾溶液也是买的有证标物。碘化钾用的是科密欧的分析纯 淀粉是金科的分析纯。硫酸是科密欧的优级纯。主要目的是为了验证颜色的变化,如果我用有证标物滴定之后计算的浓度是符合证书上的数值,那么我再标定我自己配的硫代硫酸钠溶液的时候就认为是准确的了而且滴定完之后,放置一段时间溶液就会像图中一样 变成浑浊的。图片照的不好,左边那2瓶应该是绿中带蓝的 但是照的照片就变色了。
因为需要用硫代硫酸钠滴定样品中的碘含量,由于不知道样品中碘的具体量,也不能估计硫代硫酸钠的用量,所以在滴定反应一开始即加入淀粉用于判断终点,将样品滴至蓝色消失,放置一段时间后又出现蓝色,怀疑由于淀粉对碘的吸附乃至滴定不完全,又用硫代硫酸钠滴到终点,可相同情况又出现,之后只好再滴加硫代硫酸钠,直到样品不再出现蓝色,请问这样操作的过程后,将硫代硫酸钠每次所用量加和,是否能作为准确值进行计算(注:样品溶液为酸性环境)
根据原理:利用氨性醋酸锌和脱硫液中硫氢根离子作用生成硫化锌沉淀,经过滤将沉淀分离,加入碘标准溶液及盐酸溶液,过量的碘用硫代硫酸钠标准溶液返滴实验步骤如下准确吸取10mL脱硫液放入盛有5mL 的2%醋酸锌溶液的250mL烧杯中,在沸水浴上加热至沉淀物凝聚,过滤,用水洗至无硫代硫酸根。滤纸同沉淀移入250mL碘量瓶中。加入约80mL水、20mL 的0.0ImoLlL碘溶液和5mL的1:2盐酸。然后搅碎滤纸,立即用0.01molL硫代硫酸钠标准溶液滴至获黄色再加入 3mL10g/L.淀粉溶液,继续滴定至蓝色消失。记录消耗体积V淀粉的颜色变化是从蓝色变成紫色,再变成粉色,最终变成无色。淀粉有3种颜色变化,那个为滴定终点。如果根据实验步骤的话,是不是在淀粉变为紫色时就要记录硫代硫酸钠溶液的消耗体积。但是我通过氧化还原电极检测溶液的电势变化发现淀粉从蓝色变成紫色电势数值没有明显突越,在从粉色变无色时,电势突越明显。到达那个是对的呢?
接近滴定终点时,水本应由蓝色变为无色,确是黄色。前几天也出现过这个问题,当时认为是淀粉指示剂放了几天的问题,重配后,问题解决。昨天又出现问题了,淀粉指示剂是现配的。滴到终点时,水又成黄色了。且消耗硫代硫酸钠体积偏小。不知哪位人士,识得此状况的缘由,请告知一二。谢谢。
硫代硫酸钠应放在碱式滴定管还是酸式滴定管中进行滴定?有没有官方文件规定?大家乍么做的?碱式滴定管理由:配制硫代硫酸钠时需加入少量的碳酸钠使溶液的pH值保持在9-10左右,以防细菌滋生和硫代硫酸钠变质而析出硫,因此其溶液呈弱碱性,建议用碱式滴定管。酸式滴定管理由:硫代硫酸钠溶液虽然呈碱性,但是水解后有S析出,S对乳胶管会起老化作用,相对与其碱性对酸式滴定管的危害远远低于析出S(硫)对碱式滴定管乳胶管的危害,所以要用酸式滴定管。两者皆可理由:硫代硫酸钠见光易分解,呈弱碱性,故最好用棕色碱式滴定管。当然见光分解也不是一下就完成了的,短时间也不会影响滴定结果,没棕色时也可用白碱式滴定管。既然是弱碱性,也不是短时间就能让活塞受损,所以用酸式也不会出问题。
硫代硫酸钠标定时,重铬酸钾溶解后加2克碘化钾,稀硫酸,静置10分钟后,250毫升水稀释,再用硫代硫酸钠滴定至临近终点,我的问题是,近终点时往往要把滴定管尖端的液体碰到碘量瓶内壁上,摇匀,能不能用洗瓶把滴定管尖端的滴定液冲到碘量瓶中?
用配制好的硫代硫酸钠溶液滴定,近终点时加2ml淀粉指示液,继续滴定至溶液由蓝色变为亮绿色。我想问一下怎去判断滴定接近终点?恳请高手帮忙解决一下。
请教各位大侠,做碘值实验是要根据哪个标准来做,网上很多,不知道哪个比较适合,为什么我做的时候用硫代硫酸钠滴定不会变黄色呢?硫代硫酸钠不是近期配置的,有一定的时间了,会影响吗?但是我用这个硫代硫酸钠做过氧化值实验又可以做,会变色
过硫酸钠按照GB/T 23940-2009 的方法检测:称取约0.3g 试样,加入30ml 水使之溶解,加入4g 碘化钾 ,盖上瓶盖,在暗处放30分钟。加入2ml 冰乙酸(1+2)和25ml 水,用硫代硫酸钠标准溶液滴定,近终点时加入3ml淀粉指示剂,滴定至蓝色消失,同时做空白实验问题是,终点时,滴定至蓝色消失,可是过1分钟左右,又恢复了蓝色。每次都是这样的。如果只滴到蓝色消失为止,不管后面又变为蓝色,所计算出来的结果又会偏低很多。为什么会出现蓝色消失,又出现这样的问题呢?我把乙酸换成浓的,加入也多一点,同样也会出现这样的现象。
请问配制硫代硫酸钠标准溶液的时候,为什么要加0.2g的无水碳酸钠?
请问大家硫代硫酸钠溶液应该盛放在酸式还是碱性滴定管内呢?
向各位高手请教:碘量法测定水体中硫化物时,标定0.1M硫代硫酸钠时出现了与标准方法不相符合的现象,不知原因是什么。取1g碘化钾,加入50ml水、15ml0.1N重铬酸钾溶液5ml(1+1)盐酸溶液,密封好于暗处静置5min,用待标定硫代硫酸钠溶液滴定至呈淡黄色,加入1ml1%淀粉溶液滴定至蓝色消失。在实际滴定时看不到淡黄色,只是以前的颜色变淡,加入淀粉后再滴定,只能滴定到浅蓝色。出现这种现象的原因是什么呢?
大家好!按照GB601的方法,硫代硫酸钠是用重铬酸钾标定的。称取0.18G于120度干燥至恒重的基准试剂重铬酸钾,置于碘量瓶中,溶于25ML水,加2G碘化钾及20ML硫酸溶液(20%),摇匀,于暗处放置10分钟,加150ML水(15-20摄氏度),用配制好的硫代硫酸钠溶液滴定[color=#f10b00],[b]近终点时[/b][/color]加2ML淀粉指示剂,继续滴定至溶液由蓝色变为亮绿色.同时做空白.请问加淀粉前的终点如何判断?
[em09509]硫代硫酸钠滴定液配制时,加硫代硫酸钠+0.2g碳酸钠,加水,煮沸,放置2周后过滤。为什么要放置2周呢?是为了让它沉淀后,上层清液便于过滤吗?以前做K的测定是,配制那个四苯硼酸钠溶液,也让放置一夜,再过滤,是不是也是让它充分沉淀,仅过滤上层清液,便于过滤?
用碘量法滴定硫代硫酸钠(0.1mol/L)溶液的时,按照常理来说滴定所需体积为25ml左右,但实际实验时,体积到3ml时,滴定就完成了,这是怎么回事?
检测溶液中的硫酸钠,用过了量的钡镁混合液与硫酸根反应。在用EDTA标液络合滴定过量的钡镁离子反应应该选择什么电极来测
硫代硫酸钠滴定用1%淀粉指示液如何配制
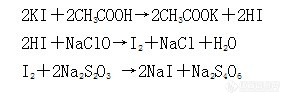
大家谁知道在硫代硫酸钠滴定次氯酸钠的时候~具体的反应方程式是怎么样的啊~次氯酸钠:硫代硫酸钠是1:2反应的么?在网上找到是这样子么?http://ng1.17img.cn/bbsfiles/images/2013/08/201308221537_459363_2255963_3.jpg
有哪位朋友做过这个方法的,帮忙给一下硫代硫酸钠(0.05mol/L)标定时候的滴定体积V1,V2硫代硫酸钠标准滴定溶液浓度的计算:c(Na,S,O )=0. 250 0*5. 00/(V1-V2)式 中 :V1— 滴 定重铬酸钾标准溶液消耗硫代硫酸钠标准滴定溶液的体积,ML V2一 滴 定空白溶液消耗硫代硫酸钠标准滴定溶液的体积,mL,感谢啊!!扩项中,可是仪器还没到货啊、、、实际做样品的滴定体积也给个例子谢谢、、、
二氧化硫加标实验可以加硫代硫酸钠标准溶液么?
有0,.1mol硫代硫酸钠滴定17%一元过氧乙酸时,先加5ml硫酸(1+9),然后加3滴钼酸铵,然后加入10ml稀释后的过氧乙酸,然后加10ml碘化钾(100g/L),在阴暗处放置10min,由于过氧乙酸含量较高,所以每次碘量瓶中有大量碘析出,滴定结果每次消耗的硫代硫酸钠体积都基本不一样(同一容量瓶里取出的3个样,其结果也都不太一致),这是由于滴定速度问题还是摇动速度问题,不明所以,请大神指点
用碘标液滴定硫代酸钠溶液,一个是纯硫代酸钠溶液,另个是硫代酸钠和硫氰酸钠混合液。硫代酸钠的浓度都是相同的。但是滴定结果是纯硫代酸钠溶液消耗的碘标液量比硫代酸钠和硫氰酸钠混合液碘标液量多。请问是硫氰酸钠和硫代酸钠反应吗?还是硫氰酸钠和缓冲液反应(缓冲液是冰乙酸和乙酸钠两种试剂)
碘和硫代硫酸钠标准溶液的配制和标定目的原理实验目的1 掌握I2和Na2S2O3溶液的配制方法与保存条件,配制0.05mol/dm3I2及Na2S2O3溶液;2 了解标定I2及Na2S2O3溶液浓度的原理和方法;3 掌握直接碘法和间接碘法的测定条件。实验原理碘法用的标准溶液主要有硫代硫酸钠和碘标准溶液两种。用升华法可制得纯粹的I2,纯I2可用作基准物,用纯I2可按直接法配制标准溶液。如用普通的I2配标准溶液,则应先配成近似浓度,然后再标定。I2微溶于水而易溶于KI溶液,但在稀的KI溶液中溶解得很慢,所以配制I2溶液时不能过早加水稀释,应先将I2与KI混合,用少量水充分研磨,溶解完全后再稀释。I2与KI间存在如下平衡I2 + I- = I-3游离I2容易挥发损失,这是影响碘溶液稳定性的原因之一。因此溶液中应维持适当过量的I-离子,以减少I2的挥发。空气能氧化I-离子,引起I2浓度增加4 I- + O2 + 4 H+ = 2 I2 + 2 H2O此氧化作用缓慢,但能为光、热及酸的作用而加速,因此I2溶液应贮于棕色瓶中置冷暗处保存。I2能缓慢腐蚀橡胶和其他有机物,所以I2溶液应避免与这类物质接触。标定I2溶液浓度的最好方法是用三氧化二砷As2O3(俗名砒霜,剧毒!)作基准物。As2O3难溶于水,易溶于碱性溶液中生成亚砷酸盐:As2O3 + 6 OH- 2 AsO33- + 3 H2O亚砷酸盐与I2的反应是可逆的AsO33-+I2+H2O AsO43-+2I-+2H+随着滴定反应的进行,溶液酸度增加,反应将反方向进行,即AsO3-4离子将氧化I-离子,使滴定反应不能完成。但是又不能在强碱溶液中进行滴定,因此一般在酸性溶液中加入过量NaHCO3,使溶液的pH值保持在8左右,所以实际上滴定反应是:I2+ AsO33-+2HCO3- = 2 I- + AsO43- + 2CO2 + H2OI2溶液的浓度,也可用Na2S2O3标准溶液来标定。硫代硫酸钠(Na2S2O35H2O)一般都含有少量杂质,如S、Na2SO3、Na2SO4、Na2CO3及NaCl等,同时还容易风化和潮解,因此不能直接配制准确浓度的溶液。Na2S2O3溶液易受空气和微生物等的作用而分解:(1)溶解的CO2的作用:Na2S2O3在中性或碱性溶液中较稳定,当pH<4.6时即不稳定。溶液中含有CO2时,它会促进Na2S2O3分解Na2S2O3 + H2CO3 NaHSO3 + NaHCO3 + S此分解作用一般发生在溶液配成后的最初十天内。分解后一分子Na2S2O3变成了一分子NaHSO3,一分子Na2S2O3只能和一个碘原子作用,而一分子NaH3却能和二个碘原子作用,因此从应能力看溶液的浓度增加了。以后由于空气的氧化作用,浓度又慢慢减小。在pH=9-10间硫代硫酸盐溶液最为稳定,所以要在Na2S2O3溶液中加入少量NaHCO3。(2)空气的氧化作用: 2Na2S2O3+O2 2Na2SO4 + 2S(3)微生物的作用:这是使Na2S2O3分解的主要原因。为了避免微生物的分解作用,可加入少量HgI2 (10mg /dm3)。为了减少溶解在水中的CO2和杀死水中微生物,应用新煮沸后冷却的蒸馏水配制溶液并加入少量Na2CO3(浓度约为0.02%),以防止Na2S2O3分解。日光能促进Na2S2O3溶液分解,所以Na2S2O3溶液应贮于棕色瓶中,放置暗处,经8-14d再标定。长期使用的溶液应定期标定。若保存得好可每两月标定一次。通常用K2Cr2O7作基准物标定Na2S2O3溶液的浓度。K2Cr2O7先与KI反应析出I2Cr2O72- + 6 I- + 14 H+ = 2 Cr3+ + 3 I2 + 7H2O析出的I2再用标准Na2S2O3溶液滴定I2 + 2 S2O32- = S4O62- + 2 I-这个标定方法是间接碘法的应用。仪器药品Na2S2O35H2O(固),Na2CO3(固),KI(固),As2O3(A.R.或基准试剂),I2(固),可溶性淀粉,K2Cr2O7 (A.R.或基准试剂)。10%KI溶液,2mol/dm3HCl溶液,1mol/dm3NaOH溶液,4%NaHCO3溶液,0.5mol/dm3H2SO4溶液,1%酚酞溶液。过程步骤一、 0.05mol/dm3I2溶液的配制称取13g I2和40g KI置于小研钵或小烧杯中,加水少许,研磨或搅拌至I2全部溶解后,转移入棕色瓶中,加水稀释至一升,塞紧,摇匀后放置过夜再标定。二、0.1mol/dm3Na2S2O3溶液的配制一般分析使用0.1mol/dm3Na2S2O3标准溶液,如果选择的测定实验需用0.05mol/dm3(或其他浓度)Na2S2O3溶液,则此处应配制0.05mol/dm3(或其他浓度)的标准溶液。称取25gNa2S2O35H2O于500ml烧杯中,加入300ml新煮沸已冷却的蒸馏水,待完全溶解后,加入0.2gNa2CO3,然后用新煮沸已冷却的蒸馏水稀释至一升,贮于棕色瓶中,在暗处放置7-14d后标定。三、0.05mol/dm3I2溶液浓度的标定(1)用As2O3标定:准确称取在H2SO4干燥器中干燥24h的As2O3,置于250ml锥形瓶中,加入1mol/dm3NaOH溶液10ml,待As2O3完全溶解后,加1滴酚酞指示剂,用0.5mol/dm3 H2SO4溶液或HCl溶液中和至成微酸性,然后加入25ml 4% NaHCO3溶液和1ml1%淀粉溶液,(加入NaHCO3溶液时,应用小表皿盖住瓶口,缓缓加入,以免发泡剧烈而引起溅失,反应完毕,将表皿上的附着物洗入锥形瓶中)。再用I2标准溶液滴定至出现蓝色,即为终点。(I2能与橡胶发生作用,因此I2溶液不能装在碱式滴定管中。) 根据I2溶液的用量及As2O3的质量计算I2标准溶液的浓度。(2)用Na2S2O3标准溶液标定:准确吸取25ml I2标准溶液置于250ml碘量瓶中,加50ml水,用0.1mol/dm3 Na2S2O3标准溶液滴定至呈浅黄色后,加入1%淀粉溶液1ml,用Na2S2O3溶液继续滴定至蓝色恰好消失,即为终点。淀粉指示剂不能过早加入,则大量的I2与淀粉结合成蓝色物质,这一部分I2不容易与Na2S2O3反应,因而使滴定发生误差。也可用I2标准溶液滴定预先加有淀粉指示剂的一定量Na2S2O3溶液。根据Na2S2O3及I2溶液的用量和Na2S2O3溶液的浓度,计算I2标准溶液的浓度。四、0.1mol/dm3Na2S2O3溶液浓度的标定准确称取已烘干的K2Cr2O7(A.R.,其质量相当于20-30ml 0.1mol/dm3Na2S2O3溶液)于250ml碘量瓶中,加入10-20ml水使之溶解。再加入20ml 10%KI溶液(或2g固体KI)和6mol/dm3 HCl溶液5ml,混匀后用表皿盖好,放在暗天处5min。如果Na2S2O3溶液浓度较稀,标定用的K2Cr2O7称取量较小时,可采用大样的办法,即称取5倍量(按消耗20—30ml Na2S2O3计算的量)的K2Cr2O7溶于水后,配成100ml溶液,再吸取20ml进行标定。K2Cr2O7与KI的反应不是立刻完成的,在稀溶液中反应更慢,因此应等反应完成后再加水稀释。在上述条件下,大约经5min反应即可完成。用50ml水稀释,用0.1mol /dm3Na2S2O3溶液滴定到呈浅黄绿色。加入1%淀粉溶液1ml,继续滴定至蓝色变绿色,终点滴定完了的溶液放置后会变蓝色。如果不是很快变蓝(经过5—10min),那就是由于空气氧化所致。如果很快而且又不断变蓝,说明K2Cr2O7和KI的作用在滴定前进行得不完全,溶液稀释得太早。遇此情况,实验应重做。生成的Cr3+离子显蓝绿色,妨碍终点观察。滴定前预先稀释,可使Cr3+离子浓度降低,蓝绿色变浅,终点时溶液由蓝变到绿,容易观察。同时稀释也使溶液的酸度降低,适于用Na2S2O3滴定I2。根据K2Cr2O7的质量及消耗的Na2S2O3溶液体积,计算Na2S2O3溶液的浓度。分析思考1 如何配制和保存浓度比较稳定的I2和Na2S2O3标准溶液?2 用As2O3作基准物标定I2溶液时,为什么先要加酸至呈微酸性,还要加入NaHCO3溶液?As2O3与I2的化学计量关系是什么?3 用K2Cr2O7作基准物标定Na2S2O3溶液时,为什么要加入过量的KI和HCl溶液?为什么放置一定时间后才加水稀释?如果:(1)加KI溶液而不加HCl溶液,(2)加酸后不放置暗处,(3)不放置或少放置一定时间即加水稀释,会产生什么影响?4 为什么用I2溶液滴定Na2S2O3溶液时应预先加入淀粉指示剂?而用Na2S2O3滴定I2溶液时必须在将近终点之前才加入?5 马铃薯和稻米等都含淀粉,它们的溶液是否可用作指示剂?6 淀粉指示剂的用量为什么要多达1ml(1%)?和其他滴定方法一样,只加几滴行不行?7 如果分析的试样不同,Na2S2O3和I2标准溶液的浓度是否都应配成0.1mol/dm3和0.05mol/dm3?8 如果Na2S2O3标准溶液是用来分析铜的,为什么可用纯铜作基准物标定Na2S4O3溶液的浓度?
在配制硫代硫酸钠标准溶液时,根据GB/T601-2002的标准配制时有这样的情况想跟大家讨论一下: 在配制时要加0.2g的碳酸钠,不知道有什么作用?而且有碳酸钠会使加速硫的生成。请问大家有必要加碳酸钠么?我们以前学的是不用加的。
各位大神好:想咨询下大家在日常检测工作中使用到的一种化学试剂,硫代硫酸钠标准溶液,我们是买的固体试剂,然后自己配制标定。在GB/T601中,是这样的配制方法:称取26g硫代硫酸钠,加0.2g无水碳酸钠,溶于1000ml水中,缓慢煮沸10min,冷却。放置两周后过滤。这个方法里有两个很关键的操作步骤:煮沸水溶液,放置后过滤。但是由于我们的用量较大,一次性配制25L,所以会先称650g到2000ml烧杯中,然后加水溶解,再放在加热板上煮沸,放置两周后,过滤。这样操作和国标有点不符。各位大神帮忙看下有没有更好的方法?有没有也是这样操作的?