今天做乌药干浸膏中乌药醚内酯含量测定时没有出现目标峰,对照品峰良好;先前已经对乌药中乌药醚内酯的含量进行了测定(第一种,按药典方法,加适量乙醚用索氏提取器提取了4小时,再用甲醇洗涤定容过滤就行了;第二种,直接精密加甲醇50毫升超声提取30分钟,再补重就行了;两种方法得出的含量相差无几,且高出标准3倍),今天测乌药干浸膏含量测定时也都用了上述药材提取这两种方法,但基本都没有什么响应,取样量也比较大,跟药材差不多(药材是1克),按道理峰响应应该比药材更高!!!但怎么会没峰呢?是提取方法有问题吗?还是其他方面的原因?请做过这方面工作的大侠帮忙分析分析乌药干浸膏提取工艺( 1 .提取 取净乌药片,置提取罐内加水煎煮二次,第一次加水量为药材重量的3倍,密闭煎煮2小时,第二次加水量为药材重量的2倍,密闭煎煮2小时,气压均恒定在0.2—0.5kg/平方厘米,温度恒定在100℃—110℃。合并煎煮液滤过,静置24小时。 2 .浓缩 取静置滤液,用新型三效浓缩器浓缩。浓缩温度控制在75℃左右,真空度/蒸汽压力为0.06/0.09Mpa,浓缩至流体相对密度为1.10-1.20左右(60℃)3.干燥 流体用不锈钢盘盛好放入真空干燥炬内进行减压干燥,水分控制在3—3.5%之间。)
做乌药醚内酯含量测定,流动相是乙腈-水(56:44),分离不开,还有拖尾,柱子是C18,流速1.0,求各位大侠帮忙
各位大侠:您们好!我做乌药中乌药醚内酯含量测定,流动相乙腈-水(56:44),柱子温度40,流速0.8,在做校准曲线的时候遇到这样的问题。乌药醚内酯标准品精密称2份,按照常理来说,浓度大的对应的峰面积大一些,但是结果刚好相反,浓度大的峰面积小,浓度小的峰面积大,做出的校准曲线与理论校准曲线不一样,结果算出的样品浓度是负值。我还以为在配制标准品的时候弄反,重新做一遍还是这样的,不知道大家有没有遇到过这样的问题,交流一下,为这事情我也挺心急的。
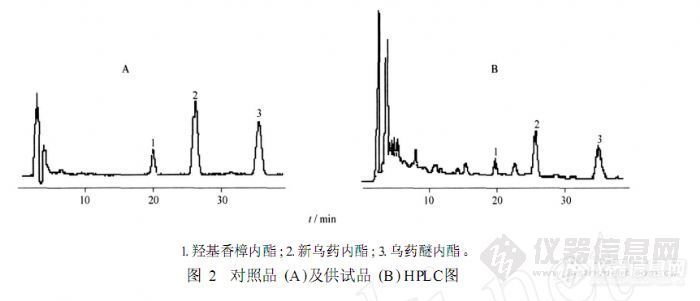
【作者】 郑运亮; 栾连军; 甘礼社; 周长新; 吴永江;【Author】 ZHENG Yunliang,LUAN Lianjun,GAN Lishe,ZHOU Changxin,WU Yongjiang* (Institute of Modern Chinese Medicine,College of Pharmaceutical Sciences,Zhejiang University,Hangzhou 310058,China)【机构】 浙江大学药学院现代中药研究所;【摘要】 目的:建立同时测定乌药中3种倍半萜内酯含量的HPLC法。方法:DiamonsilTM(钻石)C18色谱柱(4.6 mm×250 mm,5μm);流动相乙腈-0.1%磷酸水溶液(45∶55),流速为1 mL.min-1,检测波长220 nm。结果:羟基香樟内酯在0.0018~0.036 0 g.L-1,新乌药内酯在0.016 2~0.323 2 g.L-1,乌药醚内酯在0.010 5~0.209 9 g.L-1与峰面积呈良好的线性关系,R2分别为0.999 8,0.999 9,0.999 9,平均加样回收率分别为100.0%,98.8%,98.9%,RSD分别为3.3%,1.9%,1.6%。结论:本方法快速简便、灵敏、可靠,为乌药的质量评价提供了科学依据。http://ng1.17img.cn/bbsfiles/images/2012/07/201207301622_380615_2379123_3.jpg
泛解酸内酯分析方法,还有标准物纯度98%或者99%可以做外标曲线么?
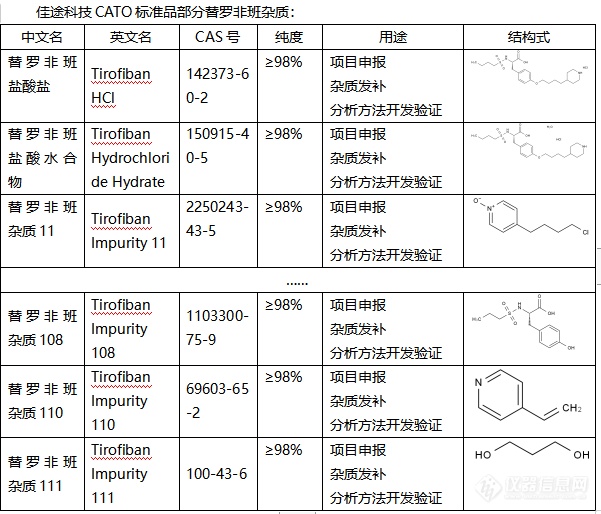
在当今的医疗领域,药物的质量控制至关重要,直接关系到患者的生命健康。替罗非班是一种广泛应用于心血管疾病治疗的药品,其质量控制尤为重要。而杂质分析作为药物质量控制的关键环节,能够准确评估药物的安全性和有效性。本文将重点探讨替罗非班杂质分析与CATO标准品应用研究的重要性。首先,杂质分析是确保药物质量的重要手段。在替罗非班的制备过程中,可能会产生一系列杂质,这些杂质的存在可能对药物的疗效和安全性产生不良影响。CATO标准品作为一种有效的分析工具,能够准确鉴定和量化替罗非班中的杂质,为药物的质量控制提供科学依据。其次,CATO标准品的应用有助于深入了解杂质的来源和性质。通过与标准品的比对分析,研究人员可以追溯杂质的产生途径,从而优化生产工艺,降低杂质的产生。此外,CATO标准品还可以用于评估杂质的毒性和风险,为药物的安全性评价提供有力支持。此外,CATO标准品在指导药物生产和改进方面也具有重要意义。通过对替罗非班中杂质的准确分析,生产商可以针对性地优化生产工艺、加强质量控制,从而提高药物的纯度和安全性。这不仅有助于保障患者的用药安全,还有助于提升企业的生产效益和市场竞争力。综上所述,替罗非班杂质分析与CATO标准品应用研究在药物质量控制中发挥着关键作用。通过深入研究替罗非班中的杂质,并借助CATO标准品这一强大工具,我们能够更好地了解杂质的来源、性质和影响,从而优化药物的生产工艺、提升药物的安全性和有效性。[img=,601,514]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021849065001_3752_6381568_3.png!w601x514.jpg[/img]欢迎有需要的各位联系
食品分析中标准物的管理及其标准溶液的校正一、意义食品分析标准物质是分析方法质控的核心,是定性和定量的依据。标准物质以一定纯度和浓度配制的溶液称标准溶液,其稳定性受其自身降解、化学转化、溶质和溶剂挥发等内在因素的影响,又受其存放条件如温度、湿度、光线照射、存放时间、存放容器及其配制技巧等外界条件的影响。由于影响标准物及其标准液的因素较多,如果条件控制不当或管理不严密,标准物质浓度易发生变化,这是食品分析中难以进行质量控制的主要原因。以上原因也是实验室食品分析测定产生误差的最主要因素,要减小这些产生误差的主要因素,就要特别注重标准物管理,以及进行标准溶液的稳定性观察和校正工作,也是实验室质量控制关键工作之一。当标准溶液发生变化时就要重新配制,并找出变化原因,为分析工作积累经验,并可写入方法注释中。在食品分析质量控制中,准确度和精密度的提高,是以标准溶液稳定性和准确性为前提的,因此对于标准溶液稳定性和准确性的关键技术问题,是质量控制的核心问题。二、标准物质的管理 1、容量分析的基准物是标定其它标准溶液的基准,应购买基准试剂,它可以保证其纯度。另一个因素是水份的影响,用前应充分干燥和恒重,配制时量器要校正。溶剂要纯化,使用的容器要充分洗涤。最终目的都是防止基准物的化合损失。2、用于分光光度分析的标准物,分有机的和无机的标准物,无机标准稳定性好,但使用液浓度低时,极易被容器吸附,并与容器中离子进行交换,因此决定了其稀溶液使用时间短。玻璃容器在碱性介质中易溶出,塑料容器在成型时加入助剂时也含有不同金属杂质,容易溶出如Zn、Ca等金属离子。有机标准最好不放在塑料制容器中,因塑料在成型时加入的有成份比较复杂的助剂和增塑剂。标准使用液应现用现配为最佳。三、标准物存放使用1、无机的标准物要求在干燥并无化学干扰物的条件下存放,选择合适干燥剂如硅胶和分子筛。有机标准物最好分装封入安培瓶中低温避光保存。固体的多环芳烃可配制成溶液,再分装在安瓿瓶中保留溶剂封存,也可把溶剂挥掉后干燥封存,使用时再定容,后一种方法更为稳妥些。配制好一批标准溶液,再一支一支使用也是很方便的。如果液体的标准物特别是几种标准的混合物用于色谱分析同系物如醇类物质,可同时配制一批分装安瓿瓶低温存放,再一支一支使用,能避免溶剂挥发体积变化产生的误差。这种做法更适于实验室间的标准分发和校正工作。最难办的是气体,标准如氯乙烯、氟里昂,最好是钢瓶中存放,或配制钢瓶标准气。这些条件不具备时也可以选择高沸点溶剂,密封溶解这些气体,称量溶质重量,一次性使用。从这一事实出发,气体,测定误差可以稍加放宽,因为标准自身稳定性差。2、用于色谱分析的标准物要求色谱纯,其配剂溶液剂也要求色谱纯,准确配制前要在色谱上进行检查。特别是几种标准进行混合更应慎重,每种要严格检查否则给定性定量带来很多麻烦。如果纯度不够时可以纯化,再结晶或用制备色谱制备。勉强使用是无益的。四、标准溶液的校正1、从安瓿瓶分装标准溶液无论是有机的或是无机的用于校正是很方便的。如原子吸收测定金属,从安瓿瓶中取一定量配制浓度系列,再封存。每隔一段时间(1~2周)再用原溶液配制同样浓度系列,严格控制仪器条件来比较二次标准曲线的斜率,斜率下降时表明有损失。2、相同浓度同时配制的标准的几支安瓿瓶,先用打开的一支标准的测定值与间隔一段时间后打开的另一支标准的测定值进行比较,以此类推最后在一段时间内几支同时测定,其变异程度就是标准在这段时间稳定性变化程度。3、几个实验室用同一标准物分别配制相同浓度标准液,各自进行标准曲线的测定,再按规定交换该标准液再进行测定,比较测定结果差异来观察同一标准的时间和空间变异。如果标准液稳定,配制不准确的实验室很容易查出。配制都准确时,标准液若不稳定时,会使各实验室的测得值都偏低。4、同种标准物来源不同,也应采用分别配制交叉测定的办法来检查标准的纯度及配制是否准确。在食品分析中无论用何种手段分析样品,所使用的标准物应作统一的或确切的规定。例如:过硫酸铵测锰,用MnSO4·H2O作为标准使用,到底硫酸锰需要不需要烘烤呢?对于这个问题,在一部份的教科书中有规定烘烤的,也有不烘烤的。按照MnSO4·H2O的性质遇到空气可能吸潮或风化,如果直接称重计算Mn量,就有可能出现误差。用烘烤称重测得水分所含的量比理论值高1.6%,有同一硫酸锰配制锰标准溶液测一合成水样,使用烘烤后配制的锰标准溶液,测得的Mn含量为0.205mg/L,未烘烤过的则高达约2.3%,从中说明硫酸锰在配制标准溶液时应经过烘烤,使标准一致。
[color=#444444]求助用[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]分析混合液中γ-戊内酯含量的方法(最好是[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]外标法)。混合液中可能含有乙酰丙酸、甲酸、乙醇、水、γ-戊内酯等物质。应该用什么规格的色谱柱。标准液要稀释到多少。求助详细的分析方法。希望各位帮忙。万分感谢![/color]
药品质量标准分析方法验证的目的是证明采用的方法适合于相应检测要求。在建立药品质量标准时,分析方法需经验证;在药品生产工艺变更、制剂的组分变更、原分析方法进行修订时,则质量标准分析方法也需进行验证。方法验证理由、过程和结果均应记载在药品标准起草说明或修订说明中。 需验证的分析项目有:鉴别试验,杂质定量检查或限度检查,原料药或制剂中有效成分含量测定,以及制剂中的其他成分(如防腐剂等)的测定。药品溶出度、释放度等功能检查中,其溶出量等的测试方法也应作必要验证。 验证内容有:准确度、精密度(包括重复性、中间精密度和重现性)、专属性、检测限、定量限、线性、范围和耐用性。视具体方法拟订验证的内容。附表中列出的分析项目和相应的验证内容可供参考。 方法验证内容如下。一、准确度准确度系指用该方法测定的结果与真实值或参考值接近的程度,一般用回收率(%)表示。准确度应在规定的范围内测试。 1.含量测定方法的准确度 原料药可用已知纯度的对照品或样品进行测定,或用本法所得结果与已知准确度的另一个方法测定的结果进行比较。制剂可用含已知量被测物的各组分混合物进行测定。如不能得到制剂的全部组分,可向制剂中加入已知量的被测物进行测定,或用本法所得结果与已知准确度的另一个方法测定结果进行比较。 如该分析方法已经测试并求出了精密度、线性和专属性,在准确度也可推算出来的情况下,这一项可不必再做。 2.杂质定量测定的准确度 可向原料药或制剂中加入已知量杂质进行测定。如不能得到杂质或降解产物,可用本法测定结果与另一成熟的方法进行比较,如药典标准方法或经过验证的方法。在不能测得杂质或降解产物的响应因子或对原料药的相对响应因子情况下,可用原料药的响应因子。应明确表明单个杂质和杂质总量相当于主成分的重量比(%)或面积比(%)。 3.数据要求 在规定范围内,至少用9个测定结果进行评价,例如,设计3个不同浓度,每个浓度各分别制备3份供试品溶液,进行测定。应报告已知加入量的回收率(%),或测定结果平均值与真实值之差及其相对标准偏差或可信限。 (意见3:是否对所设定的浓度范围作出要求,如:该方法用于药品的含量测定,回收率试验的样品浓度应设定于含量100%的±20%之间;用于溶出(释放)曲线考察时,回收率试验的样品浓度应设定于全曲线范围的上、中、下部位。)二、精密度 精密度系指在规定的测试条件下,同一个均匀样品,经多次取样测定所得结果之间的接近程度。精密度一般用偏差、标准偏差或相对标准偏差表示。 在相同条件下,由一个分析人员测定所得结果的精密度称为重复性;在同一个实验室,不同时间由不同分析人员用不同设备测定结果之间的精密度,称为中间精密度;在不同实验室由不同分析人员测定结果之间的精密度,称为重现性。 含量测定和杂质的定量测定应考虑方法的精密度。 1.重复性 在规定范围内,至少用9个测定结果进行评价,例如,设计3个不同浓度,每个浓度各分别制备3份供试溶液,进行测定。或100%的浓度水平,用至少测定6次的结果进行评价。 2.中间精密度 为考察随机变动因素对精密度的影响,应设计方案进行中间精密度试验。变动因素为不同日期、不同分析人员、不同设备。 3.重现性 当分析方法将被法定标准采用,应进行重现性试验,例如,建立药典分析方法时通过协同检验得出重现性结果。协同检验的目的、过程和重现性结果均应记载在起草说明中。应注意重现性试验用的样品本身的质量均匀性和贮存运输中的环境影响因素,以免影响重现性结果。 4.数据要求 均应报告标准偏差、相对标准偏差和可信限。三、专属性 专属性系指在其他成分(如杂质、降解产物、辅料等)可能存在下,采用的方法能正确测定出被测物的特性。鉴别反应、杂质检查、含量测定方法均应考察其专属性。如方法不够专属,应采用多个方法予以补充。 1.鉴别反应 应能与可能共存的物质或结构相似化合物区分。不含被测成分的样品,以及结构相似或组分中的有关化合物,应均呈负反应(不呈正反应?)。2.含量测定和杂质测定 色谱法和其他分离方法,应附代表性图谱,以说明方法的专属性,并应标明诸成分在图中的位置。色谱法中的分离度应符合要求。 在杂质可获得的情况下,对于含量测定,试样中可加入杂质或辅料,考察测定结果是否受干扰,并可与未加杂质或辅料的试样比较测定结果。对于杂质测定也可向试样中加入一定量的杂质,考察杂质能否得到分离。 在杂质或降解产物不能获得的情况下,可将含有杂质或降解产物的试样进行测定,与另一个经验证了的或药典方法比较结果。用强光照射,高温,高湿,酸、碱水解或氧化的方法进行加速破坏,以研究可能的降解产物和降解途径。含量测定方法应比对二法的结果,杂质检查应比对检出的杂质个数,必要时可采用二极管阵列检测和质谱检测,进行峰纯度检查。四、检测限 检测限系指试样中被测物能被检测出的最低量。药品的鉴别试验和杂质检查方法,均应通过测试确定方法的检测限。常用的方法如下。 1.非仪器分析目视法用已知浓度的被测物,试验出能被可靠地检测出的最低浓度或量。 2.信噪比法 用于能显示基线噪声的分析方法,即把已知低浓度试样测出的信号与空白样品测出的信号进行比较,算出能被可靠地检测出的最低浓度或量。一般以信噪比为3∶1或2∶1时相应浓度或注入仪器的量确定检测限。 3.数据要求 应附测试图谱,说明测试过程和检测限结果。五、定量限 定量限系指样品中被测物能被定量测定的最低量,其测定结果应具一定准确度和精密度。杂质和降解产物用定量测定方法研究时,应确定方法的定量限。 常用信噪比法确定定量限。一般以信噪比为10∶1时相应浓度或注入仪器的量确定定量限。六、线性 线性系指在设计的范围内,测试结果与试样中被测物浓度直接呈正比关系的程度。 应在规定的范围内测定线性关系。可用一贮备液经精密稀释,或分别精密称样,制备一系列供试样品的方法进行测定,至少制备5份供试样品。以测得的响应信号作为被测物浓度的函数作图,观察是否呈线性,再用最小二乘法进行线性回归。必要时,响应信号可经数学转换,再进行线性回归计算。 数据要求:应列出回归方程、相关系数和线性图。(意见4:“线性”、“范围”中,如测定方法用于溶出(释放)曲线考察时,是否规定样品浓度的范围应涵盖整条曲线。)七、范围 范围系指能达到一定精密度、准确度和线性,测试方法适用的高低限浓度或量的区间。 范围应根据分析方法的具体应用和线性、准确度、精密度结果和要求确定。原料药和制剂含量测定,范围应为测试浓度的80%~120%;制剂含量均匀度检查,范围应为测试浓度的70%~130%,根据剂型特点,如气雾剂、喷雾剂,范围可适当放宽;溶出度或释放度中的溶出量测定,范围应为限度的±20%,如规定了限度范围,则应为下限的-20%至上限的+20%;杂质测定,研究时,范围应根据初步实测,拟订为规定限度的±20%。如果含量测定与杂质检查同时进行,用百分归一化法,则线性范围应为杂质规定限度的-20%至含量限度(或上限)的+20%。八、耐用性 耐用性系指在测定条件有小的变动时,测定结果不受影响的承受程度,为把方法用于常规检验提供依据。开始研究分析方法时就应考虑其耐用性。如果测试条件要求苛刻,则应在方法中写明。典型的变动因素有:被测溶液的稳定性,样品的提取次数、时间等。液相色谱法中典型的变动因素有:流动相的组成和pH值,不同厂牌或不同批号的同类型色谱柱,柱温,流速等。气相色谱法变动因素有:不同厂牌或批号的色谱柱、固定相,不同类型的担体,柱温,进样口和检测器温度等。 经试验,应说明小的变动能否通过设计的系统适用性试验,以确保方法有效。 附表 检验项目和验证内容 项目 鉴别 杂质测定 含量测定及溶出量测定 内容 定量 限度 准确度 - + - + 精密度 - - - + 重复性 - + - + 中间精密度- +① - +① 专属性② + + + + 检测限 - -③ + - 定量限 - + - - 线性 - + - + 范围 - + - + 耐用性 + + + + ① 已有重现性验证,不需验证中间精密度。 ② 如一种方法不够专属,可用其他分析方法予以补充。 ③ 视具体情况予以验证。
药品分析中标准品和对照品有什么区别?
药品分析中标准品和对照品有什么区别?
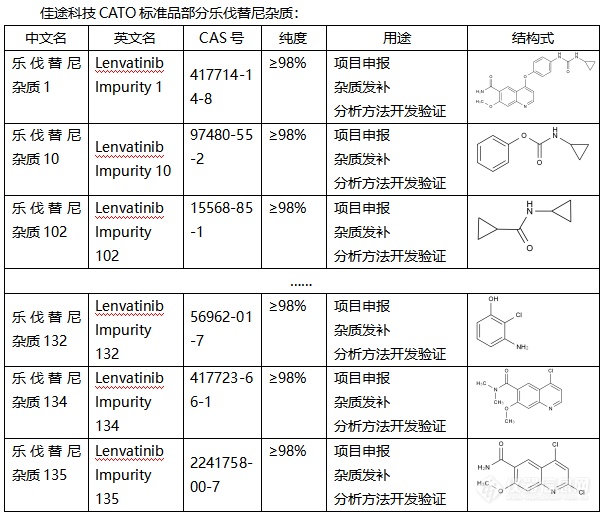
乐伐替尼,作为现代医学的瑰宝,广泛应用于肿瘤治疗领域。然而,就像其他药物一样,乐伐替尼在生产过程中也可能会产生杂质。这些微小的杂质,虽然量少,却可能对药物的疗效和安全性产生不可忽视的影响。为了确保乐伐替尼的纯净与安全,科学家们引入了CATO标准品进行杂质分析。CATO标准品,就像一把精准的尺子,能够帮助研究人员准确地检测和衡量乐伐替尼中的杂质。通过对比和分析,我们可以清楚地了解杂质的种类、数量以及可能对药物产生的影响。这项应用研究不仅提升了乐伐替尼的生产质量,更为患者的安全用药提供了有力保障。借助CATO标准品,我们能够及时发现并控制杂质,确保每一颗乐伐替尼都是纯净、有效的。未来,随着科学技术的不断进步,我们期待看到更多关于乐伐替尼杂质分析的研究成果,为患者带来更加安全、可靠的治疗方案。同时,也期待CATO标准品在更多药物杂质分析中发挥重要作用,守护人类的健康与安全。[img=,603,515]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021836237186_8744_6381568_3.png!w603x515.jpg[/img]广州佳途科技股份有限公司是一家专业的CATO标准品生产厂家,我们目前库存有全套乐伐替尼杂质,能够提供相应的系列图谱和产品COA证书,并支持溯源。我们公司已经通过了国内外双ISO 17034质量体系认证,欢迎广大客户选购。
药品分析中标准品和对照品有什么区别?
目前要检测一类有机物,带有羧基,还有烃基,想用GC/MS去测,但是不知道有没有标准品,请大神分析一下,指点指点。如果GC/MS不适合,用什么质谱仪器最好?如果没有标准品最好能推荐几种内标物。十分感谢。http://muchongimg.xmcimg.com/data/bcs/2017/0112/w155h496848_1484232405_311.jpg
SNT 2311-2009 进出口乳及乳制品中大环内酯类药物残留检测方法 放射受体分析法
《我国与CAC关于食品中污染物限量标准的对比分析》摘要:对比分析我国与国际食品法典委员会(CAC)关于食品中污染物限量标准的异同。从标准涉及的污染物种类、具体食品种类和限量值3个层面逐级对比。结果表明,我国标准涉及的污染物种类为42种,CAC标准为29种,二者相同的污染物种类为12种;我国标准涉及的食品种类和具体数量多于CAC,其中有7类食品为我国单独规定限量,我国污染物限量指标的总数为748个,远远多于CAC的174个;在可比指标范围内,我国有61个限量指标值与CAC相同,26个限量指标值严于CAC,64个限量指标值宽于CAC。我国污染物限量标准中有57%的可比指标值已达到或超过CAC标准的要求,与CAC的一致性程度较低。

[b][center]【第二届网络原创作品赛】药品(原料,成品、制剂)质量标准研究浅析[/center][/b][center][img]http://ng1.17img.cn/bbsfiles/images/2009/08/200908241737_167440_1600062_3.gif[/img][/center][center][img]http://ng1.17img.cn/bbsfiles/images/2009/08/200908241809_167443_1600062_3.jpg[/img][/center]从事药品研究的对于药品的质量标准制定是再熟悉不过了,文献报道的也非常多(这里主要是针对中药药品的质量标准制定)。有很多是来自国家课题,如对某些药品尚缺质量标准,有的是标准的提高(采用了更为先进的方法等),有的是对药品质量标准增加检测项,有的是来自国家药典委员会的研究项目等等。药品质量标准研究结构清晰,有章可循,从宏观上看是没有很大问题。但是在理清质量分析的基础上涉及到的具体方法研究和条件探索有的时候并不是一件容易的事。标准制定研究是一项细心的活,工作量大,有时由于时间的限制压力也很大,所以比较适合女孩子做。当然男孩子做,没问题,只要养成细心的习惯就好。质量标准制定,估计药厂里面做的不是很多(当然不排除),药厂做的是对原料、中间体和成品的检测(按照中国药典、部颁标准或企业标准)。质量标准研究做的比较多的是一些研究机构,如药检所,药物研究中心,药物检测中心或国家药监局、省药检所指定的事业单位或企业部门。好了,现在分别讨论对原料药、成品和制剂的有关质量研究发表下自己的看法和体会,以下内容仅代表自己的观点,如果有什么不对的地方,还请板油批评指出。[b]一、原料药的质量标准研究[/b]一种成药来自一味原料药的并不多,绝大多是复方,否则就没有处方保密问题了。现在以一味复方成品药为例来说明原料药的质量标准。首先了解该复方的处方组成(这不是废话嘛,呵呵,别急),如有A、B、C三味原料药组成。则需要对三味原料药进行质量标准的制定。三味药根据其入药成分的不同,分别采取不同的分析方法,不过其中原料的性状鉴别、显微鉴别是一样的。1、性状性状鉴别就是观察颜色,形状,味道情况,在没有标准之前,老药工就是根据这个方法进行辨别药材的好坏。2、鉴别显微鉴别就是取原料组织进行切片,经过适当的处理后,放在显微镜下观察,包括石细胞,鞘细胞,导管等分布情况,并最好附照片。对于一些比较特殊的药材或矿物要,可以根据其结构与特定试剂反应,有颜色反应或沉淀生产,如棕榈的鉴别。薄层鉴别是中药质量评价过程中主要的鉴别手段之一。对于中药的鉴别,采用薄层是最好的,采用对照药材,对照品和阴性比照,可以很清晰的辨别药材的真伪。薄层鉴别有其很多优点,如成本低,分析时间短,分离效果非常好,检测不受溶剂干扰和色谱直观性强等优点,用它来做定性鉴别是最好不过的。药典中大多数都是使用薄层鉴别。对于没有标准的药物,制定薄层鉴别,对于有些药物,特别是复方,条件摸索还有些难度。通常的筛选条件有:薄层板的选择,大多数用的是硅胶G板;点样量的考察,多了超载分不开,少了,点不清晰;展开剂的选择,这属于薄层鉴别最重要的部分了。选择展开是依据分析样品的性质决定,相似相容。黄酮类、生物碱类、酚酸类等都有比较成熟的条件。关于展开剂的选择,网上的资料也很多,关键是经验和实践。对于薄层色谱样品和对照品以及阴性样品的制备,和液相的处理方式差不多,但是没有液相的严格。一般包括超声萃取和加热回流,当然还有普通的水煎,对于特殊样品还可以采取SPE(固体萃取)或SFE(超临界流体萃取)等。如果没有标准参考,需要对处理方法进行考察,包括萃取溶剂的选择,萃取时间,加热温度,回流溶剂,回流时间,溶剂的浓度,方法之间选定指标进行比较。阴性样品是除掉要检测的药材或成分后,和样品处理方法一致制备而成的。所以点样的点应包括:3个批号的样品、对照品、对照药材、阴性对照样品。对于薄层色谱的操作方法参考《中国药典》2005年版(很快就是2010年版)附录ⅥB。
国内最大最专业的国家标准物质服务平台坛墨质检-国家标准物质中心(北京坛墨质检科技有限公司),是国家质检总局指定的国家标准物质研制单位,是国内最大最专业的食品、环境、职业卫生标准物质生产商和服务商。 产品编号 产品名称 标准值 BW538720(R)人参皂苷Rg2对照品,有报告HPLC≥98%BW5388商陆皂苷甲; 商陆皂甙A对照品,有报告HPLC≥98%BW5389白当归脑对照品,有报告HPLC≥98%BW5390新橙皮苷二氢查尔酮对照品,有报告HPLC≥98%BW5391马钱苷酸; 马钱酸; 落干酸对照品,有报告HPLC≥98%BW5392仙鹤草酚B对照品,有报告HPLC≥98%BW5393升麻醇-3-O-β-D-吡喃木糖苷对照品,有报告HPLC≥98%BW5394牡荆素鼠李糖苷对照品,有报告HPLC≥98%BW5396人参皂苷F4对照品,有报告HPLC≥98%BW5399蔓荆子黄素对照品,有报告HPLC≥98%BW5401原苏木素B; 原巴西苏木素对照品,有报告HPLC≥98%BW5403乌药醚内酯对照品,有报告HPLC≥98%BW5404漆黄素;非瑟酮对照品,有报告HPLC≥98%BW5408白术内酯Ⅰ; 苍术内酯I对照品,有报告HPLC≥98%BW5410白术内酯III; 苍术内酯III对照品,有报告HPLC≥98%BW5412根皮素(三羟苯酚丙酮)对照品,有报告HPLC≥98%BW5413胆红素对照品,有报告HPLC≥98%BW5419瑞香素; 祖师麻甲素对照品,有报告HPLC≥98%BW5421重楼皂苷I;重楼皂甙I对照品,有报告HPLC≥98%BW5422重楼皂苷II;重楼皂甙II对照品,有报告HPLC≥98%BW5424重楼皂苷VI;重楼皂甙VI对照品,有报告HPLC≥98%BW5425重楼皂苷VII;重楼皂苷VII对照品,有报告HPLC≥98%BW5426乌金甙; 乌金苷对照品,有报告HPLC≥98%BW5427獐芽菜苷,当药苷对照品,有报告HPLC≥98%BW5430川陈皮素;川皮亭;蜜橘黄素对照品,有报告HPLC≥98%BW5431告达亭甙元; 告达亭苷元对照品,有报告HPLC≥98% 坛墨质检现有员工79人,办公室面积450平米,实验室1650平米;销售、客服、财务及行政人员35人,实验室工作人员21人,库房14人,市场部8人。实验仪器设备:气相色谱、液相色谱、气质联用、液质联用、离子色谱、紫外分光光度计,原子吸收、ICP-OES和ICP-MS;库房面积450平米,库房工作人员12人,现货产品5万个,坛墨质检自主研发的产品近3000个,已申报国标345项,填补国内空白的产品达到65项。坛墨质检是国内唯一提供标准溶液定制服务的标准物质研制单位,定制范围:特殊浓度定制、特殊溶剂定制、混标定制。
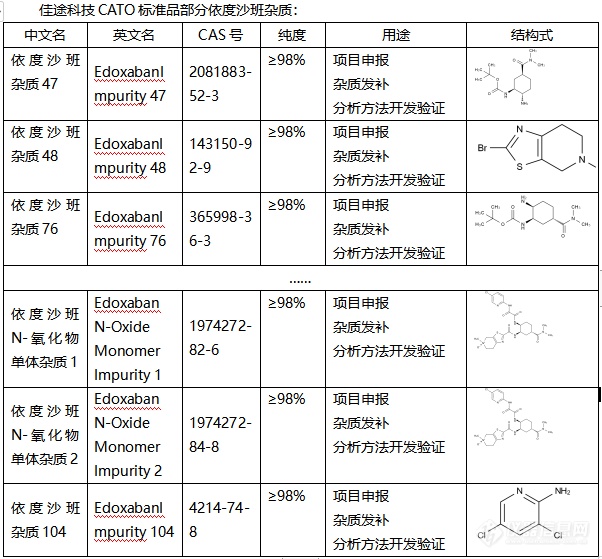
依度沙班,作为一种抗凝药物,被广泛应用于预防和治疗血栓形成。然而,与其他药物一样,依度沙班在生产过程中也可能产生杂质。这些杂质的存在可能会影响药物的安全性和有效性。为了确保依度沙班的质量,科学家们引入了CATO标准进行杂质分析。CATO标准是一种先进的分析方法,可以帮助研究人员准确地检测和衡量依度沙班中的杂质。通过对比和分析,我们可以清楚地了解杂质的种类、数量以及可能对药物产生的影响。这一标准的应用,不仅提高了依度沙班的生产质量,也为我们提供了一种有效的质量控制手段。在实际应用中,CATO标准品发挥着重要的作用。首先,它能够准确鉴定和量化依度沙班中的杂质,为药物的质量控制提供科学依据。其次,通过与标准品的比对分析,研究人员可以深入了解杂质的来源和性质,从而优化生产工艺,降低杂质的产生。此外,CATO标准品还可以用于评估杂质的毒性和风险,为药物的安全性评价提供有力支持。随着研究的深入,CATO标准在依度沙班杂质分析中的应用将不断优化和完善。通过科学的分析和严格的控制,我们能够确保依度沙班的安全性和有效性,为患者的健康提供更好的保障。同时,这也将推动药物生产的科技进步,造福更多患者。[img=,602,559]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021907159831_6894_6381568_3.png!w602x559.jpg[/img]广州佳途科技股份有限公司是一家专业的CATO标准品生产厂家,目前公司库存有全套乐伐替尼杂质,能够提供相应的系列图谱和产品COA证书,并且支持买家溯源。
[b]我国香蕉农药残留标准与国外标准的比较分析[/b][i]李玉萍,方佳,梁伟红,董定超[/i] 1 我国香蕉农药残留国家标准现状 在我国,水果农药残留国家标准开始于20世纪70年代末,起步较晚。经过20余年的努力,取得了可喜的成绩,截至到1999年9月底,我国已发布18个与水果有关的农药最大残留限量强制性国家标准,涉及50种农药。2005年1月我国又颁布新的国家标准《食品中农药最大残留限量》(GB2763-2005),将原先的18个标准代替。新标准规定了水果中70种农药的最大残留限量,其中仅有腈苯唑、咪鲜胺、丙环唑、戊唑醇、噻菌灵5种农药对香蕉的残留限量值作了专门规定;溴氰菊酯、乙烯利、代森锰锌3种农药对皮不可食的热带与亚热带水果作了专门规定;乙酰甲胺磷等13种农药对所有水果规定了统一的最大残留限量;多菌灵除对梨果类水果、葡萄作出专门规定外,对其他水果也都规定了相同的残留限量值。此外,在我国现行的《农产品安全质量无公害水果安全要求》(GB18406.2-2001)强制性国家标准中,也规定了无公害水果中22 种农药的最大残留限量值。综合上述国家标准,直接或间接涉及香蕉农药残留最大限量指标共33项,涉及农药33种。其中杀虫剂23种,杀菌剂8种,除草剂1种,植物生长调节剂1种。 2 国际及国外先进国家香蕉农药残留最大限量标准现状 食品法典委员会(Codex Alimentarius Commission,简称CAC)是世界上唯一的政府间协调国际食品标准法规的国际组织,成立于1962年,至今已拥有163个成员国。到目前为止,CAC 已规定了香蕉、葡萄、苹果等63种(类)水果及其产出品的最大农药残留限量,涉及农药100余种,其中有24种农药对香蕉作了专门规定(其中除草剂2种,杀虫剂9种,杀菌剂12种,杀螨剂1种)。 欧盟制定的香蕉农药最大残留限量标准涵盖180种农药。其中除草剂39种,杀虫剂73种,杀菌剂49种,杀螨剂9种,熏蒸剂2种,植物生长调节剂8种。 美国在美国联邦法规(CFR)第40篇第180部分对香蕉规定了详细的农药最大残留限量,涵盖农药47种,有些农药还分别对香蕉全果、果肉进行了规定。在47种农药中,包括除草剂10种,杀虫剂11种,杀菌剂23种,杀螨剂1种,熏蒸剂1种,植物生长调节剂1 种。 日本有91种农药对香蕉的农药最大残留限量进行了规定。其中除草剂16种,杀虫剂40种,杀菌剂27种,植物生长调节剂2种,薰蒸剂2种,杀螨剂4种。 3 我国与国外香蕉农药残留指标比对分 析3.1 我国香蕉农药残留指标与 CAC 比对分析 目前我国香蕉农药残留指标33项,涉及33种农药,CAC 香蕉农药残留指标24项,涉及24种农药。我国香蕉农药残留指标与CAC 相比,有6种农药与 CAC都有限量要求,其中指标相同的有腈苯唑、丙环唑、戊唑醇、噻菌灵4种,占我国香蕉指标的12.1%,占 CAC指标的16.7%;比 CAC 严的有克百威1种;比 CAC 宽的有百菌清1种。有27种农药我国有限量要求而CAC 却没有,有18种农药 CAC 有限量要求而我国却没有。
国内最大最专业的国家标准物质服务平台坛墨质检-国家标准物质中心(北京坛墨质检科技有限公司),是国家质检总局指定的国家标准物质研制单位,是国内最大最专业的食品、环境、职业卫生标准物质生产商和服务商。 产品编号 产品名称 标准值 BW5474红车轴草根苷(三叶豆根苷)对照品,有报告HPLC≥98%BW5476去氢二异丁香酚对照品,有报告HPLC≥98%BW5477利卡灵-B;利卡灵B对照品,有报告HPLC≥98%BW5478肉豆蔻木脂素对照品,有报告HPLC≥98%BW5479泽泻醇B-23-醋酸酯(泽泻醇B醋酸酯)对照品,有报告HPLC≥98%BW5481人参皂苷F1对照品,有报告HPLC≥98%BW5482人参皂苷F2对照品,有报告HPLC≥98%BW5483人参皂苷CK对照品,有报告HPLC≥98%BW5484异鼠李素-3-O-葡萄糖苷对照品,有报告HPLC≥98%BW5485草质素苷; 草质素甙对照品,有报告HPLC≥98%BW5486科罗索酸; 2-alpha-羟基熊果酸对照品,有报告HPLC≥98%BW5488白桦脂醇; 桦木醇对照品,有报告HPLC≥98%BW5489白桦脂醛对照品,有报告HPLC≥98%BW5490延龄草苷; 地索苷对照品,有报告HPLC≥98%BW5491异乌药内酯; 异乌药醚内酯对照品,有报告HPLC≥98%BW5046巴豆苷; 异鸟苷对照品,有报告HPLC≥98%BW5493(R型)原人参二醇对照品,有报告HPLC≥98%BW5494文多灵(长春刀灵)对照品,有报告HPLC≥98%BW5495长春质碱对照品,有报告HPLC≥98%BW5497川续断皂苷VI; 木通皂苷D对照品,有报告HPLC≥98%BW5498大波斯菊苷( 芹菜素-7-葡萄糖苷)对照品,有报告HPLC≥98%BW5499辽东楤木皂苷V对照品,有报告HPLC≥98%BW5500辽东楤木皂苷X对照品,有报告HPLC≥98%BW5501辽东楤木皂苷VII对照品,有报告HPLC≥98%BW5502阿魏酸乙酯对照品,有报告HPLC≥98% 坛墨质检现有员工79人,办公室面积450平米,实验室1650平米;销售、客服、财务及行政人员35人,实验室工作人员21人,库房14人,市场部8人。实验仪器设备:气相色谱、液相色谱、气质联用、液质联用、离子色谱、紫外分光光度计,原子吸收、ICP-OES和ICP-MS;库房面积450平米,库房工作人员12人,现货产品5万个,坛墨质检自主研发的产品近3000个,已申报国标345项,填补国内空白的产品达到65项。坛墨质检是国内唯一提供标准溶液定制服务的标准物质研制单位,定制范围:特殊浓度定制、特殊溶剂定制、混标定制。
国内最大最专业的国家标准物质服务平台坛墨质检-国家标准物质中心(北京坛墨质检科技有限公司),是国家质检总局指定的国家标准物质研制单位,是国内最大最专业的食品、环境、职业卫生标准物质生产商和服务商。 BW5465亥茅酚苷对照品,有报告HPLC≥98%BW5466异鼠李素-3-O-新橙皮糖苷对照品,有报告HPLC≥98%BW5467紫蓳灵; 紫堇醇灵碱对照品,有报告HPLC≥98%BW5468高丽槐素; 马卡因对照品,有报告HPLC≥98%BW5469秦皮苷;白蜡树苷对照品,有报告HPLC≥98%BW5470奇任醇;奇壬醇对照品,有报告HPLC≥98%BW5471比枯枯灵(山乌龟碱)对照品,有报告HPLC≥98%BW5473乙酰紫堇灵;乙酰紫堇醇灵碱对照品,有报告HPLC≥98%BW5474红车轴草根苷(三叶豆根苷)对照品,有报告HPLC≥98%BW5476去氢二异丁香酚对照品,有报告HPLC≥98%BW5477利卡灵-B;利卡灵B对照品,有报告HPLC≥98%BW5478肉豆蔻木脂素对照品,有报告HPLC≥98%BW5479泽泻醇B-23-醋酸酯(泽泻醇B醋酸酯)对照品,有报告HPLC≥98%BW5481人参皂苷F1对照品,有报告HPLC≥98%BW5482人参皂苷F2对照品,有报告HPLC≥98%BW5483人参皂苷CK对照品,有报告HPLC≥98%BW5484异鼠李素-3-O-葡萄糖苷对照品,有报告HPLC≥98%BW5485草质素苷; 草质素甙对照品,有报告HPLC≥98%BW5486科罗索酸; 2-alpha-羟基熊果酸对照品,有报告HPLC≥98%BW5488白桦脂醇; 桦木醇对照品,有报告HPLC≥98%BW5489白桦脂醛对照品,有报告HPLC≥98%BW5490延龄草苷; 地索苷对照品,有报告HPLC≥98%BW5491异乌药内酯; 异乌药醚内酯对照品,有报告HPLC≥98%BW5046巴豆苷; 异鸟苷对照品,有报告HPLC≥98%BW5493(R型)原人参二醇对照品,有报告HPLC≥98%BW5494文多灵(长春刀灵)对照品,有报告HPLC≥98%BW5495长春质碱对照品,有报告HPLC≥98% 坛墨质检现有员工79人,办公室面积450平米,实验室1650平米;销售、客服、财务及行政人员35人,实验室工作人员21人,库房14人,市场部8人。实验仪器设备:气相色谱、液相色谱、气质联用、液质联用、离子色谱、紫外分光光度计,原子吸收、ICP-OES和ICP-MS;库房面积450平米,库房工作人员12人,现货产品5万个,坛墨质检自主研发的产品近3000个,已申报国标345项,填补国内空白的产品达到65项。坛墨质检是国内唯一提供标准溶液定制服务的标准物质研制单位,定制范围:特殊浓度定制、特殊溶剂定制、混标定制。
各位同行: 在农药残留分析中,一个讨论较多的话题就是关于基质效应的问题,一般采用添加基质的标准品来补偿基质效应,但是在具体的配制过程中,现在尚为有一个统一规范的标准,请大家都来讨论一下,各自在平时的实验中,是怎么样来操作的! 此贴只为抛砖引玉,希望大家踊跃讨论,有好的操作,我们一起学习!
哪位朋友做过吡唑醚菌酯的分析测定,请教执行标准以及分析测定的各项指标!多谢了!在线等!!
国内最大最专业的国家标准物质服务平台坛墨质检-国家标准物质中心(北京坛墨质检科技有限公司),是国家质检总局指定的国家标准物质研制单位,是国内最大最专业的食品、环境、职业卫生标准物质生产商和服务商。BW5479 泽泻醇B-23-醋酸酯(泽泻醇B醋酸酯)对照品,有报告 HPLC≥98% BW5480 原花青素B2对照品,有报告 HPLC≥98% BW5481 人参皂苷F1对照品,有报告 HPLC≥98% BW5482 人参皂苷F2对照品,有报告 HPLC≥98% BW5483 人参皂苷CK对照品,有报告 HPLC≥98% BW5484 异鼠李素-3-O-葡萄糖苷对照品,有报告 HPLC≥98% BW5485 草质素苷; 草质素甙对照品,有报告 HPLC≥98% BW5486 科罗索酸; 2-alpha-羟基熊果酸对照品,有报告 HPLC≥98% BW5487 羽扇豆醇对照品,有报告 HPLC≥98% BW5488 白桦脂醇; 桦木醇对照品,有报告 HPLC≥98% BW5489 白桦脂醛对照品,有报告 HPLC≥98% BW5490 延龄草苷; 地索苷对照品,有报告 HPLC≥98% BW5491 异乌药内酯; 异乌药醚内酯对照品,有报告 HPLC≥98% BW5492 高香草酸对照品,有报告 HPLC≥98% BW5493 (R型)原人参二醇对照品,有报告 HPLC≥98% BW5494 文多灵(长春刀灵)对照品,有报告 HPLC≥98% BW5495 长春质碱对照品,有报告 HPLC≥98% BW5496 异甘草素对照品,有报告 HPLC≥98% BW5497 川续断皂苷VI; 木通皂苷D对照品,有报告 HPLC≥98% BW5498 大波斯菊苷( 芹菜素-7-葡萄糖苷)对照品,有报告 HPLC≥98% BW5499 辽东楤木皂苷V对照品,有报告 HPLC≥98% BW5500 辽东楤木皂苷X对照品,有报告 HPLC≥98% BW5501 辽东楤木皂苷VII对照品,有报告 HPLC≥98% BW5502 阿魏酸乙酯对照品,有报告 HPLC≥98% BW5503 咖啡因对照品,有报告 HPLC≥98% BW5504 茶碱对照品,有报告 HPLC≥98% 坛墨质检现有员工79人,办公室面积450平米,实验室1650平米;销售、客服、财务及行政人员35人,实验室工作人员21人,库房14人,市场部8人。实验仪器设备:气相色谱、液相色谱、气质联用、液质联用、离子色谱、紫外分光光度计,原子吸收、ICP-OES和ICP-MS;库房面积450平米,库房工作人员12人,现货产品5万个,坛墨质检自主研发的产品近3000个,已申报国标345项,填补国内空白的产品达到65项。坛墨质检是国内唯一提供标准溶液定制服务的标准物质研制单位,定制范围:特殊浓度定制、特殊溶剂定制、混标定制。
实验数据中各变量的关系可表示为列表式,图示式和函数式。 列表式:将实验数据制成表格。它显示了各变量间的对应关系,反映出变量之间的变化规律。它是标绘曲线的基础。图示式:将实验数据绘制成曲线。它直观地反映出变量之间的关系。在报告与论文中几乎都能看到,而且为整理成数学模型(方程式)提供了必要的函数形式。 函数式:借助于数学方法将实验数据按一定函数形式整理成方程即数学模型。 熟悉相关和回归的定义,相关系数的定义,直线回归的最小二乘法。 熟悉药品质量标准分析方法验证中各项指标的定义和考察方法。 含量测定方法的评价 (效能指标—分析品质因数) 一般常用的分析效能评价指标包括:精密度、准确度、检测限、定量限、选择性、线性与范围、重现性、耐用性等;测定法的效能指标可评价分析测定方法,也可作为建立新的测定方法的实验研究依据。 1.精密度系指用该法测定同一匀质样品的一组测量值彼此符合的程度。它们越接近就越精密。在药物分析中,常用标准(偏)差(SD或S); 相对标准(偏)差(RSD),也称变异系数(CV),表示。 生物样品分析时,常用RSD表示精密度,并可细分为批内(或日内)精密度及批间(或日间)精密度。 批内精密度:是同一次测定的精密度。通常采用高、中、低三种浓度的同一样品各7-10份,每种浓度的样品按所拟定的分析方法操作,一次开机后,一一测定。计算每种浓度样品的SD值及RSD值。批内精密度也可视为日内精密度。所得RSD应争取达到5%以内,但不能超过10%。 批间精密度:是不同次测定的精密度。通常采用高、中、低三种浓度的同一样品,每种浓度配制7-10份,置冰箱冷冻。自配制样品之日开始,按所拟定的分析方法操作,每天取出一份测定,计算每种浓度样品的SD值及RSD值。批间精密度也可视为日间精密度。所得RSD应控制在15%以内。 2.准确度是指测得结果与真实值接近的程度,表示分析方法测量的正确性。 由于“真实值”无法准确知道,因此,通常采用回收率试验来表示。 制剂的含量测定时,采用在空白辅料中加入原料药对照品的方法作回收试验及计算RSD,还应作单独辅料的空白测定。每份均应自配制模拟制剂开始,要求至少测定高、中、低三个浓度,每个浓度测定三次,共提供9个数据进行评价。 回收率=(平均测定值M -空白值B)/ 加入量A×100% 回收率的RSD一般应为2%以内。 3.检测限(LOD)是指分析方法能够从背景信号中区分出药物时,所需样品中药物的最低浓度,无需定量测定。 LOD是一种限度检验效能指标,它既反映方法与仪器的灵敏度和噪音的大小,也表明样品经处理后空白(本底)值的高低。要根据采用的方法来确定检测限。当用仪器分析方法时,可用已知浓度的样品与空白试验对照,记录测得的被测药物信号强度S与噪音(或背景信号)强度N,以能达到S/N=2或S/N=3时的样品最低药浓为LOD;也可通过多次空白试验,求得其背景响应的标准差,将三倍空白标准差(即3δ空或3S空)作为检测限的估计值。为使计算得到的LOD值与实际测得的LOD值一致,可应用校正系数来校正,然后依之制备相应检测限浓度的样品,反复测试来确定LOD。如用非仪器分析方法时,即通过已知浓度的样品分析来确定可检出的最低水平作为检测限。 4.定量限 (LOQ)是指在保证具有一定可靠性(一定准确度和精密度)的前提下,分析方法能够测定出的样品中药物的最低浓度。 它反映了分析方法测定低药物浓度样品时具有的可靠性。它与上述的检测限的差别在于:定量限要定量测定某一药物在样品介质中的最低浓度,且定量限规定的最低浓度应该符合一定的精密度和准确度的要求。确定定量限的方法也因所用方法不同而异。当用非仪器分析方法时,与上述检测限的确定方法相同;如用仪器分析方法时,则往往将多次空白试验测得的背景响应的标准差(即空白标准差)乘以10,作为定量限的估计值,继之,再通过分析适当数量已知接近定量限或以定量限制备的样品来验证。 5.选择性是指在样品介质中有其他组分共存时该分析方法对供试物质准确而专属的测定能力。 它与专属性的含义稍有不同。专属性是指一种方法仅对一种分析成分产生唯一信号;选择性则可对多种化学成分产生不同响应,而主要成分的响应可与其它响应区分。 因此,选择性是指该法用于复杂样品分析时相互干扰程度的量度。 在药物分析中考察一个分析方法的选择性时,应着重考虑杂质、降解产物、相关化合物以及制剂辅料等其他组分是否对被测药物的测定有干扰。一般,通过添加上述物质的样品与未曾添加的样品所得分析结果进行比较而确定。 6.线性与范围 分析方法的线性是在给定范围内获取与样品中供试物浓度成正比的试验结果的能力。换句话说,就是供试物浓度的变化与试验结果(或测得的响应信号)成线性关系。 所谓线性范围是指利用一种方法取得精密度、准确度均符合要求的试验结果,而且成线性的供试物浓度的变化范围,其最大量与最小量之间的间隔,可用mg/L ~ mg/L、 ug/ml ~ ug/ml等表示。 线性与范围的确定可用作图法(响应值Y/浓度X)或计算回归方程(Y=a+bX)来研究建立。 测定样品时所有生物药物分析方法都必须同时作标准曲线。每次作标准曲线时,方法应与分析方法考核时完全一致。标准浓度应包括一定梯度的5-8个浓度(非线性者如免疫分析可适当增加),每个浓度只需测定一次(免疫分析可测定两次并取均值);标准曲线应覆盖样品可能的浓度范围,对于含量测定要求一般浓度上限为样品最高浓度的120%,下限为样品最低浓度的80% (但应高于LOQ);目前仍广泛采用相关系数(r)表示标准曲线的线性度、并控制r≥0.9900。对照品的LOQ必须包括在线性范围。 7.耐用性 是指利用相同的方法在各种正常实验条件下对同一样品进行分析所得结果的重现程度。 所谓各种正常实验条件,包括不同的实验室、不同的分析人员、不同的仪器、不同批号的试剂、不同的测试耗用时间、不同的分析温度、不同的测定日期等等。分析方法重现性的测定是通过在不同实验室由不同的实验者(操作和环境条件虽有差别但仍在规定的分析参数内)对同一样品的分别测试而获得的。 重现性 即是指在不同实验室中使用此种分析方法的精密度。是评价其保持不受参数微小变差影响的能力,并可作为正常使用的一个可靠性指标。 8. 与参比方法测得结果的相关程度的比较 由于生物样品中含有许多干扰测定的杂质,特别是与原型药物相似的代谢物常对药物的测定有影响。因此,除考察选择性外,有时还用参比方法对实际生物样品同时测定并进行比较。比较试验时,取若干份实际样品 (如病人服药后采取的血样),用一个已证明有相当专属性和可靠性的方法与新建立的方法同时进行测定,以参比方法测得的药浓为横坐标(X),以新建立方法测得的药浓为纵坐标(Y)作成散布图,并求出直线回归方程 (y=a+bx)及相关系数 (r)。r最大值为1,表示两法完全相关(结果完全吻合);r=0时,表示两法完全不相关。一般要求两法的相关系数r>0.95,而相关直线的斜率 应接近于1。 评价一种分析方法的效能,一般根据方法的使用对象区别。有以下四种情况: A.用于原料药中主要组分或制剂中有效组分含量测定的方法:除了检测限和定量限二项指标外,对精密度、准确度、选择性、线性与范围、耐用性等均应有所要求; B.用于原料药中杂质测定或制剂中降解产物测定的方法又可分为两种: ①用于含量测定;要求是:除检测限和精密度指标不必要求外,对准确度、选择性、线性与范围、定量限、耐用性等均应有所要求; ②用于限度检查。要求是:只对检测限、选择性和耐用性三项指标有所要求,其余均无需要求。 C.用于溶出度测定的方法及药物释放度测定的方法,只有精密度和耐用性有所要求,其余项目均不作要求。 D.用于生物样品中药物测定的方法,对精密度、准确度、检测限、选择性、可测线性范围、定量限、对生物样品的耐用性以及与参比方法测得结果的相关程度的比较等指标应有所要求。
药物杂质中有三甲胺、溴代十六烷和溴代十八烷(沸点超过300度)。其中三甲胺标准品的溶剂为甲醇,浓度为100mg/L。做药物杂质的含量分析时,如用DB-5ms柱,进样口温度为310度,则柱温25度甲醇峰掩盖三甲胺的峰;溴代十六烷和溴代十八烷在220度保持20分钟会出峰。如用DB-wax柱,进样口温度为240度,溶剂为乙醚。如何证明溴代十六烷和溴代十八烷在进样口中完全气化。
以下是国家药典委员会勘误药品标准中有关内容(7月~10月)转自医药网国家药典委员会关于勘误“乳块消胶囊”药品标准有关内容的函 (国药典中发〔2006〕325号) 各省、自治区、直辖市食品药品监督管理局(药品监督管理局): “乳块消胶囊”系国家药品监督管理局药品标准新药转正标准(中药)第 35 册收载的品种,标准编号为 WS 3 -250 ( Z-240 ) -2002 ( Z )。现申报单位提出原申报材料有误,经我会核查,由于原申报材料打印错误,该品种国家药品标准【含量测定】项下色谱条件与系统适用性试验“……乙腈—水—磷酸( 20 ∶ 80 ∶ 20 )为流动相”,应为“……乙腈—水—磷酸( 20 ∶ 80 ∶ 0.2 )为流动相”;【含量测定】项下供试品溶液的制备“……精密量取续滤液 10ml ,蒸干,残渣用 20ml 乙醚洗涤 3 次,……”,应为“……精密量取续滤液 10ml ,蒸干,残渣加水溶解,用乙酸乙酯振摇提取 4 次( 20 , 15 , 15 , 10ml ),合并乙酸乙酯提取液,蒸干,残渣用 20ml 乙醚洗涤 3 次,……”。特此勘误,自即日起照此执行。请有关省级食品药品监督管理局及时通知有关生产企业。 国家药典委员会 二〇〇六年十月三十日
国内最大最专业的国家标准物质服务平台坛墨质检-国家标准物质中心(北京坛墨质检科技有限公司),是国家质检总局指定的国家标准物质研制单位,是国内最大最专业的食品、环境、职业卫生标准物质生产商和服务商。 BW5346石榴皮鞣素; 安石榴磷对照品,有报告HPLC≥98%BW5361新芒果苷对照品,有报告HPLC≥98%BW5375白花前胡丙素对照品,有报告HPLC≥98%BW537610-脱乙酰巴卡丁III对照品,有报告HPLC≥98%BW5378白当归素对照品,有报告HPLC≥98%BW5380异去氢钩藤碱; 异柯诺辛因碱对照品,有报告HPLC≥98%BW5381麦冬皂苷D对照品,有报告HPLC≥98%BW5382巴西苏木素对照品,有报告HPLC≥98%BW5383丁溴酸东莨菪碱对照品,有报告HPLC≥98%BW5386莫诺苷对照品,有报告HPLC≥98%BW538720(R)人参皂苷Rg2对照品,有报告HPLC≥98%BW5388商陆皂苷甲; 商陆皂甙A对照品,有报告HPLC≥98%BW5389白当归脑对照品,有报告HPLC≥98%BW5390新橙皮苷二氢查尔酮对照品,有报告HPLC≥98%BW5391马钱苷酸; 马钱酸; 落干酸对照品,有报告HPLC≥98%BW5392仙鹤草酚B对照品,有报告HPLC≥98%BW5393升麻醇-3-O-β-D-吡喃木糖苷对照品,有报告HPLC≥98%BW5394牡荆素鼠李糖苷对照品,有报告HPLC≥98%BW5396人参皂苷F4对照品,有报告HPLC≥98%BW5399蔓荆子黄素对照品,有报告HPLC≥98%BW5401原苏木素B; 原巴西苏木素对照品,有报告HPLC≥98%BW5403乌药醚内酯对照品,有报告HPLC≥98%BW5404漆黄素;非瑟酮对照品,有报告HPLC≥98%BW5408白术内酯Ⅰ; 苍术内酯I对照品,有报告HPLC≥98%BW5410白术内酯III; 苍术内酯III对照品,有报告HPLC≥98%BW5412根皮素(三羟苯酚丙酮)对照品,有报告HPLC≥98%BW5413胆红素对照品,有报告HPLC≥98% 坛墨质检现有员工79人,办公室面积450平米,实验室1650平米;销售、客服、财务及行政人员35人,实验室工作人员21人,库房14人,市场部8人。实验仪器设备:气相色谱、液相色谱、气质联用、液质联用、离子色谱、紫外分光光度计,原子吸收、ICP-OES和ICP-MS;库房面积450平米,库房工作人员12人,现货产品5万个,坛墨质检自主研发的产品近3000个,已申报国标345项,填补国内空白的产品达到65项。坛墨质检是国内唯一提供标准溶液定制服务的标准物质研制单位,定制范围:特殊浓度定制、特殊溶剂定制、混标定制。
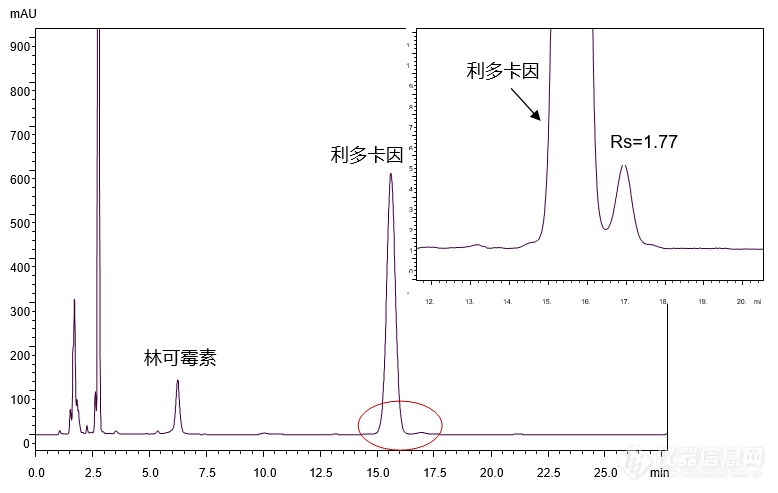
[align=center][b]【国家药品标准】林可霉素利多卡因凝胶的分析[/b][/align][align=center][b][/b][/align][align=right][b]——依据国家药品标准WS-10001-(HD-0140)-2002方法[/b][/align][b]林可霉素利多卡因凝胶[/b]为复方制剂,每克含林可霉素5毫克,利多卡因4毫克。适应症为用于轻度烧伤、创伤及蚊虫叮咬引起的各种皮肤感染。 [img=,193,127]http://ng1.17img.cn/bbsfiles/images/2018/07/201807260834522166_2994_2222981_3.gif!w193x127.jpg[/img] [img=,140,64]http://ng1.17img.cn/bbsfiles/images/2018/07/201807260834520028_3541_2222981_3.gif!w140x64.jpg[/img] 林可霉素 利多卡因 Lincomycin Lidocaine M.W.: 406.54 M.W.: 234.34客户提供林可霉素利多卡因凝胶样品,希望本实验室帮忙通过筛选色谱柱及调节分析条件,依据[color=#ff0000][b]国家药品标准WS-10001-(HD-0140)-2002[/b][/color]方法,实现林可霉素利多卡因凝胶样品的良好分析。首先,使用能在纯水条件下稳定使用的高极性色谱柱[color=#ff0000][b]CAPCELL PAK C[sub]18[/sub] AQ S5 4.6 mm i.d. × 150 mm[/b][/color],对林可霉素利多卡因凝胶样品进行分析,结果如图1所示,[color=#330099]利多卡因与其峰后杂质之间分离度为1.77[/color]。[align=center][img=,690,437]http://ng1.17img.cn/bbsfiles/images/2018/07/201807260858200006_8607_2222981_3.png!w690x437.jpg[/img][/align][align=center]图1 CAPCELL PAK C[sub]18 [/sub]AQ分析所得色谱图[/align]注:峰上标数字为分离度。[img=,528,205]http://ng1.17img.cn/bbsfiles/images/2018/07/201807260858202566_2695_2222981_3.png!w528x205.jpg[/img]为进一步提高利多卡因与其峰后杂质之间的分离度,在原条件基础上将柱温由30℃降低至25℃,并分别使用 CAPCELL PAK C[sub]18[/sub] AQ、CAPCELL PAK C[sub]18[/sub] MG及高含碳量ODS色谱柱SUPERIOREX ODS进行分析,结果如图2所示。[align=center][img=,690,490]http://ng1.17img.cn/bbsfiles/images/2018/07/201807260859201516_7229_2222981_3.png!w690x490.jpg[/img][/align][align=center]图2 25℃条件下不同色谱柱分析结果对比[/align]注:峰上标数字为分离度。[img=,637,223]http://ng1.17img.cn/bbsfiles/images/2018/07/201807260859204236_7198_2222981_3.png!w637x223.jpg[/img]如图2所示,在柱温25℃条件下使用三款色谱柱进行分析,其中,[color=#ff0000][b]CAPCELL PAK C[sub]18[/sub] AQ色谱柱分析结果最好,利多卡因与其峰后杂质分离得到最佳分离,分离度为4.23[/b][/color];[color=#330099][b]使用CAPCELL PAK C[sub]18[/sub] MG色谱柱进行分析时,利多卡因与其峰后杂质分离度为3.27[/b][/color];而使用SUPERIOREX ODS色谱柱分析时,利多卡因与其峰后杂质未得到有效分离。综上,在国家药品标准WS-10001-(HD-0140)-2002方法基础上,将色谱柱柱温由30℃降低至25℃,使用高极性色谱柱CAPCELL PAK C[sub]18[/sub] AQ及中等极性色谱柱CAPCELL PAK C[sub]18[/sub] MG进行分析,均可在25 min内完成林可霉素利多卡因凝胶样品的分析,并得到利多卡因与其峰后杂质之间的良好分离结果。[align=right][/align][align=right][/align][align=right] [/align][align=right]三耀精细化工品销售(中国)有限公司[/align][align=right]技术开发部[/align][align=right]地址:北京经济技术开发区宏达南路5号[/align][align=right]宏达利德工业园1栋418室[/align][align=right]邮编:100176[/align]