谁有三羟甲基氨基甲烷、人血白蛋白的质量标准啊,最好是国家标准PDF。谢谢
人血白蛋白多聚体测定法本法系用分子排阻色谱法测定人血白蛋白多聚体含量。照分子排阻色谱法(附录Ⅲ D)测定。色谱条件与系统适用性试验 用亲水硅胶高效体积排阻色谱柱(SEC,排阻极限300kD,粒度10μm),柱直径7.5mm,长60cm;以含1%异丙醇的pH7.0 0.2mol/L磷酸盐缓冲液为流动相;检测波长为280nm ;流速为每分钟0.6ml。取每1ml含蛋白质为12mg 的人血白蛋白溶液20μl,注入色谱柱,记录色谱图,人血白蛋白单体峰与二聚体峰间的分离度应大于1.5,拖尾因子按人血白蛋白单体峰计算应为0.95~1.40。测定法 取供试品适量,用流动相稀释成每1ml约含蛋白质12mg的溶液,取20μl,注入色谱柱,记录色谱图60分钟(色谱柱长60cm)。按面积归一法计算,色谱图中未保留(全排阻)峰的含量(%)除以2,即为人血白蛋白多聚体含量请教:为何除以2呢?很奇怪呀
今天老大接了个活,要测人血白蛋白中的铝,可据说10次测定的结果中有9次都不好,想问问线上的高手,测铝需要注意什么呀?
求助大神,最近在做原子火焰测人血白蛋白中钠离子检测,做加标回收,回收率普遍在110%以上…请问大神,有没有成型的方案或者方法借鉴一下!
[align=center][b][font=宋体]附录Ⅵ[/font][font=Times New Roman] Q[/font][font=宋体]人血白蛋白多聚体测定法[/font][/b][/align][font=宋体][size=3]本法系用分子排阻色谱法测定人血白蛋白多聚体含量。[/size][/font][size=3][font=宋体]照分子排阻色谱法(附录Ⅲ[/font][font=Times New Roman] D[/font][font=宋体])测定。[/font][/size][size=3][b][font=宋体]色谱条件与系统适用性试验[/font][/b][font=Times New Roman] [/font][font=宋体]用亲水硅胶高效体积排阻色谱柱([/font][font=Times New Roman]SEC[/font][font=宋体],排阻极限[/font][font=Times New Roman]300kD[/font][font=宋体],粒度[/font][font=Times New Roman]10[/font][font=宋体]μ[/font][font=Times New Roman]m[/font][font=宋体]),柱直径[/font][font=Times New Roman]7[/font][font=宋体].[/font][font=Times New Roman]5mm[/font][font=Times New Roman],[/font][font=宋体]长[/font][font=Times New Roman]60cm[/font][font=宋体];以含[/font][font=Times New Roman]1[/font][font=宋体]%异丙醇的[/font][font=Times New Roman]pH7[/font][font=宋体].[/font][font=Times New Roman]0 0[/font][font=宋体].[/font][font=Times New Roman]2mol/L[/font][font=宋体]磷酸盐缓冲液[取[/font][font=Times New Roman]0[/font][font=宋体].[/font][font=Times New Roman]5mol/L[/font][font=宋体]磷酸二氢钠[/font][font=Times New Roman]200ml[/font][font=宋体]、[/font][font=Times New Roman]0[/font][font=宋体].[/font][font=Times New Roman]5mol/L[/font][font=宋体]磷酸氢二钠[/font][font=Times New Roman]420ml[/font][font=宋体]、异丙醇[/font][font=Times New Roman]15[/font][font=宋体].[/font][font=Times New Roman]5ml[/font][font=宋体]及水[/font][font=Times New Roman]914.5ml[/font][font=宋体],混匀]为流动相;检测波长为[/font][font=Times New Roman]280nm [/font][font=宋体];流速为每分钟[/font][font=Times New Roman]0[/font][font=宋体].[/font][font=Times New Roman]6ml[/font][font=宋体]。取每[/font][font=Times New Roman]1ml[/font][font=宋体]含蛋白质为[/font][font=Times New Roman]12mg [/font][font=宋体]的人血白蛋白溶液[/font][font=Times New Roman]20[/font][font=宋体]μ[/font][font=Times New Roman]l[/font][font=宋体],注入色谱柱,记录色谱图[/font][font=Times New Roman],[/font][font=宋体]人血白蛋白单体峰与二聚体峰间的分离度应大于[/font][font=Times New Roman]1[/font][font=宋体].[/font][font=Times New Roman]5[/font][font=宋体],拖尾因子按人血白蛋白单体峰计算应为[/font][font=Times New Roman]0[/font][font=宋体].[/font][font=Times New Roman]95[/font][font=宋体]~[/font][font=Times New Roman]1[/font][font=宋体].[/font][font=Times New Roman]40[/font][font=宋体]。[/font][/size][size=3][b][font=宋体]测定法[/font][/b][font=Times New Roman] [/font][font=宋体]取供试品适量,用流动相稀释成每[/font][font=Times New Roman]1ml[/font][font=宋体]约含蛋白质[/font][font=Times New Roman]12mg[/font][font=宋体]的溶液[/font][font=Times New Roman],[/font][font=宋体]取[/font][font=Times New Roman]20[/font][font=宋体]μ[/font][font=Times New Roman]l[/font][font=宋体],注入色谱柱,记录色谱图[/font][font=Times New Roman]60[/font][font=宋体]分钟[/font][s][font=宋体](色谱柱长[/font][/s][s][font=Times New Roman]60cm[/font][/s][s][font=宋体])[/font][/s][font=宋体]。[/font][/size][size=3][color=#fe2419][font=宋体]按面积归一法计算,色谱图中未保留(全排阻)峰的含量[/font][font=Times New Roman](%)[/font][font=宋体]除以[/font][font=Times New Roman]2[/font][font=宋体],即为人血白蛋白多聚体含量。[/font][/color][/size][size=3][font=Times New Roman][b][color=#0021b0]计算方法不是很明白,为什么要除以2 ??? 全排阻的峰指的是哪一个??谢谢[/color][/b][/font][/size]
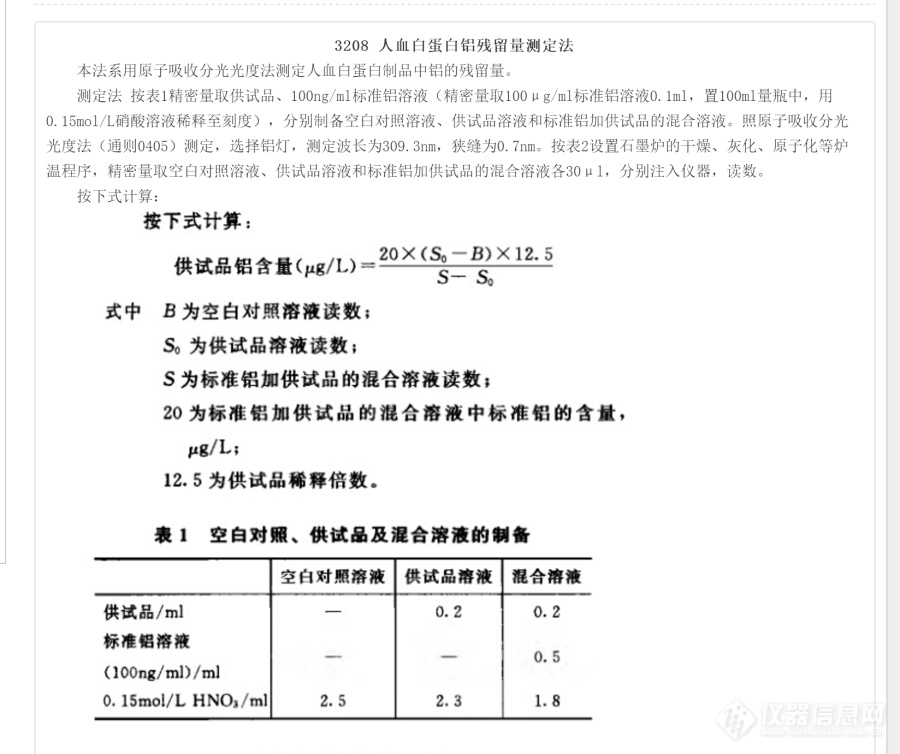
请问下各位有没有用过药典通则3208对人血白蛋白铝残留量测定法的。有几个疑问望高人解答。①:为保证基体干扰的影响,石墨炉法中一般可加入基体改进剂增加样品的稳定性,而文中配制样品溶液所采用的0.15mol/L硝酸溶液是否属于基体改进剂的一种?②:如不属于的话,该测定方法是否需要增加基体改进剂的使用,其品种的选择及用量,一般怎么进行选择呢?③:若检验仪器的狭缝没有文中所列举的0.7的话是否可以选用更低的狭缝进行测定。④:对于此类较为粘稠的样品,除了基体改进剂的选择外,是否还需要增加表面活性剂的使用,如曲拉通X-100用以稀释蛋白。[img=,690,578]https://ng1.17img.cn/bbsfiles/images/2020/05/202005031536126971_5530_3390787_3.png!w690x578.jpg[/img]

[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]快速检测人血白蛋白原液蛋白质含量的建模研究摘要:本研究建立[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]定量分析模型,对浓缩液蛋白含量进行快速及有效的测定。在实验室条件下配置不同浓度的蛋白样品,建立用于蛋白含量测定的定量分析模型,以实现浓缩液蛋白含量的快速及有效的判断。关键词:[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]分析技术;人血白蛋白;定量分析模型1材料1.1 试剂供试品:人血白蛋白原液;生理盐水。1.2 仪器和软件AntarisⅡ傅里叶变换[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url](美国Thermo Fisher scientific公司);内径4×50 mm的玻璃小管(Kimble Chase,德国); MATLAB 2015a(美国Mathworks公司);PLS_Toolbox工具箱(美国Eigenvector Research公司)。2方法2.1 蛋白含量的测定及样品溶液的配制2.1.1 蛋白质含量的测定取生产过程中超滤浓缩后的人血白蛋白原液为实验供试品,用半微量凯氏定氮法测定蛋白质浓度,浓度应不低于26.5%。2.1.2样品溶液的配制根据试验需要,将供试品溶液用生理盐水进行稀释得到多个不同蛋白质浓度的实验样品。2.2 样品光谱的采集本实验使用AntarisⅡ傅里叶变换[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url],采用透射分析模块,采用仪器自带的RESULT-Intergration软件编写采集光谱的工作流程。光谱分辨率为8 cm-1,扫描范围为10000-4000 cm-1,扫描次数为32次,用偏最小二乘回归(Partial Least Squares Regression, PLSR)方法建立定量模型。2.3 校正集和验证集的划分校正集中的样品应包含使用该模型预测的未知样品的所有化学成分。且校正集中的样品的化学成分浓度范围应覆盖使用该模型预测的未知样品中可能存在的浓度范围。而且验证集中的样品应涵盖使用模型分析的待测样品中的化学组成,测定浓度范围也应尽可能覆盖该模型分析的待测样品可能存在的浓度范围,且分布均匀。所以,需要选择合理的样品集划分方法,以提高模型的应用性及准确性。2.4 预处理方法的选择为了消除噪声和产生的基线漂移,提高模型的预测能力,得到稳健的模型,需要在模型建立前对样品的原始光谱进行预处理,常用的谱图处理方法有均值中心化(Mean Center)、标准化(Auto scale)、平滑和导数等。导数是常用的基线校正和光谱分辨预处理方法,但也会放大噪声的信号,降低光谱的信噪比;为消除光谱变换带来的噪声,常对原始光谱进行平滑后求导,能有效提高信噪比;均值中心化可增大不同样品之间的差异,从而使模型的稳健性和预测能力得到提高;标准化可以使光谱中所有波长变量的权重相同,增加光谱之间差异化,适合于低浓度成分的建模。本研究中对Auto scale、Mean Center、一阶导数(First Derivative,FD)SG13点平滑、二阶导数(Second Derivative,SD)SG13点平滑等预处理方法进行了考察,以模型的RMSEP为指标,选择最合适的预处理方法。2.5 光谱区间的选择[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]信息十分复杂,在建立校正模型的过程中选择有效的建模变量是十分必要的。本研究选用间隔偏最小二乘法(Interval Partial Least Squares Regression, iPLS)),以RMSECV值为评价标准,选择变量区间以建立最佳的定量模型。3 实验结果3.1 蛋白质含量的测定结果采用半微量凯氏定氮法进行蛋白含量的测定,测定得到17个样品的蛋白含量。用生理盐水稀释样品,共得到49个不同蛋白质含量的样品。3.2 样品的原始光谱图1为49个蛋白样品的原始光谱,原始光谱图中可见各样品的光谱差异不明显,因此需要使用化学计量学方法对样品光谱进行处理。[align=center][img=,494,237]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151606_01_1626619_3.png[/img][/align][align=center]图1 样品原始光谱图[/align]3.3 校正集和验证集的划分结果本研究采用Kennard-Stone(K-S)分类的算法,按照2:1的比例进行样品集的划分,划分为33个校正集样品和16个验证集样品。图2为校正集样品和验证集样品的主成分得分图,图中灰色点为校正集样品,红色点为验证集样品,从主成分得分图中可以看出,校正集样品和验证集样品分布比较均匀,且验证集样品比较均匀的分布在校正集样品之间,符合理想校正集和验证集的要求。[align=center] [img=,467,301]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151608_01_1626619_3.png[/img][/align][align=center]图2 样品主成分得分图[/align]3.4 光谱预处理的结果建模过程中,分别采用各种方法对光谱数据进行预处理,包括标准化(Auto scale)、均值中心化(Mean Center)、一阶导数(First Derivative,FD)、SG13点平滑、二阶导数(Second Derivative,SD)等处理方法,以RMSEP作为评价模型的参数,通过对比预处理后的建模结果,选出最合适的预处理方法。表1列出了预处理后各模型的评价参数,通过比对,可以较直观的选出一阶导数SG13点平滑和Mean Center的组合为最佳预处理方法。图3所示为用经过一阶导数SG13点平滑和Mean Center 预处理后的光谱所建立的模型的结果,从图3中可以看出,建模效果较好,预测能力较高,Rc2=0.994,Rp2=0.986,RMSEC=0.1993%,RMSEP=0.2585%,RMSECV=0.2518%。[align=center]表1 不同预处理后各模型参数[/align][align=center][img=,629,241]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151613_01_1626619_3.png[/img][/align][align=left]FD+SG:一阶导数+SG13点平滑[/align][align=left]SD+SG:二阶导数+SG13点平滑[/align][align=center][img=,572,305]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151616_01_1626619_3.png[/img][/align][align=center]图3 一阶导数+SG平滑+ Mean Center[/align]3.5 光谱区间的选择结果通过筛选光谱区间,可以选择与样品白蛋白含量相关性大的光谱变量进行建模,去掉大量无关信息,减少模型的计算量,使得模型的效果更好。本实验采用iPLS进行变量的选择。将光谱进行SG13点平滑+一阶导数+ Mean Center预处理后,分别采用Forward iPLS和Reverse iPLS方法选择最佳的光谱区间,改变窗口宽度,分别选择最佳变量,以RMSECV为标准选择谱区。3.5.1Forward iPLS选择波段采用FiPLS的方法以RMSECV为标准选取最佳的光谱区间,分别选择50、100、200个变量进行自动选择,如表2所示窗口宽度为100个变量时建模结果较佳,结果图4所示。[align=center]表2 Forward iPLS结果[/align] [align=center][img=,645,163]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151618_01_1626619_3.png[/img][/align][align=center][img=,517,246]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151619_01_1626619_3.png[/img][/align][align=center]图4 Forward iPLS波段结果图[/align]由图4中可以看出,绿色部分为建模的波段,图5为建模预测结果图。[align=center][img=,551,291]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151620_01_1626619_3.png[/img] [/align][align=center]图5 Forward iPLS建模结果图[/align]3.5.2 Reverse iPLS选择波段采用Reverse iPLS的方法选取最佳的光谱区间,同样,分别选择50、100、200个变量进行自动选择,如表3所示窗口宽度为50个变量时建模结果较佳,波段选择结果如图6所示。[align=center]表3 Reverse iPLS结果[/align][align=center][img=,652,456]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151622_01_1626619_3.png[/img][/align] [align=center]图6 Reserve iPLS 选波段结果图[/align]如图6中所示,其中绿色部分为建模波段,图7为预测结果。[align=center][img=,520,228]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151624_01_1626619_3.png[/img][/align][align=center]图7 Reserve iPLS 建模结果图[/align]通过采用Forward iPLS和Reservei PLS波段选择方法建立PLSR模型,经过两种方法中选择的最优变量的对比(见表4),选择窗口宽度为100变量的Forward iPLS变量选择方法建立的模型最佳。最终建立的PLSR模型结果:模型的参数为Rc2=0.997,Rp2=0.987,均方根误差RMSEC=0.1394%,RMSEP=0.2560%,RMSECV= 0.1831%,建模结果较好。[align=center]表4不同变量选择方法的建模结果[/align][align=center][img=,641,142]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151629_01_1626619_3.png[/img][/align]3.6 一级数据与预测值比较对16个验证集样品的传统方法获得的蛋白含量和NIRS蛋白含量预测值进行偏差分析,结果见表5所示。蛋白含量一级数据和预测值的平均偏差和相对平均偏差的计算公式见式1和式2,蛋白含量NIRS的预测值和一级数据间的平均偏差为0.17,相对平均偏差为0.81,两者都较低,说明了NIRS和传统的凯氏定氮法结果相差较小,表明NIRS用于蛋白含量测定的准确性和可靠性。[align=center][img=,372,89]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151631_01_1626619_3.png[/img][/align]式中yi, actual为传统凯氏定氮方法得到的一级数据值,yi, predicted为NIRS得到的预测值,n为验证集样品数量。[align=center]表5 验证集样品方法结果比较表[/align][align=center][img=,585,86]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151632_01_1626619_3.png[/img][/align]3.7 预测值的精密度通过重复测量光谱计算,建立的蛋白含量校正模型的预测精密度。随机选取验证集样品中的1号、15号、35号、42号和47号样品,每个样品重复测量10次,然后采用建立的蛋白含量模型采集以上样品的光谱,得到样品的预测值。然后计算每个样品预测值的平均值、标准偏差和相对标准偏差,用这些指标来表示预测的精密度,结果见表6。如表中所示, RSD值均在1.0%以下,远远低于5.0%,证明了模型的精密度良好。[align=center]表6 模型精密度考察结果[/align][align=center][img=,584,394]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151636_01_1626619_3.png[/img][/align]4结论和讨论本研究建立了人血白蛋白生产过程中蛋白含量测定的近红外定量模型,用于人血白蛋白原液蛋白质含量的测定,为下一步原液的生产配制提高依据。首先,取生产过程中的样品17个,用凯氏定氮法测得各个样品的蛋白含量,然后在实验室条件下,用生理盐水配制成49个不同浓度的蛋白样品。对49个样品进行[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]的采集,然后对样品进行校正集和验证集的划分,对光谱进行预处理方法和不同的变量选择方法进行了考察;采用Kennard-Stone(K-S)分类的算法,按照2:1的比例进行样品集的划分,优先选出Mean Center +一阶导数SG13点平滑的预处理方法,并采用窗口宽度为100变量的Forward iPLS变量选择方法选出变量区间,最终建立最佳的近红外定量模型。最终建立的PLSR模型结果:Rc2=0.997,Rp2=0.987,均方根误差RMSEC=0.1394%,RMSEP=0.2560%,RMSECV= 0.1831%。除此之外,对模型进行了重复性考察,从结果可知模型具有较好的重复性。在模型的建立中,选用Kennard-Stone(K-S)分类的算法进行样品集的划分,通过PCA分析得到具有代表性的校正集和验证集样品。在预处理方法的选择中,分别选用Autoscale、Mean Center、SG平滑一阶导数以及各预处理方法的组合进行预处理方法的考察,其中SG平滑中,不同的窗口宽度会对平滑产生不同的效果,窗口宽度越宽平滑效果越好,但也会丢掉有用的信息,经过考察选择13点平滑时结果较佳。参考文献吴清, 周法根. 脑梗死治疗中白蛋白应用价值的探讨 . 心脑血管病防治, 2005, 5(2): 49-50.王华平, 米宇俊. 人血白蛋白治疗肾综合征出血热低血压休克患者疗效观察 . 医师进修杂志, 2001, 24(8):20-21.郑红光, 杨志藩, 关欣. 静脉输注人血白蛋白对肾病综合征的正负临窗效应观察 . 中国实用内科杂志, 2003, 23(1):25-27.刘丽萍. 人血白蛋白在肝硬化资料中的应用 . 中国医院用药评价与分析, 2013, 13(5):388-390.常花蕾, 史涛. 人血白蛋白临床不合理应用及改进措施 . 中国药物应用与监测, 2014, 11(1): 52-54.孙世光, 余明莲, 王建民, 张国辉. 人血白蛋白的临床应用误区及其对策 .解放军药学学报, 2009, 25(4):366-368.
由武汉大学生命科学院教授、武汉禾元生物科技有限公司董事长杨代常领衔的研发团队从2006年开始进行植物源替代血浆来源的医药蛋白的研究与开发,现已取得突破性进展并已跨入规模化生产的阶段,填补了国际上此项技术空白。相关论文“Large-scale production of functional human serum albumin from transgenic rice seeds ”(利用转基因水稻规模化生产重组人血清白蛋白)于2011年10月31日在线发表于《美国科学院院报》( PNAS ) 。该论文在线之际,受到国外Scientist , Nature news , The Australian , Thomson Reuters, Fox News , Agence France Presse (AFP法新社) 等美国、英国、俄罗斯、德国、巴西、印度各专业杂志及媒体的广泛关注和报道。该研究表明由转基因水稻种子生产的重组人血清白蛋白(OsrHSA)在生理生化性质、物理结构,生物学功能、免疫原性与血浆来源的人血清白蛋白一致;并建立了大规模生产重组人血清白蛋白的生产工艺,获得了高纯度和高产量重组人血清白蛋白产品。利用大量数据证明了转基因水稻种子可取代现有基于发酵的表达技术来生产重组蛋白质是经济有效的。正如PNAS 审稿人对该文章的评价:“这篇文章解决了在科学上振奋人心、在经济上都非常重要的议题--即用转基因植物生产血浆产品或其他蛋白产品的技术平台,可代替其他基于发酵的表达技术,其重要性也不言而喻……这篇文章近乎完美地证实了植物生产的医药蛋白和批准临床使用的血浆来源医药蛋白是完全相同的,并提供了翔实数据证明植物系统规模化容易和成本优势。”目前,人血清白蛋白(human serum albumin)广泛应用于临床治疗和细胞培养领域。常见的人血清白蛋白大多数从人的血浆中提取,这样的生产方式不仅受到血浆供应的限制,而且还具有携带病毒传播的高风险性。国际上以重组人血白蛋白替代血源产品的应用已成为趋势,国内市场需求也逐年扩大,2010年已达150吨。尽管市场广阔,但高纯度重组人血白蛋白的规模化生产技术和质量控制技术却是世界性难题。武汉禾元历经多年的技术攻关,利用水稻胚乳表达技术平台,研发出国际先进水平的重组人血白蛋白产品生产技术,并成功实现重组人血白蛋白规模化和产业化,完全摆脱了相关制约,具有纯度更高、无动物组分、安全、高效、绿色环保、廉价、无限量供应等优势。随着植物源重组人血清白蛋白的发展,我国人血清白蛋白日益紧张的局面必将得到缓解。详细论文,请点击下载:http://www.oryzogen.com/category/22/2011-11-01/93315359.html注:《美国科学院院报》(Proceedings of the National Academy of Sciences of the United States of America, 缩写 PNAS,ISSN:0027-8424)是被引用次数最多的综合学科文献之一。它是美国科学院的院刊。自1914年创刊至今,PNAS提供具有高水平的前沿研究报告、学术评论、学科回顾及前瞻、学术论文以及美国国家科学学会学术动态的报道和出版。PNAS收录的文献涵盖生物、物理和社会科学,2008年的影响因子为9.38,2009年影响因子为9.432, 2010年影响因子为9.771。在SCI综合科学类排名第三位,因而已成为全球科研人不可缺少的科研资料。
中文摘要: 目的 实验室规模通过近红外光谱分析技术对人血白蛋白醇沉过程进行监测,为提高组分I+II+III上清液乙醇沉淀环节收率提供支持。 方法 实验室条件下模拟8批正常过程和3批异常过程。定性模型以6个正常批次作为校正集建立主成分分析模型,2个正常批次和3个异常批次作为验证集考察模型过程监测和错误诊断能力。定量模型以醇沉过程中人血白蛋白含量和总蛋白含量作为建模指标,6个正常批次样品作为校正集,2个正常批次样品作为验证集,建立了可用于人血白蛋白和总蛋白含量快速准确测定的偏最小二乘回归模型。 结果 定性的主成分分析模型和定量偏最小二乘回归模型可实现醇沉过程的监测和错误判断。 结论 利用近红外光谱分析技术结合化学计量学对人血白蛋白生产过程中的FI+II+III上清液醇沉过程进行监测的方法可行。关键词:近红外光谱分析技术;组分I+II+III;化学计量学;醇沉淀 人血白蛋白(Human Albumin,HA)是最早从人血浆中提取并应用于临床上的血液制品。组分(Fraction, F)I+II+III上清液醇沉过程是HA生产过程中的重要一步,其目的是去除各种杂蛋白,得到FIV上清液,为下一步醋酸缓冲液沉淀过程做准备。目前人血白蛋白组分I+II+III上清液醇沉过程生产过程的控制模式大都采用离线的方式,即当乙醇加入到含量为40%时醇沉过程结束,然后取样进行实验室化验,其结果严重滞后于生产过程,无法实时的监测指导生产过程的进行。在制药领域,NIRS作为一种重要的PAT工具,已成功用于药物的原辅料质量评价、关键过程的监测和控制、成品的快速放行和质量检测等各个环节,为保证产品质量、降低生产成本、革新生产过程发挥了重要的作用。本研究中利用NIRS结合化学计量学对HA生产过程中的FI+II+III上清液醇沉过程进行监测,以实现醇沉环节的过程控制。1 材料1.1 试剂FI+II+III压滤后上清液(山东泰邦生物制品有限公司);95%乙醇(分析纯,国药集团化学试剂有限公司);去离子水。1.2 仪器和软件 Antaris II傅里叶变换近红外(Fourier Transform NearInfrared, FT-NIR)光谱仪(美国Thermo Fisher Scientific公司),液体透射采样模块,内径为4×50 mm的玻璃小管(德国Kimble Chase公司);低温反应仪(郑州长城科工贸有限公司);BF300恒流泵(保定齐力恒流泵有限公司);Alpha 1-2 LD实验室型冻干机(德国Christ公司);高速离心机(Thermo Fisher Scientific公司);MATLAB 2010a(美国Mathworks公司);PLS_Toolbox工具箱(美国Eigenvector Research公司)。2 方法2.1 醇沉过程正常醇沉过程:醇沉过程在低温反应仪中进行,温度设定和实际生产反应温度一致。每个批次取100 mL FI+II+III压滤后上清液置于250 mL的圆底烧瓶中,恒流泵加入95%乙醇的速度为1 mL/min。醇沉开始前以及醇沉过程中每隔3 min取样1 mL用于光谱的采集及蛋白含量的测定。异常醇沉过程:本研究中为考察定性
如果说一个人一次献血200ml,一亩转基因水稻产出的血清白蛋白量约等于300人献的血——转基因水稻胚乳可提取血清白蛋白——转基因水稻胚乳可提取血清白蛋白2012年09月01日 来源: 中国科技网 关注转基因 白蛋白供应紧张一直困扰着人类。我国每年需求150—160吨,全球每年需求量则高达500吨,由于血浆来源紧张,我国目前从血浆中提取量仅可供应1/3,其中2/3依赖进口。 2011年10月31日,武汉大学生命科学学院教授杨代常撰写的论文《利用转基因水稻规模化生产重组人血清白蛋白》在《美国科学院院报》发表,吸引了世界的目光。 文章用翔实的科学数据证明,植物来源的重组人血清白蛋白与临床使用的血浆来源血清白蛋白,无论是在生理生化性质,还是功能用途等方面,都具有高度的等同性。 为何这项研究引发种种关注?稻米血清白蛋白是否会危及生态及人身安全?其何时能用于临床治疗?……带着这些问题,记者采访了杨代常和他的团队。 “借腹生子”:从水稻胚乳中提取血清白蛋白 植物种子生物反应器,是将植物种子作为一个蛋白质“生产车间”,利用植物作为合成蛋白质的“机器”来合成人类所需的蛋白质。“通俗地解释,便是‘借腹生子’。”杨代常说。 国外从1989年已开始利用DNA重组技术生产血清白蛋白,但由于血清白蛋白产量低、纯化工艺复杂、生产成本远高于市场成本,始终无法进入市场。 杨代常带领研究团队,从水稻基因组数据入手,根据水稻种子储藏蛋白与血清白蛋白的生化性质差异,设计出从提取到纯化的一整套工艺方案,最大限度地提取血清白蛋白,最低限度去除种子的内源蛋白,成为一项原始创新的科研成果。 “具体来说,是由表达元件组成的载体,通过遗传工程整合到水稻基因组内,在种子特异性调控元件的指导下,水稻种子在成熟过程中也不断地合成和积累人血清白蛋白,然后通过规模化种植获得原料,再经过提取、纯化等步骤获得高纯度的血清白蛋白。”杨代常介绍,目前大约每亩水稻可以产生1.5—2公斤血清白蛋白,如果说一个人一次能献血200ml,一亩转基因水稻产出的血清白蛋白量约等于300人献血。 “天然屏蔽”:可杜绝肝炎、艾滋病毒等风险 植物源重组血清白蛋白优势明显,它来源于非动物,避免了各种病毒和病原菌的污染,并由于不受血浆供应限制,可无限量供应。但是转基因农业作物安全性向来争议不断,植物源血清白蛋白有望未来直接应用于人体中,有人担心会危及生态及人身安全。 对此,杨代常解释,首先,就人血清白蛋白本身安全性而言,血清白蛋白本就是人体的蛋白质,占血浆中蛋白的30%,是一种安全的蛋白质。目前,根据获取的数据,植物来源的人血清白蛋白从生物活性、分子结构和理化性质与血浆来源的人血清白蛋白完全一致,从水稻胚乳中提取的血清白蛋白可杜绝携带如肝炎病毒、艾滋病毒等风险。研究发现,人体对植物蛋白的耐受能力大于对细菌和酵母的耐受能力。从安全性考虑,已建立高纯度符合医药级别纯度的血清白蛋白。其次,就转基因生物安全而言,由于采取地理和时间双重隔离方法,要求比美国更为严格。第三,为杜绝进入食物链,在研究中采取了专用收割机、烘干机、稻米加工设备以及专用仓库等措施,建立了严格的监管规范,能做到可管可控和可追溯。 未来预期:进入临床需4至5年 从2005年始,杨代常自主研发的水稻胚乳细胞蛋白质高效表达技术平台,填补了国际上此项技术规模化生产的空白,已获美、日、欧盟以及我国的多项专利。 杨代常说,目前,植物源重组血清白蛋白的质量已达到非临床应用标准,可替代血源人血白蛋白用于细胞培养基添加剂,成为细胞培养中血浆来源的血清白蛋白的替代品;可减少培养基中胎牛血清的使用量;还可用于高纯试剂、细胞冷冻保护剂、医疗器械包埋剂、药物载体、化妆品组分、体外诊断等。 国外已在疫苗及生物医药产品的细胞培养的稳定剂上使用。我国按照国家药监局的要求,要通过临床研究后才能进入临床应用。 通过治疗大鼠肝硬化腹水对比,进行植物源重组血清白蛋白的药效研究,发现大鼠肝硬化腹水的治疗效果在降低腹围、增加尿量和尿蛋白量等指标优于血浆来源的血清白蛋白。 “植物源重组血清白蛋白正在进行临床前研究,已完成大部分的药学研究,预计在2013年上半年可望完成临床前研究;预计进入临床研究至少需要2年时间,进入临床应用至少需要4—5年或更长的时间,这取决于临床研究的结果与进度以及国家的法规。”杨代常说。 从实验室走向产业化 去年年初,杨代常带着多年的研发成果,入驻武汉东湖国家自主创新示范区光谷生物城,一年内实现了项目产业化。 “这一过程我们走得很艰难。”杨代常说,为了让投资者更有信心,他在商业模式上从长中短期产品计划入手,将技术做好做精。在科技部转基因重大专项、国家863计划和武汉东湖国家自主创新示范区光谷生物城的支持下,加速了项目产业化进程。 “我国生物产业要走在世界前列,在心理上要打破‘奴性’思维,在政策上要突破传统观念,要敢做别人不能做或不敢做的事情。”杨代常说,“现在一谈到转基因,很多人就‘谈虎色变’。实际上,理解上存在很多误区。转基因技术是通过遗传工程的手段,将人类需要的基因(一段DNA片段)导入到植物或任何一种生物的一项高科技技术,是人类由必然王国走向自由王国的必由之路。” 近日,杨代常的科研团队又传出喜讯,在水稻中“种”出了“人抗胰蛋白酶”。目前,重组抗胰蛋白酶与重组血清白蛋白一样,有效地避免人血液中病毒病原菌感染的风险,但需要进行一系列的免疫原性、急性、毒性等相关实验和临床研究后,方能应用于临床。 杨代常透露,未来,其团队研发重心将着重原创性技术研究,建立单克隆抗体的表达平台,使我国的单克隆抗体药物的价格降到5万元左右,重组血清白蛋白进入临床应用。(记者 马爱平) 《科技日报》(2012-09-01 三版)
前一段一个亲戚生病,医院要求用白蛋白,这东西很贵,是属于血液制品吗?
最近在做公司产品含药量的释放情况,释放液是加了牛血清白蛋白的PBS液,释放后产品从释放液中取出,注射用水洗净后晾干。产品上残留药品再用乙酸乙酯超声洗脱,用UV测定乙酸乙酯中的药品浓度。因最近新换了牛血清白蛋白,后来实验数据与前比似乎有点偏低,怀疑产品上牛血清白蛋白没洗干净,对UV吸收有影响?牛血清白蛋白对UV吸光度值有什么影响呢?哪里有供应质量稳定的牛血清白蛋白?
β-乳球蛋白属于乳白蛋白还是属于乳球蛋白里面的一种成分?最近看到有两种版本,其一,说是属于乳白蛋白里面的一种成分,乳白蛋白包括α-乳白蛋白、β-乳球蛋白和血清白蛋白。乳球蛋白即免疫球蛋白。其二,乳白蛋白包括α-乳白蛋白和血清白蛋白,乳球蛋白包括β-乳球蛋白和免疫球蛋白。现在不知道哪种说法对,请各位指教!!!谢谢!!!
尿微量蛋白(尿微量白蛋白/蛋白尿)试验(也称“白蛋白试验”,“尿微量白蛋白”和“蛋白尿”试验)何为尿微量白蛋白(白蛋白)试验?尿微量白蛋白试验是对尿液中的蛋白质进行测定的筛选试验。人体血液中有一种蛋白质称为白蛋白。在正常情况下,几乎无法在尿液中检测到。只有在肾脏受损,尤其是损伤早期,它可以优先于其他肾损伤标志物在尿液中被检测出,因此,尿微量白蛋白在诊断肾脏疾病、早期肾损伤等方面具有重要意义。此项试验有何目的?蛋白质是人体的基本构成“材料”,具备一些重要的功能和作用,可结合营养物质将其运输至各个组织,,并将人体中循环的体液量维持在适当水平。肾脏功能正常时,蛋白质几乎无法通过肾脏进入尿液(仅会排出血液循环产生的废料)。然而,如果人的肾功能受损或衰竭,该肾脏对蛋白质的过滤能力将有所下降,因而一些蛋白质将会透过肾脏而出现在尿液中,称为尿微量蛋白。尿微量白蛋白与蛋白尿有何不同?白蛋白是一种大量存在于血液中的典型蛋白质。因其分子个头小,当肾脏功能出现问题时,白蛋白是能够率先通过肾脏进入尿液的几种蛋白质之一。尿液中出现少量白蛋白的情况称为尿微量白蛋白。若肾脏功能受损严重,尿液中的白蛋白数量呈现出增长趋势,这种症状被改称为蛋白尿。尿微量白蛋白/蛋白尿有何症状?病症早期,并无明显症状或征兆显现。随着肾功能衰竭的加重,大量蛋白质出现在尿液中,手脚、腹部和面部可能出现肿胀。如果蛋白尿的情况加重,可能会造成永久性肾功能损伤,有些病人可能需要做透析或肾移植。不论上述症状是否存在,尿蛋白测定是确定有多少蛋白质进入尿液的唯一办法。蛋白尿还可能引发心血管疾病。血管受损除了会引发肾脏疾病外,还可能会造成窒息和心力衰竭。患蛋白尿(症)的高危人群有哪些?患有糖尿病、高血压、心血管疾病和其他类型肾脏疾病等慢性病的病人易出现蛋白尿。老年人、肥胖人群以及有肾脏疾病家族史的人群。其
请问用高效液相色谱法检测牛血清白蛋白标准品(BSA),用什么柱子比较好?
中文摘要: 目的 通过近红外光谱技术对组分IV上清液酸沉过程中人血白蛋白的含量进行测定,实现酸沉过程人血白蛋白含量的过程监测。 方法 在实验室条件下模拟8批酸沉过程,以溴甲酚绿(Bromocresol Green, BCG)比色法测定人血白蛋白的含量;然后以5批作为校正集,3批作为验证集,建立人血白蛋白含量的PLSR定量测定模型。 结果 对变量选择方法进行了详细考察,最终选择35个有效变量建立模型,得到的模型Rc2、Rp2、RMSECV和RMSEP分别为0.977、0.978、0.7038 g/L和0.5893 g/L。 结论 评价结果显示模型有较好的预测能力,可用于酸沉过程中人血白蛋白的含量测定。关键词:近红外光谱分析技术;组分IV;化学计量学;酸沉淀人血白蛋白(Human Albumin,HA)是最早从人血浆中提取并应用于临床上的血液制品。在人血白蛋白(Human Albumin, HA)生产过程中,需要对FIV上清液进行酸沉,其目的为酸性条件下使HA沉淀下来,得到FV的沉淀,为下一步HA产品的纯化和精制做准备。在制药领域,NIRS作为一种重要的PAT工具,已成功用于药物的原辅料质量评价、关键过程的监测和控制、成品的快速放行和质量检测等各个环节,为保证产品质量、降低生产成本、革新生产过程发挥了重要的作用。本研究将PAT的理念引入到生产过程,对酸沉过程中HA的含量进行实时监测,根据HA的含量的变化即时调整醋酸缓冲液的加入速度,在保证产品的质量的同时提高生产效率。1 材料1.1 试剂FIV压滤后上清液(山东泰邦生物制品有限公司);pH 4.0的醋酸缓冲液(山东泰邦生物制品有限公司);白蛋白检测试剂盒(美国BioAssay Systems公司);去离子水。1.2 仪器和软件Antaris II FT-NIR光谱仪(美国Thermo Fisherscientific公司);内径4×50 mm的玻璃小管(Kimble Chase,德国);低温反应仪(郑州长城科工贸有限公司);离心浓缩仪(Thermo Fisher Scientific公司);高速离心机(Thermo Fisher Scientific公司);酶标仪(Thermo Fisher Scientific公司);MATLAB 2013b(美国Mathworks公司);PLS_Toolbox工具箱(美国Eigenvector Research公司)。2 方法2.1 酸沉过程实验室条件下模拟8批酸沉过程,反应在低温反应仪中进行,温度设置和实际生产相一致。具体过程如下:取100 mL FIV压滤后上清液置于圆底烧瓶中,然后将圆底烧瓶置于温度恒定的低温反应仪中;酸沉过程开始前取样1 mL后开始滴加醋酸缓冲液(pH4.0),醋酸缓冲液的加入方式为前9次每次加0.2 mL,后6次每次加0.8 mL;酸沉过程中每4 min加一次醋缓并取样1 mL并做离心处理,用于光谱的采集和HA含量的测定,每个酸沉过程得到16个样品。2.2 样品光谱的采集Antaris II FT-NIR光谱仪的透射模块进行原始近红外光谱的采集。光程4 mm,光谱范围10000-4000 cm-1,分辨率为8 cm-1,扫描次数32;每小时采集一次背景,以空气作为参考。所有样品采集3张原始光谱,以平均光谱作为最终的样品光谱。2.3 白蛋白含量的测定HA含量的测定方法为BCG法,采用市售的试剂盒进行测定。为了去除样品中乙醇对HA含量测定的影响, HA含量测定前通过离心浓缩仪将溶剂去除,然后去离子水复溶。含量测定的具体步骤如下。标准曲线的制作:① 将50 g/L的牛血清蛋白标准品用不同量的蒸馏水稀释,得到牛血清白蛋白含量在0-40 g/L范围内的标准品溶液;② 向96孔板中加入5 μL不同浓度含量值的标准品溶液,然后加入200 μL试剂并轻敲孔板使其混合,使每个板孔中不要留有气泡;③ 室温下静置5 min,利用酶标仪在630 nm处读取吸光度值;④ 根据得到的吸光度值和标准品的浓度值拟合用于测定HA含量的标准曲线。样品的测定:① 向96孔板中加入5 μL的待测样品,然后加入200 μL试剂并轻敲孔板使其混合均匀,并将板孔中气泡赶出;② 室温下静置5 min,利用酶标仪于630 nm处读取吸光度值;③ 根据得到的吸光度值代入拟合的标准曲线中,算得样品的HA含量值。2.4 数据的处理和模型的建立研究中利用MATLAB 2013b 数学软件以及基于该软件的PLS_Toolbox工具箱对光谱数据进行处理,建立酸沉过程中HA含量测定的PLSR定量分析模型。首先将8批样品中的5批样品作为校正集,剩余的3批作为验证集;然后对光谱进行预处理和变量选择,以提取光谱的有效信息,得到稳健性和准确性高的定量模型;最后对模型进行验证和评价。在模型的建立中以留一法作为交互验证方法。为得到最佳的模型结果,本研究中引入缩小浓度区间的策略。3 实验结果3.1 样品原始光谱本实验中平行进行了8个批次的酸沉过程,每个批次收集16个样品,共得到128个样品。图1为128个样品的原始近红外光谱图,。data:image/png;base64,/9j/4AAQSkZJRgABAQEAkACQAAD/2wBDAAoHBwgHBgoICAgLCgoLDhgQDg0NDh0VFhEYIx8lJCIfIiEmKzcvJik0KSEiMEExNDk7Pj4+JS5ESUM8SDc9Pjv/2wBDAQoLCw4NDhwQEBw7KCIoOzs7Ozs7Ozs7Ozs7Ozs7Ozs7Ozs7Ozs7Ozs7Ozs7Ozs7Ozs7Ozs7Ozs7Ozs7Ozs7Ozv/wAARCAEsAuIDASIAAhEBAxEB/8QAHwAAAQUBAQEBAQEAAAAAAAAAAAECAwQFBgcICQoL/8QAtRAAAgEDAwIEAwUFBAQAAAF9AQIDAAQRBRIhMUEGE1FhByJxFDKBkaEII0KxwRVS0fAkM2JyggkKFhcYGRolJicoKSo0NTY3ODk6Q0RFRkdISUpTVFVWV1hZWmNkZWZnaGlqc3R1dnd4eXqDhIWGh4iJipKTlJWWl5iZmqKjpKWmp6ipqrKztLW2t7i5usLDxMXGx8jJytLT1NXW19jZ2uHi4+Tl5ufo6erx8vP09fb3+Pn6/8QAHwEAAwEBAQEBAQEBAQAAAAAAAAECAwQFBgcICQoL/8QAtREAAgECBAQDBAcFBAQAAQJ3AAECAxEEBSExBhJBUQdhcRMiMoEIFEKRobHBCSMzUvAVYnLRChYkNOEl8RcYGRomJygpKjU2Nzg5OkNERUZHSElKU1RVVldYWVpjZGVmZ2hpanN0dXZ3eHl6goOEhYaHiImKkpOUlZaXmJmaoqOkpaanqKmqsrO0tba3uLm6wsPExcbHyMnK0tPU1dbX2Nna4uPk5ebn6Onq8vP09fb3+Pn6/9oADAMBAAIRAxEAPwD2aiiigAooooAKKKKACiiigAooooAKKKKACiiigAooooAKKKKACiiigAooooAKKKKACiiigAooooAKKKKACiiigAooooAKKKKACiiigAooooAKKKKACiiigAooooAKKKKACiiigAooooAKKKKACiiigAooooAKKKKACiiigAooooAKKKKACiiigAooooAKKKKACiiigAooooAKKKKACiiigAooooAKKKKACiiigAooooAKKKKACiiigAoo
国家蛋白标准品怎么这么难买?
[font=宋体][font=宋体]重组人血清白蛋白([/font][font=Calibri]Recombinant Human Serum Albumin[/font][font=宋体],简称[/font][font=Calibri]rHSA[/font][font=宋体])是一种通过基因工程技术合成的白蛋白。其结构和功能与天然人血清白蛋白相似,因此可以作为血浆替代物,适用于临床治疗、细胞培养和生物技术领域的研究等。[/font][/font][font=宋体][font=宋体]人血清白蛋白是一种由[/font][font=Calibri]585[/font][font=宋体]个氨基酸组成的单链蛋白质,分子量为[/font][font=Calibri]66.5kDa[/font][font=宋体],含有[/font][font=Calibri]17[/font][font=宋体]个二硫键和一个自由半胱氨酸。人血清白蛋白的结构包括三个结构上相似的功能域,而每个功能域又可分为包含两个相似的α[/font][font=Calibri]-[/font][font=宋体]螺旋结构的亚域,形成了一个心型分子。[/font][/font][b][font=宋体]人血清白蛋白在人体内负责许多细胞功能,如:[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]维持胶体渗透压,调节体液平衡[/font][/font][font=宋体][font=Calibri]2. [/font][font=宋体]结合和运输脂肪酸,胆红素和药物等各种物质[/font][/font][font=宋体][font=Calibri]3. [/font][font=宋体]通过清除自由基和活性氧作为抗氧化剂[/font][/font][font=宋体][font=Calibri]4. [/font][font=宋体]调节血液的[/font][font=Calibri]pH[/font][font=宋体]值和缓冲能力[/font][/font][font=宋体][font=Calibri]5. [/font][font=宋体]调节免疫反应和炎症[/font][/font][font=宋体][font=Calibri]6. [/font][font=宋体]提供配体代谢修饰,使潜在的毒素无害等[/font][/font][font=宋体] [/font][b][font=宋体]人血清白蛋白的用途与重要性[/font][/b][font=宋体] [/font][font=宋体]人血清白蛋白在医学领域的应用广泛,涉及治疗多种疾病和病症。其用途包括但不限于:[/font][font=宋体] [/font][font=宋体]治疗多种疾病:血容量不足、休克、烧伤、手术失血、外伤、出血、体外循环、急性呼吸窘迫综合征等。[/font][font=宋体]支持肝功能:急性与慢性肝病的治疗中,人血清白蛋白有助于肝功能恢复。[/font][font=宋体]营养支持:为患者提供必要的营养。[/font][font=宋体]蛋白质与肽的半衰期延长:有助于药物研发中延长蛋白质和肽的活性时间。[/font][font=宋体]细胞培养中的应用:在细胞培养中,人血清白蛋白的作用包括限制细胞聚集、保护蛋白质免于降解、结合与运输代谢物以及增加疏水分子溶解度。它还能增强培养中细胞的生长和活力,提高重组蛋白的产量和质量。[/font][font=宋体]生物反应器中的用途:在生物反应器中,人血清白蛋白用于减轻物理冲击和剪切,保护细胞。[/font][font=宋体]全球需求增长:随着其在生物学领域的广泛应用,全球对人血清白蛋白的需求逐年增加。[/font][font=宋体]人血清白蛋白的供应挑战与重组人血清白蛋白的发展[/font][font=宋体] [/font][b][font=宋体]由于人血清白蛋白的多种重要用途,其全球需求持续增长,但供应却面临挑战:[/font][/b][font=宋体] [/font][font=宋体]供应有限:传统上,人血清白蛋白是通过人类血浆分馏生产的,受限于血浆供应。[/font][font=宋体]原材料的不一致性:这可能影响患者安全、治疗效果,并存在潜在的血液来源病原体污染风险。[/font][font=宋体][font=宋体]重组人血清白蛋白的兴起:鉴于上述挑战,科学家们努力开发重组人血清白蛋白([/font][font=Calibri]Recombinant Human Serum Albumin, rHSA[/font][font=宋体])。多个宿主生物(如大肠杆菌、酵母等)被尝试用于生产重组蛋白,最终基于毕赤酵母和水稻的表达系统成为主要选择。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/recombinant-protein-expression-service][b]重组蛋白表达纯化服务[/b][/url],[/font][font=Calibri]https://cn.sinobiological.com/services/recombinant-protein-expression-service[/font][/font][font=宋体] [/font][font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/protein-productio][b]重组蛋白生产[/b][/url]:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-production[/font][/font][b][font=宋体] [/font][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
[em53] ,我最近常用石墨炉[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url](PE公司)测人血白蛋白中的铝,发现重现性很差。请教各位英雄,有没有什么好的解决办法??急盼回复!谢谢!
Waters XBridge C18柱,进了几针白蛋白,柱效明显下降了,咋办?
有谁知道如何用牛血清白蛋白配制空白血浆?文献报道如下:Reconstituted plasma was prepared by dissolving 0.8 g of NaCl, 0.02 g of NaCl, 0.02 g of KH2PO4, 0.11 g Na2HPO4 and 4 g of bovine albumin (Sigma, St. Louis, MO, USA) in 100 ml of water.但是0.8 g of NaCl, 0.02 g of NaCl肯定有一个是重复的,哪位大侠知道如何配制啊
凯氏定氮法检测期间微生物负载情况研究1凯氏定氮法检测前后产品中微生物负载情况研究本部分主要是考察人血白蛋白原液蛋白质含量检测前后产品中微生物负载水平的变化情况。1.1 材料供试品:人血白蛋白原液蛋白质含量检测前后的制品;培养基:青岛日水生物技术有限公司生产的胰酪大豆胨营养琼脂培养基(成品),批号:20150825。30-35 ℃细菌培养箱;净化超净工作台;无菌试管等。1. 2方法(1)样品的采集采用无菌的塑料试管,对连续生产的201601批至201610批共10批人血白蛋白产品原液蛋白质含量检测前后的制品进行取样,共得到20个样品。(2)试验方法根据《中国药典》2015版三部1105通则“微生物计数法”要求,在超净工作台下,每个样品取样1 ml接种到无菌的胰酪大豆胨琼脂培养基(φ脂培培养基)上,轻轻摇动,待样品分布均匀涂布后,放置于30-35 ℃细菌培养箱中培养3天,进行细菌计数。每个样品至少接种2个平皿,同时做阴性对照。1.3实验结果经30-35 ℃培养3天后,观察平皿培养结果,发现阴性对照无细菌菌落生长,人血白蛋白原液201601批至201610批细菌含量较多,菌落数均在100 cfu/ml以上,且部分平皿无法进行细菌菌落的准确计数。结果表明,人血白蛋白产品原液蛋白质含量检测前后制品中微生物含量存在批间差异,但总体来看微生物含量较多,且检测前后明显增多。图1至8为部分批次产品凯氏定氮法检测前后微生物的负载情况,图1,3,5,7为检测前,图2,4,6,8为检测后。[align=center] [img=,250,163]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151544_01_1626619_3.png[/img][/align][align=center]图1人血白蛋白201601批 [/align][align=center][img=,236,164]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151545_01_1626619_3.png[/img][/align][align=center] 图2人血白蛋白201602批[/align][align=center][img=,251,175]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151545_02_1626619_3.png[/img][/align][align=center]图3人血白蛋白201603批[/align][align=center][img=,234,174]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151546_01_1626619_3.png[/img][/align][align=center] 图4人血白蛋白201605批[/align][align=center][img=,251,166]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151546_02_1626619_3.png[/img][/align][align=center]图5人血白蛋白201606批[/align][align=center][img=,234,165]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151546_03_1626619_3.png[/img][/align][align=center] 图6人血白蛋白201608批[/align][align=center][img=,256,156]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151546_04_1626619_3.png[/img][/align][align=center]图7 人血白蛋白201609批 [/align][align=center][img=,256,156]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151547_01_1626619_3.png[/img] [/align][align=center] 图8 人血白蛋白201610批[/align]2产品中微生物负载量变化情况研究本部分主要考察凯氏定氮法检测蛋白质含量期间,随时间的延长人血白蛋白原液中微生物负载量变化的情况。通过对比检测前后制品原液中微生物负载水平的变化情况,分析由于检测时间较长带来的微生物数量的变化情况。2.1材料2.1.1 试剂供试品:人血白蛋白原液蛋白质含量检测前的制品;培养基:青岛日水生物技术有限公司生产的胰酪大豆胨营养琼脂培养基(成品),批号:20150825。2.1.2 仪器和软件30-35 ℃细菌培养箱;净化超净工作台;无菌试管等。2.2方法2.2.1样品的采集采用无菌的塑料试管,对连续生产的201601批至201603批共3批人血白蛋白产品原液蛋白质含量检测前的制品进行取样,每批样品至少取样20 ml。2.2.2试验方法根据《中国药典》2015版三部1105通则“微生物计数法”要求,将每批样品分样到13个无菌无热源的试管中,1 ml/管。放置于10-20 ℃的条件下密封保存,在超净工作台下分别把0 min、1 min、2 min、3 min、5 min、10 min、15 min、30 min、1 h、2 h、3 h时的样品取0.1 ml接种到无菌的胰酪大豆胨琼脂培养基上,轻轻摇动,待样品分布均匀涂布后,放置于30-35 ℃细菌培养箱中培养3天,进行细菌计数。每个样品至少接种2个平皿,同时做阴性对照。2.3 实验结果经30-35 ℃培养3天后,观察平皿培养结果,发现阴性对照无细菌菌落生长,表1为人血白蛋白原液201601批至201603批样品不同时间段接种的平皿中菌落平均数,图9为201601批至201603批产品不同时间段微生物数量变化趋势。[align=center]表1 不同时间段接种的平皿中菌落平均数[/align][align=center][img=,583,142]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151550_01_1626619_3.png[/img][/align][align=center][/align][align=center][img=,606,282]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151551_01_1626619_3.png[/img][/align][align=center]图9 201601批至201603批产品不同时间段微生物数量变化趋势[/align]从培养结果看,人血白蛋白原液201601批至201603批样品0 min、1 min、2 min、3 min、5 min、10 min、15 min、30 min,样品中的菌落数几乎没有变化;1 h后样品中菌落数有增长趋势。本次试验结果表明,人血白蛋白产品原液在等待凯氏定氮法检测蛋白质含量期间,制品中微生物负载量有增长的趋势。根据试验结果推算,在2-3小时后每ml人血白蛋白原液中至少含100 CFU,那么批量1000L的制品中至少含有109 个微生物,如此数量的微生物肯定会对人血白蛋白的质量(如纯度、热源)有一定的影响。但具体使用凯氏定氮法检测人血白蛋白原液蛋白质含量前后产品质量指标(如纯度、热原质等)的变化情况还有待进一步研究。结合[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]检测技术快速检测(2-3分钟)的特点,如果在人血白蛋白实际生产中应用[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]快速检测技术,除了能够快速准确的为人血白蛋白生产提供非常有意义的指导外,还能有效控制产品中的微生物负载量,大大降低人血白蛋白产品的质量风险。参考文献刘文芳. 人血白蛋白分离工艺的历史沿革及发展 . 中国输血杂志, 2008, 21(4):323-326.倪道明.《血液制品》 . 北京:人民卫生出版社, 2003.03: 19.Quinlan GJ,Martin GS, Evans TW. Albumin: biochemical properties and therapeutic potential . Hepatology. 2005. 41(6):1211-9.杨阳, 刘玉红, 王凤山.《人血清白蛋白的制备与应用研究进展》 .《中国药学杂志》, 2011, 46(24):1857-1860.杨晓波, 王晓雷, 王峰.人血白蛋白提取工艺的对比分析与改进方案 . 生命科学仪器, 2010, 08(2):44-48.张建军, 高缘, 孙婉瑾. 白蛋白作为药物载体的研究 . 化学进展, 2011, 23(8): 1747-1754.郭宾,李川. 药物与血浆蛋白结合的药理学基础及其研究进展 . 中国临床药理学和治疗学, 2005, 10(3): 241-253.张敏. 人血浆白蛋白的生理功能及临床应用 . 四川生理科学杂志, 2011, 33(1):36-38.肖婷予, 王斌. 人血白蛋白临床应用调查与分析 . 药物与临床, 2010, 45(13)1036.

凯氏定氮法检测期间微生物负载情况研究1凯氏定氮法检测前后产品中微生物负载情况研究本部分主要是考察人血白蛋白原液蛋白质含量检测前后产品中微生物负载水平的变化情况。1.1 材料供试品:人血白蛋白原液蛋白质含量检测前后的制品;培养基:青岛日水生物技术有限公司生产的胰酪大豆胨营养琼脂培养基(成品),批号:20150825。30-35 ℃细菌培养箱;净化超净工作台;无菌试管等。1. 2方法(1)样品的采集采用无菌的塑料试管,对连续生产的201601批至201610批共10批人血白蛋白产品原液蛋白质含量检测前后的制品进行取样,共得到20个样品。(2)试验方法根据《中国药典》2015版三部1105通则“微生物计数法”要求,在超净工作台下,每个样品取样1 ml接种到无菌的胰酪大豆胨琼脂培养基(φ脂培培养基)上,轻轻摇动,待样品分布均匀涂布后,放置于30-35 ℃细菌培养箱中培养3天,进行细菌计数。每个样品至少接种2个平皿,同时做阴性对照。1.3实验结果经30-35 ℃培养3天后,观察平皿培养结果,发现阴性对照无细菌菌落生长,人血白蛋白原液201601批至201610批细菌含量较多,菌落数均在100 cfu/ml以上,且部分平皿无法进行细菌菌落的准确计数。结果表明,人血白蛋白产品原液蛋白质含量检测前后制品中微生物含量存在批间差异,但总体来看微生物含量较多,且检测前后明显增多。图1至8为部分批次产品凯氏定氮法检测前后微生物的负载情况,图1,3,5,7为检测前,图2,4,6,8为检测后。[align=center] [img=,250,163]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151544_01_1626619_3.png[/img][/align][align=center]图1人血白蛋白201601批 [/align][align=center][img=,236,164]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151545_01_1626619_3.png[/img][/align][align=center] 图2人血白蛋白201602批[/align][align=center][img=,251,175]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151545_02_1626619_3.png[/img][/align][align=center]图3人血白蛋白201603批[/align][align=center][img=,234,174]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151546_01_1626619_3.png[/img][/align][align=center] 图4人血白蛋白201605批[/align][align=center][img=,251,166]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151546_02_1626619_3.png[/img][/align][align=center]图5人血白蛋白201606批[/align][align=center][img=,234,165]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151546_03_1626619_3.png[/img][/align][align=center] 图6人血白蛋白201608批[/align][align=center][img=,256,156]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151546_04_1626619_3.png[/img][/align][align=center]图7 人血白蛋白201609批 [/align][align=center][img=,256,156]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151547_01_1626619_3.png[/img] [/align][align=center] 图8 人血白蛋白201610批[/align]2产品中微生物负载量变化情况研究本部分主要考察凯氏定氮法检测蛋白质含量期间,随时间的延长人血白蛋白原液中微生物负载量变化的情况。通过对比检测前后制品原液中微生物负载水平的变化情况,分析由于检测时间较长带来的微生物数量的变化情况。2.1材料2.1.1 试剂供试品:人血白蛋白原液蛋白质含量检测前的制品;培养基:青岛日水生物技术有限公司生产的胰酪大豆胨营养琼脂培养基(成品),批号:20150825。2.1.2 仪器和软件30-35 ℃细菌培养箱;净化超净工作台;无菌试管等。2.2方法2.2.1样品的采集采用无菌的塑料试管,对连续生产的201601批至201603批共3批人血白蛋白产品原液蛋白质含量检测前的制品进行取样,每批样品至少取样20 ml。2.2.2试验方法根据《中国药典》2015版三部1105通则“微生物计数法”要求,将每批样品分样到13个无菌无热源的试管中,1 ml/管。放置于10-20 ℃的条件下密封保存,在超净工作台下分别把0 min、1 min、2 min、3 min、5 min、10 min、15 min、30 min、1 h、2 h、3 h时的样品取0.1 ml接种到无菌的胰酪大豆胨琼脂培养基上,轻轻摇动,待样品分布均匀涂布后,放置于30-35 ℃细菌培养箱中培养3天,进行细菌计数。每个样品至少接种2个平皿,同时做阴性对照。2.3 实验结果经30-35 ℃培养3天后,观察平皿培养结果,发现阴性对照无细菌菌落生长,表1为人血白蛋白原液201601批至201603批样品不同时间段接种的平皿中菌落平均数,图9为201601批至201603批产品不同时间段微生物数量变化趋势。[align=center]表1 不同时间段接种的平皿中菌落平均数[/align][align=center][img=,583,142]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151550_01_1626619_3.png[/img][/align][align=center][/align][align=center][img=,606,282]http://ng1.17img.cn/bbsfiles/images/2017/09/201709151551_01_1626619_3.png[/img][/align][align=center]图9 201601批至201603批产品不同时间段微生物数量变化趋势[/align]从培养结果看,人血白蛋白原液201601批至201603批样品0 min、1 min、2 min、3 min、5 min、10 min、15 min、30 min,样品中的菌落数几乎没有变化;1 h后样品中菌落数有增长趋势。本次试验结果表明,人血白蛋白产品原液在等待凯氏定氮法检测蛋白质含量期间,制品中微生物负载量有增长的趋势。根据试验结果推算,在2-3小时后每ml人血白蛋白原液中至少含100 CFU,那么批量1000L的制品中至少含有109 个微生物,如此数量的微生物肯定会对人血白蛋白的质量(如纯度、热源)有一定的影响。但具体使用凯氏定氮法检测人血白蛋白原液蛋白质含量前后产品质量指标(如纯度、热原质等)的变化情况还有待进一步研究。结合[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]检测技术快速检测(2-3分钟)的特点,如果在人血白蛋白实际生产中应用[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]快速检测技术,除了能够快速准确的为人血白蛋白生产提供非常有意义的指导外,还能有效控制产品中的微生物负载量,大大降低人血白蛋白产品的质量风险。参考文献刘文芳. 人血白蛋白分离工艺的历史沿革及发展 . 中国输血杂志, 2008, 21(4):323-326.倪道明.《血液制品》 . 北京:人民卫生出版社, 2003.03: 19.Quinlan GJ,Martin GS, Evans TW. Albumin: biochemical properties and therapeutic potential . Hepatology. 2005. 41(6):1211-9.杨阳, 刘玉红, 王凤山.《人血清白蛋白的制备与应用研究进展》 .《中国药学杂志》, 2011, 46(24):1857-1860.杨晓波, 王晓雷, 王峰.人血白蛋白提取工艺的对比分析与改进方案 . 生命科学仪器, 2010, 08(2):44-48.张建军, 高缘, 孙婉瑾. 白蛋白作为药物载体的研究 . 化学进展, 2011, 23(8): 1747-1754.郭宾,李川. 药物与血浆蛋白结合的药理学基础及其研究进展 . 中国临床药理学和治疗学, 2005, 10(3): 241-253.张敏. 人血浆白蛋白的生理功能及临床应用 . 四川生理科学杂志, 2011, 33(1):36-38.肖婷予, 王斌. 人血白蛋白临床应用调查与分析 . 药物与临床, 2010, 45(13)1036.
博晖创新是一家专门从事临床人体元素分析检测系列产品的研发、生产、销售以及售后服务的企业。2012年5月公司成功登陆深圳创业板。 博晖创新12月5日晚间公告,公司收购广东卫伦生物制药有限公司的30%股权。 广东卫伦拥有《药品生产许可证》及《药品GMP证书》,广东卫伦下属单采血浆子公司拥有《单采血浆许可证》。此外,广东卫伦拥有通过国家GMP认证的血液制品生产线以及符合国家标准的动物实验室一座,目前已取得的血液制品再注册批准文件包括人血白蛋白(5个规格)、冻干静注人免疫球蛋白(pH4)(2个规格)、人免疫球蛋白(1个规格)、乙型肝炎人免疫球蛋白(2个规格)、破伤风人免疫球蛋白(1个规格)、狂犬病人免疫球蛋白(3个规格)等。 紧接着,博晖创新宣布以16.27元/股的价格大安制药48%的股权,交易价格合计6.62亿元。 大安制药属于医药行业中的血液制品子行业,主要从事血液制品的研发、生产和销售,主要产品包括人血白蛋白和人免疫球蛋白。其目前共持有人血白蛋白16个规格批件、人免疫球蛋白2个规格批件、乙型肝炎人免疫球蛋白3个规格批件、破伤风人免疫球蛋白1个规格批件,所有品种规格均已取得再注册批件。目前大安制药人血白蛋白2个规格、人免疫球蛋白2个规格的产品可正式生产上市销售。 收购完成后,博晖创新形成了“血液制品+体外诊断”的战略布局。血液制品行业具有需求刚性、资源稀缺、特许经营等特点,因此一直以来行业景气度较高,并受到国家政策的重点扶持。通过收购大安和卫伦,博晖创新得到了稀缺的血液制品产业链,其打造血液制品大平台的前景可以期待。 但是据了解,大安制药是一家至今亏损的制药公司。跨界进军血液制品的博晖创新是否能如愿以偿?
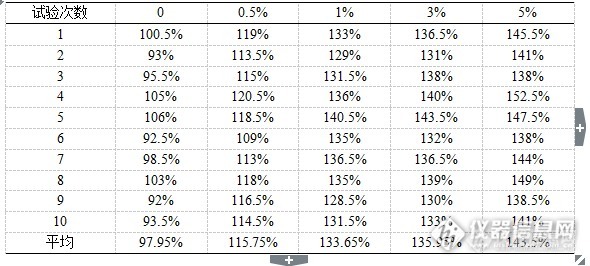
[b]中文摘要:目的[/b] 确立因子类血液制品中蛋白质含量对效价检测结果的影响,从而完善因子类血液制品效价检测的方法。[b]方法 [/b]选取不同蛋白质浓度梯度的稀释液对同一供试品进行稀释来确定蛋白质影响的规律。 [b]结果 [/b]建立起人凝血因子Ⅷ、人凝血酶原复合物的全自动血凝仪因子效价检测方法,根据效价检测反应体系中蛋白浓度对检测结果的影响,建立因子类血液制品效价全自动血凝仪检测的方法。[b]结论 [/b]建立的两种稀释方法均消除了样品中蛋白质含量的不同对检测结果的影响,提高了检测的准确性,不但可以适用于现在产品的效价检测,而且适用于随着生产工艺的提升生产的更高纯度、低蛋白含量的FⅧ和PCC,同时也是对中国药典标准的补充。[b]关键词[/b]:人凝血因子Ⅷ;人凝血酶原复合物;效价;蛋白含量 人凝血因子Ⅷ、人凝血酶原复合物、人凝血因子Ⅸ等因子类血液制品,是以健康人血浆为原料,经分离纯化和病毒灭活制成,在临床上主要用于各种凝血因子缺乏的治疗,这些因子类血液制品的凝血因子效价是药品有效性的指标,凝血因子效价的测定也是药品质量检测中的关键检测项目。血液制品生产企业及各级检测机构一般采用全自动血凝仪并按照仪器使用说明来进行因子效价的检测,然而在不同检测方法结果比对中,发现全自动血凝仪检测结果与中国药典中一期法的检测结果在部分因子效价检测中存在检测差异,差异可能是样品稀释中使用的稀释液的蛋白含量不同引起的,故本课题主要研究因子类血液制品中蛋白质含量对效价检测结果影响。通过蛋白含量对因子效价检测影响的研究建立起的全自动血凝仪因子效价检测方法,消除了产品本身性质的影响,可以准确进行因子效价的测定,方法的建立不但可以准确控制因子类血液制品的质量,保证生产企业持续稳定生产出质量均一的药品,而且可以减少因子类产品在临床使用中的风险。[b]1 实验仪器与试剂[b]1.1 仪器[/b][/b]Stago-compact全自动血凝仪(法国Diagnostica Stago公司),漩涡振荡器(美国Thermo Scientific公司)。[b][b]1.2 试剂[/b][/b]人凝血因子Ⅷ缺乏血浆(法国Diagnostica Stago公司),人凝血因子Ⅸ缺乏血浆(法国Diagnostica Stago公司),APTT试剂(法国Diagnostica Stago公司),Owren-Koller(稀释液)(法国Diagnostica Stago公司),0.025 mol/L氯化钙溶液(法国Diagnostica Stago公司),Desorb U(清洗液)(法国Diagnostica Stago公司),人凝血因子Ⅷ国家标准品(批号20100101),人凝血酶原复合物国家标准品(批号20130306),生理氯化钠溶液(石家庄四药有限公司),咪唑(天津市巴斯夫化工有限公司),氯化钠(天津市巴斯夫化工有限公司),枸橼酸钠(台山新宁制药有限公司),人血白蛋白(公司自产)。[b][b]2 方法2.1 人凝血因子Ⅷ不同蛋白质浓度梯度稀释效价测定[/b][/b] 人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 不同蛋白质浓度梯度稀释液制备:选取全自动血凝仪的稀释液Owren-Koller、生理氯化钠溶液、取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合液分别定义为稀释液1、稀释液2、稀释液3。向3种稀释液中分别加入人血白蛋白,使其中人血白蛋白的浓度分别为0、0.5%、1%、3%、5%。 人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用含不同蛋白浓度的稀释液做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.2 人凝血因子Ⅷ人凝血因子缺乏血浆稀释效价测定[/b] [/b]人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用人凝血因子Ⅷ缺乏血浆将其稀释成每1ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用人凝血因子Ⅷ缺乏血浆将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.3 人凝血酶原复合物人凝血因子Ⅸ不同蛋白质浓度梯度稀释效价测定[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 不同蛋白质浓度梯度稀释液制备同2.1。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用含不同蛋白浓度的稀释液做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]2.4 人凝血酶原复合物人凝血因子Ⅸ人凝血因子缺乏血浆稀释效价测定[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用人凝血因子Ⅸ缺乏血浆将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用人凝血因子Ⅸ缺乏血浆将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]3 结果3.1 人凝血因子Ⅷ不同蛋白质浓度梯度稀释效价测定结果[/b][/b] 选取2015ZK0801批人凝血因子Ⅷ进行了不同蛋白质浓度梯度稀释效价测定,不同浓度稀释液分别测定10次。人血白蛋白的浓度分别为0、0.5%、1%、3%、5%的稀释液1、稀释液2、稀释液3的效价检测结果分别见表1、2、3,效价检测结果为效价标示量的百分比。[align=center]表1 FⅧ质控品不同蛋白浓度梯度稀释液1检测结果[/align][align=center][img=,590,266]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142017_01_1626619_3.png[/img][/align][align=center]表2 FⅧ质控品不同蛋白浓度梯度稀释液2检测结果 [/align][align=center][img=,586,260]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_01_1626619_3.png[/img][/align][align=center]表3 FⅧ质控品不同蛋白浓度梯度稀释液3检测结果 [/align][align=center][img=,585,261]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_02_1626619_3.png[/img][/align]人凝血因子Ⅷ质控品2015ZK0801批用不同蛋白质浓度梯度的稀释液1、稀释液2、稀释液3稀释效价检测结果平均值用折线图表示,如图1:[align=center]图1 FⅧ质控品不同蛋白质浓度检测结果对比[/align][align=center][img=,548,295]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_03_1626619_3.png[/img][/align] 选取2批国外产人凝血因子Ⅷ和VWF混合制剂进行了不同蛋白质浓度梯度稀释效价测定,人血白蛋白的浓度分别为0、0.5%、1%、3%、5%的稀释液1、稀释液2、稀释液3的效价检测结果见表4、5,效价检测结果为效价标示量的百分比。[align=center]表4 658668A批制剂FⅧ检测结果[/align][align=center][img=,585,99]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142020_01_1626619_3.png[/img][/align][align=center]表5 A3B1814批制剂FⅧ检测结果[/align][align=center][img=,577,97]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142021_01_1626619_3.png[/img][/align]FⅧ效价检测结果用折线图表示,如图2、3:[align=center][img=,563,299]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142029_01_1626619_3.png[/img][/align][align=center]图2 658668A批不同蛋白质浓度检测结果对比[/align][align=center][img=,567,287]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142030_01_1626619_3.png[/img][/align][align=center]图3 A3B1814批不同蛋白质浓度检测结果对比[/align][b][b]3.2 人凝血酶原复合物不同蛋白质浓度梯度稀释效价测定结果[/b][/b] 选取2015ZK0901批人凝血酶原复合物进行了不同蛋白质浓度梯度稀释人凝血因子Ⅸ效价测定,不同浓度稀释液分别测定10次。人血白蛋白的浓度分别为0、0.5%、1%、2%、3%、4%、5%的稀释液1、稀释液2、稀释液3的效价检测结果分别见表6、7、8,效价检测结果为效价标示量的百分比。[align=center]表6 PCC质控品不同蛋白浓度梯度稀释液1检测结果[/align][align=center][img=,583,269]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142031_01_1626619_3.png[/img][/align][align=center]表7 PCC质控品不同蛋白浓度梯度稀释液2检测结果[/align][align=center][img=,586,260]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142031_02_1626619_3.png[/img][/align][align=center]表8 PCC质控品不同蛋白浓度梯度稀释液3检测结果[/align][align=center][img=,593,263]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142043_01_1626619_3.png[/img][/align]人凝血酶原复合物质控品2015ZK0901批用不同蛋白质浓度梯度的稀释液1、稀释液2、稀释液3稀释FⅨ效价检测结果平均值用折线图表示,如图4:[align=center][img=,556,300]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142032_01_1626619_3.png[/img][/align][align=center]图4 PCC质控品不同蛋白质浓度FⅨ检测结果对比[/align][b][b]3.3 人凝血因子Ⅷ人凝血因子缺乏血浆稀释效价测定结果[/b][/b]选取2015ZK0801批人凝血因子Ⅷ进行了人凝血因子缺乏血浆稀释效价测定,共测定10次。效价检测结果见表9,效价检测结果为效价标示量的百分比。[align=center]表9 FⅧ质控品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,579,74]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142032_02_1626619_3.png[/img][/align]选取2批国外产人凝血因子Ⅷ和VWF混合制剂进行了人凝血因子缺乏血浆稀释效价测定。效价检测结果见表10,效价检测结果为效价标示量的百分比。[align=center]表10 国外产品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,578,77]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142036_01_1626619_3.png[/img][/align][b][b]3.4 人凝血酶原复合物人凝血因子Ⅸ人凝血因子缺乏血浆稀释效价测定结果[/b][/b]选取2015ZK0901批人凝血酶原复合物进行了人凝血因子缺乏血浆稀释人凝血因子Ⅸ效价测定,共测定10次。效价检测结果见表11,效价检测结果为效价标示量的百分比。[align=center]表11 PCC质控品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,582,89]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142047_01_1626619_3.png[/img][/align][b][b]4 讨论[/b][/b] 本实验中对人凝血因子Ⅷ和人凝血酶原复合物分别用不同蛋白浓度梯度的稀释液进行了效价测定,另外用人凝血因子缺乏血浆稀释后进行了效价测定。因子效价测定中,稀释液1、稀释液2、稀释液3中加入相同浓度的人血白蛋白后,得到的因子效价检测结果没有差异,说明全自动血凝仪的稀释液Owren-Koller、生理氯化钠溶液、取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合液作为稀释液时没有区别。 人凝血因子Ⅷ、人凝血酶原复合物不同蛋白浓度梯度效价测定时,随着稀释液中蛋白质含量的增高,效价检测结果也不断升高,但在人凝血因子Ⅷ效价测定中,采用蛋白质含量为1%、3%的稀释液时,效价检测结果间均无显著差别,在人凝血酶原复合物人凝血因子Ⅸ效价测定中,采用蛋白质含量为0、0.5%、1%的稀释液时,效价检测结果间均无显著差别。另外,人凝血因子Ⅷ进行人凝血因子缺乏血浆稀释效价测定效价检测结果与采用蛋白质含量为1%、3%的稀释液得到的检测结果也无显著差异,人凝血酶原复合物人凝血因子缺乏血浆稀释人凝血因子Ⅸ效价检测结果与采用蛋白质含量为0、0.5%、1%的稀释液得到的检测结果也无显著差异。另外,国外生产的人凝血因子Ⅷ和VWF的混合制剂FⅧ效价的检测结果及血浆、稀释液的影响同泰邦公司产品一致。[b]参考文献[/b][align=left] 邬杨斌, 余蓉. 凝血因子Ⅸ复合物的研制 . 华西药学杂志, 2000, 15(3):177-179. Pabinger I, Brenner B, Kalina U, et al. Prothrombin complex concentrate(Beriplexw P/N)for emergency anticoagulation reversal: A prospective multinational clinical trial . J Thromb Haemost, 2008, 6(4):622-631. Kiman E, Elela AA, Ramsis N, et al. Evaluation of the coagulation factors activity of Cryosupernatant . Suez Canal Univ Med J, 2003, 6(2):247-258.Tullis JL, Melin M, Jurigian P. Clinical use of human Prothrombin complexes . N Engl J Med, 1965, 73(13):667-674.马莉, 孙盼, 李长清, 等. 去冷沉淀血浆的质量分析 . 中国生物制品学杂志, 2013, 26(1):81-83.魏舒, 时凯, 刘国荣, 等. 冻干人凝血酶原复合物的生产工艺研究 . 中国输血杂志, 2008, 21(10):282-284.Samama CM. Prothrombin complex concentrates: a brief review . Eur J Anaesthesiol, 2008, 25(10):784-789.焦丽华, 代旭兰, 刘文芳. 凝血酶原复合物的制备及其临床应用进展 .中国输血杂志, 2008, 21(9):737-741.[/align][b] [/b]
[b]【序号】:2【作者】:【题名】:[b][b][size=12px][font=&]T/CSIQ 77001—2020[/font] [/size][font=&][color=#333333]乳制品中ɑ-乳白蛋白含量的测定 高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法[/color][/font][/b][/b]【期刊】:【年、卷、期、起止页码】:【全文链接】:[/b]
请问,酪蛋白对照品有效期,一般为多久
[b]中文摘要:目的[/b] 确立因子类血液制品中蛋白质含量对效价检测结果的影响,从而完善因子类血液制品效价检测的方法。[b]方法 [/b]选取不同蛋白质浓度梯度的稀释液对同一供试品进行稀释来确定蛋白质影响的规律。 [b]结果 [/b]建立起人凝血因子Ⅷ、人凝血酶原复合物的全自动血凝仪因子效价检测方法,根据效价检测反应体系中蛋白浓度对检测结果的影响,建立因子类血液制品效价全自动血凝仪检测的方法。[b]结论 [/b]建立的两种稀释方法均消除了样品中蛋白质含量的不同对检测结果的影响,提高了检测的准确性,不但可以适用于现在产品的效价检测,而且适用于随着生产工艺的提升生产的更高纯度、低蛋白含量的FⅧ和PCC,同时也是对中国药典标准的补充。[b]关键词[/b]:人凝血因子Ⅷ;人凝血酶原复合物;效价;蛋白含量 人凝血因子Ⅷ、人凝血酶原复合物、人凝血因子Ⅸ等因子类血液制品,是以健康人血浆为原料,经分离纯化和病毒灭活制成,在临床上主要用于各种凝血因子缺乏的治疗,这些因子类血液制品的凝血因子效价是药品有效性的指标,凝血因子效价的测定也是药品质量检测中的关键检测项目。血液制品生产企业及各级检测机构一般采用全自动血凝仪并按照仪器使用说明来进行因子效价的检测,然而在不同检测方法结果比对中,发现全自动血凝仪检测结果与中国药典中一期法的检测结果在部分因子效价检测中存在检测差异,差异可能是样品稀释中使用的稀释液的蛋白含量不同引起的,故本课题主要研究因子类血液制品中蛋白质含量对效价检测结果影响。通过蛋白含量对因子效价检测影响的研究建立起的全自动血凝仪因子效价检测方法,消除了产品本身性质的影响,可以准确进行因子效价的测定,方法的建立不但可以准确控制因子类血液制品的质量,保证生产企业持续稳定生产出质量均一的药品,而且可以减少因子类产品在临床使用中的风险。[b]1 实验仪器与试剂[b]1.1 仪器[/b][/b]Stago-compact全自动血凝仪(法国Diagnostica Stago公司),漩涡振荡器(美国Thermo Scientific公司)。[b][b]1.2 试剂[/b][/b]人凝血因子Ⅷ缺乏血浆(法国Diagnostica Stago公司),人凝血因子Ⅸ缺乏血浆(法国Diagnostica Stago公司),APTT试剂(法国Diagnostica Stago公司),Owren-Koller(稀释液)(法国Diagnostica Stago公司),0.025 mol/L氯化钙溶液(法国Diagnostica Stago公司),Desorb U(清洗液)(法国Diagnostica Stago公司),人凝血因子Ⅷ国家标准品(批号20100101),人凝血酶原复合物国家标准品(批号20130306),生理氯化钠溶液(石家庄四药有限公司),咪唑(天津市巴斯夫化工有限公司),氯化钠(天津市巴斯夫化工有限公司),枸橼酸钠(台山新宁制药有限公司),人血白蛋白(公司自产)。[b][b]2 方法 2.1 人凝血因子Ⅷ不同蛋白质浓度梯度稀释效价测定[/b][/b] 人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 不同蛋白质浓度梯度稀释液制备:选取全自动血凝仪的稀释液Owren-Koller、生理氯化钠溶液、取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合液分别定义为稀释液1、稀释液2、稀释液3。向3种稀释液中分别加入人血白蛋白,使其中人血白蛋白的浓度分别为0、0.5%、1%、3%、5%。 人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用含不同蛋白浓度的稀释液做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.2 人凝血因子Ⅷ人凝血因子缺乏血浆稀释效价测定[/b] [/b]人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用人凝血因子Ⅷ缺乏血浆将其稀释成每1ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用人凝血因子Ⅷ缺乏血浆将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.3 人凝血酶原复合物人凝血因子Ⅸ不同蛋白质浓度梯度稀释效价测定[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 不同蛋白质浓度梯度稀释液制备同2.1。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用含不同蛋白浓度的稀释液做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]2.4 人凝血酶原复合物人凝血因子Ⅸ人凝血因子缺乏血浆稀释效价测定[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用人凝血因子Ⅸ缺乏血浆将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用人凝血因子Ⅸ缺乏血浆将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]3 结果3.1 人凝血因子Ⅷ不同蛋白质浓度梯度稀释效价测定结果[/b][/b] 选取2015ZK0801批人凝血因子Ⅷ进行了不同蛋白质浓度梯度稀释效价测定,不同浓度稀释液分别测定10次。人血白蛋白的浓度分别为0、0.5%、1%、3%、5%的稀释液1、稀释液2、稀释液3的效价检测结果分别见表1、2、3,效价检测结果为效价标示量的百分比。[align=center]表1 FⅧ质控品不同蛋白浓度梯度稀释液1检测结果[/align][align=center][/align][align=center][img=,590,266]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142017_01_1626619_3.png[/img][/align][align=center]表2 FⅧ质控品不同蛋白浓度梯度稀释液2检测结果 [/align][align=center][img=,586,260]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_01_1626619_3.png[/img][/align][align=center]表3 FⅧ质控品不同蛋白浓度梯度稀释液3检测结果 [/align][align=center][img=,585,261]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_02_1626619_3.png[/img][/align]人凝血因子Ⅷ质控品2015ZK0801批用不同蛋白质浓度梯度的稀释液1、稀释液2、稀释液3稀释效价检测结果平均值用折线图表示,如图1:[align=center]图1 FⅧ质控品不同蛋白质浓度检测结果对比[/align][align=center][img=,548,295]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_03_1626619_3.png[/img][/align] 选取2批国外产人凝血因子Ⅷ和VWF混合制剂进行了不同蛋白质浓度梯度稀释效价测定,人血白蛋白的浓度分别为0、0.5%、1%、3%、5%的稀释液1、稀释液2、稀释液3的效价检测结果见表4、5,效价检测结果为效价标示量的百分比。[align=center]表4 658668A批制剂FⅧ检测结果[/align][align=center][img=,585,99]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142020_01_1626619_3.png[/img][/align][align=center]表5 A3B1814批制剂FⅧ检测结果[/align][align=center][img=,577,97]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142021_01_1626619_3.png[/img][/align]FⅧ效价检测结果用折线图表示,如图2、3:[align=center][img=,563,299]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142029_01_1626619_3.png[/img][/align][align=center]图2 658668A批不同蛋白质浓度检测结果对比[/align][align=center][img=,567,287]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142030_01_1626619_3.png[/img][/align][align=center][/align][align=center]图3 A3B1814批不同蛋白质浓度检测结果对比[/align][b][b]3.2 人凝血酶原复合物不同蛋白质浓度梯度稀释效价测定结果[/b][/b] 选取2015ZK0901批人凝血酶原复合物进行了不同蛋白质浓度梯度稀释人凝血因子Ⅸ效价测定,不同浓度稀释液分别测定10次。人血白蛋白的浓度分别为0、0.5%、1%、2%、3%、4%、5%的稀释液1、稀释液2、稀释液3的效价检测结果分别见表6、7、8,效价检测结果为效价标示量的百分比。[align=center]表6 PCC质控品不同蛋白浓度梯度稀释液1检测结果[/align][align=center][img=,583,269]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142031_01_1626619_3.png[/img][/align][align=center]表7 PCC质控品不同蛋白浓度梯度稀释液2检测结果[/align][align=center][img=,586,260]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142031_02_1626619_3.png[/img][/align][align=center]表8 PCC质控品不同蛋白浓度梯度稀释液3检测结果[/align][align=center][img=,593,263]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142043_01_1626619_3.png[/img][/align]人凝血酶原复合物质控品2015ZK0901批用不同蛋白质浓度梯度的稀释液1、稀释液2、稀释液3稀释FⅨ效价检测结果平均值用折线图表示,如图4:[align=center][img=,556,300]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142032_01_1626619_3.png[/img][/align][align=center]图4 PCC质控品不同蛋白质浓度FⅨ检测结果对比[/align][b][b]3.3 人凝血因子Ⅷ人凝血因子缺乏血浆稀释效价测定结果[/b][/b]选取2015ZK0801批人凝血因子Ⅷ进行了人凝血因子缺乏血浆稀释效价测定,共测定10次。效价检测结果见表9,效价检测结果为效价标示量的百分比。[align=center]表9 FⅧ质控品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,579,74]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142032_02_1626619_3.png[/img][/align]选取2批国外产人凝血因子Ⅷ和VWF混合制剂进行了人凝血因子缺乏血浆稀释效价测定。效价检测结果见表10,效价检测结果为效价标示量的百分比。[align=center]表10 国外产品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,578,77]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142036_01_1626619_3.png[/img][/align][b][b]3.4 人凝血酶原复合物人凝血因子Ⅸ人凝血因子缺乏血浆稀释效价测定结果[/b][/b]选取2015ZK0901批人凝血酶原复合物进行了人凝血因子缺乏血浆稀释人凝血因子Ⅸ效价测定,共测定10次。效价检测结果见表11,效价检测结果为效价标示量的百分比。[align=center]表11 PCC质控品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,582,89]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142047_01_1626619_3.png[/img][/align][b][b]4 讨论[/b][/b] 本实验中对人凝血因子Ⅷ和人凝血酶原复合物分别用不同蛋白浓度梯度的稀释液进行了效价测定,另外用人凝血因子缺乏血浆稀释后进行了效价测定。因子效价测定中,稀释液1、稀释液2、稀释液3中加入相同浓度的人血白蛋白后,得到的因子效价检测结果没有差异,说明全自动血凝仪的稀释液Owren-Koller、生理氯化钠溶液、取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合液作为稀释液时没有区别。 人凝血因子Ⅷ、人凝血酶原复合物不同蛋白浓度梯度效价测定时,随着稀释液中蛋白质含量的增高,效价检测结果也不断升高,但在人凝血因子Ⅷ效价测定中,采用蛋白质含量为1%、3%的稀释液时,效价检测结果间均无显著差别,在人凝血酶原复合物人凝血因子Ⅸ效价测定中,采用蛋白质含量为0、0.5%、1%的稀释液时,效价检测结果间均无显著差别。另外,人凝血因子Ⅷ进行人凝血因子缺乏血浆稀释效价测定效价检测结果与采用蛋白质含量为1%、3%的稀释液得到的检测结果也无显著差异,人凝血酶原复合物人凝血因子缺乏血浆稀释人凝血因子Ⅸ效价检测结果与采用蛋白质含量为0、0.5%、1%的稀释液得到的检测结果也无显著差异。另外,国外生产的人凝血因子Ⅷ和VWF的混合制剂FⅧ效价的检测结果及血浆、稀释液的影响同泰邦公司产品一致。[b]参考文献[/b][align=left] 邬杨斌, 余蓉. 凝血因子Ⅸ复合物的研制 . 华西药学杂志, 2000, 15(3):177-179. Pabinger I, Brenner B, Kalina U, et al. Prothrombin complex concentrate(Beriplexw P/N)for emergency anticoagulation reversal: A prospective multinational clinical trial . J Thromb Haemost, 2008, 6(4):622-631. Kiman E, Elela AA, Ramsis N, et al. Evaluation of the coagulation factors activity of Cryosupernatant . Suez Canal Univ Med J, 2003, 6(2):247-258.Tullis JL, Melin M, Jurigian P. Clinical use of human Prothrombin complexes . N Engl J Med, 1965, 73(13):667-674.马莉, 孙盼, 李长清, 等. 去冷沉淀血浆的质量分析 . 中国生物制品学杂志, 2013, 26(1):81-83.魏舒, 时凯, 刘国荣, 等. 冻干人凝血酶原复合物的生产工艺研究 . 中国输血杂志, 2008, 21(10):282-284.Samama CM. Prothrombin complex concentrates: a brief review . Eur J Anaesthesiol, 2008, 25(10):784-789.焦丽华, 代旭兰, 刘文芳. 凝血酶原复合物的制备及其临床应用进展 .中国输血杂志, 2008, 21(9):737-741.[/align][b] [/b]
3日,财政部公布了2012年蛋白类生物药、通用名化学药项目拟支持名单,其中多家上市公司相关项目入围2012年蛋白类生物药和疫苗发展拟支持单位公示表序号 承担单位 项目名称1 北京昭衍新药研究中心 动物实验公共服务技术平台项目2 北京中关村生命科学园发展 北京蛋白类生物药创新园区公共服务支撑能力建设项目3 天津市国际生物医药联合研究院 天津生物技术药物研发开放实验室和GMP中试服务平台4 天津药物研究院 天津生物技术药物综合服务平台建设5 华北制药 抗体药物中试基地建设6 华北制药 重组人血白蛋白作为化学成分确定的无血清培养基添加物的产业化7 上海中信国健药业 新型抗体大规模制剂生产线8 上海天士力药业 生物一类新药注射用重组人尿激酶原产业化9 上海百迈博制药 用于类风湿性关节炎等重大疾病治疗的蛋白类生物药的产业化能力建设10 上海抗体药物国家工程研究中心 新型抗体纯化介质和无血清培养基产业化11 国家上海新药安全评价研究中心 药物非临床安全评价服务能力提升建设12 上海药明康德新药开发 符合国际标准的从DNA到临床批件一站式蛋白抗体药开发平台建设13 江苏华泰疫苗工程技术研究 疫苗研发公共服务平台14 海正药业(杭州) 年产320万支抗体药物安佰诺产业化与国际化能力建设15 杭州安普生物工程 用于动物细胞大规模培养的激流式生物反应器及其配套耗材产品的开发与产业化16 珠海联邦制药 重组人胰岛素高技术产业化示范工程17 广州博济医药生物技术 广州生物医药研究开发公共服务平台18 石药集团百克(烟台)生物制药 年产40万支聚乙二醇化重组人粒细胞刺激因子注射液产业化19 山东福瑞达医药集团公司 山东省新药药理与安全评价公共服务平台20 华兰生物工程 疫苗国际化认证建设21 厦门万泰沧海生物技术 国家一类新药重组戊型肝炎疫苗技术改造及海外注册22 南昌市浩然生物医药 蛋白类生物药新型高效分离纯化介质产业化23 武汉光谷生物产业基地建设投资 武汉国家生物产业基地基因工程药物公共服务平台建设24 西安交大保赛生物技术 生物药及疫苗用分离介质的自动化控制工业生产25 昆明亚灵生物科技 昆明国家生物产业基地灵长类实验动物与临床前评价服务支撑能力建设26 云南沃森生物技术 系列重大传染病预防用疫苗新产品产业化能力建设27 成都生物制品研究所 乙脑减毒活疫苗的国际化能力建设
中文摘要: 目的 将近红外光谱技术应用于人血白蛋白酸沉生产过程中,实现了生产过程中pH值的定量测定和过程监测。 方法 首先实验室条件下模拟6批酸沉过程,气相色谱法测定乙醇含量,pH计测定pH值;然后74个样品建立pH值测定的PLSR定量分析模型,在模型的建立中对样品集划分方法、光谱预处理方法以及样品的光谱进行了考察以优化模型。 结果 模型的Rc2=0.968,Rp2=0.956,RMSEC=0.0512,RMSECV=0.0875,RMSEP=0.0594。 结论 模型有较好的预测能力和重复性,可实现酸沉过程pH值的有效测定和终点的准确判断。关键词:近红外光谱分析技术;组分IV;化学计量学;酸沉淀;pH人血白蛋白(Human Albumin, HA)生产过程中,需要对组分IV(FIV)上清液进行酸沉,当pH值达到HA的等电点(大约4.60~4.70左右)时停止醋酸缓冲液的加入,此生产过程结束。人血白蛋白生产过程中对组分IV上清液进行酸沉,由于FIV上清乙醇的含量在40%左右,而乙醇对pH的影响较大,因此在生产中采用离线的方式,当临近终点时需要将反应液稀释至4倍,使乙醇含量在10%左右进行pH的测定。随着醋酸缓冲液的加入,如果同样将反应液稀释4倍则临近终点时测得的pH值有微小的差别,如果每次先测定乙醇的含量然后通过乙醇含量进行稀释得到乙醇含量10%的样品进行pH的测定则会使生产过程变得繁琐。在制药领域,NIRS作为一种重要的PAT工具,已成功用于药物的原辅料质量评价、关键过程的监测和控制、成品的快速放行和质量检测等各个环节,为保证产品质量、降低生产成本、革新生产过程发挥了重要的作用。本研究中利用NIRS结合化学计量学对HA生产过程中的FI+II+III上清液醇沉过程进行监测,以实现醇沉环节的过程控制。1 材料1.1 试剂FIV压滤后上清液(山东泰邦生物制品有限公司);pH 4.0的醋酸缓冲液(山东泰邦生物制品有限公司);无水乙醇(色谱纯,山东禹王实业有限公司化工分公司);去离子水。1.2 仪器和软件Antaris II FT-NIR光谱仪(美国Thermo Fisherscientific公司);内径4×50 mm的玻璃小管(Kimble Chase,德国);低温反应仪(郑州长城科工贸有限公司);气相色谱仪(美国Agilent Technologies公司);pH计(德国Sartorius公司);高速离心机(ThermoFisher Scientific公司);MATLAB 2013b(美国Mathworks公司);PLS_Toolbox工具箱(美国EigenvectorResearch公司)。2 方法2.1 酸沉过程实验室条件下模拟6批酸沉过程,除第6批外其它5批酸沉的步骤和第三章中的酸沉过程保持一致。第6批中在加酸13次后每次补加乙醇1 ml,共补加2次,其余条件和前5批均一致。每次取样1.2 ml并做离心处理,用于光谱的采集、乙醇含量的测定及pH值的测定。2.2 样品乙醇含量和pH值的测定气相色谱法测定样品中乙醇的含量。该部分实验在华熙福瑞达生物医药有限公司完成。根据测得的结果用去离子水配成乙醇含量为10%的样品,然后用pH计在室温条件下测定样品的pH值。2.3 样品光谱的采集 采用Antaris II FT-NIR光谱仪的透射模块采集样品的原始近红外光谱。光谱范围为10000-4000 cm-1,分辨率为8 cm-1,光程为4 mm,扫描次数32,背景参照为空气。所有样品采集3张原始光谱,以平均光谱作为最终的样品光谱。2.4 样品集的划分在近红外模型的建立中样品集的划分至关重要,对模型的准确性和有效性影响较大。校正集样品应包含所预测未知样品包含的所有化学成分并且化学值的浓度范围涵盖未知样品可能遇到的所有浓度范围,验证集样品应均匀分布于校正集样品中。因此需要科学合理的选择用于建模的样品,使模型既能满足应用的需要又能提高其准确性。目前可以用于校正集和验证集划分的方法较多,包括随机(Random Selection,RS)法、含量梯度法、Kennard-Stone(KS)法、SPXY(Sample Set PartitioningBased On Joint x-y Distances)法、Duplex法等8, 9]。本研究中对不同的样品集划分方法进行考察,以模型RMSEP值作为考察依据,优选出最佳的校正集和验证集,用于后面模型的建立。2.5 预处理方法的选择近红外原始光谱一般需要预处理以提取有效信息、消除无关信息和噪声的干扰。本研究中对正交信号校正(OSC)、一阶导数(First Derivative,FD)SG 15点平滑、二阶导数(SecondDerivative, SD)SG 15点平滑等预处理方法进行了考察,以模型RMSEP值作为考察依据,优选出最佳的预处理方法。2.6 样品光谱的考察由于样品最初是由生理盐水稀释配制而成,因此对样品光谱和生理盐水光谱进行了考察,寻找两者光谱间的异同,去除光谱中相似的光谱区间从而消除背景吸收对模型建立的影响。此外,光谱的吸光度值对光谱的质量以及模型的建立也将产生较大的影响。光谱较高的吸光度将导致检测器检测到的透过样品的光较少,所以此部分信号的信噪比较低;光谱较低的吸光度说明在此区间内样品吸收的近红外光较少,其包含的样品信息也较少。因此需要通过考察以选择最佳的光谱区间建立用于pH值测定的定量分析模型。2.7 模型的建立与评价 本研究中利用PLSR方法建立用于酸沉过程pH值测定的定量分析模型,Venetian blinds法作为校正集交互验证方法,并且对模型的预测能力和重复性进行评价。3 实验结果3.1 pH值测定结果图1和图2分别为气相色谱法测定样品乙醇含量时不含乙醇的空白样品气相色谱图和样品的气相色谱图。图中显示空白样品没有色谱峰出现,在样品色谱图中乙醇含量的峰出现在1.3 min左右,并且周围没有杂峰的干扰。酸沉过程pH值的测定结果,由于初始样品的pH值距离反应终点的pH值较远,在不影响终点判断的情况下第一至三批中0至2号样品、第四批中0至4号样品、第五六批中0至3号样品没有测定pH值,最终6个批次得到74个样品的pH值落在4.30-5.60范围内。[align=center][img=,437,186]data:image/png;base64,iVBORw0KGgoAAAANSUhEUgAAAo8AAAEXCAYAAADMTa7IAAAAAXNSR0IArs4c6QAAAAlwSFlzAAAWJQAAFiUBSVIk8AAAABl0RVh0U29mdHdhcmUATWljcm9zb2Z0IE9mZmljZX/tNXEAADl+SURBVHhe7d0HfBRl/sfx72bTISQhlNAJXaWDKFhAVOxdAfUAz36C3TvhBEUR+2EvWP9nAawoNs4GIioKVkBBelEgEAIJ6cnuf55dlhMv4EwM45bP83rtyyM3O/P83jM7+92ZeWbi/VYTDQEEEEAAAQQQQAABGwLxNqZhEgQQQAABBBBAAAEEAgKERzYEBBBAAAEEEEAAAdsC+yw8mrPha9euVWVl5a7OxMXFKSsrS/Xq1bPdQSZEAAEEEEAAAQQQCB+BfRYefT6fHn/8ceXl5e2qtrS0VElJSZo8eXL4CNATBBBAAAEEEEAAAd