各位大神想请教一个问题,本人做苯磺酸氨氯地平的方法学试验,样品是儿童铁锌钙口服液(保健品),标准是国家食药监总局药品补充检验方法和检验项目批准件(降压类中成药和辅助降血压类保健食品)第2011008号。一开始是几个地平一起做的(氨氯、尼群、非洛、硝苯),做了三个加标水平(10PPb、40ppb、80ppb)其他三个都没有问题,但是氨氯地平的三水平的回收率都非常高,超200%了,做了样品中是没有的,然后又单独配了氨氯地平的标曲和重做了回收率,这次比混标稍微好一点,但是三水平的回收率还是偏高,分别是160%、160%、130%,请问有遇到过类似情况的吗?是因为样品的问题吗?(就是说氨氯地平跟样品中的某些物质发生反应?我查看了图谱,标准的峰比较正常,但是样品加标的峰会比较胖一些),请各位大神指点!谢谢
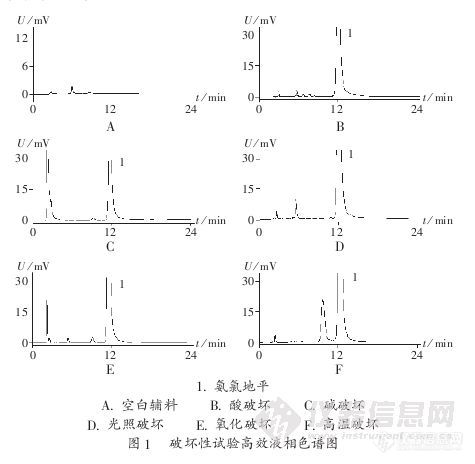
作者:秦书德 马晓伟 陈静 郭兴杰作者单位沈阳药科大学,摘 要:目的建立检查苯磺酸氨氯地平有关物质的反相高效液相色谱法。方法采用Diamonsil C18色谱柱(200 mm×4.6 mm,5μm)进行分离,流动相为甲醇-30 mmol/L磷酸二氢钾溶液(60∶40),流速1.0 mL/min,检测波长238 nm。结果所用色谱条件能很好地分离氨氯地平及其降解产物,氨氯地平质量浓度在0.71~3.57μg/mL范围内与峰面积线性关系良好。结论反相高效液相色谱法专属性强、准确、灵敏,可用于苯磺酸氨氯地平片中有关物质的检查:http://ng1.17img.cn/bbsfiles/images/2012/08/201208201631_384755_2379123_3.jpg
各位前辈,今日做苯磺酸氨氯地平片,看到新药转正标准上鉴别有红外鉴别一项,分别用氯仿、甲醇、无水乙醇提取后做红外图谱,但是和对照图谱集对不上哦,这是什么情况,有作过的朋友指点一下,到底有什么提取,怎样提取出来,感谢!
各位前辈,今日做苯磺酸氨氯地平片,看到新药转正标准上鉴别有红外鉴别一项,分别用氯仿、甲醇、无水乙醇提取后做红外图谱,但是和对照图谱集对不上哦,这是什么情况,有作过的朋友指点一下,到底有什么提取,怎样提取出来,感谢![color=#f10b00]见此贴:[/color][url]http://bbs.instrument.com.cn/shtml/20091027/2177496/[/url]
苯磺酸氨氯地平 2015年版二部药典上添加了有关物质I 是薄层色谱法 在紫外灯254nm和365nm下检视 大家觉着是分别开这两个波长的灯还是一起开?
氨氯地平是一种常用的抗高血压药物,对于其中的杂质,氨氯地平杂质其作用主要体现在以下几个方面:1. 质量影响:杂质会影响氨氯地平的纯度和稳定性,可能会导致药品质量下降。2. 安全性影响:杂质可能会产生一些未知的副作用和毒性反应,影响药品的安全性。3. 药效影响:杂质可能会干扰氨氯地平的药效,使得药物的治疗效果降低。4. 法规因素:食品药品监管部门对药品中的杂质有严格的限制标准,过多的杂质可能会导致药品不能上市。CATO标准品对于氨氯地平这类药物的生产,控制和降低杂质的含量是非常注重的。[img=,606,519]https://ng1.17img.cn/bbsfiles/images/2024/02/202402041354066781_2922_6381668_3.png!w606x519.jpg[/img]
急需以下化学试剂标准四氢呋喃、吗啉、DMF-DMA、N-甲基哌嗪、甲磺酸、对甲苯磺酸有知道的同志请将结果发送至我的邮箱weiweidou2008@live.cn谢谢大家啦!
一下子买不到色谱纯或分析纯的甲磺酸,于是就用了化学纯的甲磺酸,只是背景稍高于以前,分离效果目前也没有什么问题,不知道以后会不会有影响。
现在我们要用气相检测甲磺酸中的甲磺酸甲酯和甲磺酸乙酯,不知道甲磺酸能不能直接进样? 对柱子和仪器有什么要求不?感谢
急需甲磺酸丁酯,哪位大虾可以指点从哪里可以购买到,急急!
请问谁有甲磺酸的检测方法,最好是简单的点的,易操作的

遗传毒性杂质,现在是药学研究的焦点之一。甲磺酸、苯甲磺酸等磺酸盐类物质与微量的低级醇在合成反应中生成烷基磺酸酯类,这些物质可与DNA发生烷基化反应,从而可能成为引发癌症的诱因。欧洲医药评价署、美国食品和药品管理局及国际药品注册协调会议等先后对基因毒性杂质做出限度规定。具体到我们的甲磺酸加贝酯产品,需要对其中的甲磺酸乙酯的限度进行控制。溶液制备:对照品溶液 取甲磺酸乙酯适量,精密称定,用乙腈制成每毫升含1.5μg/ml的溶液,精密移取2ml加入顶空瓶中,加入3ml水,6g碘化钠后,扎盖密封。供试品溶液 取甲磺酸加贝酯适量,精密称定,按供试品100mg与乙腈1ml的比例配制供试品溶液,溶液经超声、波膜过滤处理后,精密移取2ml加入顶空瓶中,加入3ml水,3g碘化钠后,扎盖密封。色谱条件:Agilent 7890色谱仪,顶空进样器,FID检测器;色谱柱,月旭WEL-PEG20M,30m*0.32mm*0.25μm(Cat. NO:01918-32001;Ser. NO:GC20131102);进样口温度为110℃,检测器温度为260℃,氢气流速为30ml/min,空气流速为350ml/min,进样量为1mL,分流比为0.1:1。升温程序,起始温度为40℃,维持10min,然后以20℃/min的升温速率,升温至160℃,维持1min。顶空瓶平衡温度为80℃,平衡时间为30min。结果:对照液色谱图: http://ng1.17img.cn/bbsfiles/images/2014/07/201407021418_503868_1609327_3.jpg其中,时间为1.982min的保留峰为甲磺酸乙酯的衍生物。供试液色谱图:http://ng1.17img.cn/bbsfiles/images/2014/07/201407021538_503896_1609327_3.jpg由色谱图中可以看出,样品中未检出甲磺酸乙酯。讨论:出峰时间非常的快,但是理论塔板数、分离度、对称因子等却非常给力!既得到了良好的分离效果,又尽可能的节约了分析时间。

[align=center][b]甲磺酸伊马替尼片的中试质量研究[/b][/align][align=center]王淑华,臧恒昌[/align](山东大学药学院)[b]摘要:[/b]甲磺酸伊马替尼片是一种小分子靶向抑制剂,用于治疗费城染色体阳性的慢性髓性白血病的慢性期、加速期或急变期和不能切除和/或发生转移的恶性胃肠道间质瘤的成人患者。甲磺酸伊马替尼由瑞士诺华公司2001年在美国首研上市,作为肿瘤的首个靶向治疗药物面世开创了肿瘤分子靶向治疗的新时代,目前已经在全球90多个国家获得批准,美国、欧盟和其它国家还批准甲磺酸伊马替尼片用于胃肠基质瘤患者的治疗。2005年进口到中国,中文商品名是格列卫。本文按照现行药品注册法规的要求对甲磺酸伊马替尼片的制备工艺进行研究,在小试工艺处方的基础上进行中试放大,对粉碎、混合、制粒、总混、压片、包衣的工艺参数进行研究确定,并确定中试设备,用中试产品与格列卫进行全面的质量对比试验,并进行影响因素试验考察10天的研究。开发出与原研药具有相同质量的甲磺酸伊马替尼片,实现甲磺酸伊马替尼片的可工业化生产。[b]关键词:[/b]甲磺酸伊马替尼片;开发;制备工艺;[b]1 实验材料和仪器[/b]1.1实验材料[align=center][img=,572,220]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251640111718_2529_3389662_3.png!w572x220.jpg[/img][/align]1.2实验仪器[align=center][img=,573,287]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251642146696_8860_3389662_3.png!w573x287.jpg[/img][/align][b]2方法与结果 [/b] 研究内容包括中试放大3批,批量为5000片,筛选各项工艺参数、进行影响因素考察、与原研药进行全面的质量对比,最终确定了中试规模的处方、工艺、工艺参数、设备及场所。[b]2.1 中试3批样品的制备[/b]为了充分验证处方及制备工艺的可行性,优化各项工艺参数,中试制备了三批甲磺酸伊马替尼片(批号20111205、20111228、20120104),每批5000片,三批产品处方见表3[align=center][img=,555,295]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251643270416_551_3389662_3.png!w555x295.jpg[/img][/align]制备工艺:取甲磺酸伊马替尼,用万能粉碎机粉碎,筛网目数为100目,粉碎后称取处方量,备用。粉碎过筛后的甲磺酸伊马替尼、微晶纤维素、羟丙甲纤维素、交联聚维酮、二氧化硅和硬脂酸镁分别称取处方量备用;将甲磺酸伊马替尼、微晶纤维素(Ⅰ)、羟丙甲纤维素同置湿法混合制粒机中,混合9min,搅拌转速20Hz,剪切转速30Hz;在HLSG-10型混合制粒机中边搅拌边加入纯化水制软材,搅拌转速15HZ,剪切转速15HZ,时间5min,取出后摇摆制粒机20目筛制粒;湿颗粒置60℃热风循环干燥箱中干燥,至水分为2.5%以下时停止;干燥完的颗粒取出,用摇摆制粒机24目筛整粒;整粒后的颗粒,加入交联聚维酮、微晶纤维素(Ⅱ)和二氧化硅,置SH-20三维混合机中混合,转速为9rpm,时间为20min,然后加入硬脂酸镁,继续混合10min,出料。取样检测中间体含量,计算理论片重;将上述总混粉用ZPW-21B型旋转压片机压片,Ф9mm圆形双凸冲模,控制平均片重为理论片重±3%,硬度50-70N;LDCS型高效包衣机,出风温度:38℃;锅体转速:5-10 rpm;喷液泵转速:5-10 rpm;雾化压力:1100mbar;直喷压力:750mbar;包衣增重2%-4%;用铝塑包装机进行泡罩包装,每板10片。泡罩板外套复合膜袋。[b]2.2 工艺参数的研究2.2.1 原料药的粉碎 [/b]甲磺酸伊马替尼为水中易溶的药物,粉碎的粒度对药物溶出的影响不大,因此,确定使用湿法制粒的常规工艺参数:即万能粉碎机粉碎,筛网为100目,备用。[b]2.2.2 混合[/b]混合采用高效湿法混合制粒机,甲磺酸伊马替尼、微晶纤维素(Ⅰ)、羟丙甲纤维素同置湿法混合制粒机中混合,搅拌转速20Hz,剪切转速30Hz,分别于3min、6min、9min和12min在不同位置取样测定甲磺酸伊马替尼的含量,计算RSD值,结果见表4,中试三批的混合参数见表5。[align=center][img=,583,304]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251644390288_1847_3389662_3.png!w583x304.jpg[/img][/align]结果显示中试样品在6min时,各个位置的含量测定结果已经没有显著差异(RSD<5%),表明这时已经混合均匀,9min和12min时,物料更加均匀(RSD<2%)。为保证工艺操作的可靠性,将中试的混合时间确定为9min。[b]2.2.3 制粒 [/b]20111205批中试样品的制粒过程:在混合制粒机中边搅拌边加入纯化水制软材,搅拌转速15Hz,根据处方筛选的结果,加入的纯化水量应为75ml,制备时先加入50ml,然后开启制粒(剪切),转速15Hz,2min后停机观察,发现软材略干,润湿不够,又加入少许,最终纯化水加入量为65 ml,制粒3min后停机观察,发现软材能够握紧成团,轻压即散,符合要求。出料后,置20目筛摇摆制粒机中制粒,湿颗粒置60℃干燥箱中干燥,至水分为2.5%以下时停止。24目筛摇摆制粒机整粒。20111228,20120104两批样品的制备均按照上述参数执行。最终确定中试的制粒参数为:搅拌转速15HZ,剪切转速15HZ,时间5min。取出后摇摆制粒机20目筛制粒。60℃干燥。水分控制小于2.5%。24目筛整粒。[b]2.2.4 总混 [/b] 由于本品制粒后需要加入较多的粉末,包括交联聚维酮、微晶纤维素、二氧化硅和硬脂酸镁,约占片芯总重的22%,所以保证粉末和颗粒的充分混合就比较关键。结合20111205批中试样品的制备,对总混时间进行了取样验证。将整粒后的颗粒与交联聚维酮、微晶纤维素(Ⅱ)和二氧化硅同置三维混合机中混合20min,转速为9rpm,然后加入硬脂酸镁,继续混合10min。分别于15min、20min、25min和30min在混合机中物料的不同部位取样6份,测定其中甲磺酸伊马替尼的含量,计算RSD值,结果见表6,三批中试批混合参数见表7。[align=center][img=,613,321]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251656004349_7538_3389662_3.png!w613x321.jpg[/img][/align]最终确定的中试混合工艺参数为:将整粒后的颗粒与交联聚维酮、微晶纤维素(Ⅱ)、二氧化硅同置三维混合机中混合20min,转速为9rpm,然后加入硬脂酸镁,继续混合10min。[b]2.2.5 中间体含量测定[/b]总混粉取样,测定其中伊马替尼的含量,按100mg/片计算理论片重,见表8。[align=center][img=,574,92]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251656591680_4007_3389662_3.png!w574x92.jpg[/img][/align][b]2.2.6 压片 [/b]参照原研药,采用Ф9mm浅圆冲压片。单独制备了一批3000片用量的总混粉,分别压制不同硬度范围的甲磺酸伊马替尼片各约800片,以确定合适的硬度,结果见表9~11及图1。[align=center][img=,555,545]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251657410320_9022_3389662_3.png!w555x545.jpg[/img][img=,512,293]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251657512292_1250_3389662_3.png!w512x293.jpg[/img][/align]试验结果显示GYYJ01批的溶出5min明显快于格列卫,10min和15min略快于格列卫,其脆碎度为0.5%,且有裂片和断片出现,脆碎度不合格;GYYJ02批溶出曲线与格列卫基本一致,脆碎度合格;GYYJ03批溶出曲线明显慢于格列卫,脆碎度合格。因此,确定压片硬度应控制在50-70N的范围之内。三批中试样品压片参数见表12。[align=center][img=,573,160]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251658297289_6842_3389662_3.png!w573x160.jpg[/img][/align][b]2.2.7 包衣[/b]取GYYJ02批的素片,进行包衣增重的研究。分别于不同时间取出部分片剂,使得它们具有不同的包衣增重。包衣条件为:取包衣粉,用纯化水配制成固含量为13%的液体,搅拌40分钟,备用;出风温度38℃,锅体转速5-10rpm,喷液泵速度5-10rpm,侧喷压力1100mbar,直喷压力750mbar。结果见表13~14及图2[align=center][img=,596,329]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251659214722_6185_3389662_3.png!w596x329.jpg[/img][img=,532,316]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251659216782_8146_3389662_3.png!w532x316.jpg[/img][/align]试验结果显示3种不同的包衣增重对溶出曲线基本无影响,因此,确定包衣增重的范围为2%~4%。中试3批包衣结果见表15[align=center][img=,593,227]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251700491390_8973_3389662_3.png!w593x227.jpg[/img][/align][b]2.2.8 包装 [/b]包衣片用铝塑包装机包装,成形温度118℃,热封温度120℃。2.2.9 中试研究工艺参数汇总[align=center][img=,533,471]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251701345335_8652_3389662_3.png!w533x471.jpg[/img][/align][b]2.3 三批中试产品数据及与原研药的对比研究[/b]结果见表17~18及图3。[align=center][img=,651,279]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251703255806_9275_3389662_3.png!w651x279.jpg[/img][img=,605,691]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251703354406_5321_3389662_3.png!w605x691.jpg[/img][/align][align=center][img=,554,639]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251705217673_2956_3389662_3.png!w554x639.jpg[/img][img=,537,641]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251705282186_7479_3389662_3.png!w537x641.jpg[/img][/align]试验结果显示20111205、 20111228两批自研产品与原研产品格列卫,在0.1M盐酸、pH6.8磷酸盐缓冲液和pH4.5醋酸盐缓冲液和水等4种溶出介质中15分钟溶出度均超过85%,判定为体外溶出行为一致。三批中试产品的各项质量指标与格列卫一致。[b]2.4 影响因素试验[/b]取20111205批中试样品,置强光照射(照度4500Lx)、高温(60℃)、高湿(RH92.5%和RH75%)条件下各放置10天,分别于0、5、10天检测吸湿增重、性状、溶出度、有关物质、含量等各项指标。同时取对照药(格列卫,100mg),置上述条件下,于0天和10天检查相应的项目,作为对比研究。影响因素试验结果表19。[align=center][img=,565,439]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251706500796_5767_3389662_3.png!w565x439.jpg[/img][/align][align=center][/align]试验结果显示自研产品和进口原研产品在高湿RH75%±5%条件下考察10天,吸湿增重均超过5%,提示产品应注意防潮。自研产品和进口原研产品在其它3个条件下各项指标均保持稳定,无显著变化。[b]2.5 中试研究试验结果[/b]2.5.1 处方(按5000片计),见表20[align=center][img=,567,322]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251708221656_8624_3389662_3.png!w567x322.jpg[/img][/align][b]2.5.2 制备工艺 [/b](1)原辅料的处理取甲磺酸伊马替尼,用万能粉碎机粉碎,筛网目数为100目,粉碎后称取处方量,备用。粉碎过筛后的甲磺酸伊马替尼、微晶纤维素、羟丙甲纤维素、交联聚维酮、二氧化硅和硬脂酸镁分别称取处方量备用。(2)混合将甲磺酸伊马替尼、微晶纤维素(Ⅰ)、羟丙甲纤维素同置湿法混合制粒机中,混合9 min,搅拌转速20Hz,剪切转速30Hz。(3)制粒在HLSG-10型混合制粒机中边搅拌边加入纯化水制软材,搅拌转速15HZ,剪切转速15HZ,时间5min,取出后摇摆制粒机20目筛制粒。(4)干燥湿颗粒置60℃热风循环干燥箱中干燥,至水分为2.5%以下时停止。(5)整粒干燥完的颗粒取出,用摇摆制粒机24目筛整粒。(6)总混整粒后的颗粒,加入交联聚维酮、微晶纤维素(Ⅱ)和二氧化硅,置SH-20三维混合机中混合,转速为9rpm,时间为20min,然后加入硬脂酸镁,继续混合10min,出料。取样检测中间体含量,计算理论片重。(7)压片将上述总混粉用ZPW-21B型旋转压片机压片,Ф9mm圆形双凸冲模,控制平均片重为理论片重±3%,硬度50-70N。(8)包衣 LDCS型高效包衣机,出风温度:38℃;锅体转速:5-10 rpm;喷液泵转速:5-10 rpm;雾化压力:1100mbar;直喷压力:750 mbar;包衣增重2%-4%。(9)包装用铝塑包装机进行泡罩包装,每板10片。泡罩板外套复合膜袋。[b]2.5.3 中试研究场地[/b]固体制剂中试车间[b]2.5.4 中试设备[/b]见表2。[b]2.5.5 质量评价[/b]与原研药格列卫对比研究结果显示,中试产品的各项质量指标与格列卫相当,高温、光照、高湿三种剧烈条件下考察10天后,中试产品的各项质量指标仍与列卫相当,说明自研中试产品与原研产品质量一致。[b]3 结论[/b]因为本品原料是水溶性原料,粒度对溶出度影响不大,所以对原料前处理采用了常规机械粉碎法,过100目筛。物料混合6-12分钟都可以混匀,选择了中间点9分钟作为混合时间。根据实际情况,粘合剂水的用量由小试的2.5g/200片降到了65g/5000片。多批样品颗粒水分都小于2.5%,说明控制2.5%以下的颗粒水分适合本工艺。三批中试结果显示总混30分钟可以保证物料混合均匀。通过溶出曲线和脆碎度两个指标,考察了30-50N、50-70N、70-100N三个硬度范围,结果显示压片硬度范围在50-70N更为合理。包衣环节,考察了包衣增重2.1%、3.2%、4.2%三个梯度,对溶出曲线均无影响,最后确定包衣增重范围是2-4%。本文对甲磺酸伊马替尼片的制备工艺进行研究,用中试产品与格列卫进行全面的质量对比试验,并进行了影响因素试验考察研究,拟开发出与原研药具有相同质量的甲磺酸伊马替尼片,实现甲磺酸伊马替尼片的可工业化生产。
求助三氟甲磺酸酐气相测试方法我们用HP-5测试 不知道测试出来的是不是主峰,并且杂质较多,求助测试方法?是否可以做硅化测试?
请问三氟甲磺酸钠、三氟甲磺酸镨如何检测含量,急需
http://www.3158.com/upfiles4/2010/08/24/15/06/07/6599bb85.jpg请教各位版友,用液相法分析甲磺酸伊马替尼(见上式),其中有个中间体是没有与甲磺酸成盐的成分。在液相的溶液条件下(水相pH2.5),能把这两种物质分开吗?甲磺酸伊马替尼是可以水解的吧?这个中间体和甲磺酸依马替尼会生成同一种物质吗?要是这样的话,那这个中间体就没法分析了吧。谢谢各位版友!
请问三氟甲磺酸钠、三氟甲磺酸镨如何检测含量,急需
各位专家,有做过土壤中乙酸和甲磺酸的吗,跪求经验!
采用RP-HPLC法测定甲磺酸帕珠沙星中有关物质。采用Diamonsil C18 5μm 4.6×200mm;乙腈为流动相A液;取1000mL水加5.76g无水柠檬酸,用三乙胺调pH3.0∶乙腈(95∶5)为流动相B液,进行梯度洗脱,0~30min内A-B的比例由8∶92线性变化到50∶50,检测波长331nm,流速为1.0mL·min-1; 结果:甲磺酸帕珠沙星与中间体及各杂质峰能完全分离。该法准确,专属性好,可用于甲磺酸帕珠沙星有关物质检测。
有没有EDTA络合滴定三氟甲磺酸钪的方法

【作者】 管清香; 林天慕; 王恩思;【机构】 吉林大学药学院; 吉林大学生命科学学院;【摘要】 目的:建立测定甲磺酸地拉韦啶薄膜衣分散片含量的方法。方法:采用Diamonsil(TM) C18(150mm×4.6mm,5μm),乙腈-50mmol·L-1pH4.6磷酸二氢钠(55∶45)为流动相,检测波长为300nm。结果:甲磺酸地拉韦啶在12.54~62.70mg·L-1范围内呈良好线性关系(r=0.9999)。低、中、高3种浓度的平均回收率分别为99.5%,99.9%和101.5%(n=3)。结论:本方法简便、快速、专属性强,可用来测定甲磺酸地拉韦啶分散片的含量。 【谱图】
[font=&][color=#333333]欧洲药典中规定用碘化钠对甲磺酸酯进行衍生化,这里的碘化钠可以用碘化钾替代吗?[/color][/font]
在检测甲磺酸酯类物质时,根据欧洲药典方法,选用碘化钠和硫代硫酸钠作为衍生试剂,其中对照溶液的配置方法是称取一定量甲磺酸酯类到5ml容量瓶中,加甲苯稀释定容摇匀,请问甲苯的作用是什么呢

10,抽取5个版友);中奖名单:yifan1117(注册ID:yifan1117)捌道巴拉巴巴巴(注册ID:v3082413)20071940xu(注册ID:20071940xu)dyd3183621(注册ID:dyd3183621)zengzhengce163(注册ID:zengzhengce163)http://ng1.17img.cn/bbsfiles/images/2017/02/201702061500_01_1610895_3.jpghttp://ng1.17img.cn/bbsfiles/images/2017/02/201702061500_02_1610895_3.jpg【注意事项】同样的答案,每人只能发一次PS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。=======================================================================HPLC法测定甲磺酸多拉司琼的含量方法:HPLC基质:动物提取物应用编号:102760化合物:甲磺酸多拉司琼固定相:Diamonsil C18色谱柱/前处理小柱:Diamonsil C18, 250 x 4.6mm色谱条件:色谱柱:Diamonsil C18 250 mm× 4.6 mm, 5μm(Cat#:99903) 流动相: 乙腈- 水- 1mo l # L - 1 甲酸铵( 450:440:110), 用三乙胺调pH 至8.0 流速: 1.0 mL/min 柱温: 室温 进样量: 20μL 检测器: UV 285nm文章出处:中国药房 2007,18(22):1731-1732关键字:甲磺酸多拉司琼, Diamonsil C18, 钻石一代, 高效液相色谱法, HPLC, 含量测定谱图:摘要:目的:建立以高效液相色谱法测定甲磺酸多拉司琼含量的方法。方法:色谱柱为Diamonsil C18,流动相为乙腈-水-1mol.L-1甲酸铵(450∶440∶110),用三乙胺调pH至8.0,流速为1.0mL.min-1,检测波长为285nm,进样量为20μL。结果:甲磺酸多拉司琼检测浓度的线性范围为24~56μg.mL-1(r=0.9996);平均加样回收率为99.67%(RSD=0.74%)。结论:本方法操作简便、灵敏度高、重现性好,可用于甲磺酸多拉司琼的质量控制。http://www.dikma.com.cn/Public/Uploads/images/93-6.JPG
不知道哪位用GC检测过"三甲硅烷基三氟甲磺酸酯(TMSOTf)"?我们曾试过,但好象由于酸性太强,对色谱柱损伤太大,目前不敢再测了.
[color=#444444]请问大家有哪些方法可以衍生甲磺酸烷基酯类化合物,采用[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]进行测定。采用碘化钾水溶液衍生时空白有干扰。[/color]
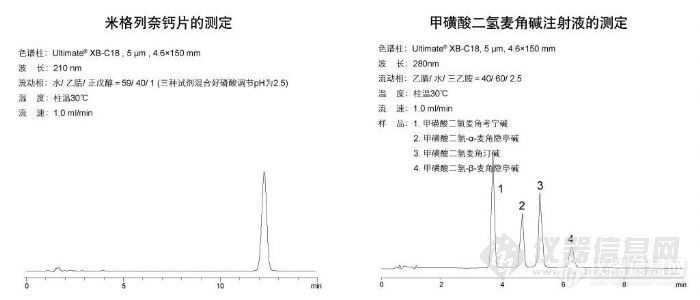
米格列奈钙片测定和甲磺酸二氢麦角碱注射液的测定http://ng1.17img.cn/bbsfiles/images/2009/11/200911021813_180160_1896702_3.jpg
请问大家在《空气与废气监测分析方法》115页,配制氨磺酸钠溶液时,书上有一句话很不解,写的是氨磺酸(H2NSO3H),写明氨磺酸的分子式是H2NSO3H,但是我找到药品瓶,氨磺酸药品瓶上的分子式是NH2SO2OH,而氨基磺酸药品瓶上的分子式是H2NSO3H,这到底是怎么回事?氨磺酸和氨基磺酸是有区别的吧?到底配制氨磺酸钠溶液用的是氨磺酸还是氨基磺酸,是把药品名写错了,还是把药品的分子式写错了呢?还是二者根本没有区别?另外,我找到另一瓶氨基磺酸,上面的分子式还有一种写的是H3NO3S,H3NO3S和H2NSO3H没有区别吧?
三氟化氮、四氟化碳、六氟化硫,三氟甲磺酸,这些高纯气体怎么分析?跪求分析方法
请问有没有食品中牛磺酸的测试标准?