如何检测石油醚,乙酸甲酯和丙酮???石油醚本身就有几个峰,要做内标法找不到对照品。用异丙醇或正丙醇做内标物可以嘛?哪个好一些?DB-WAX柱子?进样口、柱温、检测器温度如何??谢谢
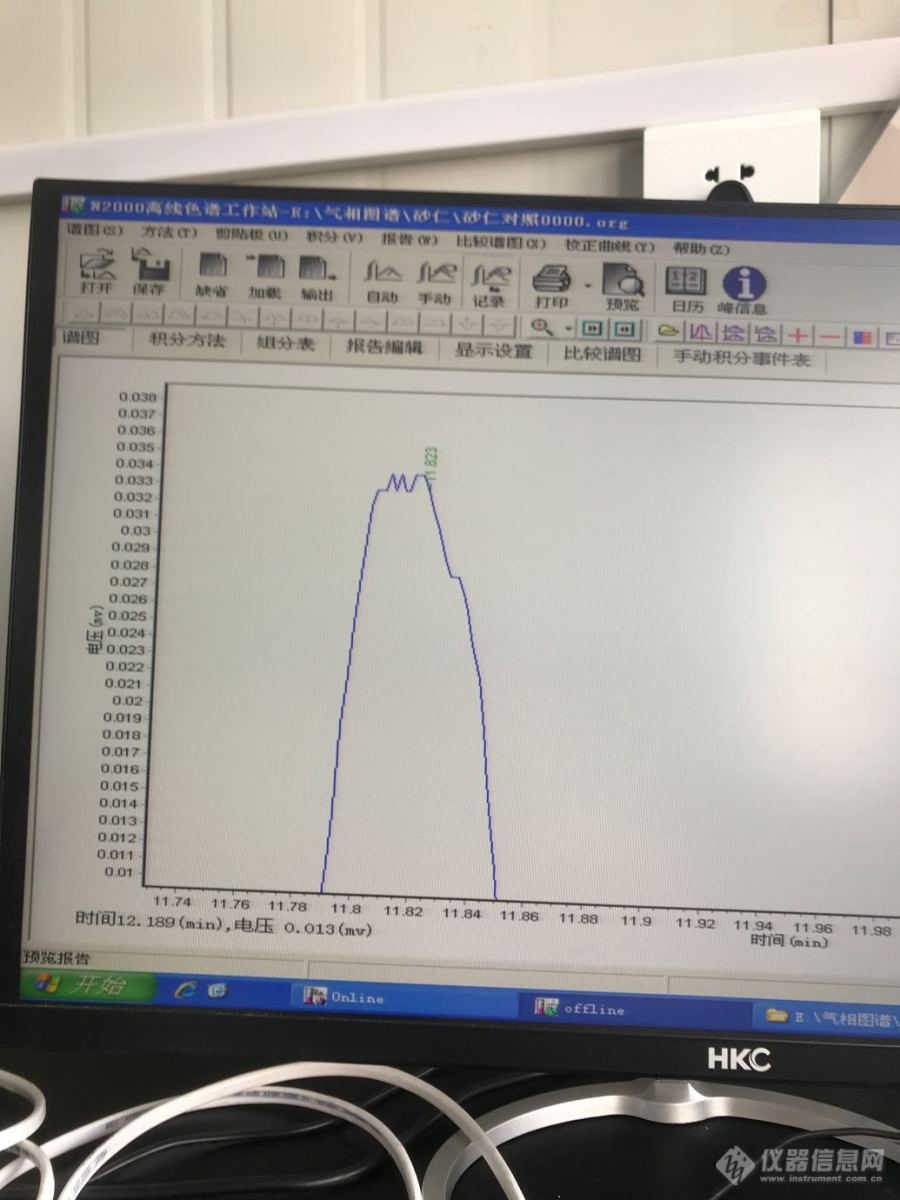
砂仁含量测定,乙酸龙脑脂对照品的峰是这样的,什么原因?[img=,690,920]https://ng1.17img.cn/bbsfiles/images/2019/09/201909291048233492_354_4008962_3.png[/img][img=,690,920]https://ng1.17img.cn/bbsfiles/images/2019/09/201909291048362627_1375_4008962_3.png[/img][img=,690,920]https://ng1.17img.cn/bbsfiles/images/2019/09/201909291048546892_2814_4008962_3.png[/img]
今天做乙酸乙酯残留,对照面积分别是702.2,722.5,738.6,790.4,821.2,rsd为6.5%,第一针和最后一针面积相差120左右,但rsd在10%内,这5个对照能采用吗?
各位专家,大家好,我现在用GC112A分析乙酸丁酯和2,3-丁二醇,柱子用的是SE-30和SE-54,2,3-丁二醇沸点为181左右,乙酸丁酯为126.1,可是乙酸丁酯的峰在2,3-丁二醇后面,而且分离度不够,不能大于1.5,我采用了各种升温程序都不行,有谁能告诉我怎么办么??
我现有一产品需要做有机溶剂残留量,可能的残留有机溶剂主要为二氯甲烷,乙酸乙酯,甲醇,乙醇.请问应该用什么样的色谱条件?
我不知道我这样理解对不对,请前辈们帮我捋一捋。一般原料叫香茅醇的是不是都是右旋的?玫瑰醇照理说应该是左旋香茅醇,但是市面上卖的玫瑰醇是不是精制过的香叶油?乙酸玫瑰酯是不是乙酸左旋香茅酯?乙酸香茅酯是不是就是乙酸右旋香茅酯?
保留时间:33.415min一款日化香精,HP-5的柱子,平常这个时间是香叶醇或者乙酸芳樟酯这次迷糊了,大家有空帮忙看看是哪个?
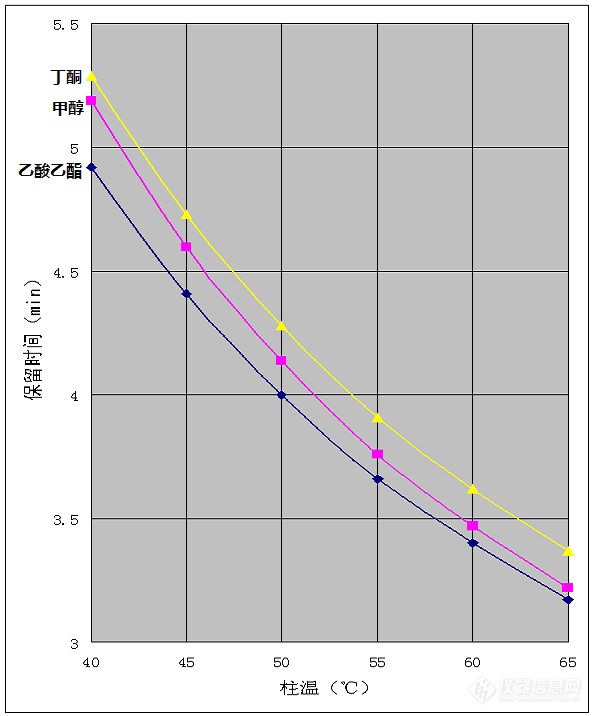
溶剂残留分析是[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]的重要应用之一,在药品、食品、包装等领域都是必测的项目。常见溶剂中涉及到的检测目标物经常有乙酸乙酯、甲醇、丁酮,以及二甲苯异构体这几项。最近看到 @m3091333、@p3109800、@Insm_c1196d2b 等多人发帖子讨论相关问题,我从原理上进行了一些解释,但终究纸上谈兵,于是找别的实验室要了这几种试剂,用实践检验了一下。首先,如果二甲苯异构体不要求分离,用624柱可以很容易的解决问题,这里就不讨论了。如果要求乙苯、对二甲苯、间二甲苯、邻二甲苯四种异构体分离,用624柱是无法完成的。因为二甲苯异构体色散力差异非常小,只能靠诱导力的差异分离,不同异构体在强极性柱上的极化率不同,乙苯极化率最低,其次是对二甲苯、间二甲苯,邻二甲苯极化率最大,出峰时间也随极化率的增加而延长。而624柱的极性比较弱,不能产生足够的极化作用,特别是对二甲苯与间二甲苯的极化差异非常小,无法实现分离。这个问题是由分子结构决定的,无论怎么调节色谱条件都不能解决。要想解决只能换强极性柱,常见的就是聚乙二醇柱,包括各种wax柱和FFAP柱等。三氟丙基柱也是强极性的,可以分离二甲苯异构体,但是这种柱很少使用。在聚乙二醇类的色谱柱上,乙酸乙酯、甲醇、丁酮三种目标物分离困难,各种类型的聚乙二醇柱选择性略有差异,但这三种物质都是较为接近的,想要分离是不太容易的。但是这三种物质与聚乙二醇固定相之间的作用力存在本质上的差异,因此通过调整柱温条件是可以分离的。下面三幅图是用60米*0.53mm*1um的INNOWAX柱分离乙酸乙酯、甲醇、丁酮的效果,柱温分别是40℃、50℃、60℃。[img=,690,796]http://ng1.17img.cn/bbsfiles/images/2018/08/201808022157168864_5041_2204387_3.png!w690x796.jpg[/img][img=,690,796]http://ng1.17img.cn/bbsfiles/images/2018/08/201808022157170984_7926_2204387_3.png!w690x796.jpg[/img][img=,690,796]http://ng1.17img.cn/bbsfiles/images/2018/08/201808022157172914_736_2204387_3.png!w690x796.jpg[/img]图中很明显,柱温低时甲醇与丁酮出峰时间接近分不开,高温时甲醇与乙酸乙酯出峰时间接近分不开,温度适中时三者可以实现分离。虽然未达到基线分离,但分离度都超过1,用来定量是完全可以的。这是找别人借的一根旧柱子,柱效只有4万塔板,如果是新柱子柱效应该能达到七八万塔板,分离度肯定更高,如果是0.32mm口径的柱子分离就更没问题了。要强调的是,能够实现分离的条件并不是完全靠盲目尝试获得的。我们看一看三种目标物的保留时间随柱温的变化就能发现其中的规律,见下图:[img=,594,716]http://ng1.17img.cn/bbsfiles/images/2018/08/201808022156374904_6999_2204387_3.png!w594x716.jpg[/img]图中可以看出,三种目标物的保留时间都是随温度升高而减小的,但是减小的幅度却并不相同。甲醇的保留时间随温度升高而减小的幅度明显大一些。这是因为甲醇具有羟基,与聚乙二醇固定相的相互作用力以氢键为主,氢键的强度随温度升高而迅速减弱。而乙酸乙酯、丁酮与聚乙二醇固定相的作用力都是以诱导力和取向力为主,这种力是由分子偶极矩决定的,受温度的影响要小一些。甲醇峰位置在乙酸乙酯与丁酮之间,温度升高时保留时间都减小,但甲醇减小更多,于是甲醇与乙酸乙酯靠的更近,与丁酮的分离度提高。温度降低时保留时间都增大,但甲醇增大更多,于是甲醇与丁酮靠的更近,与乙酸乙酯的分离度提高。用其他的柱子,如DB-wax或者FFAP时,各组分之间的相对位置会有差别,甚至有时出峰顺序都会变,但是保留时间随温度变化的这种规律仍然是适用的。所以遇到分不开的情况,一定不要盲目的乱试一通,也不用盲目的换柱子,一定要把问题想明白,有针对性的优化条件。最后要强调的是,这里虽然是以溶剂检测为例讨论了如何只用一根柱子就实现分离,但实际样品很复杂,并不是每次都能通过这种优化实现全部分离目的。所以色谱实验室配备多种不同极性的色谱柱是非常重要的。特别是做复杂样品时,即使谱图上看起来分离不错,最好也能用另外一种柱子进行一次验证,以免实际样品中有干扰物共流出,造成假阳性。
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=125076]丙二醇单甲醚乙酸酯的合成[/url]
大家经常做气相需要测对照品溶液,有时对照品溶液的出峰面积在不同时期可能差异较大,大家遇到过这样的问题吗?问题:取甲醇、乙酸乙酯、甲苯适量,精密称定,用DMF溶解稀释定容制成每1ml中约含甲醇60ug、乙酸乙酯100ug、甲苯20ug的混合溶液。那么我们实际称取的对照质量应该在什么范围内是可以接受的?因为称量的差异会导致对照品出峰面积的差异。问题:如何能用天平称准对照试剂的量?(有机溶剂甲醇、乙腈、二氯甲烷等)换算成体积量取还是直接称取?
[align=right][b]SGLC-GC-039[/b][/align][b]摘要:[/b]本文建立了砂仁中乙酸龙脑酯含量测定的GC 方法。结果表明,参照2020版《中国药典》中色谱条件并对升温程序进行优化,采用色谱柱SH-1 分析砂仁中乙酸龙脑酯,乙酸龙脑酯峰形对称,理论塔板数按乙酸龙脑酯峰计算远高于10000,满足《中国药典》要求。此方法可为砂仁中乙酸龙脑酯含量测定提供参考。。[b]关键词:[/b]砂仁 乙酸龙脑酯 SH-1 GC[b]1. 实验部分1.1 实验仪器及耗材[/b]Shimadzu GC-2030[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱仪[/color][/url];色谱柱:SH-50(30 m,0.25 mm × 0.25 μm;P/N:227-36162-01;S/N:1553669);SHIMSEN Arc Disc HPTFE针式过滤器(P/N:380-00341-05);[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]GC-MS[/color][/url]认证样品瓶LabTotal Vial(P/N:227-34002-01);SHIMSEN Pipet[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url]:SHIMSEN Pipet PMII-10(P/N:380-00751-02);SHIMSEN Pipet PMII-100(P/N:380-00751-04);SHIMSEN Pipet PMII-1000(P/N:380-00751-06)。[b]1.2 对照品溶液的制备[/b]取芳樟醇对照品适量,精密称定,加乙酸乙酯制成每1 mL含0.1 mg的溶液,即得。[b]1.3 供试品溶液的制备[/b]取本品粉末(过三号筛)约1 g,精密称定,置具塞锥形瓶中,精密加入无水乙醇25 mL,密塞,称定重量,超声处理(功率300W,频率40 kHz)30 分钟,放冷,用无水乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。。[b]1.4 分析条件[/b]色谱柱:SH-1 (30 m, 0.25 mm × 0.25 μm P/N:221-75719-30;S/N:1541069 )升温程序:初始温度80 ℃,保持1分钟,以每分钟2 ℃的速率升温至100 ℃,保持5分钟载气:N2进样口温度:230 ℃分流模式:分流(10:1)控制模式:恒线速度(30 cm/s)初始流速:1.09 mL/min检测器:FID,温度:250 ℃进样量:1 μL[b]2. 实验结果[/b]按照上述色谱条件(1.4)进行采集,对照品溶液和供试品溶液色谱图如下:[b]对照品溶液[/b][img=砂仁中乙酸龙脑酯含量测定]https://img.shimadzumall.com/Storage//userfiles/images/Img_articles/SGLC-GC-039_1.png[/img][font=arial, &][size=12px][/size][/font][b]供试品溶液[/b][img=砂仁中乙酸龙脑酯含量测定]https://img.shimadzumall.com/Storage//userfiles/images/Img_articles/SGLC-GC-039_2.png[/img][font=arial, &][size=12px][/size][/font][b]重现性[/b][img=砂仁中乙酸龙脑酯含量测定]https://img.shimadzumall.com/Storage//userfiles/images/Img_articles/SGLC-GC-039_3.png[/img][font=arial, &][size=12px][/size][/font][b]3. 结论[/b]本文建立了砂仁中乙酸龙脑酯含量测定的GC 方法。结果表明,参照2020版《中国药典》中色谱条件,采用色谱柱SH-1 分析砂仁中乙酸龙脑酯,乙酸龙脑酯峰形对称,理论塔板数按乙酸龙脑酯峰计算远高于10000,满足《中国药典》要求。此方法可为砂仁中乙酸龙脑酯含量测定提供参考。
二硫化碳毒性太大了,实验室也没准备,是上气相色谱法做乙酸乙酯、己酸乙酯用的,可以用乙醇稀释吗?有人做过吗?
我现在在做某物质的[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]残留溶剂,标准规定乙酸丁酯≤1000ppm,我配置对照品溶液时可以配置的比标准规定的低吗(比如对照品溶液配成500ppm)?样品中乙酸丁酯的残留大概是80ppm
产物中有空气,二氧化碳,乙醇,乙醛,乙酸,乙酸乙酯,之前一直用PQ柱,乙酸响应太低,且拖尾严重,求推荐合适的填充柱。
我现在要做一个乙酸乙酯残留的溶剂残留,但是标样已经没有了。我想请教一下,用分析纯的乙酸乙酯做对照对系统会有什么损害吗?我知道,那样的话,数据的精确度会打折扣,但是,这对系统,包括柱子和监测器会有什么损害吗?谢谢!da
[color=#444444]本人最近按2015版药典做了一个药用辅料-醋酸羟丙甲纤维素琥珀酸酯的的游离乙酸的含量测定实验。实验过程如下:[/color][color=#444444] 游离乙酸、琥珀酸 取本品0.102g,精密称定,置锥形瓶中,精密加入磷酸盐溶液(取0.02mol/L磷酸二氢钾溶液,用1mol/L氢氧化钠溶液调pH值至7.5)4.0ml,搅拌2小时,加磷酸溶液(取1.25mol/L磷酸1ml,置50ml量瓶中,加水稀释至刻度,摇匀)4.0ml,强力振摇,离心,上清液作为供试品溶液;精密称取琥珀酸0.13g,置100ml量瓶中,加水适量,振摇使完全溶解,加水至刻度,摇匀,作为琥珀酸贮备液;取加有水20ml的100ml量瓶,称重,精密加入冰乙酸2ml,再称重,用水稀释至刻度,摇匀,精密量取6ml,置100ml量瓶中,用水稀释至刻度,摇匀,作为乙酸贮备溶液;精密量取乙酸贮备液和琥珀酸贮备液各4.0ml,置同一25ml量瓶中,用流动相稀释至刻度,摇匀,作为对照溶液。照高效液相色谱法(中国药典2015年版四部通则0512)试验。以十八烷基硅烷键合硅胶为填充剂,以0.02moI/L磷酸二氢钾溶液(用6mol/L磷酸溶液调pH值至2.8)为流动相,流速每分钟1ml,检测波长为215nm。取对照溶液10μl, 注入液相色谱仪,按琥珀酸峰计算,理论板数不得少于8000。取供试品溶液与对照溶液各10μl,注入液相色谱仪,按干燥品计算,游离乙酸和琥珀酸总量不得过1.0%。[/color][color=#444444]计算公式: 游离乙酸含量=0.0768(WA/(W(1-干燥失重)))(γUA/γSA)[/color][color=#444444] 式中 WA为乙酸贮备溶液中冰乙酸量,mg;[/color][color=#444444] W为供试品的取样量,mg;[/color][color=#444444] γUA、γSA为供试品溶液、对照溶液中乙酸的峰面积。[/color][color=#444444] 游离琥珀酸含量=1.28(WS/(WUS(1-干燥失重)))(γUS/γSS)[/color][color=#444444] 式中 WS为琥珀酸贮备液中琥珀酸量,mg;[/color][color=#444444] WUS为供试品取样量,mg;[/color][color=#444444] γUS、γSS为供试品溶液、对照溶液琥珀酸的峰面积。[/color][color=#444444]我的问题是,根据“干燥品计算,游离乙酸和琥珀酸总量不得过1.0%”这句话,游离乙酸含量的最后计算的结果要不要乘以100%,比如我最后计算结果是0.0139,如果这个结果再乘以100%,就变为1.39%,从而超过限度,那么就需要重新做实验复核一遍。[/color]
se54毛细柱可用于检测丙二醇甲醚乙酸酯吗
se54毛细柱子可用于检测丙二醇甲醚乙酸酯吗
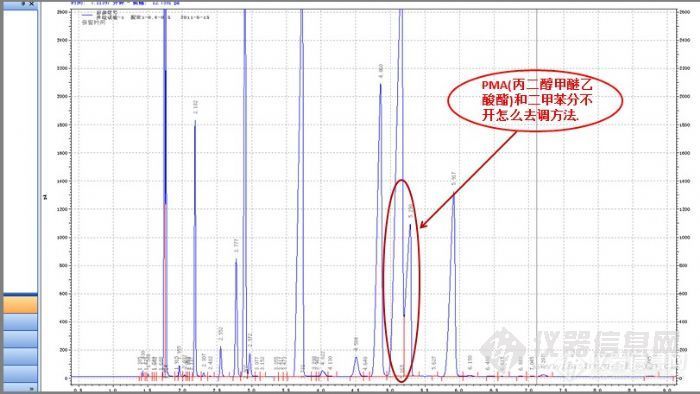
测涂料里的苯系物 PMA+二甲苯分不开各位: 1、我今天做了一下PU白面漆的苯系物含量,但做出来的谱图里面的 PMA(丙二醇甲醚乙酸酯)和那个二甲苯分不开,要怎么去调方法呢? 2、做涂料的苯系物含量是不是要先按要求配比好(漆:固化剂:稀释剂),再加一点乙酸乙脂稀释,再离心一下,取上部清液分析呢。http://ng1.17img.cn/bbsfiles/images/2017/01/201701191653_630872_2263490_3.jpg
第一题:请问为什么白酒中乙酸乙酯要用内标法? 外标法有何缺陷?第二题:测定甲醇可以和乙酸乙酯用同一根柱子么?请各位老师指教...
请问DMBC Acetate乙酸二甲基苄基原醇酯的质谱图是怎样的?CAS000151-05-3
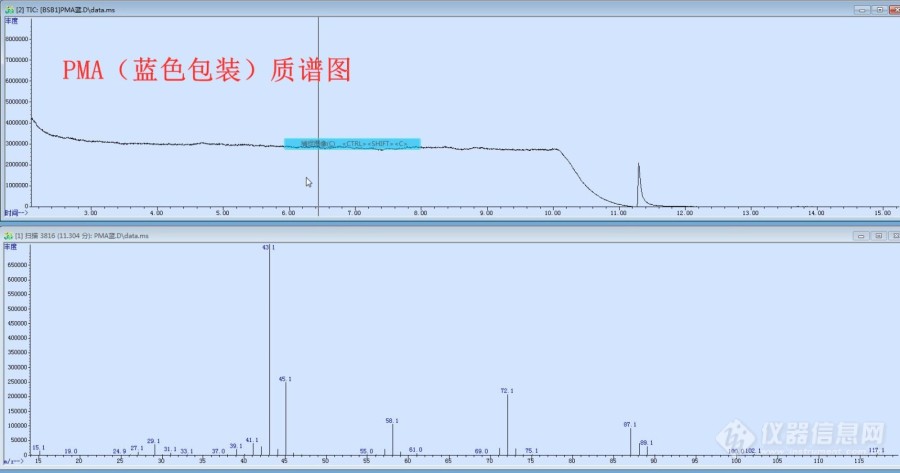
2018年,无意中发现仓库里的两个批次PMA出峰时间有一点区别(一批次是白色桶包装,另一批次是蓝色桶包装,是同一个厂家生产的),当时闻了两个批次PMA的气味是一样的,就没有在意,只是把两个批次的PMA分别留了一瓶样, 前几天把2018年留的样拿出来重新测了一下, 一、色谱上检测,两个样品确实出峰时间不一样,(下图色谱图是两个样1:1混合,出两个峰,峰面积差不多1:1)。 二、质谱走样, 1、正常PMA(蓝色桶)主要离子丰度从大到小大致是43、45、72、58、87,与谱库离子对的上号。 2、未知物(白色桶PMA)主要离子丰度从大到小大致是59、43、29、31、72。 三、百度上搜索了下,丙二醇甲醚乙酸酯好像没有其他结构,只有在HG/T3940-2007工业用丙二醇甲醚乙酸酯标准中提到过“2-甲氧基-1-丙醇乙酸酯”的物质请专家指导一下,从质谱上分析,这个未知物(白色桶PMA)会不会是2-甲氧基-1-丙醇乙酸酯?[img=,690,473]https://ng1.17img.cn/bbsfiles/images/2021/06/202106011541055349_1792_2932653_3.png!w690x473.jpg[/img][img=,690,362]https://ng1.17img.cn/bbsfiles/images/2021/06/202106011541232724_8127_2932653_3.jpg!w690x362.jpg[/img][img=,690,358]https://ng1.17img.cn/bbsfiles/images/2021/06/202106011541376269_8104_2932653_3.jpg!w690x358.jpg[/img][img=,690,920]https://ng1.17img.cn/bbsfiles/images/2021/06/202106011541500369_5011_2932653_3.jpg!w690x920.jpg[/img]
我在GDX-102气象色谱柱(热导池法)上测混合物(含乙酸。乙醇。正丙醇。异丁醇。异戊醇。乙酸乙酯。乙酸正丙酯。乙酸异丁酯。乙酸异戊酯),请问专家:怎样控制气象色谱的操作条件能把这些混合物各自的含量测出来,而且峰形较好
(1)原理试样经处理后,在pH6左右的溶液中,镉离子与二硫腙形成配合物,并经乙酸丁酯萃取分离,导入原子吸收仪中,原子化以后,吸收228.8nm共振线,其吸收值与镉含量成正比,与标准系列比较定量。(2)试剂 氨水、混合酸、1g/L二硫腙-乙酸丁酯溶液(称取0.1g二硫腙,加10mL三氯甲烷溶解后,再加乙酸丁酯稀释至100rnL,临用时配制)、2mo1/L柠檬酸钠缓冲液(称取226.3g柠檬酸钠及48.46g柠檬酸,加水溶解,必要时加温助溶,冷却后加水稀释至500mL,临用前用1g/L二硫腙-乙酸丁酯溶液处理以降低空白值)、镉标准储备溶液和标准使用液的配制与碘化钾-4-甲基戊酮-2法中的相同。(3)仪器原子吸收分光光度计。(4)分析步骤①试样处理对于谷类要去除其中的杂物及尘土,必要时除去外壳。对于豆类,取可食部分洗净晾干,切碎充分混匀。②样品消化称取5.00g上述试样,置于250mL高型烧杯中,加15mL混合酸,盖上表面皿,放置过夜,再于电热板或电砂浴上加热。消化过程中,注意勿使干涸,必要时可加少量硝酸,直至溶液澄明无色或微带黄色。冷后加25mL水煮沸,除去残余的硝酸至产生大量白烟为止,如此处理两次,放冷。以25mL水分数次将烧杯内容物洗入125mL分液漏斗中。取与处理样品相同量的混合酸、硝酸按同一操作方法做试剂空白试验。③萃取分离 吸取0、0.25mL、0.50mL、1.50mL、2.50mL、3.50mL、5.0mL镉标准使用液(相当于0、0.05μg、0.1μg、0.3μg、0.5μg、0.7μg、1.0μg镉)。分别置于125mL分液漏斗中,各加盐酸(1+11)至25mL。向试样品处理溶液、试剂空白液及镉标准溶液各分液漏斗中各加5mL柠檬酸钠缓冲液(2mol/L),以氨水调节pH至5~6.4,然后各加水至50mL,混匀。再各加5.0mL二硫腙-乙酸丁酯溶液(1g/L),以氨水调节pH至5~6.4,然后各加水至501mL,混匀。再各加5.0mL二硫腙-乙酸丁酯溶液(1g/L),振摇2min,静置分层,弃去下层水相,将有机层放入具塞试管中,备用。④测定测定方法与碘化钾-4-甲基戊酮-2法中的相同。⑤结果计算 样品中镉的含量按下式进行计算。X=/(m×1000)式中,X为试样中镉的含量,mg/kg;A1为测定用试样液中镉的质量,μg;A2为试剂空白液中镉的质量,μg;m为试样质量或体积,g或mL。计算结果保留两位有效数字。⑥精密度 在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的15%。
用FFAP分析白酒中乙酸乙酯和甲醇时,乙酸乙酯和甲醇的出峰时间比较接近,如果乙酸乙酯含量太高,甲醇含量太低的时候,乙酸乙酯出峰覆盖甲醇峰,无法对甲醇的浓度做出判断!请问该用什么方法解决?

帮我看下乙酸乙酯的标线做的怎么样?1分钟多的是二硫化碳,我用的乙酸乙酯是分析纯的,我推算是1.6分钟那个是乙酸乙酯,其他是杂质峰,老师们觉得呢[img=,690,949]https://ng1.17img.cn/bbsfiles/images/2019/07/201907051351244896_5205_1791505_3.jpg!w690x949.jpg[/img]
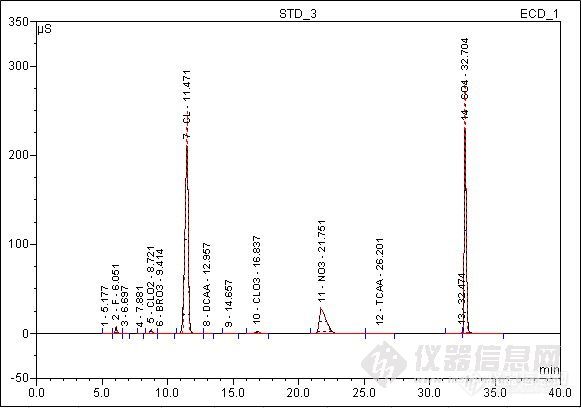
离子色谱法测定水中二氯乙酸和三氯乙酸检测实施细则1 目的规范离子色谱测定生活饮用水和水源水中二氯乙酸和三氯乙酸检测方法,保证检测工作顺利进行。2 方法的适用范围适用于使用戴安ICS-900离子色谱仪对生活饮用水和水源水中二氯乙酸和三氯乙酸进行检测。该方法对这两种消毒副产物的方法检出限(MDL)分别为:二氯乙酸:1.5μg/L;三氯乙酸:1.8μg/L,定量检测限(LOQ)分别为:二氯乙酸:6.0μg/L三氯乙酸:7.2μg/L。3 仪器3.1 ICS-900离子色谱仪:AS19分析柱、AG19保护柱、ASRS300抑制器、ED50电导检测器3.2 AS-DV自动进样器3.3 CR-ATC淋洗液自动生成器4 试剂4.1 纯水:含各种待测阴离子应低于仪器的最低检出限,使用前应测定空白值。4.2 二氯乙酸和三氯乙酸标准物质,由上海安谱科学仪器有限公司提供。二氯乙酸标准品:1g;三氯乙酸标准品:1g(纯度为99.40%)。5 水样5.1 水样的采集及储存:水样采集在聚乙烯瓶中,于4℃冰箱内保存。5.2 水样的预处理:经0.2μm孔径的微孔滤膜过滤后可直接进样;若样品中碳酸根的质量浓度在200 mg/L以上,则要经过酸化除去大量存在的碳酸根,然后将样品在真空装置中进行脱气,再进样分析。样品测定时应注意的问题样品中某些组分浓度太高,应选择适当的稀释倍数稀释样品后测定。如果已检测了高组分的样品,并对下一样品的测定产生了影响,建议进1一2针去离子水测定,将高组份完全洗脱后再测下一个样品。由于进样量小,操作装应严格防止纯水和器皿在水样预处理过程中的污染,以确保分析的准确性。6 试验6.1 色谱条件进样体积:300μL;流量:1.0mL/min。表5.1.1.1 淋洗液梯度程序时间/(min)氢氧化钾浓度/(mmol/L)0.010.025.0
气相用的比较少,所以条件总是摸索不好。现在条件是 安捷伦7890-FID 柱子是 HP-innowax 30m 求助详细色谱条件 进样口温度 分流比 柱子流速 程序升温 谢谢~~~测甲醇和乙酸乙酯一个方法 测乙醇另一个方法。现在总是甲醇乙酸乙酯乙醇分不开。 乙醇方法中乙醇峰宽太大0.14了都....新手求助~~~ 谢谢现在我用的条件是 进样口220度 分流比 20:1 进样体积1μL 柱流速2.5 , 柱温 40度保持5分钟 30度每分升到220 结束。还是分不开。乙酸乙酯和甲醇都是圆头峰还叠加在一起连带着乙醇... 流速1.5-3.5都试过,温度50也试过柱子是 hp-innowax ,30m ,0.25mm ,0.25μm另外大家洗针的溶剂是什么?做红酒是蒸馏后进样还是过0.25膜后直接进样?
脱氢乙酸具有较强抑制细菌、霉菌及酵母菌发酵的作用,尤其对霉菌的抑制作用最强,是一种高效的防霉、防腐剂。其还具有脂溶性强、热稳定性高的特点,在摄氏120℃的杀菌温度下仍保持杀菌能力不变。国外曾广泛使用于食品、药品中,我国自上世纪70年代中其开始用于食品防腐,曾用于果汁、酱菜、腐乳、干酪、人造奶油、乳酸菌饮料、月饼、果酱等食品。而脱氢乙酸的缺点是毒性较强,目前我国允许在腐乳、酱菜、果蔬汁、肉类制品、糕点、月饼、焙烤馅料中作为防腐剂使用,最大使用量0.5克/公斤。 脱氢乙酸的国标检测方法为[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法,样品经过有机溶剂的萃取、净化、浓缩等步骤的复杂处理,并且脱氢乙酸在[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]条件下,色谱峰出现拖尾现象,使定性、定量影响较大。据报道利用高效液相色谱法食品中的脱氢乙酸,采用纯水、乙醇-水、碱性水对样品进行超声萃取处理,萃取液经过滤后上机检测。作者在试验中发现,利用脱氢乙酸难溶于水而易溶于甲醇、乙醇、乙腈等有机溶剂的特性,样品均浆后酸化处理,用乙腈提取,经微孔过滤后再用高效液相色谱进行定性、定量测定,方法的灵敏度、准确度和回收率高,精密度良好,重现性好,前处理简便快捷,更能满足样品分析要求。 实验样品材料采用一般市售的果汁、酱菜、腐乳、糕点等食品。果汁样品精确称取5.00 g于50 ml的离心管中;酱菜、腐乳、糕点等食品样品事先均匀,准确称取2.0~3.0 g于50ml的离心管中,加入5mL饱和氯化钠溶液和1ml盐酸溶液(1:1),用旋涡混合器混合1分钟,准确加入10mL乙腈,用旋涡混合器混合3分钟,3000转离心15分钟,取上清液经0.45μm过滤器过滤后供液相色谱测定。 按相应的色谱条件对样液进行分析,采用外标法,以保留时间定性,以峰面积定量,测定样液中脱氢乙酸的浓度(mg/ml)。 得到结果以下结果:一、根据扫描的结果,脱氢乙酸的最大吸收波长在230 nm和297 nm处,230 nm处吸收较强,但基体干扰较多,在波长297NM处基体干扰较少,故选取检测波长297NM。 二、动相为乙腈+水时,脱氢乙酸峰形拖尾,使用0.02 mol / L的乙酸铵代替水作流动相,峰形得到较大的改善。乙腈的比例影响出峰的时间和响应,乙腈的比例低,保留时间长,响应也会低,乙腈比例高时,出峰时间短,响应也较高。试验表明,当0.02 mol / L的乙酸铵―乙腈比例为85:15时效果较好。 三、脱氢乙酸难溶于水,易溶于苯、氯仿、乙醚。脱氢乙酸钠则易溶于水,选用水或氢氧化钠溶液、碳酸钠溶液提取,提取液须净化后方可使用。本方法选用乙腈作提取液,主要考虑到脱氢乙酸能溶液于乙腈,乙腈的水溶性有利于乙腈从酸性的样液中把脱氢乙酸完全溶解,同时乙腈可沉淀蛋白质,与脂肪不溶,离心分离得到干净的提取液。 四、在相应的色谱条件下测定,脱氢乙酸的保留时间为5.775min,峰形及组分分离效果好。 五、以70%乙腈水溶液为溶剂配制浓度0.01~0.1范围内的脱氢乙酸标准使用液。以峰面积对脱氢乙酸浓度进行回归分析得回归方程式Y=2.39X×108� 1.33×105,R=0.9997,线性良好。在对同一浓度标样连续进样5次,得到脱氢乙酸的峰面积和保留时间的RSD值分别为0.35%和0.24,方法的定性和定量准确度较高。 本文采用乙腈提取食品中脱氢乙酸,注入高效液相色谱进行测定,以保留时间定性,采用外标法定量。本方法的线性方程有良好的相关性,R=0.9997。方法加标回收率为96.2%~99.6%,变异系数RSD值为1.09%。该方法操作简便、准确,回收率高,精密度良好,重现性好,可用于优化食品中脱氢乙酸的测定。
目前我有一个体系中含有甲醇,乙酸,乙酸甲酯,以及少量的硫酸,我想问怎么才能够准确的知道甲醇,乙酸,乙酸甲酯的量,另外气相在进样过程中如何避免甲醇和乙酸之间的反应