[align=left][/align][align=left][/align][align=center][/align][align=center][font='黑体'][size=29px]食品添加剂 L[/size][/font][font='黑体'][size=29px]-[/size][/font][font='黑体'][size=29px]丙氨酸[/size][/font][/align][align=center][font='宋体'][size=18px]吴勇[/size][/font][/align][align=center][font='宋体'][size=18px]二〇二一年七月二十二日[/size][/font][/align]1. 概述L-丙氨酸通常指L-α-氨基丙酸,在营养学上属于非必需氨基酸,同时在人体血液氨基酸中含量最高,在食品、医药、化工等领域得到广泛应用。L-丙氨酸作为食品添加剂时属于增味剂或营养强化剂。2. 理化性质性状为白色结晶或结晶性粉末,属斜方晶系。可溶于水和乙醇,不溶于乙醚和丙酮,无臭无毒。密度为1.432gcm[font='等线'][size=13px]-3[/size][/font],熔点为314.5℃,相对分子质量为89.09。3. 制备方法L-丙氨酸的制备方法经历了蛋白水解提取法、发酵法和酶法的发展过程。其中蛋白水解提取法的成本较高,已不适合工业化生产。目前工业化生产的主要方法是酶法转化,即利用携带具有生物活性的L-天冬氨酸-β脱羧酶的微生物,通过生物催化的方式将L-天冬氨酸转化为L-丙氨酸。酶法转化通常可分为两类:固定化细胞法和游离细胞法。生产L-丙氨酸的菌种包括德阿昆哈假单孢菌、黄色短杆菌、产气荚膜梭菌、脱硫脱硫孤菌、小球诺卡氏菌等。[font='等线'][size=13px][1][/size][/font]3.1 固定化细胞法固定化细胞法生产L-丙氨酸的基本工艺流程为:菌体培养加入L-天冬氨酸进行酶转化抽滤L-丙氨酸粗品母液稀释脱色过滤真空浓缩干燥。[font='等线'][size=13px][2][/size][/font]可使用卡拉胶进行固定化,通过固定化德阿昆哈假单孢菌和固定化大肠杆菌装柱串联,可达到从富马酸铵经过转化为L-天冬氨酸的过程转化为L-丙氨酸,从而实现连续化生产。其中,大肠杆菌可实现富马酸到L-天冬氨酸的转化过程,德阿昆哈假单孢菌可实现L-天冬氨酸到L-丙氨酸的转化过程。此方法的关键在于防止固定化过程可能带来的酶失活和pH变化带来的酶失活,以及防止丙氨酸消旋酶对L-丙氨酸的外消旋化。3.2 游离细胞法游离细胞法生产L-丙氨酸的基本工艺流程为:菌体培养离心固定化加入L-天冬氨酸进行酶转化脱色、浓缩、结晶干燥。[font='等线'][size=13px][2][/size][/font]此方法的关键在于抑制丙氨酸消旋酶的活性,同时提高酶的活性和稳定性。4. 应用[font='等线'][size=13px][1][/size][/font]4.1 L-丙氨酸在食品工业的使用L-丙氨酸作为一种广泛存在于食品中的氨基酸,可用作食品的添加剂。4.1.1 防腐剂L-丙氨酸与二元羧酸(如乙酸钠、富马酸)、氧化性酸的混合物可用作保存面条的防腐剂,并且能在防腐的同时保持面条的鲜度。L-丙氨酸与辣椒油、山梨酸钾的混合物能够有效抑制酵母菌、大肠杆菌、黑曲霉等细菌的滋生,可适用于水产品、面条、腌制品、海产品、豆制品、畜产品以及饲料、化妆品、药品的保鲜。4.1.2 风味调味料[font='等线'][size=13px][3][/size][/font]L-丙氨酸具有改善风味的效果,属于重要的氨基酸类调味剂,能够与其它氨基酸配合使用加强食品与饮料的风味。L-丙氨酸与其它氨基酸和(如葡萄糖、阿拉伯糖、甘露糖、果糖、蔗糖、麦芽糖等)以任意比例混合后可显著改善食品、饲料的风味。目前,L-丙氨酸作为食品增味剂的应用已经有了比较大的发展,但仍需要进一步的开发。4.1.2.1 酱油酱油中L-谷氨酸钠等增味剂的添加量较大以及酱油的咸度太高等问题都限制了酱油的使用市场,如何减少味精等添加剂的用量以及降低酱油的咸味已经逐渐成为人们关注的焦点。在酱油中添加L-丙氨酸后,尤其是对于苦涩味特别严重的三级酱油,随着丙氨酸浓度的增大,酸味、苦味、涩味变得柔和,酱油整体风味得到改善。适量L-丙氨酸的添加对已加工酱油和原油都具有良好的改善风味作用,可使酱油咸度降低,甜度提升,味道持久性增加,整体口感变得柔和。适量L-丙氨酸的添加对已加工酱油和原油都具有良好的改善风味作用,可使酱油咸度降低,甜度提升,味道持久性增加,整体口感变得柔和,尤其是对盐度高、不含L-谷氨酸钠、I+G和酵母抽提物等添加剂的酱油原油的调味效果最为明显。4.1.2.2 鱼露在国外的鱼露的生产中,一般通过添加HVP(植物蛋白水解液,hydrolyzed vegetable protein)补充氨基酸,提高鱼露的鲜味,HVP中含有一种名为3-氯-1, 2-丙二醇(3-MCPD)的物质,这种物质对生殖器官、肾脏和神经均有毒性,同时还存在潜在的致癌和致突变作用,长期食用含有3-MCPD的食品会造成严重身体损伤。针对3-MCPD的安全性和出口限量标准等问题,一些酱油、鱼露生产商对其生产工艺进行了改善,将传统工艺中的HVP替换为丙氨酸、谷氨酸、甘氨酸等的混合溶液,所得鱼露的味道更加醇厚,而且改善后的生产工艺成本与改善前相差不大。4.1.2.3 食用盐国外推出的低钠盐,主要成分为60%~70%氯化钠和20%~30%氯化钾,10%左右的L-丙氨酸、酵母提取物以及I+G,可以实现减盐不减咸,帮助人体钠钾平衡,增加鲜味,尤其是可以减少味精的使用量,对预防及降低高血压均起到了积极的作用。4.1.2.4 鸡精为了提升鸡精的风味,除了增加鸡肉粉的添加量以外,一些生产厂家优选在其鸡精配方中添加丙氨酸,利用丙氨酸的鲜味以及诱发食物风味的作用来 提升鸡精调味料的口感,既起到了协调增鲜的作用,又降低了人体钠的摄入量。鸡精中添加L-丙氨酸后,其鸡肉风味更加醇厚,鲜味增强。4.1.2.5 复配甜味剂许多甜味剂单体都有各自的优点和缺陷,无论哪种甜味剂单体,用量过大时都会产生不良风味和后味,均不能同时满足安全、口感、工艺、成本四项要求。只有对单体甜味剂各自的优点进行利用和发挥,对其缺点进行弥补和改造,用科学合理的方法对多种甜味剂进行复配和改造,才能满足使用要求。在复配甜味剂中加入1%~10%的L-丙氨酸,能提高甜度、柔和甜 味,减少糖精钠等人工合成甜味剂的用量,是制作糖尿病人食品的潜在甜味剂,同时也能满足现代人“低糖”的饮食习惯。4.2 L-丙氨酸在医药上的应用L-丙氨酸作为一种蛋白质的合成原料,能够影响人体的生理活动。40年代起出现第一代氨基酸输液,由水解蛋白制成,含有较多杂质,在临床中出现不良反应;1965年日本出现第二代氨基酸输液,其中含有11种氨基酸,除人体必需氨基酸8种外还存在精氨酸、组氨酸和甘氨酸;1976年开始,多国出现第三代氨基酸输液,在第二代氨基酸输液的基础上加入了L-丙氨酸、脯氨酸和丝氨酸等多种非必需氨基酸。随着临床医学的发展,第四代氨基酸输液不再是营养型输液,而是治疗型输液,通过调整人体的氨基酸代谢水平对部分疾病进行治疗。L-丙氨酸在治疗如肝病引起的蛋白质合成紊乱、糖尿病、急慢性肾功能衰竭以及对维持危急病人的营养、抢救患者的生命方面起到了积极作用。L-丙氨酸可以有效减轻酒精对肝脏的损害。L-丙氨酸可以有效地减轻酒精对肝脏的损害。通过对腹腔注射170mmol/kg体重19%的乙醇的小鼠进行试验表明,投服L-丙氨酸的小鼠的生存率为67%,比不投的高出34%;而L-丙氨酸与鸟氨酸相结合, 则生存率提高到100%。所以可将L-丙氨酸与L-鸟氨酸的混合物按0.01%~10%添加量加到食品中,也可以将L-丙氨酸与谷氨酰胺以 1:0.05~0. 5(摩尔比)混合物制成片剂、胶囊、乳剂、口服液等,能够起到保护肝脏、降低酒精中毒的作用。L-丙氨酸还是血液保存剂的主要成分。目前输血用血液保存方法中除了全血保存外,还有红血球制剂保存。但血液制剂在保存过程中会发生老化,因而保存期有限。为了提高保存期 ,防止老化,采用了添加腺嘌呤、肌苷、蔗糖、乳糖等方法。但这类方法都有缺点,这些添加成分在输血前必须予以除去。例如,在添加蔗糖时,直接将含有蔗糖的血液注射到人体中时,血液中的糖浓度会急剧上升,必须在输液前预先用等渗透压生理盐水洗涤、渗透等方法降低糖浓度后才能输血。而氨基酸既可以降低渗透压又显示与蔗糖相同的抗溶血性,在输血时可 以不必除去,能直接使用,还具有优良的营养效果。5. 限量标准现行标准[font='等线'][size=13px][4][/size][/font]中对L-丙氨酸的功能划分为增味剂,仅用于调味品(食品分类号12.0)生产,对于最大使用量无明确界定,按生产需要适量使用。6. 理化指标及测定方法[font='等线'][size=13px][5][/size][/font]6.1 理化指标现行标准[font='等线'][size=13px][5][/size][/font]中L-丙氨酸的理化指标列于下表。[table][tr][td]项目[/td][td][/td][td]指标[/td][/tr][tr][td]L-丙氨酸(以干基计),w/%[/td][td][/td][td]98.5~101.5[/td][/tr][tr][td]干燥减量,w/%[/td][td]≤[/td][td]0.20[/td][/tr][tr][td]pH(50g/L 水溶液)[/td][td][/td][td]5.7~6.7[/td][/tr][tr][td]砷(As)/(mg/kg)[/td][td]≤[/td][td]1[/td][/tr][tr][td]重金属(以Pb计)/(mg/kg)[/td][td]≤[/td][td]10[/td][/tr][tr][td]灼烧残渣,w/%[/td][td]≤[/td][td]0.20[/td][/tr][tr][td]比旋光度 α[font='等线'][size=13px]m[/size][/font](20℃,D)/[(o)dm2 kg[font='等线'][size=13px]-1[/size][/font]][/td][td][/td][td]+13.5~+15.5[/td][/tr][/table]6.2 测定方法6.2.1 鉴别实验6.2.1.1 茚满三酮试验称取约1g样品,精确至0.1g,溶于1000mL水中,取此溶液5mL,加1mL 20g/L茚满三酮溶液,加热至沸,约3min后显紫色。6.2.1.2 氧化试验称取约0.2g实验室样品,溶于10mL (1+30) 硫酸溶液,加入0.1g高锰酸钾,煮沸,有强烈的刺激臭味乙醛产生。6.2.2 L-丙氨酸含量测定称取约0.2g干燥样品,精确至0.0001g,置于250mL干燥的锥形瓶中,加3mL无水甲酸溶解,加50mL冰乙酸,加2滴2g/L结晶紫指示液,用0.1 mol/L高氯酸标准滴定溶液滴定至溶液由蓝色变成蓝绿色为终点。按照相同的步骤,除不加入样品外其它条件不变,进行空白实验。L-丙氨酸的质量分数可通过以下公式计算:式中:w[font='等线'][size=13px]1[/size][/font]表示L-丙氨酸的质量分数,以百分比形式表示;V[font='等线'][size=13px]1[/size][/font]表示样品消耗高氯酸标准滴定溶液的体积(mL);V[font='等线'][size=13px]2[/size][/font]表示空白消耗高氯酸标准滴定溶液的体积(mL);c表示高氯酸标准滴定溶液浓度(molL[font='等线'][size=13px]-1[/size][/font]);m表示样品质量(g);M表示L-丙氨酸的摩尔质量(gmol[font='等线'][size=13px]-1[/size][/font]),M=89.09。6.2.3 干燥减量的测定将电热恒温干燥箱调节至(105±2)℃,之后将称量瓶置于电热恒温干燥箱中干燥,取出后在干燥器中冷却,称量,精确至0.0001g,重复操作至恒重。之后用已恒重的称量瓶称取1g~2g样品,精确至0.0001g。将装有样品的称量瓶和盖子放入电热恒温干燥箱同时干燥2h~4h,之后将称量瓶和盖子迅速移至干燥器中冷却。冷却后盖上盖子进行称量,精确至0.0001g,重复操作至恒重,重复干燥时间为1h。水分质量分数可通过以下公式计算:式中:w[font='等线'][size=13px]2[/size][/font]表示水分的质量分数,以百分比形式表示;m[font='等线'][size=13px]0[/size][/font]表示称量瓶的质量(g);m[font='等线'][size=13px]1[/size][/font]表示称量瓶和干燥前样品质量(g);m[font='等线'][size=13px]2[/size][/font]表示称量瓶和干燥后样品质量(g)。[font='等线'][size=13px][6][/size][/font]6.2.4 pH的测定称取约5g样品,精确至0.01g,加入约20mL无二氧化碳的水溶解并稀释至100mL。将校准后的酸度计的电极用水冲洗一次,之后用样品溶液冲洗一次。调节样品溶液的温度至(25±1)℃,并将酸度计的温度补偿旋钮调至25℃,读取pH值。样品应分为2份进行平行测定,测得的pH值读数稳定1min以上,测得的pH值允许误差绝对值小于等于0.02。[font='等线'][size=13px][7][/size][/font]6.2.5 砷的测定称取0.25g二乙氨基二硫代甲酸银,研碎后用适量三氯甲烷溶解,加入1.0mL三乙醇胺,再用三氯甲烷稀释至100mL,作为吸收液。称取约1g样品,精确至0.01g。吸取一定量的样品溶液和1mL含砷0.001mg的砷标准使用溶液,置于砷发生瓶中,补加硫酸至总量为5mL,加水至50mL。在各瓶中加入3mL 150g/L碘化钾溶液,混匀,放置5min。分别加入1mL 400g/L氯化亚锡溶液,混匀,放置15min。加入5g无砷金属锌,立即塞上装有乙酸铅棉花的导气管,并使管的尖端插入盛有5.0mL吸收液的吸收管中,室温反应1h。取下吸收管,用三氯甲烷将吸收液体积定容至5.0mL。经目视比色或用1cm比色杯,于515nm波长下测定吸收液的吸光度。样品液的色度或吸光度不得超过砷标准吸收液的色度或吸光度。[font='等线'][size=13px][9][/size][/font]6.2.6 重金属的测定准备以下溶液:1. 硫代乙酰胺溶液:称取硫代乙酰胺约4g,精确至0.1g,溶于100mL水中,置于冰箱保存。临用前取此液1.0mL加入预先由15mL 40g/L氢氧化钠溶液、5mL水和20mL甘油组成的混合液5mL,置于水浴上加热20s,冷却后立即使用。2. 乙酸铵缓冲溶液(pH=3.5):称取25.0g乙酸铵,溶于25mL水中,加入45mL 6mol/L盐酸,用稀盐酸或稀氨水调节至pH=3.5,之后用水稀释至100mL。3. 1μg/mL铅标准溶液。临用前配制。称取约10 g样品,精确至0.01g,溶于约60mL无二氧化碳水,之后转移至100mL容量瓶并使用无二氧化碳水定容,摇匀。吸取样品溶液12mL,置于25mL具塞比色管中,即为A 管。吸取10mL铅标准溶液和2mL样品溶液置于25mL具塞比色管中,摇匀,即为B管(标准)。吸取10mL无二氧化碳水和2mL样品溶液置25mL具塞比色管中,摇匀,即为C管(空白)。在 A、B、C 管中,各加入2mL乙酸铵缓冲溶液,摇匀,分别滴加1.2mL硫代乙酰铵溶液,迅速搅拌混合。相对于C管,B管显现了淡棕色。2min后,A管的颜色不应深于B管。6.2.7 灼烧残渣的测定称取约2g~3g样品,精确至0.0001g,置于在800℃±25℃灼烧至恒重的瓷坩埚中,加入适量的(1+8)硫酸溶液将样品完全浸湿,用温火加热,至样品完全炭化,冷却。加入约0.5mL硫酸将残渣完全浸湿,使用相同的方法加热直至硫酸蒸气全部逸散。在(800±25)℃下灼烧45min,之后放入干燥器中冷却至室温,称量残渣的质量。灼烧残渣的质量分数可通过以下公式计算:式中:w3表示灼烧残渣的质量分数,以百分比形式表示;m表示样品质量(g);m1表示残渣质量(g)。6.2.8 比旋光度称取10g样品,精确至0.0001g,加入(1+1)盐酸溶液溶解,转移至100mL容量瓶并使用(1+1)盐酸溶液定容,摇匀。按照仪器的使用说明调整旋光仪,用(1+1)盐酸溶液校正零点。将样品溶液充满洁净、干燥的旋光管,排出气泡,将盖旋紧后放入旋光仪内。调节样品溶液的温度至(20±0.5)℃,按照仪器的使用说明操作并读取旋光角,精确至0.01°。比旋光度可通过以下公式计算:式中:α[font='等线'][size=13px]m[/size][/font](20℃, D)表示20℃钠灯照射下的比旋光度[(°)dm[font='等线'][size=13px]2[/size][/font]kg[font='等线'][size=13px]-1[/size][/font]];α表示旋光角(°);l表示旋光管长度(dm);ρ[font='等线'][size=13px]α[/size][/font]表示溶液中L-丙氨酸的质量浓度(g/mL)。[font='等线'][size=13px][8][/size][/font]参考文献[1] L-丙氨酸的生产及应用. 王雪根, 朱建良, 欧阳平凯. 南京化工大学学报(自然科学版). 1998, 20, 01.[2] 游离细胞法与固定化细胞法生产L-丙氨酸的比较. 徐虹, 王雪根, 范伟平, 欧阳平凯. 工业微生物. 1988, 28, 38-39.[3][font='宋体'][size=24px][color=#333333] [/color][/size][/font]L-丙氨酸在食品工业中的应用潜力. 郭媛, 王丽娟等. 中国调味品[font='宋体'][size=12px][color=#666666]. [/color][/size][/font]2017, 42, 07.[4] GB 2760 - 2014[5] GB 25543 - 2010[6] GB/T 6284 - 2006[7] GB/T 9274 – 2007[8] GB/T 613[9] GB 5009.76 - 2014
[color=#444444]我的水质中包含氨氮,乙酸,丙酸以及丙氨酸。[/color][color=#444444]我查看文献,先考虑的是直接检测的方法。但是我无论改变流动相比例还是改变pH值都是不到2分钟就出峰了,那我看标品的线性还行就勉强用了,但是在后来发现根本不行,无论水中丙氨酸有多少,因为乙酸,丙酸的存在,峰面积都不怎么变,后来我又查看文献发现乙酸丙酸的液相检测方法很类似。[/color][color=#444444]那我考虑衍生化呗,但是好像氨氮的存在会对各种衍生产生影响。求教各位大神,我该用什么方法检测该水中的丙氨酸啊[/color]
各位,你们好。我想求教一下我这种情况,该怎么检测丙氨酸我的水质中包含氨氮,乙酸,丙酸以及丙氨酸。我查看文献,先考虑的是直接检测的方法。但是我无论改变流动相比例还是改变pH值都是不到2分钟就出峰了,那我看标品的线性还行就勉强用了,但是在后来发现根本不行,无论水中丙氨酸有多少,因为乙酸,丙酸的存在,峰面积都不怎么变,后来我又查看文献发现乙酸丙酸的液相检测方法很类似。那我考虑衍生化呗,但是好像氨氮的存在会对各种衍生产生影响。我也是第一次接触色谱,求教各位大神,我该怎么做啊
丙谷二肽杂质对照品名称 环-(L-丙氨酰-L-谷氨酰胺) 规格:0.25gL-焦谷氨酰-L-丙氨酸 规格1g"N-(2)-D-丙氨酰-L-谷氨酰胺" 规格:0.25gL-丙氨酰-L-谷氨酸 规格:1gL-焦谷氨酸 规格:125mg
请问有做过丙氨酸薄层色谱检测限的吗,浓度多少
请教苯丙氨酸和苯丙胺醇的液相分析条件?有作过类似分析的吗?我用C18柱,未找到合适的方法,请有经验的同行不吝赐教。谢谢![em01]
a-丙氨酸能溶于水丙氨酸甲酯可溶于水么?谢谢
要做一个苯丙氨酸样品GC含量测定,对方提供方法DB-WAX柱190度恒温,FID:250度,没提供用什么试剂溶解,我查了一下苯丙氨酸物理性质溶于热水,不溶于乙醇甲醇乙醚,溶于甲酸,在烯酸或氢氧化钠试剂中易溶,但是DB-WAX不适合进水样啊,请问高手该怎么处理样品呢?可以用甲酸溶解进DB-WAX柱吗?
我现在需要测定苯丙氨酸,一直没找到合适的液相条件,出来的图谱总是拖尾,响应值也不高,而且在高浓度的时候峰形很凸,哪位高手做过这种物质吗?麻烦您不吝赐教哦,谢谢
硅烷化衍生化植物材料,衍生化之前加入了内标l-2氯苯丙氨酸,想知道内标衍生化后的产物是什么?
[color=#444444]在利用液相色谱分析检测氨基甲酸乙酯的时候,总是有丙氨酸的干扰,而且两者的出峰时间较为接近,丙氨酸很容易将后面出来的氨基甲酸乙酯的峰重叠掉,试了很多方法都没办法改变,请求各位支招,万分感谢![/color]
本人正在做氨基酸的同位素示踪分析,想求助苯丙氨酸和缬氨酸标准质谱图,分析其是怎么断裂的。本人用的是三重四级杆液质做的二级扫描,得到好多准分子离子但是想和谱库对比一下。谢谢谢谢
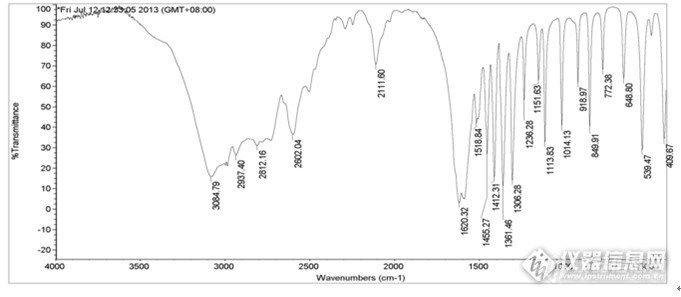
麻烦各位帮忙分析分析,丙氨酸红外图谱,特征峰http://ng1.17img.cn/bbsfiles/images/2013/10/201310121041_470541_2792812_3.jpg
[color=#444444]检测一种代谢物β-氰基丙氨酸,使用Agilent XDB C-18 2.1X50mm 液相色谱柱分离,流速0.2ml/min,出峰在0.8min左右。老板说让保留时间尽量长,否则就失去了色谱柱分离的意义。请问β-氰基丙氨酸此化合物的极性如何?如何在不换柱子的前提下延长保留时间?[/color]
菜鸟请教。有没有同行用液相做过丙氨酸的纯度分析;仪器是怎样的配置?谢谢!
我都郁闷了 要测定苯丙氨酸,看文献上说用紫外检测器测190nm出有最大吸收,可是紫外的范围就是190-790nm,老板说这个波长不行,要重新找一个,找来找去都找不到合适的,哎,有谁测定过吗?用的流动相是什么呢?请高手指点,谢谢!
各位大哥大姐,请问大家有没有苯丙氨酸甲酯盐酸盐的手性分离条件?
我目前只知道药典上有苯丙氨酸的资料,请各位帮忙有没有其他级别和相关的标准如国标或食品级。[em0801]
最近用D-丙氨酸作为原料做合成,但是丙氨酸几乎无紫外吸收基团,看了几个衍生化方式,都极为复杂,有没有简单的方式检测的?我们有[url=https://insevent.instrument.com.cn/t/Mp]气相[/url],但是其沸点也无明显说明,只能了解大概在212±30℃,且其水溶性极强,不溶于有机相,目前在用的只有一根极性柱,100%聚乙二醇填料的,基本无法使用。能否有更合适的方式检测监控?
最近在测定L-丙氨酸中D-丙氨酸的含量时,为什么有时候测定的图谱中在2.15min左右全部样品都出现一个峰,当隔了几个小时再去测得时候,条件全部相同并且还是上次测得那几个样品(没有动)。在2.15min左右就全部都没有峰了。为什么????????
做代谢组学实验的时候需要配置2-氯苯丙氨酸内标,请问 用什么溶剂来配呢?配成[font='Arial Unicode MS',sans-serif]2.7 mg/mL的浓度[/font]
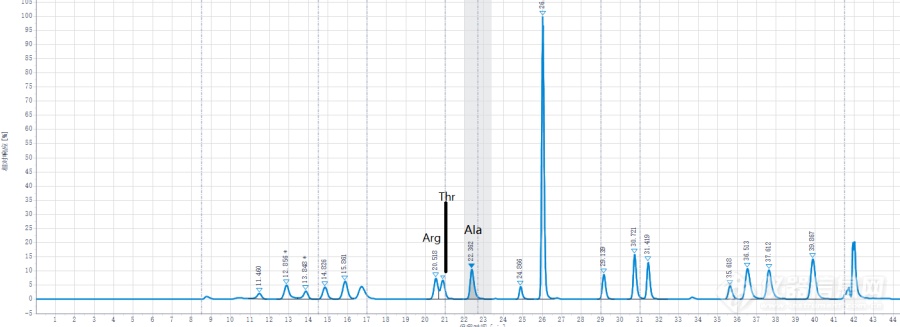
仪器:安捷伦1260ⅱ方法:AccQTag法流动相:A:Waters AccQTag A浓液1: 10(V/V)稀释;B:60%乙腈;C:屈臣氏纯净水;D:纯乙腈问题:标样里丙氨酸(Ala)峰面积与浓度不成比例,峰和数据如图。国庆节之前一直都很正常,放个假回来再测就变成这样了,样品的峰也改变了,这样情况下算出来的丙氨酸含量甚至出现了负值。请问有老师碰见过这种情况吗?或者有什么解决的思路吗?感谢![img=,690,250]https://ng1.17img.cn/bbsfiles/images/2021/11/202111011944358938_1636_5346829_3.png!w690x250.jpg[/img][img=,690,98]https://ng1.17img.cn/bbsfiles/images/2021/11/202111011944428389_3521_5346829_3.png!w690x98.jpg[/img][img=,690,423]https://ng1.17img.cn/bbsfiles/images/2021/11/202111011944477378_1801_5346829_3.png!w690x423.jpg[/img]除了Ala以外,与它相邻的前面两个氨基酸Arg和Thr的峰形也有变化,分离度不如以前了。下图是之前正常时的峰形。[img=,690,262]https://ng1.17img.cn/bbsfiles/images/2021/11/202111011946324377_3818_5346829_3.png!w690x262.jpg[/img](第一张图的峰的保留时间相较正常时有漂移是因为仪器漏液的原因,现已解决,但Ala的问题仍存在。)
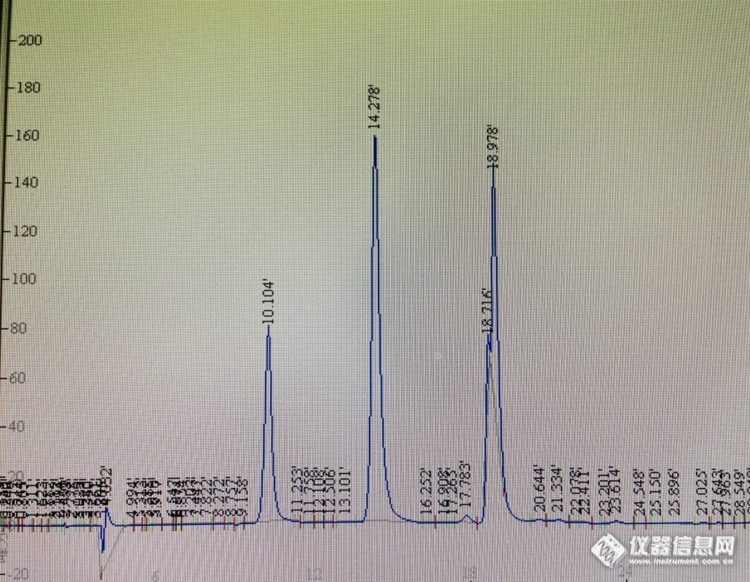
柱子是迪马钻石 C18 5um 250*4.6mm 柱体积4.2ml 流动相和对照品的制备全部按照药典规定进行:以乙腈-0.1mol/L醋酸钠溶液(用醋酸调节pH值至6.5)(7:93)为流动相A,以乙腈-水(4:1)为流动相B,按下表中的规定进行梯度洗脱;检测波长为254nm;柱温为43℃。理论板数按L-羟脯氨酸峰计算应不低于4000。时间(分钟)流动相A(%)流动相B(%)0~1111~13.913.9~1414~2929~30100→9393→8888→8585→6666→00→77→1212→1515→3434→100对照品溶液的制备取L-羟脯氨酸对照品、甘氨酸对照品、丙氨酸对照品、L-脯氨酸对照品适量,精密称定,加0.1mol/L盐酸溶液制成每1ml分别含L-羟脯氨酸80μg、甘氨酸0.16mg、丙氨酸70μg、L-脯氨酸0.12mg的混合溶液,即得精密量取上述对照品溶液和供试品溶液各5ml,分别置25ml量瓶中,各加0.1mol/L异硫氰酸苯酯(PITC)的乙腈溶液2.5ml,1mol/L三乙胺的乙腈溶液2.5ml,摇匀,室温放置1小时后,加50%乙腈至刻度。摇匀。取10ml,加正己烷10ml,振摇,放置10分钟,取下层溶液,滤过,取续滤液,即得。[
谷氨酸发酵液除菌体提取谷氨酸研究进展作者:佚名 文章来源:本站原创点击数: 222 更新时间:2010-4-14 13:19:04 file:///C:/Users/%E9%83%AD%E9%9B%B7/AppData/Local/Temp/msohtml1/01/clip_image001.gif我国味精生产,从发酵液中提取谷氨酸大多采用带菌体冷冻等电加离交法,由于发酵液中存在大量的菌体蛋白、悬浮物及其它杂质,给谷氨酸提取操作、提取收率、谷氨酸质量带来显著影响,且废水含高C0D、高B0D等严重污染环境的物质,又给废水治理带来重重困难。 近几年来,国内一些味精生产企业、研究所,对谷氨酸发酵液除菌体及提取谷氨酸进行了大量研究,除菌体工艺有高速离心机分离,絮凝剂分离、膜分离等,都取得了明显成果。按除菌体不同工艺、除菌体率分别达到70%~96%,以膜分离法除菌率最高达95%以上,得到的发酵液澄清,0D低,谷氨酸提取操作方便,由于除去了影响谷氨酸结晶的大量杂质,因而谷氨酸结晶颗粒大,纯度高、质量好,易于沉降分离,提取收率明显提高。高纯度谷氨酸有利于味精精制,味精中和脱色过滤可降低活性碳或树脂用量,提高味精结晶质量,大大降低味精生产成本。除菌体后的发酵液及等电提取后的废液中C0D、BOD大大减少,减轻了环境污染,降低了废水治理负荷与难度。得到的菌体经干燥后可以综合利用,作高蛋白质饲料或作核苷酸的生产原料。 谷氨酸发酵液除菌体及多种新工艺提取谷氨酸的研究,是对我国味精工业清洁生产的有益探索。随着研究的不断深化,许多先进工艺技术将会被应用,味精生产终将进入一个新水平。 1 高速离心分离除菌体,浓缩等电提取 沈阳味精厂从瑞典引进4台ALFA—LAVA公司的FESX5l2S一3lC型蝶片式高速喷咀离心机,转速4650I1) 分,功率45kw,对玉米淀糖为碳源,尿素作氨源、玉米浆为生物素的T一6l3菌发酵液进行了工业性除菌体,进料量20m ,喷咀直径1.0mm,菌体分离率达70%以上,轻流占75% ,重流占25%左右,除菌体后发酵液中谷氨酸略增,还原糖下降,0D值明显降低,工业规模运转证明,该设备对分离谷氨酸发酵液性能可靠,比较适宜。 发酵液除菌体后采用浓缩等电点提取法。 除菌体后的发酵液,经减压蒸发到含谷氨酸12%~15% ,后与重液经水解浓缩制成的二次蒸发液进行等电中和(60℃、40l1)m搅拌),然后冷却、沉淀、离心分离,提取达83.14%~85.03%,比带菌体浓缩等电点提取收率77.24%显著增加。且谷氨酸含量高达96%(干),用于制造味精时脱色液过滤快,透光率高,味精质量好。 2 凝聚剂除菌体一次等电或浓缩等电提取 使用安全性高的壳聚糖作絮凝剂,其阳离子性能与发酵液中菌体(带负电荷)与蛋白凝聚使其沉淀而进行分离。壳聚糖对金属离子、蛋白质、氨基酸、核酸均有很强的吸附能力,特别对胶体微粒有甚大的絮凝作用,其官能基团主要是氨基。在最佳pH、搅拌速度、用量、温度条件下,菌体去除率可达9O%左右。 壳聚糖不易溶于水,而溶解于酸性溶液中。配成一定浓度后,于发酵液中慢慢加人,搅拌速度也以慢为好。过快易将凝絮物打碎,难过滤。菌体凝聚沉降后,抽取上清液,沉降物可加硅藻土或珍珠岩作助滤剂,尤以硅藻土作助滤剂好,不吸附谷氨酸。中试规模过滤可用板框压滤,小试规模实验室中,采用高速离心机分离。应用国产高速离心机分离除菌体凝絮物(包括菌体)至今未见报导,这也是用凝絮法除菌体不能很快推广的一个较大问题。凝聚法去除菌体后的谷氨酸发酵液的提取方法有: 2.1一次等电点法 谷氨酸发酵液经絮凝处理后,采用一次等电点法,(即用酸逐步调到pH3-2法)提取收率可达76.18% ,比对照收率71.3%提高6.2% ,谷氨酸结晶的透光率52.25% ,比对照l1.25%提高了4倍;谷氨酸提取后的母液,可减少谷氨酸0.06%~0.11%。这是提高谷氨酸收率的一个重要原因,即去除了干扰谷氨酸结晶因素。 2.2 浓缩等电点法 将除菌体经过滤的发酵液,真空浓缩一倍,用加热快速调pH的方法,一次性直接调到pH3.2。搅拌到常温,再搅拌2h~3h时,沉淀3h,离心分离谷氨酸,谷氨酸一次收率平均可达85%左右,纯度可达95%左右,且调节pH的酸用量比普通谷氨酸等电点法用量要少。 2.3 先等电提取后浓缩再提取法 谷氨酸发酵液除菌体后,先用一次等电点法(常温或冷冻)提取出谷氨酸的60%~75%,残母液中含1.2%~1.5%左右的残谷氨酸,再加以浓缩(通过多效蒸发器)3倍,再提出剩余谷氨酸,总收率可达85%以上。母液浓缩成浆状可作肥料,再根据当地的土质情况,适当添加磷、钾等肥效成分。这条工艺路线是既提高了谷氨酸的提取收率,又产生综合效益。从发酵液分离出
最近在做一个课题,夏天测谷氨酸的标线还是好好的,这俩天就不行了,我想问下谷氨酸的液相测定方法是如何测定的,我用的流动相是磷酸水溶液,因为谷氨酸是微溶于水的,所以配的浓度最高是25 mmoL/L,想问下大神们液相测定谷氨酸和焦谷氨酸的方法~ 谢谢~
【中文名称】胱氨酸;双巯丙氨酸-二硫代双丙氨酸【英文名称】cystine【结构或分子式】 【相对分子量或原子量】240.30【密度】1.677【熔点(℃)】260(分解)【性状】 白色六角形板状晶体或结晶粉末,无味。【溶解情况】 难溶于水,不溶于乙醇、苯、乙醚、氯仿,溶于烯酸和碱。【用途】 供生物化学和营养研究用。医药上,有促进机体细胞氧化和还原机能,增加白血球和阻止病原菌发育作用。主要用于各种脱发症。也用于痢疾、伤寒、流感等急性传染病、气喘、神经痛、湿疹以及各种中毒疾患等。并有维持蛋白质构型作用。 用作含硫氨基酸加到饲料种,可增加禽畜发育,增加体重化肝肾机能,提高毛皮质量,同时可减轻家禽啄癖症。【制备或来源】 广泛存在于毛、发、骨、角中,可由蛋白质(如人发)水解、精制而得,或由半胱氨酸在碱性水溶液中氧化而成。【其他】 有三种异构体:左旋体、右旋体、消旋体。【生产单位】 济南历城生物化工厂;平乐县制药厂;武汉大学九一生化微生物工厂;胶县氨基酸厂等
本人在8月发表的一篇原创中提及”甘氨酸与组氨酸无法分离“的问题,在经过10多天的准备,已有不小的收获,现在分享。摘要 目的: 建立用高效液相色谱法测定人凝血因子VIII中氨基酸含量。方法: 采用6 - 氨基喹啉- N - 羟基琥珀酰亚氨基氨基甲酸酯( AQC) 为衍生剂,与氨基酸柱前衍生后,用Agilent 1200 高效液相色谱仪,AccQ·Tag C18柱( waters 150 mm ×3. 9 mm,4 μm) ,以水Eluent( 醋酸盐- 磷酸盐缓冲液) 稀释液和乙腈进行梯度洗脱,检测波长为248 nm,柱温37 ℃,进样量10μL。结果: 各氨基酸在32 min 内测定完毕,回收率为98.7% ~ 101.5%。RSD 均小于1. 5%。结论: 本法分离度好,快速、简便,可作为产品的质量控制方法。关键词: 6 - 氨基喹啉- N - 羟基琥珀酰亚氨基氨基甲酸酯; 人凝血因子VIII; 甘氨酸; 衍生物; 梯度洗脱; 高效液相色谱法;氨基酸; 含量测定人凝血因子VIII,本品对缺乏人凝血因子礓所致的凝血机能障碍具有纠正作用,主要用于防治甲型血友病和获得性凝血因子Ⅷ缺乏而致的出血症状及这类病人的手术出血治疗。该药物制备过程中使用了氨基酸( 精氨酸、丙氨酸、甘氨酸、组氨酸、盐酸赖氨酸、脯氨酸 等) 做稳定剂,为了保证药品质量和用药安全,应对其中氨基酸的含量进行控制。该法依据过量的6 - 氨基喹啉基- N - 羟基琥珀酰亚氨基氨基甲酸酯( AQC) 在一定条件和氨基酸形成稳定的衍生产物( 柱前衍生) ,用高效液相色谱法测定衍生产物,根据衍生产物的含量计算人凝血因子中各氨基酸的含量。1 仪器和试药1200 高效液相色谱系统( 美国Agilent 公司) ,配置低压四元梯度泵、1314B 紫外吸收检测器、自动进样器、柱温箱、Chemistations 化学工作站; Sartorius CP225D 电子微量天平( 德国Sartorius 公司) ; SartoriusPB - 21 型pH 计( 德国Sartorius 公司) ; LDZ5 -2 低速自动平衡离心机( 上海医用离心机厂) 等。各标准品均来自于中国食品药品检定研究院2 色谱条件及系统适用性试验色谱柱: Waters AccQ·Tag C18色谱柱( 3. 9 mm ×150 mm) ; 流动相: 水为溶剂D,Eluent( 醋酸盐- 磷酸盐缓冲液) 稀释液( A) - 乙腈( B) - 水( D) ,柱温:37 ℃; 检测波长: 248 nm。精密量取对照品溶液与供试品溶液10 μL,分别注入液相色谱仪,记录色谱图32 min。3 溶液制备3. 1 Eluent( 醋酸盐- 磷酸盐缓冲液) 稀释液称取三水乙酸钠190. 4 g,加注射用水1000 mL,搅拌,溶解,用稀磷酸将pH 调至5. 2,加入乙二胺四乙酸二钠溶液( 称取乙二胺四乙酸二钠100 mg,加注射用水100 mL,摇匀使其溶解) 10 mL,加入叠氮化钠0. 1 g 及三乙胺23. 7 mL( 17. 2 g) ,用稀磷酸滴定至pH 4. 95,用0. 45 μm 的滤膜过滤,于4 ℃储存,备用( 此条件下可保存6 个月) 。量取该溶液100 mL,加注射用水稀释至1000 mL,混匀,即得Eluent( 醋酸盐- 磷酸盐缓冲液) 稀释液。3. 2 对照品储备液混合对照品储备液精密称取各氨基酸对照品适量,置同一100 mL量瓶中,以注射用水溶解并定容至刻度。制成含氨基酸含量均含5. 0 mg·mL - 1 的混合对照品溶液,即得。单个对照品储备液: 精密称取各含氨基酸的各对照品适量,分别置100mL 量瓶中,用注射用水溶解并定容至刻度。制成分别含各氨基酸的单个对照品溶液,即得。3. 3 供试品储备液3. 3. 1 加样回收率试验溶液精密称取各氨基酸各0. 3200,0. 4000,0. 4800 g 和辅料适量,加人凝血因子VIII原液7. 5 mL,肝素钠适量,用1. 0 mol·L - 1 盐酸调pH 至6. 9,加0. 01 mol·L - 1枸橼酸三钠溶液溶解并定容于20 mL。分别制备成16. 0, 20. 0, 24. 0 mg·mL - 1溶液。3. 3. 2 空白溶液 按公司处方,加入辅料的混合物,用注射用水制备各空白溶液3. 4 内标溶液精密称取α - 氨基丁酸( AABA)0. 4 g,加注射用水定容至100 mL。4 氨基酸衍生方法4. 1 精密量取供试品储备液、样品及对照品储备液各1. 0 mL,加1. 5%磺基水杨酸9. 0 mL,混匀静置2 h以上, 3000 r·min - 1离心10 min,留取上清液。4. 2 精密量取“4. 1”项下上清液1. 0 mL( 其中对照品储备液对应上清液分别精密量取0. 06, 0. 4,0. 8,1. 0, 1. 2, 1. 6 mL) ,分别置10 mL 量瓶中,用注射用水定容。制备成供试品溶液、样品溶液及浓度分别为1. 5, 10. 0, 20. 0, 25. 0, 30. 0,40. 0 mg·mL - 1 的对照品溶液。4. 3 精密量取“4. 2”项下溶液各100 μL,分别加注射用水0. 4 mL 及内标溶液20 μL,混匀备用。4. 4 精密量取“4. 3”项下溶液30 μL 放入衍生管中,加硼酸缓冲液( pH 8 ~ 10) 210 μL 涡旋混合,并加入AQC 衍生剂60 μL 涡旋混合15 s,即为各供试品溶液,待用。
[color=#444444]请教各位高手:调味品中的谷氨酸钠的含量检测一般都用甲醛法,现在我的样品是经过高温熬制的,里面的谷氨酸钠很可能变成了焦谷氨酸钠,这样用甲醛法检测的结果是否会受到影响?增高还是降低?[/color]
各位大侠,最近在用超高效液相色谱做焦谷氨酸,目前只有c18反相柱,焦谷氨酸在柱子上很快就跟溶剂差不多出来了,请问在不换柱子的前提下(没有正相柱),有没有在流动相做手脚,我用甲醇-乙酸铵做流动性,也已经调PH值至3.4,可没有多大效果,是否可以加入离子对?请帮忙!
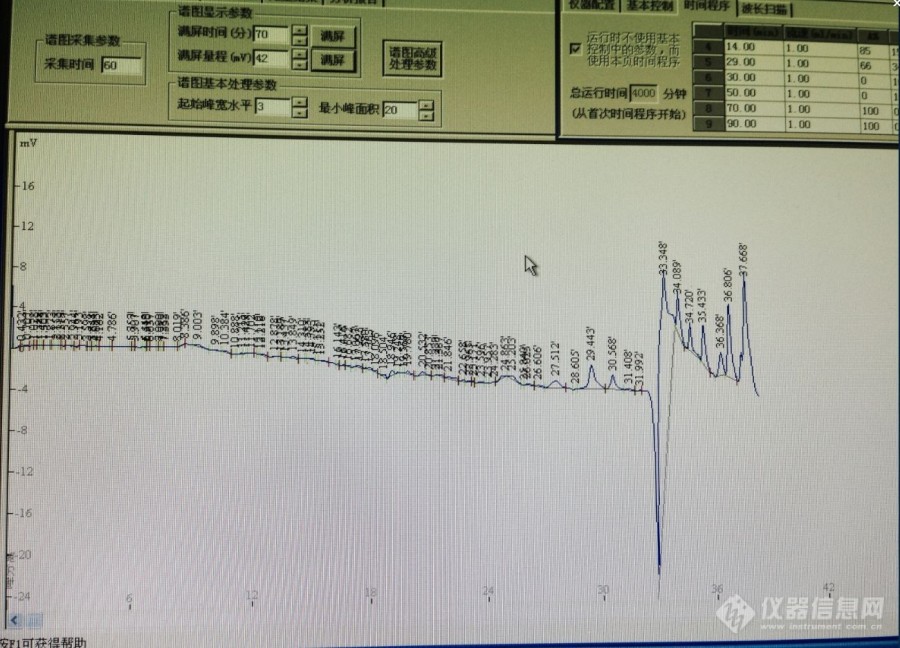
柱子是迪马钻石 C18 5um 250*4.6mm 柱体积4.2ml 流动相和对照品的制备全部按照药典规定进行:以乙腈-0.1mol/L醋酸钠溶液(用醋酸调节pH值至6.5)(7:93)为流动相A,以乙腈-水(4:1)为流动相B,按下表中的规定进行梯度洗脱;检测波长为254nm;柱温为43℃。理论板数按L-羟脯氨酸峰计算应不低于4000。时间(分钟) 流动相A(%) 流动相B(%)0~11 100→93 0→711~13.9 93→88 7→1213.9~14 88→85 12→1514~29 85→66 15→3429~30 66→0 34→100对照品溶液的制备取L-羟脯氨酸对照品、甘氨酸对照品、丙氨酸对照品、L-脯氨酸对照品适量,精密称定,加0.1mol/L盐酸溶液制成每1ml分别含L-羟脯氨酸80μg、甘氨酸0.16mg、丙氨酸70μg、L-脯氨酸0.12mg的混合溶液,即得精密量取上述对照品溶液和供试品溶液各5ml,分别置25ml量瓶中,各加0.1mol/L异硫氰酸苯酯(PITC)的乙腈溶液2.5ml,1mol/L三乙胺的乙腈溶液2.5ml,摇匀,室温放置1小时后,加50%乙腈至刻度。摇匀。取10ml,加正己烷10ml,振摇,放置10分钟,取下层溶液,滤过,取续滤液,即得。出图如下:图1是走空白基线的图图2是进样后出图[img=,690,496]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131110025275_5197_1795523_3.jpg!w690x496.jpg[/img][img=,690,456]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131110071653_2952_1795523_3.jpg!w690x456.jpg[/img]