求助一份过氧化物酶的化验单???
本法反应温和,对抗原、抗体免疫活性影响小,已被广泛应用。缺点是标记率较低,一般为20~40%。 1.原理此法是利用乳过氧化物酶(Lactoperoxidase)有促进微量过氧化氢对125I-的氧化作用,生成125I+,并标记在多肽、蛋白质酪氨酸分子上。 2.方法以标记蛋白质抗原为例。 (1)反应液组成:蛋白质2~5μg溶于磷酸缓冲液10~25μl中,加入Na125i 1m Ci(10μl)、乳过氧化物酶溶液25ng(10μl)、H2O2200ng(10μl); (2)在室温保温7min; (3)加入H2O2200ng(10μl); (4)过7min再加入H2O2(3μl); (5)保温7min后,加入0.5ml、10mmol/L巯基乙醇以停止反应; (6)10min后加入NaI载体溶液1ml ; (7)按常规方法分离纯化。 3.注意事项 (1)LPO质量好坏,可直接影响标记率,LPO应在使用前新鲜配制,以防酶活性降低。 (2)LPO用量应小于总蛋白质用量的1%,以减少酶自身碘化而带入的放化杂质。 (3)碘化反应速率分析表明,酶的催化速度很快。 (4)碘化反应在pH4.0~8.5较宽范围内均可进行,最适pH值应依据蛋白质本身性质而定。 (5)H2O2应保持低浓度,如高于0.1mmol/L,对酶的活性将有抑制作用。
大球盖菇过氧化物酶及超氧化物歧化酶的研究 张琪林1,王红2(1运城学院生命科学系,山西运城044000 2运城学院生化实验中心,山西运城044000) 摘 要:采用聚丙烯酰胺凝胶圆盘电泳法测定大球盖菇过氧化物酶和超氧化物歧化酶(SOD)同工酶活 性,结果表明大球盖菇过氧化物酶有4种同工酶,比移分别是:0.13、0.18、0.25、0.32,其活性大小接近. SOD三种都有,比移分别为0.20、0.21、0.25,以CuZn-SOD活性最大,Mn-SOD活性较小.CuZn-SOD 及Mn-SOD辅因子易于丢失,应用时应予以注意.关键词:大球盖菇 过氧化物酶 超氧化物歧化酶 聚丙烯酰胺凝胶圆盘电泳中图分类号:Q935 文献标识码:A大球盖菇(Strophariarugoso-annulate)栽培广 泛,食药两用,深受菇农与消费者青睐,栽培研究颇 多,生理研究也日渐深入.已有液体培养氮碳营养 源[1]、与pH关系[2]、胞外酶特性[3]等研究报道,而 胞内酶研究报道尚未见到.过氧化物酶、超氧化物 歧化酶是机体清除H2O2、超氧离子(O-2)等活性氧 的氧化还原酶.[img]http://ng1.17img.cn/bbsfiles/images/2009/03/200903260925_140607_1614854_3.gif[/img]对生物抗氧化、防辐射、抗衰老等方面都有重要作 用,尤其是SOD.本文采用聚丙烯酰胺凝胶圆盘电 用方法鉴定大球盖菇上述两种酶的活性及种类,以 期为大球盖菇的生理生化研究和大球盖菇的应用 提供理论依据.1 材料与方法1.1 材料供试菌株引自河南省清丰县食用菌技术推广 中心.所用化学试剂均为分析纯.1.2 方法1.2.1 菌丝培养 20%土豆浸汁1000mL,蔗糖 20g,蛋白胨2g,磷酸二氢钾2g,硫酸镁1.5g,pH值 自然.分装于300mL锥形瓶,每瓶50mL,高压灭菌.接种后25~28℃恒温摇床培养21天,振荡频 率为120r/min.1.2.2 酶液制备 菌丝冲洗干净后,于-4℃冷冻 12h.按菌丝∶0.1MpH7.4磷酸缓冲液(冷藏)∶石 英砂=1∶2∶0.2比例混合.冰浴磨成匀浆.在 10℃以下环境离心(4000r/min,15min).取上清液 5份与40%蔗糖(冷藏)、0.01%溴酚蓝各1份混 合,置冰箱备用.1.2.3 电泳 方法为聚丙烯酰胺凝胶圆盘电泳. 样品分离胶浓度为7%,pH8.9.浓缩胶浓度为2. 5%,pH6.7.电极缓冲液为Tris-甘氨酸缓冲液, pH8.3.点样量为30μL/管.以溴酚蓝为指示剂.电 流开始为10mA,电泳两分钟后加大至50mA.待溴 酚蓝移至凝胶柱下端附近时停止电泳.电泳环境温 度为10℃,时间1.2h.1.2.4 染色1.2.4.1 过氧化物酶染色 A液:0.4g联苯胺加 入3mL冰醋酸于80℃溶解,加入17mL蒸馏水,随 用随配.B液:4%氯化铵.C液:5%EDTA.D液:0. 3%H2O2.按等体积加8倍水混合,量以淹没胶柱 为度.剥胶后立即放入染液,等到有蓝色谱带出现 后,取出用水冲洗干净,再用7%醋酸脱色漂洗后 观察.1.2.4.2 SOD染色 (1)对照a、在2.45×10-2M 氯化硝基四氮唑蓝(NBT)液中黑暗下浸泡1h,温 度37℃.b、在2.8×10-2M四甲基乙二胺、2.8× 10-5M核黄素和在3.6×10-2MpH7.8磷酸缓冲 液中黑暗下浸泡1h,温度37℃.c、在1×10-4M EDTA,5×10-2MpH7.8磷酸缓冲液中,距40W日 光灯20cm光照20min.(2)添加辅基处理.在(1 中分别添加5mMNa2SO4 FeSO4 MnSO4 CuSO4+ ZnSO4 FeSO4+MnSO4+CuSO4+ZnSO4.(3)添加 抑制剂处理.在酶液中分别添加10mMKCN或 30%氯仿-乙醇,其他同上.2 结果与讨论2.1 过氧化物酶谱及分析[img]http://ng1.17img.cn/bbsfiles/images/2009/03/200903260926_140608_1614854_3.gif[/img]结果如图1.从图1可见,大球盖菇菌丝体过 氧化物酶有4条带.比移分别为0.13,0.18,0.25, 0.32.其活性大小接近.2.2 超氧化物歧化酶谱及分析(1)添加SOD辅因子试验结果见图2.从中可 见共有三条带.比移分别为A:0.20,B:0.21,C:0. 25.都有B带,但加铁处理(3、6)的较亮,说明B带 是Fe-SOD,铁离子对该SOD活性有明显的增强作 用.没有加铁的处理(1,2,4,5)SOD也有活性,说 明铁与酶蛋白的结合较牢固,不易丢失.1,2,3,5 无A带,4,6有,说明A带是Mn-SOD.同理,C带为 CuZn-SOD.未加锰、铜、锌盐的没有相应的带,说 明锰、铜、锌与酶蛋白的结合较为松散,易于丢失. 比较三种SOD,以Mn-SOD活力最小,CuZn-SOD 活性最大.(2)添加抑制剂试验结果为:加KCN后,显色 结果无C带 加氯仿-乙醇后,无A带.已知10mM KCN抑制CuZn-SOD,30%氯仿-乙醇抑制Mn- SOD[4].说明2.2.1结论是正确的.综上所述,大球盖菇菌丝体抗氧化酶比较丰 富,过氧化物同工酶有4种 超氧化物歧化酶有3 种,以CuZn-SOD活性较高,Mn-SOD、Fe-SOD活 性较低,但CuZn-SOD、Mn-SOD辅因子易于丢 失,应用时应予以注意.参考文献:[1]张琪林,王红.大球盖菇液体培养碳氮营养源研究[J].食用 菌.2002,24(1):6.[2]王红,张琪林.大球盖菇液体培养与pH值关系研究[J].山西 师范大学学报(自然科学版).2003,17(增1期):108~109. [3]王红,张琪林.大球盖菇液体培养胞外酶特性研究[J].食用 菌.2003,25(2):8~9.[4]李中振,田廷亮.灵芝超氧化物歧化酶同工酶研究[J].中国食 用菌.1997,16(4):32~34.
请教辣根过氧化物酶的等电点5.5-9是什么意思?在pH7的溶液中,它会是带负电的吗?
过氧化物酶 的定量、活性测定是用UV?哪些品牌较好?谢谢!
请教,如何用分光光度法测定葡萄糖氧化酶和辣根过氧化物酶的活性?急!!!!!谢谢
专家您好 我用紫外可见分光光度计,用辣根过氧化物酶催化H2O2氧化酚红,增加了吸光度,测定H2O2含量,我第一步绘制标准曲线,选择的浓度分别为1,2,4,6,8,10,20µ M等,测定的吸光度均小于0.2,这样是不是相对误差很大,不行啊?请专家给予指导,非常感谢
第一篇来自Sowmya Swaminathan, Nature Cell Biology, "GFP: the green revolution", doi:10.1038/ncb1953, October 1, 2009;第二篇来自Andy, brainslab.wordpress.com,"Horseradish peroxidase as marker for anatomical em", April 3, 2011;第三篇来自Andy, brainslab.wordpress.com, "MiniSOG, a light and electron microscopy fusable marker", April 16, 2011第一篇:绿色荧光蛋白: 绿色革命http://www.biomart.cn//upload/userfiles/image/131175417948693.jpg来自秀丽隐杆线虫(Caenorhabditis elegans)的两个触觉感受器神经元的细胞体(cell body)用编码β-微管蛋白的基因表达的绿色荧光蛋白标记,图片来自doi:10.1126/science.8303295.1994年,Chalfie等人在Science杂志发表一篇报道,表明来自维多利亚水母(Aequorea Victoria)的绿色荧光蛋白(green fluorescent protein, GFP),在没有任何A. Victoria的辅助因子存在下,能在活着的细菌和线虫细胞中用作蛋白定位和表达的标记。这种显示GFP作为体内研究蛋白的工具基本上改变了细胞生物学家能够解决的问题的性质和范围。1962年,Shimomura和他的同事们在A. victoria生物发光蛋白水母素(aequorin)的纯化过程中偶然间第一次发现了GFP。1974年,Morise和他的同事们在随后的纯化、晶体形成和从水母素到GFP能量转移的体外重建过程中,为GFP的荧光性质提供启迪,而且证实GFP接受来自水母素的能量转移后发射绿光。在此之后许多年,在外源系统中GFP是否需要水母素和可能来自水母的其他因子发出荧光,这仍然是一个公开的问题。1992年,也就是在GFP发现后的30年,Prasher等人克隆了编码GFP的基因,就为实验上评估它用作蛋白质的体内标记铺平道路。而在两年后,Chalfie等人证实当GFP在细菌和线虫细胞中表达时,它能够发出荧光。在线虫中,GFP是在一个表达β-微管蛋白的基因启动子的控制下表达的。它在线虫特异性神经元中的时空表达模拟了内源性β-微管蛋白基因的表达,因而证明GFP能够作为一种可靠的标记以便监控基因表达模式。此后不久,Roger Tsien的实验室对天然GFP进行改造使之变得更加明亮和耐光,以及在一个与常规显微镜过滤器装置相匹配的波长下激发,因而增加了它的实际适应性。GFP技术的下一个突破便是开发GFP变异体产生蓝色、青色和黄色荧光蛋白,因而能够使得影像实验在细胞和有机体中采用多种标记的蛋白。绿色荧光蛋白(GFP)是由238个氨基酸残基组成,在蓝色波长范围的光线激发下,会发出绿色荧光。而EGFP是增强型的GFP (enhanced GFP),发生了双氨基酸取代,亮氨酸(Leu)取代GFP上第64位苯丙氨酸(Phe),苏氨酸(Thr)取代了GFP上的第65位丝氨酸(Ser),与GFP相比,具有更强更稳定的绿色荧光。黄色荧光蛋白(yellow fluorescent protein, YFP)其序列与GFP基本相同,不同之处就是把第203位Thr以Tyr取代,这样的GFP不发出绿色荧光,而发出较长波长的黄色荧光。青色荧光蛋白(cyan fluorescent protein, CFP)与此类似,也是GFP第66位Tyr(酪氨酸)被Thr(色氨酸)所取代的结果,发青色荧光。由此可见,GFP标签与其它突变体GFP、YFP、EYFP、CFP的序列非常的类似,只有1-2个氨基酸残基的变化。在GFP发现后的将近半个世纪以来,因为发现和开发绿色荧光蛋白,2008年诺贝尔化学奖被授予给Osamu Shimomura, Martin Chalfie和Roger Tsien,来表彰这次发现给后世带来的巨大影响。参考文献:Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W. & Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science 263, 802–805 (1994).Shimomura, O., Johnson, F. H. & Saiga, Y., Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan Aequorea. J. Cell. Comp. Physiol. 59, 223–239 (1962).Morise, H., Shimomura, O., Johnson, F. H. & Winant, J. Intermolecular energy transfer in the bioluminescent system of Aequorea. Biochemistry 13, 2656–2662 (1974).Prasher, D. C., Eckenrode, V. K., Ward, W. W., Prendergast, F. G. & Cormier, M. J. Primary structure of the Aequorea victoria green-fluorescent protein. Gene 111, 229–233 (1992).Tsien, R. Y. The green fluorescent protein. Annu. Rev. Biochem. 67, 509–544 (1998).第二篇:辣根过氧化物酶作为解剖学电子显微镜(anatomical electron microscopy)的标记要绘制诸如视网膜的大容量组织中的突触联系(synaptic connection) James R. Anderson等人于2009年就已经主张应当将分子表达谱(molecular profiling)与电子显微镜图片相关联。如今,这里给出一个例子来说明分子表达谱仪(molecular profiler)如何得到很好的利用。Jianli Li等人采用电穿孔技术产生将携带有靶向到细胞膜的辣根过氧化物酶(membrane-targeted horseradish peroxidase, mHRP)基因的表达构建物导入神经元。辣根过氧化物酶发射可放大的波长为428nm的荧光。这些研究人员就使用它作为解剖学上的标记,与蝌蚪神经元的连续切片电子显微镜图片(serial section electron microscopy, SCEM)在空间上相互关联。辣根过氧化物酶的优势之一在于它在包括线粒体/小泡(vesicle)在内的细胞膜上均匀分布。它也有助于鉴定长轴突(axon)/小直径的树突(dendrite)。但是另一方面,不同于其他的标记,它不得不在动物仍然活着的时候通过电穿孔技术导入细胞才有效果。下面是一系列电子显微镜图片,其中远侧树突分支(distal dendritic branch),蓝色显示;带有轴突末端(axon terminal, 用粉红色显示)的突触,用白色箭头符号指示:http://www.biomart.cn//upload/userfiles/image/131175420478195.jpg比例尺=1微米当从向右观看这一系列图片时,你能够看到树突如何缩减,而研究人员能够在他们的微回路(microcircuit)模型中重构这些图片。
[color=#444444]请问过氧化物用液相色谱可以分析吗,这个物质没有标样,是中间产物,请问有谁做过过氧化物色谱分析的,请教一下,具体的液相柱子,及条件等,[/color][color=#444444][url=https://insevent.instrument.com.cn/t/Mp]气相[/url]因为热分解所以不能用。滴定法也不想考虑啊[/color]
[color=#444444]请问过氧化物用液相色谱可以分析吗,这个物质没有标样,是中间产物,请问有谁做过过氧化物色谱分析的,请教一下,具体的液相柱子,及条件等,[/color][color=#444444][url=https://insevent.instrument.com.cn/t/Mp]气相[/url]因为热分解所以不能用。滴定法也不想考虑啊[/color]
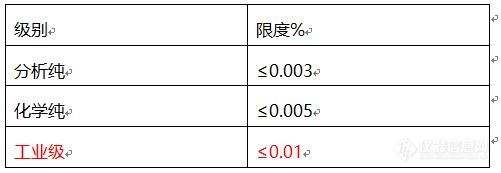
[align=left] 我也不知道把这个放在哪个分类,勉强放这里把~~[/align][align=left] 这是第一次原创,关于异丙醚中过氧化物的检测,最近有时间进行了一次试验,可以用比色法简单的定量(仅定出范围)。[/align][align=left] 主要是在反应过程中用来简单的中控,此方法相对快捷简便,但并非精密检测,如果有什么问题欢迎指点。[/align][align=left][font='微软雅黑','sans-serif'][size=18px][b] [size=16px] 异丙醚中过氧化物的检测方法(硫氰化铁)[/size][/b][/size][/font][/align][align=left][b]提出的检测要求:[/b]快捷简单,能够直接判断过氧化物的大致量。[/align][align=left][b]方法查询:[/b][/align][align=left] 1、淀粉碘化钾试纸:[font='Microsoft YaHei',Arial,Helvetica][color=#000000]最常用的是用淀粉碘化钾试纸来检测过氧化物,但是经测试,低浓度的过氧化物无法显色,因此试纸无法用来检测溶剂中的过氧化物。[/color][/font][/align][align=left][font='Microsoft YaHei',Arial,Helvetica][color=#000000] 2、淀粉碘化钾溶液:不同浓度的过氧化物,使用淀粉碘化钾溶液显色后,颜色非常接近,难以肉眼判断深浅,只能用来定性。[/color][/font][/align][align=left][font='Microsoft YaHei',Arial,Helvetica][color=#000000] 3、硫氰化钾与氯化铁溶液:未有关于这方面的详细介绍,自己进行测试。[/color][/font][/align][align=left][b]方法原理:硫氰化钾和氯化铁被氧化形成硫氰化铁,呈红色。[/b][/align][align=left] Fe2+过氧化物→Fe3+[/align][align=left] Fe3+硫氰化钾→Fe(SCN)3(血红色)[/align][align=left][font='微软雅黑','sans-serif'][color=black][b]异丙醚中过氧化物的质量分数限度要求(以H2O2计)%[/b][/color][/font][/align][align=left][font='微软雅黑','sans-serif'][color=black][b] [img=,501,173]https://ng1.17img.cn/bbsfiles/images/2020/03/202003181233226782_8146_3116636_3.jpg!w501x173.jpg[/img][/b][/color][/font][/align][align=left][color=black][b][font='微软雅黑','sans-serif'][back=white]试剂[/back][/font][/b][font='微软雅黑','sans-serif'][color=black] 30%[/color][/font][font=&][back=white]过氧化氢 分析纯[/back][/font][color=black][back=white] 硫氰化钾 化学纯[/back][/color][color=black] 氯化亚铁 [back=white]化学纯[/back][/color][back=white] 亚硫酸氢钠 化学纯[/back][/color][back=white] 纯化水 /[/back][b][back=white]溶液配制(此处以30%的过氧化氢作为标准液测试)[/back][/b][font='微软雅黑','sans-serif'][back=&] 0.003%[/back][/font][font='微软雅黑','sans-serif']过氧化氢溶液:用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]吸取1ml30%过氧化氢于100ml容量瓶,用纯化水稀释定容,再用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]吸取稀释后过氧化氢溶液1ml至100ml容量瓶,用纯化水稀释定容,混匀备用,所得过氧化氢质量分数为0.003%。[/font][font='微软雅黑','sans-serif'][back=&] 0.005%[/back][/font][font='微软雅黑','sans-serif']过氧化氢溶液:用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]吸取0.167ml30%过氧化氢于10ml容量瓶,用纯化水稀释定容,再用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]吸取稀释后过氧化氢溶液1ml至100ml容量瓶,用纯化水稀释定容,混匀备用,所得过氧化氢质量分数约为0.005%。[/font][font='微软雅黑','sans-serif'][back=&] 0.01%[/back][/font][font='微软雅黑','sans-serif']过氧化氢溶液:用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]吸取0.333ml30%过氧化氢于10ml容量瓶,用纯化水稀释定容,再用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]吸取稀释后过氧化氢溶液1ml至100ml容量瓶,用纯化水稀释定容,混匀备用,所得过氧化氢质量分数约为0.001%。[/font][font='微软雅黑','sans-serif'][back=&] 0.5%[/back][/font][font='微软雅黑','sans-serif']氯化亚铁溶液:称取0.5g氯化亚铁固体于100ml容量瓶中,用水溶解并定容,混匀,所得氯化亚铁溶[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]量分数为0.5%。[/font][font='微软雅黑','sans-serif'][back=&] 0.5%[/back][/font][font='微软雅黑','sans-serif']硫氰化钾溶液:称取0.5g硫氰化钾固体于100ml容量瓶中,用水溶解并定容,混匀,所得硫氰化钾溶[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]量分数为0.5%。[/font][back=white] 显色溶液:量取适量0.5%氯化亚铁溶液与0.5%硫氰化钾溶液,按1:1混匀备用。[/back][back=white] 亚硫酸氢钠溶液(100g/L): 取适量亚硫酸氢钠,配制成100g/L备用。[/back][b][back=white]测定方法[/back][/b] 空白对照:取异丙醚4ml,加入2ml亚硫酸氢钠溶液,振摇2min,加水4ml振摇,静置分层后取异丙醚层1ml,加入1ml显色溶液,摇晃混匀后倒入比色管,放置5min。 标准比对溶液:分别取不同质量分数的过氧化氢溶液1ml,加入1ml显色溶液,摇晃混匀后倒入比色管,放置5min。 样品溶液:取待测异丙醚1ml,加入1ml显色溶液,摇晃混匀后倒入比色管,放置五分钟。[font='微软雅黑','sans-serif'] 沿比色管轴线方向观测所得血红色不得深于标准比对溶液的颜色。[/font][font='微软雅黑','sans-serif'][color=#990000] (注:此处为了更加精准因而用比色管,且加入的量相对精准,但是经测试,无需非常精准,也无需比色管,用简单的冷冻管,试管等透明的容器都可以,在本实验本身误差下,由容器,量取方面带来的误差结果不明显,只需要对照溶液相互之间加入的量一致就可以。)[/color][/font][font='微软雅黑','sans-serif'][b][font='微软雅黑','sans-serif']结果分析[/font][/b][color=black] 分析纯异丙醚:样品溶液不得深于0.003%质量分数的标准比对溶液。[/color][color=black] 化学纯异丙醚:样品溶液不得深于0.005%质量分数的标准比对溶液。[/color][color=#000000] 工业级异丙醚:样品溶液不得深于0.01%质量分数的标准比对溶液。[/color][/font][b]此方法中,不同浓度的颜色相差很明显,肉眼即可辨别。以下为用冷冻管作为容器的图:[/b][img=,364,397]https://ng1.17img.cn/bbsfiles/images/2020/03/202003181241397051_3470_3116636_3.jpg!w364x397.jpg[/img][img=,143,405]https://ng1.17img.cn/bbsfiles/images/2020/03/202003181243017681_4750_3116636_3.jpg!w143x405.jpg[/img][b]上图可以清晰的辨别不同浓度之间的颜色,可以简单的定量0.003—0.001mol/L之间的过氧化物范围,如果需要更精准,则可以配制浓度差异更小的过氧化物进行测试,但此处未曾测试过,因为以上几种颜色已足够我们实验使用。以下附图为用淀粉碘化钾进行测试的颜色图一使用的冷冻管,颜色非常不明显,基本无法辨别。[img=,252,199]https://ng1.17img.cn/bbsfiles/images/2020/03/202003181248434297_5877_3116636_3.jpg!w252x199.jpg[/img]图二更换为了比色管,稀释了一下,颜色相对更为清晰,虽然图内能够勉强辨认,但是其实现实中肉眼是难以看出色差的。[img=,311,286]https://ng1.17img.cn/bbsfiles/images/2020/03/202003181249241813_8832_3116636_3.jpg!w311x286.jpg[/img]以上便是我自己的测试方法,如果大家有更好的也可以提出来,进行改进。不过我自己做完了倒是有几个疑问:1、为什么基本检测过氧化物的方法都是用淀粉碘化钾,滴定定量时也是用此试药来判断终点。淀粉碘化钾最大的优势是在哪里?2、我看过很多方法写的都是淀粉碘化钾溶液变蓝色即为有过氧化物,而我做的都是偏紫色,最蓝的一次也不过是蓝紫色,是做错了什么步骤?3、洗脱过氧化物的方法,主要以亚硫酸钠为主,但是我做了实验,亚硫酸钠的洗脱效果还不如亚硫酸氢钠,而亚硫酸氢钠更是远不如硫酸亚铁,那么为什么更多方法中使用的是亚硫酸钠呢?[/b][/align][align=left][/align]
新购乙醚或放置一段时间的乙醚里面会含有过氧化物,一般蒸馏除去。请教大家:1. 会是那些过氧化物,有人做过GCMS吗?2.过氧化物会对柱子,特别是极性柱子有影响吗?3.在用乙醚做溶剂处理样品时,过氧化物对某些易氧化物质,例如醛类有无氧化作用?
前面买了一瓶乙醚(进口),发现里面的过氧化物高,使用前必须重蒸。请使用乙醚做提取的朋友推荐一家含过氧化物含量低,杂质也低的乙醚供应商。
生物标记三部曲:绿色荧光蛋白(GFP)、辣根过氧化物酶(HRP)和小型单线态氧制造者(MiniSOG)【towersimper注:本文为译文,每篇都有部分改动,仅用作研究之用,不得用作商业开发,转载请标明翻译者towersimper,第一篇来自Sowmya Swaminathan, Nature Cell Biology, "GFP: the green revolution", doi:10.1038/ncb1953, October 1, 2009;第二篇来自Andy, brainslab.wordpress.com,"Horseradish peroxidase as marker for anatomical em", April 3, 2011; 第三篇来自Andy, brainslab.wordpress.com, "MiniSOG, a light and electron microscopy fusable marker", April 16, 2011】 第一篇:绿色荧光蛋白: 绿色革命http://bbs.bioon.net/bbs/data/attachment/album/201107/23/1829154rjsutzjgu2tw4hf.jpg来自秀丽隐杆线虫(Caenorhabditis elegans)的两个触觉感受器神经元的细胞体(cell body)用编码β-微管蛋白的基因表达的绿色荧光蛋白标记,图片来自doi:10.1126/science.8303295.1994年,Chalfie等人在Science杂志发表一篇报道,表明来自维多利亚水母(Aequorea Victoria)的绿色荧光蛋白(green fluorescent protein, GFP),在没有任何A. Victoria的辅助因子存在下,能在活着的细菌和线虫细胞中用作蛋白定位和表达的标记。这种显示GFP作为体内研究蛋白的工具基本上改变了细胞生物学家能够解决的问题的性质和范围。1962年,Shimomura和他的同事们在A. victoria生物发光蛋白水母素(aequorin)的纯化过程中偶然间第一次发现了GFP。1974年,Morise和他的同事们在随后的纯化、晶体形成和从水母素到GFP能量转移的体外重建过程中,为GFP的荧光性质提供启迪,而且证实GFP接受来自水母素的能量转移后发射绿光。在此之后许多年,在外源系统中GFP是否需要水母素和可能来自水母的其他因子发出荧光,这仍然是一个公开的问题。1992年,也就是在GFP发现后的30年,Prasher等人克隆了编码GFP的基因,就为实验上评估它用作蛋白质的体内标记铺平道路。而在两年后,Chalfie等人证实当GFP在细菌和线虫细胞中表达时,它能够发出荧光。在线虫中,GFP是在一个表达β-微管蛋白的基因启动子的控制下表达的。它在线虫特异性神经元中的时空表达模拟了内源性β-微管蛋白基因的表达,因而证明GFP能够作为一种可靠的标记以便监控基因表达模式。此后不久,Roger Tsien的实验室对天然GFP进行改造使之变得更加明亮和耐光,以及在一个与常规显微镜过滤器装置相匹配的波长下激发,因而增加了它的实际适应性。GFP技术的下一个突破便是开发GFP变异体产生蓝色、青色和黄色荧光蛋白,因而能够使得影像实验在细胞和有机体中采用多种标记的蛋白。绿色荧光蛋白(GFP)是由238个氨基酸残基组成,在蓝色波长范围的光线激发下,会发出绿色荧光。而EGFP是增强型的GFP (enhanced GFP),发生了双氨基酸取代,亮氨酸(Leu)取代GFP上第64位苯丙氨酸(Phe),苏氨酸(Thr)取代了GFP上的第65位丝氨酸(Ser),与GFP相比,具有更强更稳定的绿色荧光。黄色荧光蛋白(yellow fluorescent protein, YFP)其序列与GFP基本相同,不同之处就是把第203位Thr以Tyr取代,这样的GFP不发出绿色荧光,而发出较长波长的黄色荧光。青色荧光蛋白(cyan fluorescent protein, CFP)与此类似,也是GFP第66位Tyr(酪氨酸)被Thr(色氨酸)所取代的结果,发青色荧光。由此可见,GFP标签与其它突变体GFP、YFP、EYFP、CFP的序列非常的类似,只有1-2个氨基酸残基的变化。
食品的过氧化物含量测定利用样品中加入硫酸,碘化钾,可溶性淀粉、硫酸锰,用硫代硫酸钠溶液滴定.食品中有过氧化物则可以使碘化钾中的碘游离出来而使淀粉显蓝色.而硫代硫酸钠的还原性可以把碘单质还原,而使蓝色消失.但是标准上还要求加入钼酸铵,不知道是什么原因?求助各位同仁!可以用钼酸钠代替吗?非常谢谢了!
大家好,我做有机过氧化物气质联用,但是得到的全是分解后的产物,有没有人也做这个,留个联系的一起讨论讨论,我才用GCMS没多久,见笑
请问用DSC做有机过氧化物的活化能、频率因子、分解速率常数并计算半衰期是不是要用专用的密封干锅呀比如过氧化甲乙酮、叔丁基过氧化-2-乙基碳酸脂。做成一氯代苯的稀溶液。加热到200℃左右。小弟没做过 如果有人懂的话指点我一下呀qq 57315240wangamada@163.com
不含过氧化物的无水乙醚能直接买到现成的吗?
请问无过氧化物的乙醚如何制备?
如何检测四氢呋喃中的过氧化物?可以定量分析吗?还有怎样除去过氧化物?哪位大侠知道,请不吝指教![em0808]
二叔丁基过氧化物GCMS测试选择什么类型色谱柱最为合适?
请问,有人知道怎样用卡尔费休滴定仪测过氧化物中的含水率?急需解答,谢谢
[color=#444444]请问火腿肠中过氧化物的限值是多少?谢谢![/color]
跪求答复,怎样用卡尔费休滴定仪测试过氧化物含水率
现在需要确立一个定性分析的分析方法,用来检测乙醚、四氢呋喃、异丙醚等溶剂中的过氧化物。我看到最简单的方法是直接将少量溶剂用淀粉碘化钾试纸来检测,变蓝则有过氧化物产生,但是问题是这个检测方法的限度是多少呢,多少范围属于安全范围呢,这个我并没有查到。再者,这些溶剂[font='Microsoft YaHei',Arial,Helvetica][size=14px][color=#000000]工厂用来回收利用,需要浓缩。[/color][/size][/font]如果碘化钾试纸无法检出的限度,理论上来说就能正常使用?接上午提问:今天做了一下测试,公司用的是异丙醚,用异丙醚做的测试。工业级要求过氧化物(以H2O2计)<0.01%,我用30%H2O2配了一个0.01% 的标准液,用淀粉碘化钾试纸是测不出来的。也就是无法用淀粉碘化钾试纸作为判断。后来发现还有一个相对简便的方法,用硫氰化钾和氯化亚铁溶液来鉴别。而且灵敏度很高,检测限也很低。0.003%以下的过氧化物都能检测出来,而且应该更低,0.003%已经是分析级别的标准了。
Aglient6890N[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url],DB-210柱子,FID检测器,内标测定有机过氧化物中的杂质CHP(异丙苯基过氧化氢),在CHP的出峰位置总有0.15%杂质,用饱和亚硫酸钠溶液也洗不掉(CHP是可以完全被过量亚硫酸钠反应掉的) 试剂空白非常干净 样品中加入定量标准CHP后出峰的形状也很好,含量也与计算的值符合 在样品中人为加入定量的CHP再用饱和亚硫酸钠溶液洗涤,不管加多少,洗完后还是0.15%.大致可判断不是CHP.也换了DB-1,DB-5,DB-1701,DB-WAX柱子,都无法分离.因为不影响产品质量,领导没让做GC-MS.各位高手帮忙出出主意,在色谱中得到较好的分离.谢谢啦.
[align=center]分析油品中过氧化物操作方法的改良[/align] [color=#333333]李久龙[/color][align=left][color=#333333] [/color][color=#333333](宁波中金石化有限公司)[/color][/align][b]摘要:[/b]本文阐述了利用化学处理法处理后,使用分光光度计测定油品的过氧化物。由于样品在空气中活度高,接触空气后容易对样品结果产生干扰。本文对样品的化学处理工具进行了改良,提高分析准备度计分析操作难度。[b]关键词:[/b]过氧化物、油品、分光光度计、操作方法改良 [b]一、ASTM E299方法分析步骤1. 范围[/b]1.1本试验方法包括了活性氧含量≥5~80ppm的有机溶剂。使用特定的反应吸收池,本试验方法可扩展到0~5ppm。本试验方法可用于确定活性不同的过氧化物类型,如过氧化氢,过氧化二酰,过酸酯及酮过氧化物。在分析条件下,稳定的二烷基过氧化物不反应。1.2包括饱和和不饱和芳烃,醇,醚,酮和酯的溶剂可以成功的分析。另外,试验方法可用于本试验方法可用于烯类溶剂以及含α,β和共轭不饱和结构的特定化合物。可溶于醋酸-氯仿溶剂的固体样品也可被分析。1.3本试验方法未打算提及所有与其应用有关的安全考虑。在使用前,本标准的用户有责任建立适当的安全和健康规则并确定规章限制的应用。1.4对于关于毒性,初次辅助规则以及安全警告的细节信息,参阅当前的MSDS。[b]2. 参考文献[/b]2.1 ASTM标准D 1193 试剂水的指标E 180 工业和特定化学品ASTM分析方法精确度的测定的规则[b]3.试验方法概述[/b]3.1 样品溶解在醋酸-氯仿混合物中。溶液脱气,加入碘化钾试剂溶液。混合物在暗处反应1h,释放出等当量的碘。在470nm处测定溶液的吸光度,样品中活性氧的量通过碘校准曲线测定。3.2 对于活性氧含量0~5ppm的样品,使用一个特定的反应-吸收池。样品脱气和反应在池内进行。在410nm处测定吸光度以提高灵敏度。[b]4.意义及应用[/b]4.1 在常用的不同的用作催化剂或反应引发剂的溶剂中稀释过氧化物溶液。过氧化物也可以通过自动氧化特定类型的化合物得到,如醚,乙缩醛,二烯烃,烷基芳香烃并说明潜在的安全伤害。本试验方法提供了一个测定过氧化物或活性氧的方法。[b]5.干扰[/b]5.1 样品中的氧化或还原物干扰测定。如果做过吸光度校正,有色溶液也可分析。[b]6.设备[/b]6.1 分光光度计—1cm比色池6.2 特定的反应-吸收池(图1)—当使用此池时,比色池用试管吸光度测定附件取代。[b]7.试剂[/b]7.1 试剂纯度—本试验中所用的试剂均为试剂级。除非另行指明,它指的是所有试剂均应符合美国化学会分析试剂委员会指定的指标。如果事先能证明其纯度足够高不会降低测定的准确度,其它级别的试剂也可以使用。7.2 水的纯度—除非另行制定,所指的水应理解为符合D1193的Ⅱ型或Ⅲ型试剂水。7.3 醋酸-氯仿溶剂(2+1)—混合两体积的醋酸和1体积的氯仿。7.4 醋酸-氯仿溶剂(含约4%的水)—在1L7.3中制备的溶剂中加入40mL水。7.5 碘7.6 氮气瓶7.7 碘化钾溶液(50%)—溶解20g碘化钾(KI)于20mL脱气水中。此试剂应在用前新鲜配制。7.8 脱气水—用前,在蒸馏水中通几分钟氮气。[b]8.步骤[/b]8.1 高范围—0-400ug活性氧:8.1.1 校准曲线的制备:8.1.1.1溶解0.1270g碘于醋酸-氯仿溶剂(2+1)并在容量瓶中稀释至100mL。此溶液含等价于80.0ug活性氧/mL的1.27mgI/mL。8.1.1.2 分别移取0,1,2,3,4,5-mL的溶液于25mL容量瓶中,分别用醋酸-氯仿稀释至刻度。混匀。8.1.1.3 用皮下注射针或玻璃毛细管,用氮气鼓溶液1-1.5min,加入1mL新鲜制备的KI溶液,继续通氮1min。塞好,混匀。8.1.1.4 在470nm处,1cm比色池,以水为参比测定每个溶液的吸光度。8.1.1.5 吸光度减去空白,以吸光度对mg活性氧/25mL作图。8.1.2 样品分析:8.1.2.1 移取活性氧含量可高至400ug的样品于25mL容量瓶中,用醋酸-氯仿溶剂(2+1)稀释至刻度(注1)。混匀。注1—只要能与醋酸-氯仿溶剂混溶,所用样品体积可高至15mL。8.1.2.2 用氮气鼓溶液1-1.5min,加入加入1mL新鲜制备的KI溶液,继续通氮1min。8.1.2.3 塞好,混匀。溶液置于暗处1h。注2—很活泼的过氧化物可在10min内完全反应,活性低的过氧化物则可能需要1h才能完全反应。因此,指定反应时间为1h。8.1.2.4 在470nm处用1cm池以水为参比测定吸光度。注3—根据样品的量和类型,可能会发生KI的沉淀。然而,在吸光度测定中,KI晶体很容易沉到底部。8.1.2.5 减去空白,从校准曲线得到样品中的mg活性氧量。8.2 低含量—0-40ug活性氧:8.2.1 校准曲线的制备:8.2.1.1 在醋酸-氯仿溶剂(2+1)中溶解0.0634g碘并稀释至100mL。移取10mL至另一个100mL容量瓶中并用醋酸-氯仿溶剂稀释至刻度。此溶液含63.4gI/mL,等价于4.0ug活性氧/mL。8.2.1.2 分别移取0,1,3,5,8,10-mL于25mL容量瓶中,用含4%水的醋酸-氯仿溶剂稀释至刻度。混匀。8.2.1.3 每一个标准移取一份于特定的吸收池中(图1)。通过侧臂通氮气吹扫3min。8.2.1.4 加入5滴新鲜制备的脱气碘化钾溶液,重新塞紧。继续通氮气3min。8.2.1.5 塞紧塞子,关闭氮气管的旋塞,保持溶液处于弱正压下。8.2.1.6 吸收管应匹配并提供一个玻璃耳使得吸光度测定时位置能重复。将此管插到池支架上并旋转直至玻璃耳与管夹接触。在410nm处以水为参比测定吸光度。8.2.1.7 减去空白,以吸光度对mg活性氧/25mL作图。8.2.2 样品分析:8.2.2.1 移取5.00mL样品于一个25mL容量瓶中,用含4%水的醋酸-氯仿(2+1)溶剂定容。混匀。8.2.2.2 移取一份此溶液于特定的吸收池中,按8.2.1.3,8.2.1.4和8.2.1.5所述显色。8.2.2.3 样品在暗处放置1h。8.2.2.4 以水为参比在410nm处测定溶液的吸光度。8.2.2.5 减去空白,根据校准曲线得样品中活性氧的mg数。[b]9.计算[/b]9.1 按下式计算样品中活性氧的含量:[img=,137,41]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181711589424_623_2307429_3.png[/img] (1)其中:A=测得的活性氧,ugB=所用样品量,mLC=密度,g/mL9.2 如果已知一个特定的过氧化物存在,用合适的转化因子,将这部分ppm活性氧转化为过氧化物[img=,321,23]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181711590870_2362_2307429_3.png[/img] (2)其中:F=过氧化物X的转化因子。9.2.1 通常的过氧化物的转化因子,如下所示:异丙苯过氧化氢 9.5125过氧化苯甲酰 15.1400t-丁基过氧化氢 5.6328Lauroyle peroxide 24.9150[b]10.报告[/b]10.1 高含量范围—准至1ppm10.2 低含量范围—准至0.1ppm[b]二、问题描述[/b]在我们化验室需要分析油品中的过氧化物含量,使用的分析方法是ASTM E299,使用的仪器的分光光度计,尤尼科的UV4802及哈希的DR5000.出现的情况是做出来曲线的线性不是很好,增加了大量的分析工作,即便是用我们化验室现在分析手法最好的员工制作工作曲线线性依然不是很好.[b]分析数据1及曲线1如下:[/b] [table=491][tr][td=3,1,491] [align=center]分析数据表1[/align] [/td][/tr][tr][td=1,1,189] [align=center]紫外分光光度计[/align] [/td][td=1,1,180] [align=center]UV4802[/align] [/td][td=1,12,123] [align=center]R=0.9967[/align] [/td][/tr][tr][td=1,1,189] [align=center]浓度范围[/align] [/td][td=1,1,180] [align=center]0-8mg/L[/align] [/td][/tr][tr][td=1,1,189] [align=center]文件名[/align] [/td][td=1,1,180] [align=center]O[sub]2[/sub].fit[/align] [/td][/tr][tr][td=1,1,189] [align=center]分析者[/align] [/td][td=1,1,180] [align=center]李久龙[/align] [/td][/tr][tr][td=1,1,189] [align=center]日期[/align] [/td][td=1,1,180] [align=center]07.3.14[/align] [/td][/tr][tr][td=1,1,189] [align=center]吸光度[/align] [/td][td=1,1,180] [align=center]浓度[/align] [/td][/tr][tr][td=1,1,189] [align=center]0.222[/align] [/td][td=1,1,180] [align=center]0[/align] [/td][/tr][tr][td=1,1,189] [align=center]0.275[/align] [/td][td=1,1,180] [align=center]0.8[/align] [/td][/tr][tr][td=1,1,189] [align=center]0.428[/align] [/td][td=1,1,180] [align=center]2.4[/align] [/td][/tr][tr][td=1,1,189] [align=center]0.529[/align] [/td][td=1,1,180] [align=center]4[/align] [/td][/tr][tr][td=1,1,189] [align=center]0.667[/align] [/td][td=1,1,180] [align=center]6.4[/align] [/td][/tr][tr][td=1,1,189] [align=center]0.822[/align] [/td][td=1,1,180] [align=center]8[/align] [/td][/tr][/table][align=center][img=,496,302]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181711589393_8671_2307429_3.png[/img][/align][align=center][b]曲线图1[/b][/align][b]三、分析分析[/b]经过多次试验及反复分析,得出主要原因是由于每个点的标样在空气中的暴露时间不同,暴露在空气中标样会与氧气发生反应,由于每个点接触空气的时间不同导致发生的增量有大有小,所以导致标样曲线线性不好。这里面包括两个暴露的时间,第一个是通过容量瓶进行氮气吹扫间断是有于空气接触,另一个比较重要的是将标液转移到比色皿的过程及分析的过程。采用的整改措施是,将原来分析样品用的容量瓶及比色皿进行改良,尽量使其更少的进入空气及暴露在空气中,最后选用了哈希做COD的样品管,由于哈希COD的样品管是一次性的,上面有盖且可以比色,将比色皿均用哈希COD的样品管进行替换,然后在标样通气前将样品先转移到哈希COD的样品管中,然后通气反应,这样标样反应及比色均在一个管中。这样做的好处有:1、减少反应后标样转移的过程;2、哈希COD的样品管上面有盖子,反应完后即可更好的密封;具体改良后的操作步骤如下:1、分别取0,l,3,5,8和10ml的标准母液A于25ml的容量瓶中,并用含4%水的醋酸-氯仿溶剂稀释到刻度,混合均匀。2、将配置好浓度的标样每个点均取7ml转移到哈希COD样品管中;3、分别向每一种标准液的COD样品管中通氮气3min。4、 然后加5滴新配制的脱气KI溶液,松开塞子,通氮气3min。5、 在410nm处使用COD样品管对溶液测定其吸光光度,并以在另一个COD样品管中的试剂空白作为参比液。6、 减去空白的吸光度,以吸光度对应每个标准溶液浓度mg活性氧化物/25ml绘制曲线图。7、 曲线文件名:O2-GL.fit。备注:改良的时候使用的风光光度计是哈希的DR5000,如果没有,可以将COD样品管固定在其他风光光度计上进行测量。以前没改良是也在DR5000上做过曲线,用比色皿做的,线性也不好。[b]改良后的分析数据2及曲线图2如下:[/b] [table=491][tr][td=3,1,491] [align=center]分析数据表[/align] [/td][/tr][tr][td=1,1,189] [align=center]紫外分光光度计[/align] [/td][td=1,1,180] [align=center]UV4802[/align] [/td][td=1,12,123] [align=center]R=0.9994[/align] [/td][/tr][tr][td=1,1,189] [align=center]浓度范围[/align] [/td][td=1,1,180] [align=center]0-8mg/L[/align] [/td][/tr][tr][td=1,1,189] [align=center]文件名[/align] [/td][td=1,1,180] [align=center]O[sub]2[/sub].fit[/align] [/td][/tr][tr][td=1,1,189] [align=center]分析者[/align] [/td][td=1,1,180] [align=center]李久龙[/align] [/td][/tr][tr][td=1,1,189] [align=center]日期[/align] [/td][td=1,1,180] [align=center]07.3.14[/align] [/td][/tr][tr][td=1,1,189] [align=center]吸光度[/align] [/td][td=1,1,180] [align=center]浓度[/align] [/td][/tr][tr][td=1,1,189] [align=center]0.222[/align] [/td][td=1,1,180] [align=center]0[/align] [/td][/tr][tr][td=1,1,189] [align=center]0.275[/align] [/td][td=1,1,180] [align=center]0.8[/align] [/td][/tr][tr][td=1,1,189] [align=center]0.408[/align] [/td][td=1,1,180] [align=center]2.4[/align] [/td][/tr][tr][td=1,1,189] [align=center]0.509[/align] [/td][td=1,1,180] [align=center]4[/align] [/td][/tr][tr][td=1,1,189] [align=center]0.692[/align] [/td][td=1,1,180] [align=center]6.4[/align] [/td][/tr][tr][td=1,1,189] [align=center]0.811[/align] [/td][td=1,1,180] [align=center]8[/align] [/td][/tr][/table][img=,487,302]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181711594161_5379_2307429_3.png[/img][align=center][b]曲线图2[/b][/align][b]五、改良结果讨论经过对分析过程容量瓶及比色皿的改良,很好的解决了分析过氧化物操作过程中引进的误差,增加了操作方法的精确度,提高了分析结果的准确度,降低了操作者对分析手法的难度。在以前遇到的分析困难得到了很好的解决。六、参考文献1、ASTM E299 有机溶剂中痕量过氧化物的标准试验方法2、UV 4802分光光度计操作规程[/b]
碳材料在氧气气氛中升温,2309和861 cm-1出现新峰,碳氧过氧化物红外峰在什么位置,这是它的峰吗? 请高手帮帮忙哈,非常着急!!!!
[size=2][font=黑体]有没有哪位同志测过四氢呋喃的过氧化物呀?用的是什么方法?如是碘量法,请告之步骤,以及注意事项.因为本人用了碘量法做过,不太理想!还有就是用碘量法做这个实验淀粉作指示剂不起作用.碘本身的颜色变化跟淀粉没什么区别.请哪位能否帮帮忙!不胜感激![/font][/size]
在线过氧化物监测仪器有什么品牌的?原理是什么?大概的价位?另在线的氧含量分析是成熟的,但对前处理的要求都比较高,有什么牌子的前处理简单些?