如果样品中含有两个羰基一个氨基怎么摸液相条件?我用的甲醇,水,峰型不好看,分离度也不好,我用醋酸铵和甲醇保留时间和甲醇水的相差很大,不知是怎么回事,望各位大侠知道的给提示一下
氨基柱和糖基柱分离分析糖的区别是什么?使用时有什么注意事项。
氨基酸分子中一定含有()。 A、氨基,羟基 B、羰基、羧基 C、氨基、醛基 D、氨基、羧基
使用HPLC测定VC时,使用氨基柱,但是VC峰面积会有很大的波动。查阅资料,羰基可能与氨基会发生类似希夫反应。但是烟酰胺也存在羰基,为什么在HPLC中,氨基柱的条件下是稳定的?希望有合适的解释能够解答VC峰面积的变化。
常用的氨基保护基1 叔丁氧羰基(tert-butoxycarbonyl) 缩写t-Boc 在以下条件稳定:H2/Pd或碱 除去条件: HBr+CH3COOH或CF3COOH2 苄氧羰基(carbobenzoxy) 缩写CBz 在以下条件稳定:CF3COOH或碱除去条件:HBr+CH3COOH或H2/Pd3 2-联苯基-2-丙氧羰基(2-biphenyl-2-propoxycarbonyl) 缩写BPoc 在以下条件稳定:碱除去条件:CF3COOH或HCOOH,CF3COOH或HBr4 邻苯二甲酰亚胺基(phthaloyl)在以下条件稳定:Na-NH3,H2/Ph,HCl或HBr+CH3COOH除去条件:NH2NH2-H2O5 对甲苯磺酰基(p-toluenesulfonyl) 缩写Tosyl 在以下条件稳定:HBr+CH3COOH或碱除去条件:Na-NH36 三苯甲基(triphenylmethyl) 缩写Trityl在以下条件稳定:碱除去条件:H2/Pd或CF3COOH(80%)7 甲酰基(formyl)在以下条件稳定:H2/Pd或Na-NH3除去条件:NH2NH2+醇+碱8 三氟乙酰基(trifluoroacetyl)在以下条件稳定:除去条件:温和碱性条件
现有基因重组表达的糖蛋白想进行以下几项委托检测, C端氨基酸测序、氨基酸组分分析、肽图、质谱分子量、糖基化分析如果有意者请联系,将样品要求、检测费用以及合作流程发到邮箱,如有疑问可以加qq联系。 qq:278569901 邮箱:wbz5102@gmail.com
[em09509]各位大虾,小弟用HPLC做邻氨基对叔丁基苯酚的分析,发现基本上只有一个峰,杂质基本上不出峰,大哥大姐们谁做过啊?能不能给个分析方法啊?或者有什么好的建议啊? 谢谢啊!!
我先介绍下我们实验室使用氨基柱的姻缘,早在两年前,领导突然要求检测制剂药品中门冬氨酸辅料的含量,于是乎从网上找了一篇文献是关于做门冬氨酸的,看了看色谱柱:氨基柱,没用过的新柱子;找供应商买了一款氨基柱(phenomenex家的),一开始由于没有经验,就只是把它当普通的色谱柱来用,用着用着发现,一个月用个2-3次,柱子就用坏了;然后就找厂家的技术支持要资料,自己也上网查资料,总结了一下氨基柱的使用与维护,现在分享给大家:我们实验室采购的是phenomenex LunaNH2氨基柱([color=#ff0000]色谱柱耐受pH 1.5-11.0[/color])(我想其他品牌的氨基柱应该是有相同的共性的,希望有用过的大家补充补充)1. 氨基柱是一款既可以正相使用,也可以反相使用,但是我们要注意到的是:正相溶剂和反相溶剂往往是不互溶的,正常情况新氨基柱出厂时保存在正相环境中,而Luna的 氨基柱查找说明书是保存在正己烷-乙腈(99:1)中。2. 如果大家是用于正相的体系:2.1 推荐先用正己烷-乙腈(99:1)以0.5ml/min的流速冲10倍柱体积,再根据流动相选用极性相近的氯仿或二氯甲烷以相同的流速冲10倍柱体积,最后换成你实验的流动相2.2 正相使用时,不宜分析含醛基、羰基的化合物,不可用于还原糖的分析;流动相要彻底脱气,并不得含有羰基化合物和过氧化物(质量不好的乙醚、四氢呋喃含有少量)2.3 [color=#ff0000]任何时候更换流动相时都要确保新流动相与柱子原保存液可互溶[/color]3. 如果大家用于反相的体系:3.1 由于新的氨基柱保存在正己烷-乙腈(99:1)中,与反相流动相是不互溶的,因此如果使用反相的方法,必须用至少10倍柱体积的异丙醇冲洗过渡(约2h,0.5mL/min),以除去正相保存溶液。过渡过程中注意因异丙醇粘度较大,会导致柱压很高,适当调低流速即可。3.2 再用至少10倍柱体积95%水-5%乙腈(或甲醇)冲洗(不含缓冲盐的流动相可省去)过渡,最后用流动相平衡。3.3 用完后洗柱时,必须先用95%水冲洗至少10倍柱体积,除去所用缓冲盐(不含缓冲盐的流动相可省去)。然后保存于乙腈/水(80:20)溶液([color=#ff0000]一个月内[/color])中。长期不用的话,建议用异丙醇保存[color=#ff0000](一个月以上)。[/color]3.4 新柱子一定要置换掉保存溶液,用异丙醇保存的柱子在使用前也需要花一定的时间给置换掉。3.5 反相条件下使用时,要特别注意控制pH值范围(根据你色谱柱耐受使用pH),pH值越低越有发生水解的危险,流动相中水的比例越高当然也越有发生水解的危险。3.6 还有一种情况是,当使用氨基柱进行酸性物质的分析时,酸性物质的存在意味着质子的存在,可能会使略带负电荷的氨基官能团质子化,导致使用一段时间后对于某些类的分析物保留性质有所改变或表现在柱效下降。---------建议用10-15倍的柱体积的为pH=11 NH3的乙腈-水(50:50)溶液冲洗该柱(冲洗后当然要再用不含碱的流动相洗去多余氨),之后再进行分析这类酸性分析物时建议在流动相中略微添加少许氨如0.1%。3.7 柱子再生:以0.5ml/min的流速用30倍柱体积的pH10.0的氨水或氢氧化钠水溶液冲柱子(注意pH值切不可超过11.0),立即用水(0.5ml/min的流速,30倍柱体积)冲洗,再乙腈/水(80:20)溶液冲洗保存。最后谈一下平衡的问题,我们用的最多的是反相体系,正相体系不是很清楚(见谅);一开始我们以为2-3小时就可以稳定了,其实不然,后来经过不断的折腾,发现至少12个小时,你的系统才能稳定下来(我们碰到过平衡时间不够,进了几十针标准品,样品出峰时间以0.02min/针的形式,从最初的12.8min漂移到15.2min)。希望对广大用氨基柱的论友们有所帮助!
1.氨基柱是同时可以用于正相条件和反相条件的,这一点很多用户都已经知道;但是要注意到的是:正相溶剂和反相溶剂往往是不互溶的,对这一点的忽略可能会带给使用者一些麻烦。 2.对于新购买到的柱子,首先请注意打开分析测试说明书,了解柱子的保存溶剂。如果保存溶剂与你将要使用的流动相极性不同不会互溶,请先用异丙醇过渡。过渡过程中注意因异丙醇粘度较大,会导致柱压很高,适当调低流速即可。如果要使用的流动相中还含有缓冲盐类,建议在用分析流动相之前,先用不含缓冲盐的同比例流动相过渡,这样可避免缓冲盐在分析柱内的析出。 3.氨基柱的使用: 需要注意的是,氨基柱的键合官能团氨丙基要比C18,C8柱的键合官能团C18,C8要容易水解,所以首先要做好其使用寿命稍逊的心理准备,特别是当你的使用条件是反相条件下时。反相条件下使用时,要特别注意控制PH值范围,PH值越低越有发生水解的危险,流动相中水的比例越高当然也越有发生水解的危险。所以,在使用后以及准备长时间放置该柱时,必要的清洗和将氨基柱保存于纯的有机溶剂中是很好的保养措施。 另外,氨基键合相在性质上与硅胶有很大的差异,主要是由于Si-OH基显酸性,而-NH2基显碱性的原因。在用水/乙腈为流动相是,可分离极性化合物,在酸性介质中氨基键合相表现为一弱阴离子交换剂。由于氨基具有形成氢键的能力,在水/乙腈作流动相是可分离单糖,双糖和多糖,这时所用的流动相好像是反相的,但由于流动相中水含量的增加使保留减少,所以是按正相方式分离的。有一种情况是,当使用氨基柱进行酸性物质如果汁的分析时(分析其中的糖份),酸性物质的存在意味着质子的存在,可能会使略带负电荷的氨基官能团质子化,导致使用一段时间后对于某些类的分析物保留性质有所改变或表现在柱效下降。这时,可以用5倍的柱体积的含0.5%NH3的50-50乙腈-水溶液冲洗该柱(冲洗后当然要再用不含碱的流动相洗去多余氨)。 需要特别注意的是,键合相中端基氨基易于氧化,易于与羰基化合物反应,因此在使用氨基键合相时,在流动相中和在样品中应不含羰基化合物。
氨基柱在[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]应用时,可在酸性水溶液中作为弱阴离子交换剂,用于分离酚、羧酸、核苷酸等。氨基用作反相固定相可与糖分子中羟基作用,用于分离糖的分离。但,一级胺能与醛、酮的羰基反应生成席夫碱,因此不能用胺基柱分析含羰基的化合物,如甾酮、还原糖等,而且分离时流动相也不能含有含羰基化合物,如丙酮。
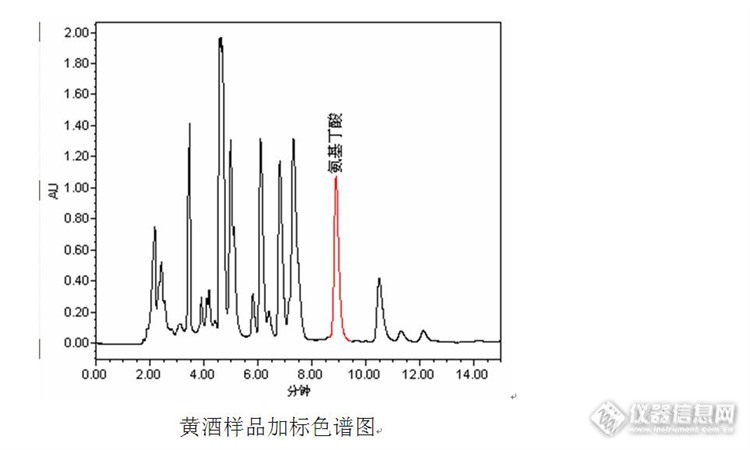
黄酒中γ-氨基丁酸含量测定的辛酸历程 近日实验室收到一批黄酒样品,该批黄酒是用发芽糙米为原料酿造而成,客户要求测定黄酒中的γ-氨基丁酸含量。由于之前实验室以丹磺酰氯为衍生试剂,建立了高效液相色谱法测定发芽糙米中γ-氨基丁酸含量的实验方法,并对实验方法的线性、精密度以及回收率进行了确认,均可以满足发芽糙米中γ-氨基丁酸含量测定要求,因此拿到黄酒样品后直接按照发芽糙米的前处理方法和色谱方法进行分析。链接如下:http://bbs.instrument.com.cn/shtml/20141226/5591256/。然而事与愿违,在测定的液相色谱图中压根就没有见到γ-氨基丁酸的色谱峰,反而在11.5min左右有个小的色谱峰,其峰高与发芽糙米中γ-氨基丁酸峰高有点相似,初步怀疑是保留时间发生了漂移,与发芽糙米样品色谱图对比后发现,在发芽糙米样品色谱图中该保留时间处也出现了一个相似的小峰,因此将该色谱峰是γ-氨基丁酸的可能性排除。http://ng1.17img.cn/bbsfiles/images/2014/12/201412311333_530568_1669358_3.jpghttp://ng1.17img.cn/bbsfiles/images/2014/12/201412311334_530570_1669358_3.jpg 原本该实验到此结束,准备将实验结果反馈给客户:黄酒中γ-氨基丁酸的检测结果为“未检出”。为了保证数据的准确性和可靠性,在黄酒样品中进行加标实验,结果在加标的色谱图中也未在相应的保留时间出峰,而且11.5min左右的色谱峰也没有增大,因此决定先将“未检出”的结果搁置,并对实验方法进行分析。 经过对样品前处理过程和色谱方法的分析,觉得可能造成加标样品中γ-氨基丁酸未检出的原因可能有:(1)保留时间漂移。由于流动相需要调节pH值,同时样品前处理过程中也涉及到酸、碱溶液的使用,怀疑是流动相或者样品pH的改变导致保留时间的漂移,从而未在原有的保留时间出现应有的色谱峰。然而重新配制流动相和前处理样品,加标样品测定结果依然是“未检出”,对比加标和不加标样品的色谱图,两者几乎一样,也没有峰面积或峰高变化明显的色谱峰;(2)衍生试剂失效。丹磺酰氯对光和湿敏感,不稳定,放置时间久了会生产二氯亚砜并继续分解成其他物质,影响其在有机溶剂中的溶解度,也会影响结果。可是为了排除衍生试剂的问题,重新打开一瓶刚购置不久的丹磺酰氯试剂,并重新试验,结果仍然不理想;(3)衍生条件控制不当。之前用相似的方法测定牛磺酸含量以及测定发芽糙米中γ-氨基丁酸含量时曾出现过衍生过程条件控制不当造成衍生不完全或者不能衍生的情况,可是与黄酒样品同一批处理的γ-氨基丁酸标准溶液和发芽糙米样品均能衍生成功,并正常出峰,为何唯独黄酒样品不出峰呢?在百思不得其解之际,看到同事在滴定黄酒中总酸,忽然间若有所悟:黄酒中的γ-氨基丁酸需要在碱性条件下才能与丹磺酰氯发生衍生反应,而黄酒是酸性介质,pH值一般在3~5之间,同时黄酒为酿造产物,对酸碱性具有一定的缓冲能力。http://ng1.17img.cn/bbsfiles/images/2014/12/201412311336_530572_1669358_3.jpg 通过比较发现:黄酒为酸性样品,缓冲能力较强,按照发芽糙米样品前处理方法直接加入0.5mL 碳酸钠(pH9.8)可能不能达到合适的衍生反应条件,最终导致黄酒样品中γ-氨基丁酸“未检出”。 找到问题后调整实验方案,先将黄酒样品调整至中性,然后再按照发芽糙米样品方法进行前处理。调整实验方案后,黄酒样品中γ-氨基丁酸测定的色谱图如下图。从色谱图中可以发现,经过实验方案的调整黄酒样品中检出了γ-氨基丁酸的存在。http://ng1.17img.cn/bbsfiles/images/2014/12/201412311337_530573_166
氨基柱的使用和保养氨基柱是同时可以用于正相条件和反相条件的这一点很多用户都已经知道;但是要注意到的是:正相溶剂和反相溶剂往往是不互溶的,对这一点的忽略可能会带给使用者一些麻对于新购买到的柱子,首先请注意打开分析测试说明书,了解柱子的保存溶剂。如果保存溶剂与你将要使用的流动相极性不同不会互溶,请先用异丙醇过渡。过渡过程中注意因异丙醇粘度较大,会导致柱压很高,适当调低流速即可。如果要使用的流动相中还含有缓冲盐类,建议在用分析流动相之前,先用不含缓冲盐的同比例流动相过渡,这样可避免缓冲盐在分析柱内的析出。柱效检测:我用于判断一个用户是否有经验的指标之一,是用户是否习惯配制一些柱效检测标准溶液。说到柱效检测,我可以向大家提供一个方法,而且很通用,你也可以用同样的标准溶液和流动相来检测硅胶柱和氰基柱。流动相:0%乙酸乙酯+90%正己烷 流速1.0标准溶液:乙苯(如乙苯找不动就用甲苯代替呗)+苯甲酸甲酯检测波长:254nm这个方法特别适用于新购柱子(新购柱子往往保存在正相溶剂中)时即进行检测,如有问题,可及时与供应商沟通。也适合在柱子在准备放置相当长一段时间之前进行充分清洗后进行检测作为记录留档。在平常的使用过程中,如果分析物是固定重复的,我们当然可以从对分析物的分离分析情况来作出判断;但如果分析物和分析条件不同时,定期检测柱效可以避免柱效下降导致分离不佳再分析查找原因这样浪费人力物力的过程。不过特别要注意的是,当氨基柱(或氰基柱)在反相条件中使用时,如用该条件检测,请注意流动相的换相过渡问题。 氨基柱的使用:需要注意的是,氨基柱的键合官能团氨丙基要比C18,C8柱的键合官能团C18,C8要容易水解,所以首先要做好其使用寿命稍逊的心理准备,特别是当你的使用条件是反相条件下时。反相条件下使用时,要特别注意控制PH值范围,PH值越低越有发生水解的危险,流动相中水的比例越高当然也越有发生水解的危险。所以,在使用后以及准备长时间放置该柱时,必要的清洗和将氨基柱保存于纯的有机溶剂中是很好的保养措施。有一种情况是,当使用氨基柱进行酸性物质如果汁的分析时(分析其中的糖份),酸性物质的存在意味着质子的存在,可能会使略带负电荷的氨基官能团质子化,导致使用一段时间后对于某些类的分析物保留性质有所改变或表现在柱效下降。这时,Kromasil专家所给的建议是:用5-10倍的柱体积的含0.5-1.0%NH3的50-50乙腈-水溶液冲洗该柱(冲洗后当然要再用不含碱的流动相洗去多余氨),之后再进行分析这类酸性分析物时建议在流动相中略微添加少许氨如0.1%。氨基柱的清洗简单说起来,正相条件下使用的氨基柱你就参照硅胶柱的清洗方法;反相条件下使用的氨基柱你就参照C18的清洗方法。平时在正相条件下使用:首先用50倍柱体积的异丙醇清洗,因异丙醇粘度较大可适当放低流速;之后,用50倍的甲醇清洗;之后,用异丙醇过渡回到平常使用的正相流动相,即可。平时在反相条件下使用:缓冲盐应及时冲洗,以及不能直接用纯甲醇冲洗缓冲盐等,属常识就不作特别交待了。用50倍纯甲醇冲洗;之后,用异丙醇过渡后,用二氯甲烷冲洗色谱柱;之后,再用异丙醇过渡回来到甲醇条件下。这些清洗方法,主要是针对当样品中有杂质逐步吸附累积到填料上时的处理方法,色谱柱表现行为为诸如柱压增高柱效降低等Ultimate氨基柱的使用方法1.氨基柱既可以正相使用,也可以反相使用,但是要注意到的是:正相溶剂和反相溶剂往往是不互溶的,正常情况新氨基柱保存在正相环境中,例如LUNA 氨基柱保存在正己烷-乙腈(99:1)中。2. 正相使用2.1 新柱子可直接用流动相。推荐先用正己烷-乙腈(99:1)以0.5ml/min的流速冲10倍柱体积,再根据流动相选用极性相近的氯仿或二氯甲烷以相同的流速冲10倍柱体积,最后换成流动相。2.2 正相使用时,不宜分析含醛基、羰基的化合物,不可用于还原糖的分析;流动相要彻底脱气,并不得含有羰基化合物和过氧化物(质量不好的乙醚、四氢呋喃含有少量)。2.3 任何时候更换流动相时都要确保新流动相与柱子原保存液可互溶。3 反相使用3.1 先用正己烷-乙腈(99:1)以0.5ml/min的流速冲10倍柱体积,再依次以相同的流速相同的用量用氯仿、异丙醇、甲醇、甲醇-水(50:50)冲柱子。3.2 以0.5ml/min的流速用30倍柱体积的pH11.0的氢氧化钠(LUNA)水溶液冲柱子(注意pH值切不可超过11.0),立即用水(0.5ml/min的流速,30倍柱体积)冲洗,再换成流动相。3.3 配制流动相时,应各组分分别量取,比例较小的组分要精密量取,需调pH值时要精密到0.1。3.4 反相条件下使用时,要特别注意控制pH值范围,pH值越低越有发生水解的危险,流动相中水的比例越高当然也越有发生水解的危险。最理想的pH范围在pH 3.0-7.03.5 如果要使用的流动相中还含有缓冲盐类,建议在用分析流动相之前,先用不含缓冲盐的同比例流动相过渡,这样可避免缓冲盐在分析柱内的析出。3.6 有一种情况是,当使用氨基柱进行酸性物质的分析时,酸性物质的存在意味着质子的存在,可能会使略带负电荷的氨基官能团质子化,导致使用一段时间后对于某些类的分析物保留性质有所改变或表现在柱效下降。建议:用5-10倍的柱体积的含0.5-1.0%NH3的乙腈-水(50:50)溶液冲洗该柱(冲洗后当然要再用不含碱的流动相洗去多余氨),之后再进行分析这类酸性分析物时建议在流动相中略微添加少许氨如0.1%。4 色谱柱的冲洗:简单说起来,正相条件下使用的氨基柱就参照硅胶柱的清洗方法;反相条件下使用的氨基柱就参照C18的清洗方法。5 色谱柱的保存5.1 正相使用时,将柱子冲洗干净后,用正己烷-乙腈(99:1)保存。5.2 反相使用时,如短期不用,可用甲醇或乙腈保存;长期不用时需将甲醇依次用异丙醇、氯仿置换,最后用正己烷保存。6 色谱柱的再生6.1 方案1:依次用甲醇、异丙醇、氯仿、正己烷、氯仿、异丙醇、甲醇冲柱子(各以0.5ml/min的流速,20倍柱体积),再换流动相。这些清洗方法,主要是针对当样品中有杂质逐步吸附累积到填料上时的处理方法,色谱柱表现行为为诸如柱压增高柱效降低等。6.2 方案2:NH2柱用于反相条件时,NH2键会水解,尤其是在该柱子pH范围以外,在极端酸性和碱性条件下柱寿命会下降很快,如果在这个条件下使用需要清洗一下,需要用10倍柱体积溶液冲洗,如下:95%水/5%乙腈THF四氢呋喃95%乙腈/5%水并保持95%乙腈/5%水继续冲洗,以低流速0.2-0.5mL/min过夜冲洗。6.3 方案3:柱子使用一定时间后,柱效下降,老化,也可清洗一下柱子恢复柱性能,清洗时依次用10倍柱体积的下列溶液冲洗:95%水/5%乙腈THF四氢呋喃95%乙腈/5%水再走流动相即可
苯丙氨酸的boc氨基保护,除了生成N-boc苯丙氨酸,还生成什么?是二氧化碳和叔丁醇吗?
[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]测氨基丁酸的文献
氨基柱是同时可以用于正相条件和反相条件的这一点很多用户都已经知道;但是要注意到的是:正相溶剂和反相溶剂往往是不互溶的,对这一点的忽略可能会带给使用者一些麻烦。对于新购买到的柱子,首先请注意打开分析测试说明书,了解柱子的保存溶剂。如果保存溶剂与你将要使用的流动相极性不同不会互溶,请先用异丙醇过渡。过渡过程中注意因异丙醇粘度较大,会导致柱压很高,适当调低流速即可。如果要使用的流动相中还含有缓冲盐类,建议在用分析流动相之前,先用不含缓冲盐的同比例流动相过渡,这样可避免缓冲盐在分析柱内的析出。柱效检测:我用于判断一个用户是否有经验的指标之一,是用户是否习惯配制一些柱效检测标准溶液。说到柱效检测,我可以向大家提供一个方法,而且很通用,你也可以用同样的标准溶液和流动相来检测硅胶柱和氰基柱。流动相:10%乙酸乙酯+90%正己烷 流速1.0标准溶液:乙苯(如乙苯找不动就用甲苯代替呗)+苯甲酸甲酯检测波长254nm这个方法特别适用于新购柱子(新购柱子往往保存在正相溶剂中)时即进行检测,如有问题,可及时与供应商沟通。也适合在柱子在准备放置相当长一段时间之前进行充分清洗后进行检测作为记录留档。在平常的使用过程中,如果分析物是固定重复的,我们当然可以从对分析物的分离分析情况来作出判断;但如果分析物和分析条件不同时,定期检测柱效可以避免柱效下降导致分离不佳再分析查找原因这样浪费人力物力的过程。不过特别要注意的是,当氨基柱(或氰基柱)在反相条件中使用时,如用该条件检测,请注意流动相的换相过渡问题。氨基柱的使用:需要注意的是,氨基柱的键合官能团氨丙基要比C18,C8柱的键合官能团C18,C8要容易水解,所以首先要做好其使用寿命稍逊的心理准备,特别是当你的使用条件是反相条件下时。反相条件下使用时,要特别注意控制PH值范围,PH值越低越有发生水解的危险,流动相中水的比例越高当然也越有发生水解的危险。所以,在使用后以及准备长时间放置该柱时,必要的清洗和将氨基柱保存于纯的有机溶剂中是很好的保养措施。有一种情况是,当使用氨基柱进行酸性物质如果汁的分析时(分析其中的糖份),酸性物质的存在意味着质子的存在,可能会使略带负电荷的氨基官能团质子化,导致使用一段时间后对于某些类的分析物保留性质有所改变或表现在柱效下降。这时,Kromasil专家所给的建议是:用5-10倍的柱体积的含0.5- 1.0%NH3的50-50乙腈-水溶液冲洗该柱(冲洗后当然要再用不含碱的流动相洗去多余氨),之后再进行分析这类酸性分析物时建议在流动相中略微添加少许氨如0.1%。氨基柱的清洗简单说起来,正相条件下使用的氨基柱你就参照硅胶柱的清洗方法;反相条件下使用的氨基柱你就参照C18的清洗方法。平时在正相条件下使用:首先用50倍柱体积的异丙醇清洗,因异丙醇粘度较大可适当放低流速;之后,用50倍的甲醇清洗;之后,用异丙醇过渡回到平常使用的正相流动相,即可。平时在反相条件下使用:缓冲盐应及时冲洗,以及不能直接用纯甲醇冲洗缓冲盐等,属常识就不作特别交待了。用50倍纯甲醇冲洗;之后,用异丙醇过渡后,用二氯甲烷冲洗色谱柱;之后,再用异丙醇过渡回来到甲醇条件下。这些清洗方法,主要是针对当样品中有杂质逐步吸附累积到填料上时的处理方法,色谱柱表现行为为诸如柱压增高柱效降低等LUNA氨基柱的使用方法1.氨基柱既可以正相使用,也可以反相使用,但是要注意到的是:正相溶剂和反相溶剂往往是不互溶的,正常情况新氨基柱保存在正相环境中,例如LUNA氨基柱保存在正己烷-乙腈(99:1)中。2. 正相使用2.1新柱子可直接用流动相。推荐先用正己烷-乙腈(99:1)以0.5ml/min的流速冲10倍柱体积,再根据流动相选用极性相近的氯仿或二氯甲烷以相同的流速冲10倍柱体积,最后换成流动相。2.1正相使用时,不宜分析含醛基、羰基的化合物,不可用于还原糖的分析;流动相要彻底脱气,并不得含有羰基化合物和过氧化物(质量不好的乙醚、四氢呋喃含有少量)。2.3 任何时候更换流动相时都要确保新流动相与柱子原保存液可互溶。3 反相使用3.1先用正己烷-乙腈(99:1)以0.5ml/min的流速冲10倍柱体积,再依次以相同的流速相同的用量用氯仿、异丙醇、甲醇、甲醇-水(50:50)冲柱子。3.2以0.5ml/min的流速用30倍柱体积的pH11.0的氢氧化钠(LUNA)水溶液冲柱子(注意pH值切不可超过11.0),立即用水(0.5ml/min的流速,30倍柱体积)冲洗,再换成流动相。3.3 配制流动相时,应各组分分别量取,比例较小的组分要精密量取,需调pH值时要精密到0.1。3.4反相条件下使用时,要特别注意控制pH值范围,pH值越低越有发生水解的危险,流动相中水的比例越高当然也越有发生水解的危险。最理想的pH范围在pH3.0-7.03.5如果要使用的流动相中还含有缓冲盐类,建议在用分析流动相之前,先用不含缓冲盐的同比例流动相过渡,这样可避免缓冲盐在分析柱内的析出。3.6有一种情况是,当使用氨基柱进行酸性物质的分析时,酸性物质的存在意味着质子的存在,可能会使略带负电荷的氨基官能团质子化,导致使用一段时间后对于某些类的分析物保留性质有所改变或表现在柱效下降。建议:用5-10倍的柱体积的含0.5-1.0%NH3的乙腈-水(50:50)溶液冲洗该柱(冲洗后当然要再用不含碱的流动相洗去多余氨),之后再进行分析这类酸性分析物时建议在流动相中略微添加少许氨如0.1%。4色谱柱的冲洗:简单说起来,正相条件下使用的氨基柱就参照硅胶柱的清洗方法;反相条件下使用的氨基柱就参照C18的清洗方法。5 色谱柱的保存5.1 正相使用时,将柱子冲洗干净后,用正己烷-乙腈(99:1)保存。5.2反相使用时,如短期不用,可用甲醇或乙腈保存;长期不用时需将甲醇依次用异丙醇、氯仿置换,最后用正己烷保存。6 色谱柱的再生6.1 方案1:依次用甲醇、异丙醇、氯仿、正己烷、氯仿、异丙醇、甲醇冲柱子(各以0.5ml/min的流速,20倍柱体积),再换流动相。这些清洗方法,主要是针对当样品中有杂质逐步吸附累积到填料上时的处理方法,色谱柱表现行为为诸如柱压增高柱效降低等。6.2方案2:NH2柱用于反相条件时,NH2键会水解,尤其是在该柱子pH范围以外,在极端酸性和碱性条件下柱寿命会下降很快,如果在这个条件下使用需要清洗一下,需要用10倍柱体积溶液冲洗,如下:95%水/5%乙腈THF四氢呋喃95%乙腈/5%水并保持95%乙腈/5%水继续冲洗,以低流速0.2-0.5mL/min过夜冲洗。6.3方案3:柱子使用一定时间后,柱效下降,老化,也可清洗一下柱子恢复柱性能,清洗时依次用10倍柱体积的下列溶液冲洗:95%水/5%乙腈THF四氢呋喃95%乙腈/5%水再走流动相即可
氨基柱是同时可以用于正相条件和反相条件的这一点很多用户都已经知道;但是要注意到的是:正相溶剂和反相溶剂往往是不互溶的,对这一点的忽略可能会带给使用者一些麻烦。对于新购买到的柱子,首先请注意打开分析测试说明书,了解柱子的保存溶剂。如果保存溶剂与你将要使用的流动相极性不同不会互溶,请先用异丙醇过渡。过渡过程中注意因异丙醇粘度较大,会导致柱压很高,适当调低流速即可。如果要使用的流动相中还含有缓冲盐类,建议在用分析流动相之前,先用不含缓冲盐的同比例流动相过渡,这样可避免缓冲盐在分析柱内的析出。柱效检测:我用于判断一个用户是否有经验的指标之一,是用户是否习惯配制一些柱效检测标准溶液。说到柱效检测,我可以向大家提供一个方法,而且很通用,你也可以用同样的标准溶液和流动相来检测硅胶柱和氰基柱。流动相:10%乙酸乙酯+90%正己烷 流速1.0标准溶液:乙苯(如乙苯找不动就用甲苯代替呗)+苯甲酸甲酯检测波长254nm这个方法特别适用于新购柱子(新购柱子往往保存在正相溶剂中)时即进行检测,如有问题,可及时与供应商沟通。也适合在柱子在准备放置相当长一段时间之前进行充分清洗后进行检测作为记录留档。在平常的使用过程中,如果分析物是固定重复的,我们当然可以从对分析物的分离分析情况来作出判断;但如果分析物和分析条件不同时,定期检测柱效可以避免柱效下降导致分离不佳再分析查找原因这样浪费人力物力的过程。不过特别要注意的是,当氨基柱(或氰基柱)在反相条件中使用时,如用该条件检测,请注意流动相的换相过渡问题。 氨基柱的使用:需要注意的是,氨基柱的键合官能团氨丙基要比C18,C8柱的键合官能团C18,C8要容易水解,所以首先要做好其使用寿命稍逊的心理准备,特别是当你的使用条件是反相条件下时。反相条件下使用时,要特别注意控制PH值范围,PH值越低越有发生水解的危险,流动相中水的比例越高当然也越有发生水解的危险。所以,在使用后以及准备长时间放置该柱时,必要的清洗和将氨基柱保存于纯的有机溶剂中是很好的保养措施。有一种情况是,当使用氨基柱进行酸性物质如果汁的分析时(分析其中的糖份),酸性物质的存在意味着质子的存在,可能会使略带负电荷的氨基官能团质子化,导致使用一段时间后对于某些类的分析物保留性质有所改变或表现在柱效下降。这时,Kromasil专家所给的建议是:用5-10倍的柱体积的含0.5-1.0%NH3的50-50乙腈-水溶液冲洗该柱(冲洗后当然要再用不含碱的流动相洗去多余氨),之后再进行分析这类酸性分析物时建议在流动相中略微添加少许氨如0.1%。氨基柱的清洗简单说起来,正相条件下使用的氨基柱你就参照硅胶柱的清洗方法;反相条件下使用的氨基柱你就参照C18的清洗方法。平时在正相条件下使用:首先用50倍柱体积的异丙醇清洗,因异丙醇粘度较大可适当放低流速;之后,用50倍的甲醇清洗;之后,用异丙醇过渡回到平常使用的正相流动相,即可。平时在反相条件下使用:缓冲盐应及时冲洗,以及不能直接用纯甲醇冲洗缓冲盐等,属常识就不作特别交待了。用50倍纯甲醇冲洗;之后,用异丙醇过渡后,用二氯甲烷冲洗色谱柱;之后,再用异丙醇过渡回来到甲醇条件下。这些清洗方法,主要是针对当样品中有杂质逐步吸附累积到填料上时的处理方法,色谱柱表现行为为诸如柱压增高柱效降低等LUNA氨基柱的使用方法1. 氨基柱既可以正相使用,也可以反相使用,但是要注意到的是:正相溶剂和反相溶剂往往是不互溶的,正常情况新氨基柱保存在正相环境中,例如LUNA 氨基柱保存在正己烷-乙腈(99:1)中。2. 正相使用2.1 新柱子可直接用流动相。推荐先用正己烷-乙腈(99:1)以0.5ml/min的流速冲10倍柱体积,再根据流动相选用极性相近的氯仿或二氯甲烷以相同的流速冲10倍柱体积,最后换成流动相。2.2 正相使用时,不宜分析含醛基、羰基的化合物,不可用于还原糖的分析;流动相要彻底脱气,并不得含有羰基化合物和过氧化物(质量不好的乙醚、四氢呋喃含有少量)。2.3 任何时候更换流动相时都要确保新流动相与柱子原保存液可互溶。3 反相使用3.1 先用正己烷-乙腈(99:1)以0.5ml/min的流速冲10倍柱体积,再依次以相同的流速相同的用量用氯仿、异丙醇、甲醇、甲醇-水(50:50)冲柱子。3.2 以0.5ml/min的流速用30倍柱体积的pH11.0的氢氧化钠(LUNA)水溶液冲柱子(注意pH值切不可超过11.0),立即用水( 0.5ml/min的流速,30倍柱体积)冲洗,再换成流动相。3.3 配制流动相时,应各组分分别量取,比例较小的组分要精密量取,需调pH值时要精密到0.1。3.4 反相条件下使用时,要特别注意控制pH值范围,pH值越低越有发生水解的危险,流动相中水的比例越高当然也越有发生水解的危险。最理想的pH范围在pH 3.0-7.03.5 如果要使用的流动相中还含有缓冲盐类,建议在用分析流动相之前,先用不含缓冲盐的同比例流动相过渡,这样可避免缓冲盐在分析柱内的析出。3.6 有一种情况是,当使用氨基柱进行酸性物质的分析时,酸性物质的存在意味着质子的存在,可能会使略带负电荷的氨基官能团质子化,导致使用一段时间后对于某些类的分析物保留性质有所改变或表现在柱效下降。建议:用5-10倍的柱体积的含0.5-1.0%NH3的乙腈-水(50:50)溶液冲洗该柱(冲洗后当然要再用不含碱的流动相洗去多余氨),之后再进行分析这类酸性分析物时建议在流动相中略微添加少许氨如0.1%。4 色谱柱的冲洗:简单说起来,正相条件下使用的氨基柱就参照硅胶柱的清洗方法;反相条件下使用的氨基柱就参照C18的清洗方法。5 色谱柱的保存 5.1 正相使用时,将柱子冲洗干净后,用正己烷-乙腈(99:1)保存。5.2 反相使用时,如短期不用,可用甲醇或乙腈保存;长期不用时需将甲醇依次用异丙醇、氯仿置换,最后用正己烷保存。6 色谱柱的再生6.1 方案1:依次用甲醇、异丙醇、氯仿、正己烷、氯仿、异丙醇、甲醇冲柱子(各以0.5ml/min的流速,20倍柱体积),再换流动相。这些清洗方法,主要是针对当样品中有杂质逐步吸附累积到填料上时的处理方法,色谱柱表现行为为诸如柱压增高柱效降低等。6.2 方案2:NH2柱用于反相条件时,NH2键会水解,尤其是在该柱子pH范围以外,在极端酸性和碱性条件下柱寿命会下降很快,如果在这个条件下使用需要清洗一下,需要用10倍柱体积溶液冲洗,如下:95%水/5%乙腈THF四氢呋喃95%乙腈/5%水并保持95%乙腈/5%水继续冲洗,以低流速0.2-0.5mL/min过夜冲洗。6.3 方案3:柱子使用一定时间后,柱效下降,老化,也可清洗一下柱子恢复柱性能,清洗时依次用10倍柱体积的下列溶液冲洗:95%水/5%乙腈THF四氢呋喃95%乙腈/5%水再走流动相即可
有没有试用氨基柱的同仁啊?最近我买了跟国产的氨基柱做糖,流动相为乙腈:水=65:35,各个组分保留时间老是不稳定,而且呈有规律的变化。变化规律为每一次进样都比前一次进样晚出峰0.5min左右。各位老大,谁能帮忙解释一下啊???????
由于实验的需要,需要液体样中引入氨,后来通过旋蒸尽量的除去了氨气,但还是有部分残留使样品的PH保持在8.0左右,请问:这会不会影响氨基态氮的滴定 ?我个人认为是不影响的,想听听大家的看法!
有人做过2氨基丁酸的衍生吗?求助
氨基柱是同时可以用于正相条件和反相条件的这一点很多用户都已经知道;但是要注意到的是:正相溶剂和反相溶剂往往是不互溶的,对这一点的忽略可能会带给使用者一些麻烦。 对于新购买到的柱子,首先请注意打开分析测试说明书,了解柱子的保存溶剂。如果保存溶剂与你将要使用的流动相极性不同不会互溶,请先用异丙醇过渡。过渡过程中注意因异丙醇粘度较大,会导致柱压很高,适当调低流速即可。如果要使用的流动相中还含有缓冲盐类,建议在用分析流动相之前,先用不含缓冲盐的同比例流动相过渡,这样可避免缓冲盐在分析柱内的析出。 柱效检测: 我用于判断一个用户是否有经验的指标之一,是用户是否习惯配制一些柱效检测标准溶液。说到柱效检测,我可以向大家提供一个方法,而且很通用,你也可以用同样的标准溶液和流动相来检测硅胶柱和氰基柱。 流动相: 10%乙酸乙酯+90%正己烷 流速1.0 标准溶液: 乙苯(如乙苯找不动就用甲苯代替呗)+苯甲酸甲酯 检测波长254nm 这个方法特别适用于新购柱子(新购柱子往往保存在正相溶剂中)时即进行检测,如有问题,可及时与供应商沟通。也适合在柱子在准备放置相当长一段时间之前进行充分清洗后进行检测作为记录留档。在平常的使用过程中,如果分析物是固定重复的,我们当然可以从对分析物的分离分析情况来作出判断;但如果分析物和分析条件不同时,定期检测柱效可以避免柱效下降导致分离不佳再分析查找原因这样浪费人力物力的过程。不过特别要注意的是,当氨基柱(或氰基柱)在反相条件中使用时,如用该条件检测,请注意流动相的换相过渡问题。 氨基柱的使用: 需要注意的是,氨基柱的键合官能团氨丙基要比C18,C8柱的键合官能团C18,C8要容易水解,所以首先要做好其使用寿命稍逊的心理准备,特别是当你的使用条件是反相条件下时。 反相条件下使用时,要特别注意控制PH值范围,PH值越低越有发生水解的危险,流动相中水的比例越高当然也越有发生水解的危险。所以,在使用后以及准备长时间放置该柱时,必要的清洗和将氨基柱保存于纯的有机溶剂中是很好的保养措施。 有一种情况是,当使用氨基柱进行酸性物质如果汁的分析时(分析其中的糖份),酸性物质的存在意味着质子的存在,可能会使略带负电荷的氨基官能团质子化,导致使用一段时间后对于某些类的分析物保留性质有所改变或表现在柱效下降。这时,Kromasil专家所给的建议是:用5-10倍的柱体积的含0.5-1.0%NH3的50-50乙腈-水溶液冲洗该柱(冲洗后当然要再用不含碱的流动相洗去多余氨),之后再进行分析这类酸性分析物时建议在流动相中略微添加少许氨如0.1%。 氨基柱的清洗 简单说起来,正相条件下使用的氨基柱你就参照硅胶柱的清洗方法;反相条件下使用的氨基柱你就参照C18的清洗方法。 平时在正相条件下使用: 首先用50倍柱体积的异丙醇清洗,因异丙醇粘度较大可适当放低流速;之后,用50倍的甲醇清洗;之后,用异丙醇过渡回到平常使用的正相流动相,即可。 平时在反相条件下使用: 缓冲盐应及时冲洗,以及不能直接用纯甲醇冲洗缓冲盐等,属常识就不作特别交待了。 用50倍纯甲醇冲洗;之后,用异丙醇过渡后,用二氯甲烷冲洗色谱柱;之后,再用异丙醇过渡回来到甲醇条件下。 这些清洗方法,主要是针对当样品中有杂质逐步吸附累积到填料上时的处理方法,色谱柱表现行为为诸如柱压增高柱效降低等 LUNA氨基柱的使用方法 1. 氨基柱既可以正相使用,也可以反相使用,但是要注意到的是:正相溶剂和反相溶剂往往是不互溶的,正常情况新氨基柱保存在正相环境中,例如LUNA 氨基柱保存在正己烷-乙腈(99:1)中。 2. 正相使用 2.1 新柱子可直接用流动相。推荐先用正己烷-乙腈(99:1)以0.5ml/min的流速冲10倍柱体积,再根据流动相选用极性相近的氯仿或二氯甲烷以相同的流速冲10倍柱体积,最后换成流动相。 2.1 正相使用时,不宜分析含醛基、羰基的化合物,不可用于还原糖的分析;流动相要彻底脱气,并不得含有羰基化合物和过氧化物(质量不好的乙醚、四氢呋喃含有少量)。 2.3 任何时候更换流动相时都要确保新流动相与柱子原保存液可互溶。 3 反相使用 3.1 先用正己烷-乙腈(99:1)以0.5ml/min的流速冲10倍柱体积,再依次以相同的流速相同的用量用氯仿、异丙醇、甲醇、甲醇-水(50:50)冲柱子。 3.2 以0.5ml/min的流速用30倍柱体积的pH11.0的氢氧化钠(LUNA)水溶液冲柱子(注意pH值切不可超过11.0),立即用水( 0.5ml/min的流速,30倍柱体积)冲洗,再换成流动相。 3.3 配制流动相时,应各组分分别量取,比例较小的组分要精密量取,需调pH值时要精密到0.1。 3.4 反相条件下使用时,要特别注意控制pH值范围,pH值越低越有发生水解的危险,流动相中水的比例越高当然也越有发生水解的危险。最理想的pH范围在pH 3.0-7.0 3.5 如果要使用的流动相中还含有缓冲盐类,建议在用分析流动相之前,先用不含缓冲盐的同比例流动相过渡,这样可避免缓冲盐在分析柱内的析出。 3.6 有一种情况是,当使用氨基柱进行酸性物质的分析时,酸性物质的存在意味着质子的存在,可能会使略带负电荷的氨基官能团质子化,导致使用一段时间后对于某些类的分析物保留性质有所改变或表现在柱效下降。建议:用5-10倍的柱体积的含0.5-1.0%NH3的乙腈-水(50:50)溶液冲洗该柱(冲洗后当然要再用不含碱的流动相洗去多余氨),之后再进行分析这类酸性分析物时建议在流动相中略微添加少许氨如0.1%。 4 色谱柱的冲洗:简单说起来,正相条件下使用的氨基柱就参照硅胶柱的清洗方法;反相条件下使用的氨基柱就参照C18的清洗方法。 5 色谱柱的保存 5.1 正相使用时,将柱子冲洗干净后,用正己烷-乙腈(99:1)保存。 5.2 反相使用时,如短期不用,可用甲醇或乙腈保存;长期不用时需将甲醇依次用异丙醇、氯仿置换,最后用正己烷保存。 6 色谱柱的再生 6.1 方案1:依次用甲醇、异丙醇、氯仿、正己烷、氯仿、异丙醇、甲醇冲柱子(各以 0.5ml/min的流速,20倍柱体积),再换流动相。这些清洗方法,主要是针对当样品中有杂质逐步吸附累积到填料上时的处理方法,色谱柱表现行为为诸如柱压增高柱效降低等。 6.2 方案2:NH2柱用于反相条件时,NH2键会水解,尤其是在该柱子pH范围以外,在极端酸性和碱性条件下柱寿命会下降很快,如果在这个条件下使用需要清洗一下,需要用10倍柱体积溶液冲洗,如下: 95%水/5%乙腈 THF四氢呋喃 95%乙腈/5%水 并保持95%乙腈/5%水继续冲洗,以低流速0.2-0.5mL/min过夜冲洗。 6.3 方案3:柱子使用一定时间后,柱效下降,老化,也可清洗一下柱子恢复柱性能,清洗时依次用10倍柱体积的下列溶液冲洗: 95%水/5%乙腈 THF四氢呋喃 95%乙腈/5%水 再走流动相即可
请问各位大侠用GCMS可以分析氨基树脂中的成分吗,例如其中氨基树脂的含量占百分之几,甲醇占百分之几,异丁醇占百分之几,
有哪位高人测过γ-氨基丁酸,我查到的标准是QB/T4587-2013,具体操作中,有哪位高人做过,帮忙指导一下,有哪些注意的,谢谢
[color=#444444][color=#444444]我想检测某种果蔬中的全部氨基酸含量和种类,查询了有好多种方法。请问有大神知道哪种方法比较好,考虑的有用液相(但是没有氨基酸专用分析柱),氨基酸自动分析仪,高效液相色谱-质谱联用,求大神指导[/color][/color]
二氧化硫甲醛吸收液中, 氨基磺酸和氨磺酸 一样吗? 氨基磺酸能代替氨磺酸吗?
现在做环境空气的氮氧化物实验,根据HJ479-2009中规定,对氨基苯磺酸溶解于200mL40到50度的热水中,请问大家做这一步时,药品都能溶解吗?我通常把水烧到50度,也不能充分溶解所有的对氨基苯磺酸,而且发现如果在溶解时,断断续续的加热,配出的显色液会变成淡红色。求大神分析下该怎么操作?还有就是,我配置的显色液并没有规范中说的在25摄氏度,暗处保存可稳定三个月,感觉过上1个星期,空白值就会越来越高。
最近准备做氨基甲酸乙酯,用之前的标准品,用之前的方法做不出峰来,用1ppm的全扫也不出峰之前是同事做的,不知道不出峰会是什么原因?是标准品不稳定分解掉了,还是现在仪器状态不如以前了?有没有做过氨基甲酸乙酯的朋友,请多多指教!谢谢
我以前搞过段时间食品中氨基酸分析,以下是一点自己的笔记。供参考。由于涉及到了一些公司的内容。所以,我不敢透露更具体的。理解。主要样品:含脂肪的肉汤,肉块等。氨基酸分析测试室使用安捷伦1100系列HPLC仪器,通过柱前衍生法分析氨基酸。我司提供食品,保健品,饲料等游离和水解氨基酸含量测试。仪器配置和原理:四元泵梯度切换——自动进样器——柱——紫外检测器——记录仪自动进样器是通过吸取OPA(邻苯二醛)和FMOC-Cl加入样品和标准品中,使样品和标准品中的氨基酸接上荧光基团,在分析柱中分离,后用荧光检测器检测。荧光法检测精度高,检测限低。样品前处理原理和操做步骤:游离氨基酸前处理原理:通过使用三氯乙酸溶液作为蛋白质变性剂,沉淀蛋白质,而不破坏溶液中氨基酸。与公司前处理比较:公司使用热水浴提取固体或液体样品。该方法不能有效地去处样品中(汤,肉等)蛋白质,致使样品中蛋白质悬浮于样品中,污染色谱柱,仪器。由于样品处理简单,对于复杂样品可能提取效率稍差。大致操作步骤:称样——10%三氯乙酸定容——放置——滤过——离心方法优点:能有效去处蛋白质,而不破坏样品中氨基酸。水解氨基酸原理:分析蛋白质或多肽氨基酸组成,需将各肽键裂解为游离氨基酸。一般使用强酸或强碱。本次学习是使用6mol/L盐酸消解,提取。操作步骤:称样于消解管——加盐酸——抽真空——封口——烘箱消解——定容——蒸干——加水溶解——离心——上样分析
滴定保护氨基酸?
请教滴定保护氨基酸的方法?
氨基柱是同时可以用于正相条件和反相条件的这一点很多用户都已经知道;但是要注意到的是:正相溶剂和反相溶剂往往是不互溶的,对这一点的忽略可能会带给使用者一些麻烦。 对于新购买到的柱子,首先请注意打开分析测试说明书,了解柱子的保存溶剂。如果保存溶剂与你将要使用的流动相极性不同不会互溶,请先用异丙醇过渡。过渡过程中注意因异丙醇粘度较大,会导致柱压很高,适当调低流速即可。如果要使用的流动相中还含有缓冲盐类,建议在用分析流动相之前,先用不含缓冲盐的同比例流动相过渡,这样可避免缓冲盐在分析柱内的析出。 柱效检测: 我用于判断一个用户是否有经验的指标之一,是用户是否习惯配制一些柱效检测标准溶液。说到柱效检测,我可以向大家提供一个方法,而且很通用,你也可以用同样的标准溶液和流动相来检测硅胶柱和氰基柱。 流动相: 10%乙酸乙酯+90%正己烷 流速1.0 标准溶液: 乙苯(如乙苯找不动就用甲苯代替呗)+苯甲酸甲酯 检测波长254nm 这个方法特别适用于新购柱子(新购柱子往往保存在正相溶剂中)时即进行检测,如有问题,可及时与供应商沟通。也适合在柱子在准备放置相当长一段时间之前进行充分清洗后进行检测作为记录留档。在平常的使用过程中,如果分析物是固定重复的,我们当然可以从对分析物的分离分析情况来作出判断;但如果分析物和分析条件不同时,定期检测柱效可以避免柱效下降导致分离不佳再分析查找原因这样浪费人力物力的过程。不过特别要注意的是,当氨基柱(或氰基柱)在反相条件中使用时,如用该条件检测,请注意流动相的换相过渡问题。 氨基柱的使用: 需要注意的是,氨基柱的键合官能团氨丙基要比C18,C8柱的键合官能团C18,C8要容易水解,所以首先要做好其使用寿命稍逊的心理准备,特别是当你的使用条件是反相条件下时。 反相条件下使用时,要特别注意控制PH值范围,PH值越低越有发生水解的危险,流动相中水的比例越高当然也越有发生水解的危险。所以,在使用后以及准备长时间放置该柱时,必要的清洗和将氨基柱保存于纯的有机溶剂中是很好的保养措施。 有一种情况是,当使用氨基柱进行酸性物质如果汁的分析时(分析其中的糖份),酸性物质的存在意味着质子的存在,可能会使略带负电荷的氨基官能团质子化,导致使用一段时间后对于某些类的分析物保留性质有所改变或表现在柱效下降。这时,Kromasil专家所给的建议是:用5-10倍的柱体积的含0.5-1.0%NH3的50-50乙腈-水溶液冲洗该柱(冲洗后当然要再用不含碱的流动相洗去多余氨),之后再进行分析这类酸性分析物时建议在流动相中略微添加少许氨如0.1%。 氨基柱的清洗 简单说起来,正相条件下使用的氨基柱你就参照硅胶柱的清洗方法;反相条件下使用的氨基柱你就参照C18的清洗方法。 平时在正相条件下使用: 首先用50倍柱体积的异丙醇清洗,因异丙醇粘度较大可适当放低流速;之后,用50倍的甲醇清洗;之后,用异丙醇过渡回到平常使用的正相流动相,即可。 平时在反相条件下使用: 缓冲盐应及时冲洗,以及不能直接用纯甲醇冲洗缓冲盐等,属常识就不作特别交待了。 用50倍纯甲醇冲洗;之后,用异丙醇过渡后,用二氯甲烷冲洗色谱柱;之后,再用异丙醇过渡回来到甲醇条件下。 这些清洗方法,主要是针对当样品中有杂质逐步吸附累积到填料上时的处理方法,色谱柱表现行为为诸如柱压增高柱效降低等 LUNA氨基柱的使用方法 1. 氨基柱既可以正相使用,也可以反相使用,但是要注意到的是:正相溶剂和反相溶剂往往是不互溶的,正常情况新氨基柱保存在正相环境中,例如LUNA 氨基柱保存在正己烷-乙腈(99:1)中。 2. 正相使用 2.1 新柱子可直接用流动相。推荐先用正己烷-乙腈(99:1)以0.5ml/min的流速冲10倍柱体积,再根据流动相选用极性相近的氯仿或二氯甲烷以相同的流速冲10倍柱体积,最后换成流动相。 2.1 正相使用时,不宜分析含醛基、羰基的化合物,不可用于还原糖的分析;流动相要彻底脱气,并不得含有羰基化合物和过氧化物(质量不好的乙醚、四氢呋喃含有少量)。 2.3 任何时候更换流动相时都要确保新流动相与柱子原保存液可互溶。 3 反相使用 3.1 先用正己烷-乙腈(99:1)以0.5ml/min的流速冲10倍柱体积,再依次以相同的流速相同的用量用氯仿、异丙醇、甲醇、甲醇-水(50:50)冲柱子。 3.2 以0.5ml/min的流速用30倍柱体积的pH11.0的氢氧化钠(LUNA)水溶液冲柱子(注意pH值切不可超过11.0),立即用水( 0.5ml/min的流速,30倍柱体积)冲洗,再换成流动相。 3.3 配制流动相时,应各组分分别量取,比例较小的组分要精密量取,需调pH值时要精密到0.1。 3.4 反相条件下使用时,要特别注意控制pH值范围,pH值越低越有发生水解的危险,流动相中水的比例越高当然也越有发生水解的危险。最理想的pH范围在pH 3.0-7.0 3.5 如果要使用的流动相中还含有缓冲盐类,建议在用分析流动相之前,先用不含缓冲盐的同比例流动相过渡,这样可避免缓冲盐在分析柱内的析出。 3.6 有一种情况是,当使用氨基柱进行酸性物质的分析时,酸性物质的存在意味着质子的存在,可能会使略带负电荷的氨基官能团质子化,导致使用一段时间后对于某些类的分析物保留性质有所改变或表现在柱效下降。建议:用5-10倍的柱体积的含0.5-1.0%NH3的乙腈-水(50:50)溶液冲洗该柱(冲洗后当然要再用不含碱的流动相洗去多余氨),之后再进行分析这类酸性分析物时建议在流动相中略微添加少许氨如0.1%。 4 色谱柱的冲洗:简单说起来,正相条件下使用的氨基柱就参照硅胶柱的清洗方法;反相条件下使用的氨基柱就参照C18的清洗方法。 5 色谱柱的保存 5.1 正相使用时,将柱子冲洗干净后,用正己烷-乙腈(99:1)保存。 5.2 反相使用时,如短期不用,可用甲醇或乙腈保存;长期不用时需将甲醇依次用异丙醇、氯仿置换,最后用正己烷保存。 6 色谱柱的再生 6.1 方案1:依次用甲醇、异丙醇、氯仿、正己烷、氯仿、异丙醇、甲醇冲柱子(各以 0.5ml/min的流速,20倍柱体积),再换流动相。这些清洗方法,主要是针对当样品中有杂质逐步吸附累积到填料上时的处理方法,色谱柱表现行为为诸如柱压增高柱效降低等。 6.2 方案2:NH2柱用于反相条件时,NH2键会水解,尤其是在该柱子pH范围以外,在极端酸性和碱性条件下柱寿命会下降很快,如果在这个条件下使用需要清洗一下,需要用10倍柱体积溶液冲洗,如下: 95%水/5%乙腈 THF四氢呋喃 95%乙腈/5%水 并保持95%乙腈/5%水继续冲洗,以低流速0.2-0.5mL/min过夜冲洗。 6.3 方案3:柱子使用一定时间后