宾斯马丁闭口闪点测定法GB/T261-2008中,仪器自校,提供了几种闪点值的标准油,蒸馏试验GB/76536-2010中,也提到了要用标准有自校,有证标准油比一般的分析纯的要贵很多,就想问问,用一般分析纯的有机油,比如,癸烷、正十烷、 十一烷、 十二烷、 正十四烷、 十六烷等 ,可行不啊?烦请大家给帮忙!
我做正癸烷催化裂化,用3420[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]分析其产物组成,根据催化裂化反应特性,其产物混合物大致为C3到C10,包括正构和异构烯烃、烷烃等,得到的谱图如下:这个谱图该怎么分析成分呢?实验室没那么多种试剂作内标定,也没条件做质谱,真是愁人~
根据检测项目,建议选择两个品牌或两个批次的标准品进行对比验证,确保标准曲线的准确性。注意商品化标准品和标准储备溶液的有效期,如果条件允许,建议能力验证实验使用新的未开瓶的标准品制备标准曲线。纯品型标准品需要使用分析天平进行准确称量,并记录数值,同时需要关注标准品的纯度,计算目标物浓度时需要带入标准品纯度。标准品的选择还需关注目标物的形式,例如四环素的标准品是以四环素盐酸盐的形式存在的,需要确认最终要求以何种形式进行报告,在进行浓度计算时需要注意换算。
摘要:本文介绍了在对含量测定所用的分析方法进行方法学验证时,各项指标的可接受标准,以利于判断该分析方法的可行性。 关键词:含量测定 分析方法验证 可接收标准 在进行质量研究的过程中,一项重要的工作就是要对质量标准中所涉及到的分析方法进行方法学验证,以保证所用的分析方法确实能够用于在研药品的质量控制。为规范对各种分析方法的验证要求,我国已于2005年颁布了分析方法验证的指导原则。该指导原则对需要验证的分析方法及验证的具体指标做了比较详细的阐述。但是文中未涉及各具体指标在验证时的可接受标准,国际上已颁布的指导原则中也未发现相关的要求。另一方面,大多数药品研发单位在进行质量研究时,已逐步认识到分析方法验证的必要性与重要性,大都也在按照指导原则的要求进行分析方法验证,但验证完后却因没有一个明确的可接受标准,而难以判断该分析方法是否符合要求。本文结合国外一些大型药品研发企业在此方面的要求,提出了在对含量测定方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。
摘要:本文介绍了在对有关物质检查所用的分析方法进行方法学验证时,各项指标的可接受标准,以利于判断该分析方法的可行性。 关键词:有关物质检查 分析方法验证 可接收标准 药品中的有关物质泛指在药品的生产与储存过程中产生的工艺杂质或降解产物。由于这些有关物质的存在会影响到药品的纯度,进而可能会产生毒副作用,所以有关物质的控制是药品研发的一个重要方面,也是我们在药品审评中一直重点关注的要点之一。而要对有关物质进行严格的控制,就离不开专属性强、灵敏度高的分析方法,这就涉及到分析方法的筛选与验证。从现有的申报资料看,药品研发单位已基本上意识到分析方法验证的重要性,但是对验证时各具体指标是否可行尚没有一个明确的可接受标准,从而难以对验证结果进行评判。为解决这一问题,本文结合国外一些大型药品研发企业在此方面的要求,提出了在对有关物质检查方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。
药品中的有关物质泛指在药品的生产与储存过程中产生的工艺杂质或降解产物。由于这些有关物质的存在会影响到药品的纯度,进而可能会产生毒副作用,所以有关物质的控制是药品研发的一个重要方面,也是我们在药品审评中一直重点关注的要点之一。而要对有关物质进行严格的控制,就离不开专属性强、灵敏度高的分析方法,这就涉及到分析方法的筛选与验证。从现有的申报资料看,药品研发单位已基本上意识到分析方法验证的重要性,但是对验证时各具体指标是否可行尚没有一个明确的可接受标准,从而难以对验证结果进行评判。为解决这一问题,本文结合国外一些大型药品研发企业在此方面的要求,提出了在对有关物质检查方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。 1.准确度 该指标主要是通过回收率来反映。验证时一般要求根据有关物质的定量限与质量标准中该杂质的限度分别配制三个浓度的供试品溶液各三份(例如某杂质的限度为0.2%,则可分别配制该杂质浓度为0.1%、0.2%和0.3%的杂质溶液),分别测定其含量,将实测值与理论值比较,计算回收率,并计算9个回收率数据的相对标准差(RSD)。该项目的可接受的标准为:各浓度下的平均回收率均应在80%-120%之间,如杂质的浓度为定量限,则该浓度下的平均回收率可放宽至70%-130%,相对标准差应不大于10%。 2.线性 线性一般通过线性回归方程的形式来表示。具体的验证方法为:在定量限至一定的浓度范围内配制6份浓度不同的供试液,分别测定该杂质峰的面积,计算相应的含量。以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。可接受的标准为:回归线的相关系数(R)不得小于0.990,Y轴截距应在100%响应值的25%以内,响应因子的相对标准差应不大于10%。 3.精密度 1)重复性 配制6份杂质浓度(一般为0.1%)相同的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于15%。 2)中间精密度 配制6份杂质浓度(一般为0.1%)相同的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于20%。 4.专属性 可接受的标准为:空白对照应无干扰,该杂质峰与其它峰应能完全分离,分离度不得小于2.0。 5.检测限 杂质峰与噪音峰信号的强度比应不得小于3。 6.定量限 杂质峰与噪音峰信号的强度比应不得小于10。另外,配制6份最低定量限浓度的溶液,所测6份溶液杂质峰保留时间的相对标准差应不大于2.0%,峰面积的相对标准差应不大于5.0%。 7.耐用性 分别考察流动相比例变化±5%、流动相pH值变化±0.2、柱温变化±5℃、检测波长变化±5nm、流速相对值变化±20%以及采用三根不同批号的色谱柱进行测定时,仪器色谱行为的变化,每个条件下各测试两次。可接受的标准为:各杂质峰的拖尾因子不得大于2.0,杂质峰与其他成分峰必须达到基线分离;各条件下的杂质含量数据(n=6)的相对标准差应不大于2.0%,杂质含量的绝对值在±0.1%以内。 8、系统适应性 配制6份相同浓度的杂质溶液进行分析,该杂质峰峰面积的相对标准差应不大于2.0%,保留时间的相对标准差应不大于1.0%。另外,杂质峰的拖尾因子不得大于2.0,理论塔板数应符合质量标准的规定。 9.溶液稳定性 按照分析方法分别配置对照品溶液与供试品溶液,平行测定两次主成分与杂质的含量,然后将上述溶液分别贮存在室温与冰箱冷藏室(4℃)中,在1、2、3、5和7天时分别平行测定两次主成分与杂质的含量。 可接受的标准为:主成分的含量变化的绝对值应不大于2.0%,杂质含量的绝对值在±0.1%以内,并不得出现新的大于报告限度的杂质。
做定量分析时,为了保证称量的准确性,配制的标准品母液浓度较高。而分析浓度较低,能连续稀释两次或三次吗?
刚接触色谱,遇到个头痛的问题,希望大家帮忙分析下。标样:75%异辛烷+5%对二甲苯+10%正癸烷+10%十六烷(质量百分比)色谱柱:Agilent 19091J-413:325℃ 30m 320μm 0.25μm进样口: 300℃ 16Psi 总流量:71.277ml/min 分流比:15:1毛细管柱:初始温度50保留5min,按15℃/min,升至170℃ ,保留10min检测器:300℃ H2 35ml/min ,Air350ml/min进样量0.5μl 手动进样三次结果:(只写出主要峰位及面积百分比)1 前 1.467 1.581 3.497 7.146 14.494 [color=#fe2419]72.184 1.527 4.729 9.379 10.252[/color] 后 1.903 2.015 3.826 7.145 14.252 [color=#0162f4]70.794 1.535 5.094 9.976 10.633[/color]2 前 1.469 1.583 3.498 7.15 14.5 [color=#ff7a73]72.289 1.529 4.739 9.378 10.154[/color] 后1.774 1.891 3.699 7.093 14.236 [color=#0162f4]70.087 1.536 5.139 10.125 11.164[/color]3 前1.47 1.583 3.498 7.074 14.497 [color=#fe2419]72.379 1.530 4.725 9.343 10.112 [/color] 后[color=#000000]1.734 1.842 3.667 7.109 14.268 [/color][color=#013add]71.652 1.531 5.057 9.776 10.038 [/color]其中1,3,4,5应该对应异辛烷,对二甲苯 正癸烷和十六烷,问题是从这三次结果来看,前检测器重现性(红色数据)应该说比较好了,而后检测器测得的后三种物质普遍较前检测器测得的大,并且忽高忽低,不知道是哪的原因?请高手指点,[color=#f10b00]如何才能使两个检测器测得的结果比较一致,且重复性好[/color]。 另外:似乎方法对数据的重复性也有很大影响,我试过单一柱温的,结果和程序升温的差好多,并且重复性更差,不知道是什么原因?
用LC—MS做定量分析时,为了保证称量的专业性,标准品配制的较浓,请问能连续稀释2—3次得到想要的浓度吧,会不会导致误差偏大呢?
化验分析硅石标准品,怎样测铝的含量,标准品如何处理?
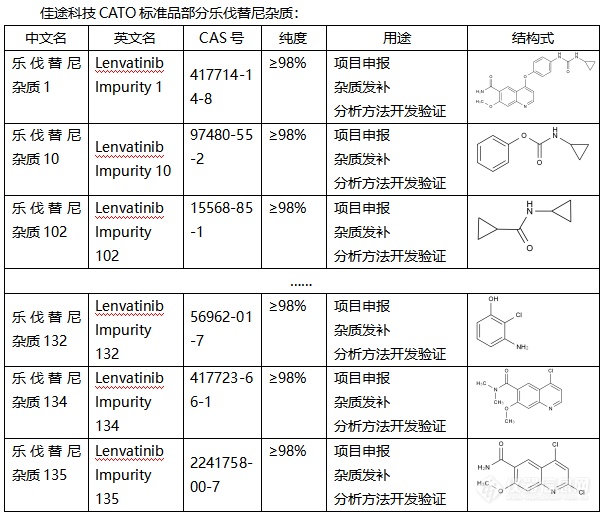
乐伐替尼,作为现代医学的瑰宝,广泛应用于肿瘤治疗领域。然而,就像其他药物一样,乐伐替尼在生产过程中也可能会产生杂质。这些微小的杂质,虽然量少,却可能对药物的疗效和安全性产生不可忽视的影响。为了确保乐伐替尼的纯净与安全,科学家们引入了CATO标准品进行杂质分析。CATO标准品,就像一把精准的尺子,能够帮助研究人员准确地检测和衡量乐伐替尼中的杂质。通过对比和分析,我们可以清楚地了解杂质的种类、数量以及可能对药物产生的影响。这项应用研究不仅提升了乐伐替尼的生产质量,更为患者的安全用药提供了有力保障。借助CATO标准品,我们能够及时发现并控制杂质,确保每一颗乐伐替尼都是纯净、有效的。未来,随着科学技术的不断进步,我们期待看到更多关于乐伐替尼杂质分析的研究成果,为患者带来更加安全、可靠的治疗方案。同时,也期待CATO标准品在更多药物杂质分析中发挥重要作用,守护人类的健康与安全。[img=,603,515]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021836237186_8744_6381568_3.png!w603x515.jpg[/img]广州佳途科技股份有限公司是一家专业的CATO标准品生产厂家,我们目前库存有全套乐伐替尼杂质,能够提供相应的系列图谱和产品COA证书,并支持溯源。我们公司已经通过了国内外双ISO 17034质量体系认证,欢迎广大客户选购。
某次去培训听人说标准品是要有证的,也就是附有不确定度,含量,使用条件,等信息的证。具体不知道是什么证了,他说有证的话就可以不做期间核查了。想问问大家是怎样买的,国家标准物质网的那些人一点耐性都没有,有时候问多一下都不理,要他们给证更没可能。
EN71-3 2013附录G有机锡分析方法中10种有机锡化合物标准品均为固体,但是采购的时候二正丙基二氯化锡这个供应商报过来的全都是10ml 10ug/ml的液体,请问大家也遇到这样的问题吗?是如何解决的呢?跪求答案,谢谢!
药品分析中标准品和对照品有什么区别?
药品分析中标准品和对照品有什么区别?
药品分析中标准品和对照品有什么区别?
[align=center][font='微软雅黑','sans-serif'][color=black]【标准品专题】由标准品产品经理引发的标准品现状分析[/color][/font][color=black]-[/color][/align][font='微软雅黑','sans-serif'][color=black][back=white]前言:[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]人事:您好,请问是[/back][/color][/font][color=black][back=white]**[/back][/color][font='微软雅黑','sans-serif'][color=black][back=white]先生吗?[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]老菜鸟:是的啊,您哪位?[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]人事:您好,我这边是[/back][/color][/font][color=black][back=white]**[/back][/color][font='微软雅黑','sans-serif'][color=black][back=white]负责中国区域的公司,看到您的简历很符合我们公司的产品经理的条件,请问有兴趣了解一下吗?[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]老菜鸟:有的。贵公司有资料吗,我能先看看吗?[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]人事:我加您微信,给你传一些我们公司的简介,然后也可以到我们公司的官网进行了解。[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]老菜鸟:好的,多谢。[/back][/color][/font][color=black][back=white] [/back][/color][font='微软雅黑','sans-serif'][color=black][back=white]老菜鸟于是查询了相关的职位说明,这个职位有点类似大数据分析、产品策划和推广、技术支持、售前服务等职位。[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]主要就是调研、分析、策划等事项,数据分析应该有专门的数据分析师通过一些问卷、实际销售地、销售人员业绩等方面进行,[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]而更主要的就是知道未来标准品的发展方向,国家的一些政策,新出的一些标准,最主要的就是信息要及时,[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]没有哪一家公司完全承接标准制定的标准品生产定制的业务,所以即将出的标准中所使用的标准品(主要是混标)必然有一部分是不能被这个公司所知道的。[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]越早发现就越及时,才能给研发和生产部门提供可靠的参考。[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]因为想去了解一下,所以还是查了一些相关的资料的,包括一些老师在论文里写的一些综述,标准品的发展,标准品的现状,[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]标准品未来的发展趋势,但是当时接触的一些标准品生产厂家也就坛墨、安谱等在国内比较知名一点的,也会遇到一些标准品没有做好的情况,[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]发错、制作错都存在,这个在行业内其实不是一件稀奇的事情。现在主要调研的是环境和药品类的比较多,[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]因为这几年环境类和药品的更换标准速度很快,不断的有新标准推出,所以重点应该在环境和药品这两个板块是比较合理的。[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]然后我去了解了一下标准品的制作流程,发现标准品的生产比较重要的是两个阶段,一个是生产阶段,这个大部分化工生产企业都可以做的事情,[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]之前生产过医药中间体的化工厂就给相关厂商供货过原材料,产品在生产出来之前如果不是主流产品,必然有一个研发阶段,然后才能到生产阶段,[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]这就是研发小试到生产大釜的过程,也是需要有一段时间进行的。然后就是定量阶段,这个就不在说了,自动化的东西。[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]出大问题容易出在研发阶段,也就是定性阶段,一个产品生产出来,是不是它,有没可能是它的副产物,[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]有没有可能是它的氟化物或者氧化物或者其他东西。如果在研发阶段都出问题,那么生产就更糊涂了。[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]当然,由于标准品生产都有相关机制去把控,所以问题相对来说出现极少。然后就是配比定量的问题了,这个不用多说。[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]标准品的生产在国内并没有形成良好的竞争趋势,相对检测公司来说,一个标准品,都有证书,只要纯度达标,那我肯定不管你定值多少,[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]不确定度多少,而是关心你的定价,那就有问题了,优的产品良的产品并不能很好的分开。[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]另外还有个问题,规格。有些标准品,尤其是混标,尽量做到一次或者几次的使用,[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]因为混标涉及到的产品变质、保存等问题都比单标相对更多。有些厂商并不能很好的处理这个问题,很容易导致客户购买量不够、过大等情况,会损失一部分客户源。[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]最后,标准品定制应该列入常备项目,定制混标虽然增加了[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]一部分工作量,[/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white]但这个是更好的服务客户,我认为如果是做企业方向策划,这个是比较重要的一部分。[/back][/color][/font][color=black][back=white] [/back][/color]
液相分析时,样品和标准品使用的溶剂不同,对测试结果影响大么?想听听大家的声音啊~~用C18色谱柱,乙腈和水作为流动相,梯度洗脱,目标物质是一种多肽。如果样品是溶解在乙腈和水的混合液中,而标准品是溶解在PBS(磷酸缓冲液 Phosphate Buffer Solution),这样会对通过标准曲线算出的样品中多肽含量有影响吗?其实,问题的关键就是溶剂不同,由于没做实验去验证,所以未果。。。专家的进来吆~~学习学习~~
在进行质量研究的过程中,一项重要的工作就是要对质量标准中所涉及到的分析方法进行方法学验证,以保证所用的分析方法确实能够用于在研药品的质量控制。为规范对各种分析方法的验证要求,中国药典2005年版附录规定了分析方法验证的指导原则。该指导原则对需要验证的分析方法及验证的具体指标做了比较详细的阐述。但是文中未涉及各具体指标在验证时的可接受标准,国际上已颁布的指导原则中也未发现相关的要求。另一方面,大多数药品研发单位在进行质量研究时,已逐步认识到分析方法验证的必要性与重要性,大都也在按照指导原则的要求进行分析方法验证,但验证完后却因没有一个明确的可接受标准,而难以判断该分析方法是否符合要求。本文提出了在对HPLC含量测定方法进行验证时的可接受标准,供大家讨论。1.准确度 该指标主要是通过回收率来反映。验证时一般要求分别配制浓度为80%、100%和120%的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率。 可接受的标准为:各浓度下的平均回收率均应在98.0%-102.0%之间,9个回收率数据的相对标准差(RSD)应不大于2.0%。 2.线性 线性一般通过线性回归方程的形式来表示。具体的验证方法为: 在80%至120%的浓度范围内配制5份浓度不同的供试液,分别测定其主峰的面积,计算相应的含量。以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。 可接受的标准为:回归线的相关系数(R)不得小于0.998,Y轴截距应在100%响应值的2%以内,响应因子的相对标准差应不大于2.0%。 3.精密度 1)重复性 配制6份相同浓度或分别配制浓度为80%、100%和120%的供试品溶液各三份的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于2.0%。 2)中间精密度 配制6份相同浓度的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于2.0%。 4.专属性 可接受的标准为:空白对照应无干扰,主成分与各有关物质应能完全分离,分离度不得小于2.0。以二极管阵列检测器进行纯度分析时,主峰的纯度因子应大于980。 5.检测限 主峰与噪音峰信号的强度比应不得小于3。 6.定量限 主峰与噪音峰信号的强度比应不得小于10。另外,配制6份最低定量限浓度的溶液,所测6份溶液主峰的保留时间的相对标准差应不大于2.0%。 7.耐用性 分别考察流动相比例变化±5%、流动相pH值变化±0.2、柱温变化±5℃、流速相对值变化±20%时,仪器色谱行为的变化,选择至少三个不同厂家或不同批号的同类色谱柱,每个条件下各测试两次。可接受的标准为:主峰的拖尾因子不得大于2.0,主峰与杂质峰必须达到基线分离,分离度应大于1.5;各条件下的含量数据(n=6)的相对标准差应不大于2.0%。 8、系统适应性 配制6份相同浓度的供试品溶液进行分析,主峰峰面积的相对标准差应不大于2.0%,主峰保留时间的相对标准差应不大于1.0%。另外,主峰的拖尾因子不得大于2.0,主峰与杂质峰必须达到基线分离,分离度应大于1.5,供试品主峰的理论塔板数应取耐用性试验不同厂家或不同批号的同类色谱柱的平均值的100%-120%。
老师同学们有无这样的经历?对已知化合物定量分析,标准品和质控样分别出自不同的厂商,皆在有效期内,定量过程线性良好,RSD合规,但是多种化合物合成的质控样一直有一个化合物无法进入合理区间范围?多次尝试无果?这个时候考虑标准品有问题还是指控样有问题?还是分析方法有问题?从哪里入手?类似问题咋解决???
[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]分析脂肪酸甲酯标准品,怎样处理标准品?用什么溶剂稀释?
求购 质谱分析的蛋白标准品,MALDI-TOF-MS上用的。 分子量在400--30000da 的或者接近这个质量范围的,如有请联系我。直接给我这个留言就可以,谢谢!
中华人民共和国国家标准 GB\T 5009.48--1996蒸馏酒及配制酒卫生标准的分析方法 代替 GB 5009.48--85Method for analysis of hygienic standardof distilled wines and mixed wines____________________________________________________________________________1 主题内容与适用范围 本标准规定了以含糖或淀粉的物质为原料,经糖化发酵蒸馏而制得的白酒及以发酵酒或蒸馏酒作酒基,经添加可食用的辅料制成的配制酒中各项卫生指标的分析方法。 本标准适用于蒸馏酒和配制酒中各项卫生指标的分析。2 引用标准 GB 2757 蒸馏洒和配制洒卫生标准 GB 5009.2 食品中相对密度的测定方法。 GB 5009.11 食品中总砷的测定方法。 GB 5009.12 食品中铅的测定方法。 GB 5009.36 粮食卫生标准的分析方法。 GB 5009.35 食品中着色剂的测定方法。 GB 12396 食品中铁、锰的[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]测定方法3 感官检查3.1 量取 30mL 样品,倒入 50mL 清洁干燥无色玻璃烧杯中,观察其颜色,应透明,无沉淀或杂质。3.2 尝其味应有该种酒特有的芳香味和滋味,不应有霉味、酸味、异味。应符合GB 2757的规定。4 理化检验4.1 乙醇浓度(比重计法)4.1.1 原理 同GB 5009.2的原理。4.1.2 仪器 酒精比重计。4.1.3 分析步骤 吸取 100mL样品于 250mL或 500mL全玻璃蒸馏器中,加 50mL 水,再加入玻璃珠数粒,蒸馏,用100mL 容量瓶收集馏出液 100mL。 将蒸馏后的样品倒入量筒中,将洗净擦干的酒精计缓缓沉入量筒中,静止后再轻轻按下少许,待其上升静止后,从水平位置观察其与液面相交处的刻度,为乙醇浓度, 同时测定温度,按测定的温度与浓度,查《酒精计温度浓度换算表》,换算成温度为20℃时的乙醇浓度(%)。4.2 甲醇4.2.1 原理 甲醇经氧化成甲醛后,与品红亚硫酸作用生成蓝紫色化合物,与标准系列比较定量。最低检出量为 0.02g/100mL。4.2.2 试剂4.2.2.1 高锰酸钾-磷酸溶液:称取 3g 高锰酸钾,加入15mL磷酸 (85%)与 70mL水的混合液中,溶解后加水至 100mL。贮于棕色瓶内,防止氧化力下降,保存时间不宜过长。4.2.2.2 草酸-硫酸溶液:称取 5g 无水草酸(H2C2O4) 或7g含 2分子结晶水草酸(H2C2O4.2H2O ), 溶于硫酸 (1+1)中至 100mL. 4.2.2.3 品红- 亚硫酸溶液 :称取 0.1g碱性品红研细后,分次加入共60mL 80℃的水,边加入水边研磨使其溶解,用滴管吸取上层溶液滤于100mL 溶量瓶中,冷却后加10mL亚硫酸钠溶液(100g/L), 1mL盐酸 ,再加水至刻度, 充分混匀,放置过夜,如溶液有颜色,可加少量活性炭搅拌后过滤,贮于棕色瓶中,置暗处保存,溶液呈红色时应弃去重新配制。4.2.2.4 甲醇标准溶液:称取 1.000g 甲醇,置于 100mL 容量瓶中, 加水稀释至刻度。此溶液每毫升相当于 10mg 甲醇。置低温保存。4.2.2.5 甲醇标准使用液:吸取 10.0mL 甲醇标准溶液,置于 100mL容量瓶中,加水稀释至刻度。再取 10.0mL 稀释液置于 50mL 容量瓶中,加水至刻度,该溶液每毫升相当0.50mg甲醇。4.2.2.6 无甲醇的乙醇溶液:取 0.3mL按操作方法检查,不应显色。如显色需进行处理。取 300mL乙醇 (95%),加高锰酸钾少许,蒸馏,收集馏出液。在馏出液中加入硝酸银溶液(取1g硝酸银溶于少量水中)和氢氧化钠溶液(取 1.5g 氢氧化钠溶于少量水中),摇匀,取上清液蒸馏,弃去最初50mL馏出液,收集中间馏出液约200mL,用酒精比重计测其浓度,然后加水配成无甲醇的乙醇(60%)。4.2.2.7 亚硫酸钠溶液(100g/L)。4.2.3 仪器 分光光度计。
[font=宋体][size=3]百灵威整合国际资源为烟草行业提供品类齐全的烟草成分分析标准品。产品涵盖烟草分析所用到的各类代谢物、衍生物、农药及香精香料标准品。可以满足烟草行业各类分析实验需求。[/size][/font]
O.999,则该校准曲线可判定为合格。 c.精密度评价 一般用高、中、低三种浓度的标准溶液,用相同的方法分别进行多次平行测定,并应分散在一段适当长的时间里进行分析,计算相对标准偏差、评价实验方法精密度。重复分析是精密度检验的一种手段,它反过来会影响结果。重复可以是一批样品中邻近的部分(检验重复性)或者随机放置的部分(检验漂移)。盲样分析是有效进行重复分析的一种方式,并且也为精密度的评价提供了一种手段。它包括可能由实验室管理人员进行的分批试样的重复测试部分。 d.准确度评价 可以用测量标准物质或将不同浓度的标准物质加到实际样品中做回收率测定来评价分析方法准确度。或者采用具有可比性的其他分析方法,根据所得结果的符合程度来估计测定的准确度。 在分析过程中用到的各种标准和化学校准物能够检验分析过程对被分析物的响应是稳定的。 用标准物质进行准确度评价时,对标准物质进行分析测定,计算平均值(;)和标准偏差(s),用£检验法将分析结果与标准物质的含量进行比较,判断分析方法的准确度。 测定样品加标回收率时,在测定成批样品时,随机抽取10%~20%的样品,加入一定量的待测组分的标准物质,与样品一起在相同条件下进行分析,并计算百分回收率 尸(%)===垒二鱼×lOO%. m式中:P——加入标准物质的回收率; m——加人标准物质的量; 27。——加标样品测定值;. 27。——样品测定值。 一般要求,被测定物质的回收率应达85%~110%。 ②质量控制图 每种分析方法都存在变异,都受时间、空间的影响,即使在理想条件下获得的一组数据,也存在随机误差。当某一结果超出了随机误差的允许范围时,统计学即可判断这一结果异常或不可信。根据一组连续测定数据,可用质控样的值z与标准偏差s,在一定的置信水平,绘制成质量控制图。从概率意义上说,测定结果有99%0的几率应在z I-3s(上、下控制线)内;95%应在x-+-2s(~、下警告线)内;68%应在at~s(上、下辅助线)内,这样质控图就确定了这种误差是否在一定允许范围内。 在常规样品分析过程中,每分析一批样品插入一个“质量控制样品”,或者在分析大批样品时,每隔10~20个样品插入一个“质量控制”,其分析方法应与试样完全相同,并至少独立分析20次以上,然后以实验测定结果为纵坐标,实验顺序为横坐标绘制而成。常用的质量控制图有精密度控制图和准确度控制图。 a.精密度控制图(均值控制图) 以测定结果的平均值z(应指明是哪一组测量的平均值)为控制图的中心线,并计算出测量值的标准偏差s,以j±2s作为上、下警告限,用虚线表示;j±3,作为上、下控制限。 这一控制图通常用来控制精密度,因此称精密度控制图。 b.准确度控制图(回收率控制图)用在分析样品中加入标准物质的百分回收率制作质控图,来控制样品分析的准确度。在理想状态下,向样品中加入已知标准物质的回收率应为100~/{o,但对于任何一种分析方法而言,由于存在各种因素的干扰,不可避免产生误差,使测得的回收率通常大于或小于100 9/6,回收率越趋近于100%,说明准确度越高。因此,利用回收率的平均值作中心线,计算回收率的标准差作为控制范围,就可绘制成百分回收率质控图。向不同浓度的样品中加入不同的已知量的标准物质,测得回收率数据,计算百分平均回收率F及其标准偏差,,,以F±2。,为E、下警告限,P±3sp为上、下控制限,绘制成准确度控制图。 , 10 I 5 序号或日期 图5.3准确度控制示意图 在进行样品分析时,将“质量控制样品”插入样品组内,在相同条件下进行分析测定,如果测定结果在控制图中的警告限内,说明测定过程处于控制状态;如果在警告限外,但仍在控制限内,则表示应进行初步检查;如超出控制限,表示测定过程失控,应找出原因并纠正;如果所有测定结果均在控制限内,但有七个结果连续在中心线的同一侧,亦为异常,应查明原因并加以纠正。 适当的质量控制级别是实验室管理的职责。在日常分析中,5%的内部质量控制级别是合理的并得到广泛承认。也就是说,每20个分析样品中应有一个样品是质量控制样品。然而,对于具有较高样品处理量的稳定日常方法,也许较低级别的质量控制更为合理。对于比较复杂的分析方法,20%o的质量控制级别是常见的,有时甚至需要50%的级别。对于不常进行的分析,在每一种情况下均应进行全面系统的方法确认。这通常涉及被分析物已被定值或浓度已知的(有证)标准物质使用,在这之后伴随着样品和添加样品(人为添加已知量被分析物的样 (2)实验室间质量控制 一个实验室根据分析质量要求与同行实验室进行比较,从而监测自身测试能力。 实验室间质量控制的一种公认方式是参加能力验证计划。能力验证结果可作为检验质量保证的一种手段。通常情况下,如果没有与实验室期望检验相关类型的能力验证计划可以利用,这时可以采用: ①用标准物质作平行测定 通常由中心实验
药品质量标准分析方法验证的目的是证明采用的方法适合于相应检测要求。在建立药品质量标准时,分析方法需经验证;在药品生产工艺变更、制剂的组分变更、原分析方法进行修订时,则质量标准分析方法也需进行验证。方法验证理由、过程和结果均应记载在药品标准起草说明或修订说明中。 需验证的分析项目有:鉴别试验,杂质定量检查或限度检查,原料药或制剂中有效成分含量测定,以及制剂中的其他成分(如防腐剂等)的测定。药品溶出度、释放度等功能检查中,其溶出量等的测试方法也应作必要验证。 验证内容有:准确度、精密度(包括重复性、中间精密度和重现性)、专属性、检测限、定量限、线性、范围和耐用性。视具体方法拟订验证的内容。附表中列出的分析项目和相应的验证内容可供参考。 方法验证内容如下。一、准确度准确度系指用该方法测定的结果与真实值或参考值接近的程度,一般用回收率(%)表示。准确度应在规定的范围内测试。 1.含量测定方法的准确度 原料药可用已知纯度的对照品或样品进行测定,或用本法所得结果与已知准确度的另一个方法测定的结果进行比较。制剂可用含已知量被测物的各组分混合物进行测定。如不能得到制剂的全部组分,可向制剂中加入已知量的被测物进行测定,或用本法所得结果与已知准确度的另一个方法测定结果进行比较。 如该分析方法已经测试并求出了精密度、线性和专属性,在准确度也可推算出来的情况下,这一项可不必再做。 2.杂质定量测定的准确度 可向原料药或制剂中加入已知量杂质进行测定。如不能得到杂质或降解产物,可用本法测定结果与另一成熟的方法进行比较,如药典标准方法或经过验证的方法。在不能测得杂质或降解产物的响应因子或对原料药的相对响应因子情况下,可用原料药的响应因子。应明确表明单个杂质和杂质总量相当于主成分的重量比(%)或面积比(%)。 3.数据要求 在规定范围内,至少用9个测定结果进行评价,例如,设计3个不同浓度,每个浓度各分别制备3份供试品溶液,进行测定。应报告已知加入量的回收率(%),或测定结果平均值与真实值之差及其相对标准偏差或可信限。 (意见3:是否对所设定的浓度范围作出要求,如:该方法用于药品的含量测定,回收率试验的样品浓度应设定于含量100%的±20%之间;用于溶出(释放)曲线考察时,回收率试验的样品浓度应设定于全曲线范围的上、中、下部位。)二、精密度 精密度系指在规定的测试条件下,同一个均匀样品,经多次取样测定所得结果之间的接近程度。精密度一般用偏差、标准偏差或相对标准偏差表示。 在相同条件下,由一个分析人员测定所得结果的精密度称为重复性;在同一个实验室,不同时间由不同分析人员用不同设备测定结果之间的精密度,称为中间精密度;在不同实验室由不同分析人员测定结果之间的精密度,称为重现性。 含量测定和杂质的定量测定应考虑方法的精密度。 1.重复性 在规定范围内,至少用9个测定结果进行评价,例如,设计3个不同浓度,每个浓度各分别制备3份供试溶液,进行测定。或100%的浓度水平,用至少测定6次的结果进行评价。 2.中间精密度 为考察随机变动因素对精密度的影响,应设计方案进行中间精密度试验。变动因素为不同日期、不同分析人员、不同设备。 3.重现性 当分析方法将被法定标准采用,应进行重现性试验,例如,建立药典分析方法时通过协同检验得出重现性结果。协同检验的目的、过程和重现性结果均应记载在起草说明中。应注意重现性试验用的样品本身的质量均匀性和贮存运输中的环境影响因素,以免影响重现性结果。 4.数据要求 均应报告标准偏差、相对标准偏差和可信限。三、专属性 专属性系指在其他成分(如杂质、降解产物、辅料等)可能存在下,采用的方法能正确测定出被测物的特性。鉴别反应、杂质检查、含量测定方法均应考察其专属性。如方法不够专属,应采用多个方法予以补充。 1.鉴别反应 应能与可能共存的物质或结构相似化合物区分。不含被测成分的样品,以及结构相似或组分中的有关化合物,应均呈负反应(不呈正反应?)。2.含量测定和杂质测定 色谱法和其他分离方法,应附代表性图谱,以说明方法的专属性,并应标明诸成分在图中的位置。色谱法中的分离度应符合要求。 在杂质可获得的情况下,对于含量测定,试样中可加入杂质或辅料,考察测定结果是否受干扰,并可与未加杂质或辅料的试样比较测定结果。对于杂质测定也可向试样中加入一定量的杂质,考察杂质能否得到分离。 在杂质或降解产物不能获得的情况下,可将含有杂质或降解产物的试样进行测定,与另一个经验证了的或药典方法比较结果。用强光照射,高温,高湿,酸、碱水解或氧化的方法进行加速破坏,以研究可能的降解产物和降解途径。含量测定方法应比对二法的结果,杂质检查应比对检出的杂质个数,必要时可采用二极管阵列检测和质谱检测,进行峰纯度检查。四、检测限 检测限系指试样中被测物能被检测出的最低量。药品的鉴别试验和杂质检查方法,均应通过测试确定方法的检测限。常用的方法如下。 1.非仪器分析目视法用已知浓度的被测物,试验出能被可靠地检测出的最低浓度或量。 2.信噪比法 用于能显示基线噪声的分析方法,即把已知低浓度试样测出的信号与空白样品测出的信号进行比较,算出能被可靠地检测出的最低浓度或量。一般以信噪比为3∶1或2∶1时相应浓度或注入仪器的量确定检测限。 3.数据要求 应附测试图谱,说明测试过程和检测限结果。五、定量限 定量限系指样品中被测物能被定量测定的最低量,其测定结果应具一定准确度和精密度。杂质和降解产物用定量测定方法研究时,应确定方法的定量限。 常用信噪比法确定定量限。一般以信噪比为10∶1时相应浓度或注入仪器的量确定定量限。六、线性 线性系指在设计的范围内,测试结果与试样中被测物浓度直接呈正比关系的程度。 应在规定的范围内测定线性关系。可用一贮备液经精密稀释,或分别精密称样,制备一系列供试样品的方法进行测定,至少制备5份供试样品。以测得的响应信号作为被测物浓度的函数作图,观察是否呈线性,再用最小二乘法进行线性回归。必要时,响应信号可经数学转换,再进行线性回归计算。 数据要求:应列出回归方程、相关系数和线性图。(意见4:“线性”、“范围”中,如测定方法用于溶出(释放)曲线考察时,是否规定样品浓度的范围应涵盖整条曲线。)七、范围 范围系指能达到一定精密度、准确度和线性,测试方法适用的高低限浓度或量的区间。 范围应根据分析方法的具体应用和线性、准确度、精密度结果和要求确定。原料药和制剂含量测定,范围应为测试浓度的80%~120%;制剂含量均匀度检查,范围应为测试浓度的70%~130%,根据剂型特点,如气雾剂、喷雾剂,范围可适当放宽;溶出度或释放度中的溶出量测定,范围应为限度的±20%,如规定了限度范围,则应为下限的-20%至上限的+20%;杂质测定,研究时,范围应根据初步实测,拟订为规定限度的±20%。如果含量测定与杂质检查同时进行,用百分归一化法,则线性范围应为杂质规定限度的-20%至含量限度(或上限)的+20%。八、耐用性 耐用性系指在测定条件有小的变动时,测定结果不受影响的承受程度,为把方法用于常规检验提供依据。开始研究分析方法时就应考虑其耐用性。如果测试条件要求苛刻,则应在方法中写明。典型的变动因素有:被测溶液的稳定性,样品的提取次数、时间等。液相色谱法中典型的变动因素有:流动相的组成和pH值,不同厂牌或不同批号的同类型色谱柱,柱温,流速等。气相色谱法变动因素有:不同厂牌或批号的色谱柱、固定相,不同类型的担体,柱温,进样口和检测器温度等。 经试验,应说明小的变动能否通过设计的系统适用性试验,以确保方法有效。 附表 检验项目和验证内容 项目 鉴别 杂质测定 含量测定及溶出量测定 内容 定量 限度 准确度 - + - + 精密度 - - - + 重复性 - + - + 中间精密度- +① - +① 专属性② + + + + 检测限 - -③ + - 定量限 - + - - 线性 - + - + 范围 - + - + 耐用性 + + + + ① 已有重现性验证,不需验证中间精密度。 ② 如一种方法不够专属,可用其他分析方法予以补充。 ③ 视具体情况予以验证。
食品分析中标准物的管理及其标准溶液的校正一、意义食品分析标准物质是分析方法质控的核心,是定性和定量的依据。标准物质以一定纯度和浓度配制的溶液称标准溶液,其稳定性受其自身降解、化学转化、溶质和溶剂挥发等内在因素的影响,又受其存放条件如温度、湿度、光线照射、存放时间、存放容器及其配制技巧等外界条件的影响。由于影响标准物及其标准液的因素较多,如果条件控制不当或管理不严密,标准物质浓度易发生变化,这是食品分析中难以进行质量控制的主要原因。以上原因也是实验室食品分析测定产生误差的最主要因素,要减小这些产生误差的主要因素,就要特别注重标准物管理,以及进行标准溶液的稳定性观察和校正工作,也是实验室质量控制关键工作之一。当标准溶液发生变化时就要重新配制,并找出变化原因,为分析工作积累经验,并可写入方法注释中。在食品分析质量控制中,准确度和精密度的提高,是以标准溶液稳定性和准确性为前提的,因此对于标准溶液稳定性和准确性的关键技术问题,是质量控制的核心问题。二、标准物质的管理 1、容量分析的基准物是标定其它标准溶液的基准,应购买基准试剂,它可以保证其纯度。另一个因素是水份的影响,用前应充分干燥和恒重,配制时量器要校正。溶剂要纯化,使用的容器要充分洗涤。最终目的都是防止基准物的化合损失。2、用于分光光度分析的标准物,分有机的和无机的标准物,无机标准稳定性好,但使用液浓度低时,极易被容器吸附,并与容器中离子进行交换,因此决定了其稀溶液使用时间短。玻璃容器在碱性介质中易溶出,塑料容器在成型时加入助剂时也含有不同金属杂质,容易溶出如Zn、Ca等金属离子。有机标准最好不放在塑料制容器中,因塑料在成型时加入的有成份比较复杂的助剂和增塑剂。标准使用液应现用现配为最佳。三、标准物存放使用1、无机的标准物要求在干燥并无化学干扰物的条件下存放,选择合适干燥剂如硅胶和分子筛。有机标准物最好分装封入安培瓶中低温避光保存。固体的多环芳烃可配制成溶液,再分装在安瓿瓶中保留溶剂封存,也可把溶剂挥掉后干燥封存,使用时再定容,后一种方法更为稳妥些。配制好一批标准溶液,再一支一支使用也是很方便的。如果液体的标准物特别是几种标准的混合物用于色谱分析同系物如醇类物质,可同时配制一批分装安瓿瓶低温存放,再一支一支使用,能避免溶剂挥发体积变化产生的误差。这种做法更适于实验室间的标准分发和校正工作。最难办的是气体,标准如氯乙烯、氟里昂,最好是钢瓶中存放,或配制钢瓶标准气。这些条件不具备时也可以选择高沸点溶剂,密封溶解这些气体,称量溶质重量,一次性使用。从这一事实出发,气体,测定误差可以稍加放宽,因为标准自身稳定性差。2、用于色谱分析的标准物要求色谱纯,其配剂溶液剂也要求色谱纯,准确配制前要在色谱上进行检查。特别是几种标准进行混合更应慎重,每种要严格检查否则给定性定量带来很多麻烦。如果纯度不够时可以纯化,再结晶或用制备色谱制备。勉强使用是无益的。四、标准溶液的校正1、从安瓿瓶分装标准溶液无论是有机的或是无机的用于校正是很方便的。如原子吸收测定金属,从安瓿瓶中取一定量配制浓度系列,再封存。每隔一段时间(1~2周)再用原溶液配制同样浓度系列,严格控制仪器条件来比较二次标准曲线的斜率,斜率下降时表明有损失。2、相同浓度同时配制的标准的几支安瓿瓶,先用打开的一支标准的测定值与间隔一段时间后打开的另一支标准的测定值进行比较,以此类推最后在一段时间内几支同时测定,其变异程度就是标准在这段时间稳定性变化程度。3、几个实验室用同一标准物分别配制相同浓度标准液,各自进行标准曲线的测定,再按规定交换该标准液再进行测定,比较测定结果差异来观察同一标准的时间和空间变异。如果标准液稳定,配制不准确的实验室很容易查出。配制都准确时,标准液若不稳定时,会使各实验室的测得值都偏低。4、同种标准物来源不同,也应采用分别配制交叉测定的办法来检查标准的纯度及配制是否准确。在食品分析中无论用何种手段分析样品,所使用的标准物应作统一的或确切的规定。例如:过硫酸铵测锰,用MnSO4·H2O作为标准使用,到底硫酸锰需要不需要烘烤呢?对于这个问题,在一部份的教科书中有规定烘烤的,也有不烘烤的。按照MnSO4·H2O的性质遇到空气可能吸潮或风化,如果直接称重计算Mn量,就有可能出现误差。用烘烤称重测得水分所含的量比理论值高1.6%,有同一硫酸锰配制锰标准溶液测一合成水样,使用烘烤后配制的锰标准溶液,测得的Mn含量为0.205mg/L,未烘烤过的则高达约2.3%,从中说明硫酸锰在配制标准溶液时应经过烘烤,使标准一致。
在做食品接触材料试验时,按照GB/T 5009.69—2003食品罐头内壁环氧酚醛涂料卫生标准的分析方法测定酚含量时配制酚标准溶液方法如下:准确称取新蒸182℃~184℃馏程的苯酚约1 g,溶于水中移入1 000 mL容量瓶,加水稀释至刻度。请问1.新蒸182℃~184℃馏程的苯酚1g,这个馏程是指在苯酚在182℃~184℃蒸馏下得到的苯酚吗?在蒸馏过程中应注意一些什么问题?用什么样的蒸馏装置较合适?2.市场上有这种苯酚的标准溶液卖吗?就是苯酚标准溶液基体是水,不是其它物质3.可以把苯酚的标准溶液的基体换成别的物质吗?对实验结果会不会与有影响?

[align=center][font=宋体][size=10.5pt][b]标准品是分析人员做实验的“定心丸”[/b][/size][/font][/align][font=宋体][size=10.5000pt]1 [font=宋体]什么是标准品 ?[/font][/size][/font][font=宋体][size=10.5000pt] 定义:具有一种或多种足够均匀和很好地确定了的特性,用以校准测量仪器、评价测量方法或给材料赋值的材料或物质。[/size][/font][font=Calibri][size=10.5000pt][font=宋体]在药品检验中,它是确定药品真伪优劣的对照,[/font][/size][/font][font=Calibri][size=10.5000pt][font=宋体]是控制药品质量必不可少的工具。[/font][/size][/font][font=宋体][size=10.5000pt]2 [font=宋体]怎么保存标准品?[/font][/size][/font][font=宋体][size=10.5000pt]我们实验室是分类进行保存[/size][/font][font=宋体][size=10.5000pt][font=宋体]([/font]1[font=宋体])[/font][/size][/font][font=Calibri][size=10.5000pt][font=宋体]常温[/font][/size][/font][font=宋体][size=10.5000pt]干燥[/size][/font][font=Calibri][size=10.5000pt][font=宋体]保存:通常用于化学性质比较稳定的标准品,[/font][/size][/font][font=宋体][size=10.5000pt]容易吸潮的标准品,[/size][/font][font=Calibri][size=10.5000pt][font=宋体]建议保存于干燥阴凉的地方[/font][/size][/font][font=宋体][size=10.5000pt],比如柚皮苷,香蒲新苷等[/size][/font][font=Calibri][size=10.5000pt][font=宋体]。[/font] [/size][/font][font=宋体][size=10.5000pt][font=宋体]([/font]2[font=宋体])[/font][/size][/font][font=Calibri][size=10.5000pt]4[/size][/font][font=宋体][size=10.5000pt]~6[/size][/font][font=宋体][size=10.5000pt]℃[/size][/font][font=Calibri][size=10.5000pt][font=宋体]冷藏:用于常温下不是很稳定的物质,保存于冰箱冷藏室[/font][/size][/font][font=宋体][size=10.5000pt],比如咖啡酸、淫羊藿苷等[/size][/font][font=Calibri][size=10.5000pt][font=宋体]。[/font] [/size][/font][font=宋体][size=10.5000pt][font=宋体]([/font]3[font=宋体])[/font][/size][/font][font=Calibri][size=10.5000pt]-20[/size][/font][font=宋体][size=10.5000pt]℃[/size][/font][font=Calibri][size=10.5000pt][font=宋体]冷冻:用于化学性质不稳定,常温下容易分解的物质[/font][/size][/font][font=宋体][size=10.5000pt],比如梓醇、毛蕊花糖苷等[/size][/font][font=Calibri][size=10.5000pt][font=宋体]。[/font] [/size][/font][font=Calibri][size=10.5000pt][img=,690,517]https://ng1.17img.cn/bbsfiles/images/2020/06/202006281315420051_3698_1858223_3.jpg!w690x517.jpg[/img][/size][/font][font=Calibri][size=10.5000pt][img=,690,517]https://ng1.17img.cn/bbsfiles/images/2020/06/202006281315074679_1542_1858223_3.jpg!w690x517.jpg[/img][/size][/font][font=宋体][size=10.5000pt]3 [font=宋体]标准品的配制 [/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]([/font]1[font=宋体])标准品使用前从储藏室取出平衡至室温才能进行称量,[/font][font=宋体]标准品使用过程中,已取出的[/font][/size][/font][font=宋体][size=10.5000pt]标准品严禁再放回原瓶中。[/size][/font][font=宋体][size=10.5000pt][font=宋体]([/font]2[font=宋体])称量完成后立即用封口膜封好,按瓶标签上的储存条件放置。[/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]([/font]3[font=宋体])配置好的标准品溶液实验室储存在[/font][font=Calibri]10ml[/font][font=宋体]棕色小瓶里面,保存,密封性比容量瓶要好。[/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]([/font]4[font=宋体]) 标准品的配制需要先了解标准品的溶解度,这里我先说一下有一次配制蒙花苷对照品时遇到的一些问题,蒙花苷的溶解度特别不好,在首次配制的时候发现,称取[/font][/size][/font][font=宋体][size=10.5000pt][font=Calibri]5 mg[/font][font=宋体]到[/font][font=Calibri]25 ml[/font][font=宋体]的容量瓶中,加入甲醇超声,加热发现都不溶解,最后发现定容到[/font][font=Calibri]100ml[/font][font=宋体]才能完全溶解。所[/font][/size][/font][font=宋体][size=10.5000pt]以一定要注意标准品的溶解度。[/size][/font][font=宋体][size=10.5000pt][img=,690,517]https://ng1.17img.cn/bbsfiles/images/2020/06/202006281316115241_7572_1858223_3.jpg!w690x517.jpg[/img][/size][/font][font=宋体][size=10.5000pt][font=宋体]后记:我只想说标准品是分析人员做实验的[/font]“定心丸”,有了标准品才能保证数据定性定量的准确性。[/size][/font]
各有关单位、各位专家: 食品营养强化剂富硒酵母等10项标准分别被列入2010-2013年食品安全国家标准制(修)订计划项目(项目名称及编号见附表1),中国食品发酵工业研究院和中国食品添加剂和配料协会作为此批项目承担单位,负责组织该批标准的制(修)订工作。 按照食品安全国家标准的制标程序,该标准起草工作组在研究了相关标准技术资料、行业调研、样品检测、数据分析等工作的基础上,提出了标准征求意见稿。为使标准更加科学、合理、适用,现将标准征求意见稿发送给各相关单位及有关专家,广泛听取意见。请贵单位在认真研究的基础上,提出修改意见及建议并填写“标准征求意见反馈表”(见附表2),并请于2014年10月10日前将对标准的意见及建议以电子邮件或传真发至中国食品发酵工业研究院(全国食品发酵标准化中心),标准起草工作组将根据所收集的合理建议对标准进行修改。 联系方式:中国食品发酵工业研究院(全国食品发酵标准化中心) 地址:北京市朝阳区酒仙桥中路24号院621室 邮编:100015 电子信箱:crucifix228@aliyun.com;foodstan@sohu.com 电话:010-53218288转6652,010-53218330 传真:010-53218325 联系人:刘捷(13811300593)、李惠宜 标准项目名称及编号编号标准项目名称项目编号1食品营养强化剂 富硒酵母spaq-2013-322食品营养强化剂 乳铁蛋白spaq-2013-373食品营养强化剂 生物素spaq-2013-174食品营养强化剂 富硒食用菌粉spaq-2013-295食品营养强化剂 DHA(金枪鱼油) spaq-2013-336食品营养强化剂 维生素C磷酸酯镁spaq-2013-167食品添加剂 蔗糖聚丙烯醚spaq-2013-378食品添加剂 氧化铁黑201001039食品添加剂 氧化铁红2010010310食品添加剂 溶菌酶指定标准转化 中国食品发酵工业研究院 中国食品添加剂和配料协会 2014年9月9日 附件1 标准项目名称及编号 附件2 (征求意见稿)意见反馈表 附件3 10项标准征求意见稿及编制说明 附件4 关于征求《食品安全国家标准 食品营养强化剂 富硒酵母》等10项标准(征求意见稿)意见的函.PDF