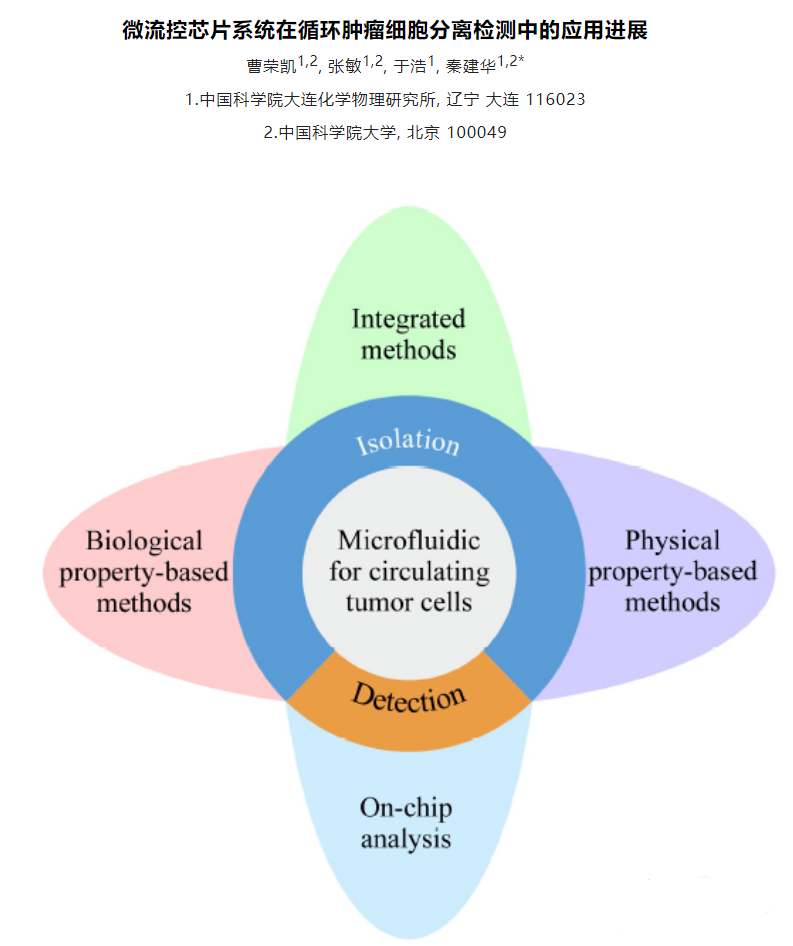
单细胞拉曼分选仪(RACS):探索微观世界的利器
马波*,籍月彤,刘阳,徐健* 摘要: 单个细胞是地球上生命活动的基本单元,单细胞精度的科学研究能够揭示生命科学的本质问题,已经成为国际研究热点。拉曼激活细胞分选(Raman-activated Cell Sorting,RACS)能够利用“单细胞拉曼图谱”这一细胞内在、免外源标记的“生化指纹”进行功能分选,突破“细胞功能异质性原理”、“大多微生物尚难培养”等共性科学问题与重大技术屏障。本文介绍了拉曼光谱在单细胞功能识别方面的研究进展,详述了基于拉曼光谱的单细胞分选技术和核心器件研制的产业化过程。同时,介绍了近期推出的第一代商品化的RACS仪器,并且讨论了这些国产仪器装备为医药、海洋、土壤/环境、工业生物技术领域提供的原创解决方案。这些拥有自主知识产权的国产高端仪器装备将广泛服务于工业过程在线实时监控、细胞工厂筛选、工业/土壤/海洋种质资源挖掘、临床精准用药及新能源开发等。 关键词:拉曼组,单细胞表型组,拉曼激活细胞分选,国产仪器装备,单细胞分选技术与核心器件 单个细胞是地球上生命活动的基本单元,因此单个细胞精度的生命系统研究能够揭示“细胞功能异质性机制”这一生命科学的本质问题1。传统的、基于细胞群体水平性状测量的信息并不能真实反映细胞内部的生物过程及机制2,3,这是因为,在细胞种群中,即使是基因组信息完全一致的不同单个细胞之间,其表型也具有极为显著的差异,而这些差异往往具有重要的生物学意义4,5。因此,单个细胞的研究能够带来生物技术在能源、环境、健康、农业、海洋等广泛应用领域的突破。2018年,利用单细胞测序技术完成的胚胎发育初期单细胞命运追踪被Science杂志评为2018年最重要的十大科学进展之首。近两年来,世界顶级学术期刊《科学》《自然》分别有43篇和38篇文章聚焦于单细胞分析。 (一)拉曼组技术是单细胞功能识别的创新工具和有力武器。 自上个世纪以来,研究人员主要通过荧光标记与流式细胞术的结合实现单细胞功能分选,即荧光激活细胞分选(Fluorescence-activated Cell Sorting,FACS)6。然而,FACS一般需要针对特定的生物标识物对细胞外加荧光标记,因此在单细胞分选方面存在如下瓶颈:(1)细胞适用性有限。不论在干细胞发育的机理研究、肿瘤细胞的诊断,还是微生物群落中功能组分的识别中,关键的细胞表型经常仅有粗放认识或完全未知(即“未知”的细胞表型),也没有其生物标记。因此,FACS通常难以分选那些生物标识物通常未知或难以外加活体荧光标记的细胞体系(如微生物群落等)。(2)难以开展“原位”研究。进入细胞的荧光标记经常会改变细胞的原位状态,有时甚至影响细胞活性,因此该方法通常仅限于能够进行外加荧光标记的细胞,而且难以进行真正意义上的“原位”研究。(3)难以获取全方位的代谢表型。FACS在单位时间只能获得与区分很有限的细胞信息数据,如形态、折光率、反射率或荧光强度等有限指标,难以表征单细胞全方位的“代谢表型组”,因此通常不易获得尚难培养微生物与其生态功能之间的原位联系。 拉曼光谱是一种非标记的散射光谱,每个单细胞拉曼光谱由分别对应于一类化学键的超过1500个拉曼谱峰组成,反映了特定细胞内化学物质的成分及含量的多维信息。因此,特定时空状态下一个细胞群体的单细胞拉曼光谱的集合称为“拉曼组”7。由于细胞内化合物的组成对于细胞生理状态和微环境的变化等因素敏感,因此单细胞拉曼图谱或拉曼组不仅潜在能区分不同物种的细胞,还可以静态或动态地表征该细胞的生理状态及所处微环境8。 业界研究表明,利用拉曼组可实现较为广泛的细胞类型及功能的表征8。例如,Forrester和Deng等分别利用拉曼光谱成功地对多株芽孢杆菌属细菌的生化特性进行了鉴定,发现根据拉曼光谱信息可实现菌株水平的鉴定,并分析了各菌株之间可能的遗传进化关系9,10。在细胞功能识别方面,Samek和Singh等分别通过检测拉曼图谱分析了不同微藻的油脂产量,并建立了通过分析特定峰位比值来估测脂类不饱和度的方法11,12。Heraud等通过检测细胞拉曼图谱,对微藻细胞所处的营养状态(缺氮与否)进行判别和预测13。在临床方面,2011年Dochow等通过微流控芯片结合拉曼光镊技术,成功对人体白细胞、红细胞、急性髓性白血病细胞以及两种乳腺癌细胞进行了鉴别14。利用癌细胞的生化表型与正常细胞的区别,Barman15, Surmacki16和Haka17分别独立地证实了单细胞拉曼可用于乳腺癌早期诊断。此外,中国科学院青岛生物能源与过程研究所单细胞中心等也证明,单细胞拉曼光谱可以区分或定量表征细菌细胞的种系发生18、药物应激反应与耐药性19,20、分解代谢(综合细胞代谢活性21、分解特定底物的活性22)、合成代谢(甘油三酯含量及油脂饱和度23,24、淀粉含量25)、不同物种之间的代谢互作26等。 (二)基于拉曼光谱的单细胞分选技术和核心器件是单细胞组学研究获得突破性进展的关键。 拉曼激活细胞分选(Raman-activated Cell Sorting,RACS)能够利用“单细胞拉曼图谱”这一细胞内在、免外源标记的“生化指纹”进行功能分选,建立单细胞功能表征和单细胞组学分析之间的桥梁,突破“细胞功能异质性原理”、“大多微生物尚难培养”等共性科学问题与重大技术瓶颈27,28。随着微流控技术的进步,一系列基于拉曼光谱的单细胞分选技术和核心器件先后面世,其中包括在静止或者相对静止系统中进行的拉曼光镊分选21,29,30、单细胞拉曼弹射分选(RACE)18,31和拉曼激活光镊重力驱动微液滴分选技术(RAGE)32,以及在液相流动态细胞中进行的拉曼激活微流分选(RAMS)33、拉曼激活单细胞微液滴流式分选(RADS)34、介电迟滞拉曼激活单细胞微液滴流式分选(pDEP-RADS)。 RACE适用于静置或贴壁细胞的单细胞分选。该技术在风干的芯片上对细胞逐一测量拉曼信号后,用脉冲激光弹射出具有目标拉曼信号的细胞18。通过改进弹射基片材料,RACE可以在背向直接采集拉曼信号,降低了操作的繁琐性并大幅提升了全流程的速度和通量35 同时,“All-In-One”RACE芯片的面世,让测量、弹射、细胞裂解与核酸扩增都在同一与空气隔绝的封闭体系内进行,从而降低了环境DNA对目标单细胞核酸扩增的污染35。近期油相震荡乳化单细胞MDA方法的开发,使RACE分离的纯培养E. coli(每个MDA体系含5个细胞)基因组覆盖度由通常的青岛星赛生物科技有限公司依托于中国科学院青岛生物能源与过程研究所单细胞中心的原创技术与知识产权,自主研发了一系列基于拉曼组原理的原创单细胞拉曼分选仪器装备。 单细胞拉曼分选-测序耦合系统(Raman-Activated single-Cell Sorting RACS-Seq)克服了单个细胞拉曼分离可靠性低、核酸扩增容易污染、全基因组测序覆盖度不均等关键技术难点,具备样品预处理、显微拉曼成像、RAGE/RADS拉曼分选、单细胞微液滴细胞裂解和核酸扩增、拉曼组分析软件等功能,实现了单细胞功能检测、分选、测序与培养之完整流程的仪器化。RACS-Seq带有配套的RAGE、RADS、pDEP-RADS等芯片和相应试剂盒(环境样品中微生物单细胞提取与制备、稳定同位素饲喂细胞、单细胞核酸裂解与扩增等),能够满足不同实验目的所需的单细胞识别、分选和测序文库构建,并且适用于任何大于0.5 μm的细菌、古菌和真菌细胞(也适用于微藻、植物、动物及人体细胞)。 临床单细胞拉曼药敏快检仪(Clinical Antimicrobial Susceptibility Test Ramanometry CAST-R)是临床样品之病原鉴定、药敏性表型测量及耐药基因解析的一体化装备。它基于重水饲喂单细胞拉曼光谱技术,不需分离培养而直接鉴定病原种类,并测量基于代谢活性抑制的药敏性表型(及其在细胞之间的异质性),全流程可在3小时内完成,将目前检测时长缩短至1/10 20。进而通过单细胞微液滴光镊拉曼分选与核酸扩增技术,完成低偏好性、高覆盖度、与耐药表型关联的单细胞基因组测序。最新论文证明,该系统能从临床菌群中直接、精准地获取一个细菌细胞的药敏表型及其完整基因组(以往未有先例) 32。CAST-R在单个细菌细胞精度同时追踪“药敏表型-完整基因组”的独特能力,预期将为临床感染诊断和用药、耐药性传播监控、微生态监控等提供新一代解决方案。 单细胞拉曼表型监测系统(Raman-Activated Phenotyping System RAPS)是基于拉曼复合表型对细胞工厂进行单细胞水平高通量、低成本、非入侵式的快速表型监测装备。现有发酵过程的监控方案存在三大问题:1)时间精度,目前只能通过离线方式对各表型分别进行测定,由于样品处理和测量时间带来的滞后性,使得微生物发酵过程的控制比一般的工业生产难度更大 2)表型精度,由于缺乏综合表型表征手段,只能通过胞外产物尽量刻画细胞状态 3)测量精度,现有表型的测量均基于群体水平大量细胞的平均性状,在高压、高浓、高密度、且营养物质不均一的发酵过程中,细胞之间的差异被累积并级联放大,而群体水平的平均性状掩盖了这种差异的发生/发展和变化规律,无法反映细胞的真实状态。RAPS克服了现有方法的滞后性、可检测表型有限,以及无法反映细胞异质性等局限,为细胞工厂研究提供了一个高效、全景式的表型鉴定和过程监测方案。 模块式单细胞微液滴分离系统(EasySort)是一款拥有自主知识产权的小型台式仪器。它小巧灵活,操作简便,能够自由地与各种型号的显微镜搭配组装,轻松将明场/荧光/拉曼显微镜升级为“所见即所分”、保持原位状态与活性的细菌单细胞精准功能分选装置。在显微镜的视野下,具特定表型的直径大于0.5 μm的单细胞均能够被迅速包裹成单液滴,并通过独有的重力驱动专利技术迅速移动到孔板或者EP管中,对接下游实验。因其兼具超高的性价比、便携的外形、灵活的适配度、简易的用户界面以及优秀的细胞活性保持等众多优势,EasySort将广泛应用于各类单细胞的分离、分选、培养及测序实验。 高通量流式拉曼分选仪(High-throughput RACS:FlowRACS)搭载了具自主知识产权的pDEP-RADS技术,通过在高速液流中基于介电迟滞来精确捕获和采集单细胞拉曼信号,克服了单细胞拉曼分选的通量限制,以及微液滴对于拉曼表型鉴定的影响,巧妙地集成了单细胞拉曼信号采集与单细胞微液滴发生。同时它利用全光谱实时判别算法,实现了活体单细胞超高通量拉曼分选的高度自动化。 (四)原创国产单细胞拉曼分选装备将服务于医药、土壤/环境、海洋和工业生物技术等广阔领域。 上述介绍的这些拥有自主知识产权的原创仪器装备已经支撑着临床精准用药、生物资源挖掘、环境微生态机制、细胞工厂筛选、工业过程监控等广阔领域。 在医药领域,细菌耐药性蔓延是临床感染面临的严重危机。当前基于培养原理的病原鉴定和药敏仪器检测一般需要花费2-3天。而CAST-R不再需要培养,而是基于重水标记单细胞拉曼光谱,在3小时之内即可完成针对代谢活性抑制的药敏性实测,而且将具有耐药表型的目标耐药菌单细胞分离出来,直接耦合细菌单细胞基因组测序,实现了在单个细菌/真菌细胞的精度,挖掘耐药基因及突变、追踪病原传播和考察耐药微进化机制。利用CAST-R针对临床尿液样品的初步分析显示,基于单细胞拉曼的菌株鉴定准确率达到93%,药敏测试与培养法的一致性达到90%。同时,从临床尿液样本中直接识别和分选出耐受特定抗生素的临床E. coli,并进行了精确到一个细菌细胞的全基因组测序,覆盖度可达99.5%32,保证了基因组上所有耐药基因突变均得以全面、精确地揭示。 在海洋和土壤/环境领域,“99%的微生物难培养”、“异质性普遍存在”、“原位功能难以测量”等因素均对环境功能基因研究、种质资源挖掘、生态环境监测等提出了严峻的挑战。借助RACE技术,研究人员以中国黄海近海真光层的新鲜海水为模式,用13C-NaHCO3饲喂其微生物组,然后通过测量海水拉曼组中各个单细胞拉曼图谱上13C峰的动态特征,分辨出在海水中活跃固定与代谢无机碳的单细胞群。同时,分选这些原位固碳单细胞群(30个细胞混合)并测定其DNA序列,可重构出基因组草图35。后续研究表明,利用搭载RAGE-Seq芯片的RACS-Seq系统,可以分选获取海水中单个原位固定CO2的目标细菌细胞,并且对1个细胞的基因组即可获得超过95%的基因组覆盖度。对于土壤样品,则可以基于重水孵育、针对代谢活性进行菌群中功能细胞的识别、分选和测序,单个细胞的基因组覆盖度可达90%。 在工业生物技术领域,新兴的合成生物学需要对细胞工厂进行人工设计并构建具新功能的生物系统,从而建立药物、材料或能源替代品等的生物制造途径36。其中细胞表型的测试筛选工作是合成生物技术发展的“限速步骤”之一。代谢物是细胞中基因表达的最终产物,因此对细胞代谢物组或代谢状态的检测是细胞功能检测最直接有效的手段之一。利用RACS-Seq,可以快速、非侵入性、不须标记地以单个活体细胞中淀粉含量这一特定表型对莱茵衣藻和小球藻进行快速表型鉴定,为富含淀粉的种质资源选育提供了一种崭新手段25。在莱茵衣藻和微拟球藻中,利用RACS-Seq可针对单个细胞中淀粉、蛋白质、甘油三酯含量和脂质不饱和度等表型对目标细胞进行快速筛选24。利用RACS-Seq,还能够针对CO2利用速率这一特定表型对海水中难培养微生物进行分选和测序,从而完成功能基因及种质资源挖掘35。 此外,在酶活筛选方面,将未知功能的酶基因库转化入酵母底盘中,利用FlowRACS基于拉曼光谱、不需酵母培养和纯化而直接识别和定量其单细胞精度的目标代谢物,进而高通量流式拉曼分选目标单细胞,并利用下游测序快速识别其中表达的目标化合物合成酶。因此,FlowRACS大大节约了时间、耗材和人力的成本,可将酶的筛选效率提高100到1000倍。 总之,拉曼组和单细胞拉曼分选基于细胞本征性的生化指纹图谱来识别与分选特定“代谢表型组”的目标细胞,具有不需预知生物标识物、不需标记、非侵入性、可全景式识别细胞代谢表型等核心优势8。因此,包括RACS-Seq,CAST-R,RAPS,EasySort以及FlowRACS等在内的单细胞分析仪器系列(青岛星赛生物科技有限公司),将在精准医疗、大健康、生物资源挖掘、生态监测、生物安全、工业生物技术等领域得以广泛应用,同时为单细胞研究提供全新的科学思路、技术路线和仪器装备。 参考文献: 1 Schubert, C. Single-cell analysis: The deepest differences. Nature 480, 133-137, doi:10.1038/480133a (2011). 2 Eldar, A. & Elowitz, M. B. Functional roles for noise in genetic circuits. Nature 467, 167-173, doi:10.1038/nature09326 (2010). 3 Spiller, D. G., Wood, C. D., Rand, D. A. & White, M. R. Measurement of single-cell dynamics. Nature 465, 736-745, doi:10.1038/nature09232 (2010). 4 Elowitz, M. B., Levine, A. J., Siggia, E. D. & Swain, P. S. Stochastic gene expression in a single cell. Science 297, 1183-1186, doi:10.1126/science.1070919 (2002). 5 Yoon, H. S. et al. Single-cell genomics reveals organismal interactions in uncultivated marine protists. Science 332, 714-717, doi:10.1126/science.1203163 (2011). 6 Bonner, W. A., Hulett, H. R., Sweet, R. G. & Herzenberg, L. A. Fluorescence activated cell sorting. Rev Sci Instrum 43, 404-409, doi:10.1063/1.1685647 (1972). 7 Xu, J. et al. Emerging trends for microbiome analysis: from single-cell functional imaging to microbiome big data. Engineering 3, 66-70 (2017). 8 He, Y., Wang, X., Ma, B. & Xu, J. Ramanome technology platform for label-free screening and sorting of microbial cell factories at single-cell resolution. Biotechnol Adv 37, 107388, doi:10.1016/j.biotechadv.2019.04.010 (2019). 9 Forrester, J. B., Valentine, N. B., Su, Y. F. & Johnson, T. J. Chemometric analysis of multiple species of Bacillus bacterial endospores using infrared spectroscopy: discrimination to the strain level. Anal Chim Acta 651, 24-30, doi:10.1016/j.aca.2009.08.005 (2009). 10 Deng, A. H., Sun, Z. P., Zhang, G. Q., Wu, J. & Wen, T. Y. Rapid discrimination of newly isolatedBacillaleswith industrial applications using Raman spectroscopy. Laser Phys Lett 9, 636-642, doi:10.7452/lapl.201210052 (2012). 11 Samek, O. et al. Raman microspectroscopy of individual algal cells: sensing unsaturation of storage lipids in vivo. Sensors (Basel) 10, 8635-8651, doi:10.3390/s100908635 (2010). 12 Wu, H. et al. In vivo lipidomics using single-cell Raman spectroscopy. Proc Natl Acad Sci U S A 108, 3809-3814, doi:10.1073/pnas.1009043108 (2011).单细胞中心合影 中国科学院青岛生物能源与过程研究所单细胞中心(徐健、马波、籍月彤、刘阳 所在单位)简介:中国科学院青岛生物能源与过程研究所是由中国科学院、山东省人民政府、青岛市人民政府于2006年7月启动筹建,2009年11月30日通过共建三方验收并纳入中国科学院“知识创新工程”管理序列的国立科研机构。单细胞中心的核心使命是以基因组工程、工具酶开发、先进成像、微流控器件、大数据等为主要方法学支撑,围绕细胞工厂构建、微生物组快检及机制等领域的关键科学和技术瓶颈,开发单细胞分析、分选、测序与培养技术,研制与产业化单细胞分析仪器系列,从国产装备的角度支撑单细胞大数据网络和微生物组天网等原创大数据系统,服务于工业生物技术、大健康、海洋资源挖掘、环境保护与修复、生物安全等应用领域。 青岛星赛生物科技有限公司(籍月彤所在单位):青岛星赛生物科技是一家专注于单细胞分析科研设备及临床诊断仪器研发与产业化的创新型高新科技企业。竭诚为科学研究人员、工业生物技术人员、以及临床工作者提供高效、可靠、一体化全方位的单细胞水平解决方案,着力打造国产高端生命科学仪器品牌。产品应用于工业过程监控、工业及海洋种质资源挖掘、临床精准用药、微生物组研究、生物安全及新能源开发等领域。