如何称取3毫克的对照品?最近我取3毫克的对照品放到100毫升的容量瓶中称量,发现十万分之一的天平读数总在增加,觉得结果不准,大家有什么好的方法称量?
今天做了一个感冒灵颗粒的鉴别,样品点能与对照品扑尔敏点对上,但是就是与对照品对己酰氨基酚难对上,药典要求是15ul,我把对照品的量减少了,样品的量加大了一倍,也不是很容易找到,请问这是什么原因?
[color=#444444]请问大神们,麻烦大家帮我分析一下,我实在没法了:我用浓度为30微克/ml的山奈素对照品溶液跑高液,色谱条件是甲醇:0.4%磷酸水比例50:50,,流速1ml/min,柱温30℃,检测波长为360nm.进样量为20微升.为什么跑不出来任何峰形啊。。用异鼠李素对照品都能跑出来的,山奈素的出峰位置应该是在异鼠李素之前的。。。[/color][color=#444444][/color]
欢迎hgy154担任试剂标物-标准物质/标准品/对照品版主!我们希望有更多的热心用户能加入到版主队伍中来,也希望在职的版主能在版面中发现有能力的热心用户推荐给我们。论坛正在招募版主,有兴趣的用户请参见这个帖子:http://www.instrument.com.cn/bbs/shtml/20071101/1042199/
如果要称量几毫克的对照品,一般都是怎么称量的呢?
我不知道如何根据现在的样品和对照品的峰面积来确定最后的一系列对照品浓度来做线性关系?
化学对照品需要105℃烘恒重吗?还有配标准液最少称多少毫克?谢谢!
[color=#333333]对照品与标准品概念[/color][color=#333333]对照品与标准品是2个不同的概念,中国药典凡例中已有明确的定义:对照品系指用于鉴别、检查、含量测定和校正检定仪器性能的标准物质,而标准品系指用于生物检定、抗生素或生物药品中含量或效价测定的标准物质,以效价单位(U)表示.文献中常将2种概念混淆,认为对照品就是标准品,是1种物质2种提法而已[1,2],造成错误的原因,可能是有的药品既有对照品,又有标准品.例如,当用微生物法测定头孢克罗效价时,用头孢克罗标准品,用HPLC或UV法测定时,则用对照品;非那西丁当用作熔点校准物质时,用熔点标准品,测定含量时,用对照品.即使是同一种物质的标准品和对照品,它们的规格、标定方法以及用途都可能是不同的.[/color]
对照品:用于鉴别、检查、含量测定和校正检定仪器性能的标准物质;对照品由国家药品检定机构审查认可,其标准应不低于制品的质量标准。 标准品:用于生物检定、抗生素或生物药品中含量或效价测定的标准物质,以效价单位(U)表示。 对照品与标准品概念不清?对照品与标准品是2个不同的概念,中国药典凡例中已有明确的定义:对照品系指用于鉴别、检查、含量测定和校正检定仪器性能的标准物质。标准品:用于生物检定、抗生素或生物药品中含量或效价测定的标准物质,以效价单位(U)表示。文献中常将2种概念混淆,认为对照品就是标准品,是1种物质2种提法而已,造成错误的原因,可能是有的药品既有对照品,又有标准品。 例如:当用微生物法测定头孢克罗效价时,用头孢克罗标准品,用HPLC或UV法测定时,则用对照品;非那西丁当用作熔点校准物质时,用熔点标准品,测定含量时,用对照品。即使是同一种物质的标准品和对照品,它们的规格、标定方法以及用途都可能是不同的。
大家好,我有一个样品是酸性的,对照品有点拖尾,但是不是很严重,样品比较严重,我加了点磷酸,没有得到改善!我不知道可以加点三乙胺吗?
我在做陈皮含量的时候,橙皮苷对照品用甲醇不溶解,请问谁可以指点一下?
各位兄弟,最近在抄报20种香港注册标准有机氯对照品,香港标准中只有“环氧七氯”,我在采购德国DR公司品种的时候,发现有“环氧七氯A Heptachlor-endo-epoxide (Isomer A) ”和“环氧七氯B Heptachlor-exo-epoxide (Isomer B) ”,我想问下你们在采购对照品的时候用的是哪种?
大家好!我正在用氨基柱分离单糖,之前都好好的,就是分离度较叉。昨天突然发现所有对照品的峰都有了分叉。开始我以为是因为我进的样品针是酸性的缘故,于是我用10倍柱体积的乙腈-0.5%的氨水(50-50)洗了柱子,然后用正常流动相洗了柱子。今天进对照品时发现还是老样子,没有改善。有人说是柱头塌陷了,有这么严重么?还有没有其它原因啊?请有心人帮帮忙啊!一个新手碰到了这样的问题真的很急很担心啊!请帮帮忙!谢谢!!!!
各位大虾,在做液相时称量对照品真是个头疼的问题。我用的是赛多利斯十万分之一的天平称量,价格贵啊,所以每次称量几毫克,但是天平读数变化好大哦,好一会儿才稳定,咨询买仪器的人家说就是那样,我总觉得不保险啊。这对照品都不准的话,怎么保证结果啊,打算用称量漏斗来称量,这样读数稳定,不会撒到外面,称两三毫克都很稳定,反复试了试重现性还可以,自认为比较可靠。不知道有没有什么问题啊?各位大侠,您们又是怎么做的呢?
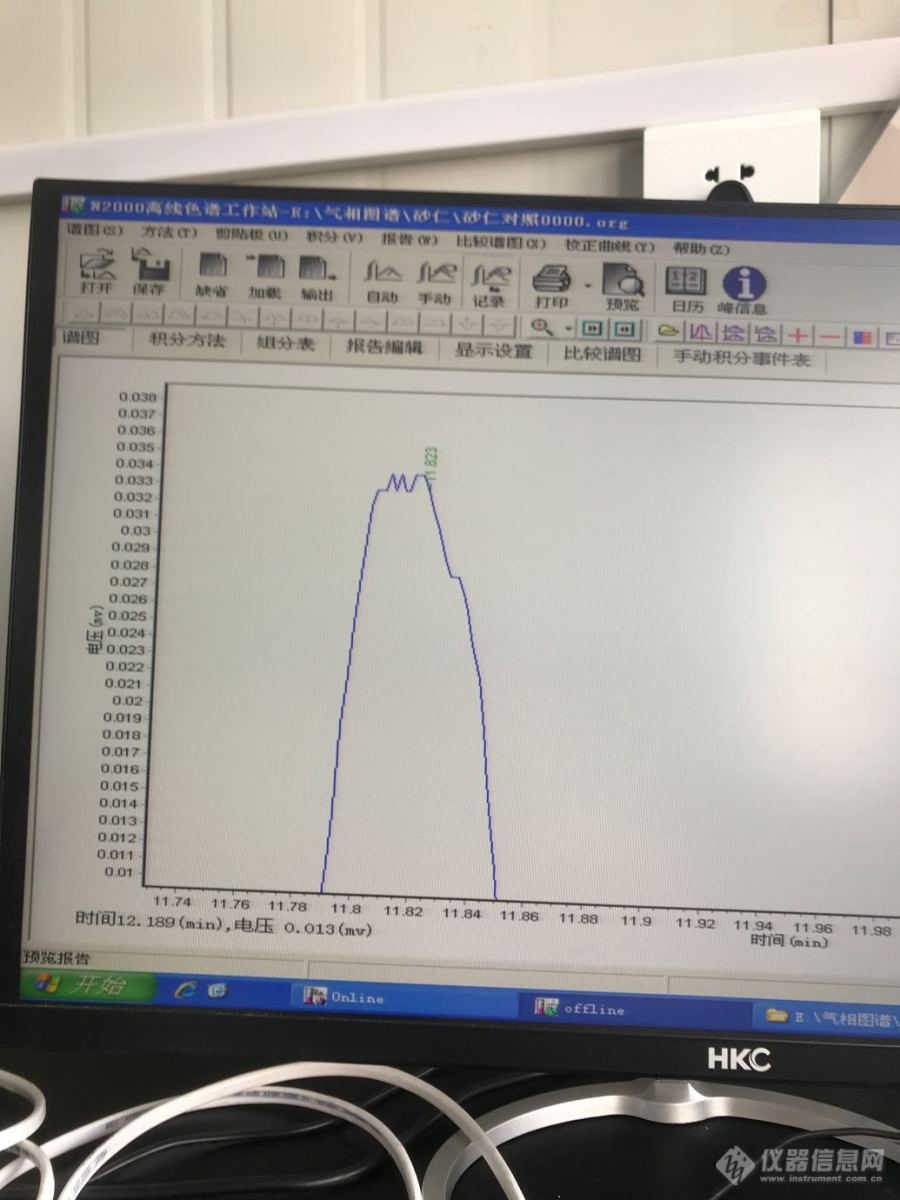
砂仁含量测定,乙酸龙脑脂对照品的峰是这样的,什么原因?[img=,690,920]https://ng1.17img.cn/bbsfiles/images/2019/09/201909291048233492_354_4008962_3.png[/img][img=,690,920]https://ng1.17img.cn/bbsfiles/images/2019/09/201909291048362627_1375_4008962_3.png[/img][img=,690,920]https://ng1.17img.cn/bbsfiles/images/2019/09/201909291048546892_2814_4008962_3.png[/img]
本人现在用[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]测硬脂酸镁,为什么对照品溶液中有很多杂峰,我用的正庚烷是色谱纯级别的,还有到最后计算是用不到对照品的浓度,那为什么还要进对照品?请各位老师指点
请问老师配苍术素对照品时,用甲醇为什么溶解不了,一直有悬浮的颗粒
请问配苍术素对照品时,用甲醇为什么溶解不了,一直有悬浮的颗粒
最近公司要采购中检所出的对照品,不知道从哪里购买?公司要求如果是从经销商购买需要经销商提供药检所的授权书,和检验报告,但是经询问经销商证书和报告都没有,那我怎么证明对照品就是药检所出的, 如果是我们做认证用,我们怎么证明这东西的来源?没有报告没有授权书似乎这东西没有说服力。 如果直接从药检所购买,似乎也很困难,服务差不说,还要托熟人帮忙购买,否则钱打过去都没人理,经销商说药检所都不乐意做生意,遇到这种情况我该怎么办呢?希望大家给出出主意!
药典上配制对照品的时候有的是称取10毫克,用溶剂溶下,再取几毫升稀释下,它这个不直接一步配制好是不是因为怕称取量太少,怕误差大的原因吗?还有其他的原因吗?
我是做中药检验的,以前用的对照品溶液都经0.45滤膜过滤后使用,还做过某两种对照品溶液的测试,峰面积差异不大。但最近我使用黄芩苷对照品时发现检品含量总是很高,反复测试才找到原因,过滤后对照品的峰面积为:3249725.000,没过滤的对照品峰面积为:4933873.000,差异很大,不知道各位朋友使用对照品溶液时是否也经过0.45滤膜过滤?有没有文件规定对照品溶液能否过滤?
大家好,烦情各位高人帮忙指点一下:对国家还没有的标准品或对照品。如果我要做一个提取物上升为标准品或对照品。要做哪些工作,再哪些网站有好的参考资料?
我这有一批对照品要处理,哪个企业要啊,Q我313753741
谁家有抗氧化剂 BHA BHT 的对照品,急求。我在上海长宁我在线等啊:)
请教:注射用水溶性维生素中关于烟酰胺、等5项的液相检测方法其标准为烟酰胺、盐酸吡哆辛、硝酸硫胺、泛酸钠、维生素C钠和核黄素磷酸钠 照高效液相色谱法(中国药典1995年版二部附录Ⅴ D)测定。 色谱条件与系统适用性试验 用氨基键合多孔硅胶为填料,以(0.02mol/L)磷酸二氢钾溶液-乙腈(27:73),用10%盐酸溶液调节pH为5.3的溶液为流动相,流速为1.5ml/min,检测波长:烟酰胺、盐酸吡哆辛、硝酸硫胺、泛酸钠、维生素C钠为214nm;核黄素磷酸钠用萤光检测λEX=445nm、λEM=520nm。各组分的分离度应符合要求。 对照品溶液的制备 (1)取烟酰胺对照品约150mg、硝酸硫胺对照品约12mg、盐酸吡哆辛对照品约18mg、泛酸钠对照品约62mg,分别精密称量置50ml量瓶中,加水溶解并稀释至刻度摇匀,精密量取2ml置50ml量瓶中,用流动相稀释至刻度,摇匀,即为对照品溶液(Ⅰ),此溶液置暗处充氮气于零下20℃可保存1个月。(2)取维生素C钠对照品约425mg、核黄素磷酸钠对照品约19mg,精密称定,置50ml量瓶中加水溶解并稀释至刻度摇匀,精密量取2ml置50ml量瓶中,用流动相稀释至刻度,摇匀即为对照品溶液(Ⅱ),此溶液必须临用新鲜配制,并于零下20℃保存,用前放置至室温。 等容混合对照品溶液(Ⅰ)和对照品溶液(Ⅱ)即为对照品溶液。 供试品溶液的制备 取装量差异项下的内容物约2瓶重量,精密称定,置100ml量瓶中,加水溶解并稀释至刻度,摇匀,精密量取15ml置200ml量瓶中,用流动相稀释至刻度。 测定法 取对照品溶液和供试品溶液各10μl,交替注入液相色谱仪,测定,用外标法计算各组分含量,即得。目前存在问题用紫外检测的分不开5种组分,大家有什么好办法,谢谢
请教各位前辈,我看到标准品和对照品的定义不同“——[url=https://baike.baidu.com/item/%E5%AF%B9%E7%85%A7%E5%93%81]对照品[/url]和标准品一样是指国家药品标准中用于鉴别、检查、含量测定、杂质和有关物质检查等标准物质,它是国家药品标准不可分割的组成部分。国家[url=https://baike.baidu.com/item/%E8%8D%AF%E5%93%81%E6%A0%87%E5%87%86%E7%89%A9%E8%B4%A8]药品标准物质[/url]是国家药品标准的物质基础,它是用来检查药品质量的一种特殊的专用量具;是测量药品质量的[url=https://baike.baidu.com/item/%E5%9F%BA%E5%87%86]基准[/url];也是作为校正[url=https://baike.baidu.com/item/%E6%B5%8B%E8%AF%95%E4%BB%AA%E5%99%A8]测试仪器[/url]与方法的物质标准。在药品检验中,它是确定药品真伪优劣的对照,是控制药品质量必不可少的工具。[url=https://baike.baidu.com/item/%E5%AF%B9%E7%85%A7%E5%93%81]对照品[/url]:是指用于鉴别、检查、含量测定的标准物质,由国务院[url=https://baike.baidu.com/item/%E8%8D%AF%E5%93%81%E7%9B%91%E7%9D%A3%E7%AE%A1%E7%90%86]药品监督管理[/url]部门指定的单位制备、标定和供应。标准品系是用于生物测定、抗生素或生化药品中含量或效价测定的标准物质,以国际标准品进行标定;对照品除另有规定外,按干燥进行计算后使用。[color=#333333]对照品与标准品是2个不同的概念,中国药典凡例中已有明确的定义:文献中常将2种概念混淆,认为对照品就是标准品,是1种物质2种提法而已,造成错误的原因,可能是有的药品既有对照品,又有标准品。例如,当用微生物法测定[/color][url=https://baike.baidu.com/item/%E5%A4%B4%E5%AD%A2%E5%85%8B%E7%BD%97]头孢克罗[/url][color=#333333]效价时,用头孢克罗标准品,用HPLC或UV法测定时,则用对照品;非那西丁当用作熔点校准物质时,用熔点标准品,测定含量时,用对照品。即使是同一种物质的标准品和对照品,它们的规格、标定方法以及用途都可能是不同的。”[/color][color=#333333]这一大段文字看了还是不甚明白,这样说来,标准品的要求更严格,应该都很贵的,我看一个检测方法还有类似文献的时候,都说用物质A的标准品3.0g,配制标准品溶液~~~~~感觉用量太大了。[/color]那我现在用液相做物质A的含量检测时,外标法,这个时候用标准品还是对照品呢?购买试剂的时候,看到纯度97%的某化合物,这个可用用来液相含量检测吗?我感觉特别混乱了,谢谢各位了
今天我把昨天的两份对照品储备液分别稀释成对照品溶液,顶空进样,但是第一份对照品溶液待测组分未出峰,第2份对照品溶液出峰正常,我想问下隔24小时以后再用待测组分都会挥发完全吗?为什么第二份正常出峰呀?对照品溶液里面的组分分别是乙醇,乙酸乙酯,丙酮,二氯甲烷,水为溶剂
[size=3]我是学中药分析的,对化学药的分析不怎么在行。今下午,一同事问我,在西药的含量测定中的K值是什么?我愣了,从来没听说过啊!问我同学,才知道,是为了防止在称取对照品时称量的误差而造成含量测定的误差加大,在称取对照品时,通常是称取两次对照品,配制两个浓度的对照品溶液。然后,计算出一个平均浓度。K值=对照品溶液的浓度/其峰面积以上说的对否?我在做中药分析过程中,从没遇到这种问题,但我觉得,为什么中药分析为什么不采用这种方法?同时,两个平行溶液间配制时,有无要求?如Rd值。[/size]
在抗生素类的标准物质使用时,经常会遇到标准品和对照品的概念。关于这二者的区别,现在比较流行的说法是在做HPLC时使用的标准物质应为对照品。摘录典型观点如下:[B]“标准品都是按效价单位(或μg)计,以国际标准品进行标定。标准品的标示量是按生物活性来计算的,不是按纯度来标示,此种标示法对单组分或多组分物质均适用,尤适用于多组分物质,如乙酰螺旋霉素标准品,是由4种有效成分组成,若欲于一个纯度来标示其含量是不可能的,但用效价(即生物活性)来标示是可行的;对照品的标示量则必定是某单一组分的纯度指标。所以日常工作中,标准品和对照品在定量时是不可相互替代的。以罗红霉素为例,现今是国家标准品与对照品并存,以抗生素微生物检定法测其含量时,必须使用罗红霉素标准品;但以HPLC法测定其含量时,又必须使用罗红霉素对照品,不可混淆。”[/B]但是我见过一些行业标准,比方说HPLC测土霉素残留中,在说到标准液的配制时,写得就是“土霉素标准品”。难道这里面的“标准品”是“对照品”的错误用法?[em0716] 请大家发表一下看法
[size=4]1.所用对照品(标准品)中检所已经发放提供(可参阅中国药典2005年版二部附录ⅩⅤG),且使用方法相同时,应使用中检所提供的现行批号对照品(标准品),并提供其标签和使用说明书,说明其批号,不应使用其他来源者;如使用方法与说明书使用方法不同(如定性对照品用作定量用、效价测定用标准品用作理化测定法定量、UV法或容量法对照品用作色谱法定量等),应采用适当方法重新标定,并提供标定方法和数据;若色谱法含量测定用对照品用作UV法或容量法,定量用对照品用作定性等,则可直接应用,不必重新标定。 2.申报临床研究时,如中检所尚无供应,为不影响注册进度,可先期与中检所接洽制备和标定,申报时提供标定报告、标签(应标明效价或含量、批号、使用效期)和使用说明书;也可与省所合作标定,申报时提供标准品或对照品研究资料,“说明其来源、理化常数、纯度、含量及其测定方法和数据”;标定有困难时,可使用国外药品管理当局或药典委员会发放的对照品(标准品)或国外制药企业的工作对照品(标准品),进行标准制订和其他基础性研究,但应提供其标签(应标明其含量)和使用说明书,能保证其量值溯源性;也可使用国外试剂公司(如sigma公司等)提供的对照品(标准品),但应提供试剂公司该批对照品(标准品)的检测报告(用作含量测定时,应有确定的含量数据),如为高纯度试剂,提供了国外试剂公司检测报告(用作含量测定时,应有确定的含量数据)时,也可使用,并应能保证其量值溯源性,但申请人应及时与中检所接洽对照品(标准品)的标定事宜,临床研究期间完成此工作。 3.直接申报生产品种,如中检所尚无供应,可参照2中要求进行,并提供相应研究资料,但申请人在标准试行期间应与中检所接洽并完成的标定事宜。 4.对照品(标准品)标定的技术要求: 4.1.创新药物 应说明对照品(标准品)原料的制备路线、精制方法、质检报告,提供理化常数和纯度的测定数据及分析结果(包括相关图谱),提供标定方法的研究和验证资料(如与原料药质量研究项下相同,可不再提供)、含量测定数据及经统计分析得到的对照品(标准品)含量结果,并说明进行临床前药学研究、药理毒理学研究所用样品的含量是否用该批对照品(标准品)确定或可用该批对照品(标准品)进行量值溯源。 ●纯度测定方法应选用色谱法,并采用两种以上不同分离机理或不同色谱条件并经验证的色谱方法相互验证比较,同时采用二极管阵列检测器或其它适宜方法检测HPLC法的色谱峰纯度,而后根据测定结果经统计分析确定对照品(标准品)原料的纯度。 ●对于组份单一、纯度较高的药物,对照品(标准品)标定方法宜首选可进行等当量换算、精密度高、操作简便快速的容量法。可根据药物分子中所具有的官能团及其化学性质,选用不同的容量分析方法,但应符合如下条件:(1)反应按一个方向进行完全;(2)反应迅速,必要时可通过加热或加入催化剂等方法提高反应速度;(3)共存物不得干扰主药反应,或能用适当方法消除;(4)确定等当点的方法要简单、灵敏;(5)标化滴定液所用基准物质易得,并符合纯度高、组成恒定且与化学式符合、性质稳定(标定时不发生副反应)等要求。 标定方法的选择要关注如下事项:(1)供试品的取用量应满足滴定精度的要求(消耗滴定液约20ml);(2)滴定终点的判断要明确,提供滴定曲线。如选用指示剂法,应考虑其变色敏锐,并用电位法校准其终点颜色。(3)为排除因加入其它试剂而混入杂质对测定结果的影响,或便于剩余滴定法的计算,可采用“将滴定的结果用空白试验校正”的办法;(4)要给出滴定度(采用四位有效数字)的推导过程。 标定结果要根据3个以上实验室各不少于15组测定结果经统计分析,去除离群值和可疑值后的结果,并报告可信限。 ●如该药物没有可进行等当量换算并符合要求的容量法时,可采用反复纯化的原料,色谱法确定纯度后扣除有关物质、炽灼残渣、水分和挥发溶剂等后的理论含量确定为标准品含量,以此为基准进行对照品(标准品)的换代和量值传递。 ●用于抗生素微生物检定法的第一代基准标准品可参照上述方法标定,如为多组份抗生素,其组份比例应与拟上市产品组份比例一致或接近,或以其中某一组份纯品为基准标准品,但要注意标准品换代时量值传递的恒定。 ●仅用于鉴别定性的化学对照品,注重其结构确证的研究资料,纯度和含量的要求一般可适当降低。 ●杂质对照品,用作限度要求时,应提供其来源(合成路线)、结构确证的研究资料,应具备较高的纯度和含量,并提供纯度和含量的的测定结果,提供质量控制标准。 4.2其他类别药物,可参照4.1要求进行。 ●用于抗生素微生物检定法的标准品须用上市国的国家标准品或原发厂的工作标准品为基准标准品进行标定。标定时采用的原料药应符合相应要求,并提供原料的制备路线、精制方法、质检报告,提供理化常数和纯度的测定数据及分析结果(包括相关图谱)。标定须用现行版中国药典附录收载的“抗生素微生物检定法”-三剂量法,并提供详细的方法学研究,包括检定菌和培养基的选择、剂量和剂距选择、缓冲液选择(如与质量研究项下相同,可不再提供)。每次标定结果均应照“生物检定统计法-量反应平行线测定法(3.3)”法进行可靠性测验及效价计算。按照《药品注册管理办法》,上市药品质量标准所用标准物质均须由中检所负责标定和管理,药品研发过程中,研制单位应注意及时与中检所联系标定事宜,以保证研发工作的连续性。[/size]