借助双光子显微成像技术 北京大学陈良怡团队合作揭示小鼠社交行为神经编码机制
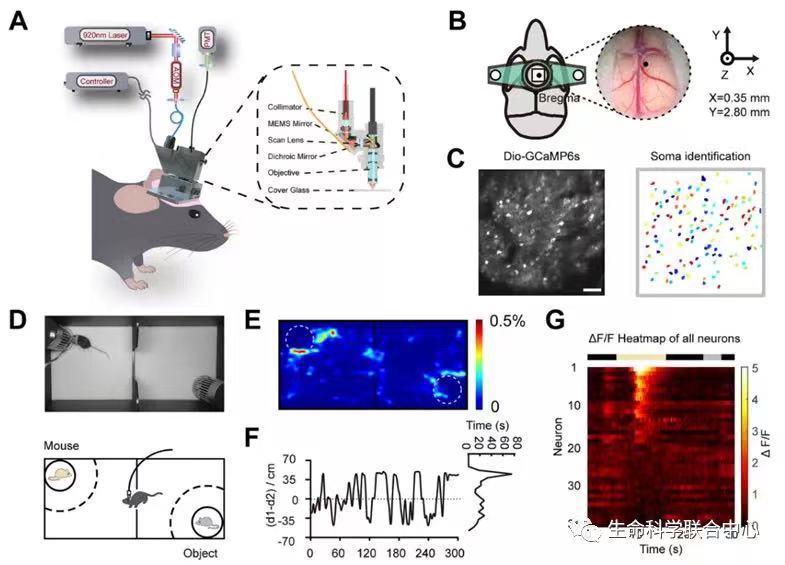
陈良怡团队合作揭示小鼠偏好“喜新厌旧”的神经元集合和孤独症小鼠的缺陷社交行为是个人和人类社会生存和发展的基础。有关大脑通过何种方式编码社交行为信息这一科学问题,目前尚无确切答案。此外,孤独症、抑郁症、精神分裂症、社交恐惧症或创伤后应激障碍(PTSD)等患者,均存在显著社交识别或互动障碍,给家庭、社会和国家带来诸多问题和负担,当前仍缺乏行之有效的干预手段或治疗方法,原因之一在于对大脑处理和编码社交行为信息的神经机制知之甚少。既往研究表明,大脑内侧前额叶皮层(mPFC)在社交探索、社交恐惧和社会竞争等方面均发挥重要调控功能[1-4]。当小鼠进行社交探索行为时,mPFC脑区前边缘皮质(PrL)内部分兴奋性锥体神经元活动会显著增强[5, 6],mPFC神经元集群在处理不同社交对象信息时,其活动表现出较强的异质性[7, 8],而且mPFC脑区内抑制性GABA能中间神经元也同社交行为密切相关[1, 4, 9],然而,由于缺乏在体单细胞分辨率水平、实时动态可视化的神经编码研究方法,这些不同亚型神经元集群是如何编码特定社交对象信息的尚不明了。北京大学未来技术学院分子医学研究所、IDG麦戈文脑科学研究所、北大-清华生命科学联合中心、生物膜国家重点实验室陈良怡实验室,联合军事医学研究院吴海涛实验室以及北京大学工学院张珏实验室,在Science Advances杂志发表了题为“Encoding of social novelty by sparse GABAergic neural ensembles in the prelimbic cortex”的研究论文,解析了孤独症小鼠“喜新不厌旧”社交缺陷下的神经编码机制。在陈良怡实验室和程和平院士团队联合开发两代高时空分辨率的微型化双光子显微成像系统基础上[10, 11],通过建立改进型小鼠两箱社交行为学研究范式,利用MeCP2转基因孤独症小鼠模型和细胞亚型特异性Cre小鼠,借助微型化双光子显微镜钙成像技术,结合基于Tet-off系统的细胞特异性化学遗传学操控技术、CRISPR-Cas9介导的基因编辑和功能挽救等前沿技术,系统探讨了正常和孤独症小鼠模型不同社交行为过程中,PrL脑区内不同亚型神经元集群编码特定社交信息的模式差异。首先,借助微型化双光子钙成像技术,研究人员发现在小鼠自由社交活动过程中,PrL脑区内抑制性中间神经元较之于兴奋性锥体神经元具有更强的相关性。数学分析揭示其中存在稀疏分布的“社交特异”神经元,与之前研究的“社交相关”神经元不同,它们特异性地参与了同“陌生”或“熟悉”老鼠的社交行为。通过化学遗传学技术,特异性抑制社交行为过程中被激活的这些抑制性中间神经元亚群,能够显著破坏小鼠社交偏好及社交新颖性行为。提示PrL脑区内这群稀疏分布的中间神经元集群在调控小鼠社交偏好性以及“喜新厌旧”行为模式中,扮演着极为关键的角色。进一步,研究人员在进行小鼠两箱社交行为学观察时发现,MeCP2转基因孤独症小鼠社交偏好性并无显著缺陷,但会丧失典型的“喜新厌旧”样社交新颖性行为。利用CRISPR-Cas9基因编辑技术,在MeCP2转基因孤独症小鼠PrL脑区中间神经元内特异性剔除外源性MeCP2转基因后,可显著挽救孤独症小鼠“喜新厌旧”样社交缺陷表型。表明PrL脑区抑制性中间神经元内过表达MeCP2转基因可能是诱发孤独症小鼠产生社交新颖性行为缺陷的罪魁祸首。最后,通过系统分析野生型和MeCP2转基因孤独症小鼠模型PrL皮层内编码“陌生”和“熟悉”社交对象信息、且稀疏分布的抑制性中间神经元钙信号动力学特征,研究人员发现,当野生型小鼠分别与“陌生”或“熟悉“小鼠发生社交时,其PrL皮层中编码相关社交对象特异性神经元的发放概率、钙信号变化幅度以及达峰时间均存在显著差别。这两群细胞通过“跷跷板”式的协同增强效应,帮助小鼠确定面对不同类型对象采取不同的社交策略。而孤独症小鼠PrL脑区内相关神经元集群均明显异常,总体表现为“陌生”或“熟悉”社交对象引起社交特异神经元间反应差异消失,从而无法区分“陌生”和“熟悉”不同社交对象之间的差别,最终导致社交新颖性行为缺陷。综上,该研究工作发现在小鼠前额叶皮层内存在一群稀疏分布的中间神经元集群,分别负责编码社交行为中的“熟悉”和“陌生”社交对象信息,这些稀疏分布的神经集群在调控小鼠社交行为,尤其是社交新颖性行为中发挥着重要作用,揭示了个体在面对不同类型对象进行社交行为时的神经编码机制。该研究为深入理解孤独症等神经精神疾病患者社交行为缺陷的神经机制,探索精准靶向诊疗新策略提供了新的证据和线索。PI简历陈良怡北京大学未来技术学院学院教授北大-清华生命科学联合中心PI邮箱:lychen@pku.edu.cn实验室主页:http://www.cls.edu.cn/PrincipalInvestigator/pi/index5489.shtml研究领域:我们发展自驱动的活细胞智能超分辨率成像技术,并应用这些技术来研究生物医学重要问题。目前一方面的工作主要集中在引入物理光学中新成像原理、数学和信息学科中的图像重建新方法等,致力于发展可以在活细胞中实现两种以上模态光学信号探测的三维超分辨率成像的通用工具,实现同一活细胞样本上长时间、超分辨率、三维成像特定生物分子(荧光)和主要细胞器(无标记)。建立基于深度学习等手段Petabyte级的图像数据的高速处理以及分割手段,自动化、定量化描述活细胞内不同蛋白等分子以及细胞器的形状、位置以及相互作用等参数,找到新的细胞器并定义它们生化特性,最终目标是建立单细胞细胞器互作组学以及活细胞超分辨率病理学的概念,利用成像来揭示细胞内的异质性动态变化以及如代谢类疾病的发生发展机制。另一方面,我们也应用发展的高时空分辨率生物医学成像的可视化手段,系统研究血糖调控紊乱激素分泌在活体组织、细胞水平以及分子代谢水平的关系。参考文献:1.Xu, H., et al., A Disinhibitory Microcircuit Mediates Conditioned Social Fear in the Prefrontal Cortex. Neuron, 2019. 102(3): p. 668-682 e5.2.Kingsbury, L., et al., Cortical Representations of Conspecific Sex Shape Social Behavior. Neuron, 2020.3.Báez-Mendoza, R., et al., Social agent identity cells in the prefrontal cortex of interacting groups of primates. Science, 2021. 374(6566): p. eabb4149.4.Zhang, C., et al., Dynamics of a disinhibitory prefrontal microcircuit in controlling social competition. Neuron, 2021.5.Murugan, M., et al., Combined Social and Spatial Coding in a Descending Projection from the Prefrontal Cortex. Cell, 2017. 171(7): p. 1663-1677 e16.6.Liang, B., et al., Distinct and Dynamic ON and OFF Neural Ensembles in the Prefrontal Cortex Code Social Exploration. Neuron, 2018. 100(3): p. 700-714 e9.7.Pinto, L. and Y. Dan, Cell-Type-Specific Activity in Prefrontal Cortex during Goal-Directed Behavior. Neuron, 2015. 87(2): p. 437-50.8.Rigotti, M., et al., The importance of mixed selectivity in complex cognitive tasks. Nature, 2013. 497(7451): p. 585-90.9.Cao, W., et al., Gamma Oscillation Dysfunction in mPFC Leads to Social Deficits in Neuroligin 3 R451C Knockin Mice. Neuron, 2018. 97(6): p. 1253-1260.e7.10.Zong, W., et al., Miniature two-photon microscopy for enlarged field-of-view, multi-plane and long-term brain imaging. Nat Methods, 2021. 18(1): p. 46-49.11.Zong, W., et al., Fast high-resolution miniature two-photon microscopy for brain imaging in freely behaving mice. Nat Methods, 2017. 14(7): p. 713-719.