我发现在做冻干粉针剂的无菌检查时,用0.9%氯化钠溶液溶解药品,后薄膜过滤?有一次,同事错用了pH7.0氯化钠-蛋白胨缓冲液,结果药粉都没溶解。在做一种药品的原料药的微生物限度检查时,一种用pH7.0氯化钠-蛋白胨缓冲液,然后薄膜过滤。请问微生物无菌检查和限度检查时用的冲洗液,为什么有时候用0.9%氯化钠溶液,有时候用pH7.0氯化钠-蛋白胨缓冲液?如何去选择?依据是什么?谢谢!
本文引用自cheney《蛋白胨和胰蛋白胨简介》蛋白胨是将肉、酪素或明胶用酸或蛋白酶水解后干燥而成的外观呈淡黄色的粉剂,具有肉香的特殊气息。蛋白质经酸、碱或蛋白酶分解后也可形成蛋白胨。蛋白胨富含有机氮化合物,也含有一些维生素和糖类。它可以作为微生物培养基的主要原料,在抗生素、医药工业、发酵工业、生化制品及微生物学科研等领域中的用量均很大。不同的生物体需要特定的氨基酸和多肽,因此存在着各种蛋白胨,一般来说,用于蛋白胨生产的蛋白包括动物蛋白(酪蛋白、肉类)和植物蛋白(豆类)等两种。能为微生物提供C源、N源、生长因子等营养物质。因此,蛋白胨从来源上可分为动物性蛋白胨和植物性蛋白胨。胰胨、肉胨、骨胨等都是动物性蛋白胨,而大豆蛋白胨等则是植物性蛋白胨。动物性来源的蛋白胨还有:蚕蛹蛋白胨、血液蛋白胨等。 不同来源的蛋白质和不同的水解条件,其水解物中组成可千差万别。所以胨往往是一个复杂的多肽混合物。可溶于水,过热不凝固,在饱和硫酸铵中不发生沉淀但可为蛋白质沉淀剂所沉淀。可用作微生物和动物细胞培养基、特种功能性食品和化妆品的配料,也有用作啤酒等产品的稳定剂。胰蛋白胨,又称胰酪蛋白胨(Casein Tryptone)、胰酶消化酪蛋白胨(Pancreatic digest of casein),是一种优质蛋白胨,是以新鲜牛肉和牛骨经胰酶消化,浓缩干燥而成的浅黄色粉末。具有色浅、易溶、透明、无沉淀等良好的物理性状。含有丰富的氮源、氨基酸等,可配制各种微生物培养基,用于细菌的培养、分离、增殖、鉴定,以及无菌试验培养基、厌氧菌培养基等细菌生化特性试验用培养基的配置。胰蛋白胨还广泛应用于高品质的抗生素、维生素、医药工业,氨基酸、有机酸、酶制剂、黄原胶等发酵工业,生化制品及微生物学科研等领域中的用量均很大,临床用于抗炎消肿,工业上用于皮革制造,生丝处理,食品加工。在国际市场上,胰蛋白胨也属于货紧价昂的短线品种之一。 胰酪蛋白胨质量标准及其检验标准: 常规各项理化指标: 1. 澄清度(磷酸盐、碱性沉淀):无沉淀、澄清 2. 2%水溶液:透明 3. 酸碱度:6-7 4. 氨基氮:≥3% 5. 色氨酸:≥0.8% 6. 胨含量:≥80% 7. 总氮:≥13% 8. 水份:≤5% 9. 灰份:≤6% 10. 氯化钠:≤0.2%胰蛋白胨特指用胰蛋白酶酶解酪蛋白生成的蛋白胨产物,与一般蛋白胨的区别在于酶解工艺处理上,属于水解度更高、胨分子量更小更均衡的蛋白胨。
配营养琼脂时 换一瓶新蛋白胨 结果发现上次买的一批蛋白胨全成板块了 。。。 还能用吗???
蛋白胨水培养基( l )成分 蛋白胨 10g 水 l000ml 氯化钠 5g ( 2 )制法 取上述成分混合,微温使溶解,调pH 值使灭菌后为7.3 士0.1 ,分装于小试管,121 ℃ 灭菌15 分钟。( 3 )用途 用于鉴别细菌能否分解色氨酸而产生靛基质的生化反应。 ① 靛基质试验取可疑菌落或斜面培养物,接种于蛋白胨水培养基中,置35 ℃ 培养24~48 小时,必要时培养4~5 天,沿管壁加人靛基质试液数滴,液面呈玫瑰红色为阳性,呈试剂本色为阴性。 ② 靛基质试液 称取对二甲氨基苯甲醛5g ,加入戊醇(或异戊醇)75ml ,充分振摇,使完全溶解后,再取盐酸25ml 徐徐滴入,边加边振摇,以免骤热导致溶液色泽变深.或称取对二甲氨基苯甲醛1g ,加人95 %乙醇95ml ,充分振摇,使完全溶解后,再取盐酸20ml 徐徐滴入。
我是做啤酒微生物检测的新手,做了2次菌落总数都没有成功,遇到几个问题请教一下;1.培养基中是用的蛋白胨代替的胰蛋白胨,可以吗?2.空白培养基上有菌落长出。(生理盐水和培养基是用的灭菌锅灭菌,移液管和培养皿是用的牛皮纸包好后160度干燥2小时灭菌。操作在无菌室内的超净工作台上。)个人觉得是不是移液管灭菌不好,培养皿一直都是这样灭菌的,做酵母的时候没有问题。3.有几个细菌长在培养基表面的,大部分长在培养基内部的,一点一点的,不知道是不是这样子的?
为什么大肠菌群MPN法,GB4789.2-2003是用9管的乳糖胆盐,而GB5750做水时候要用15管法的乳糖蛋白胨,而改版后的新GB4789.2008.2中改用LST,其与乳糖胆盐相比又有什么优势呢?
请教各位老师,从一个资料上看说乳糖蛋白胨中的乳糖不能换成葡萄糖是因为葡萄糖经发酵产酸过多使PH达到4.5,使大肠杆菌死亡!这个说法对吗?还有大肠菌群的生长ph范围是多少。有根据吗?
一、目的与要求(一)学习制备培养基的基本技术。(二)制备牛肉膏蛋白琼脂培养基。二、原理牛肉膏蛋白培养基是一种应用最广泛和最普通的细菌培养基,这种培养基中含有一般细菌生长繁殖所需要的最基本的营养物质,可供作繁殖之用,制作固体培养基时须加2%琼脂,培养细菌时,应用稀酸或稀碱将PH调至中性或微碱性。牛肉膏蛋白培养基的配方:牛肉膏0.5%,蛋白胨1%,NaCl0.5%,pH7.4~7.6。三、材料与仪器(一)试剂 牛肉膏,蛋白胨、NaCl、琼脂、1mol/L NaOH、1mol/L HCl。(二)其他 试管,三角烧瓶,烧杯,量筒,漏斗,乳胶管,弹簧夹,纱布,棉花,牛皮纸,线绳,pH试纸,电炉,台称。四、操作步骤(一)称量 根据用量按比例依次称取成分,牛肉膏常用玻棒挑取,放在小烧杯或表面皿中称量,用热水溶化后倒入烧杯,蛋白胨易吸湿,称量时要迅速。(二)溶解 在烧杯中加入少于所需要的水量,加热,ZHU一加入各成分,使其溶解,琼脂在溶液煮沸后加入,融化过程需不断搅拌。加热时应注意火力,勿使培养基烧焦或溢出。溶好后,补足所需水分。(三)调PH 用1mol/L NaOH或1mol/L HCl把PH调至所需范围。(四)过滤 趁热用滤纸或多层纱布过滤,以利于某些实验结果的观察,如无特殊要求时可省去此步骤。(五)分装 按实验要求,可将配制的培养基分装入试管内或三解瓶内,分装装置如实验图8所示;分装时注意,勿使培养基沾染在容器口上,以免沾染棉塞引起污染。1.液体分装 分装高度以试管高度的1/4左右为宜,分装三角瓶的量则根据需要而定,一般以不超过三角瓶容积的1/2为宜。2.固体分装 分装试管,其装量不超过管高的1/5,灭菌后制成斜面,斜面长度不超过管长的1/2。分装三解瓶,以不超过容积的1/2为宜。3.半固体分装 装置以试管高度的1/3为宜,灭菌后垂直待凝。(六)加棉塞 分装完毕后,在试管口或三解瓶口塞上棉塞(或泡沫塑料塞及试管帽等,以阻止外界微生物进入培养基而造成污染,并保证有良好的通气性能。(七)包扎 棉塞头上包一层牛皮纸,扎紧,即可进行灭菌。(八)保存 灭菌后的培养基放入37℃养箱中培养24小时,以检验灭菌的效果,无污染方可使用。
乳糖蛋白胨灭菌完放在室内不放冰箱可以保存吗
乳糖蛋白胨的培养基,是需要自己培养还是买 成品?成品是否需要 检测纯度之类的???
我今天已经把装有乳糖蛋白胨的培养基115[size=2]℃[/size]20min高压灭菌好了,但样品明天才来,那我这培养基可以放到明天才用吗?
刚开始接触蛋白分析,样品等电点在5.0左右,使用C4,300A的反相柱,使用0.1%TFA和乙腈作为流动相,出峰正常,但换用20mM磷酸盐缓冲液(pH=6.5和4.5)和乙腈洗脱就没有峰,调高了乙腈比例仍然没有峰,请有经验的朋友指点,谢谢。
乳糖蛋白胨的培养基,是需要自己培养还是买 成品?成品是否需要 检测纯度之类的???这种合成品符合CMA的要求吗?如果厂家能提供成品的检测报告是否可以使用,,是否符合认定要求???
1、匀浆缓冲液(200 mM Tris–HCl、150 mM NaCl、10 mM EDTA、pH 8.0)怎么配制?2、[font='Times New Roman']Tris–HCl[font=仿宋]缓冲液([/font][font=Times New Roman]50 mM[/font][font=仿宋],[/font][font=Times New Roman]pH 8.0[/font][font=仿宋])怎么配制?[/font][/font]
请问专家,用HPLC分析蛋白多肽,流动相加入三氟乙酸作用是什磨?磷酸盐缓冲液可代替吗?谢谢!
分析化学和生物学科之间的交叉越来越多,大家在用电泳分离蛋白质、多肽的时候都用的什么缓冲溶液?您分离的是那类的蛋白质、多肽?
N-三(羟甲基)甲基-3-氨基丙磺酸,简称TAPS.作为DNA筛分体系中常用的缓冲液体系,也可作为RNA样品的缓冲液成分,适用于叶绿体薄层备样的电子传递和磷酸化研究,在冷冻干燥过程中保护氧合血红蛋白氧化为高铁血红蛋白,也可作为毛细管区带电泳进行蛋白微量分析的背景电解质。
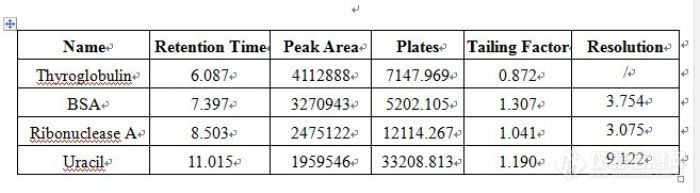
Ultimate® SEC色谱柱是硅胶基质的体积排阻色谱柱,也可以称之为“球状蛋白亲水改性硅胶柱”(中国药典门冬酰胺酶指定色谱柱)。其色谱填料为高纯度、具有良好稳定性的硅胶微球表面键合亲水性聚合物。月旭公司采用特殊的表面修饰技术,确保了该填料具有良好的稳定性和批与批之间的重现性。 Ultimate® SEC填料采用独特的化学键合技术,在硅球表面键合了亲水性聚合物以及亲水性二醇基官能团。双重键合机制使水溶性高分子聚合物、蛋白、生物酶、多肽等生物样品的非特异性吸附极小,因而可广泛应用于水溶性聚合物及生物大分子的分离和测定。Ultimate® SEC色谱填料的特点1) Ultimate® SEC色谱填料由含二醇基官能团的刚性球形硅胶微球表面覆盖亲水性高分子聚合物所组成;2) Ultimate® SEC色谱填料内径为5 μm或3 μm的硅胶微球,能够获得最高的分离效率。3)Ultimate® SEC 120 Å小孔径色谱柱适合分离头孢类等极性目标物;300 Å适合分离蛋白、多肽等生物大分子;4) Ultimate® SEC产品目前有120 Å、300 Å、500 Å和1000 Å四种孔径规格的色谱柱。Ultimate® SEC色谱填料的技术参数http://ng1.17img.cn/bbsfiles/images/2012/09/201209201443_392056_1628076_3.jpgUltimate® SEC色谱柱使用注意事项1)使用前,请把色谱柱用纯水冲洗40-60个柱体积,以确保柱填料能够充分被润湿,防止色谱柱在使用过程中造成固定相塌陷;2)色谱柱在用纯水流动相分析时,需要充分地用纯水流动相平衡色谱柱,待基线充分平稳后进样分析;3)由于该类型色谱柱一般用的流动性是纯水相的缓冲盐,因而色谱柱在使用完以后需要用纯水流动相充分冲洗色谱柱,以保证缓冲盐被充分的清除,防止缓冲盐对色谱柱固定相造成的伤害;4)长时间不使用色谱柱时, 该类型色谱柱保存方式类似于常规的色谱柱,即高比例的有机溶剂-水溶液中,一般有机溶剂的比例为90%。Ultimate® SEC色谱柱可替代市场上同类型产品1) Ultimate® SEC 120 Å可替代的其他厂家色谱柱有:日本东曹Tosoh公司的TSK gel G2000SWxl、日本昭和电工Shodex公司的 PROTEIN KW-802.5、Sepax SRT SEC-150等;2) Ultimate® SEC 300Å可替代的类型有: 日本东曹Tosoh公司的TSK gel G3000SWxl、日本昭和电工Shodex公司的 PROTEIN KW-803、Sepax SRT SEC-300等;3) Ultimate® SEC 500Å可替代的类型有:日本东曹Tosoh公司的TSK gel G4000SWxl、Sepax SRT SEC-300、日本昭和电工Shodex公司的PROTEIN KW-804;Ultimate® SEC型色谱柱性能评价色谱柱:Ultimate SEC(7.8×300 mm,5 μm,300 Å);流动相:150 mM磷酸盐缓冲溶液,pH 7.0(具体配置方法为:称取17.997 g磷酸二氢钠,用超纯水定容至1000 mL,然后用1 M氢氧化钠调节至所需pH值);检测波长:214 nm;流速:0.8 mL/min;柱温:室温(25 oC);进样量:10 μL。样品处理方法:四种标准物质的浓度均为1.0mg/mL,解冻至室温后直接进样;http://ng1.17img.cn/bbsfiles/images/2012/09/201209201447_392057_1628076_3.jpg四种标准物质色谱图(1.甲状腺球蛋白;2.牛血清蛋白;3.核糖核苷酸酶A;4.尿嘧啶)http://ng1.17img.cn/bbsfiles/images/2012/09/201209201448_392058_1628076_3.jpg
用黑曲霉第2代斜面上的菌株如何制作甘油冻存管?20%的甘油里面需要有0.05%的吐温80吗?配制20%的甘油是用生理盐水还是用PH7.0氯化钠-蛋白胨缓冲液?
(1)超声波细胞破碎机适用于5-100g湿菌体超声破碎,实验室规模用。一般可选择直径10、15、20mm的超声探头。推荐国产机器为宁波新芝。(2)高压匀浆机大规模生产用,对菌体量无限制。破菌效果好,但要注意冷却。(3)高分散乳化机均匀悬浮菌体用,比搅拌快,均匀性好,特别适合于大规模生产。另外,大规模生产时缓冲液的配制很有用,可快速溶解、混匀。推荐品牌:IKA 国产品牌:FLUKO;(4)中空纤维超滤柱大规模生产时做菌体收集用,要配合大蠕动泵及压力表。小规模研发时也有用做浓缩的,但感觉死体积比较大。(5)高速冷冻离心机小试、中试菌体收集用,破菌后离心,包涵体溶解后离心、小规模离心超滤等。推荐品牌:BECKMAN、日立、Eppendorf(6)磁力搅拌器就是搅拌用了。缓冲液配制,包涵体溶解等。推荐品牌:国产的都行,最好配4或6工位的。(7)真空泵离心上清过滤、缓冲液过滤、样品过滤等。推荐品牌:Millipore WP61型。(8)过滤器同真空泵配合使用。推荐品牌:Sartorius烧结金属垫板的不锈钢50mm滤器。(9)pH计缓冲液配制、样品pH调节用。推荐品牌:梅特勒(10)电导仪就是测定缓冲液及样品的电导了,做离子交换层析有时候要用到。(11)纯水仪如果没有管道系统的纯水设备,那就必需要的了。至少也是要去离子水、双蒸水或三蒸水。推荐品牌:MINI Q(12)紫外可见分光光度计测定蛋白浓度。推荐品牌:Beckman,岛津(13)核酸蛋白检测仪纯化时在线监测。如果不是用AKTA、Bio-Rad之类的高级仪器,就必须要了。(14)蠕动泵简单纯化系统用、包涵体稀释复性。推荐品牌:兰格、GE公司P50。(15)纯化系统高级的纯化系统了。推荐品牌:AKTA explorer、AKTA Purifier。不推荐bio-rad的DUOFLOW。(16)膜超滤器蛋白样品浓缩、缓冲液置换、以及药品级蛋白纯化时缓冲液的去内毒素用。推荐品牌:Millipore Labscale、Pellicon(泵可用国产的兰格)(17)蛋白电泳仪SDS-PAGE、Westblot用。推荐品牌:Bio-Rad,国产上海天能。(18)脱色摇床电泳染色、脱色用。(19)制冰机破菌时冷却用。(20)恒温培养箱融合蛋白酶切去除tag时恒温用,做ELISA时用。(21)凝胶成像仪就是给电泳胶及WB拍照片用,要配照片打印机哦。就是一台数码相机,硬件各品牌没有本质差异,主要看那家的软件做的好,界面友好。(22)电磁炉加热电泳样品,方便,快捷。(23)微波炉电泳考染脱色。加热水,溶解尿素、硫酸铵等。(24)微量取样器就是枪了。从1ul到5ml都要的。还有一种电动的,可以用刻度吸管。推荐品牌:Gilson,eppendorf(25)超净工作台做蛋白样品的无菌过滤用。(26)冰箱不说了。(27)电风扇小量样品的浓缩风干。个人感觉10-200ml的样品浓缩最为方便,比超滤、PEG等方法简单实用。(28)电子天平称重了。两种精度:0.1mg和0.01g。推荐品牌:梅特勒(29)空调这个我相信大家都不会反对,也是蛋白纯化对环境的要求。(30)超声波清洗机缓冲液脱气用,当然也可以采用真空泵抽真空的方法。特别是做疏水层析时,有机溶剂与水相混溶时脱气。(31)酶标仪、洗板机测定蛋白质免疫活性用。特别当我们纯化的蛋白原料含量很低时,SDS-PAGE无法有效监测就必须应用Elisa方法。(32)恒温干燥箱、干烤箱恒温干燥箱用于玻璃器皿、一般塑料件洗涤后的干燥,设定温度40-60度。干烤箱用于干烤灭菌,内毒素去除等,设定温度180-220度。(33)酸缸就是做细胞培养常用的那种浸泡容器的东东,对药品级的蛋白纯化要求容器都要用酸缸泡过。(34)UPS电源保护层析设备,防止数据丢失,生产必备。(35)层析冷柜 低温冷室4度双门的那种大冷柜,可以把层析柱放进去,对温度敏感的蛋白纯化需要。冷室作用同上,更彻底,只是运行费用更大。(36)冷冻干燥机(器)蛋白质保存较佳的方案。从手提式到药厂的大规模冻干室形式多样。(37)不锈钢层析柱架、三叉夹柱架有商品化的卖,但是没有自己DIY的好。可以自己设计好后找做不锈钢窗户的小店去做,很便宜。夹层析柱的夹子首选三叉夹,很牢靠,最大可以夹50mm的GE夹套XK柱。
从 植物 叶片提取的植物总蛋白不但是家养类动物生长发育的重要营养物质,而且是具有潜力的新一代营养保健食品,因而掌握植物叶蛋白的提取方法至关重要,让我们一起了解这整个实验原理和过程吧。一、实验目的熟悉植物叶蛋白的几种提取原理和方法,了解其意义及其应用价值。二、实验原理植物叶蛋白或称绿色蛋白浓缩物(leaf protein concentration,简称LPC),是从新鲜植物叶片中提取的高质量浓缩蛋白质,不仅是畜禽生长发育和生产畜产品的主要营养物质,而且目前也正成为人类的保健营养理想食品之一。天然蛋白存在于为数甚多的植物体内,对其分离应依据人们的利用目的及提取蛋白含量和品质加以考虑。天然蛋白质一般在溶液中呈稳定的亲水胶体状态,故LPC 亦称叶蛋白胶。其特点是:(1)水化作用 即蛋白质分子表面附有能有效防止蛋白质分子沉淀析出的水化膜;(2)电荷排斥作用 水化膜外还有电荷层(具阴、阳离子)能有效地防止蛋白质分子的凝集。故溶液蛋白质颗粒(溶质)呈溶解状态;(3)欲提取植物组织中的蛋白质必须利用溶解度的差异进行分离纯化(如盐析、有机溶剂分级沉淀法、疏水层析、结晶、加热、离心分离等法),利用分子大小和形状差异进行分离纯化(分子筛层析法);还可利用电荷性质的差异分离纯化(离子交换法)。只要创造上述影响因素,即可使蛋白质从植物叶片中分离并沉淀出来。植物叶蛋白提取一般遵循如下基本原则:尽可能提高样品蛋白的溶解度,抽提最大量的总蛋白,减少蛋白质的损失;减少对蛋白质的人为修饰;破坏蛋白与其他生物大分子的相互作用,并使蛋白质处于完全变性状态。根据该原则,植物叶蛋白制备过程中一般需要有四种试剂①离液剂:尿素和硫脲等;②表面活性剂:又称去垢剂,早期常用NP-40、Tritonx-100等非离子型去垢剂,离子型去垢剂有SDS、胆酸钠、LiDS 等,还有象CHAPS(含它的蛋白溶液可以冻存)与Zwittergent 等双性离子去垢剂;③还原剂:DTT、DTE、TBP、Tris-base 等;④蛋白酶抑制剂及核酸酶:EDTA、PMSF、蛋白酶抑制剂混合物(Protease inhibitor cocktails)等,如为了去除缓冲液中存在的痕量重金属离子,可在其中加入0.1~5 mmol/LEDTA,同时使金属蛋白酶失活。三、仪器和试剂仪器离心机、移液器、研钵、离心管、冰箱。试剂1. 20 mL 样品提取缓冲液:2.5 mL 0.5 mol/LTris-HClhttp://img.dxycdn.com/trademd/upload/userfiles/image/2013/10/A1381399946_small.jpg3. -20 ℃下预冷丙酮(含0.07% β-巯基乙醇)4. -20 ℃预冷的80%丙酮(含0.07% β-巯基乙醇)5. 饱和硫酸铵溶液 称取(NH4)2SO4 80 g,加蒸馏水100 mL,加热50~60 ℃,搅拌溶解,室温过夜,用浓氨水调pH 至7.06. 0.05 molpH7.0的磷酸缓冲液10%NaCl 0.1mol 醋酸95%乙醇7. 植物叶片(草本植物、木本植物叶片等都可)四、实验步骤植物叶蛋白的提取主要有盐析法、有机溶剂沉淀法、加热法(含逐步和快速加热)、 离心分离法、结晶和重结晶法等。依据今后的开发方向(以饲料为基础,以食品、饮品为开发方向)及简便易行和使用的原则,主要采用盐析法、加热法和有机溶剂法分离提取叶蛋白(冷提和热提)。不同的提取方法,对样品的处理方式、程度和要求不同,结果也有差异。1. (NH4)2SO4 沉淀法提取叶蛋白取0.3 g 植物叶蛋白,用液氮充分研磨转入离心管中,加入3 mL 提取缓冲液,摇匀并放在4 ℃条件下提取1 h,充分溶解蛋白后,4 ℃10000 r/min 离心20 min,弃沉淀,上清液中加入(NH4)2SO4,混匀1 h,按1:2(v/v)加入-20 ℃预冷的80%丙酮,混匀后4 ℃12000 r/min 离心10 min,沉淀在-20 ℃冰箱中放置20 min,使丙酮完全挥发后加适量上样缓冲液,待沉淀充分溶解后,4 ℃12000 r/min 离心5 min,取上清液即为所提取的叶蛋白溶液。2. 改良丙酮沉淀法提取叶蛋白取0.3 g 左右的植物叶片,用液氮研磨,色素多的可按材料鲜重的10%加入PVP,并将充分研磨过的样品转入离心管中,加入4 mL 的提取缓冲液,摇匀并放在4 ℃条件下提取1 h,充分溶解蛋白。放置后的样品充分摇匀,4 ℃10000 r/min 离心30min,弃沉淀,上清液中加入2.5~3倍体积的村-20 ℃条件下过夜,让蛋白充分沉淀。之后,4 ℃10000 r/min 离心30min,其上清,沉淀置于-20 ℃下,使丙酮完全挥发,如有必要加入上样缓冲液溶解沉淀。缓冲液用量300 ul,沉淀充分溶解后,转移至1.5 mL 离心管中,4 ℃12000 r/min 离心15min ,取上清液即为所提取的叶蛋白溶液。该方法提取的蛋白质,提取效率高,杂质干扰少,电泳结果蛋白条带清晰,数量多。 3. 植物叶片总蛋白的提取—三氯醋酸—丙酮沉淀法①在液氮中研磨适量的叶片;②悬浮于含10%的三氯醋酸和含0.07% β-巯基乙醇(可用DTT 代替)的丙酮溶液在-20 ℃条件下冰浴;③让蛋白质沉淀过夜后离心(4 ℃ 10000 r/min 离心30~60min),弃上清;④重悬沉淀浮于含0.07% β-巯基乙醇的预冷丙酮溶液中;⑤离心(同上)后真空干燥沉淀;⑥用上样缓冲液溶解沉淀,离心;⑦Brandford 法定量蛋白,然后分装至Eppendof 管中保存在-78 ℃备用。4. 分步提取可溶性叶蛋白(1)蛋白质浸出①水溶性蛋白质浸出:用0.05 molpH7.0的磷酸缓冲液(或蒸馏水)将样品制成匀浆液,然后离心15min(4000 r/min),收集上清液即蛋白质浸出液,再将沉淀物按上述操作重复两次。②盐溶性蛋白质浸出用10%NaCl 将前者剩余沉淀物分离提取两次,收集蛋白质浸出液。(2)蛋白质沉淀用0.1mol 醋酸将蛋白质浸出液pH 值调至蛋白质等电点(pH4.5左右),即8体积蛋白质浸出液加入1体积0.1 mol 醋酸,混匀,离心15min(3000 r/min),弃去上清液,沉淀物即为可溶性叶蛋白。(3)蛋白质收集于沉淀物中加入95%乙醇,混匀,用定量滤纸过滤或抽滤,待风干后收集。植物总蛋白的提取方法以有机盐沉淀法为主,本文中介绍到的(NH4)2SO4沉淀法、丙酮沉淀法、三氯乙酸—丙酮沉淀法和分步提取法,各个方法各有特点和适用范围,各位如有更好的植物总蛋白提取方法,欢迎补充。
蛋白提取过程中,将组织样本冻干磨粉后加入水,盐、酸、碱等溶液进行提取,然后离心取上清和直接取少量组织以一定料液比加入缓冲液(200mM Tris-HCl、150mM NaCl、10mM EDTA、PH8.0)进行匀浆然后离心取上清这两种提取方式有什么区别?
现在有一个疑问想请教老师们,仪器[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url],分别是安捷伦1100,AB 3200,[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]。做的是药代动力学,因为样品前期处理是用的简单的乙腈沉淀蛋白后进样,洗脱梯度是乙腈:1mM甲酸铵(60:40),现在走完一条标曲(8个点)、一套指控(4个点)之后,走一个人的样品(13个点),再走质控合格。继续再走一个人的样品后,质控就无法合格了。只能用水比例较大的流动相冲洗半小时到一小时,之后质控就能合格了。我想问在用水比例较大的流动相冲洗时,能不能直接用带有缓冲盐的水相,也就是用乙腈:1mM甲酸铵(10:90)冲洗,这样可以节省很多的平衡时间。我还没有试,望高手指点

水质总大肠的最后一步复发酵实验,就是接种了EMB培养上的菌落应该是取10ML 的乳糖蛋白胨培养液还是5ML?[img=,654,120]https://ng1.17img.cn/bbsfiles/images/2019/12/201912101144341109_959_4064492_3.png!w654x120.jpg[/img]医疗废水上就写着取[img=,690,139]https://ng1.17img.cn/bbsfiles/images/2019/12/201912101148371298_8342_4064492_3.png!w690x139.jpg[/img]谢谢大家。
大部分蛋白是酸性蛋白,等电点小于7,pH7.0的缓冲液中带负电,色谱柱说明书里的标准蛋白也是这类蛋白。可是对于那些等电点大于7的碱性蛋白来说,pH7.0下带正电荷,蛋白柱对于碱性蛋白的分离效果如何?再比如一个PI=7的蛋白,在pH4.0和pH9.0的buffer中,保留体积是一样的吗?虽然有些蛋白柱的应用案例也有碱性蛋白,但是实际上,我用同样的条件做下来,结果的并不好。不知大家做下来如何?
我最近在用毛细管电泳淌度法测药物与蛋白结合常数,但是重现性很差,而且甚至连线性关系都没有。我就想问一下,文献上说要在缓冲液中加入不同浓度的药物、然后以蛋白进样。可是Inlet的A1,A2和Outlet的A1放的都是缓冲液,应该怎么这三瓶缓冲液都加入药物还是只要其中一瓶加入药物就可以呢?本科生对仪器不够了解,希望各位大神能够提供些帮助和解答。谢谢!
5. 做SDS-PAGE的时候,除了蛋白量上样一致,最好体积也一致,这样跑出来的胶各个泳道之间的band能做到一样宽,方便后面的比较,特别是WB。做法就是拿1X的上样缓冲补全要加的样做到体积一致,否则跑出来会有的宽有的窄,特别是上样体积相差较大的。6. 在把蛋白胶做成干胶时,很多时候会因为有气泡使胶裂掉,我的经验是在做胶时加上层膜前在胶上多加些水就不容易进气泡了,还有就是高温烘胶(管家哥提醒慎用),我喜欢放到60度烘箱里烘,这样水分蒸发速度快,即使有一些小的气泡也不会有影响。
条条大路通罗马,纯化之路千万条。本篇是写给蛋白质纯化新手的,就一些最常用的纯化工艺、概念方法作一些列举。以起始原料的不同来进行分类,分为:大肠杆菌、酵母、细胞培养、腹水、血清、生物组织六个板块。板块一、大肠杆菌(这里讨论的大肠杆菌为非分泌到培养基中的重组蛋白,是否有重组蛋白分泌到培养基中的工程菌我没有见过。)一、关于菌体的量大肠杆菌表达的基因工程蛋白是纯化人员最方便获得的原料,对纯化工艺开发来说几乎没有原料方面的限制。常看到有战友用个几毫升的菌液去做纯化,对此我十分不解,同样要做,为什么不多做点呢?很少的菌体会给纯化带来一些难以估计的问题,工艺的重复性和放大往往出现问题。因此,要做个好工艺就多发酵表达一些菌体吧。我做纯化时,初始工艺摸索用的菌体量一般为10g左右。二、关于是否包涵体表达包涵体的定义我就不讲了。我要讲的是,一个基因工程蛋白是否是包涵体表达的说法本身就不完全准确。至于包涵体在电镜下的晶体颗粒表现等等对我们纯化来说毫无意义,我相信做纯化工艺的人没有谁去看这个电镜,也不关心。我们判断的依据只是SDS-PAGE,目的蛋白在破菌沉淀中,我们就认为是包涵体表达,但这是一个似是而非的结论。看着没问题,实际上是有毛病的。关键在于你用的是什么破菌缓冲液!有些蛋白在用缓冲液A破菌时是在破菌沉淀中,而用缓冲液B破菌时却在破菌上清中。缓冲液A和B的差别可能只是pH上相差1-2个单位。那么它是包涵体表达还是可溶上清表达呢?说这个问题主要在于有些战友往往非常在意他的目标蛋白是否包涵体表达。甚至还有包涵体表达就用专门的包涵体蛋白纯化方法等等。我们应该关心的是目标蛋白在什么缓冲体系下是可溶的,在什么缓冲体系下是不溶的!不要让包涵体这个概念给你误导。三、关于表达量我们常常在发表的文章上看到,我这个工程菌的目标蛋白的表达量达到菌体总蛋白的30%、50%等等。我要说都是文章的作者在忽悠。不知道他们是如何定量的,用的最多的大概就是SDS-PAGE的扫描分析吧。且不说一个SDS-PAGE不能表现出所有的菌体蛋白,电泳的染色方法、染色脱色强度、照片的曝光强度、扫描分析时的条带选择等等无不对这个百分比影响巨大。在公司的QC部门做的对此应该最有体验,20%的条带要它变成30%又有何难?我的观点是对待表达量的描述不可定量,只能定性。如用:很低、较低、中等、较高、很高等来描述。有一个指标与表达量密切相关,那就是单位体积的菌体量。两者的乘积才是单位体积发酵液的目标蛋白产率。与表达量相关的指标还有纯化倍数、纯化收率等,这些指标我们也常常在发表的文章中看到。同样,我也认为都是不准确的。除非你用的是活性测定的方法,用蛋白活性收率来表征。纯化工艺的难易有时候也与表达量相关,表达量高时往往纯化也方便的多。所以,尽量提高你的目标蛋白表达量不只是基因工程上游和产量的问题,还是纯化工艺开发的问题。四、菌体破碎(1)破菌前处理诱导表达的菌体在发酵离心后,最好先用PBS缓冲液或其它缓冲液立即洗涤一次。菌体洗涤可以去除一些培养基中的杂质,及代谢产物,减少对后续纯化的影响。如果菌体已经冻存过,冻融的菌体可能有部分破碎,就不要洗涤菌体了。小量菌体的悬浮可以用5ml的枪头吹打,再磁力搅拌。大量菌体的悬浮可以用分散乳化机。破菌缓冲液的用量一般为1∶10—1∶20,即1g湿菌体用10—20ml的破菌缓冲液。(2)破菌缓冲液的选择选择何种破菌缓冲液,应该与后续的纯化方法密切相关,不能一刀切。而且,破菌缓冲液还与是否可溶表达相关。对于可溶表达的重组蛋白,一般就选用第一步层析纯化的平衡缓冲液为破菌缓冲液。对于不可溶表达的重组蛋白,最简单的就是选用PBS为破菌缓冲液。在选用破菌缓冲液时,有个小小的trick,加EDTA。有个别重组蛋白很脆弱,在超声破菌时就有大量的降解。注意,不是表达降解,而是超声过程中降解。特别是用pET32表达的his-tag融合蛋白容易降解,我运气好,遇到过2次这种超声降解。第一次碰到时,害得我好苦。反复找原因,是诱导表达温度?是超声温度过高?超声功率?外源蛋白酶污染?……最后用EDTA解决了。在破菌缓冲液中加0.5mM的EDTA就不会降解了。推测原因,可能是大肠杆菌自身有那么一种蛋白酶,破菌释放后就正好会攻击我的宝贝蛋白。而这种蛋白酶是金属蛋白酶,加EDTA后把它的枪栓(金属离子)给卸了,我的蛋白小命也就保全了,哈哈。第二次在SDS-PAGE上看到降解时,心里就不慌了。可能有战友会问,his-tag的蛋白加了EDTA后还怎么过Ni柱啊,恭喜你,问对了。我的解决方案是先过离子交换柱。EDTA带负电荷,用Q/DEAE吸附EDTA,或用SP柱吸附目标蛋白后,再透析一下,过Ni柱纯化。爱探险的dora跳着舞,成功啦,you did it!。(3)破菌方法大肠杆菌的破碎方法常用的大概有:反复冻融加溶菌酶法、超声法和压力匀浆法。一般来说处理菌体的量也是这个顺序。冻融方法我不喜欢,处理量太少且费时,要买溶菌酶,还是个外源蛋白。我喜欢强力型的超声和压力匀浆。超声法是小规模和中等规模破碎菌体的首选,选择好相应的超声探头,一次处理菌体量为0.1g-100g。压力匀浆为中到大规模破菌的首选,处理量大、快,破菌效果好,但发热量大,对温度非常敏感的蛋白慎用。超声破菌:以10g湿菌体为例,加入破菌缓冲液100ml,玻璃烧杯中磁力搅拌悬浮充分。冰水浴超声。设置超声时间4s,间隙时间4s,超声功率400-600W,超声次数100-200次。压力匀浆:以200g湿菌体为例,加入4℃预冷的破菌缓冲液3000ml,用分散乳化机充分混匀。匀浆压力800bar左右,压力匀浆发热非常大,流出液要冰水浴加磁力搅拌。一次匀浆完毕后,让菌液充分冷却后再进行二次匀浆。匀浆完毕的菌液如果粘度比较大,可用超声破碎仪超声40次,打碎核酸减小粘度,以方便离心和纯化。(4)破菌后离心高速冷冻离心机离心,50ml的小管18000rpm,20min,4℃;500ml的瓶用10000rpm,30min,4℃。50ml小管的离心效果比500ml的瓶好,如果你的溶液量在300ml以下,还是勤快点,多装几根50ml的小管吧。(5)过滤对上清可溶表达的蛋白在收集破菌离心上清后,必须过滤后才能上柱纯化。在园子里常看到有战友说我的柱流速很慢,层析柱压缩等很厉害,柱头有杂质堵了等等,这多数是因为没有进行过滤操作。过滤一般采用真空负压抽滤,可以选择0.8um的膜或双层滤纸过滤。多数层析的要求都是过柱溶液需经过0.45um的膜过滤,但实际上对破菌后的上清液或包涵体的溶解上清样,0.45um膜太难过滤了,mission impossible,无法完成操作。所以在实际工作中,我们都是采用双层滤纸或0.8um的膜过滤。在此推荐我用的一套设备组合:millipore wp6122050型台式真空压力两用泵和Sartorius 16201不锈钢过滤器,非广告,好用哦。五、包涵体处理前面说过对纯化来说,我不赞成包涵体的提法,但为了表述方便还是不妨借用一下,谁…谁在拍砖头啊。(1)包涵体洗涤我的蛋白是包涵体表达,用什么来洗涤啊?此类问题战友常问。其实还真不好回答。用什么溶液来洗涤包涵体也是与后续纯化方法相关的。例如,后面接离子交换层析,洗涤液不能加盐;后面接Ni柱,洗涤液不能加EDTA等等。罗列了一些可用的洗涤液成分如下,根据自己的需求来增减。pH6.0-pH9.0:高pH使得包涵体倾向于溶解,杂蛋白也去除的好些,但高pH有可能使目的蛋白降解。10-50mM PB,10-50mM Tris:维持缓冲环境,后接离子交换时选低一点的浓度。0-0.5N NaCl:盐洗涤有助于核酸的去除,多年前有位做干扰素的可爱老太太教我,盐洗涤后包涵体的OD280/260的比值(溶解后)会升高很多,也就是核酸去除很多,有利于后续纯化。0.5-5mM DTT:提供还原环境,打开蛋白中的二硫键,使得包涵体倾向于溶解,有利于杂蛋白的去除。但浓度太高了使得包涵体真的溶解就不是洗涤了。后续用Ni-IDA柱不可以加,用Ni-NTA柱少加。0-1%beta-ME:同DTT,还原能力稍弱。气味那个香啊……0-2N Urea:变性剂,有利于包涵体中氢键、疏水键、范德华力……的打开,有利于洗涤去除杂蛋白。同样高浓度会使包涵体溶解。类似的是盐酸胍,更强的变性剂,更高的价格,我等不穷的人也消费不起。当然,你很富就用吧,有时候更有利于包涵体蛋白的线性化。0.05-1%Triton X100:非离子型表面活性剂,像洗衣粉一样用了。同样的还有zwittergent,一种我一直想找机会试试的东东,当年为了溶解beta干扰素包涵体搞得我好苦。0-2mM EDTA:螯合剂,去除金属离子,有利于蛋白的稳定和溶解。Ni柱禁用。其它:期待各路英豪奉献。(2)包涵体溶解看了包涵体洗涤部分,怎么溶解包涵体应该心中有数了。无非就是pH,变性剂,还原剂,表面活性剂等等的组合。经典的包涵体溶解液的配方为:pH8.0,20mM Tris,8M Urea。说它经典,是因为我用的最多,嘻嘻。再根据个性蛋白纯化的需要往这个配方里面加调料,如Ni柱纯化的咪唑、氯化钠;溶解或吸附不好时再加点DTT、Triton。包涵体的溶解也有两个小Trick,独门秘籍哦。第一,包涵体沉淀在溶解时往往会有一些像硬胶状的块块,有弹
目的要求(1)了解克隆基因表达的方法和意义。(2)了解重组蛋白亲和层析分离纯化的方法。实验原理克隆基因在细胞中表达对理论研究和实验应用都具有重要的意义。通过表达能探索和研究基因的功能以及基因表达调控的机理,同时克隆基因表达出所编码的蛋白质可供作结构与功能的研究。大肠杆菌是目前应用最广泛的蛋白质表达系统,其表达外源基因产物的水平远高于其它基因表达系统,表达的目的蛋白量甚至能超过细菌总蛋白量的80%。本实验中,携带有目标蛋白基因的质粒在大肠杆菌BL21中,在 37℃,IPTG诱导下,超量表达携带有6个连续组氨酸残基的重组氯霉素酰基转移酶蛋白,该蛋白可用一种通过共价偶连的次氨基三乙酸(NTA)使镍离子(Ni2+)固相化的层析介质加以提纯,实为金属熬合亲和层析(MCAC)。蛋白质的纯化程度可通过聚丙烯酰胺凝胶电泳进行分析。试剂和器材一、试剂 LB液体培养基:Trytone 10g, yeast extract 5g, NaCl 10g, 用蒸馏水配至1000mL. 氨苄青霉素:100mg/mL 上样缓冲液:100 mM NaH2PO4, 10 mMTris, 8M Urea, 10 mM2-ME, pH8.0 Washing Buffer:100 mM NaH2PO4, 10 mM Tris, 8 M Urea, pH6.3 Elution Buffer:100 mM NaH2PO4, 10 mMTris, 8M Urea, 500 mM Imidazole, pH8.0 IPTG二、器材摇床,离心机,层析柱(1′10 cm)操作方法一、氯霉素酰基转移酶重组蛋白的诱导1. 接种含有重组氯霉素酰基转移酶蛋白的大肠杆菌BL21菌株于5mL LB液体培养基中(含100ug/mL 氨苄青霉素),37℃震荡培养过夜。2. 转接1mL过夜培养物于100mL(含100ug/mL 氨苄青霉素)LB液体培养基中,37℃震荡培养至OD600 = 0.6 - 0.8。取10ul 样品用于SDS-PAGE 分析。3. 加入IPTG至终浓度0.5 mmol/l, 37℃继续培养1-3h.4. 12,000rpm 离心10 min, 弃上清,菌体沉淀保存于-20℃或-70℃冰箱中。二、氯霉素酰基转移酶重组蛋白的分离、纯化1. NTA层析柱的准备:在层析柱中加入1mL NTA介质,并分别用8mL 去离子水,8mL上样缓冲液洗涤。2. 重组蛋白的变性裂解:在冰浴中冻融菌体沉淀,加入5mL上样缓冲液, 用吸管抽吸重悬,超声波破裂菌体,用振荡器等轻柔的混匀样品60min, 4℃ 12000rpm 离心 30 min, 将上清吸至一个干净的容器中,并弃沉淀。取10ul 上清样品用于SDS-PAGE 分析。3. 上清样品以10-15mL/h 流速上Ni2+-NTA柱,收集流出液,取10ul样品用于SDS-PAGE 分析。4. 洗脱杂蛋白:用Washing Buffer以10-15mL/h流速洗柱,直至OD280 = 0.01.分步收集洗脱液,约3-4h,取10ul洗脱开始时的样品用于SDS-PAGE 分析。5. 洗脱目标蛋白:用Elution Buffer洗柱,收集每1 mL 级分,分别取10ul样品用于SDS-PAGE 分析。
我用SDS-CGE方法分离了乳蛋白和大豆分离蛋白,仪器是贝克曼的,柱子也是贝克曼的未涂层的空柱子,方法都是按照说明书的处理方法,即标准蛋白样品用样品缓冲液(含SDS)和水溶解后水,再水浴后上机的。可是图谱的效果和说明书的不一致,而且其他样品图谱也不对,并不是一种成份一个峰,而且很多响应值较高的峰,峰形倒是好,但是图谱明显不对,没有那么多成分阿,我反复做过,结果都是这样,很烦恼,望赐教!!! 这是我上传的我做的图谱![img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=33845]我用SDS-CGE方法分离的乳蛋白和大豆分离蛋白的图谱[/url]