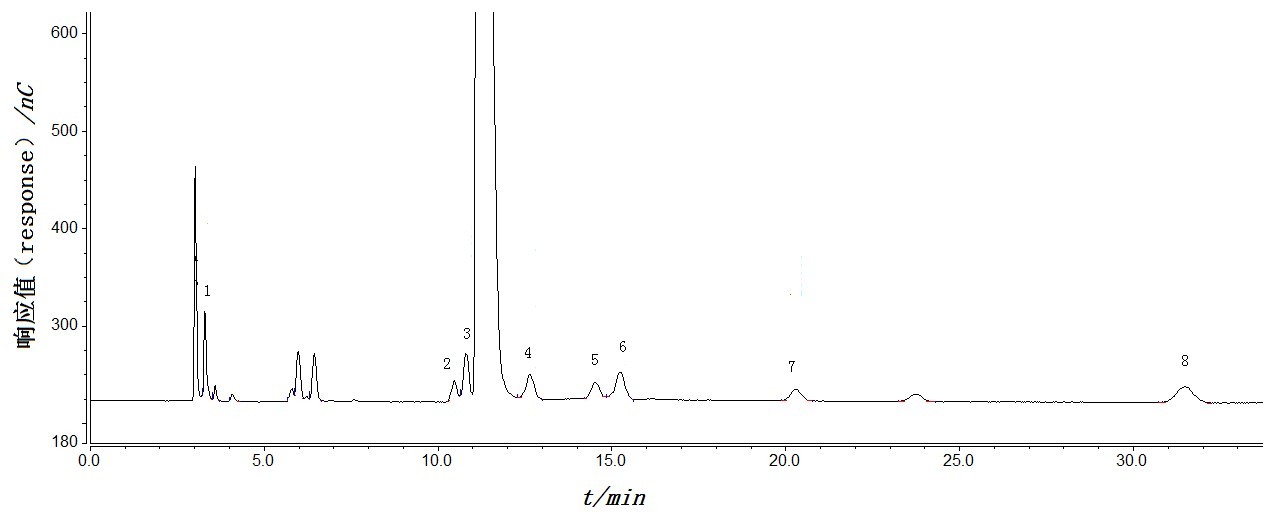
聚焦药典三部—生物制剂检测
p style=" text-align: justify text-indent: 2em " strong 2005 /strong 年起,药典增加了以生物制剂(诊断、预防等)为主要内容的第三部。《中国药典》三部源于《中国生物制品规程》。自1951年以来,该规程已有六版颁布执行,分别为1951年及1952年修订版、1959年版、 1979年版、1990年版及1993年版(诊断制品类)、1995年版、2000年版及2002年增补版。2002年翻译出版了第一部英文版《中国生物制品规程》(2000年版)。 /p p style=" text-indent: 2em " 在2020年版《中国药典》三部中检测方法的变化主要体现在3个方面: br/ /p p style=" text-align: justify text-indent: 2em margin-top: 10px " 1.通则 span style=" font-size: 14px color: rgb(63, 63, 63) " strong 《3208 人血白蛋白铝的检测》 /strong /span 中,增加 span style=" color: rgb(0, 112, 192) " strong 第二法ICP-MS法 /strong /span 。 /p p style=" text-align: justify text-indent: 2em " 2.通则 span style=" color: rgb(63, 63, 63) font-size: 14px " strong 《3129 单抗电荷变异体测定法》 /strong /span 中使用 span style=" color: rgb(0, 112, 192) " iCIEF毛细管等电聚焦技术 /span 对抗体药物检测。 /p p style=" text-align: justify text-indent: 2em " span style=" text-indent: 2em " 3.通则 span style=" text-indent: 2em font-size: 14px color: rgb(63, 63, 63) " strong 《3130 单抗N糖谱测定法》 /strong /span 中使用UHPLC法检测抗体药物。 /span /p p label=" 标题居中" style=" font-size: 32px font-weight: bold border-bottom: 2px solid rgb(204, 204, 204) padding: 0px 4px 0px 0px text-align: center margin: 0px 0px 20px " span style=" font-size: 18px color: rgb(0, 112, 192) " 3208 人血白蛋白铝残留量测定法 /span br/ /p p style=" text-align: justify text-indent: 2em " strong 原理: /strong 本法系用 span style=" color: rgb(255, 0, 0) " strong 原子吸收分光光度法 /strong /span 测定人血白蛋白制品中铝的残留量。& nbsp /p p style=" text-align: justify text-indent: 2em " strong 方法: /strong 精密量取供试品、100 ng/mL标准铝溶液(精密量取100 μg/mL标准铅溶液0.1 mL,置100 mL量瓶中,用0.15 mol/L硝酸溶液稀释至刻度),分别制备空白对照溶液、供试品溶液和标准品加供试品的混合溶液。照原子吸收分光光度法(通则0405)测定,选择铝灯,测定波氏为309.3 nm,狭缝为0.7 nm。 /p p style=" text-align: center" img style=" max-width: 100% max-height: 100% width: 360px height: 85px " src=" https://img1.17img.cn/17img/images/202008/uepic/a801e294-19c7-4db9-b6cf-91745bb0fee7.jpg" title=" 48DF010D-2A6B-4131-B9AE-9F270FD01EA8.jpeg" alt=" 48DF010D-2A6B-4131-B9AE-9F270FD01EA8.jpeg" width=" 360" vspace=" 0" height=" 85" border=" 0" / /p p style=" text-align: justify text-indent: 2em " & nbsp span style=" font-size: 14px " strong span style=" color: rgb(63, 63, 63) " B为空白对照溶液渎数; span style=" text-indent: 2em " S /span sub style=" text-indent: 2em " 0 /sub span style=" text-indent: 2em " 为供试品溶液读数;S为标准铝加供试品的混合溶液读数; /span /span span style=" font-size: 14px color: rgb(63, 63, 63) " 20为标准铝加供试品的混合溶液中标准铝的含量; span style=" font-size: 14px color: rgb(63, 63, 63) text-indent: 2em " 12.5 为供试品稀释倍数。 /span /span /strong /span /p p style=" text-align: justify text-indent: 2em margin-top: 10px " span style=" text-indent: 2em color: rgb(0, 0, 0) font-size: 16px " 设置石墨炉的干燥、灰化、原子化等炉温程序。精密量取空白对照溶液、供试品溶液和标准品+供试品的混合溶液各30 μL分别注入仪器、读数。 /span /p p style=" text-align: justify text-indent: 2em margin-top: 10px " span style=" color: rgb(255, 76, 0) " strong span style=" text-indent: 2em font-size: 16px " 新版2020药典增加ICP-MS法测量,准确度更高、灵敏度更好。 /span /strong /span span style=" text-indent: 2em color: rgb(0, 0, 0) font-size: 16px " /span /p p style=" text-align: center" a href=" https://www.instrument.com.cn/zc/293.html" target=" _blank" /a /p p style=" text-align: center" a href=" https://www.instrument.com.cn/zc/293.html" target=" _self" img style=" max-width: 100% max-height: 100% width: 214px height: 200px " src=" https://img1.17img.cn/17img/images/202008/uepic/ea3d0a09-4ed0-463d-bbb1-c40c7677c419.jpg" title=" ICP-MS.png" alt=" ICP-MS.png" width=" 214" vspace=" 0" height=" 200" border=" 0" / /a /p p style=" text-align: center " span style=" font-size: 14px color: rgb(147, 137, 83) " 【点击进入 strong ICP-MS专场 /strong 查看更多信息】 /span /p p style=" text-indent: 2em " span style=" color: rgb(0, 0, 0) font-size: 16px " strong span style=" color: rgb(0, 0, 0) " 意义: /span /strong span style=" color: rgb(0, 0, 0) " 加强对人和动物来源血液制品杂质控制。 /span /span br/ /p p label=" 标题居中" style=" font-size: 32px font-weight: bold border-bottom: 2px solid rgb(204, 204, 204) padding: 0px 4px 0px 0px text-align: center margin: 0px 0px 20px " span style=" font-size: 18px color: rgb(0, 112, 192) " 3129 单抗电荷变异体测定法 /span br/ /p p style=" text-align: justify text-indent: 2em margin-top: 10px " span style=" color: rgb(0, 32, 96) " strong span style=" text-indent: 2em font-size: 16px " 单克隆抗体 /span /strong /span span style=" text-indent: 2em font-size: 16px color: rgb(0, 0, 0) " 是一种复杂的糖蛋白,作为一种全新的生物制剂,可以治疗肿瘤、风湿等多种疾病。复杂的细胞培养工艺、纯化及制剂等制造过程或储存过程可能给单抗制剂引入各种修饰形成的变异体,它们通常呈现微观不均一性。因此,抗体所带的电荷就会存在差异,这些变异体可能会影响抗体的 span style=" text-indent: 2em font-size: 16px color: rgb(63, 63, 63) " strong 稳定性,药效,免疫原性 /strong /span 等,因此对电荷变异体的表征和质控至关重要。通过对变异体的分子量及肽图的表征,可以确定其修饰种类及后续QC中的质量监控。 /span /p p style=" text-align: justify text-indent: 2em " span style=" text-indent: 2em font-size: 16px color: rgb(0, 0, 0) " 目前,电荷变异体分析常用的 strong PH梯度 /strong 或 strong 盐梯度 /strong 方法。由于流动相一般含不挥发性盐,需要色谱分离除盐冻干再进质谱分析。这一过程复杂容易造成样品损失及蛋白变性,因此使用低离子强度、挥发性盐的流动体系,在PH梯度条件下分离电荷变异体,同时进质谱分析,能够快速在完整蛋白水平上表征变异体修饰,包括C端赖氨酸变异体、脱酰胺、焦谷氨酸环化、糖化以及抗体相关片段等。 /span 主要步骤为: span style=" color: rgb(255, 0, 0) " strong 完整分子量分析,轻重链分析以及肽图分析 /strong /span 。 /p p style=" text-align: justify text-indent: 2em margin-top: 10px " strong span style=" text-indent: 2em font-size: 16px color: rgb(0, 0, 0) " 原理:药典三部通则中 /span /strong span style=" text-indent: 2em font-size: 16px color: rgb(0, 0, 0) " 采用全柱成像毛细管等电聚焦电泳 strong (iCIEF) /strong ,依据不同电荷变异体的等电点(pI)特征,按 span style=" text-indent: 2em font-size: 16px color: rgb(255, 0, 0) " strong 毛细管电泳法 /strong /span (通则0542)将其分离 ,测定单抗产品各电荷变异体的等电点并计算相对百分含量。 /span /p p style=" text-align: center margin-top: 10px " a href=" https://www.instrument.com.cn/netshow/C263761.htm" target=" _blank" img style=" max-width: 100% max-height: 100% width: 250px height: 250px " src=" https://img1.17img.cn/17img/images/202012/uepic/8c448341-11d0-4e01-9b72-208808933f79.jpg" title=" proteinsimple.jpg" alt=" proteinsimple.jpg" width=" 250" vspace=" 0" height=" 250" border=" 0" / /a /p p style=" text-align: justify text-indent: 2em " 电荷变化是测定单抗药物降解变异最灵敏快速的方法之一,已经被国内外生物制药企业广泛采用。全柱成像毛细管等电聚焦电泳(iCIEF)为Proteinsimple首创全景式动态等电聚焦分析技术,已经成为等电点检测及电荷异质性分析的行业金标准。 /p p style=" margin-top: 10px text-indent: 0em text-align: center " span style=" font-size: 14px color: rgb(147, 137, 83) " strong 【点击进入查看更多信息】 /strong /span span style=" text-indent: 2em font-size: 16px color: rgb(0, 0, 0) " /span span style=" color: rgb(0, 112, 192) " span style=" text-indent: 2em font-size: 16px " /span strong span style=" text-indent: 2em font-size: 16px " /span /strong /span br/ /p p style=" text-align: center" img style=" max-width: 100% max-height: 100% width: 356px height: 271px " src=" https://img1.17img.cn/17img/images/202008/uepic/7bf31f3a-0103-4d57-96f0-4fc042d7e9b5.jpg" title=" 等电标志物.png" alt=" 等电标志物.png" width=" 356" height=" 271" / /p p style=" text-align: justify text-indent: 2em margin-top: 10px " strong 注意事项: /strong 1、如供试品的盐浓度较高,需对其进行脱盐前处理。 2、由于 iCIEF 分析仪器品牌不同、毛细管品牌或者规格存在差异,系统适用性对照品的电泳图谱与参考图谱峰型可略有差异。 /p p label=" 标题居中" style=" font-size: 32px font-weight: bold border-bottom: 2px solid rgb(204, 204, 204) padding: 0px 4px 0px 0px text-align: center margin: 0px 0px 20px " span style=" font-size: 18px color: rgb(0, 112, 192) " 3130 单抗N糖谱测定法 /span br/ /p p style=" text-align: justify text-indent: 2em margin-top: 10px " span style=" color: rgb(0, 112, 192) " strong span style=" text-indent: 2em font-size: 16px color: rgb(0, 0, 0) " 第一法 亲水相互作用色谱法: /span /strong span style=" text-indent: 2em font-size: 16px color: rgb(0, 0, 0) " 亲水作用色谱柱(HPLC) /span /span /p p style=" text-align: justify text-indent: 2em margin-top: 10px " span style=" color: rgb(147, 137, 83) " strong span style=" text-indent: 2em font-size: 16px " 第二法 毛细管电泳法:CE /span /strong /span /p p style=" text-align: justify text-indent: 2em margin-top: 10px " span style=" color: rgb(0, 112, 192) " strong span style=" text-indent: 2em font-size: 16px color: rgb(0, 0, 0) " 第三法& nbsp 高效阴离子色谱法: /span /strong span style=" text-indent: 2em font-size: 16px color: rgb(0, 0, 0) " 离子色谱法 /span /span /p p style=" text-align: justify text-indent: 2em margin-top: 10px " span style=" color: rgb(0, 112, 192) " strong span style=" text-indent: 2em font-size: 16px color: rgb(0, 0, 0) " HPAEC-PAD /span /strong span style=" text-indent: 2em font-size: 16px color: rgb(0, 0, 0) " 离子色谱具有方便、快速、灵敏度高、选择性好、重现性好、准确度高、可同时分析多种离子化合物等优点。其中的高效阴离子交换色谱-脉冲安培检测法( HPAEC-PAD) 可直接分析糖类物质,应用于 span style=" text-indent: 2em font-size: 16px color: rgb(0, 176, 80) " 多糖疫苗 span style=" text-indent: 2em font-size: 16px color: rgb(0, 0, 0) " 及 /span 多糖蛋白结合疫苗 /span 中多糖的分析。 /span /span /p p style=" text-align: justify text-indent: 2em margin-top: 10px " span style=" color: rgb(0, 112, 192) " span style=" text-indent: 2em font-size: 16px color: rgb(0, 0, 0) " /span /span /p p style=" text-align: center" a href=" https://www.instrument.com.cn/zc/24.html" target=" _blank" img style=" max-width:100% max-height:100% " src=" https://img1.17img.cn/17img/images/202009/uepic/b6590ab4-2912-4f5c-93aa-80ca30c78ca9.jpg" title=" 离子色谱.png" alt=" 离子色谱.png" / /a /p p style=" margin-top: 10px text-indent: 0em text-align: center " span style=" text-indent: 2em font-size: 16px color: rgb(0, 0, 0) " /span span style=" color: rgb(147, 137, 83) " strong span style=" font-size: 14px " 【点击进入IC专场查看更多信息】 /span /strong /span /p p style=" text-align: justify text-indent: 2em margin-top: 5px " span style=" text-indent: 2em font-size: 16px color: rgb(0, 0, 0) " 近年来,离子色谱应用在多糖及多糖蛋白结合疫苗的质量控制中,如测定疫苗中的多糖、游离糖、杂质多糖、对人有免疫原性的功能基团等的研究有许多报道。该方法可以加强 span style=" text-indent: 2em font-size: 16px color: rgb(255, 0, 0) " strong 多糖疫苗N糖 /strong /span (氨基端糖链的)结构分析与鉴别的质量控制。 /span /p p style=" text-align: justify text-indent: 2em margin-top: 5px " span style=" text-indent: 2em font-size: 16px color: rgb(0, 0, 0) " /span /p p style=" text-align: center margin-top: 10px " a href=" https://www.instrument.com.cn/zt/2020ChP-changes" target=" _self" img style=" max-width:100% max-height:100% " src=" https://img1.17img.cn/17img/images/202009/uepic/d68e2042-5e48-4019-9898-74375c0edcb3.jpg" title=" w640h1102020ChP.jpg" alt=" w640h1102020ChP.jpg" / /a /p p style=" text-indent: 2em text-align: justify " 仪器信息网将特别推出 span style=" color: rgb(255, 10, 10) " strong “2020年版《中国药典》变化盘点” /strong /span 专题,盘点通则增修、药典仪器以及相关资讯。敬请广大读者关注! /p