请问谁有大气中溴化氢的测定方法, 固定污染源的也可以!! 急需!!!谢谢!!!
品红比色法《空气中有害物质的测定方法》(第二版)杭士平主编测空气中的溴化氢,波长如何选择?按照显色颜色选择波长,响应值很小。用紫外光度计扫描,共扫描到三个波长,分别为294nm,279nm,249nm,其中279nm和249nm是同时扫描到的,按照双波长做标线,不成线性。选择294nm ,线性也不大好。 真诚请教用品红比色法测溴化氢,选择多大的波长呢?
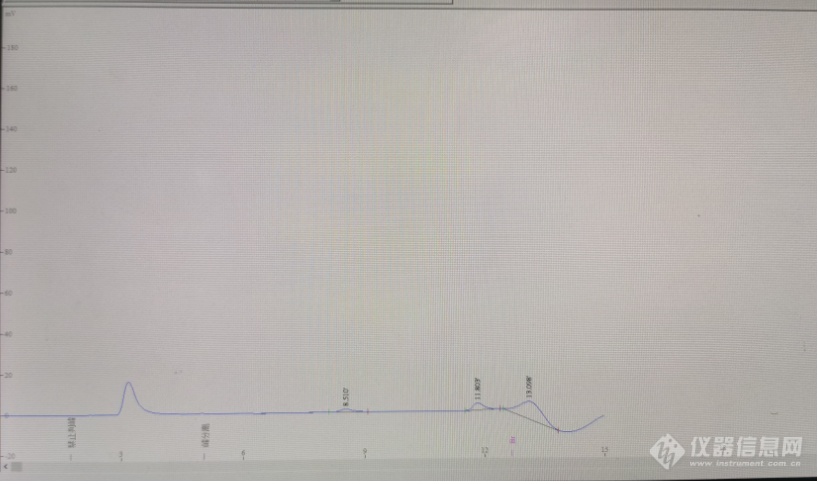
[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]做溴化氢曲线,大约在12min出峰,氢氧化钠吸收液,做空白样出来的谱图像图中那样,用的是碳酸盐淋洗液,有大侠指教下应该要怎么处理吗?[img=,690,408]https://ng1.17img.cn/bbsfiles/images/2023/03/202303130805397669_2059_5453158_3.png!w690x408.jpg[/img]
第一部分:化学品名称 回目录 化学品中文名称: 溴化氢 化学品英文名称: hydrogen bromide 中文名称2: 英文名称2: 技术说明书编码: 1034 CAS No.: 10035-10-6 分子式: HBr 分子量: 80.91 第二部分:成分/组成信息 回目录 有害物成分 含量 CAS No. 溴化氢 10035-10-6 第三部分:危险性概述 回目录 危险性类别: 侵入途径: 健康危害: 人吸入的最小中毒浓度为5ppm。液态溴化氢可引起皮肤、 粘膜的刺激或灼伤。长期低浓度接触可引起呼吸道刺激症状和消化功能障碍。 环境危害: 燃爆危险: 本品不燃,有毒,具强腐蚀性、强刺激性,可致人体灼伤。 第四部分:急救措施 回目录 皮肤接触: 立即脱去污染的衣着,用大量流动清水冲洗至少15分钟。就医。 眼睛接触: 立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。就医。 吸入: 迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。 食入: 第五部分:消防措施 回目录 危险特性: 不燃。能与普通金属发生反应, 放出氢气而与空气形成爆炸性混合物。纯品在空气中较稳定,但遇光及热易被氧化而游离出溴。遇溴氧能发生爆炸性反应。遇水时有强腐蚀性。 有害燃烧产物: 溴化氢。 灭火方法: 消防人员必须佩戴过滤式防毒面具(全面罩)或隔离式呼吸器、穿全身防火防毒服,在上风向灭火。迅速切断气源,用水喷淋保护切断气源的人员,然后根据着火原因选择适当灭火剂灭火。尽可能将容器从火场移至空旷处。喷水保持火场容器冷却,直至灭火结束。 第六部分:泄漏应急处理 回目录 应急处理: 迅速撤离泄漏污染区人员至上风处,并立即隔离150m,严格限制出入。建议应急处理人员戴自给正压式呼吸器,穿防毒服。从上风处进入现场。尽可能切断泄漏源。用工业覆盖层或吸附/ 吸收剂盖住泄漏点附近的下水道等地方,防止气体进入。喷氨水或其它稀碱液中和。构筑围堤或挖坑收容产生的大量废水。如有可能,将残余气或漏出气用排风机送至水洗塔或与塔相连的通风橱内。漏气容器要妥善处理,修复、检验后再用。 第七部分:操作处置与储存 回目录 操作注意事项: 严加密闭,提供充分的局部排风和全面通风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防毒面具(全面罩),穿密闭型防毒服,戴橡胶手套。防止气体泄漏到工作场所空气中。避免与氧化剂、碱类接触。搬运时轻装轻卸,防止钢瓶及附件破损。配备泄漏应急处理设备。 储存注意事项: 储存于阴凉、通风的库房。远离火种、热源。库温不宜超过30℃。应与氧化剂、碱类、食用化学品分开存放,切忌混储。储区应备有泄漏应急处理设备。 第八部分:接触控制/个体防护 回目录 职业接触限值 中国MAC(mg/m3): 未制定标准 前苏联MAC(mg/m3): 2 TLVTN: OSHA 3ppm,9.9mg/m3 TLVWN: ACGIH 3ppm,9.9mg/m3[上限值] 监测方法: 工程控制: 严加密闭,提供充分的局部排风和全面通风。提供安全淋浴和洗眼设备。 呼吸系统防护: 空气中浓度超标时,必须佩戴自吸过滤式防毒面具(全面罩)。紧急事态抢救或撤离时,应该佩戴空气呼吸器。 眼睛防护: 呼吸系统防护中已作防护。 身体防护: 穿密闭型防毒服。 手防护: 戴橡胶手套。 其他防护: 工作现场禁止吸烟、进食和饮水。工作完毕,淋浴更衣。保持良好的卫生习惯。 第九部分:理化特性 回目录 主要成分: 纯品 外观与性状: 无色、有辛辣刺激气味的气体。 pH: 熔点(℃): -86.9 沸点(℃): -66.8 相对密度(水=1): 无资料 相对蒸气密度(空气=1): 2.71 饱和蒸气压(kPa): 53.32/-78.0℃ 燃烧热(kJ/mol): 无意义 临界温度(℃): 90.0 临界压力(MPa): 8.51 辛醇/水分配系数的对数值: 无资料 闪点(℃): 无意义 引燃温度(℃): 无意义 爆炸上限%(V/V): 无意义 爆炸下限%(V/V): 无意义 溶解性: 易溶于水、乙醇。 主要用途: 作为有机及无机溴化物制造的原料,也用于制触媒及药物。 其它理化性质: 第十部分:稳定性和反应活性 回目录 稳定性: 禁配物: 强氧化剂、碱类。 避免接触的条件: 聚合危害: 分解产物: 第十一部分:毒理学资料 回目录 急性毒性: LD50:无资料LC50:2858ppm,1小时(大鼠吸入) 亚急性和慢性毒性: 刺激性: 致敏性: 致突变性: 致畸性: 致癌性: 第十二部分:生态学资料 回目录 生态毒理毒性: 生物降解性: 非生物降解性: 生物富集或生物积累性: 其它有害作用: 无资料。 第十三部分:废弃处置 回目录 废弃物性质: 废弃处置方法: 加入碱液-石灰水中,生成中性的溴化物溶液,用水稀释后排入废水系统。 废弃注意事项: 第十四部分:运输信息 回目录 危险货物编号: 23004 UN编号: 1048 包装标志: 包装类别: O52 包装方法: 钢质气瓶。 运输注意事项: 铁路运输时应严格按照铁道部《危险货物运输规则》中的危险货物配装表进行配装。采用刚瓶运输时必须戴好钢瓶上的安全帽。钢瓶一般平放,并应将瓶口朝同一方向,不可交叉;高度不得超过车辆的防护栏板,并用三角木垫卡牢,防止滚动。严禁与氧化剂、碱类、食用化学品等混装混运。夏季应早晚运输,防止日光曝晒。公路运输时要按规定路线行驶,禁止在居民区和人口稠密区停留。铁路运输时要禁止溜放。 第十五部分:法规信息 回目录 法规信息 化学危险物品安全管理条例 (1987年2月17日国务院发布),化学危险物品安全管理条例实施细则 (化劳发[1992] 677号),工作场所安全使用化学品规定 ([1996]劳部发423号)等法规,针对化学危险品的安全使用、生产、储存、运输、装卸等方面均作了相应规定;常用危险化学品的分类及标志 (GB 13690-92)将该物质划为第2.3 类有毒气体;剧毒物品分级、分类与品名编号(GA 57-93)中,该物质的液化或压缩品被划为第三类 B级无机剧毒品。
[color=#00008B]概述:[/color] 国标编号:61001 CAS号:506-68-3 中文名称:溴化氰;氰化溴 英文名称:cyanogen bromide bromine cyanide 结构或分子式:CNBr 分子量:105.92 危险标记:13(无机剧毒品)。[color=#DC143C]基本性质:[/color] 熔点:52℃ 沸点:61.4℃ 密度:相对密度(水=1)2.02(20℃);相对密度(空气=1)3.65。 性状:菱形透明晶体。由刺激性气味。 溶解情况:稍溶于水,溶于乙醇、苯、和乙醚。 稳定性:稳定。 其他:与水或水蒸气接触会放出剧毒、易燃和腐蚀性的溴化氢和氰化氢气体。有不纯物质存在时能很快引起分解,并引起爆炸。[color=#00008B]主要用途:[/color] 用于有机合成、也是提取金的氰化剂、制杀虫剂等。[color=#DC143C]健康危害以及其它资料:[/color] 侵入途径:吸入、食入、经皮吸收 健康危害:毒作用似氢氰酸,并有明显刺激性。吸入后引起头痛、头晕、恶心、呕吐、虚弱、惊厥、昏迷、咳嗽、呼吸困难,重者发生肺水肿,可致死。对眼和皮肤有强烈刺激性。口服后引起口腔和胃刺激和灼伤,可引起死亡。 燃烧(分解)产物:氰化氢、溴化氢。 本品为极毒而且性质活泼。与氢氧化钠作用生成氰酸钠,与氨和胺作用生成氨基氰,与醇作用生成三聚氰酸酯。 受热、遇水放出剧毒气体. 遇酸易引起爆炸 本品不燃. 如火场中有溴化氰存在, 可用水灭火, 但须避免水与溴化氰直接接触. 禁止用酸碱灭火剂. 含氰化物的废水,必须经过处理后再排放,排水必须与酸性废水分开,以免引起氰化氢气体逸出使人中毒。 溴化氰也极毒,曾作为第一次世界大战期间澳大利亚军队的毒气。 对人来说,在极低的浓度下,就能刺激眼、咽喉而催泪、咳喇,并且在0.05mg/L(20PPM)的浓度下1分钟也忍耐不了。如果长时间吸入比这更低浓度的气体时,能引起轻度的结膜炎、嗓音嘶哑而且还能引起消化器官的障碍。在120mg/m3条件下,接触30分钟后即死亡。氯化氰进入人体内约有30%迅速变为氰化氢,与血红蛋白和谷胱甘肽反应,可释放出氰离子。
各位大侠,做奶粉中黄曲霉毒素时要用到过溴化氢溴化吡啶做柱后衍生剂,但这个试剂会腐蚀不锈钢吸滤头,请问是否可以不适用滤头,直接把管放在流动相瓶中?
吡啶,有机化合物,是含有一个氮杂原子的六元杂环化合物。可以看做苯分子中的一个(CH)被N取代的化合物,故又称氮苯,无色或微黄色液体,有恶臭。吡啶及其同系物存在于骨焦油、煤焦油、煤气、页岩油、石油中。吡啶在工业上可用作变性剂、助染剂,以及合成一系列产品(包括药品、消毒剂、染料等)的原料。 英文名称: pyridine 中文名称2: 氮(杂)苯 CAS No.: 110-86-1 分子式: C5H5N 分子量: 79.10吡啶结构 吡啶的结构与苯非常相似,近代物理方法测得,吡啶分子中的碳碳键长为139pm,介于C-N单键 (147pm)和C=N双键(128pm)之间,而且其碳碳键与碳氮键的键长数值也相近,键角约为120°,这说明吡啶环上键的平均化程度较高,但没有苯完全。 吡啶环上的碳原子和氮原子均以sp2杂化轨道相互重叠形成σ键,构成一个平面六元环。每个原子上有一个p轨道垂直于环平面,每个p轨道中有一个电子,这些p轨道侧面重叠形成一个封闭的大π键,π电子数目为6,符合4n+2规则,与苯环类似。因此,吡啶具有一定的芳香性。氮原子上还有一个sp2杂化轨道没有参与成键,被一对孤对电子所占据,是吡啶具有碱性。吡啶环上的氮原子的电负性较大,对环上电子云密度分布有很大影响,使π电子云向氮原子上偏移,在氮原子周围电子云密度高,而环的其他部分电子云密度降低,尤其是邻、对位上降低显著。所以吡啶的芳香性比苯差。 在吡啶分子中,氮原子的作用类似于硝基苯的硝基,使其邻、对位上的电子云密度比苯环降低,间位则与苯环相近,这样,环上碳原子的电子云密度远远少于苯,因此象吡啶这类芳杂环又被称为“缺π”杂环。这类杂环表现在化学性质上是亲电取代反应变难,亲核取代反应变易,氧化反应变难,还原反应变易。吡啶性质 外观与性状: 无色或微黄色液体,有恶臭。 熔点(℃): -41.6 沸点(℃): 115.3 相对密度(水=1): 0.9827 折射率:1.5067(25℃) 相对蒸气密度(空气=1): 2.73 饱和蒸气压(kPa): 1.33/13.2℃ 闪点(℃): 17 引燃温度(℃): 482 爆炸上限%(V/V): 12.4 爆炸下限%(V/V): 1.7 偶极距:吡啶为极性分子,其分子极性比其饱和的化合物——哌啶大。这是因为在哌啶环中,氮原子 只有吸电子的诱导效应(-I),而在吡啶环中,氮原子既有吸电子的诱导效应,又有吸电子的共轭效应(-C)。 溶解性: 溶于水、醇、醚等多数有机溶剂。吡啶与水能以任何比例互溶,同时又能溶解大多数极性及非极性的有机化合物,甚至可以溶解某些无机盐类。所以吡啶是一个有广泛应用价值的溶剂。吡啶分子具有高水溶性的原因除了分子具有较大的极性外,还因为吡啶氮原子上的未共用电子对可以与水形成氢键。吡啶结构中的烃基使它与有机分子有相当的亲和力,所以可以溶解极性或非极性的有机化合物。而氮原子上的未共用电子对能与一些金属离子如Ag、Ni、Cu等形成配合物,而致使它可以溶解无机盐类。 与水形成共沸混合物,沸点92~93℃。(工业上利用这个性质来纯化吡啶。) 光谱性质: (1)吡啶的红外光谱(IR):芳杂环化合物的红外光谱与苯系化合物类似,在3070~3020cm-1处有C—H伸缩振动,在1600~1500cm-1有芳环的伸缩振动(骨架谱带),在900~700cm-1处还有芳氢的面外弯曲振动。 (2)吡啶的核磁共振氢谱(HNMR):吡啶的氢核化学位移与苯环氢(δ7.27)相比处于低场,化学位移大于7.27,其中与杂原子相邻碳上的氢的吸收峰更偏于低场。当杂环上连有供电子基团时,化学位移向高场移动,取代基为吸电性时,则化学位移向低场移动。 (3)吡啶的紫外吸收光谱(UV):吡啶有两条紫外光谱吸收带,一条在240~260nm(ε=2000),相应于π→π*跃迁(与苯相近)。另一条在270nm的区域,相应于n→π*跃迁(ε=450)。吡啶化学性质 吡啶及其衍生物比苯稳定,其反应性与硝基苯类似。典型的芳香族亲电取代反应发生在3、5位上,但反应性比苯低,一般不易发生硝化、卤化、磺化等反应。吡啶是一个弱的三级胺,在乙醇溶液内能与多种酸(如苦味酸或高氯酸等)形成不溶于水的盐。工业上使用的吡啶,约含1%的2-甲基吡啶,因此可以利用成盐性质的差别,把它和它的同系物分离。吡啶还能与多种金属离子形成结晶形的络合物。吡啶比苯容易还原,如在金属钠和乙醇的作用下还原成六氢吡啶(或称哌啶)。吡啶与过氧化氢反应,易被氧化成N-氧化吡啶。 (1)碱性和成盐 吡啶氮原子上的未共用电子对可接受质子而显碱性。吡啶的pKa为5.19,比氨(pKa9.24)和脂肪胺(pKa10~11)都弱。原因是吡啶中氮原子上的未共用电子对处于sp2杂化轨道中,其s轨道成分较sp3杂化轨道多,离原子核近,电子受核的束缚较强,给出电子的倾向较小,因而与质子结合较难,碱性较弱。但吡啶与芳胺(如苯胺,pKa4.6)相比,碱性稍强一些。 吡啶与强酸可以形成稳定的盐,某些结晶型盐可以用于分离、鉴定及精制工作中。吡啶的碱性在许多化学反应中用于催化剂脱酸剂,由于吡啶在水中和有机溶剂中的良好溶解性,所以它的催化作用常常是一些无机碱无法达到的。 吡啶不但可与强酸成盐,还可以与路易斯酸成盐。 此外,吡啶还具有叔胺的某些性质,可与卤代烃反应生成季铵盐,也可与酰卤反应成盐。 (2)亲电取代反应 吡啶是“缺π”杂环,环上电子云密度比苯低,因此其亲电取代反应的活性也比苯低,与硝基苯相当。由于环上氮原子的钝化作用,使亲电取代反应的条件比较苛刻,且产率较低,取代基主要进入3(β)位。 与苯相比,吡啶环亲电取代反应变难,而且取代基主要进入3(β)位,可以通过中间体的相对稳定性来说明这一作用。 由于吸电性氮原子的存在,中间体正离子都不如苯取代的相应中间体稳定,所以,吡啶的亲电取代反应比苯难。比较亲电试剂进攻的位置可以看出,当进攻2(α)位和4(γ)位时,形成的中间体有一个共振极限式是正电荷在电负性较大的氮原子上,这种极限式极不稳定,而3(β)位取代的中间体没有这个极不稳定的极限式存在,其中间体要比进攻2位和4位的中间体稳定。所以,3位的取代产物容易生成。 (3)亲核取代反应 由于吡啶环上氮原子的吸电子作用,环上碳原子的电子云密度降低,尤其在2位和4位上的电子云密度更低,因而环上的亲核取代反应容易发生,取代反应主要发生在2位和4位上。 吡啶与氨基钠反应生成2-氨基吡啶的反应称为齐齐巴宾(Chichibabin)反应,如果2 位已经被占据,则反应发生4位,得到4-氨基吡啶,但产率低。如果在吡啶环的α位或γ位存在着较好的离去基团(如卤素、硝基)时,则很容易发生亲核取代反应。如吡啶可以与氨(或胺)、烷氧化物、水等较弱的亲核试剂发生亲核取代反应。 (4)氧化还原反应 由于吡啶环上的电子云密度低,一般不易被氧化,尤其在酸性条件下,吡啶成盐后氮原子上带有正电荷,吸电子的诱导效应加强,使环上电子云密度更低,更增加了对氧化剂的稳定性。当吡啶环带有侧链时,则发生侧链的氧化反应。 吡啶在特殊氧化条件下可发生类似叔胺的氧化反应,生成N-氧化物。例如吡啶与过氧酸或过氧化氢作用时,可得到吡啶N-氧化物。 吡啶N-氧化物可以还原脱去氧。在吡啶N-氧化物中,氧原子上的未共用电子对可与芳香大π键发生供电子的p-π共轭作用,使环上电子云密度升高,其中α位和γ位增加显著,使吡啶环亲电取代反应容易发生。又由于生成吡啶N-氧化物后,氮原子上带有正电荷,吸电子的诱导效应增加,使α位的电子云密度有所降低,因此,亲电取代反应主要发生在4(γ)上。同时,吡啶N-氧化物也容易发生亲核取代反应。 与氧化反应相反,吡啶环比苯环容易发生加氢还原反应,用催化加氢和化学试剂都可以还原。 吡啶的还原产物为六氢吡啶(哌啶),具有仲胺的性质,碱性比吡啶强(pKa11.2),沸点106℃。很多天然产物具有此环系,是常用的有机碱。 (5)环上取代基与母环的影响 取代基对水溶解度的影响:当吡啶环上连有-OH、-NH2后,其衍生物的水溶度明显降低。而且连有-OH、-NH2数目越多,水溶解度越小。. 其原因是吡啶环上的氮原子与羟基或氨基上的氢形成了氢键,阻碍了与水分子的缔合。取代基对碱性的影响:当吡啶环上连有供电基时,吡啶环的碱性增加,连有吸电基时,则碱性降低。与取代苯胺影响规律相似。吡啶应用 除作溶剂外,吡啶在工业上还可用作变性剂、助染剂,以及合成一系列产品(包括药品、消毒剂、染料、食品调味料、粘合剂、炸药等)的起始物。 吡啶还可以用做催化剂,但用量不可过多,否则影响产品质量。吡啶来源 吡啶可从天然煤焦油中获得,也可由乙醛和氨制得。吡啶及其衍生物也可通过多种方法合成,其中应用最广的是汉奇吡啶合成法,这是用两分子的β-羰基化合物,如乙酰乙酸乙酯与一分子乙醛缩合,产物再与一分子的乙酰乙酸乙酯和氨缩合形成二氢吡啶化合物,
烟气中的氯化氢最小要求采样孔孔径多大?
盐酸雾和氯化氢气体有什么区别?这两个是一样的吗?
请问专家:4,5,6,7-四氢噻吩[3.2-c]吡啶盐酸盐成品的含量测定的液相色谱条件是什么呢?谢谢!
如题:盐酸(氯化氢)的CAS登记号.
刚刚摸索用内标法测定2-氰基吡啶和3-氰基吡啶纯品的含量,不知道选哪种内标物比较好?(纯品中可能还含有甲苯、吡啶、2-甲基吡啶/3-甲/4-甲、4-氰基吡啶)看到一篇文献中以3-氰基吡啶为内标物测定2-氰基吡啶水溶液的含量,但以我们现在的[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]条件,2-氰基吡啶和3-氰基吡啶的样品峰并不能完全分开,还有一小部分互溶,好像达不到内标法的要求。用甲醇或乙醇作内标物不知道合适不?期盼高手解答一下。不胜感激!
[table=100%][tr][td]用[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]岛津色谱分析3-甲基吡啶 3-氰基吡啶 3-吡啶甲醛,乙醇为溶剂,得到的结果是吡啶甲醛和氰基吡啶的出锋时间相同,完全重合了,请问该怎样将他们分开?[/td][/tr][/table]
场所氰化氢 异烟酸-巴比妥酸法测氰化氢,为什么没有梯度啊,试剂都是新配的!????
一瓶盐酸,常温下充入空气来赶走氯化氢,那么溶液中盐酸浓度会降到一定值恒定呢,还是盐酸浓度一直下降,直至全部只剩下水?
最近在做吡啶甲酸铬,国标上的流动相是0.125mol/L的磷酸盐缓冲液,国标上写的是用磷酸二氢钾和磷酸氢二钾配制,没有说怎么配,有人用国标检测过吡啶甲酸铬吗?
谁有三乙胺三氟化氢的分析方法?请共享好么?
各位大虾,有谁知道去哪儿购买六氢吡啶啊,我从网上找了几个,他们都不生产了,现在对这种药品禁卖了吗?
吡啶盐酸盐是铵盐还是胺盐?
本贴为空气中氯化氢的分析、测定等问题以及相关资料汇总贴,请勿灌水!氯化氢相关资料:氯化氢是无色而有刺激性气味的气体。纯盐酸为无色液体,在空气中冒雾(由于盐酸有强挥发性),有刺鼻酸味。粗盐酸因含杂质氯化铁而带黄色。它易溶于水,在0℃时,1体积的水大约能溶解500体积的氯化氢。氯化氢的水溶液呈酸性,叫做氯化酸,习惯上叫盐酸。主要用于制做染料、香料、药物、各种氯化物及腐蚀抑制剂。盐酸为氯化氢的水溶液,是无色或微黄色的液体。中文名:氯化氢,水溶液为盐酸。用途:配制标准溶液滴定碱性物质。调节溶液的酸碱度。水解淀粉和蛋白质等。制备氯化物、胶、药品和染料。有机合成催化剂。溶剂。腐蚀剂。氯化氢气体的用途主要为制染料、香料、药物、各种氯化物及腐蚀抑制剂安全措施:泄漏:迅速撤离泄漏污染区人员至安全区并进行隔离,严格限制出入。建议应急处理人员戴自给正压式呼吸器,穿防酸碱工作服。不要直接接触泄漏物。尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间。小量泄露:用砂土、干燥石灰或苏打灰混合。也可用大量水冲洗,洗水稀释后放入废水系统。大量泄露:构筑围堤或挖坑收容;用泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。健康危害:本品对眼和呼吸道粘膜有强烈的刺激作用。环境危害:对环境有危害,对水体可造成污染。遇水有强腐蚀性。原创类:【原创】硫氰酸汞分光光度法测氯化氢分析方法的验证报告求助类:【求助】硫氰酸汞分光光度法测定氯化氢的问题【求助】废气氯化氢测定【求助】硫氰酸汞分光光度法分析氯化氢【求助】请教,为什么氯化氢的现场空白测定值比样品值还要高【求助】求抑雾率(氯化氢)测定的方法【求助】为什么做空气氯化氢时我的做的平行样不一样而且相差很大【求助】大气中氯化氢采样检测如何避免污染【求助】尾气中氯气、氯化氢检测问题!【求助】哪位有铬酸雾、硫酸雾、氯化氢的原始记录表格啊【求助】空气中氯化氢校准曲线问题【求助】废气污染源中氯化氢的测定方法【求助】请问环境空气监测氯化氢时采集空气样品时用的滤膜夹是啥样的?【求助】求测定氯化氢方法的问题【求助】请问一下做氯化氢的朋友【求助】空气中氯化氢的检测【求助】求废气中氯化氢的测定方法【求助】求教氯化氢温度及操作问题【求助】求空气中氟化氢、氯化氢含量测定方法(应急处理时使用)【求助】问一下离子色谱法测定环境空气中氯化氢的问题 大气中的氯化氢为什么会出现倒置 烟气中的氯化氢 氯化氢测定的问题 硫氰酸汞分光光度法分析氯化氢
有朋友做过4-羟基吡啶盐酸盐的液相色谱分析吗?在水与甲醇混合流动相中,HCl会解离出来吗?在纯甲醇做流动相时,还是以盐酸盐形式存在吗?请指教,谢谢!
请大家帮忙了,我这边希望找到二氢吡啶的检测方法,不知道哪里才能查到?谢咯!
应用吸收﹑吸附和催化氧化等方法对工业生产过程排放的硫化氢(HS)进行回收﹑利用或无害化处理。 概述 硫化氢产生于天然气净化﹑石油炼制﹐以及制煤气﹑制革﹑制药﹑造纸﹑合成化学纤维等生产过程。硫化氢是无色气体﹐有刺激性恶臭﹐易挥发﹐燃烧时呈蓝色火焰。硫化氢是大气的主要污染物之一﹐不仅危害人体健康﹐还会严重腐蚀设备等。 硫化氢治理开始较早。1809年英国克莱格使用石灰乳净化器脱硫﹐1849年英国兰宁和希尔斯获得干式氧化铁法专利﹐1870年美国发展了氧化铁制备方法﹐这种干式氧化铁法在脱硫领域沿用 100年之久。20世纪30~40年代出现溶液法﹐将氢氧化铁悬浮在碱液中进行脱硫。50年代起﹐西欧普遍采用氨水法。60年代出现砷碱法﹐用砷化物作催化剂。因砷化物有剧毒﹐逐渐为无毒催化剂所取代。如对苯二酚法﹑A.D.A.法﹑富玛克斯法﹑达克哈克斯法等都使用无毒催化剂。这些方法都是近年发展较快的技术。另一方面溶液法的吸收废液处理技术也不断发展﹐形成了不同的脱硫工艺。 脱硫方法 基本上分干法和湿法两类﹕ 干法 包括氢氧化铁法﹑活性炭法﹑克劳斯法和氧化锌法等。 氢氧化铁法﹕将铁屑和湿木屑充分混合﹐加0.5%氧化钙﹐制成脱硫剂﹐湿度为30~40%。硫化氢同脱硫剂反应而被脱除﹐再生的氢氧化铁可继续使用。其反应如下﹕ 2Fe(OH)+3HS─→FeS+6HO 2FeS+6HO+3O─→4Fe(OH)+6S 此法脱硫效率高﹐适于净化硫化氢含量低的气体﹐但设备占地面积大﹐脱硫剂必须定期再生和更换﹐操作条件差﹐因而已逐渐为湿法取代﹐或同湿法联合用于深度脱硫。 活性炭法﹕用活性炭吸附硫化氢﹐通氧气转换成单体硫和水﹐用硫化胺洗去硫磺﹐活性炭可继续使用。此法不宜用于含焦油的气体。 克劳斯法﹕先把1/3硫化氢氧化成二氧化硫﹐再使它在转化炉内同剩余硫化氢反应﹐可直接从[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]制取高质量熔融硫。 氧化锌法﹕粒状的氧化锌和硫化氢反应生成硫酸锌和水。主要用于净化硫化氢含量低的废气。此法效率较高﹐但不经济。 湿法 包括溶剂法﹑中和法和氧化法。 溶剂法﹕常用15~20%二乙醇胺水溶液吸收硫化氢﹐形成“复合物”﹐把富液加热到100~130℃﹐硫化氢被解析出来﹐经冷凝可得到高浓度硫化氢﹐再制成硫磺。溶液再生后经换热器冷却继续使用﹐这种工艺叫胺洗。 此法特点是溶剂容易生产﹐价格低廉﹐工艺成熟﹐脱硫效率高﹐降解和蒸发损失小。广泛应用于石油炼制的脱硫。此法还可采用环丁﹑氨基异丙醇﹑聚乙醇醚﹑磷酸酯﹑碳酸丙烯酯﹑冷甲醇等作为溶剂。但某些溶剂不适于重烃﹑芳烃含量高的气体脱硫。 中和法﹕硫化氢是酸性物质﹐可用碱性吸收液去除。富液可经过加热减压处理﹐使硫化氢脱吸﹐吸收液可循环使用。应用的碱性吸收液主要有碳酸钠﹑磷酸钾﹑氢氧化钙的溶液和氨水等﹐其中氨水应用较广。氨水法可利用煤气中的氨作碱性吸收液去除硫化氢﹐既不用外来碱源﹐也不产生废液。其反应如下﹕ 中和法操作简单﹐费用低﹐废液少﹐但碱耗高﹐吸收液再生较困难﹐脱硫效率一般比较低。 氧化法﹕硫化氢用碱性吸收液吸收后﹐在催化剂作用下氧化成硫磺。催化剂可用空气再生﹐继续使用。常用催化剂有镍盐﹑铁氰化物﹑氧化铁﹑对苯二酚﹑氢氧化铁﹑硫化砷酸的碱金属盐类﹑二磺酸盐﹑苦味酸﹑二磺酸盐等。常用吸收液有碳酸钠溶液﹑氨水等。氧化法因催化剂和吸收液的不同而异﹐举例如下﹕ 对苯二酚法﹕以碳酸钠溶液或氨水作吸收液﹐以对苯二酚作催化剂。对苯二酚是一种有机载氧体﹐脱硫效率高﹐催化剂再生所需空气少。 砷碱法﹕以氨水或碳酸钠溶液作吸收液﹐以硫代砷酸的碱金属盐类作催化剂﹐其反应如下﹕ 吸收 NaAsSO+HS─→NaAsS+HO 再生 2NaAsS+O─→2NaAsSO+2S 砷碱法为焦化厂广泛使用﹐但因催化剂污染水体﹐所以应用受到限制。 A.D.A.法﹕是以3~5%碳酸钠溶液作吸收液﹐以二磺酸钠和偏钒酸钠作催化剂﹐并加入少量酒石酸钠﹐防止有钒存在时出现沉淀物﹐硫化氢被吸收并被氧化为单体硫而加以回收。此法脱硫效率高﹐获得的硫纯度也高﹐但有副反应﹐碱耗大。 富玛克斯法﹕以2~3%碳酸钠溶液作吸收液﹐加入0.1%苦味酸作催化剂﹐吸收硫化氢。吸收硫化氢后的溶液输送到再生塔用空气再生﹐反应如下﹕ HS吸收 NaCO+HS─→NaHS+NaHCO HS氧化 NaHS+*RNO+HO─→NaOH+S+*RNHOH NaHCO+NaOH─→NaCO+HO 苦味酸再生 *R表示芳基。此法催化剂易得﹐操作温度范围较宽﹑效率高。 达克哈克斯法﹕又名法﹐以二磺酸钠为催化剂﹐以碳酸钠溶液或氨水为吸收液﹐吸收塔采用高效的泰勒填料﹐可同时脱硫脱氰。此法因碱源和废液处理方法不同可组成三种全流程﹕氨型达克哈克斯湿式氧化法﹐可得到硫酸和硫酸铵。氨型达克哈克斯燃烧法﹐产生单体硫﹑二氧化硫和氮气﹐二氧化硫可制硫酸。钠型达克哈克斯还原热解法﹐产生单体
请教给位大侠,废气中氯化氢含量与氯气含量是否有大小关系。氯化氢用硝酸盐容量法检测,氯气用碘量法检测时因检出限不一样,怎样判断氯化氢结果是否受氯气的干扰,怎么判别废气中的氯化氢与氯气的大小。
最近在测空气中的硫化氢,加入显色液后会有很剧烈的反应,同时产生大量白烟,请问这是什么原因呢?白烟的散失对测定结果有影响吗?环境温度40多度,对硫化氢的测定有影响吗?
求助 2-巯基吡啶氮氧化物钠盐(SPT) 分析条件。中文名称:2-巯基吡啶氧化物钠盐英文名称:Sodium-2-pyridinethiol-1-oxide中文别名:吡硫嗡钠;吡硫霉净;α-巯基吡啶-N-氧化物钠;吡啶硫酮钠
请问有哪位兄弟姐妹有"二氢吡啶"的检测方法呢.小弟遇到麻烦,急需此检测方法.希望各位能帮帮忙.谢谢.

[img]http://ng1.17img.cn/bbsfiles/images/2009/10/200910222329_177315_1610969_3.jpg[/img][color=#00008B]磷化氢[/color] 一、物品与成分辨识资料 物品名称:磷化氢(Phosphine) 同义名称: Hydrogen Phosphide、Phosphorus Hydride、Phosphuretted Hydrogen、Phosphorus Trihydride 化学性质:磷化氢是一种无色、高毒、易燃的储存于钢瓶内的液化压缩气体。 危害物质成分 中英文名称:磷化氢Phosphine 化学式:PH3 含量%:100% 化学文摘社登记号码(CAS No.):007803-51-2 危害物质分类及图式:2.3 有毒气体;2.1 易燃性气体 二、[color=#DC143C]危害辨识资料[/color] 紧急情况综述: 磷化氢是一种无色、高毒、易燃的储存于钢瓶内的液化压缩气体。其存储压力为其蒸汽压522psig (70 F ) 该气体比空气重并有类似臭鱼的味道。如果遇到痕量其它磷的氢化物如乙磷化氢,会引起自燃。磷化氢应该按照高毒性且自燃的气体处理。吸入磷化氢会对心脏、呼吸系统、肾、肠胃、神经系统和肝脏造成影响。进入磷化 氢浓度超标的区域要配戴自给式呼吸器(SCBA)和全身防火服。进入含有可燃气体区域的人员要意识到极严重的火灾和爆炸危险。 最重要危害与效应: 急性: 眼接触:暴露在低浓度的磷化氢中会造成刺激。接触其液体会造成冻伤。 摄入:不可能。接触液体会造成冻伤。 吸入:磷化氢不仅有刺激性而且是系统毒剂。症状包括流泪、刺激肺、气短、咳嗽、肺积水、头痛、青紫、头晕、疲劳、恶心、呕吐、严重的上腹疼痛、麻木、颤抖、痉挛、黄疸、肝脏及心脏功能紊乱、肾发炎及死亡。 皮肤接触:接触液体会造成刺激和冻伤。 慢性: 侵入途径:吸入 症状:重复暴露在低浓度磷化氢中的症状包括支气管炎、厌食、神经系统问题,以及类似于急性中毒的症状如:黄疸、肝脏及心脏功能紊乱、肾发炎。慢性暴露还会造成骨骼的变化。 损害器官:肺、心、肝、肾、中枢神经系统和骨骼。 过度暴露造成的病情恶化 :哮喘、肺炎或肺纤维化疾病。 致癌性:未被 NTP、OSHA及IARC列为致癌物或潜在致癌物。
实验室用的是国产的色谱,用的是TCD检测器,色谱柱用的是5A分子筛,现在想分析氢气中微量的氯化氢,请高手指教!谢谢!
求助 2-巯基吡啶氧化物钠盐 分析条件。中文名称:2-巯基吡啶氧化物钠盐英文名称:Sodium-2-pyridinethiol-1-oxide中文别名:吡硫嗡钠;吡硫霉净;α-巯基吡啶-N-氧化物钠;吡啶硫酮钠;奥麦丁钠;2-巯基吡啶N-氧化物钠盐无水;吡硫翁钠英文别名:Sodium omadine; Sodium Pyrithione; 2-Mercaptopyridine-N-oxide sodium salt; NaPT; ; sodium pyridine-2-thiolate 1-oxide; 2-thioxopyridin-1(2H)-olate; 2-pyridinethiol, 1-oxide, sodium salt (1:1)CAS号:3811-73-2分子式:C5H5NNaOS分子量:150.1535