如题求助奥美沙坦酯的分析方法谢谢
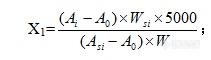
[align=center]奥美拉唑成品中杂质的质量检测[/align][align=center][b]摘要:目的:[/b]在对奥美拉唑原料药中引入的基因毒性杂质,即4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺设定质量检测方法,并进行方法验证。同时,对合成工艺中引入的残留溶剂进行质量检测,确保奥美拉唑成品的质量安全。[b]方法:[/b]在对4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺进行质量检测中,采用液相色谱的方法,并对其进行限度验证;而对残留溶剂采用[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url],利用内标法进行质量检测。[b]结果:[/b]本研究对两种基因毒性杂质及残留溶剂的检测是可行有效的,有利于对奥美拉唑原料药的质量监控,同时为后续对奥美拉唑质量标准的制定提供理论依据。[b]关键词:[/b]奥美拉唑;质量标准;毒性杂质;残留溶剂[/align][b]Abstract Objective[/b]: Themass detection is set in the introduction of genotoxic impurities into theomeprazole APIproducts, namely 4-methoxy-2-nitroaniline and4-methoxy-o-phenylenediamine, and the method was verified.At the same time, the quality of theresidual solvent introduced in the synthesis process is checked to ensure thequality and safety of the omeprazole.[b]Methods:[/b]In the mass detection of4-methoxy-2-nitroaniline and 4-methoxy-o-phenylenediamine, the method of liquidchromatography is used, and the limit is verified the residual solvent aretested by the gas chromatogram and internal standard method for quality.[b]Results:[/b]This study is feasible and effective for the detection of twogenotoxic impurities and residual solvents, which is the benefit of qualitymonitoring of omeprazole APIproducts, and provides a theoretical basis forthe subsequent development of omeprazole quality standards.[b]Keywords:[/b] Omeprazole Quality standard Genotoxicimpurities Residual solvents随着人们平时工作、学习等压力的不断增加,导致消化类疾病患病率不断上升,而在中国,发病率已达到20%左右[sup][/sup]。用于治疗消化类疾病的药物也逐步成为生活中的常用药,其发展市场也在不断扩大。在消化系统溃疡类疾病的临床治疗中,质子泵抑制剂类药物因其具有良好的治疗效果,市场销售份额高达58%[sup][/sup]。而奥美拉唑是质子泵抑制剂类的代表药物,通过抑制胃酸分泌,用于治疗胃溃疡、十二指肠溃疡等疾病。但长期服用奥美拉唑存在着潜在风险,可能会引起心脏类疾病等。且其生产过程引入的有机杂质、基因毒性杂质、无机杂质或残留的有机溶剂等均对人体健康有一定危害。因此,建立奥美拉唑引入杂质或残留有机溶剂的质量检测方法是十分有必要的,严格控制质量标准,把控药品市场质量安全。[b]1 仪器与材料1.1 实验仪器[/b]高效液相色谱仪(THERMO SCIENYIFIC, Mltimate3000);电子天平(METTLER-TOLEDO、BP-210S) [url=https://insevent.instrument.com.cn/t/Mp]气相色谱仪[/url](Agilent 6890N)顶空进样器(Agilent 7694E)[b] 1.2 实验试剂[/b][align=center][b]表1-1 实验所需试剂[/b][/align] [table][tr][td=2,1] [align=center][b]实验试剂[/b][/align] [/td][td] [align=center][b]厂家[/b][/align] [/td][/tr][tr][td=2,1] [align=center]磷酸二氢钾[/align] [/td][td] [align=center]莱阳经济技术开发区精细化工厂[/align] [/td][/tr][tr][td=2,1] [align=center]氢氧化钾[/align] [/td][td] [align=center]国药集团[/align] [/td][/tr][tr][td=2,1] [align=center]乙腈[/align] [/td][td] [align=center]Fisher Scientific[/align] [/td][/tr][tr][td=2,1] [align=center]4-甲氧基-2-硝基苯胺[/align] [/td][td] [align=center]北京百灵威科技有限公司[/align] [/td][/tr][tr][td=2,1] [align=center]4-甲氧基-邻苯二胺[/align] [/td][td] [align=center]Alfa Aesar[/align] [/td][/tr][tr][td=2,1] [align=center]奥美拉唑[/align] [/td][td] [align=center]寿光富康制药有限公司[/align] [/td][/tr][tr][td=1,6] [align=center]分析纯[/align] [/td][td] [align=center]丙酮[/align] [/td][td] [align=center]西陇化工股份有限公司[/align] [/td][/tr][tr][td] [align=center]甲醇[/align] [/td][td] [align=center]Fisher Scientific[/align] [/td][/tr][tr][td] [align=center]苯[/align] [/td][td] [align=center]天津富宇化工有限公司[/align] [/td][/tr][tr][td] [align=center]甲苯[/align] [/td][td] [align=center]莱阳经济技术开发区精细化工厂[/align] [/td][/tr][tr][td] [align=center]二氯甲烷[/align] [/td][td] [align=center]天津科密欧化学试剂有限公司[/align] [/td][/tr][tr][td] [align=center]DMA[/align] [/td][td] [align=center]Sigma-Aldrich[/align] [/td][/tr][/table][b]2 基因毒性杂质的检验方法的设定及方法学验证[/b]来源于起始物料苯并咪唑的合成路线的基因毒性杂质[sup][/sup]不适用于药典各论方法检测此类物质,在药典规定的波长无吸收。因此,采用液相色谱方法,对奥美拉唑成品中的4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺进行限度检测和控制。[b]2.1色谱条件[/b]色谱柱:ODS-3,5μm,4.6×250mm;检测波长分别设定为4-甲氧基-2-硝基苯胺(230nm)及4-甲氧基-邻苯二胺(210nm);流速为1.0ml/min;进样量为80μl;柱温为30℃。[b]2.2 溶液配制[/b]1) 流动相:溶解6.8g的磷酸二氢钾用纯化水溶解并稀释至1000ml,用氢氧化钾调节pH至6.5,和乙腈按(73:27)混合。2) 对照溶液:取4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺各16mg,精密称定置于200ml容量瓶中,用流动相溶解并稀释至刻度,准确量取1ml此溶液用流动相稀释至100ml,再量取1ml用流动相稀释至50ml。3) 奥美拉唑供试液:称取奥美拉唑样品100mg,精密称定置于50ml容量瓶中,用流动相溶解并稀释至刻度。注:计算奥美拉唑中的4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺含量都不得超过8ppm。[b]2.3质量检测方法验证[/b]通过限度验证,即该方法的专属性、系统适应性、检测限以及样品测定,是否符合验证可接受的标准,来判断该方法是否符合标准,可用于杂质测定。[b]2.3.1 专属性[/b]1) 溶液配制定性溶液:取4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺各16mg,精密称定置于200ml容量瓶中,用配制完毕的流动相溶解并稀释至刻度,准确量取1ml此溶液用流动相稀释至100ml,再稀释1ml用流动相稀释至50ml。2) 测定取流动相作为空白、定性溶液进样,记录色谱图,数据和结果。3) 数据与结果[align=center][b]表2-1专属性测试数据和结果[/b][/align] [table][tr][td] [align=center][b]项目[/b][/align] [/td][td] [align=center][b]4-甲氧基-2-硝基苯胺峰面积(230nm)[/b][/align] [/td][td] [align=center][b]4-甲氧基-邻苯二胺峰面积(210nm)[/b][/align] [/td][/tr][tr][td] [align=center]空白[/align] [align=center]溶液[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][tr][td] [align=center]定性[/align] [align=center]溶液[/align] [/td][td] [align=center]8550[/align] [/td][td] [align=center]12258[/align] [/td][/tr][/table][align=center][b]表2-2信噪比测试数据和结果[/b][/align] [table=100%][tr][td] [align=center][b]杂质[/b][/align] [/td][td] [align=center][b]信噪比[/b][/align] [/td][/tr][tr][td] [align=center]4-甲氧基-2-硝基苯胺峰面积(230nm)[/align] [/td][td] [align=center]0[/align] [/td][/tr][tr][td] [align=center]4-甲氧基-邻苯二胺峰面积(210nm)[/align] [/td][td] [align=center]0[/align] [/td][/tr][/table][b]2.3.2系统适用性试验[/b]1) 溶液制备贮备液:取4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺各16mg,精密称定置于200ml容量瓶中,用流动相溶解并稀释至刻度,准确量取1ml此溶液用流动相稀释至100ml。杂质溶液:用流动相稀释1ml贮备液到50ml或用专属性定性溶液及图谱。分离度:称取埃索美拉唑镁或奥美拉唑镁样品100mg,精密称定置于50ml容量瓶中,用流动相溶解后准确加入1ml贮备液并用流动相稀释至刻度。2) 测定以方法规定的色谱条件,取杂质溶液、分离度溶液分别进样,记录色谱图,数据和结果。3) 数据与结果[align=center][b]表2-3 系统适用性性测试结果[/b][/align] [table=562][tr][td] [align=center][b]溶液[/b][/align] [align=center][b]名称[/b][/align] [/td][td] [align=center][b]峰面积1[/b][/align] [/td][td] [align=center][b]峰面积2[/b][/align] [/td][td] [align=center][b]峰面积3[/b][/align] [/td][td] [align=center][b]峰面积4[/b][/align] [/td][td] [align=center][b]峰面积5[/b][/align] [/td][td] [align=center][b]峰面积6[/b][/align] [/td][td] [align=center][b]峰面积平均值[/b][/align] [/td][td] [align=center][b]RSD[/b][/align] [/td][/tr][tr][td] [align=center]4-甲氧基-2-硝基苯胺峰面积(230nm)[/align] [/td][td] [align=center]8427[/align] [/td][td] [align=center]8425[/align] [/td][td] [align=center]8481[/align] [/td][td] [align=center]8533[/align] [/td][td] [align=center]8483[/align] [/td][td] [align=center]8460[/align] [/td][td] [align=center]8468.17[/align] [/td][td] [align=center]0.48%[/align] [/td][/tr][tr][td] [align=center]4-甲氧基-邻苯二胺峰面积(210nm)[/align] [/td][td] [align=center]11701[/align] [/td][td] [align=center]11539[/align] [/td][td] [align=center]11086[/align] [/td][td] [align=center]11043[/align] [/td][td] [align=center]10548[/align] [/td][td] [align=center]10679[/align] [/td][td] [align=center]11099.33[/align] [/td][td] [align=center]4.11%[/align] [/td][/tr][/table][align=center][b]表2-4 奥美拉唑和4-甲氧基-邻苯二胺分离度测试结果[/b][/align] [table=100%][tr][td] [align=center][b]名称[/b][/align] [/td][td] [align=center][b]保留时间[/b][/align] [/td][td] [align=center][b]分离度[/b][/align] [/td][/tr][tr][td] [align=center]相邻杂质峰[/align] [/td][td] [align=center]3.813[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]4-甲氧基-邻苯二胺峰面积(210nm)[/align] [/td][td] [align=center]4.736[/align] [/td][td] [align=center]2.16[/align] [/td][/tr][tr][td] [align=center]相邻杂质峰[/align] [/td][td] [align=center]5.248[/align] [/td][td] [align=center]1.69[/align] [/td][/tr][/table][align=center][b]表 2-5奥美拉唑和4-甲氧基-2-硝基苯胺分离度测试结果[/b][/align] [table=100%][tr][td] [align=center][b]名称[/b][/align] [/td][td] [align=center][b]保留时间[/b][/align] [/td][td] [align=center][b]分离度[/b][/align] [/td][/tr][tr][td] [align=center]相邻杂质峰[/align] [/td][td] [align=center]23.168[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]4-甲氧基-2-硝基苯胺峰面积(230nm)[/align] [/td][td] [align=center]26.908[/align] [/td][td] [align=center]3.32[/align] [/td][/tr][tr][td] [align=center]相邻杂质峰[/align] [/td][td] [align=center]29.467[/align] [/td][td] [align=center]2.85[/align] [/td][/tr][/table][b]2.3.3检测限[/b]1) 溶液制备按照选择项下贮备溶液的配制方法配制溶液,并将标准溶液逐步稀释,得到适当浓度的溶液。2) 测定在色谱条件下,取溶液进样,记录色谱图。当待测组分的信噪比大于2时,对应的浓度为该组分的最小检测浓度。3) 数据与结果4-甲氧基-2-硝基苯胺检测限0.00256 μg/ml,LOD=1.28ppm,S/N=2.22 4-甲氧基-邻苯二胺检测限0.00256μg/ml,LOD=0.000128,S/N=2.[b]2.3.4样品检测[/b]1) 溶液配制根据已设定检测方法已将溶液配制完毕。2) 测定分别取三批样品按照溶液的配制方法,配制供试液进样,记录色谱图。3) 数据与结果[align=center][b]表2-6 奥美拉唑样品检测结果[/b][/align] [table=102%][tr][td] [align=center][b]批号[/b][/align] [/td][td] [align=center][b]4-甲氧基-2-硝基苯胺(230nm)[/b][/align] [/td][td] [align=center][b]4-甲氧基-邻苯二胺(210nm)[/b][/align] [/td][/tr][tr][td] [align=center]20150401[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][tr][td] [align=center]20150402[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][tr][td] [align=center]20150403[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][/table][b]3残留溶剂的检测方法的设定[/b]在《中国药典》[sup][/sup]规定的奥美拉唑中各论残留溶剂的检测方法的基础上,进行修正,更改部分参数,选用内标法对残留溶剂进行检测,有利于快速检验及产品及时入库。[b]3.1 色谱条件[/b]1) [url=https://insevent.instrument.com.cn/t/Mp]气相[/url]部分色谱柱:Agilent DB-624, 0.32mm×30m,膜厚1.8μm;柱温先以50 ℃保持5分钟,后以20℃/min升温到200℃保持4分钟;进样口温度为200℃; 分流比为1:1;检测器为FID,其温度为300℃;载气设定为氮气;柱流量则为3.0ml/min。2) 顶空部分顶空瓶平衡温度98℃,平衡时间20min;定量环温度115℃,体积1ml;传输管线温度为130℃。[b]3.2 溶液配制[/b]1) 苯贮备液:精密称取苯0.02g于已加入少量DMA的100ml容量瓶中,用DMA稀释至刻度,摇匀。2) 标准贮备液:精密称取丙酮0.15g,甲醇0.1g,二氯甲烷0.01g,甲苯0.03g,于已加入少量DMA的100ml容量瓶中,在此容量瓶中加入1ml准确量取的苯贮备液,用DMA稀释至刻度,摇匀。3) 标准溶液:精密量取标准溶液贮备液5.0ml于50 ml容量瓶中,用DMA稀释至刻度,混合均匀。4) 供试溶液:精密称定样品0.5g于20ml顶空瓶中,用5ml DMA溶解。[b]3.3 检测方法[/b]1) 按照[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]部分和顶空部分的操作条件设定操作方法。取标准溶液顶空进样,记录色谱图(主要组分出峰顺序依次为甲醇、丙酮、二氯甲烷、苯、甲苯)。注:计算相邻组分之间的分离度R,均应不小于1.5;取6份标准溶液,连续进样,计算各溶剂峰面积的RSD,应不大于10%。2) 先将空白溶液、6份标准溶液和样品溶液各5ml置于顶空瓶中,密封。取空白溶液进样,记录图谱,再取6份标准溶液,记录色谱图,进行系统适用性试验和标准校正,最后取供试溶液进样,记录图谱。计算公式如下式(2-1):[align=center][img=,211,60]https://ng1.17img.cn/bbsfiles/images/2019/07/201907241130224283_2738_3389662_3.png!w211x60.jpg[/img];[/align][align=center][img=,187,81]https://ng1.17img.cn/bbsfiles/images/2019/07/201907241130597462_639_3389662_3.png!w187x81.jpg[/img][/align]注:X[sub]1[/sub]:残留甲醇、甲苯、二氯甲烷、丙酮的量,ppm X[sub]2[/sub]:残留苯的量,ppm Ai:供试溶液的图谱中溶剂(i)的峰面积;A[sub]0[/sub]:空白溶液的图谱中溶剂(i)的峰面积;A[sub]si[/sub]:标准溶液的图谱中溶剂(i)的峰面积;W:样品的称量,g;W[sub]si[/sub]:溶剂(i)的称重,g。[b]3.4 检测结果[/b][align=center][b]表3-1 奥美拉唑残留溶剂检验结果[/b][/align] [table][tr][td=1,2] [align=center][b]项目[/b][/align] [/td][td=1,2] [align=center][b]标准[/b][/align] [/td][td=1,2] [align=center][b]方法[/b][/align] [/td][td=3,1] [align=center][b]奥美拉唑检验批号[/b][/align] [/td][/tr][tr][td] [align=center][b]A-51511507002[/b][/align] [/td][td] [align=center][b]A-51511507003[/b][/align] [/td][td] [align=center][b]A-51511507004[/b][/align] [/td][/tr][tr][td=1,5] [align=center]残留溶剂检验[/align] [/td][td] [align=center]丙酮不得超过1500ppm[/align] [/td][td=1,5] [align=center]内控[/align] [/td][td] [align=center]309ppm[/align] [/td][td] [align=center]396ppm[/align] [/td][td] [align=center]423ppm[/align] [/td][/tr][tr][td] [align=center]二氯甲烷不得超过100ppm[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][tr][td] [align=center]甲醇不得超过500ppm[/align] [/td][td] [align=center]115ppm[/align] [/td][td] [align=center]129ppm[/align] [/td][td] [align=center]122ppm[/align] [/td][/tr][tr][td] [align=center]甲苯不得超过300ppm[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][tr][td] [align=center]苯不得超过1ppm(LOQ)[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][td] [align=center]未检出[/align] [/td][/tr][/table][b]4小结[/b]本研究对治疗胃溃疡的一线药物奥美拉唑进行质量检验方法的研究。通过分析其合成过程中引入的杂质,创新性的提出原料药中可能存在的基因毒性杂质4-甲氧基-2-硝基苯胺、4-甲氧基-邻苯二胺,同时对生产过程引入的残留有机溶剂进行质量监控。根据ICH的指南Q2A和Q2B的要求,采用液相色谱,对奥美拉唑成品中的4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺进行限度检测,并对检测方法进行了专属性、系统适应性、检测限,样品测定等方面的限度验证。限度验证结果均应符合标准,说明该检测方法符合测定的准确性、可靠性和灵敏度的要求,能够进行该杂质的测定。且使用该方法进行三种批号的奥美拉唑基因毒性杂质检验时,均未发现存在4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺。说明现有的工艺可有效除去原料药中引入的这两种基因毒性杂质,可不放入日常质量监控之中。同时,在对奥美拉唑合成工艺中残留的有机溶剂的质量检测研究中,进行检测时,发现,其药品中检测出少量的丙酮和甲醇,但均在质量标准规定以内,未检测出二氯甲烷、甲苯、苯,说明选用的三批奥美拉唑成品药均符合药品质量标准。而在检测中,本研究创新性使用不同于中华人民共和国药典中的N ,N-二甲基甲酰胺(DMF),而选择易于冲洗的N ,N-二甲基乙酰胺(DMA)做溶媒,易冲洗干净,且不影响公司内其它产品的检测,与中华人民共和国药典方法相比,大大缩短检验样品的时间,中华人民共和国药典方法单个样品的检测时间为65min,内控的方法仅为36.5min,对工业化规模生产来说,快速检测样品既经济又能保证产品及时入库。[b]参考文献[/b] AnaLuisa Correia, Mina J Bissell. The tumor microenvironment is a dominantforceinmulti drμg resistance.Drμg Resist Update. 2012, 15(6):39-49. Shaojun Shi, ΜlrichKlotz,Protonpump inhibitors: an update of their clinical us and pharmacokinetics .EurJ Clin Pharmacol, 2008, 64(30): 935-951. ICHVALIDATION OF ANALYTICAL PROCEDURES: TEXT AND METHODOLOGY Q2 (R1) Current Step4 version (Complementary Guideline on Methodology dated 6 November 1996incorporated in November 2005). 国家药典委员会.中华人民共和国药典.二部.北京:中国医药科技出版社, 2015: 1412.
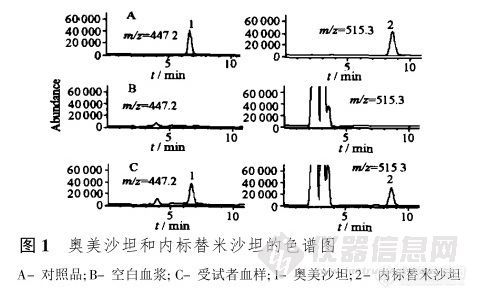
【作者】 于洋; 侯艳宁; 刘建芳; 王金; 【Author】 YU Yang,HOU Yan-ning~(*),LIU Jian-fang,WANG Jin(Department of Clinical Pharmacology,Bethune International Peace Hospital,Shijiazhuang 050082,China) 【机构】 白求恩国际和平医院临床药理室; 白求恩国际和平医院临床药理室 石家庄050082; 石家庄050082; 【摘要】 目的建立人血浆中奥美沙坦质量浓度的HPLC-MS测定法。方法血浆样品用OASIS HLB 3cc固相萃取小柱萃取,在Diamonsil C18(4.6 mm×150 mm,5μm)色谱柱上分离,流动相为甲醇-水(含体积分数为0.2%醋酸)(70∶30),流速0.5 mL.min-1。LC-ESI/MS选择离子检测,正离子模式,用于定量分析的离子分别为m/z447.2(奥美沙坦),m/z515.3(内标,替米沙坦)。结果奥美沙坦血药质量浓度在1~3 000μg.L-1内的线性关系良好(r=0.999 9),血浆中低、中、高3种质量浓度(3,100,2 400μg.L-1)的相对回收率在97.6%~100.9%之间,日内RSD≤5.2%,日间RSD≤13.3%。结论本法操作简便、准确、灵敏,适用于临床药动学研究。 【关键词】 奥美沙坦; 固相萃取; 高效液相色谱-质谱联用法; 血浆; http://ng1.17img.cn/bbsfiles/images/2012/09/201209022113_388003_1838299_3.jpg

今天收到客户一个实验,检测奥美拉唑镁肠溶片,溶出度实验,样品中有一个杂质未分开,希望安排售前实验,进行色谱柱的筛选。以辛烷基硅烷键和硅胶为填充剂,流动相是0.01M磷酸氢二钠(磷酸调pH=7.6)-乙腈=75:25,波长302nm,要求奥美拉唑峰与杂质I分离度大于2.0.下面是客户做的结果,实验室色谱柱筛选工作正在进行中……http://ng1.17img.cn/bbsfiles/images/2016/03/201603071349_586166_1987954_3.png
请问专家有没有奥美沙坦的HPLC分析方法,它含有-NH-,请问能不能用FITC衍生。谢谢
102%(对照为奥美拉唑钠),后来领导指示我们用奥美拉唑对照再来用液相检测奥美拉唑钠,含量又和奥美拉唑钠对照算出来的结果差很多(奥美拉唑钠和奥美拉唑的转换系数考虑在内了),大家帮忙分析一下是什么原因啊
奥美拉唑胶囊在酸里面的溶出如何测定呢?碳酸氢钠需要测溶出吗?
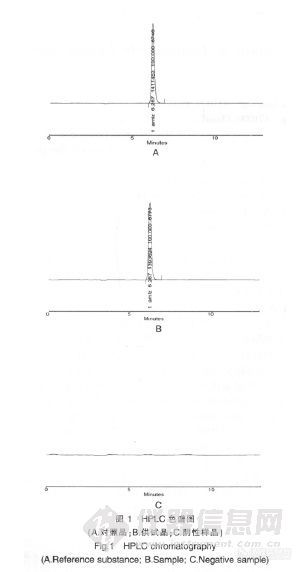
作者:孙蕊;刘世超; (河南省洛阳市中心医院药剂科;河南省洛阳市妇女儿童医疗保健中心药剂科;)摘要:目的:建立高效液相法测定奥美拉唑镁肠溶片含量的方法。方法:采用Diamonsil-C18(4.6 mm×150 mm,5μm)色谱柱;流动相:甲醇-水-磷酸-三乙胺(65∶35∶0.12∶0.3);检测波长:302 nm;流速:1.0 ml/min。结果:奥美拉唑镁在13.3182~31.0758μg范围内与峰面积呈良好的线性关系(r=0.999 0),平均回收率为101.14%,RSD=1.64%。结论:本法简便、准确、重现性好,可用于奥美拉唑镁肠溶片的质量控制。谱图:http://ng1.17img.cn/bbsfiles/images/2012/08/201208201413_384697_1606903_3.jpg
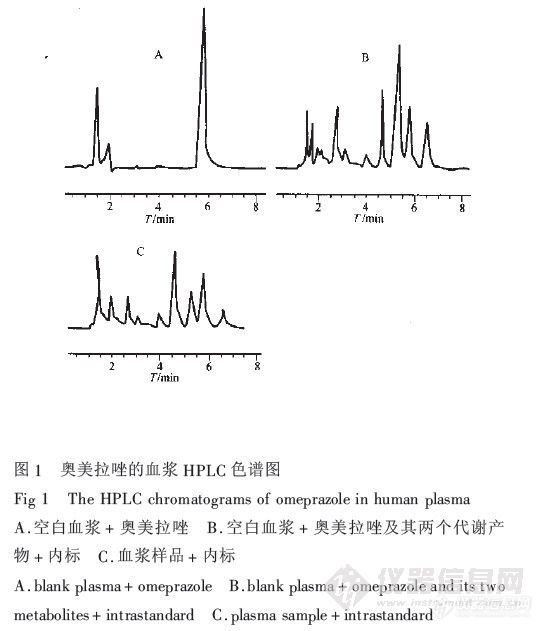
奥美拉唑肠溶胶囊人体相对生物利用度王平全,安富荣,刘振,左明,秦绮 ( 上海第二医科大学仁济医院临床药理药学研究室,上海 复旦大学医学院药物分析教研室,上海) 目的:建立测定奥美拉唑血药浓度的反相高效液相色谱法,并测定奥美拉唑肠溶胶囊的人体相对生物利用度。方法:色谱柱:Diamonsil C18( 150mmx4.6mm,5um);流动相:醋酸铵缓冲液(0.1mol/l,ph7.0),乙腈A甲醇(60:35:5);流速:1.2ml/min;检测波长:UV302nm。以内标法定量,内标物为对羟基苯甲酸乙酯。进行人体随机交叉自身对照试验,血样以二氯甲烷一次提取,测定奥美拉唑肠溶胶囊的相对生物利用度。结果:血药浓度测定的线性范围为:0.004-5.0ug/ml,回归方程为Y=3.0218C-0.0079(r=0.9998,n=7),最低检测浓度为2.5ng/ml(s/n=3),平均方法回收率为102.60%,日内、间精密度均小于5%。结论:方法简便,准确,灵敏,可用于奥美拉唑血药浓度的测定。两种制剂具有生物等效性,试验胶囊的相对生物利用度为(100.4+-13.8%)。 奥美拉唑肠溶胶囊;反相高效液相色谱法;血药浓度;生物利用度http://ng1.17img.cn/bbsfiles/images/2012/07/201207241851_379461_2355529_3.jpg
亲,最近我在做小试,需要分析奥美拉唑氯化物的分析方法,HPLC条件是怎么样的。。。
能提供兰索氯化物2-氯甲基-3-甲基-4-(2,2,2-三氟乙氧基)吡啶盐酸][/size]和奥美氯化物(2-氯甲基-3,5二甲基-4-甲氧基吡啶)的检测方法不,谢谢。还有2-疏基苯并咪唑和2-疏基-5甲氧基苯并咪唑的检测方法。谢谢
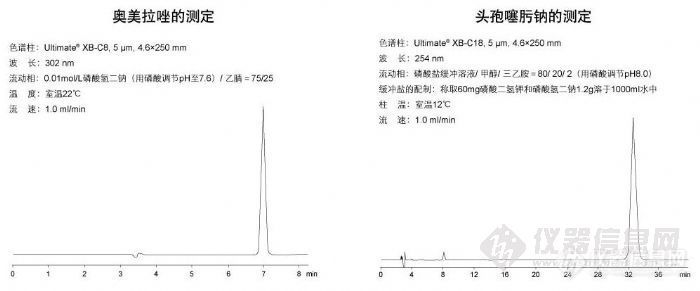
奥美拉唑的测定和头孢噻肟钠的测定http://ng1.17img.cn/bbsfiles/images/2009/11/200911021837_180180_1896702_3.jpg

【作 者】田书霞 蒋晔 赵静 任进民 王淑梅【机 构】河北医科大学药学院,河北石家庄050017 河北医科大学第二医院药剂科,河北石家庄050017【刊 名】中国药业, 2006(4): 50-51【关键词】奥美拉唑 反相高效液相色谱法 血药浓度http://www.chemdrug.com/images/space.gif【文 摘】目的 建立反相高效液相色谱法测定血浆中奥美拉唑浓度的方法。方法 血浆经碱化后以乙酸乙酯-氯仿(4:1)为提取溶剂,以液-液萃取法处理血浆样品。采用Diamonsil C18柱(150mm×4.6mm,5μm)为色谱柱,流动相为pH=6.8的甲醇-异丙醇-0.5%三乙胺水溶液(37:10:53),流速为1.0mL/min,内标为硝苯地平,检测波长为302nm。结果 该法血药浓度在7.98~2.024×10^3ng/mL范围内线性关系良好(r=0.9998),最低检测限为2ng/mL,精密度日内RSD〈3.2%,日间RSD<3.7%,平均提取回收率为84.6%,平均方法回收率为99.6%。结论 该方法快速、准确,适用于奥美拉唑的临床药代动力学研究和血药浓度检测。http://ng1.17img.cn/bbsfiles/images/2012/08/201208271659_386550_2352694_3.jpg
问题: 请问各位老师,有做过艾司奥美拉唑原料有关物质的吗?交流一下好吗?谢谢!艾司奥美拉唑钠有关物质
[b]问题:[b][b][b][/b][/b]艾司奥美拉唑镁肠溶片的检测,流动相是?[/b]答案:流动相: A:水-磷酸盐缓冲溶液-乙腈(80:10:10) B:乙腈-磷酸盐缓冲溶液-水(80:1:19)=======================================================================【活动内容】1、每个工作日上午10:00左右发布一个关于应用数据库的应用问答题,版友根据题目给出自己理解的答案。2、每个工作日下午15:10公布参考答案。【活动奖励】幸运奖:抽奖软件,当天随机抽取3个或5个回答正确的版友ID号(最后一个ID号,截止至下午15:00),每人奖励[color=#ff0000]2钻石币[/color](抽奖人数≤10,抽取3个版友;抽奖人数>10,抽取5个版友);中奖名单:lijing320323(注册ID:lijing320323)999youran(注册ID:999youran)dahua1981(注册ID:dahua1981)PAEs(注册ID:v2911392)吕梁山(注册ID:shih20j07)[img=,690,388]https://ng1.17img.cn/bbsfiles/images/2018/09/201809041504163298_6848_1610895_3.png!w690x388.jpg[/img][img=,690,388]https://ng1.17img.cn/bbsfiles/images/2018/09/201809041504189792_3148_1610895_3.png!w690x388.jpg[/img]积分奖励:所有回答正确的版友奖励[color=#ff0000]10个积分[/color](幸运奖获得者除外)。【注意事项】同样的答案,每人只能发一次[/b][align=left][color=#ff0000][b]PS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。[/b][/color][/align][align=left][color=#ff0000][b] 下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。[/b][/color][/align][align=center]=======================================================================[/align]方法:HPLC基质:药品应用编号:103783化合物:艾司奥美拉唑色谱柱:[url=http://www.dikma.com.cn/product/details-855.html]Platisil ODS 5μm 250 x 4.6mm[/url]样品前处理:有关物质供试品:精密称取20mg样品置于100mL容量瓶中,加10mL甲醇,振摇,加20mL磷酸盐缓冲溶液(每1000mL水中加入磷酸钠0.0137mol和磷酸氢二钠0.0551mol),超声使其溶解,用水稀释到100mL,混匀,过滤,取续滤液。色谱条件:色谱柱: Platisil ODS 250*4.6 mm,5 μm(Cat#:99503)流动相: A:水-磷酸盐缓冲溶液-乙腈(80:10:10) B:乙腈-磷酸盐缓冲溶液-水(80:1:19)磷酸盐缓冲溶液:1000mL水+磷酸二氢钠0.0052mol+磷酸氢二钠0.0315mol流速: 1.0 mL/min柱温: 30 ℃检测器: 302nm进样量: 20uL文章出处:天津应用实验室关键字:艾司奥美拉唑镁肠溶片、Platisil ODS、99503、HPLC摘要:Platisil ODS检测艾司奥美拉唑镁肠溶片。图谱:[img]http://www.dikma.com.cn/u/image/2017/01/05/1483598227111770.jpg[/img][img]http://www.dikma.com.cn/u/image/2017/01/05/1483598227527569.jpg[/img][img]http://www.dikma.com.cn/u/image/2017/01/05/1483598227109068.jpg[/img]
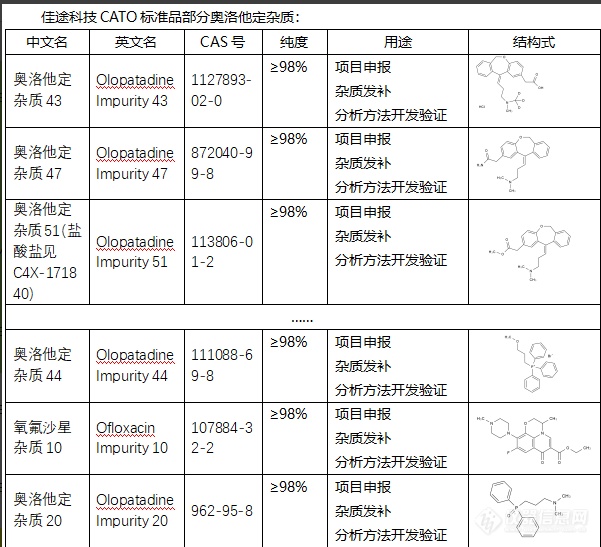
奥洛他定是一种用于治疗孤独症、精神分裂症和双相情感障碍的药物。在其生产过程中可能产生一些杂质。这些杂质可能源于原料、废弃的生产物或制造过程中的化学反应。过多的杂质可能会干扰药物的效力,引起不良反应,甚至影响患者的安全性。因此,对奥洛他定药品的杂质进行严格的检测和控制是非常重要的。制药公司必须遵循严格的质量控制程序,以保证药品的质量和安全性。CATO标准品对奥洛他定杂质进行研究和分析,可以为改善和优化制造过程,以及提高药品质量提供有价值的信息。通过了解含有哪些杂质,及其如何形成,制药厂商可以改进其生产过程,以减少杂质的产生,并提高药物的纯度和效力[img=,601,547]https://ng1.17img.cn/bbsfiles/images/2024/02/202402052109512474_2064_6381668_3.png!w601x547.jpg[/img]
大家好,最近在用安捷伦7890A气相色谱仪检测奥美拉唑钠原料里面的甲醇、乙醇、丙酮、乙酸乙酯、二氯甲烷这五个残留溶剂,顶空进样,顶空瓶温度60℃,程序升温:35℃保持10min,再以40℃/min的速率升温至200℃,DB-624毛细管柱。进样以后,发现定位(单个溶剂进样)都能出峰,但是混合之后(作对照)就少了一个峰,有可能是乙醇和甲醇峰这两个一个中的一个没有出来。试了很多种方法包括降低氮气流速、第二阶程序升温、降低分流比、增大顶空样品瓶平衡温度等方式,走了一个流程下来还是不出,小女子百思不得其解了,请教各位大神还有可能是哪方面的问题,怎么解决?我的qq是1071505965,希望大家不吝赐教啦
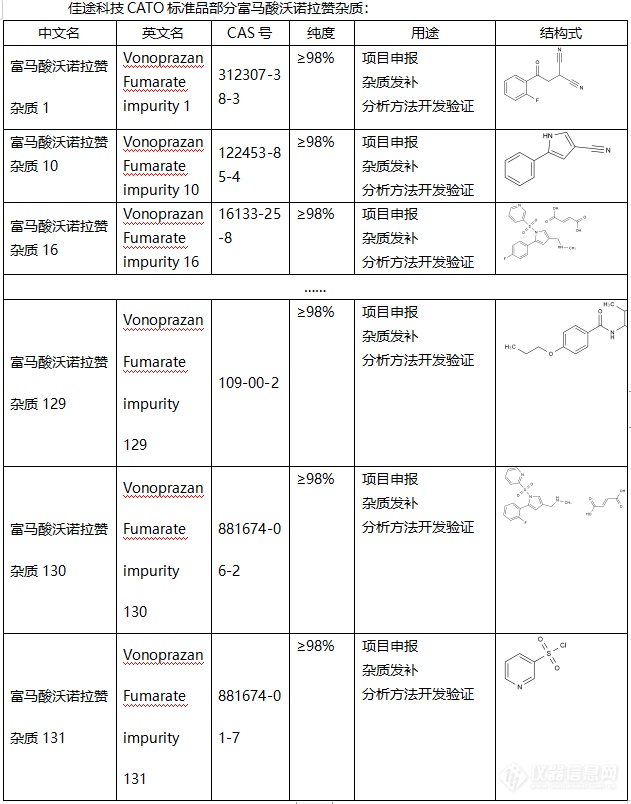
◇关于[font=UICTFontTextStyleBody]富马酸沃诺拉赞杂质[/font][font=UICTFontTextStyleBody][/font] 富马酸沃诺拉赞是一种抑酸的药物,又称为钾离子竞争性酸阻滞剂,通过[font=.pingfang sc]竞争性的阻断[/font]H+,K+-ATP酶(质子泵)K+结合位点,抑制了K+对H+,K+-ATP酶(质子泵)的结合作用,从而达到抑制了胃酸分泌的效果,除此之外还可以抑制胃肠道上部黏膜损伤的形成,在临床上可以治疗反流性食管炎。富马酸沃诺拉赞与普通抑制胃酸的药物,例如剂奥美拉唑、兰索拉唑等相比较,本品因为无需肠溶包衣,所以奇效更快,效果时间也更长。 [font=UICTFontTextStyleBody]CATO[/font]标准品提供的[font=UICTFontTextStyleBody]富马酸沃诺拉赞杂质[/font],可以治疗胃溃疡、十二指肠溃疡等疾病。[font=UICTFontTextStyleBody][font=.pingfang sc] [/font][/font][img=,631,804]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021602111695_2371_6381607_3.png!w631x804.jpg[/img][font=UICTFontTextStyleBody] [/font]
如题,俺第一次测盐酸左氧氟沙星,做有关物质时杂质A与左氧保留时间完全重叠,排除了乙酸铵、高氯酸钠等试剂滴原因,实在没辙咧,请教大虾帮忙。盐酸左氧氟沙星有关物质测定方法(来源:中国药典2010年版第一增补本): 有关物质 取本品,精密称定,加0.lmol/L盐酸溶液溶解并定量稀释制成每1ml中约含1.2mg的溶液,作为供试品溶液,精密量取适量,用0.1mol/L盐酸溶液定量稀释制成每1ml中含2.4ug的溶液,作为对照溶液。另精密称取杂质A对照品约18mg,置100ml量瓶中,加6mol/L氨溶液1ml与水适量使溶解,用水稀释至刻度,摇匀,精密量取2ml,置100ml量瓶中,用水稀释至刻度,摇匀,作为杂质A对照品溶液。照高效液相色谱法(附录V D)测定,用十八烷基硅烷键合硅胶为填充剂;以醋酸铵高氯酸钠溶液(取醋酸铵4.0g和高氯酸钠7.0g,加水1300ml使溶解,用磷酸调节pH值至2.2)-乙腈(85 :15)为流动相A,乙腈为流动相B;按下表进行线性梯度洗脱。柱温为40°C;流速为每分钟1ml。称取左氧氟沙星对照品、环丙沙星对照品和杂质E对照品各适量,加0.1mol/L盐酸溶液溶解并稀释制成每1ml中约含左氧氟沙星1.2mg、环丙沙星和杂质E各6ug的混合溶液,取10ul注人液相色谱仪,以294nm为检测波长,记录色谱图,左氧氟沙星峰的保留时间约为15分钟。左氧氟沙星峰与杂质E峰和左氧氟沙星峰与环丙沙星峰的分离度应分别大于2.0与2.5。量取对照溶液10ul注人液相色谱仪,以294mn为检测波长,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%。精密量取供试品溶液、对照溶液和杂质A对照品溶液各10ul,分别注人液相色谱仪,以294nm和238nm为检测波长,记录色谱图。供试品溶液色谱图中如有杂质峰,杂质A(238nm检测)按外标法以峰面积计算,不得过0.3%。其他单个杂质(294nm检测)峰面积不得大于对照溶液主峰面积(0.2%),其他各杂质(294nm检测)峰面积的和不得大于对照溶液主峰面积的2.5倍(0.5%)。供试品溶液色谱图中任何小于对照溶液主峰面积0.1倍的峰可忽略不计。时间(分钟) 流动相A(%) 流动相B(%) 0 100 0 18 100 0 25 70 30 39 70 30 40 100 0 50 100 0
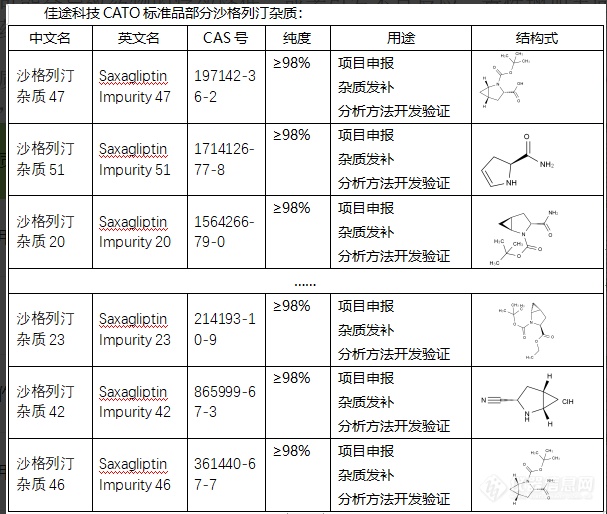
沙格列汀杂质可能是由制药过程中的化学反应产生,也可能是原料中的不纯物。当杂质的总量超过了允许的范围,可能会对药品的质量、安全性和疗效产生影响。例如,部分杂质可能会导致药物的疗效降低,或者引发不良反应、毒性增加等问题。因此,对于沙格列汀这类药物,对其杂质进行严格的检测和控制是保证药品质量的重要环节。只有将杂质控制在安全的范围内,才能保证药物的有效性和安全性。CATO标准品对沙格列汀杂质的研究也能帮助优化制药流程,找出产生过多杂质的环节,从而改进工艺,提高药品的质量和疗效。沙格列汀杂质可能是由制药过程中的化学反应产生,也可能是原料中的不纯物。[img=,607,514]https://ng1.17img.cn/bbsfiles/images/2024/02/202402052059405101_6177_6381668_3.png!w607x514.jpg[/img]
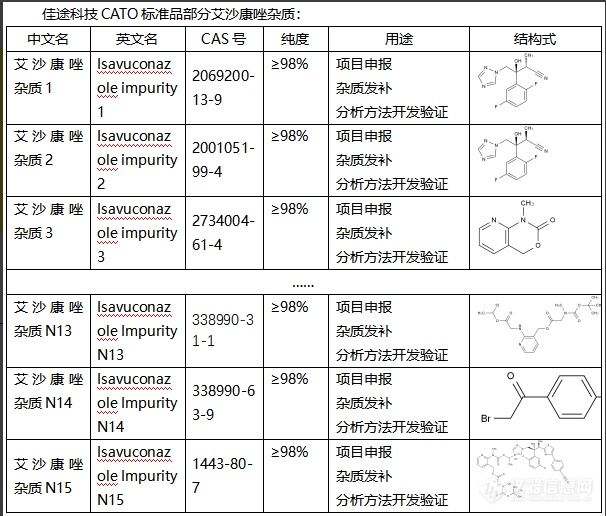
艾沙康唑是一种广谛抗真菌药,用于治疗各种真菌感染。然而,任何药物的生产过程中都可能会有杂质产生。艾沙康唑杂质的作用主要取决于杂质的性质。一些杂质可能无害,而一些杂质可能有害。有害的杂质可能会干扰艾沙康唑的抗真菌效果,增加药物的毒性,或引起不良反应。因此,药物生产中对杂质的控制是非常重要的。药品工艺需要设计成尽可能减少杂质的生成,并需要检测和控制杂质的含量,以确保药物的质量和安全。在药品注册时,也需要提交关于杂质的详细信息和控制策略。总的来说,艾沙康唑杂质对于药物的质量、疗效和安全性等都有重要影响,CATO标准品在药品的研发和生产过程中给予了足够的关注和控制。[img=,606,516]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021705445515_9017_6381668_3.png!w606x516.jpg[/img]
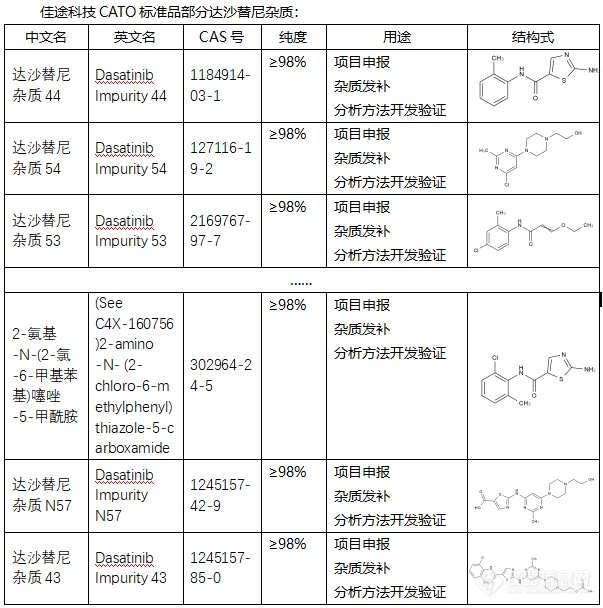
[font=宋体]◇达沙替尼[/font][font=宋体]杂质[/font][font=宋体] 达沙替尼[/font][font=宋体],[/font][font=宋体]其英文名为[/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]Dasatinib[/back][/color][/font][font=宋体][color=#05073b][back=#fdfdfe],)是一种创新的第二代双重酪氨酸激酶抑制剂(TKI),也被称作DASA锡IB或商品名SPRYCEL(施达赛)。[/back][/color][/font][font=宋体]达沙替尼[/font][font=宋体][font=宋体]杂质过抑制[/font][font=Calibri]BCR-ABL[/font][font=宋体]蛋白的活性来发挥治疗作用。达沙替尼能够与[/font][font=Calibri]BCR-ABL[/font][font=宋体]蛋白结合并抑制其激酶活性,从而阻断白细胞的异常增殖,并促进正常白细胞的生成。[/font][/font][font=宋体][font=Calibri] CATO[/font][font=宋体]标准品提供的达沙替尼杂质用途主要是用于分析化学物质和质量控制的化学物质。[img=,603,608]https://ng1.17img.cn/bbsfiles/images/2024/02/202402062123365450_9441_6381607_3.png!w603x608.jpg[/img][/font][/font][font=宋体][font=宋体] 广州佳途科技股份有限公司,[/font][font=Calibri]CATO[/font][font=宋体]标准品厂家,提供达沙替尼全套[/font][/font][font=宋体]的[/font][font=宋体]杂质,通过全面的检测、高效的沟通、专业的服务和完善的售后,确保所有产品均能现货供应[/font][font=宋体],[/font][font=宋体]致力于为客户提供高质量的产品和优质的服务,以满足客户在药物研发和质量控制方面的需求。[/font]

[font=宋体]莫西沙星是一种广谱的抗生素,被广泛用于治疗很多种的细菌感染。莫西沙星杂质会影响到药物的安全性和有效性。[/font][font=宋体][/font][font=宋体][/font][font=宋体]1. 影响药物的安全性:如果莫西沙星中的杂质过多或是有毒性较高的杂质,可能会导致药品的毒副作用增加,影响到药品的安全应用。[/font][font=宋体][/font][font=宋体][/font][font=宋体]2. 影响药物的有效性:有一些杂质可能会与莫西沙星发生化学反应,改变其化学结构,从而降低其抗菌活性,影响治疗效果。[/font][font=宋体][/font][font=宋体][/font][font=宋体]3. 影响药物的稳定性:某些杂质可能会影响莫西沙星的稳定性,导致药物质量的降低。[/font][font=宋体][/font][font=宋体][/font][font=宋体]因此,对莫西沙星的杂质进行控制是非常重要的,相关监管部门也对其中的含量有着严格的标准。[/font][font=宋体][font=Calibri]CATO[/font][font=宋体]标准品[/font][/font][font=宋体]在药品的生产过程中,对杂质进行定期的检测和控制,以确保药品的质量。[img=,600,610]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021649392583_1508_6381668_3.png!w600x610.jpg[/img][/font]
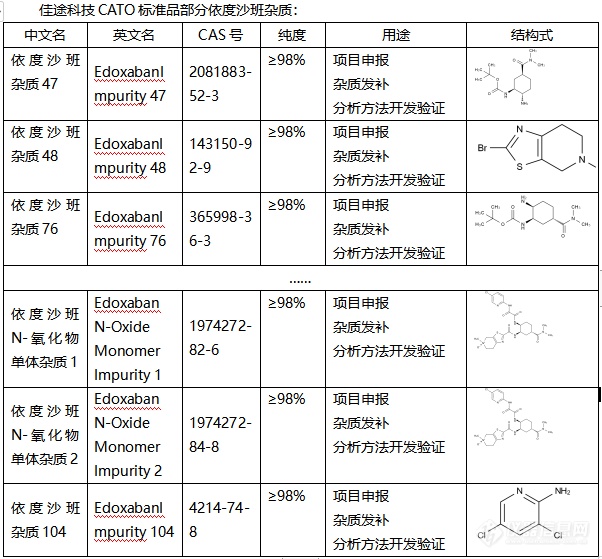
依度沙班,作为一种抗凝药物,被广泛应用于预防和治疗血栓形成。然而,与其他药物一样,依度沙班在生产过程中也可能产生杂质。这些杂质的存在可能会影响药物的安全性和有效性。为了确保依度沙班的质量,科学家们引入了CATO标准进行杂质分析。CATO标准是一种先进的分析方法,可以帮助研究人员准确地检测和衡量依度沙班中的杂质。通过对比和分析,我们可以清楚地了解杂质的种类、数量以及可能对药物产生的影响。这一标准的应用,不仅提高了依度沙班的生产质量,也为我们提供了一种有效的质量控制手段。在实际应用中,CATO标准品发挥着重要的作用。首先,它能够准确鉴定和量化依度沙班中的杂质,为药物的质量控制提供科学依据。其次,通过与标准品的比对分析,研究人员可以深入了解杂质的来源和性质,从而优化生产工艺,降低杂质的产生。此外,CATO标准品还可以用于评估杂质的毒性和风险,为药物的安全性评价提供有力支持。随着研究的深入,CATO标准在依度沙班杂质分析中的应用将不断优化和完善。通过科学的分析和严格的控制,我们能够确保依度沙班的安全性和有效性,为患者的健康提供更好的保障。同时,这也将推动药物生产的科技进步,造福更多患者。[img=,602,559]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021907159831_6894_6381568_3.png!w602x559.jpg[/img]广州佳途科技股份有限公司是一家专业的CATO标准品生产厂家,目前公司库存有全套乐伐替尼杂质,能够提供相应的系列图谱和产品COA证书,并且支持买家溯源。
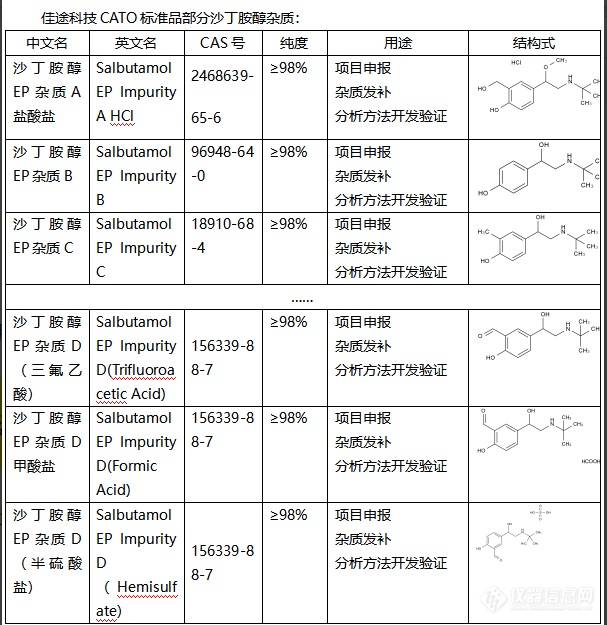
沙丁胺醇是一种药物,主要用于治疗哮喘和慢性阻塞性肺病等呼吸系统疾病。在药品制备过程中,可能会产生一些不同结构的化合物,这些化合物就被称为杂质。杂质可能会对药品的品质、安全性、效力和稳定性等产生影响。根据产生的差异,杂质的作用可以具体表现如下:1. 影响药品的稳定性:杂质可能导致药品在贮存过程中发生化学变化,从而影响药品的稳定性。2. 影响药品的安全性:如果杂质对人体有毒性,那么杂质的存在可能降低药品的安全性。3. 影响药品的效力:杂质可能与药品的有效成分发生竞争,导致药品的效力降低。4. 影响药品的品质:杂质可能改变药品的外观、颜色、溶解性等物理性质,影响药品的品质。CATO标准品制药行业对药品的杂质进行严格控制,保障药品的质量和患者的用药安全。[img=,607,625]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021631332927_8650_6381668_3.png!w607x625.jpg[/img]
本人初用ICP,请教各位专家:为什么我用ICP测高纯石英砂中的杂质元素时铁、钙、镁的值总是会低于试剂空白值?大家有没有人用ICP检测高纯石英砂啊?为什么有时我做ICP的标曲时空白很大,做的曲线乱乱的,而有时却又很好~~ 我们的ICP是安捷伦700-ES,请问这台仪器的稳定性怎么样?会不会受环境湿度的影响啊?
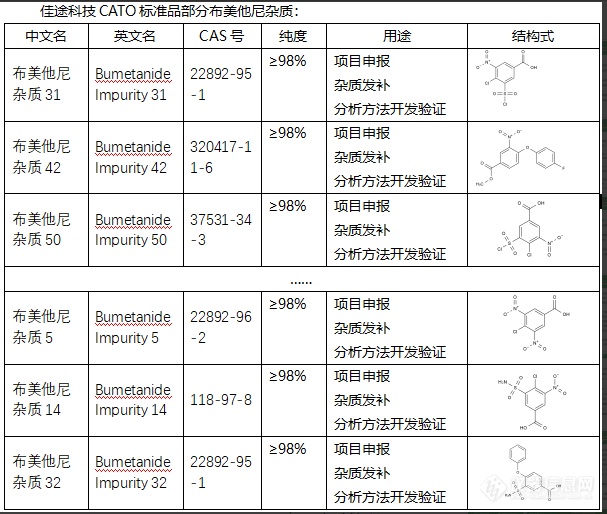
布美他尼杂质是药物布美他尼制剂中可能存在的杂质,这些杂质可能来源于原料药的生产过程、制剂的准备过程或者储存过程。1. 影响药效:药物中含有过多的杂质可能会影响药物的药效,产生药效不稳定、药效降低等问题。2. 影响安全性:部分杂质可能具有潜在的毒性,长期或高剂量使用可能对人体造成伤害。严重情况下可能出现药品不良反应甚至中毒。3. 影响药物的稳定性:不同类型的杂质结构,可能影响药物的稳定性,例如酸性或碱性杂质可能引起药物分解,导致药效降低或失效。4. 影响药物的外观质量:杂质可能会影响药物的外观性状,如颜色、透明度和溶解性等。因此,确定和控制药物中的杂质是药品质量控制的重要环节。CATO标准品对于药物杂质的研究,主要包括杂质的来源、形成机理、控制策略和杂质的鉴定、定量测定等内容。[img=,607,514]https://ng1.17img.cn/bbsfiles/images/2024/02/202402041444015575_2473_6381668_3.png!w607x514.jpg[/img]
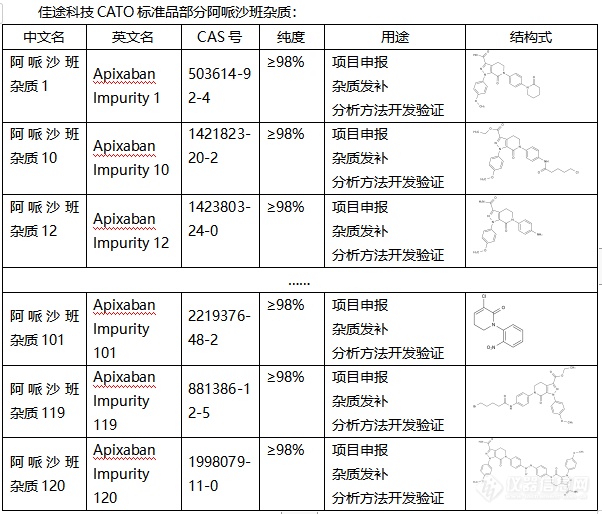
◇关于阿哌沙班杂质 阿哌沙班杂质是用于髋关节或膝关节择期置换术的成年患者,预防静脉血栓栓塞的杂质,阿哌沙班是一种结构新颖的中性双环吡唑,分子量为459.5 g/mol,水溶性为 40–50 μg/mL,Caco-2细胞渗透率为0.9?×?10?6 cm/s。阿哌沙班是通过抑制凝血因子Xa来发挥抗凝作用,阿哌沙班杂质的吸收主要发生在小肠。与其它的杂质相比,阿哌沙班杂质疗效更好,安全性更高。[font=UICTFontTextStyleBody]CATO[/font]标准品提供的[font=宋体]阿哌沙班杂质[/font][font=宋体],是抗凝[/font][font=宋体][font=宋体]剂领域的[/font]“领头羊”[/font][font=宋体]。[img=,602,514]https://ng1.17img.cn/bbsfiles/images/2024/02/202402040843332660_3775_6381607_3.png!w602x514.jpg[/img][/font]
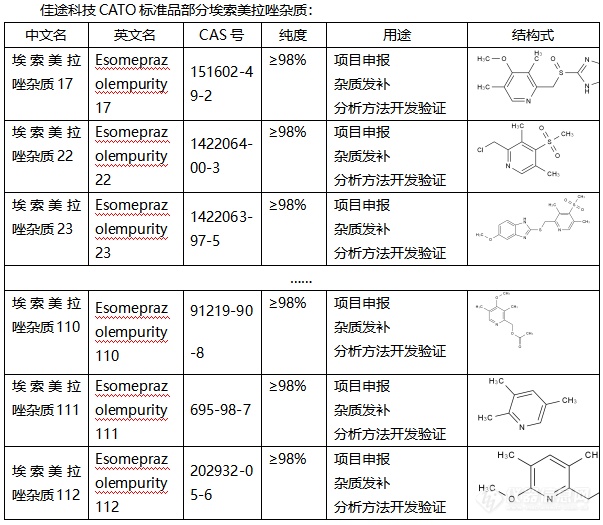
◇关于埃索美拉唑杂质 埃索美拉唑杂质是一种质子泵抑制剂,它不仅是[font=UICTFontTextStyleBody]治疗胃食管反流性杂质,还可以防止胃酸形成,[/font]它的原理主要是通过抑制胃壁细胞中[font=.pingfang sc]的[/font]H+/K+-ATP酶来达到减少胃酸分泌。埃索美拉唑杂质是一种高效且广泛应用于胃酸相关疾病治疗的质子泵抑制剂,通过抑制质子泵的活性,它不仅可以减少胃酸的分泌,还可以帮助溃疡的愈合。其作用机理是通过与胃腺细胞内的质子泵结合,形成稳定的复合物来发挥作用。[font=UICTFontTextStyleBody] [/font][font=UICTFontTextStyleBody]CATO[/font]标准品提供的[font=宋体]埃索美拉唑杂质[/font][font=宋体],在治疗肠胃道疾病中发挥着重要的作用,并且有针对性的抗菌作用。[img=,603,525]https://ng1.17img.cn/bbsfiles/images/2024/02/202402040930531289_1324_6381607_3.png!w603x525.jpg[/img] [/font]
高纯石英沙99.996%以上的样品,如何检测杂质含量,如Fe、Cu、mg、Ni、Na、Co等元素