
键和金刚烷基团的ADME色谱柱对于极性化合物能得到良好的保留与分离,对于代谢产物的分析具有优势。如LC Café espresso No.2016005所述,从疏水性及表面极性参数可以对其具有特长的溶出行为进行说明。本次实验以极性化合物别嘌呤醇与黄嘌呤氧化酶反应生成的代谢物别嘌呤二醇,嘌呤体代谢产生的次黄嘌呤、黄嘌呤以及尿酸作为样品(参照图1),分别使用CAPCELL PAK ADME、CAPCELL PAK C18 AQ、CAPCELL PAKC18 MGII以及3种他社杂化型ODS色谱柱(粒径均为5 μm)进行分析,对各色谱柱的溶出行为进行了比较。http://ng1.17img.cn/bbsfiles/images/2016/07/201607210842_601338_2222981_3.jpg分析所得色谱图见图2。分析所用HPLC条件如下:http://ng1.17img.cn/bbsfiles/images/2016/07/201607210842_601339_2222981_3.jpghttp://ng1.17img.cn/bbsfiles/images/2016/07/201607210842_601340_2222981_3.jpg如图2,各化合物的保留随着各色谱图右侧所示色谱柱表面极性的增加而增强。其中,只有键和金刚烷基团的CAPCELL PAK ADME色谱柱实现了尿酸(峰1)与次黄嘌呤(峰2)间的分离;键和C18基团的色谱柱均无法得到良好分离。进一步,在本次进行比较的色谱柱中,CAPCELL PAK ADME所得理论塔板数(别嘌呤醇:峰5)是最高的,彰显了其对极性化合物优异的分析能力。
豆浆中的腺嘌呤,鸟嘌呤,黄嘌呤,次黄嘌呤是如何产生,如何相互转化的?望老师不吝赐教
次黄嘌呤苷有腺嘌呤的结构,有共轭,为何在紫外下不显色啊?它有多个醇,如果紫外不显色,那么用何方法使其显色啊?
如题,本人想选择一款可以很好分离,成型四种嘌呤的液相色谱柱,分别是鸟嘌呤,腺嘌呤,黄嘌呤,次黄嘌呤,文献中的色谱柱是waters的Atlantic T3 流动相是0.05mol/L的磷酸二氢钾缓冲盐,不含有机相,现在我的疑问是1、waters这款柱子到底适不适合这种纯水相的条件2、waters这款色谱柱有点小贵,有没有其他品牌但是效果差不多的色谱柱呢,当然要是再贵一点,但是比这款柱子更适合的也可以希望懂的人能够给与解答,不胜感激
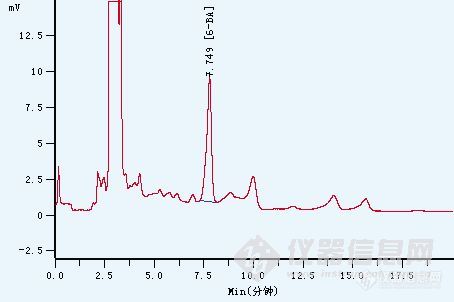
分享一个我公司实验人员优化的豆芽中的6-苄基腺嘌呤检测方法。豆芽中的6-苄基腺嘌呤检测,按照DB/11T 279-2006,北京市地方检测方法,用C18小柱富集,回收率只有40%左右,考虑到6-苄基腺嘌呤是酸性的物质,后来尝试了用CNW poly-sery MAX小柱富集,回收率可以做到80%以上。前处理方法:捣碎豆芽10g用20mL 酸化甲醇(甲醇/水=60:40,加入50μL乙酸)提取,离心,上清液旋转蒸发除去甲醇,调pH至9.0左右,待上样至固相萃取小柱。SPE固相萃取:活化:5mL 甲醇平衡:5mL 去离子水上样:流速 0.5滴/s淋洗:3mL 去离子水,3mL 20%甲醇水溶液,抽干洗脱:5mL 2%乙酸甲醇液相色谱条件:检测波长(nm): UV267nm柱型号: C18柱(4.6*250,5μm)流量(ml/min): 1.0mL/min流动相: 甲醇/1%乙酸=50/50柱温(℃): 30进样量: 20μL附上图谱(3ppm目标物)http://ng1.17img.cn/bbsfiles/images/2011/09/201109301339_320394_1776417_3.jpg
急!急!急!腺嘌呤及6-卞氨基嘌呤的测试方法
做6-苄基腺嘌呤方法验证的时候色谱柱一直平衡不好,流动相用的是甲醇+0.02mol/L乙酸铵(千分之1乙酸),基线一直是这样的,有什么解决办法吗?[img]https://ng1.17img.cn/bbsfiles/images/2021/05/202105181351571722_3426_5026084_3.png[/img]
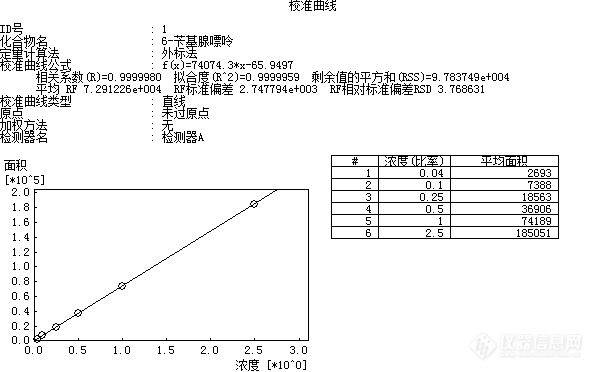
[align=center][b]食品中6-苄基腺嘌呤的测定方法验证报告[/b][/align][align=center][b]GB/T 23381-2009( 高效液相色谱法)[/b][/align][align=center][b]张霞[/b][/align]一、方法概述1.范围 本标准规定了用高效液相色谱法测定食品中6-苄基腺嘌呤(6-BA)含量的方法。 本标准适用于果蔬菜(豆芽、黄瓜、番茄、香菇、草莓、橙类)等植物性食品及其制品中6-苄基腺嘌呤的测定。2.规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方面研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T 6682 分析实验室用水规格和试验方法(GB/T 6682-2008,ISO 3696:1987,MOD)3.方法提要 试样经甲醇提取、浓缩并净化后,用高效液相色谱检测,外标法定量。二、仪器与试剂1. 仪器1.1高效液相色谱仪:配有紫外检测器或二极管阵列检测器。1.2 组织捣碎机。1.3离心机:转速不低于4000r/min。1.4超声波清洗仪。1.5旋转蒸发仪。1.6固相萃取装置。1.7电子天平:感量0.1mg。1.8微孔滤膜:0.45μm,有机相。以上仪器符合国标要求。2. 试剂及其配制 除另有规定外,所有试剂均为分析纯,水为GB/T 6682规定的一级水。2.1甲醇:色谱纯。2.2冰乙酸。2.3 C[sub]18[/sub]固相萃取柱:6mL,500mg,或相当者,使用前依次用5mL甲醇、10mL水活化。2.4乙酸铵溶液(0.02mol/L):称取1.54g乙酸铵,用适量水溶解,加入1.0mL冰乙酸,加水定容至1000mL。2.5 6-苄基腺嘌呤标准溶液(100.0μg/mL) [color=#ff0000] [/color][color=#ff0000]来源[/color][color=#ff0000]:[/color][color=#ff0000]农业部环境保护科研监测所[/color][color=#ff0000] [/color][color=#ff0000]货[/color][color=#ff0000]号[/color][color=#ff0000]:[/color][color=#ff0000]SB05-368-2016[/color][color=#ff0000] [/color]三、分析步骤1、标准曲线绘制1.1 标准工作液的配制: 分别吸取适量6-苄基腺嘌呤标准溶液,用甲醇定容至10mL容量瓶中,配制成浓度为0.04μg/mL、0.1μg/mL、0.25μg/mL、0.5μg/mL、1.0μg/mL、2.5μg/mL系列工作液。2、样品的处理2.1提取:称取经组织捣碎机捣碎的样品约10g(精确到0.01g)于50mL离心管中,加入20mL甲醇,超声提取15min,以转速不低于4000r/min离心10min,上清液转入50mL梨形瓶中,样品再次用20mL甲醇超声提取15min,离心合并上清液,用旋转蒸发仪(不超过60℃)浓缩至近干,去除甲醇,残液待净化。2.2纯化:将上述2.1残液以2mL/min流速通过预先活化的固相萃取柱,用少量水(约2mL)洗涤梨形瓶,洗液过固相萃取柱,再用5mL水洗涤固相萃取柱,去除杂质后用甲醇洗脱并定容至5.0mL,混匀后经0.45μm滤膜过滤,作为待测液供HPLC分析。3.仪器测定条件3.1色谱柱:C18柱,柱长250mm,内径4.6mm,粒径5μm或相当型号色谱柱。3.2流速:1.0mL/min。3.3柱温:30℃。3.4检测波长:267nm。3.5进样量:10μL。3.6流动相:甲醇 :0.02mol/L乙酸铵溶液=1:1四、结果处理试样6-苄基腺嘌呤含量按下式进行计算:[table][tr][td=1,2][align=center]X(mg/kg)=[/align][/td][td]C×[i]V[/i]×1000[/td][/tr][tr][td]m×1000[/td][/tr][/table]式中:X-试样中6-苄基腺嘌呤含量,单位为毫克每千克(mg/kg) C-由标准曲线计算出样液中6-苄基腺嘌呤的浓度,单位为微克每毫升(μg/mL) m-试样质量,单位为克(g) V-试样的最终定容体积,单位为毫升(mL)。1000—换算系数。计算结果保留两位有效数字。五、验证结果1.线性结果将标准系列工作溶液分别注入液相色谱仪中,测定相应的峰面积,以标准系列工作溶液的质量浓度为横坐标,以峰面积为纵坐标,绘制标准曲线。同时做空白实验。6-苄基腺嘌呤[u]Y=74074.3*X-65.9497 R^2=0.9999959[/u][align=center][img=,595,372]http://ng1.17img.cn/bbsfiles/images/2018/07/201807242033263735_9846_2904018_3.png!w595x372.jpg[/img][/align]以上结果表明6-苄基腺嘌呤在0.04μg/mL~2.5μg/mL范围内,R[sup]^2[/sup]=0.9999959,6-苄基腺嘌呤浓度和峰面积呈线性关系,线性良好,符合要求。2.检出限结果将0.25μg/mL标准溶液逐级稀释至S/N=3±1,得出6-苄基腺嘌呤的方法检出限为0.0125mg/kg[color=#ff0000],[/color]此检出限结果小于国标GB/T 23381-2009的方法检出限0.02mg/kg,故此方法满足条件。六、方法精密度(重复性)对LBF180700282样品分别进行6次加标重复性的测定,测定结果如下:[table][tr][td][align=center]测定编号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][td][align=center]6[/align][/td][/tr][tr][td][align=center]质量(g)[/align][/td][td][align=center]10.0031[/align][/td][td][align=center]10.0016[/align][/td][td][align=center]10.0025[/align][/td][td][align=center]10.0044[/align][/td][td][align=center]10.0027[/align][/td][td][align=center]10.0048[/align][/td][/tr][tr][td][align=center]浓度(μg/mL)[/align][/td][td][align=center]0.652[/align][/td][td][align=center]0.650[/align][/td][td][align=center]0.652[/align][/td][td][align=center]0.652[/align][/td][td][align=center]0.652[/align][/td][td][align=center]0.651[/align][/td][/tr][tr][td][align=center]含量(mg/kg) [/align][/td][td][align=center]0.33[/align][/td][td][align=center]0.32[/align][/td][td][align=center]0.33[/align][/td][td][align=center]0.33[/align][/td][td][align=center]0.33[/align][/td][td][align=center]0.33[/align][/td][/tr][tr][td][align=center]平均值(mg/kg)[/align][/td][td=6,1][align=center]0.33[/align][/td][/tr][tr][td][align=center]RSD%[/align][/td][td=6,1][align=center]1.24[/align][/td][/tr][/table]本方法的精密度为1.24%,符合GB/T 23381-2009中给出试样测试结果的精密度要求。因此,本次测定均符合要求。七、准确度验证(加标回收)对LBF180700282样品加标,取2.5μg/mL的标液0.09mL、0.35mL、0.64mL同样品同步处理后,结果见下表:[table][tr][td=2,1][align=center]测定编号[/align][/td][td=6,1][align=center]6-苄基腺嘌呤[/align][/td][/tr][tr][td][align=center]序号[/align][/td][td][align=center]m(g)[/align][/td][td][align=center]V(mL)[/align][/td][td][align=center]C(μg/mL)[/align][/td][td][align=center]6-苄基腺嘌呤含量(mg/kg)[/align][/td][td][align=center]平均值(mg/kg)[/align][/td][td][align=center]加标量(mg/kg)[/align][/td][td][align=center]回收率%[/align][/td][/tr][tr][td][align=center]1#[/align][/td][td][align=center]10.0236[/align][/td][td][align=center]5.0[/align][/td][td][align=center]N.D[/align][/td][td][align=center]N.D[/align][/td][td=1,2][align=center]N.D[/align][/td][td][align=center]/[/align][/td][td][align=center]/[/align][/td][/tr][tr][td][align=center]2#[/align][/td][td][align=center]10.0157[/align][/td][td][align=center]5.0[/align][/td][td][align=center]N.D[/align][/td][td][align=center]N.D[/align][/td][td][align=center]/[/align][/td][td][align=center]/[/align][/td][/tr][tr][td][align=center]加标1#[/align][/td][td][align=center]10.0087[/align][/td][td][align=center]5.0[/align][/td][td][align=center]0.042[/align][/td][td][align=center]0.021[/align][/td][td][align=center]0.021[/align][/td][td][align=center]0.022[/align][/td][td][align=center]95.5[/align][/td][/tr][tr][td][align=center]加标2#[/align][/td][td][align=center]10.0103[/align][/td][td][align=center]5.0[/align][/td][td][align=center]0.163[/align][/td][td][align=center]0.081[/align][/td][td][align=center]0.081[/align][/td][td][align=center]0.087[/align][/td][td][align=center]93.1[/align][/td][/tr][tr][td][align=center]加标3#[/align][/td][td][align=center]10.0189[/align][/td][td][align=center]5.0[/align][/td][td][align=center]0.307[/align][/td][td][align=center]0.15[/align][/td][td][align=center]0.15[/align][/td][td][align=center]0.16[/align][/td][td][align=center]93.8[/align][/td][/tr][/table] 由上表可以看出6-苄基腺嘌呤测定的加标回收范围在 60%-120% ,RSD值为1.31%符合规定要求。八、总结从检出限、线性范围、重复性、回收率测试结果可知,均符合方法要求,本实验方法符合GB/T 23381-2009的要求。[img=,595,372]http://ng1.17img.cn/bbsfiles/images/2018/07/201807242033072325_3650_2904018_3.png!w595x372.jpg[/img][img=,595,372]http://ng1.17img.cn/bbsfiles/images/2018/07/201807242033072325_3650_2904018_3.png!w595x372.jpg[/img][img=,595,372]http://ng1.17img.cn/bbsfiles/images/2018/07/201807242033072325_3650_2904018_3.png!w595x372.jpg[/img]
蔬菜的嘌呤含量与动物内脏、海鲜、肉汤等动物蔬菜的嘌呤含量与动物内脏、海鲜、肉汤等动物性食物相比,总体来说确实要低一些,但扁豆、芦笋、紫菜、豆苗等嘌呤含量相对较高,痛风急性发作期患者也要尽量避免吃,缓解期减少进食次数和进食量。性食物相比,总体来说确实要低一些,但扁豆、芦笋、紫菜、豆苗等嘌呤含量相对较高,痛风急性发作期患者也要尽量避免吃,缓解期减少进食次数和进食量。
本人最近在做关于腺嘌呤去氨基反应,到网上查找到重氮反应可以去氨基,但是做了几次都比较失败,所用的是在腺嘌呤中加入盐酸和亚硝酸钠,在0度左右进行反应,结果是腺嘌呤并没有太大变化,请问有做过腺嘌呤如何去氨基的吗,或者还有什么别的方法能去掉环上的氨基?
尿酸高的人建议选择低嘌呤的食材,同时在烹饪上要注意。嘌呤是水溶性分子,煮和焯等烹饪方法可以减少食物中约30%~40%嘌呤含量,肉、禽类煮后弃汁也可降低嘌呤含量。可以减少食物中约30%~40%嘌呤含量,肉、禽类煮后弃汁也可降低嘌呤含量。
看到一些食品中含有多少多少的嘌呤,想知道嘌呤是怎么检测的?哪里可以测啊?或者有没有相关标准?谢谢!
我想做嘌呤的纸色谱,就是不太知道能与嘌呤成色的络合物,求助有谁知道能与嘌呤形成络合物的物质都有什么呢
[align=center][b][/b][/align][align=center][b][b]“嘌呤大户”被揪出!这4种食物才是痛风的祸源,再喜欢也别碰[/b][/b][/align]根据2021年数据显示,我国患有痛风这种疾病的人有1.466万人,超过了一千万人,而在这部分人群里,男性人群居多。随着人们生活方式和习惯的改变,更多人患上了痛风这种疾病,而很多人患痛风都是因为吃了大量的含有高嘌呤的食物。之但是如果患者的血尿酸水平居高不下,是不太建议食用含有嘌呤的食物的。所以,如果血尿酸水平比较高的时候,豆制品还是不吃比较好。如果已经患有痛风的人群,应该尽量不要食用含有高嘌呤的食物,以下4种食物,痛风患者不可食用。[align=center][b][b][font=宋体][color=#333333]第一种:啤酒[/color][/font][/b][/b][/align][color=#333333]有的人很喜欢喝酒,开心或者悲伤的时候,都喜欢喝一些酒来释放情绪,但是长期喝酒或者食用含有酒精类的食物,很容易引起痛风的发生。很多人觉得啤酒度数不高,喝点啤酒应该是没事的,如果这样想的话就大错特错了。啤酒是含有嘌呤比较高的饮品,饮用的话很容易引起血尿酸水平的升高,从而导致痛风的发生,或者加重痛风的病情,而如果痛风发作,还会增加患有其他疾病像是高血压,糖尿病的风险。所以,日常生活中,我们尽量少饮酒,痛风患者坚决不要喝啤酒,可以喝一些白开水或者其他不含或者含有嘌呤比较低的饮品来替代。[/color][b][font=宋体][color=#333333]第二种:动物内脏[/color][/font][/b][color=#333333]正常人吃了动物内脏对于身体不会造成什么不好的影响,但是痛风患者不能食用动物的内脏。因为动物内脏也是一种高嘌呤的食物,吃动物内脏会使得身体代谢紊乱,血尿酸水平升高,从而导致病情的加重。[/color][b][font=宋体][color=#333333]第三种:海鲜[/color][/font][/b][color=#333333]海鲜也是一种含有嘌呤比较高的食物,食用太多很容易诱发痛风。[/color][color=#333333]有些人在食用海鲜的时候,常常会搭配啤酒一起食用,这样食物中的嘌呤含量就更高了,如果是患有痛风的话,很容易对身体造成影响。[/color][color=#333333]所以,痛风患者像是生蚝、虾、螃蟹等等海鲜也是最好不要吃的,以免病情加重,出现身体不适。[/color][b][font=宋体][color=#333333]第四种:含糖饮料[/color][/font][/b][color=#333333]含糖饮料一般都会加入果糖来使饮料的口感更好,但是果糖在体内代谢之后会产生尿酸。[/color][color=#333333]而且还会导致尿酸的排泄的减少,长期喝果糖饮料,很容易患上痛风,而这种饮料也会加重痛风的症状,所以,日常生活中,不建议痛风患者饮用。以上就是我们关于四种嘌呤含量比较高会导致痛风的食物的介绍了,如果已经患有痛风,这些食物是都不建议食用的。[/color][color=#333333]同时,在日常生活中,痛风患者除了应该控制进食高嘌呤的食物之外,还应该注意饮食的搭配,适当地进行体育锻炼,劳逸结合,坚持进行药物的治疗,控制病情的发展。[/color]随着人们生活方式和习惯的改变,更多人患上了痛风这种疾病,而很多人患痛风都是因为吃了大量的含有高嘌呤的食物。[align=center][img]https://p0.ssl.img.360kuai.com/t01684c2d17b385a134.webp[/img][/align]根据2021年数据显示,我国患有痛风这种疾病的人有1.466万人,超过了一千万人,而在这部分人群里,男性人群居多。随着人们生活方式和习惯的改变,更多人患上了痛风这种疾病,而很多人患痛风都是因为吃了大量的含有高嘌呤的食物。之前有人说吃“豆制品”会导致痛风症状的加重,但其实虽然豆制品里边确实含有嘌呤,但是所含的并不多。[align=center]根据2021年数据显示,我国患有痛风这种疾病的人有1.466万人,超过了一千万人,而在这部分人群里,男性人群居多。[/align]随着人们生活方式和习惯的改变,更多人患上了痛风这种疾病,而很多人患痛风都是因为吃了大量的含有高嘌呤的食物。之前有人说吃“豆制品”会导致痛风症状的加重,但其实虽然豆制品里边确实含有嘌呤,但是所含的并不多。[img]https://p0.ssl.img.360kuai.com/t01cb0d14d26c0d7a6e.webp[/img]所以,如果患者的血尿酸水平比较稳定,少量地食用一些豆制品并不会对身体造成影响。但是如果患者的血尿酸水平居高不下,是不太建议食用含有嘌呤的食物的。所以,如果血尿酸水平比较高的时候,豆制品还是不吃比较好。如果已经患有痛风的人群,应该尽量不要食用含有高嘌呤的食物,以下4种食物,痛风患者不可食用。
6苄基腺嘌呤为什么常温保存?望老师不吝赐教
高嘌呤食物有哪些
黄嘌呤氧化酶(xanthine oxidase,XOD),可选择性催化氧化黄嘌呤和次黄嘌呤生成尿酸。有没有做过该酶传感器和对该酶性质了解的朋友?这种酶传感器似乎比较难做?因为:1. XOD活力小,0.67U/mg。2.检测对象次黄嘌呤在水中溶解度小,一般只能配到10^(-4)M级。所以电流响应始终做不出来。相同的方法换成葡萄糖氧化酶效果要好的多。大家多给意见。
如题,鸟嘌呤中氯化铵的残留应该怎么做呢?
糠氨基嘌呤的含量一般是怎么测定的?哪里可以测这个呢?
求助:2-氯腺嘌呤的HPLC方法,先谢谢了!!
本人没有做过有关腺嘌呤方面的分析,厂家的质检报告是国标,请多多帮助
请麻烦告诉一下2,6-二氨基嘌呤有关物质的HPLC检测条件,谢谢!
尿酸高也能吃的低嘌呤食物
求助:2-氯腺嘌呤的含量测定方法,谢谢!
控尿酸,要限制高嘌呤食物,比如动物内脏、海鲜、紫菜、啤酒;多喝水,每天至少喝1500毫升;还要坚持运动,控好体重。
国家重申生产者不得在豆芽生产过程中使用6-苄基腺嘌呤、4-氯苯氧乙酸钠、赤霉素等物质,豆芽经营者不得经营含有6-苄基腺嘌呤、4-氯苯氧乙酸钠、赤霉素等物质的豆芽。大家有豆芽中6-苄基腺嘌呤、4-氯苯氧乙酸钠、赤霉素同时检测方法吗?
请教2-氯腺嘌呤的溶解度及HPLC分析方法,谢谢!
6-苄基腺嘌呤在被豆芽吸收后会转化成什么物质?有没有对这个植物生长激素有研究的版友指导一下?我的困惑其实是作为检测工作来说,6-苄基腺嘌呤在豆芽样品中残留量会不会随着时间的推移,检出量会不会发生变化?
前两天碰到一位老邻居走路很困难,说是得了痛风。问他是不是啤酒喝得太多了?他说是豆浆喝多了所致。有没有办法去除豆制品中的嘌呤、草酸之害呢?
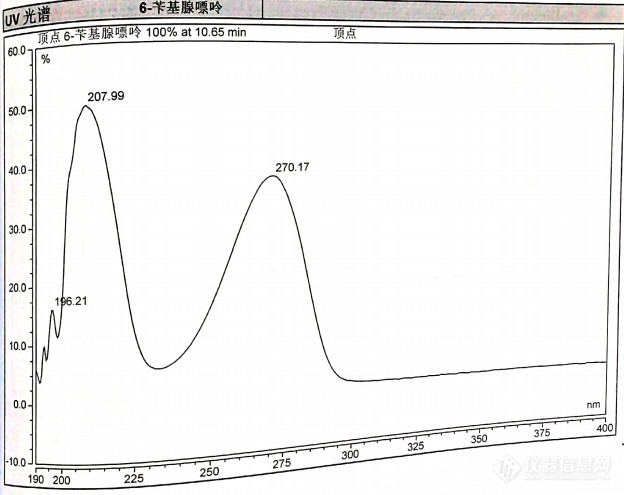
[font=宋体][size=14pt]GBT 23381-2009[/size][/font][font=宋体][size=14pt]液相色谱法检测豆芽中的[/size][/font][font=Times New Roman][size=14pt]6-[/size][/font][font=宋体][size=14pt]苄基腺嘌呤[/size][/font][font=宋体][size=14pt][font='Times New Roman']6-苄氨基嘌呤[/font][font='Times New Roman']([/font][font='Times New Roman']6-BA[/font][font='Times New Roman'])是一种人工合成的细胞分裂素,与植物内源激素具有相似的结构和性质,能够抑制植物叶内叶绿素、[/font][font='Times New Roman']核酸和蛋白质分解,广泛用作[/font][font='Times New Roman']无根豆芽[/font][font='Times New Roman']的生长调节剂。它是一种能使豆芽细胞快速分裂的激素类农药,同氮肥一样对人体都有致癌、致畸的作用。超量摄入激素类药品后,会对人体产生一定的危害,如使儿童发育早熟、女性生理发生改变、老年人骨质疏松等等。即使有些危害不会在短时间内出现,但是长久沉积必然会给健康带来不利影响。[/font][/size][/font][font=宋体][size=14pt][font=宋体]试剂:[/font][/size][/font][font='Times New Roman'][size=14pt][size=10.5000pt]0.02 mol/L醋酸铵水[/size][/size][/font][font=宋体][size=14pt][size=10.5000pt](0.1%乙酸)[/size][/size][/font][font='Times New Roman'][size=14pt][size=10.5000pt]:[/size][/size][/font][font=宋体][size=14pt][size=10.5000pt]1.0 L超纯水中加入1.54 g醋[/size][/size][/font][font='Times New Roman'][size=14pt][size=10.5000pt]酸[/size][/size][/font][font=宋体][size=14pt][size=10.5000pt]铵和1.0 mL冰醋酸,混匀超声[/size][/size][/font][font='Times New Roman'][size=14pt][size=10.5000pt],过0.45[/size][/size][/font][font='Times New Roman'][size=14pt][size=10.5000pt]μm滤膜备用[/size][/size][/font][font=宋体][size=14pt][size=10.5000pt];[/size][/size][/font][font=宋体][size=14pt][font='Times New Roman']2[/font][font=宋体].5[/font][font='Times New Roman']%甲酸[/font][font=宋体]水[/font][font='Times New Roman']:[/font][font=宋体]2.5 [/font][font='Times New Roman']mL甲酸加入[/font][font=宋体]水中[/font][font='Times New Roman'],定容[/font][font=宋体]至1[/font][font='Times New Roman']00[/font][font='Times New Roman']mL[/font][font=宋体];[/font][font=宋体]20[/font][font='Times New Roman']%氨水甲醇:[/font][font=宋体]20[/font][font='Times New Roman']mL氨水加入甲醇定容[/font][font=宋体]至[/font][font='Times New Roman']100[/font][font='Times New Roman']mL[/font][font=宋体];[/font][font=宋体]20%甲醇水:[/font][font='Times New Roman']量取[/font][font=宋体]20 [/font][font='Times New Roman']mL[/font][font=宋体]甲醇[/font][font='Times New Roman']、纯水定容[/font][font=宋体]至[/font][font='Times New Roman']100[/font][font='Times New Roman']mL,混匀备用[/font][font=宋体];[/font][font='Times New Roman']混合型阳离子交换柱;60[/font][font='Times New Roman']mg[/font][font=宋体],[/font][font='Times New Roman']3[/font][font='Times New Roman']mL,使用前分别用3[/font][font='Times New Roman']mL甲醇、3[/font][font='Times New Roman']mL[/font][font=宋体] 2.5%甲酸[/font][font='Times New Roman']水活化[/font][font=宋体];[/font][font='Times New Roman'] 方法原理[/font][font='Times New Roman']6-苄氨基嘌呤[/font][font=宋体]:[/font][font='Times New Roman']豆芽样品经粉碎后在酸化的乙腈水溶液提取条件下提取效率高、能消除干扰。高效液相色谱测定,紫外[/font][font='Times New Roman']检测器检测,以保留时间定性,峰面积或峰高定量。[/font][font='Times New Roman']前处理条件[/font][font='Times New Roman']称[/font][font=宋体]取[/font][font='Times New Roman']样品[/font][font=宋体]10[/font][font='Times New Roman'].0[/font][font='Times New Roman']g[/font][font=宋体]至50 [/font][font='Times New Roman']m[/font][font=宋体]L[/font][font='Times New Roman']离心管, 加入[/font][font=宋体]20 [/font][font='Times New Roman']mL[/font][font=宋体]甲醇,超声提取15 min[/font][font='Times New Roman'],4000[/font][font='Times New Roman']r/min 离心[/font][font=宋体]5[/font][font='Times New Roman']分钟,上清夜[/font][font=宋体]转移至1[/font][font='Times New Roman']50[/font][font='Times New Roman']m[/font][font=宋体]L鸡心瓶中,再[/font][font='Times New Roman']加入20[/font][font='Times New Roman']m[/font][font=宋体]L甲醇[/font][font='Times New Roman'],[/font][font=宋体]超声提取15 min,[/font][font='Times New Roman']4000[/font][font='Times New Roman']r/min 离心5分钟,[/font][font=宋体]合并上清液,用旋转蒸发仪40℃减压[/font][font='Times New Roman']浓缩[/font][font=宋体](水浴温度不得超过60℃) ,除尽甲醇。残液中加入3滴6 mol/L HCl(残液体积不足2mL时,加入3 mL [/font][font='Times New Roman']2[/font][font=宋体].5[/font][font='Times New Roman']%甲酸[/font][font=宋体]水),涡旋,高速离心,[/font][font='Times New Roman']上清液过用[/font][font=宋体]3 [/font][font='Times New Roman']mL甲醇、[/font][font=宋体]3 mL [/font][font='Times New Roman']2[/font][font=宋体].5[/font][font='Times New Roman']%甲酸[/font][font=宋体]水[/font][font='Times New Roman']活化过的[/font][font=宋体]PCX[/font][font='Times New Roman']小柱[/font][font=宋体]净化[/font][font='Times New Roman'],[/font][font=宋体]依次[/font][font='Times New Roman']用[/font][font=宋体]3 mL [/font][font='Times New Roman']2[/font][font=宋体].5[/font][font='Times New Roman']%甲酸[/font][font=宋体]水[/font][font='Times New Roman']和[/font][font=宋体]3 [/font][font='Times New Roman']mL甲醇洗涤柱子,再用[/font][font=宋体]5 [/font][font='Times New Roman']mL[/font][font=宋体] 10 [/font][font='Times New Roman']%氨水甲醇溶液洗脱[/font][font=宋体],[/font][font='Times New Roman']收集洗脱液于50[/font][font='Times New Roman']℃氮气吹干,[/font][font=宋体]20%甲醇水[/font][font='Times New Roman']涡旋[/font][font=宋体]洗脱[/font][font='Times New Roman'],[/font][font=宋体]定容5[/font][font='Times New Roman'].0[/font][font='Times New Roman']m[/font][font=宋体]L,[/font][font='Times New Roman']过[/font][font=宋体]0.45 um水[/font][font='Times New Roman']膜[/font][font=宋体],[/font][font='Times New Roman']上机测定。[/font][font=宋体]【说明】:标准中称样量为10.0 g,40 mL甲醇分两次超声提取后,使用C18固相萃取柱净化,甲醇定容,过0.45 um有机膜后上机测定。[/font][font=宋体]本文[/font][font=宋体]使用阳离子交换柱净化,20%甲醇水洗脱,过水膜后上机测定。[/font][font=宋体][1] 温度高时,6-苄基腺嘌呤容易发生转化;[/font][font=宋体][2] 调pH=1.0~2.0,低于6-苄基腺嘌呤pKa(为3.8)两个单位,保证6-苄基腺嘌呤上柱前99%以上处于离子态,保证回收;减压浓缩除尽甲醇后,剩余液体的体积大于4 mL,可以不加3 mL 2.5%甲酸水,直接使用6 mol/L HCl调节酸性后,高速离心,上柱净化;[/font][font=宋体][3]高速离心,沉淀非水溶性固体,溶液澄清后提高过柱速度;[/font][font=宋体][4]使用5%氨水甲醇5 mL洗脱,阳离子交换柱上有残留,回收低;[/font][font=宋体][5]若使用有机滤膜会引入吸收波长为247nm的干扰峰。[/font][font=宋体][6]干样称2 g,加8 mL水,提取、净化步骤同新鲜样品,使用5%氨水甲醇3 mL洗脱,收集洗脱液,于50℃氮气吹干,20%甲醇水洗脱,定容1.0 mL。[/font][font=宋体][[/font][font=宋体]7[/font][font=宋体]]因流动相中含有0.1%乙酸,仪器要平衡足够长时间(待基线完全直线,一般一个小时以上)[/font][font='Times New Roman']仪器分析条件[/font][font='Times New Roman']1[/font][font=宋体]、[/font][font='Times New Roman']色谱的选择[/font][font='Times New Roman']6-苄氨基嘌呤[/font][font='Times New Roman']在甲醇和乙腈等有机试剂中有较好的溶解度,用这些试剂提取再配合液相色谱仪,可大大简化前处理过程,缩短前处理时间,且高效液相色谱仪[/font][font='Times New Roman']应用较为普遍,其易于推广应用,实用性强。[/font][font='Times New Roman']2[/font][font=宋体]、[/font][font='Times New Roman']色谱的[/font][font='Times New Roman']优化[/font][font='Times New Roman']实验过程中通过对色谱条件规定的参数要求进行了多次调整,以使仪器的灵敏度、稳定性和分离效率均处于最佳状态,获得满意的分离效果,达到回收率的要求。经过多次的试验摸索,确定实验参数。[/font][font=宋体](1)[/font][font='Times New Roman']色谱柱的选择[/font][font='Times New Roman']选用[/font][font='Times New Roman']C18[/font][font='Times New Roman']色谱柱,该色谱柱可在宽[/font][font='Times New Roman']pH [/font][font='Times New Roman']范围[/font][font='Times New Roman'](pH 2-9) [/font][font='Times New Roman']内提供良好的峰形,实验证明,该色谱柱适合分离豆芽中的[/font][font='Times New Roman']6-苄氨基嘌呤[/font][font='Times New Roman'],[/font][font='Times New Roman']峰形完全能满足检测要求且与干扰物质进行有效分离。[/font][font='Times New Roman'](2) [/font][font='Times New Roman']色谱条件的选择[/font][font='Times New Roman']通过对[/font][font='Times New Roman']0.5[/font][font='Times New Roman']mg/L[/font][font='Times New Roman']的[/font][font='Times New Roman']6-苄氨基嘌呤[/font][font='Times New Roman']的甲醇溶液并以甲醇为参比进行[/font][font='Times New Roman']200-400 nm[/font][font='Times New Roman']范围的紫外扫描,结果发现,[/font][font='Times New Roman']6-苄氨基嘌呤[/font][font='Times New Roman']在[/font][font='Times New Roman']267[/font][font='Times New Roman']nm[/font][font='Times New Roman']处有最大吸收,因此紫外吸收波长确定为[/font][font='Times New Roman']267[/font][font='Times New Roman']nm[/font][font='Times New Roman']。[/font][/size][/font][font=宋体][size=14pt][font='Times New Roman'] [img=,624,495]https://ng1.17img.cn/bbsfiles/images/2020/06/202006010609342120_2678_2166779_3.jpg!w624x495.jpg[/img][/font][/size][/font][font='Times New Roman'][size=10.5000pt][font=宋体] 6-苄氨基嘌呤光谱图[/font][/size][/font][font=宋体][font=宋体][size=10.5000pt](3)仪器的工作条件为:仪器型号:WATERS 2695色谱柱: C18/250*4.6mm检测器:PDA 267 nm进样量:10μL;流速:1.0mL/min柱 温:35 ℃流动相:梯度洗脱 B:甲醇; A:0.02 mol/L醋酸铵乙酸水(0.1%乙酸)[/size][/font][/font][font=宋体][font=宋体][size=10.5000pt][img=,577,79]https://ng1.17img.cn/bbsfiles/images/2020/06/202006010612124022_9207_2166779_3.png!w577x79.jpg[/img][/size][/font][/font][font=宋体][size=10.5000pt][font=宋体](4) 液相色谱法线性范围6-苄氨基嘌呤标准系列工作液浓度分别为0.10 mg/L、0.2 mg/L、0.5mg/L、1.00 mg/L、2.00 mg/L、将各浓度按照建立的方法依次进样后,检测得出一系列峰面积与浓度的对应点,连点成线,得到拟合标准曲线,直线方程为[b]Y=0.9013X-0.0051[/b],相关系数r=1.0000。可见在0.1~2mg/L浓度范围内线性很好。如果实测样品的含量超过此范围,可对其进行稀释。方法检出限:取豆芽样品,加标浓度为0.05mg/kg,S/N值为6.2。[/font][/size][/font][font=宋体][size=10.5000pt][font=宋体][img=,638,506]https://ng1.17img.cn/bbsfiles/images/2020/06/202006010614227772_157_2166779_3.png!w638x506.jpg[/img][/font][/size][/font][font=宋体][font=宋体][size=10.5000pt] 样品检出限色谱图[/size][/font][/font][font=宋体][font=宋体][size=10.5000pt]方法的回收率分别以黄豆芽和绿豆芽为加标对象,分别加入2个水平的6-苄氨基嘌呤标准溶液,进行回收率的测定,每个样品重复6次,计算出每个添加水平的回收率和相应的相对标准偏[/size][/font][/font][font=宋体][font=宋体][size=10.5000pt]差(RSD)值。方法回收率结果见表1。 [/size][/font][/font][font=宋体][font=宋体][size=10.5000pt] [img=,690,385]https://ng1.17img.cn/bbsfiles/images/2020/06/202006010636575612_5770_2166779_3.png!w690x385.jpg[/img] [img=,600,483]https://ng1.17img.cn/bbsfiles/images/2020/06/202006010626546266_2432_2166779_3.jpg!w600x483.jpg[/img][/size][/font][/font][font=宋体][size=10.5pt] 样品加标0.1mg/kg堆栈难色谱图[/size][/font][font=宋体][font=宋体][size=10.5000pt] [img=,555,459]https://ng1.17img.cn/bbsfiles/images/2020/06/202006010628451672_2213_2166779_3.jpg!w555x459.jpg[/img][/size][/font][/font][font=宋体][font=宋体][size=10.5000pt] 样品加标0.25mg/kg堆栈难色谱图[/size][/font][/font][font='Times New Roman'][size=10.5pt][size=10.5000pt] 6-苄氨基嘌呤[/size][/size][/font][font='Times New Roman'][size=10.5pt][size=10.5000pt]属五大类植物激素中的细胞激动素类,其主要功能为促进非分化组织分化,促进生物体内物质的积累,促进侧芽发生,防止老化等作用,因此被广泛应用于农业、果树和园艺作物从发芽到收获的各个阶段。因此,有所检出可能为豆子本身的残留,而非人为添加。[/size][/size][/font][font='Times New Roman'][size=10.5pt][size=10.5000pt]结论:[/size][/size][/font][size=10.5000pt][color=#ff0000][font=宋体]【说明】:1、标准中称样量为10.0 g,40 mL甲醇分两次超声提取后,使用C18固相萃取柱净化,甲醇定容,过0.45 um有机膜后上机测定。本文使用阳离子交换柱净化,20%甲醇水洗脱,过水膜后上机测定。2、 温度高时,6-苄基腺嘌呤容易发生转化;3、 调pH=1.0~2.0,低于6-苄基腺嘌呤pKa(为3.8)两个单位,保证6-苄基腺嘌呤上柱前99%以上处于离子态,保证回收;减压浓缩除尽甲醇后,剩余液体的体积大于4 mL,可以不加3 mL 2.5%甲酸水,直接使用6 mol/L HCl调节酸性后,高速离心,上柱净化;4、高速离心,沉淀非水溶性固体,溶液澄清后提高过柱速度;5、使用5%氨水甲醇5 mL洗脱,阳离子交换柱上有残留,回收低;6、若使用有机滤膜会引入吸收波长为247nm的干扰峰。7、干样称2 g,加8 mL水,提取、净化步骤同新鲜样品,使用5%氨水甲醇3 mL洗脱,收集洗脱液,于50℃氮气吹干,20%甲醇水洗脱,定容1.0 mL。8、因流动相中含有0.1%乙酸,仪器要平衡足够长时间(待基线完全直线,一般一个小时以上)[/font][/color][/size]