[color=#3e3e3e]用溶剂清洗色谱柱包括将色谱柱从GC上卸下来,并将几毫升溶剂至于色谱柱中。任何可溶于清洗剂的残留物就会从色谱柱中去除。如果未卸下色谱柱就注入大量溶剂,将不能清洗色谱柱,也不能从色谱柱中去除任何污染物。毛细管GC色谱柱必须具有键合和交联的固定相才可以使用溶剂进行清洗。使用溶剂清洗非键合的固定相会严重损坏色谱柱。[/color][color=#3e3e3e] [/color][color=#3e3e3e] 可使用色谱柱清洗装置来将溶剂注入色谱柱中,溶剂冲洗装置会连接到有压力的气源(N2或He),并把色谱柱插入到清洗装置中。把溶剂加入样品瓶中,然后使用气源对溶剂瓶回压。压力会强制溶剂流过色谱柱。残留物将溶解到溶剂中,并随溶剂反冲出色谱柱。然后将溶剂吹扫出色谱柱,并对色谱柱进行适当的老化。[/color][color=#3e3e3e] [/color][color=#3e3e3e] 清洗色谱柱前,从色谱柱的前端将其切去半米(即靠近进样器的一端)。将色谱柱连接检测器的一端插入清洗装置中。通常使用多种溶剂来清洗色谱柱。后面继续使用的溶剂必须与前面的溶剂互溶。一定不要使用高沸点溶剂,特别是不要用作最后使用的溶剂。溶解样品的溶剂通常是不错的选择。[/color][color=#3e3e3e] [/color][color=#3e3e3e] 建议使用甲醇、二氯甲烷和已烷,它们在大多数情况下都不错。可使用丙酮替代二氯甲烷、以避免使用含氯溶剂,但是二氯甲烷是最好的清洗溶剂之一。如果注射的是水性样品(例如生理体液或组织),则请在使用甲以前先使用水来冲洗。某些来自于水性样品残留物只能溶于水中而不溶于有机溶剂。应使用水和醇类(例如甲醇、乙醇和异丙醇)来清洗键合的聚乙二醇基固定相,但一般不建议采用该方法。[/color][color=#3e3e3e] [/color][color=#3e3e3e] 下表列出了针对各种直径的色谱柱,建议使用的溶剂的体积。使用大量溶剂虽无害,但效果不会好很多,并且还十分浪费。加入第一种溶剂后,对清洗装置加压,但要低于20psig。使溶剂流速低于1ml/min。除大多数0.53mm内径的色谱柱外,在流速达到1ml/min之前清洗装置的压力将先达到20psi。如果使用的是比重较大或粘度较大的溶剂,或色谱柱长度长或内径小,则需要较长的清洗时间。第一种溶剂全部进入或大部分进入色谱柱中后,加入下一种溶剂。当开始加入第二种溶剂后,上一种溶剂不要完全赶出色谱柱。[/color][color=#3e3e3e] [/color][color=#3e3e3e] 最后一种溶剂流出色谱柱后,让加压的气体流入色谱柱5-10分钟,将色谱柱装入进样口,然后通入载气。将载气通入色谱柱5-10分钟。把色谱柱连接到检测器上(或也可以不接检测器)。使用程序升温,从40℃-50℃开始将色谱柱以2-3℃/min的速度达到温度上限。将此温度保持1―4个小时,直至色谱柱完全老化为止。[/color][color=#3e3e3e][/color][color=#3e3e3e]冲洗色谱柱的溶剂体积[/color][table][tr][td][color=#3e3e3e]色谱柱内径(mm)[/color][/td][td][color=#3e3e3e]溶剂体积(ml)[/color][/td][/tr][tr][td][color=#3e3e3e]0.18-0.2[/color][/td][td][color=#3e3e3e]3-4[/color][/td][/tr][tr][td][color=#3e3e3e]0.25[/color][/td][td][color=#3e3e3e]4-5[/color][/td][/tr][tr][td][color=#3e3e3e]0.32[/color][/td][td][color=#3e3e3e]6-7[/color][/td][/tr][tr][td][color=#3e3e3e]0.45[/color][/td][td][color=#3e3e3e]7-8[/color][/td][/tr][tr][td][color=#3e3e3e]0.53[/color][/td][td][color=#3e3e3e]10-12[/color][/td][/tr][/table]
新手求助:我们实验室稀释一般用重量法稀释,最近比较关注逐级稀释的问题。目前操作的时候,一般直接称重,比如1g样品稀释到10g,算是10%的浓度的,按重量称,不按体积稀释。看大家说稀释超过100倍需要逐级稀释来减小误差,但是我看到的逐级稀释都是称一定重量的样品再用容量瓶加稀释溶剂,比如1g样品用容量瓶加到100ml。现在有个问题,逐级稀释是针对体积稀释还是重量稀释?假如用分析天平,精度为0.00001g,准确称取0.02g左右的样品(这个数字我用天平可以准确读出),再稀释至10g,这样算是2000ppm?这个稀释算1000倍,应该用逐级稀释吗?其实最纠结的点在于:1.天平可以准确的读出这个数字,那么是否还需要逐级稀释,也就是存在的称量的误差是否可以用天平消除2.体积稀释需要用逐级稀释,是否称重法也需要3.如果需要逐级稀释,是否溶质的质量不能太小?比如在天平准确称量的前提下稀释至10%,是1g稀释到10g好还是0.1g稀释到1g好?
请问,我们想买装分析柱的装柱机,但不知有哪些厂家,及型号如何,就是装普通液相分析柱。请发*********************谢谢了!huaibeijiayuan:如果有信息请与楼主站短联系
正向柱和反向柱相互切换要用什么溶剂冲洗?
各位高手,我常在论坛中看到大家有时候提到使用气相做标准和样品检测以后,需要用溶剂洗一洗色谱柱子。请问:1、每次检测结束以后,必须用溶剂对色谱柱进行清洗吗? 2、常用清洗色谱柱的溶剂有哪些?如何清洗?
柱色谱湿法装住时是用流动相(洗脱剂)与吸附剂混合装柱还是用水?
我看到一个帖子是讲清洗柱子,欢迎大家讨论你们都用什么溶剂清洗过什么样的柱子!!各位大神请不另指教!
用溶剂清洗毛细管色谱柱的方法,包括将要清洗的色谱柱从GC上卸下来,并将几毫升溶剂注入色谱柱中。 任何可溶于清洗溶剂的残留物就会从色谱柱中去除。如果仪器分析未卸下色谱柱,就注入大量溶剂,将不能清洗色谱柱,也不能从色谱柱中去除任何污染物。毛细管GC色谱柱必须具有键合和交联的固定相才可以使用溶剂进行清洗。若使用溶剂清洗非键合的固定相会严重损坏色谱柱。 可使用色谱柱清洗装置来将溶剂注入色谱柱中。溶剂清洗装置会连接到有压力的气源(N2或He),同时把色谱柱插入阿斗清洗装置中。把溶剂加入到样品瓶中,分析化学任何使用气源对溶剂瓶加压。压力会强制溶剂流过色谱柱。残留物将溶解在溶剂中,并随溶剂反冲出色谱柱。然后将溶剂吹扫出色谱柱,并对色谱柱进行适当的老化。 清洗色谱柱前,从色谱柱的前端敬爱能够其切去0.5米(即靠近进样器的一端)。将色谱柱连接检测器的一端插入清洗装置中。通常使用多种溶剂来清洗色谱柱。后面继续使用的溶剂要必须要与前一种溶剂互溶。分析化学一定不要使用高沸点溶剂,特别是不要作为最后使用的溶剂。溶解样品的溶剂通常是不错的选择。 建议使用甲醇、二氯甲烷和己烷,它们在大多数情况下效果不错。可使用丙酮代替二氯甲烷,以避免使用含氯溶剂,但是,二氯甲烷是最好的清洗溶剂之一。 两篇不错的气相色谱经验文章:《气相色谱仪器故障排除方法(不出峰与灵敏度降低)》 《经验:气相色谱维修维护经验谈》 如果测定的样品是水性的样品,如:生理体液和组织,则请在使用甲醇以前先使用水来冲洗。某些来自于水性样品的残留物只能溶于水中而不溶于有机溶剂。应使用水和醇类(如:甲醇、乙醇和异丙醇)来清洗键合的聚乙二醇基固定相(如:DB-WAX、DB-WAXetr、B-FFAP、HP-Innowax),但一般不建议采用该方法。 表中列出了针对各种直径的色谱柱,建议使用的溶剂的体积。使用大量溶剂虽然无害,但效果不会好很多,并且还十分浪费。加入第一种溶剂后,对清洗装置加压,但要低于20psi。使用可保持溶剂流速低于1mL/min的最高压力。除大多数0.53mmm内径的色谱柱外,在流速达到1mL/min之前清洗装置的压力将先到达20psi。如果使用的是比重较大或粘度较大的溶剂,或色谱柱直径小或长度大,则需要较长的清洗时间。待第一种溶剂全部进入或大部分已进入色谱柱中后,加入下一种溶剂。仪器分析待清洗的溶剂流出色谱柱后,让加压的气体通入色谱柱5-10分钟。将色谱柱装入进样口然后通入载气。将载气通入色谱柱5-10分钟。把色谱柱连接到检测器上(或也可以根据个人意愿不接到检测器上)。使用程序升温,从40-50℃开始将色谱柱以2-3℃/min的升温速率,直至达到温度上限。将此温度保持1-4个小时,直至色谱柱完全老化为止。
洗瓶机用了很长一段时间了,总结了一些使用注意事项,在这里和大家分享下。如果你也在用洗瓶机,不妨看看。我们在验收的时候要注意外包装有没有很明显的破损,如果破损严重很可能洗瓶机也受到了影响。洗瓶机的进水管路不能经受高温和化学试剂的侵蚀。像烧杯、容量瓶、培养皿这些器皿化学稳定性和热稳定性较强,高温清洗没关系。但一些塑料器皿本身不耐热,大家慎洗。洗瓶机工作的时候不要随意开仓门,不然可能会被热蒸汽烫着。节假日长时间不用的话,就把电源断掉,进水阀门最好也关上、如果你还有什么使用心得,欢迎补充进来![img]https://simg.instrument.com.cn/bbs/images/default/em09505.gif[/img]
洗板机选购应注意以下几个方面: 1. 关键指标:残留量≤2uL/孔。这是洗板机的一个关键指标,残留量大的洗板机其洗板效果相对较差。目前大多数洗板机的残留量为≤5uL,设计良好的洗板机可达≤2uL。
1.注意谨慎使用清洗液在使用超声波清洗机的时候,必须要按照规范要求的顺序进行操作,特别是不可以先开机然后再把清洗液倒进去,这属于违规操作会引发严重的后果甚至会损坏机器,因此一定要先把液体放进去然后再打开开关。同时还应该要顾及到清洗液的成分,如果它含有易燃性质的液体那么一定要在短时间内完成操作,并且全程都要有人监督,不可以离开现场。2.注意使用腐蚀或挥发性清洗液要做特殊处理通常情况下是不提倡使用危险性清洗液的,但如果情况比较特殊,强调超声波清洗机厂家必须要使用含有腐蚀性或挥发性的液体,那么应该要采取间接的方式来进行妥善的处理。具体的操作方法是在清洗槽里面先加水,然后再另外用一个容器装清洗液并放入需要清洗的物品,然后在它们浸入清洗槽的水里面,用这种方式来进行清洗该也会在同样的效果,又可以保证安全的问题。3.超声波清洗机电源及电热器电源必须有良好接地装置。4.超声波清洗机严禁在槽中没有水或溶剂时,千万不要启动,造成空振,造成振动头报废或损坏。5.有加热系统的清洗设备严禁无液时打开加热开关。6.禁止用重物(铁件)撞击清洗缸缸底,以免能量转换器晶片受损。7.超声波发生器电源应单独使用一路220V/50Hz电源并配装2000W以上稳压器。8.清洗缸缸底要定期冲洗,不得有过多的杂物或污垢。9.清洗机操作过程中请勿将手指放入清洗槽中,否则会感到刺痛或者不适。10.每次换新液时,待超声波起动后,方可洗件。11.采用清水或水溶液作为清洗剂,绝对禁止使用酒精,汽油或任何可燃气体作为清洗剂加入清洗机中。12.当直接使用易燃液体清洗时,要尽量在短时间内完成清洗工作,并要求操作者不要离开现场。13.当需要用腐蚀性或挥发性强的清洗液时,可采用间接清洗的方法。即:首先在清洗槽内加水,再将所需清洗液倒入适宜的容器内并放入被清洗物,然后将装有清洗液和清洗物的容器浸入清洗槽中,即可开始清洗工作,其效果与直接清洗相同。14.使超声波清洗效果最佳的方式,超声波清洗槽的温度最好为30~50℃,根据不同的清洗对象正确选择清洗剂。清洗剂一般分为水基(碱性)清洗剂、有机溶剂清洗剂和化学反应清洗剂。通常使用最多的为水基清洗剂,根据被清洗物的污染程度和污垢性质,选用不同的清洗时间。15.在使用时禁止先开机后倒入清洗液,这样会使机器损坏。16.清洗物品不要直接放在清洗槽底部,应用专用清洗支架清洗筐,这样有利于提高清洗效果。17.尽量避免长时间连续工作,一般不超过30分钟为宜。18.在使用时槽内清洗或脱气的溶液不要放入过少,一般在槽内2/3处最佳。19.注意控制好清洗的相关因素超声波清洗机厂家建议不要把需要清洗的东西放在最底端,应该要用专门清洗的支架进行架空放在中间的位置,这样一来在进食的时候就可以均匀的受力获得好的清洗效果。同时高端的超声波清洗机厂家提醒还要注意到所放入的清洗液能量也应该要控制好,不能放太少否则可能会损坏仪器或者出现故障。
保护柱与分析柱的体积比为多少最好?
看资料得知有“注射器清洗剂”,清洗气相进样针用的,有没有版友用过?
[size=3][font=宋体] 用溶剂清洗毛细管色谱柱的方法,包括将要清洗的色谱柱从[/font][font=Times New Roman]GC[/font][font=宋体]上卸下来,并将几毫升溶剂注入色谱柱中。[/font][/size][size=3][font=宋体] 任何可溶于清洗溶剂的残留物就会从色谱柱中去除。如果未卸下色谱柱,就注入大量溶剂,将不能清洗色谱柱,也不能从色谱柱中去除任何污染物。毛细管[/font][font=Times New Roman]GC[/font][font=宋体]色谱柱必须具有键合和交联的固定相才可以使用溶剂进行清洗。若使用溶剂清洗非键合的固定相会严重损坏色谱柱。[/font][/size][font=宋体][size=3] 可使用色谱柱清洗装置来将溶剂注入色谱柱中。溶剂清洗装置会连接到有压力的气源([/size][/font][size=3][font=Times New Roman]N2[/font][font=宋体]或[/font][font=Times New Roman]He[/font][font=宋体]),同时把色谱柱插入阿斗清洗装置中。把溶剂加入到样品瓶中,任何使用气源对溶剂瓶加压。压力会强制溶剂流过色谱柱。残留物将溶解在溶剂中,并随溶剂反冲出色谱柱。然后将溶剂吹扫出色谱柱,并对色谱柱进行适当的老化。[/font][/size][font=宋体][size=3] 清洗色谱柱前,从色谱柱的前端敬爱能够其切去[/size][/font][size=3][font=Times New Roman]0.5[/font][font=宋体]米(即靠近进样器的一端)。将色谱柱连接检测器的一端插入清洗装置中。通常使用多种溶剂来清洗色谱柱。后面继续使用的溶剂要必须要与前一种溶剂互溶。一定不要使用高沸点溶剂,特别是不要作为最后使用的溶剂。溶解样品的溶剂通常是不错的选择。[/font][/size][font=宋体][size=3] 建议使用甲醇、二氯甲烷和己烷,它们在大多数情况下效果不错。可使用丙酮代替二氯甲烷,以避免使用含氯溶剂,但是,二氯甲烷是最好的清洗溶剂之一。[/size][/font][size=3][font=宋体] 如果测定的样品是水性的样品,如:生理体液和组织,则请在使用甲醇以前先使用水来冲洗。某些来自于水性样品的残留物只能溶于水中而不溶于有机溶剂。应使用水和醇类(如:甲醇、乙醇和异丙醇)来清洗键合的聚乙二醇基固定相(如:[/font][font=Times New Roman]DB-WAX[/font][font=宋体]、[/font][font=Times New Roman]DB-WAXetr[/font][font=宋体]、[/font][font=Times New Roman]B-FFAP[/font][font=宋体]、[/font][font=Times New Roman]HP-Innowax[/font][font=宋体]),但一般不建议采用该方法。 [/font][/size]
老化不好使,没有溶剂清洗工具包,用一组溶剂打针,前提把毛细柱反过来,FID检测器,之后烤柱子可以吗?谢谢大家拉[em0804]
[size=4]我有个试验要用的流动相为乙睛-甲醇-水-乙酸(2:2:9:0.2)。现在我们的仪器是waters2695 HPLC,色谱柱为C18柱,请问:柱塞密封清洗溶剂、针头清洗溶剂和关机前清洗系统溶剂我该分别选用什么溶剂? [/size]谢谢大家。以下是我看的资料举例说明中得到的东西:1.柱塞密封清洗溶剂(成份:80%水:20%甲醇)2.针头清洗溶剂(成份:比例接近流动相,1.8:1.8:9.42:0.18,乙睛-甲醇-水-乙酸配在一起)3.流动相(乙睛-甲醇-水-乙酸,2:2:9:0.2)3.1乙睛(2)3.2甲醇-水-乙酸(11.2)4.关机前系统清洗溶剂(成份:超纯水/HPLC级水,水-甲醇)4.1超纯水/HPLC级水4.2 水-甲醇(80%水:20%甲醇)加上废液瓶,共需7个容器。各位大侠,不知道我能不能按照上面那样用?
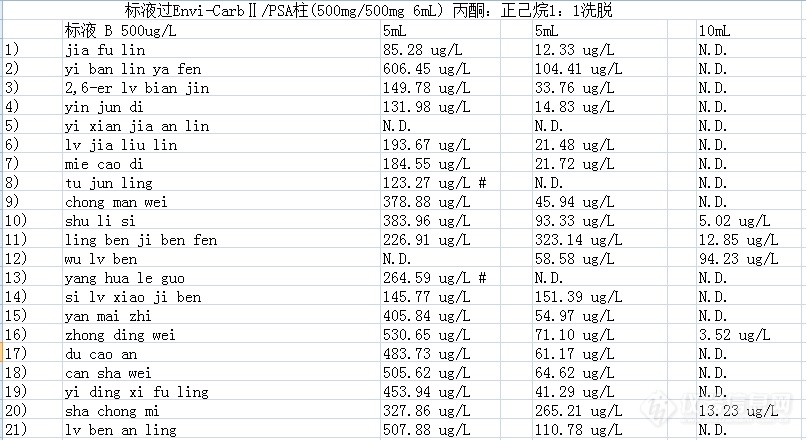
[size=3][/size]我用ASE100提取土壤中的多氯联苯跟有机氯农药,提取剂用的是1:1的丙酮:正己烷,手动过佛罗里希柱,5ml正己烷活化柱子,10ml正己烷:二氯甲烷 1:1的混合液洗脱,回收率才20%多一些,我的过柱的样品只有3ml左右,我不知道该用多少洗脱液来淋洗,请做过的帮忙找下愿意你是不是洗脱的问题。多氯联苯跟有机氯农药的回收率都是这样,旋转蒸发出去的溶剂中没有被测物质,加载样品洗脱前流出的液体中也没有被测物质,初步判断为样品吸附在了柱子上。 我准备做过柱不过柱的对比,不过柱出杂峰但是不对其积分应该也可以吧,做多氯联苯用质谱检测,有杂峰也影响不到。过柱的那部分,分次过柱,我看用多少体积过柱才能使得最后的洗脱液中检测不到被测物质。 有什么好的建议请多多指教
Varian 提供各种规格的Bond Elut SPE柱,吸附剂的质量从50mg至100g不等。小柱床的吸附剂通常用于样品体积有限,或者需要特别小的洗脱体积去洗脱目标分析物,以达到最大的分析物浓度。非极性吸附剂和极性吸附剂 吸附剂的容量定义为:给定质量的吸附剂,在最佳条件下可以保留分析物的总质量。不同的键合硅胶吸附剂,其保留容量也有很大不同。对于极性和非极性硅胶基质的吸附剂而言,其保留容量常常小于吸附剂质量的1% (尽管有时也会超过5%),例如500mg C18吸附剂至多可以保留25mg目标分析物和干扰物质。在某一个处理过程中,对给定吸附剂需要选择所需用量时,不但要考虑对目标分析物的保留容量,还要考虑样品中可能会发生共保留的样品干扰组分。很明显,在决定所需要吸附剂的容量时,这些干扰组分与目标分析物相比,影响因素更大。因此建议:在不同应用中分别测试一下柱容量。 一般较大的吸附剂质量,保留容量也会很大,但是所需要的洗脱溶剂量也会加大,与小柱床体积吸附剂的SPE柱相比,最终洗脱液中的分析物浓度也会偏低。 最小洗脱体积定义为2个柱床体积的洗脱溶剂量。一般典型的柱床体积为120μl/100mg吸附剂。有些情况下,所用洗脱体积会小于2个柱床体积。但是此种萃取过程,一般受流速和其它因素的影响较大,很难得到重复性较好的萃取结果,因此一般不建议采用小体积洗脱萃取方法。

看到某厂家的资料,可用溶剂清洗色谱柱,分享一下。http://ng1.17img.cn/bbsfiles/images/2015/12/201512041647_576354_1645480_3.jpg
选用的阳离子SCX固相萃取小柱,测肌肉中的卡巴多,和喹乙醇很像,是一种促生长剂,可使用柱子的时候,回收率很低,请问哪位大侠用过这种柱子啊,我查了资料,使用5ML甲醇,5ML水,5ML稀盐酸活化,可样品液过柱损失不小啊,影响回收率,请问前对样品液的PH值要求高吗,还有淋洗和洗脱选用什么比较合适啊,我试了用水和甲醇淋洗,都有损失,郁闷啊
我现在用的是SE-30或SE-54的柱子,FID检测器,用做检测分析硅烷类有机物,以前每做完一个样都用丙酮洗柱子.但是最近听别人说这两个柱子都是非极性柱,而丙酮又是极性的溶剂,最好不要用丙酮清洗.根据相似相溶的原则是不该用丙酮清洗,但是有些硅烷类有机物会把柱子给堵死,该怎么办
关于这个问题,大家不要笑我,可能对很多人来说心中早有答案。这个问题的起因是:无火焰法的国标方法中常常出现从贮备液→中间液→使用液的试剂配制过程,例如GB/T5750.6-2006中的15.1镍,无火焰[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]分光光度法。明明可以从1000ug/ml到1ug/ml,用到一个1L的容量瓶,稀释1000倍。但是国标却是分两步:第一步,取贮备液5ml于100ml容量瓶,所得为中间液。第二步,取中间液2ml于100ml容量瓶,所得为使用液,也就是先稀释20倍,再稀释50倍。下面是我对逐级稀释和直接稀释的误差计算,大家帮我看看有没问题:首先假设:每次取液误差为2%。1.直接稀释法取1ml至1000ml容量瓶,假设取了1.02ml,所得浓度为:1.02ml*1000ug/ml除以1000ml,1.02ug/ml。2.逐级稀释法第一步,取贮备液5ml于100ml容量瓶,按2%误差,假设误差都为增量,取液5ml*102%,所得浓度为:1000ug/ml*5ml*102%除以100ml,51ug/ml。第二步,取第一步所得液2ml于100ml容量瓶,按2%误差,假设误差都为增量,取液2ml*102%,所得浓度为:51ug/ml*2ml*102%除以100ml,1.0404ug/ml。也就是说分两次级逐级稀释的误差是102%的平方,大于直接稀释法的102%,为什么还要逐级稀释呢?
请问:在使用固相萃取小柱时洗脱的过程一般是不能让小柱流干的,那么同样体积的溶剂,分几次洗脱和一次洗脱有什么区别吗?为什么?

柱子每年一换,没有做过以下的柱子清洗工作,看了大家的讨论,翻看了安捷伦的手册,找到了这一页,和有位网友的顶空瓶加压类似,为了显示A的高大上,设备必须跟上。1. 毛细管GC色谱柱必须具有键合和交联的固定相,才能用溶剂冲洗2.清洗前,拆下柱子,并且进样口端截0.5m3.冲洗方向:由检测器端 到 进样口端4.注意冲洗时,流速(压力)的控制5.冲洗结束时,载气冲柱子6.接上检测器,低温开始慢速老化http://ng1.17img.cn/bbsfiles/images/2016/01/201601071527_581186_1654762_3.jpg
大家再使用一种新的固相萃取柱时,有没有将平时你们所要检测的农残项目的混标过这个萃取柱,然后使用不同的洗脱剂进行洗脱实验,看看各种农药会不会存在被固相萃取柱所吸附而用洗脱剂洗脱不下来的情况?我看有的实验室有这样做,觉得他们的工作做的好细致认真。[img=,690,376]http://ng1.17img.cn/bbsfiles/images/2017/12/201712171338_6751_2166779_3.png!w690x376.jpg[/img][img=,690,365]http://ng1.17img.cn/bbsfiles/images/2017/12/201712171339_1942_2166779_3.png!w690x365.jpg[/img]
分子印迹整体柱合成后,要用极性较大的溶剂将印迹分子冲去,我用手动的方法用注射器冲洗,但是就是打不穿,没有液滴从另一端出来。(我是合成了3个小时,就硬结成这样了)。请问是我合成的太致密了?还是我打的时候压力不够?需要换成用液相泵,买个接头冲洗?这样在电泳仪上是不是意味着压不进液体了?(我们这边电泳仪是公用的,从来没有用过外加小氮气瓶压力进样)恳请高手赐教!
碳硫分析仪器如何正确选用助溶剂锡粒 正确选用助溶剂,对确保试样燃烧完全是很重要的。锡粒,(英文名称:Tin flux,Tin chip accelerator,也可称为锡助熔剂,纯锡助熔剂)在碳硫分析中燃烧样品时做助熔剂用,可用于管式炉、电弧引燃炉,具有降低熔点,加速样品燃烧及搅拌的作用。 碳钢、低合金钢用锡粒好(一般加0.2-0.3g);而中、高合金钢等难熔合金,用锡粒再加铁粉(0.5g)作助溶剂。锡粒的熔点较低(231.89℃),熔融后形成液滴,可扑捉燃烧过程中产生的氧化物,这样可避免二氧化硫转化为三氧化硫,从而大大提高了硫的回收率。在不锈钢超低碳检测精度要求高的前提下,我公司生产的电弧红外碳硫分析仪产品配用助溶剂锡粒,可使熔点降低,燃烧充分,从而大大提高了超低碳检测精度,使其完全达到国家标准。
固相萃取中 小柱的填充料跟洗脱机有无关系在做氨基甲酸酯类农药加标回收试验前处理中 采用过两种净化方法,方法一是:将氨基柱用4.0m甲醇l+二氯甲烷(1+99)预习条件化,当溶剂液面到达柱吸附层表面时,立即加入上述待净化溶液,用10ml试管B收集洗脱液,用2ml甲醇+二氯甲烷(1+99)洗试管A后过柱,并重复一次。将试管置于氮吹仪上,水浴温度50℃,氮吹蒸发至近干,取2ml10%乙腈溶解,在混合器上混匀后,用0.45um滤膜过滤,待测。方法二是:将SPE柱先用3ml甲醇润洗,然后用3ml水润,接着将上述净化液加入已经活化完的SPE柱,弃去滤液,用5ml乙酸乙酯+丙酮(90+10)洗脱SPE柱,抽真空,用5ml试管收集滤液,将试管置于氮吹仪上,水浴温度40℃,氮吹蒸发至近干,取2ml10%乙腈溶解,在混合器上混匀后,用0.45um滤膜过滤,待测。 最后经液相-柱后衍生,得到的结果是,方法一的回收率优于方法二,而且方法二的基线走的比较高,有杂峰。 哪位高手帮我分析一下原因 ,我估计原因大可能出在净化前处理中洗脱剂与柱子的选择上。具体原因不清楚,还有就是小柱与洗脱剂相互的选择性有没有内在的联系
今天配溶液的时候和同事谈到了逐步稀释和一步稀释哪个好,同事们都说逐步稀释比一步稀释要好,逐步稀释误差比一步稀释要小,我不同意他们的说法,和他们挣了半天也没出结果。他们的观点是无论怎么样逐步稀释都比一步稀释准确,只是实际操作可能一步稀释简单一些,都不使用逐步稀释;我的观点是如果取同样体积的原液稀释100倍,一步稀释比逐步稀释要好一些,例如A:取1ml直接定容至100ml,B:取1ml先定容至10ml,再取1ml定容至10ml,我的观点就是A比B要准确一些,但是我同事都说B比A准确。C:取1ml定容至100ml,D:取10ml定容至100ml,再取10ml定容至100ml,这种情况我和我同事的观点都一样,D要比C准确一些。CD这种情况基本没什么可说的了,D就是比C准确,但是AB这种情况我还是坚持A要好一些,但是我没法用数据来说服他们,他们也找不到能让我心服口服的数据,有没有人能用数据来说一下AB哪个更好?我来说一下为什么我觉着A要比B准确吧。因为我觉着同样取1ml溶液,取一次的误差就是比取两次的误差要小,一步稀释定容至100ml在取样上只会产生一次误差;但是逐步稀释需要2次取样,会产生2次误差。有可能2次取样会产生正负互补,但是如果2次取样都是正正或者都是负负呢?如果一次取样的误差范围是±0.1,而2次取样的误差范围就有可能是±0.2了(数据是随便编的,但是2次取样误差范围一定会比1次取样要大),这种情况下还是一步稀释要准确一些。总体来说我的观点就是:如果取的母液容积一定,一步稀释要比逐步稀释准确,不管你稀释10倍、100倍还是1000倍。还有一点就是,通常说的稀释倍数不能超过100倍,我认为这个也是要看情况的,我还是上面的观点,如果你只有1ml的母液要稀释1000倍,直接取1ml定容至1000ml要比取1ml定容至10ml、再取10ml定容至1000ml(或其他逐步稀释的方法)要准确。如果母液充足,逐级稀释要比一步稀释准确。求大神用数据来支持或反驳我的观点,如能说服我改变观点,感激不尽!!!!!!!
最近的幾篇有關管柱的討論,其中的某些觀點似乎是值得拿出來再加以澄清的,當然這是我的看法,如果有不同的論點也是可以再提出來......毛細管柱一般都不會便宜, 在進行某些步驟時需要多多考慮一下!!1. 新的管柱需要再加以condition( 老化)嗎?? 當然需要! 但絕對不需要花整夜的時間來condition! 尤其是不論青紅皂白的在持續高溫下整夜的加熱condition,這對管柱其實是很大的傷害,就算是一支嚴重污染的管柱都不一定需要如此做,更何況還是一支新的. 事實上,在管柱的包裝盒中都會有告訴你這一支新管柱的Condition方法,照著做,如果無法達到你的要求, 再換更激烈一點的方法還不遲! 2. 使用過的管柱要怎麼做Condition? 最大的忌諱就是前一項中所提的,絕對不要長時間在高溫下烘烤你的管柱,即使你的溫度已經調到管柱的最高耐溫下30度,也不要如此做!! Condition應採低溫==高溫==降溫==升溫==高溫==降溫.....的模式操作,就是在一個操作的program中設定好多次的升降溫度. 那麼高溫要到幾度? 兩種做法:一是依照你管柱所能承受的最高溫度再降30度. 另一種就是你分析時所用之program的最高溫度. 我通常都是使用第一種的設定方式. 3. 到底要Condition到甚麼程度下才可以正式run樣品? 這要看你儀器感度和分析的需要,而不是一成不變的用同一個標準! 如果你是分析高濃度,幾個ppm以上的樣品,其實你的管柱不需要太多的Condition! 如果你的分析物出來的時間較後面,且濃度較低的話,就必須使用比較嚴苛一點的方式和久一點的時間了! 例如在我的實驗中,如果是需要低濃度接近MDL的分析考試, 在前一天的下班時,就會設定一連串空針的空針(使用明天要用分析program ), 一直run到正式的樣品上機為止.4. 管柱可以用有機溶劑清洗嗎? 一般WCOT和cross link的管柱都沒問題! 在DB和HP的管柱使用說明中就有說明哪些DB和HP系列的管柱不可以使用有機溶劑清洗. 5. 甚麼東西是絕對不可以注射進入管柱的? 無機酸和鹼是最大的忌諱,幾乎所有類型的管柱都無法忍受!!6. 水呢? 可以用水清洗管柱嗎? 可以直接注射水樣進入管柱嗎? 其實最近的一些討論內容中,水是否可以進入管柱中,是個討論的重點, 一般GC分析員的的觀念中,視水為GC管柱及GC儀器本身的大敵, 但事實上水沒那麼可怕! 除了幾種靜相之外,水不但可以可以直接注射進入管柱中,甚至於可以如有機溶劑一般來清洗管柱. 在手上的一篇J&W公司(DB管柱的製造廠商)的資料中顯示(很久以前從網路下載的,已經忘掉位址了),在三種靜相性質完全不同的管柱:DB-wax, DB-1和DB-225,分兩種狀況來實驗,一是以水樣注射,第二種是先以3mL的水清洗,在依序接著以1mL的甲醇,二氯甲烷,正己烷等沖洗後,以相同的物質在前述兩種實驗方式的前後分別注射(不同的管柱分析物並不相同),可以獲得下列的數據:( "before Inj.表示為實驗前, "After Inj.表示為注射水樣後,"After rinse表示為以水清洗後)DB-1Parameter Before Inj. After Inj. After RinseRet. Factor 14.6 14.5 14.5Ret. Index 1 1349.88 1350.02 1350.05Ret. Index 2 1427.77 1428.16 1428.07Theor. plates 1448 1474 1391Bleed(pA) 12.8 11.2 21.5 DB-waxParameter Before Inj. After Inj. After RinseRet. Factor 12.6 12.6 11.7Ret. Index 1 1149.54 1149.73 1150.82Ret. Index 2 1163.44 1163.71 1164.13Theor. plates 1277 1261 1268Bleed(pA) 50.5 97.8 97.6Bleed2 42.2 41.0 39.6DB-225Parameter Before Inj. After Inj. After RinseRet. Factor 11.5 11.4 11.2Ret. Index 1 1622.30 1621.26 1620.97Ret. Index 2 1711.51 1711.03 1710.77Theor. plates 1101 1110 1160Bleed(pA) 15.0 114.0 53.9大概的結論是:a. 管柱注射水樣後對於:polarity, selectivity, retention time, efficiency, activity等並無太大的改變.b.對於管柱的Bleeding方面:100%的DMPS無影響,但PEG和50%的cyanopropyl phase仍需繼續觀察下去.c.Non polar管柱對於注射水樣和以水清洗管柱並無影響, 對於polar 的管柱(bonded,和cross-link)而言, 水樣的注射亦無影響. 但不推薦使用水去清洗管柱.在我還是研究生的階段,就已經使用FID,直接注射水樣來分析五氯酚的實驗.... 至於有人說注射水樣會使得FID的火熄滅,其實應該要先檢討一下空氣和氫氣的流速和流速比是否正確.....但是ECD則持保留的態度, 那東西是超級怕水的!!7. 分析的後段在高溫時, base line會隆起,需要condition管柱嗎? 毛細管柱在烘箱中,除了在是溫以外,只要溫度一升高,就一定會產生bleeding, 在高溫時當然最多,尤其是當你使用膜厚較大的管柱時,這種情況特別嚴重! 需不需要就看你要求的偵測極限,當管柱的bleeding大到遮住你的分析物時, 這時你再怎麼去加熱Condition也沒有用! 還不如視情況換一支較小膜厚的管柱......