概念:细胞克隆形成率即细胞接种存活率,表示接种细胞后贴壁的细胞成活并形成克隆的数量。贴壁后的细胞不一定每个都能增殖和形成克隆,而形成克隆的细胞必为贴壁和有增殖活力的细胞。克隆形成率反映细胞群体依赖性和增殖能力两个重要性状。基本步骤:1、取对数生长期的各组细胞,分别用0.25%胰蛋白酶消化并吹打成单个细胞,并把细胞悬浮在10%胎牛血清的DMEM培养液中备用。2、将细胞悬液作梯度倍数稀释,每组细胞分别以每皿50、100、200个细胞的梯度密度分别接种含10mL 37℃预温培养液的皿中,并轻轻转动,使细胞分散均匀。置37℃ 5% CO2及饱和湿度的细胞培养箱中培养2~3周。3、经常观察,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用PBS小心浸洗2次。加4%多聚甲醛固定细胞5mL固定15分钟。然后去固定液,加适量GIMSA应用染色液染10~30分钟,然后用流水缓慢洗去染色液,空气干燥。4、将平皿倒置并叠加一张带网格的透明胶片,用肉眼直接计数克隆,或在显微镜(低倍镜)计数大于10个细胞的克隆数。最后计算克隆形成率。克隆形成率 =(克隆数/接种细胞数)×100%平板克隆形成试验方法简单,适用于贴壁生长的细胞。适宜底物为玻璃的、塑料瓶皿。试验成功的关键是细胞悬液的制备和接种密度。细胞一定要分散得好,不能有细胞团,接种密度不能过大。
[size=18px]流式细胞术[/size][size=18px]及平板克隆[/size][size=16px]([/size][size=16px]1[/size][size=16px])铺板[/size][size=16px] [/size][size=16px]取[/size][size=16px]对数生长期[/size][size=16px] H446[/size][size=16px]、[/size][size=16px]H[/size][size=16px]69[/size][size=16px]、[/size][size=16px]H[/size][size=16px]526[/size][size=16px]、[/size][size=16px]D[/size][size=16px]MS114[/size][size=16px]细胞,[/size][size=16px]计数,分别接种等量细胞至[/size][size=16px]6[/size][size=16px]孔板,[/size][size=16px]“[/size][size=16px]十字形[/size][size=16px]”[/size][size=16px]晃动,使细胞分布均匀,[/size][size=16px]继续[/size][size=16px]培养。[/size][size=16px] [/size][size=16px]([/size][size=16px]2[/size][size=16px])药物处理[/size][size=16px] [/size][size=16px]待细胞融合率约[/size][size=16px]80%[/size][size=16px],[/size][size=16px]加入[/size][size=16px]不同浓度([/size][size=16px]0[/size][size=16px]、[/size][size=16px]IC20[/size][size=16px]、[/size][size=16px]IC50[/size][size=16px])[/size][size=16px]西达本胺处理[/size][size=16px]4[/size][size=16px]8[/size][size=16px] [/size][size=16px]h[/size][size=16px]。每组均设置[/size][size=16px]D[/size][size=16px]MSO[/size][size=16px]对照组。继续培养[/size][size=16px]4[/size][size=16px]8[/size][size=16px] [/size][size=16px]h[/size][size=16px]后采用[/size][size=16px]Annexin V-FITC /PI[/size][size=16px]双染法对细胞进行染色。[/size][size=16px]([/size][size=16px]3[/size][size=16px])准备:[/size][size=16px]冰[/size][size=16px]PBS[/size][size=16px]、流式细胞术专用试管、凋亡试剂盒([/size][size=16px]10[/size][font='arial'][size=16px]×[/size][/font][size=16px] [/size][size=16px]Annexin V[/size][size=16px]结合缓冲液用[/size][size=16px]DD[/size][size=16px]水稀释[/size][size=16px]1[/size][font='arial'][size=16px]×[/size][/font][size=16px])[/size][size=16px]([/size][size=16px]4[/size][size=16px])对照组的设置:阴性对照([/size][size=16px]未染色细胞[/size][size=16px])、[/size][size=16px]FITC Annexin V[/size][size=16px]([/size][size=16px]无[/size][size=16px]PI[/size][size=16px])单[/size][size=16px]染细胞[/size][size=16px]、[/size][size=16px]PI[/size][size=16px]单[/size][size=16px]染[/size][size=16px]([/size][size=16px]不含[/size][size=16px]FITC Annexin V[/size][size=16px])细胞。[/size][size=16px]([/size][size=16px]5[/size][size=16px])染色:[/size][size=16px]a[/size][size=16px].[/size][size=16px]将细胞[/size][size=16px]用冷[/size][size=16px]PBS[/size][size=16px]洗涤[/size][size=16px]3[/size][size=16px]次,然后[/size][size=16px]重悬细胞[/size][size=16px]在[/size][size=16px]密[/size][size=16px]度为[/size][size=16px]1.5[/size][font='arial'][size=16px]×[/size][/font][size=16px]10[/size][font='times new roman'][size=16px]6[/size][/font][size=16px]/[/size][size=16px]mL[/size][size=16px]的[/size][size=16px]1[/size][font='arial'][size=16px]×[/size][/font][size=16px]结合缓冲液中。[/size][size=16px]b[/size][size=16px].[/size][size=16px]将[/size][size=16px]100[/size][size=16px] [/size][size=16px]μ[/size][size=16px]L[/size][size=16px]的溶液[/size][size=16px](1×10[/size][font='times new roman'][size=16px]5[/size][/font][size=16px]个细胞[/size][size=16px])[/size][size=16px]转移到[/size][size=16px]5[/size][size=16px] mL[/size][size=16px]培养管中。[/size][size=16px]c[/size][size=16px].[/size][size=16px]加入[/size][size=16px]1[/size][size=16px] [/size][size=16px]μ[/size][size=16px]L [/size][size=16px]FITC Annexin V[/size][size=16px]和[/size][size=16px]1[/size][size=16px] [/size][size=16px]μ[/size][size=16px]L[/size][size=16px] PI[/size][size=16px]。[/size][size=16px]d[/size][size=16px].[/size][size=16px]轻轻[/size][size=16px]拍打[/size][size=16px]细胞,[/size][size=16px]避光、室温[/size][size=16px] [/size][size=16px](25°C)[/size][size=16px] [/size][size=16px]孵育[/size][size=16px]15[/size][size=16px] min[/size][size=16px]。[/size][size=16px]e[/size][size=16px].[/size][size=16px]向每管中加入[/size][size=16px]400[/size][size=16px] [/size][size=16px]μ[/size][size=16px]L[/size][size=16px]的[/size][size=16px]1[/size][font='arial'][size=16px]×[/size][/font][size=16px] [/size][size=16px]Annexin V[/size][size=16px]。[/size][size=16px]1[/size][size=16px] h[/size][size=16px]内进行流式细胞仪分析。[/size][size=18px]克隆形成实验[/size][size=16px]H446[/size][size=16px]、[/size][size=16px]DMS114[/size][size=16px]采用平板克隆实验,[/size][size=16px]H69[/size][size=16px]、[/size][size=16px]H526[/size][size=16px]采用软琼脂克隆实验。[/size][size=16px]用公式[/size][size=16px]克隆形成率[/size][size=16px]=[/size][size=16px]克隆形成数[/size][size=16px]/[/size][size=16px]接种细胞数[/size][font='arial'][size=16px]×[/size][/font][size=16px]100[/size][size=16px]%[/size][size=16px]计算克隆形成率。[/size][size=16px]([/size][size=16px]1[/size][size=16px])铺板[/size][size=16px] [/size][size=16px]取[/size][size=16px]对数生长期[/size][size=16px] H446[/size][size=16px]、[/size][size=16px]H[/size][size=16px]69[/size][size=16px]、[/size][size=16px]H[/size][size=16px]526[/size][size=16px]、[/size][size=16px]D[/size][size=16px]MS114[/size][size=16px]细胞,[/size][size=16px]计数,分别接种等量细胞至[/size][size=16px]6[/size][size=16px]孔板,[/size][size=16px]“[/size][size=16px]十字形[/size][size=16px]”[/size][size=16px]晃动使细胞分布均匀,[/size][size=16px]继续培养[/size][size=16px]。[/size][size=16px] [/size][size=16px]([/size][size=16px]2[/size][size=16px])药物处理[/size][size=16px] [/size][size=16px]待细胞融合率约[/size][size=16px]80[/size][size=16px] [/size][size=16px]%[/size][size=16px],[/size][size=16px]用[/size][size=16px]不同浓度([/size][size=16px]0[/size][size=16px]、[/size][size=16px]IC20[/size][size=16px]、[/size][size=16px]IC50[/size][size=16px])[/size][size=16px]西达本胺处理细胞[/size][size=16px]4[/size][size=16px]8[/size][size=16px] [/size][size=16px]h[/size][size=16px]后进行克隆形成实验。每组均设置[/size][size=16px]D[/size][size=16px]MSO[/size][size=16px]对照组。[/size][size=16px]([/size][size=16px]3[/size][size=16px])平板克隆形成实验[/size][size=16px]此方法[/size][size=16px]适用于贴壁生长的细胞[/size][size=16px]。[/size][size=16px]a[/size][size=16px].[/size][size=16px]西达本胺处理[/size][size=16px]4[/size][size=16px]8[/size][size=16px] [/size][size=16px]h[/size][size=16px]后[/size][size=16px]的[/size][size=16px]H[/size][size=16px]446[/size][size=16px]、[/size][size=16px]D[/size][size=16px]MS114[/size][size=16px]细胞,用胰酶消化[/size][size=16px]并计数。[/size][size=16px] [/size][font='times new roman'][size=16px]b.[/size][/font][font='times new roman'][size=16px]接种细胞:将细胞接种于[/size][/font][font='times new roman'][size=16px]6[/size][/font][font='times new roman'][size=16px]孔板中,[/size][/font][font='times new roman'][size=16px]H[/size][/font][font='times new roman'][size=16px]446[/size][/font][font='times new roman'][size=16px]接种密度为[/size][/font][font='times new roman'][size=16px]4[/size][/font][font='times new roman'][size=16px]×[/size][/font][font='times new roman'][size=16px]1[/size][/font][font='times new roman'][size=16px]0[/size][/font][font='times new roman'][size=16px]3[/size][/font][font='times new roman'][size=16px]/[/size][/font][font='times new roman'][size=16px]孔,[/size][/font][font='times new roman'][size=16px]D[/size][/font][font='times new roman'][size=16px]MS114[/size][/font][font='times new roman'][size=16px]接种密度[/size][/font][font='times new roman'][size=16px]500[/size][/font][font='times new roman'][size=16px]/[/size][/font][font='times new roman'][size=16px]孔,注意一定让[/size][/font][font='times new roman'][size=16px]细胞均匀[/size][/font][font='times new roman'][size=16px]分布[/size][/font][font='times new roman'][size=16px]。于[/size][/font][font='times new roman'][size=16px] 37℃[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]5% CO2 [/size][/font][font='times new roman'][size=16px]静置培养[/size][/font][font='times new roman'][size=16px] [/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]-[/size][/font][font='times new roman'][size=16px]3[/size][/font][font='times new roman'][size=16px]周(终止培养时间以不于[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]周而且克隆之间不发生融合为标准)。[/size][/font][font='times new roman'][size=16px]c[/size][/font][font='times new roman'][size=16px].[/size][/font][font='times new roman'][size=16px]出现肉眼可见的克隆时,终止培养。弃去[/size][/font][font='times new roman'][size=16px]旧培养基[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px][color=#4472c4] [/color][/size][/font][font='times new roman'][size=16px]用[/size][/font][font='times new roman'][size=16px]PBS [/size][/font][font='times new roman'][size=16px]清[/size][/font][font='times new roman'][size=16px]洗[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]次[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]4%[/size][/font][font='times new roman'][size=16px]多聚甲醛[/size][/font][font='times new roman'][size=16px]固定液[/size][/font][font='times new roman'][size=16px]固定[/size][/font][font='times new roman'][size=16px] 20[/size][/font][font='times new roman'][size=16px] min[/size][/font][font='times new roman'][size=16px],随后[/size][/font][font='times new roman'][size=16px]去除固定液,加适量结晶紫染色[/size][/font][font='times new roman'][size=16px]30[/size][/font][font='times new roman'][size=16px] min[/size][/font][font='times new roman'][size=16px],用[/size][/font][font='times new roman'][size=16px]蒸馏水[/size][/font][font='times new roman'][size=16px]洗去[/size][/font][font='times new roman'][size=16px]结晶紫[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]晾干,用扫描仪扫描成图片。[/size][/font][font='times new roman'][size=16px]d[/size][/font][font='times new roman'][size=16px].[/size][/font][font='times new roman'][size=16px]在低倍镜[/size][/font][font='times new roman'][size=16px]下[/size][/font][font='times new roman'][size=16px]计数大于[/size][/font][font='times new roman'][size=16px]50[/size][/font][font='times new roman'][size=16px]个细胞的克隆数。[/size][/font][font='times new roman'][size=16px]e.[/size][/font][font='times new roman'][size=16px]计算克隆形成率。[/size][/font][size=16px]([/size][size=16px]4[/size][size=16px])[/size][size=16px]软琼脂[/size][size=16px]克隆形成实验[/size][font='times new roman'][size=16px]适用于悬浮生长的细胞以及繁殖较快的贴壁细胞。[/size][/font][font='times new roman'][size=16px]a[/size][/font][font='times new roman'][size=16px].[/size][/font][font='times new roman'][size=16px]配胶液:[/size][/font][font='times new roman'][size=16px]用蒸馏水[/size][/font][font='times new roman'][size=16px]和琼脂糖粉配制浓度为[/size][/font][font='times new roman'][size=16px]0.6%[/size][/font][font='times new roman'][size=16px]和[/size][/font][font='times new roman'][size=16px]0.3%[/size][/font][font='times new roman'][size=16px]的[/size][/font][font='times new roman'][size=16px]琼脂糖液,高压灭菌[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]置于[/size][/font][font='times new roman'][size=16px]42[/size][/font][font='times new roman'][size=16px]℃[/size][/font][font='times new roman'][size=16px]水浴锅中,目的是为了使其保持融化状态。[/size][/font][font='times new roman'][size=16px]b[/size][/font][font='times new roman'][size=16px].[/size][/font][font='times new roman'][size=16px]配制含[/size][/font][font='times new roman'][size=16px]20%[/size][/font][font='times new roman'][size=16px] [/size][/font][font='times new roman'][size=16px]FBS[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]×[/size][/font][font='times new roman'][size=16px]双抗的[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]×[/size][/font][font='times new roman'][size=16px]1640[/size][/font][font='times new roman'][size=16px]培养基,用[/size][/font][font='times new roman'][size=16px]0.22[/size][/font][font='times new roman'][size=16px] [/size][/font][font='times new roman'][size=16px]m[/size][/font][font='times new roman'][size=16px]的滤器过滤除菌。[/size][/font][font='times new roman'][size=16px]c[/size][/font][font='times new roman'][size=16px].[/size][/font][font='times new roman'][size=16px]铺下层胶:[/size][/font][font='times new roman'][size=16px]将[/size][/font][font='times new roman'][size=16px]0.6%[/size][/font][font='times new roman'][size=16px]的琼脂糖胶[/size][/font][font='times new roman'][size=16px]液[/size][/font][font='times new roman'][size=16px]与[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]×[/size][/font][font='times new roman'][size=16px]1640[/size][/font][font='times new roman'][size=16px]培养基[/size][/font][font='times new roman'][size=16px]等体积[/size][/font][font='times new roman'][size=16px]混合,[/size][/font][font='times new roman'][size=16px]以[/size][/font][font='times new roman'][size=16px]每孔[/size][/font][font='times new roman'][size=16px]1.5[/size][/font][font='times new roman'][size=16px] mL[/size][/font][font='times new roman'][size=16px]加[/size][/font][font='times new roman'][size=16px]至[/size][/font][font='times new roman'][size=16px]6[/size][/font][font='times new roman'][size=16px]孔板中,室温[/size][/font][font='times new roman'][size=16px]等其[/size][/font][font='times new roman'][size=16px]凝固。[/size][/font][font='times new roman'][size=16px]d.[/size][/font][font='times new roman'][size=16px]细胞计数:将细胞用[/size][/font][font='times new roman'][size=16px]PBS[/size][/font][font='times new roman'][size=16px]洗一遍,离心,加入新的培养基混匀稀释,[/size][/font][font='times new roman'][size=16px]计数。[/size][/font][font='times new roman'][size=16px]H[/size][/font][font='times new roman'][size=16px]69[/size][/font][font='times new roman'][size=16px]以[/size][/font][font='times new roman'][size=16px]8[/size][/font][font='times new roman'][size=16px]×[/size][/font][font='times new roman'][size=16px]1[/size][/font][font='times new roman'][size=16px]0[/size][/font][font='times new roman'][size=16px]3[/size][/font][font='times new roman'][size=16px]/[/size][/font][font='times new roman'][size=16px]孔铺入[/size][/font][font='times new roman'][size=16px]6[/size][/font][font='times new roman'][size=16px]孔板,[/size][/font][font='times new roman'][size=16px]H[/size][/font][font='times new roman'][size=16px]526[/size][/font][font='times new roman'][size=16px]以[/size][/font][font='times new roman'][size=16px]5[/size][/font][font='times new roman'][size=16px]×[/size][/font][font='times new roman'][size=16px]1[/size][/font][font='times new roman'][size=16px]0[/size][/font][font='times new roman'][size=16px]3[/size][/font][font='times new roman'][size=16px]/[/size][/font][font='times new roman'][size=16px]孔铺入[/size][/font][font='times new roman'][size=16px]6[/size][/font][font='times new roman'][size=16px]孔板。[/size][/font][font='times new roman'][size=16px]e.[/size][/font][font='times new roman'][size=16px]铺上层胶:[/size][/font][font='times new roman'][size=16px]将[/size][/font][font='times new roman'][size=16px]0.3%[/size][/font][font='times new roman'][size=16px]的琼脂糖胶[/size][/font][font='times new roman'][size=16px]液[/size][/font][font='times new roman'][size=16px]与[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]×[/size][/font][font='times new roman'][size=16px]培养基[/size][/font][font='times new roman'][size=16px]1[/size][/font][font='times new roman'][size=16px]:[/size][/font][font='times new roman'][size=16px]1[/size][/font][font='times new roman'][size=16px]混合,加入[/size][/font][font='times new roman'][size=16px]100[/size][/font][font='times new roman'][size=16px] [/size][/font][font='times new roman'][size=16px]μ[/size][/font][font='times new roman'][size=16px]L[/size][/font][font='times new roman'][size=16px]细胞悬液[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]混匀后,每孔加入[/size][/font][font='times new roman'][size=16px]1.5[/size][/font][font='times new roman'][size=16px] mL[/size][/font][font='times new roman'][size=16px]混合液[/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]f.[/size][/font][font='times new roman'][size=16px]放入[/size][/font][font='times new roman'][size=16px]37℃[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]5%CO[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]培养箱培养,约[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]-3[/size][/font][font='times new roman'][size=16px]周后[/size][/font][font='times new roman'][size=16px]终止培养[/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]g.[/size][/font][font='times new roman'][size=16px]计数比较对照组与实验组的细胞数量,计算克隆形成率。[/size][/font]
一、实验目的了解稀释平板计数的原理,掌握涂抹平板培养法和混合平板培养法,认识细菌、放线菌、霉菌的菌落特征。二、实验原理 稀释平板计数是根据微生物在固体培养基上所形成的单个菌落,即是由一个单细胞繁殖而成这一培养特征设计的计数方法,即一个菌落代表一个单细胞。计数时,首先将待测样品制成均匀的系列稀释液,尽量使样品中的微生物细胞分散开,使成单个细胞存在(否则一个菌落就不只是代表一个细胞),再取一定稀释度、一定量的稀释液接种到平板中,使其均匀分布于平板中的培养基内。经培养后,由单个细胞生长繁殖形成菌落,统计菌落数目,即可计算出样品中的含菌数。此法所计算的菌数是培养基上长出来的菌落数,故又称活菌计数。一般用于某些成品检定(如杀虫菌剂等)、生物制品检验、土壤含菌量测定及食品、水源的污染程度的检验。三、实验器材 1.活材料:苏云金芽孢杆菌(Bacillus thuringiensis)菌剂。2.培养基:牛肉膏蛋白胨琼脂培养基(附录三、1)3.器材:90ml无菌水、9ml无菌水、无菌平皿、lml无菌吸管、天平、称样瓶、记号笔、玻璃刮铲等。四、实验方法 1.样品稀释液的制备 准确称取待测样品l0g,放入装有90ml无菌水并放有小玻璃珠的250ml三角瓶中,用手或置摇床上振荡20 min,使微生物细胞分散,静置20-30s,即成10-1稀释液;再用1ml无菌吸管,吸取10-1稀释液lml,移入装有9ml无菌水的试管中,吹吸3次,让菌液混合均匀,即成10-2稀释液;再换一支无菌吸管吸取10-2稀释液1 ml,移入装有9ml无菌水的试管中,也吹吸三次,即成l0-3稀释液;以此类推,连续稀释,制成10-4、10-5、10-6、10-7、10-8、10-9等一系列稀释菌液(图22-1)。图22-1 平板计数法中样品的稀释和稀释液的取样培养用稀释平板计数时,待测菌稀释度的选择应根据样品确定。样品中所含待测菌的数量多时,稀释度应高,反之则低。通常测定细菌菌剂含菌数时,采用10-7、10-8、10-9稀释度,测定土壤细菌数量时,采用10-4、10-5、10-6稀释度,测定放线菌数量时,采用l0-3、10-4、10-5稀释度,测定真菌数量时,采用10-2、10-3、10-4稀释度。2.平板接种培养 平板接种培养有混合平板培养法和涂抹平板培养法两种方法。 (1)混合平板培养法 将无菌平板编上10-7、10-8、10-9[fo
做cell biology实验,细胞铺板大概是最常见的一个实验了。但是有很多人不是很得要领,铺得不是均匀: 要么中间密周围稀,要么周围密中间秃顶。以下是我的一些技巧,希望可以帮助到大家。1. 一般96孔板我每孔是加100微升细胞悬液,从孔的左边靠近底部加入,加完半边板后,将未加的细胞悬液混一下再,继续加剩余的半边板子,都加完后盖上盖子,左手轻轻扶住板的左边,右手轻轻敲击板的右边缘,注意把握力度(我一般轻巧敲三下),太强或次数太多会导致细胞集中成堆,将板顺时针旋转(逆时针效果不好),依次敲击剩余三个边,静置约5分钟,放入37度培养箱。 6孔板12孔板或24孔板,我均采用将第一个孔加入少量无血清培养基,晃动浸润整个孔底,然后用移液枪吸至第二孔,同样方法浸润孔底,其它孔一次类推,这样整个孔底都是湿润的,细胞悬液会平铺在整个孔底,加细胞悬液的时候可以避免加在中间中间细胞多,而加在周边晃匀后周边细胞多中间少的现象,细胞分散较均匀,注意加完细胞悬液后要放工作台静置一下。这个方法就是有点慢,但操作熟练了也不慢。也可以采用轻拍的方式,但力度没有96孔板好掌握,效果没有96孔板好,所以我放弃改用浸润孔底的方法。2.细胞悬液加完后,将细胞培养板抬高,对着灯光,从底部往上看,看细胞有没有抱团。然后从底部敲击,使之分散。3. 如果实验室有平板振荡器的话,我建议用这个仪器稍振荡一下,效果不错,就是振幅小,频率高的那种。4. 细胞要尽量打散,大部分呈单个状态。离心后,要充分悬浮!还有转移到六孔板后,是要晃得!晃的时候最好不要让那个细胞液转圈,不然细胞就全被带到中间去了,就会不均匀!5. 一瓶细胞长满后,正常处理,在培养瓶里吹匀,然后铺6孔板,每孔2毫升,铺完之后不用观察直接用酒精棉擦拭,然后放到培养箱里,轻微的左三圈右三圈 前三圈 后三圈。基本上24小时之后观察 每孔的细胞都会很均匀。6.计算好所需要的全部液体量和细胞量,混匀后,加到六孔板里,六孔板按横8字型晃,显微镜下观察,如果不均匀,按上述方法再晃。如果细胞未计数直接种的话,在种六孔板的过程中,随时晃一下混匀用的瓶子,瓶子我通常是顺时针或逆时针转圈。7.放在水平板面上先上下移动,再左右移动,每个方向5到6次,但关键的是摇完后最好直接放入培养箱中,不要再做过多的运动,例如放到镜下去看,否则很容易就又聚到中间去了。
一、实验原理稀释平板测数是根据微生物在高度稀释条件下固体培养基上所形成的单个菌落是由一个单细胞繁殖而成这一培养特征设计的计数方法,即一个菌落代表一个单细胞。计数时,首先将待测样品制成均匀的繁殖稀释液,尽量使样品中的微生物细胞分散开,使其成单个细胞存在,否则一个菌落就不只是代表一个细胞,再取一定稀释度、一定量的稀释液接种到平板中,使其均匀分布于平板中的培养基内。经培养后,由单个细胞生长繁殖形成菌落,统计菌落数目,即可计算出样品中的含菌数。此记数方法所计算的菌数是培养基上长出来的菌落数,故又称活菌计数。一般用于某些产品检定,如根瘤菌剂等产品检定,生物制品检验,土壤含菌量测定及食品、水源的污染程度的检验。自然条件下,微生物常以群落状态存在,这种群落往往是不同种类微生物的混合体。为了研究某种微生物的特性或者要大量培养和使用某种微生物,必须从这些混杂的微生物群落中获得纯培养,这种获得纯培养的方法称为微生物的分离与纯化。在自然界中,土壤是微生物生活的良好环境,其中生活的微生物数量和种类都是极其丰富的,因此土壤是人类开发利用微生物资源的重要基地。土壤中的微生物数量、种类与土壤肥力有关,肥沃的土壤中多,贫瘠土壤中少。其生理类群则与土壤的其它理化性质,如通气、pH有关,例如在通气良好的菜园土中,好气性微生物占有绝对优势。本实验以菜园土为材料分离土壤中的好气性细菌,并进行数量测定。分离微生物时,一般是根据该微生物对营养、pH、氧气等要求的不同,供给它们适宜的生活条件,或加入某种抑制剂造成只利于该菌种生长,不利于其它菌种生长的环境,从而淘汰不需要的菌种。分离微生物常用的方法有稀释平板分离法和划线分离法,根据不同的材料,可以采用不同方法,其最终目的是要在培养基上出现欲分离微生物的单个菌落,必要时再对单个菌落进一步分离纯化。在用稀释平板分离微生物时,还可以同时测定待分离的微生物的数量。放线菌与细菌同属原核微生物,是重要的抗生素产生菌,在土壤中的数量仅次于细菌,尤其是在有机质丰富、透气性好的中性到微碱性土壤中的数量较多。本实验采用高氏一号琼脂培养基分离和计数菜园土中的放线菌。真菌在土壤中的数量次于细菌和放线菌,主要在有机质丰富、透气性好的偏酸性土壤中较多。分离土壤中的真菌并不难,但由于其菌落大,容易扩展,计数准确性较低。本实验采用加有氯霉素或庆大霉素和孟加拉红的马丁氏培养基分离及计数菜园土中的真菌。按一般资料介绍为链霉素,但此种抗生素要先配成一定浓度的溶液,且应于倒平板前才加入培养基中。在此培养基上,放线菌和细菌被氯霉素或庆大霉素和孟加拉红所抑制,但大多数真菌能够生存,且其菌落受孟加拉红的抑制而较小,从而避免了某些真菌的扩散蔓延而带来的数量上的误差。
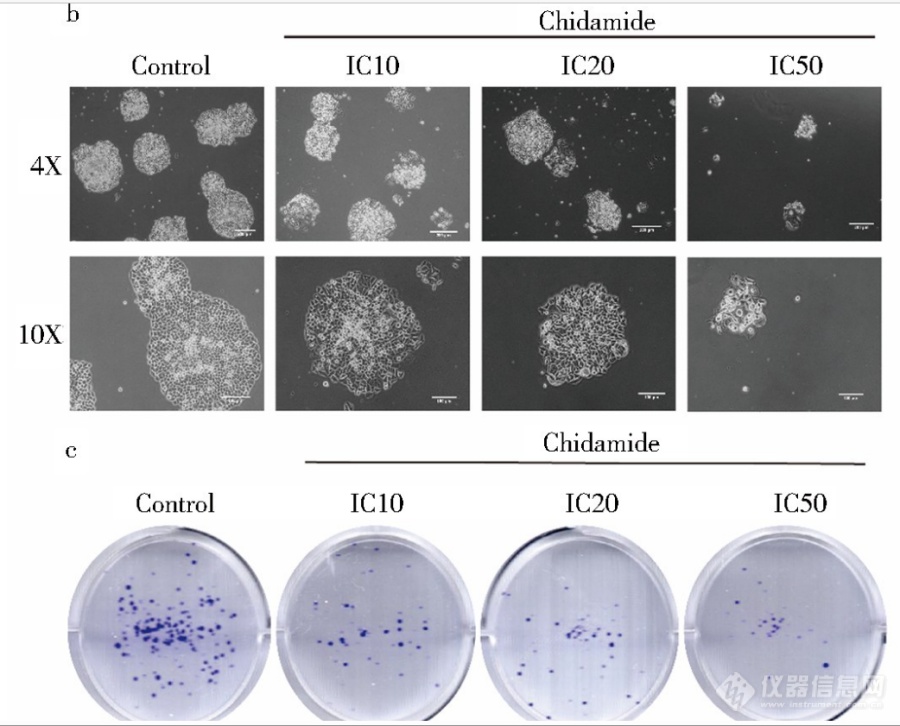
显微镜下西达本胺影响细胞克隆平板克隆的结果显示,随着加药浓度的增加克隆集落数减少,且单个集落体积逐渐减小(图 b).平板克隆结晶紫染色结果同样印证了上述结果,集落数明显减少(图c).由此可见,西达本胺显著影响 了结肠癌细胞的生物学形态和克隆形成能力. [img]https://ng1.17img.cn/bbsfiles/images/2023/06/202306302201105759_3735_5389809_3.png[/img]
[align=center][font='calibri'][size=13px]生乳体细胞检测[/size][/font][/align]1、 [size=18px]生乳体细胞检测目的及意义[/size][size=18px]体细胞数的英文是Somatic Cell Count , 缩写为SCC是指出现在正常牛奶中少量的动物身体细胞。以每毫升牛奶中的体细胞数表示,通常以千个计数。体细胞( scc ) 的组成,白细胞 (即巨噬细胞、嗜中性白细胞和淋巴细胞)和上皮细胞。[/size][size=18px]体细胞(SCC)越低牛奶质量越高SCC越高对原奶质量的影响越大,并对牛奶的保质期和乳制品如酸奶、奶酪等的产量、质量、风味等产生极大的不利影响。因此各国都将体细胞数作为牛奶质量标准中最重要的指标之一。[/size]2、 [size=18px]检测原理[/size][size=18px]采用荧光染色自动镜检原理,染色剂外无需额外的化学试剂;干粉式染色剂无需要样品稀释液。排除液体染色剂挥发的影响;体细胞检测范围1-1000万,建议有效计数范围为5万以上。[/size]3、 [size=18px]操作过程[/size][align=left][size=18px]第一步:充分搅拌后在取样瓶中用 100ul 的[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url]抽取 [/size][size=18px]100ul [/size][size=18px]奶[/size][size=18px],[/size][size=18px]加入到染色瓶中;第二步:把加入奶样后的染色剂瓶放置在搅拌器上,按 2 秒,松 [/size][size=18px]2 [/size][size=18px]秒,共搅拌 [/size][size=18px]10 [/size][size=18px]次, 静止 [/size][size=18px]2 [/size][size=18px]分钟让它充分染色,然后再放在搅拌器上按压搅拌 [/size][size=18px]3 [/size][size=18px]次。第三步:打开盖子,用另外一个[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url]取样出 8ul 奶样在检测板半圆孔处缓慢排出,无需排气, 让样品慢慢渗过去,然后静置 [/size][size=18px]30 [/size][size=18px]秒,直至对面直线处充满样品。[/size][/align][align=left]4、 [size=18px]注意事项[/size][/align][align=left][size=18px]1、开机时,先接电源,打开机器,最后开平板,避免第二步自检不成功[/size][/align][align=left][size=18px]2、在进行检测时,若点击按钮没有反应,则机器可能进入了仿真模式,若出现 [/size][/align][align=left][size=18px]这种情况,可返回自检界面,调整箭头所指模式即可。[/size][/align][align=left]3、 [size=18px]仪器使用较长时间后,会出现卡顿现象,这种情况下可以清除以往检测数据,点击参数选项,进入页面。[/size][/align][align=left][size=18px]4、仪器使用时,请勿在平板上下载游戏,视频等占内存的软件,避免出现卡顿现象。 [/size][/align][align=left][size=18px]5[/size][size=18px]、仪器使用结束后,关机时请先关闭平板,再关闭机器,最后拔下电源。[/size][/align]
关键词(必填项目):胚胎干细胞培养目的(必填项目):正确规范胚胎干细胞培养背景知识(选填项目):无。原理(选填项目):无主体内容:目录一、细胞二、一般培养-保持胚胎干细胞处于未分化状态培养基细胞复苏冻存细胞明胶包被细胞传代三、体外分化培养基包被有多聚鸟氨酸/纤维结合蛋白的培养板(使用或不使用盖玻片)体外分化方法四、移植细胞的准备细胞多能性胚胎干细胞产生于小鼠胚泡1.表达绿色荧光蛋白(EGFP)的B5-ES细胞。由Dr. Nagy的实验室制备。2.D3-ATCC; CRL-1934. 我们得到时大约传了17代。3.J1-由Dr. Jaenish的实验室友情提供。我们得到时大约传了7-9代。4.J1rtTA-rtTA表达J1细胞,由Dr. Jaenish的实验室友情提供。5.表达黄色荧光蛋白的YC5-ES细胞,由Dr. Nagy的实验室提供。一般培养--维持ES细胞处于未分化状态ES细胞培养用含有ESGRO(白血病抑制因子)的高糖培养基来阻止细胞的分化。为细胞提供包被有0.1%明胶的平板作为粘附细胞的基质。建议每2-3天从达到80%-90%融合的平板按1:8的比率传代细胞一次,细胞传代以后,在将细胞接种在0.1%明胶包被的培养皿之前,通过预先将细胞接种在没有经过包被的组织培养板2个小时,使分化细胞粘附,从而将分化和未分化细胞分开。将细胞全程置于37℃,5%CO2,100%湿度条件下培养。培养基ES:配制一20×不含DMEM,HS,ESGRO的溶液(该溶液也能用于EB培养基--见下文)。分装在50ml FALCON管中,(稀释为2×,每管42ml),贮存在-20℃。通过将21ml该溶液,HS和ESGRO加入450mlDMEM中制备培养基,0.2μm滤膜过滤。贮存于4℃。 注:一瓶DMEM是500ml。贮存液 DMEM(高糖) [/s
感受态是指细菌处于容易吸收外源DNA的状态。转化是指质粒DNA或以它为载体构建的重组子导人细菌的过程。其原理是细菌处于0℃,CaCl2低渗溶液中,菌细胞膨胀成球形。转化混合物中的DNA形成抗DNA酶的羟基—钙磷酸复合物粘附于细胞表面,经42℃短时间热击处理,促进细胞吸收DNA复合物。将细菌放置在非选择性]培养基[/url]中保温一段时间,促使在转化过程中获得的新的表型(如Amp[sup]r[/sup]等)得到表达,然后将此细菌培养物涂在含有氨苄青霉素的选择性[://]培养基[/url]上。重组质粒转化宿主细胞后,还需对转化菌落进行筛选鉴定。利用α互补现象进行筛选是最常用的一种鉴定方法。现在使用的许多载体都具有一段大肠杆菌β半乳糖苷酶的启动子及其编码α肽链的DNA序列,此结构称为[i]lac[/i]Z'基因。[i]lac[/i]Z'基因编码的α肽链是β半乳糖苷酶的氨基端的短片段(146个氨基酸)。任何携带着[i]lac[/i]Z'基因的质粒载体转化了染色体基因组存在着此种β半乳糖苷酶突变的大肠杆菌细胞后,便会产生出有功能活性的半乳糖苷酶,在IPTG(异丙基β—D—硫代半乳糖苷)诱导后,在含有Xgal(5-溴-4-氯-3-吲哚-6-D-半乳糖苷)的培养基平板上形成蓝色菌落(半乳糖苷酶能将无色的化合物Xgal切割成半乳糖和深蓝色的底物5-溴-4-靛蓝)。而当有外源DNA片段插入到位于[i]lac[/i]Z'中的多克隆位点后,就会破坏α肽链的阅读框,从而不能合成与受体菌内突变的β半乳糖苷酶相互补的活性α肽,而导致不能形成有功能活性的β半乳糖苷酶,也就不能分解Xgal而显蓝色,因此含有重组质粒载体的克隆往往是白色菌落。[仪器、材料与试剂](一) 仪器和材料 超净工作台、低温离心机、恒温摇床、恒温箱、恒温水浴、离心管、试管、培养皿、锥形瓶、接种针、玻璃涂棒、酒精灯、镊子、牙签、大肠杆菌DH5a 、质粒(二) 试剂0.1mol/L CaCl2溶液 LB液体培养基 LB固体培养基 氨苄青霉素(Amp):用无菌水配制成100mg/mL溶液,置—20℃冰箱保存。Xgal:将Xgal溶于二甲基甲酰胺,配成20mg/mL,不需过滤灭菌,分装小包装,避光贮存于-20℃。IPTG:取2g IPTG溶于8mL双蒸水中,再用双蒸水补至10mL,用0.22um滤膜过滤除菌,每份1mL,贮存于-20℃。[实验步骤](一) 制备感受态细胞1、吸取15µl E.coil菌液,接种于20ml LB液体培养基中,37℃振荡培养过夜,待OD600=0.5左右将该菌悬液以1:50接种量转于50ml LB液体培养基中,37℃振荡扩大培养,当培养液开始出现混浊后,每隔20-30min测一次OD600,至OD600=0.6左右,停止培养。2、培养液转入离心管中,在冰浴10min,4℃下5000rpm离心10min。3、弃上清液,用4ml冰预冷的0.1M CaCl2溶液轻轻悬浮菌体至均匀,冰上放置30min。4、4℃下5000rpm离心6min。5、弃上清液,用2ml冰预冷的0.1M CaCl2溶液轻轻悬浮菌体至均匀,冰上放置片刻后即制成感受态细胞悬液。6、以上制好的感受态细胞悬液可在冰上放置,24小时内直接用于转化实验,也可加入15%高压灭菌过的甘油,混匀后,分装于1.5ml离心管中,每管100µ l感受态细胞悬液,置-70℃条件下保存。.(二) 质粒DNA转化大肠杆菌1、取100µl摇匀后的感受态细胞悬浮液(如是冷冻保存液,则需化冻后马上进行下面的操作),加入5µl连接产物,轻轻摇匀,冰上放置30min后,于42 IPTG水浴中保温90s,然后迅速在冰上冷却2min。2、加入900µl LB液体培养基,则总体积约1ml,混匀于37℃振荡培养90分钟使受体菌恢复正常生长状态并使转化体产生抗药性Amp[sup]r[/sup]。3、在预制的LB琼脂平板上,加40uL 20mg/mL的Xgal和4uL 200mg/mL的IPTG溶液,并用灭菌玻璃推子(酒精灯上烧后冷却),均匀涂布于琼脂凝胶表面,37℃倒置吸收。4、将恢复培养的菌体4000rpm离心5min,移去上层900µl LB培养基,用余下的100µl重悬菌体至均匀。(四) α互补现象的检查将重悬菌体均匀涂布于含X-gal+IPTG+氨苄青霉素的LB平板上,37℃倒置培养12—24h,出现菌落。其中白色菌落从理论上讲为重组克隆。如果进一步验证,可挑取多个白色菌落分别接种到1ml含有氨苄青霉素的LB液体培养基中,37℃振荡培养6-8h,然后提取质粒酶切验证,或进行菌落PCR扩增鉴定。
许多关于细胞利用的一些生物学应用,如微生物学、细胞培养、血液检查等要求我们在实验中确定细胞的浓度。细胞计数非常简单,需要有一个计数板,称为血细胞计数板,或血细胞计数器。19世纪法国解剖学家Louis-Charles Malassez发明了这种血细胞计数板。血细胞计数板是由一片较厚的特制玻片构成,中间有一个垂直线网格。网格的尺寸是给定的,因此每条线覆盖的区域是已知的,这样就可以对一定体积内的溶液中的细胞数量进行计数,为后期的血细胞检测奠定基础。最为常见的血细胞计数板类型的中部有一个“H”形结构,上面有两个像镜子一样抛光的网格表面,并可在上面加上外罩。加载血细胞计数板开始进行计数之前,用擦镜纸拭去灰尘颗粒,确保血细胞计数板及其盖玻片处于洁净状态。安装在血细胞计数板上的盖玻片是特制的,明显厚于传统的显微镜盖玻片,这是因为它必须能够克服液滴的表面张力。确保在加载细胞悬液之前,先将盖玻片放置在计数表面,然后将吸液头和样本放进其中的一个V型孔中,并小心地挤出样本。利用毛细管作用充填盖玻片下部的区域。必须放入足够的液体以便覆盖整个镜片的表面,通常需要大约10ul,但不要溢出表面。您可以在一台血细胞计数板中加载两个样本,每个样本进入两个网格。将加载完的血细胞计数板放置在显微镜台上,然后将计数格在低倍镜焦距中显示。将样本静置几分钟,不要移动盖玻片,以免产生气泡导致计数困难。在血细胞计数板上进行血细胞计数一个血细胞计数板的整个网格包括9个方格,每个方格的面积为1mm2。血细胞计数板的中心区域有25个较大的方格,每个大的方格中又包含16个小方格。当进行计数时,仅对那些位于大方格两侧的各行中的细胞进行计数,以避免重复计数。悬液必须稀释到足够的程度,这样,细胞或其它颗粒才能均匀分布,不会再网格中相互重叠。为了判断细胞的活性,通常采用一种特殊的染色剂(如用台盼蓝稀释样本)。这种染色方法,又称为染色
感受态细胞的制备(一)制备新鲜或冷冻的大肠杆菌感受态细胞 下述操作方案是由Hanahan(1983)提供的,所制备的大肠杆菌DHl、DH5和MM249感受态细胞培养物能使每微克超螺旋DNA以≥5x108转化菌落的频率进行转化,其他大多数大肠杆菌菌株的最高转化率大约只有前述菌株的1/10-1/5。尽管如此,实际上对所有克隆方面的用途来说,这已绰绰有余。一些大肠杆菌菌株(如MC1061)不适于此法。下列有3个因素对于获得持续高的转化频率来说是至关重要的:(1)转化缓冲液中试剂的纯度 务必使用所能得到的最高质量的试剂,这些试剂应分装成小份,避光保存于冷处。(2)细胞的生长状态 由于一些不清楚的原因,直接用贮存于-70┴冰冻培养基中的贮存原种搠种而进持培养的细菌,所得到的转化效率最高,不应使用在实验中的贮存原咱接种崦进持培养的细菌,所得到的转效率最高,不应使用在实验室中连续传代,贮存于4℃或贮存于室温的培养物。(3)玻璃和塑料器皿的清洁度 痕量的去污剂或其他化学物质的存在可能大大地降低细菌的论效率,所以最好拨出一批玻璃器皿专用于制备感受态细菌,而不作它用。这些玻璃器皿应用手洗刷,再灌满纯水(Milli-Q级或与其相当的级别),然后高压灭菌,临用前方把水倒掉。细心操作的话,几乎总是可以获得转化效率高的感受态细胞,每微克超螺旋DNA可能得到5x107-1x108个转化菌落。然而甚至经验最为丰富的工作者也不可能保证持有必要用标准的螺旋质粒DNA制品来检测每一批新的感受态细胞的转化效率。制备感受态细胞前,先制备一大批黧的螺旋质粒DNA,分装成许多小份贮存于-70℃。这些标准制品可用来检验每一批新的感受态细胞的转化效率,并检查每一个实验的转化效率。设立这样一个阳性对照后,如果某一次实验得不到转化菌落,就可以根据对照的情况查明宣究竟是感受态细菌方面有庇漏,还是DNA制品间有差异。分装的感受态细菌可在-70℃保存几个月而转效率无明显下降。1)用无菌铂丝直接蘸取冻存有大肠杆菌DHl株(或DH5株、MM249株原种)(贮存于-70℃的冻培养基上,见附录A),在SOB琼脂平板表面划线, 于37℃培养16小时。将冰冻的细菌融化,铂丝在冻存细菌原种的表面划过时,已带上足量的细菌,因此一管冻存细菌原种可使用多次。2)将4-5个分隔良好的菌落转移到1ml含20mmol/L MgSo4的SOB中,菌落直径为1-2mm。中速振荡使细菌分散,然后在1L锥瓶中用30-100ml含20mmol/LMgSO4的SOB稀释培养物。3)于37℃将细菌培养0.5-3.0小时,为达到高效转化,活细胞数务必少于108细胞/ml,可每隔20-30分钟测定OD600值来检测培养物的生长情况。在菌株与菌株之间,OD600值和每毫升中活细胞数间的关系变化很大,因此有必要通过测量特定大肠杆菌菌株的生长培养物在生长周期的不同时相的OD600值,并将各稀释度的培养物铺于无抗生素的LB琼脂平皿以计算每时相的活细胞数,从而使分光光度读数得到标化。4)在无菌条件下将细菌转移到一个无菌、一次性使用的、用冰预冷的50ml聚丙烯管(Falcon 2070)中,在冰上放置10分钟,使培养物冷却至0℃。切记:下述所有步骤均需无菌操作。5)于4℃用Sorvall GS3转头(或与其相当的转头)以4000转/分离心10分钟, 回收细胞。6)倒出培养液,将管倒置1分钟以使最后残留的痕量培养液流尽。7)用约20ml(每个50ml管)用冰预冷的转化缓冲液(对于TFB''见表1.3;对于FSB,可参见表1,4)轻轻振荡,重悬沉淀(若制备需立即使用的感受态细胞可用TFB:若制备需要贮存于-70℃的感受态细胞则用FSB),将重悬细胞冰浴10分钟。8)于4℃用Sorvall GS3转头或与其相当的转头)以4000转.分离心10分钟,回收细胞。9)倒出培养液,将管倒置1分钟以使最后残留的痕量培养液流尽。10)用4ml(每个50ml管)用冰预冷的TFB或FSB轻轻振荡重悬沉淀。按步骤11)a给出的操作程序制备立即使用的感受态细胞,而步骤11)b制德贮存于-70℃留待以后使用的感受态细胞。11)a.新鲜感受态细胞的制备a)将140μl DnD溶液加到每一悬液的中心,立即轻轻旋转以混匀悬液,然后在冰上放置15分钟。DnD溶液二硫苏糖醇(DTT) 1.53gDMSO 9.0ML1mol/L乙酸钾(pH78.5) 100μl水至 10MLDnD溶液作可耐受人机溶剂的Millex SR膜(Millipore)过滤除菌,将DnD溶液分装成160μl小份放入0.5ml的无菌微量离心管中,密封管口,贮存于-20℃。DMSO的氧化产物,据推测可能是二甲硫醚,是转化的掏物。为避免这个问题,应购买质量最好的DMSO。应将所购试剂分装成10ml小份,放入无菌试管,密封管口,贮存于-70℃。每小份只用1次,用后弃去。1mol/L乙酸钾(pH7.5)的配法。b)每管再加140μlDnD溶液,轻轻旋转混匀之,将悬液置于冰上,再放15分钟。c)将小份悬液分装到冷却的无菌聚丙烯管(Falcon 2059''17x100mm)中,将管置于冰上。就大多数克隆方面的用途来说,50μl感受细胞悬液已绰绰有余。然而,如需要更大量的转化菌落(如构建cDNA文库),每小份感受态细胞的量可能需要加大些.加入DNA后,于42℃短暂加热感受态细胞,这是一个关键步骤,务必以正确的升温速度使细胞加温到正确的温度。下面给出的所有时间和温度是用Falcon 2059型管获得的数据,其他类型的管未必可产生相同的结果。b.冻存的感受态细胞的制备a)每4ml重悬细胞加140 μl DMSO,轻轻旋转混匀之,将悬液置冰上15分钟。b)每份悬液再加140μl DMSO,轻轻旋转混匀之,重新放入冰浴中。c)迅速将悬液分装到冷却的无菌的微时离心管中,封紧管口,没入液氮中快速冰冻感受态细胞。贮存于-70℃备用。就大多数克隆方面的用途来说,50μl感受态细胞悬液已绰绰有余。然而,如需要更大量的转化菌落(如构建cDNA文库),每小份感受态细胞的量可能需要加大些。d)需要时,从-70℃冰箱中取出一管感受态细胞,把管握于手民主,融化细胞。细胞一经融化,立即把管转移至冰浴中,在冰上放置10分钟。e)用一冷却的无菌吸头把感受态细胞转移到冷却的无菌聚丙烯管中(Falcon2059''17x100mm)中,放置在冰浴上。加入DNA后,于42℃短暂加热感受态细胞,这是一个关链步骤,务必以正确的升温速度使细胞如温到正确的温度。下面给出的所有时间和温度是用Falcon 2059试管获者的数据,其他类型的管未必可产生相同的结果。12)将DNA加入到感受态细胞中,轻轻旋转几认混匀内容物。在冰上放置30分钟。为得到最佳结果,DNA溶液的体积不应超过感受态细胞体积的5%。转化体的数量相对于所加入的DNA量近妣例地增加,直至系统达到饱和,尽管感受态细胞在不同批次之间有一些差异,50μl感受态细胞通常可被约lng超粒DNA所饱和。虽然再加DNA也不影响转化体的总产量,但使用过多的DNA将降低系统的效率(以每微克DNA所获转化体的数量来衡量)。当所转化的DNA很难得时(如用从相对难得的样品中提取mRNA而合成的cDNA),这就显得格外重要。为最大限度地提高转化菌落的数目,可把现有DNA分置于几小份感受态细胞中,以期系统不致饱和。试验中一定包括下面的对照:a.加入已知量的标准超螺旋质粒DNA制品的感受态细胞。b.完全不加质粒DNA的感受态细菌。13)将管放入预加温到42℃的循环水浴中放好的试管加架上,恰恰放置90秒,不要摇动试管。14)快速将管转移到冰浴中,使细胞冷却1-2分钟。15)每管加800μl SOC培养基(见附录A)。用水浴将培养基加温至37℃,然后将管转移到37℃摇床上,温育43分钏使细菌复苏并表达质粒编码的抗生素抗性标记基因。为最大限度地提高转化效率,复苏期中应温放地摇动细胞(转速225转/分)。16)将适当体积(每个90m平板达200μl)已转化的感受态细胞转移到含20mmol/L MgSO4和相应抗生素的SOB琼脂培养基上。如培养物体积太小(〈10μl),可再加肉汤培养基,用一无菌的弯头玻棒轻轻地将转化的细胞涂到琼脂平表面。如在一个90mm平板上铺200μl以上的感受态细胞,应离心浓缩细胞(于室温用Sorvall SS34转头(或与其相当的转头)以4000转/分离心10分钟),然后用适量SOC轻轻重悬细胞。如用四环素抗性作为选择标记,全部的转化混合物可以铺在一个单独的平皿上(或铺在软琼脂中)。然而如选用氨苄青霉素抗性,则只能将一部分培养物(根据实验决定)铺在单独的平皿上,氨苄青霉素抗性菌落数的曾加与平皿上所加细菌数的增加并无线性比例关系,这可能是因为被抗生素杀死的细胞可释放生长抑制物质的缘故。\par 17)将平板置于室温直至液体被吸收。18)倒置平皿,于37℃培养,12-16小时后可出现菌落。如检查氨苄青霉素抗性,用转化细胞铺平板时密度应较低(每个90mm平板不超过104菌落),于37℃培养平板时不应超过20小时。氨苄青霉素抗性的转化体可将β-内酰胺酶分泌到培养基中,迅速灭活菌落周围区域中的抗生素。这样,铺平板时懊度太高或培养时间太长都会导致出现对氨苄青霉敏感的卫星菌落。在造
[size=16px]克隆形成实验[/size][size=16px]及划痕实验[/size][size=16px]、[/size][size=16px]流式细胞术[/size][size=16px]操作步骤[/size]软琼脂克隆形成实验检测单细胞克隆形成能力软琼脂克隆形成实验适用于悬浮生长的细胞。1. 配胶液:用蒸馏水和琼脂糖粉配制浓度为 0.3% 的琼脂糖液,高压灭菌,置于42℃ 水浴锅中,目的是为了使其保持融化状态。2. 配制含 20% FBS 的 2×1640 培养基,用 0.22 ?m 的滤器过滤除菌。3. 铺下层胶:将 0.6% 的琼脂糖胶液与 2×1640 培养基等体积混合,以每孔 1.5mL 加至 6 孔板中,室温等其凝固。4. 细胞计数:将细胞用 PBS 洗一遍,离心,加入新的培养基混匀稀释,计数。H69-NC、H69-shMSI1-1、H69-shMSI1-2、H82-NC、H82-shMSI1-1、H82-shMSI1-2、H526-NC、H526-shMSI1-1、H526-shMSI1-2 均以 1×104/孔铺入 6 孔板。5. 铺上层胶:将 0.3% 的琼脂糖胶液与 2× 培养基 1:1 混合,加入 100 μL 细胞悬液,混匀后,每孔加入 1.5 mL 混合液。6. 放入 37℃,5%CO2 培养箱培养,约 2-3 周后终止培养。7. 比较细胞克隆形成能力的差异,利用 Graphpad prism5 作图计算两种细胞克隆形成能力的差异。平板克隆形成实验检测单细胞克隆形成能力平板克隆形成实验适用于贴壁生长的细胞。1. 细胞处理:将 SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2 细胞,用 PBS洗一遍,用胰酶消化并计数。2. 接种细胞: 将细胞接种于 6 孔板中, SW1271-NC 、SW1271-shMSI1-1 、SW1271-shMSI1-2 接种密度为 3×103/孔,注意一定让细胞均匀分布。于 37℃,隔离CO2 静置培养 2-3 周(终止培养时间以不小于 2 周且克隆之间不发生融合为标准)。3. 出现肉眼可见的克隆时,终止培养。弃去旧培养基, 用 PBS 清洗 2 次,用 4% 多聚甲醛固定液固定 20 min,吸除固定液,用蒸馏水清洗 2 次后加适量结晶紫染色15-20 min,用蒸馏水洗去结晶紫,自然风干,用扫描仪扫描成图片。4. 在低倍镜下计数大于 50 个细胞的克隆数。5. 计算克隆形成率。细胞划痕实验1. 用记号笔在 12 孔板底部划两条平行线做为标记。2. 将 SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2 细胞接种至 6 孔板。3. 待细胞汇合度为 90% 左右时,用 10μL 枪头垂直于两条平行标记线进行划痕。4. 吸除培养基,1xPBS 漂洗 2 次,并换用无血清培养基培养。5. 分别在划痕后培养 0h,12h,24h,48h,72h 观察细胞迁移情况并拍照。流式细胞术1. 收集 H69、H82、H526、SW1271 的对照组和实验组细胞(包括培养上清中的细胞),收集 1 - 10 ×105 个细胞,用预冷 PBS 离心洗涤。用双蒸水稀释 5 ×Binding Buffer为 1 × 工作液,取 500 μl 1 × Binding Buffer 重悬细胞。2. 每管加入 5 μl Annexin V-APC 和 10 μl 7-AAD。3. 轻柔涡旋混匀后,室温避光孵育 5 分钟。4. 上机进行分析。

http://ng1.17img.cn/bbsfiles/images/2017/10/2016082816541190_01_3092793_3.jpg YEESPEC智能细胞成像系统已全面升级:强大的配置与功能,高品质成像质量,更方便的显微操作,绝对能带给您眼前一亮的全新体验。 作为新一代的智能细胞成像系统,它比传统显微镜操作要方便许多,所有的操作工程都可以通过前面的触摸控制屏完成。只要轻轻地点几下屏幕,就可以轻松地完成整个细胞成像过程,包括:镜头切换、荧光切换、聚焦。 同时,因为设计的小巧,我们也可以把它放在培养箱或者安全柜里使用,可以边做实验室边观察。 YEESPEC智能细胞成像系统,更是科研的得力助手。与传统活细胞工作站相比,它具有更强大的功能特点。 1、 操作方便,即开即用: 采用全触控屏操作,也可以通过手机端平板端进行操作;荧光光源采用高亮度LED光源,不需要预热。 2、 成像质量好,光路的主要元器件均采用原装进口: 采用顶级CCD芯片、原装进口长工作距离荧光物镜、Omega荧光滤光片、K9光学玻璃载物台,透过率非常高。 3、 没有耗材,使用成本低: 采用高亮度白色LED,荧光光源采用高亮度单色LED。LED的寿命是5万个小时以上,基本上仪器买回去10年都不用更换。 4、保证实验安全: 内部装有两块10000mAh,12V的电池,短时间观察使用时可以不需要接电源,即使停电也可以完成实验,保证了实验安全。
[color=#5f9cef][b]二者范围不同:[/b][/color]GB4789.3-2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》范围中规定:“本标准第一法适用于大肠菌群含量较低的食品中大肠菌群的计数;第二法适用于大肠菌群含量较高的食品中大肠菌群的计数。”[color=#f96e57]这里所说的含量高低通常以100CFU为准,即含量低于100CFU采用MPN法,含量高于100CFU采用CFU法。[/color][b][color=#5f9cef]概念不同:[/color][/b][color=#f96e57]• MPN(most probable number)法:[/color]即最近似数法,也称为最可能数法,是食品检验中常用的方法。1915年,McCrady首次发表了用MPN法 (最大可能数法) 来估算细菌浓度的方法, 这是一种应用概率理论来估算细菌浓度的方法。[color=#f96e57]• 平板计数法 (colony forming units):[/color]CFU 即菌落形成单位,样品经过处理培养后我们数出平板上所生长出的菌落个数,从而计算出每毫升或每克待检样品中可以培养出多少个菌落,以CFU/ml或CFU/g报告之。[color=#f96e57]• 滤膜法(membrane filter method):[/color]将一定量水样注入已灭菌的微孔薄膜的滤器中,经过抽滤,细菌被截留在滤膜上,将滤膜贴于培养基上,经培养后计数和鉴定滤膜上生长的菌落,依据过滤水样计算每升或每100毫升水样中的菌落总数。[color=#f96e57]• 菌落:[/color]是指细菌在固体培养基上生长繁殖而形成的能被肉眼识别的生长物,它是由数以万计相同的细菌集合而成。[b][color=#5f9cef]原理不同:[/color][/b][color=#f96e57]• MPN法:[/color]利用待测微生物的特殊生理功能的选择性来摆脱其他微生物类群的干扰,并通过该生理功能的表现来判断该类群微生物的存在和丰度。因为细菌在样本内的分布是随机的,所以检测细菌时,可应用概率理论计算菌数,实验结果以MPN值表示,但MPN值并不能表示实际菌落数, 实际菌落数有可能落在置信区间内的任何一点,MPN值是落在这个置信区间内概率最大的一点。举例说:稀释度为 0.01,0.001,0.0001所对应的阳性管数分别为 2-0-0 ;查MPN检索表可知:MPN值为92 CFU/ml(g), 当置信度为95%,则其下限和上限分别为14,380,即对应的菌落浓度区间为14~380 CFU/ml(g),意思是:这个检验结果显示细菌浓度落在14-380 CFU/ml(g)区间均有可能,只不过92 CFU/ml(g)出现的概率最大,概率为31.9%. [color=#f96e57]平板计数法[/color]:平板菌落计数法是根据微生物在固体培养基上所形成的一个菌落是由一个单细胞繁殖而成的现象进行的,也就是说一个菌落即代表一个单细胞。计数时,先将待测样品作一系列稀释,样品经适当稀释后,其中的微生物充分分散为单个细胞,取一定量的稀释液接种到平板上,经过培养,由每个单细胞生长繁殖而形成的肉眼可见的菌落,即一个单菌落应代表原样品中的一个单细胞。统计菌落数,根据其稀释倍数和取样接种量即可换算出样品中的含菌数。[color=#f96e57]滤膜法:[/color]在压力差的作用下,悬浮液中的液体(或气体)透过可渗性介质(过滤介质),直径大于网孔直径的菌体为介质所截留,从而实现样品和菌体的分离。然后将滤膜放在适当的培养基上进行培养,菌体可直接在膜上生长,从而可直接计数。[b][color=#5f9cef]MPN优缺点[/color][/b][color=#f96e57]优点:[/color]操作简便、灵敏度较高,时间短,可直接观察试管得出结论,每个接种稀释度均有重复,重复次数越多,误差就会越小。[color=#f96e57]缺点:[/color]要求样品具有均一性,适合检验液体样品,且只能用于检验在发酵培养基中产气的菌种。[color=#f96e57]注意事项:[/color]需选择合适的稀释度和接种量。[b][color=#5f9cef]平板计数法优缺点[/color][/b][color=#f96e57]优点:[/color]1、能测出样品中的活菌数,直观,能够直接读数2、平板菌落计数法通常做梯度稀释,所以计数的线性范围大。3、由于是菌悬液倾注或涂布,所以比较均匀,能较好的反应菌落的疏密程度。4、灵敏,平行性较好。[color=#f96e57]缺点:[/color]1、手续较繁,而且测定值常受各种因素的影响。2、厌氧或微需氧菌、有特殊营养要求的以及非嗜中温的细菌,比较难检测出。3、菌落总数并不能区分其中细菌的种类,所以有时被称为杂菌数,需氧菌数等。4、长成的一个单菌落也可能来自样品中的2~3或更多个细胞。因此平板菌落计数的结果往往偏低。5、检验时间长。[color=#f96e57]注意事项:[/color]样品需要充分均匀以及选择合适稀释度和接种量,检验过程必须严格无菌,以防污染杂菌。[b][color=#5f9cef]滤膜法优缺点 [/color][/b][color=#f96e57]优点:[/color]1、可以检测大量的样品。2、浓缩效应使微生物检测的准确度提高。3、带有菌落的滤膜,可作为检测的永久记录存档。4、可见的菌落和样品量直接对应,得出定量结果。[color=#f96e57]缺点:[/color]1、成本高。2、操作要求高。[color=#f96e57]注意事项:[/color]对样品的流动性要求比较高,并且含菌量不能太高。[b][color=#5f9cef]分类以及操作方法[/color][/b][color=#f96e57]MPN法:[/color]根据需要以及检验的精度不一样可使用9管法以及15管法;其中9管法通常用作食品检验,而15管法用在饮用水的检验(15管法的精度要高些);基本操作:样品梯度稀释——接种——培养——观察结果——查表报告。[color=#f96e57]平板计数法:[/color]有平板倾注法,一般检验使用的方法;平板涂布法,用于细菌含量比较高,并且要求知道细菌菌落形态(只计数特定细菌);以及滤膜法,检测特定种类菌常用方法,应用越来越广泛;基本操作一般包括:样品的稀释--倾注平皿--培养48小时--计数报告。(滤膜法是:样品——过滤——贴滤膜——培养 ——计数报告。)[b][color=#5f9cef]适用性[/color][/b][color=#f96e57]MPN法:[/color]适用于具有特殊生理功能的微生物类群或者检测带有大量竞争菌的食品及其原料和未经处理的含少量金黄色葡萄球菌的食品(土壤、污水、牛奶等)。[color=#f96e57]平板计数法:[/color]应用广泛,是检验、菌种分离、纯化等用得最多的方法(固体、液体样品均可)。[color=#f96e57]滤膜法:[/color]主要应用于洁净度较高的样品,并且样品的流动性决定了可操作性。[b][color=#5f9cef]卫生学意义[/color][/b]两者都是检测的活菌数,MPN是通过极大近似值然后估计,求出分布函数中的参数、置信区间,再估计;但是CFU通过数据直接求数学期望,平均值和方差。测定结果判定食品被细菌污染的程度及卫生质量,一定程度反映食品在生产过程中是否符合卫生要求,以便对被检样品做出适当的卫生学评价。多少在一定程度上标志着食品卫生质量的优劣。
日本东京大学的研究人员宣布,他们开发出了用诱导多功能干细胞(iPS细胞)制造血小板的技术,并通过动物实验确认了制造出来的血小板具有止血功能。iPS细胞是具有较强分化潜力的干细胞,由皮肤细胞等体细胞经基因改造“诱导”发育而成。培养这类细胞不需要利用人类早期胚胎,而且可以无限增殖,因此新技术有望用于大量生产输血用的血小板。东京大学副教授江藤浩之率领的研究小组,在11月22日的美国《实验医学杂志》(Journal of Experimental Medicine)月刊上发表论文说,他们首先利用人体皮肤纤维组织母细胞和脐带血细胞制造出iPS细胞,然后加入几种血液细胞增殖因子和营养细胞,培养出能够制造血小板的巨核细胞,最终制造出血小板。研究人员将制造出的血小板输给小鼠,发现血小板集中到受伤的血管上,形成血栓,正常发挥了血小板的功能。研究人员使用了与癌症有关的cMyc基因,能够高效制造巨核细胞并生产血小板。由于血小板中不存在含有遗传信息的细胞核,而且混杂其中的其他细胞的细胞核可以通过照射放射线和过滤去除,所以临床应用时不会有癌变的危险。血小板是血液细胞之一,能够凝固血液,防止出血。手术时使用的血小板现在完全依赖献血。研究小组准备确认新技术的安全性之后,早日将其应用于手术。
目前国内对细胞破碎机的研究局限于实验研究,仅对某种结构均质阀的均质效果进行验证与分析,或是选择结构参数。实验研究的局限性使这种分析不够全面。高压细胞破碎机是目前生物工程领域广泛使用的一种细胞破碎机。作者结合近期国外对高压细胞破碎机的理论研究工作,应用半经验半理论的方法,分析探讨了高压细胞破碎机的均质理论。高压细胞破碎机的结构及工作原理: 高压细胞破碎机由高压泵和破碎阀两部分组成,高压泵通常采用柱塞往复泵,其结构与一般柱塞泵相同。破碎阀安装在柱塞泵的排出管路上,一般由阀芯和阀座构成,阀芯和阀座的结构形式对破碎效果、能耗以及阀的磨损影响极大。国外对破碎阀的结构进行了大量研究,设计出许多不同结构的破碎阀,研究主要围绕下列问题进行:1,在较低操作压力下提高破碎效果2,提高阀的使用寿命。意大利Niro Soavi公司为此,开发出R型细胞破碎阀,经过多年的实际使用,获得用户的认可。高压细胞破碎机工作原理: 高压细胞破碎机有一个或数个往复运动的柱塞,物料在柱塞作用下进入可调节压力大小的阀组中,经过特定宽度的限流缝隙(工作区)后,瞬间失压的物料以极高的流速(1000米/秒,最高可达1500米/秒)喷出,碰撞在阀组件之一的碰撞环上,产生三种效应: 空穴效应:被柱塞压缩的物料内积聚了极高的能量,通过限流缝隙时瞬间失压,造成高能释放引起空穴爆炸,致使物料强烈粉碎细化。(主要应用于均质) 撞击效应:物料通过可调节限流缝隙的以上述极高的线速度,喷射到用特殊材料制成的碰撞环上,造成物料粉碎。(主要应用于细胞破碎) 剪切效应:高速物料通过泵腔内通道和阀口狭缝时会产生剪切效应。(主要应用于乳化)经过这三种效应处理过的物料可均匀细化到0.1μm-2μm粒径。
液氮槽vaporphase长期储存。-20℃不可超过1小时,以防止胞内冰晶过大,造成细胞大量死亡,亦可跳过此步骤直接放入-80℃冰箱中,惟存活率稍微降低一些。(2)程序降温:利用已设定程序的等速降温机以-1~-3℃/分钟之速度由室温降至(-80℃以下)-120℃,再放在液氮槽vaporphase长期储存。适用于悬浮型细胞与hybridoma之保存。3、步骤:(1)冷冻前24-48小时更换半量或全量培养基,使细胞处于指数生长期。(2)配制冷冻保存溶液(使用前配制):另取一离心管,加入培养基、血清,逐滴加入二甲基亚砜(DMSO)至20%浓度,即制成双倍的冻存液,置于室温下待用。(3)离心收集培养之细胞,用加血清的培养基重悬起细胞,取少量细胞悬浮液(约0.1ml)计数细胞浓度及冻前存活率。(4)取与细胞悬液等量的冻存液,缓慢逐滴加入细胞悬液,并晃动试管,制成细胞冻存悬液(DMSO最后浓度为5~10%),使细胞浓度为1~5×106cells/ml,混合均匀,分装于已标示完全之冷冻保存管中,1~2ml/vial,并取少量细胞悬浮液作污染检测。严密封口后,注明细胞名称、代数、日期。然后进行冻存。4、注意事项:(1)欲冷冻保存之细胞应在生长良好(logphase)且存活率高之状态,约为80~90%致密度。冷冻前检测细胞是否仍保有其特有性质,例如hybridoma应在冷冻保存前一至二日测试是否有抗体之产生。(2)细胞在液氮中可长期冻存无限时间,而不会影响细胞活力;在-70度可保存数月。(3)注意冷冻保护剂之品质。DMSO应为试剂级等级,无菌且无色(以0.22micron FGLP Telflon过滤或是直接购买无菌产品,如Sigma D-2650),以5~10ml小体积分装,4℃避光保存,勿作多次解冻。Glycerol亦应为试剂级等级,以高压蒸汽灭菌后避光保存。在开启后一年内使用,因长期储存后对细胞会有毒性。本方法中先制备双倍冻存液,可避免DMSO直接加入时释放的热量对细胞的损伤。缓慢逐滴加入细胞悬液是使细胞逐步适应高渗,可降低细胞受损。DMSO可能引起部分白血病细胞株的分化,可换用10%甘油冻存。(4)冷冻保存之细胞浓度:①normal human fibroblast:1~3×106cells/ml②hybridoma:1~3×106cells/ml,细胞浓度不要太高,某些hybridoma会因冷冻浓度太高而在解冻24小时后死去。③adherent tumor lines:5~7×106,依细胞种类而异。Adenocarcinoma解冻后须较高之浓度,而HeLa只需1~3×106cells/ml④other suspensions:5~10×106cells/ml,human lymphocyte须至少5×106cells/ml。(5)冷冻保护剂浓度为5或10%DMSO,若是不确定细胞之冷冻条件,在做冷冻保存之同时,亦应作一个backup culture,以防止冷冻失败。(6)冻存可用10%~90%的血清,一般高浓度血清有助于维护细胞活力,此处介绍20%终浓度有利于细胞悬浮而少沉积(4度时),复苏存活率在80%~90%以上,对原代培养细胞,以90%血清冻存更为有效。二、冷冻细胞活化1、冷冻细胞之活化原则为快速解冻,以避免冰晶重新结晶而对细胞造成伤害,导致细胞之死亡。2、细胞活化后,约需数日,或继代一至二代,其细胞生长或特性表现才会恢复正常(例如产生单株抗体或是其它蛋白质)。3、材料37℃恒温水槽、新鲜培养基、无菌吸管/离心管/培养瓶、液氮或干冰容器4、步骤:(1)操作人员应戴防护面罩及手套,防止冷冻管可能爆裂之伤害。(2)自液氮或干冰容器中取出冷冻管,检查盖子是否旋紧,由于热胀冷缩过程,此时盖子易松掉。(3)将新鲜培养基置于37℃水槽中回温,回温后喷以70%酒精并擦拭之,移入无菌操作台内。(4)取出冷冻管,立即放入37℃水槽中快速解冻,轻摇冷冻管使其在1分钟内全部融化,以70%酒精擦拭保存管外部,移入无菌操作台内。(5)取出解冻之细胞悬浮液,缓缓加入有培养基之培养容器内(稀释比例为1:10~1:15),混合均匀,放入CO2培养箱培养。取0.1ml解冻细胞悬浮液作存活测试。(6)解冻后是否立即去除冷冻保护剂(例如DMSO或glycerol),依细胞种类而异,一般而言,大都不需要立即去除冷冻保护剂。惟若要立即去除,则将解冻之细胞悬浮液加入含有5-10ml培养基之离心管内,离心1000rpm,5分钟,移去上清液,加入新鲜培养基,混合均匀,放入CO2培养箱培养。(7)若不需立即去除冷冻保存剂,则在解冻培养后隔日更换培养基。三、细胞计数与存活测试1、原理:(1)计算细胞数目可用血球计数盘或是Coultercounter粒子计数器自动计数。(2)血球计数盘一般有二个chambers,每个chamber中细刻9个1mm2大正方形,其中4个角落之正方形再细刻16个小格,深度均为0.1mm。当chamber上方盖上盖玻片后,每个大正方形之体积为1mm2×0.1mm=1.0x10-4ml。使用时,计数每个大正方形内之细胞数目,乘以稀释倍数,再乘以104,即为每ml中之细胞数目。(3)存活测试之步骤为dyeexclusion,利用染料会渗入死细胞中而呈色,而活细胞因细胞膜完整,染料无法渗入而不会呈色。一般使用蓝色之trypan blue染料,如果细胞不易吸收trypan blue,则用红色之Erythrosin bluish。计算细胞活率:活细胞数/(活细胞数+死细胞数)×100%。计数应在台盼兰染色后数分钟内完成,随时间延长,部分活细胞也开始摄取染料;因为台盼兰对蛋白质有很强的亲和力,用不含血清的稀释液,可以使染色计数更为准确。2、材料:0.4%w/v trypan blue(GibcoBRL15250-061);Erythosin bluish stain;取0.1gram Erythrosin bluish(SigmaE-9259)及0.05gram preservative methyl paraben(SigmaH-3647)溶于100mlCa++/Mg++freesaline;血球计数盘及盖玻片(Hemocytometerandcoverslip);计数器(counter);低倍倒立显微镜;粒子计数器(Coultercounter,CoulterElectronics)。白细胞稀释液(4%乙酸溶液)。3、步骤:(1)取50μl细胞悬浮液与50μl trypan blue(orErythrosinbluish)等体积混合均匀于1.5ml小离心管中。(2)取少许混合液(约15μl)自血球计数盘chamber上方凹槽加入,盖上盖玻片,于100倍倒立显微镜下观察,活细胞不染色,死细胞则为蓝色(或红色-Erythrosin bluish)。(3)计数四个大方格之细胞总数,再除4,乘以稀释倍数(至少乘以2,因与trypanblue等体积混合),最后乘以104,即为每ml中细胞悬浮液之细胞数。若细胞位于线上,只计上线与右线之细胞(或计下线与左线之细胞)。注:4大格细胞总数×稀释倍数×104/4=细胞数/ml;每一大格的体积=0.1cm×0.1cm×0.01cm=10-4ml计数板计数时,最适浓度为5~10×105细胞/ml,此范围外计数误差偏大。高浓度细胞悬液,可取出部分作稀释或连续稀释后计数。5、范例:T75 monolayer culture制成10ml细胞悬浮液,取0.1ml溶液与0.1ml trypan blue混合均匀于试管中,取少许混合液加入血球计数盘,计数四大方格内之细胞数目。活细胞数/方格:55,62,49,59;死细胞数/方格:5,3,4,6;细胞总数=243平均细胞数/方格=60.75;稀释倍数=2;细胞数/ml:60.75×104×2(稀释倍数)=1.22×106;细胞数/flask(10ml):1.22×106×10ml=12.2×106存活率:225/243﹦92.6%
无菌操作技术不仅在微生物学研究和应用上起着举足轻重的作用,在许多生物技术中也被广泛应用,例如转基因技术、单克隆抗体技术等。 无菌室,微生物实验室内专辟的一个小房间,室外设一个缓冲间,缓冲间的门和无菌室的门不要朝向同一方向,以免气流带进杂菌。无菌室和缓冲间都必须密闭,无菌室内的地面、墙壁必须平整,不易藏污纳垢、便于清洗,室内装备的换气设备必须有空气过滤装置。工作台的台面应该处于水平状态,无菌室和缓冲间都装有紫外线灯(距离工作台面1米),工作人员进入无菌室应穿戴灭过菌的服装、帽子。 超净台,主要功能是利用空气层流装置排除工作台面上部包括微生物在内的各种微小尘埃,通过电动装置使空气通过高效过滤器具后进入工作台面,使台面始终保持在流动无菌空气控制之下。在条件较困难的地方,也可以用木制无菌箱代替超净台(正面开有两个洞,不操作时用推拉式小门挡住,操作时可以将双臂伸进去;正面上部装有玻璃,便于在内部操作,箱内部装有紫外线灯,从侧面小门可以放进去器具和菌种、细胞株等)。 微生物的培养 在微生物的培养过程中,要保持培养物纯净性;培养微生物的要领,是为所需要的微生物提供良好的生存环境,同时阻止或抑制其他微生物的生长。 (一)培养基1.认识培养基的基本组成成分,从生物体构成的基本元素这一角度理解培养基中为什么都需要具备这些基本成分。2.培养基的用途和种类:液体和固体两大类。3.不同的微生物往往需要采用不同的培养基配方;尽管培养基的配方各不相同,但是其基本成分都包括水、碳源、氮源和无机盐。4.培养基是否合格(无菌试验):培养基在恒温箱中保温1~2d后无菌落生长(液体不变浑浊),说明培养基的制备是成功的,否则需要重新制备。 (二)无菌技术 1. 无菌技术的概念无菌操作泛指在培养微生物的操作中,所有防止杂菌污染的方法。日常的生活环境中,每时每刻每处都存在着微生物,任何一个不经意的动作都可能将某种微生物引入到培养物中。在具备无菌环境和获得无菌材料后,还要始终保持无菌状态,才能对某种特定的已知微生物进行研究或利用它们的功能,否则外界的各种微生物很容易混入。外界不相干的微生物混入的现象,在微生物学叫做污染杂菌。防止污染是微生物学工作中十分关键的技术:彻底灭菌和防止污染是无菌技术的两个方面。此外,要有效避免操作者自身被微生物感染,还要防止所研究的微生物,特别是致病微生物或经过基因工程改造了的本来自然界不存在的微生物从我们的实验容器中逃逸到外界环境中去(生物安全)。无菌操作非常重要,无论是倒平板、平板划线操作,还是平板稀释涂布法,其操作中的每一步都需要做到“无菌”,只有熟练、规范地进行无菌操作,才可能成功地培养微生物。 2. 消毒与灭菌的概念(1)培养细菌用的培养基与培养皿(需要灭菌)(2)玻棒、试管、烧瓶和吸管(需要灭菌)(3)实验操作者的双手(需要消毒)(4)接种环、针、涂布棒:灼烧灭菌(外焰)。 3.倒平板(1)灭菌后,培养基冷却到55 [font='宋
一、酶消化法1、胰酶。这是用得最多的。一般浓度在0.25-0.5%。作用时间根据细胞种类、作用温度等因素而变化很大,从几分钟到几十分钟不等。0.25%的胰酶作用于单层贴壁的细胞,在37度条件下,一般消化1-5分钟就足够了。终止是用血清。主要作用于细胞间。配制时不能用含钙、镁的平衡液,否则影响活性。保存于-20度。2、胶原酶。这种方法比较少,一般是用原代培养时,从组织消化下细胞。这种方法作用温和,对细胞损伤较小,但是,价格也较贵。中止同样是用血清。二、离子螯合剂 不破坏细胞表面分子,仅与CAMs螯合,因此,如果检测细胞表面分子的话,尽量,甚至是一定不要用酶消化法。1、EDTA。用得也是非常多。一般浓度在0.02%左右。作用于细胞与间质,对细胞间也有一定作用。注意,它能显著影响pH值,而且在弱碱性条件下才易溶。因此,配制时应调节好酸碱度。它不能被终和。因此,消化下来的细胞要洗一遍。2、商品化的无酶消化液。个人的使用经常觉得对细胞的损伤比较大,但是分离成单细胞悬液的能力确实比较强。三、物理法 直接吹打或用细胞刮子将细胞刮下来。四、冷冻法 这是本人做细胞培养时发现的方法。此方法仅能用于细胞传代时。无法使组织上的细胞脱落下来。本方法的原理,我想是因细胞冷冻后收缩,从而从培养瓶上脱落下来。优点是:对细胞损伤小,不需要中止或洗细胞,方便,不需要另外配制消化液。特别适用那些贴壁不是特别紧,又特别娇气的细胞。不足是细胞常成小片脱落。此种方法曾用于因用其它方法传代导致大量细胞死亡操作的间充质干细胞、DC细胞的培养,效果非常满意。具体过程是:1、用较多的4度的PBS洗涤一遍细胞(以6孔板为例,加1.5 ml/孔);2、再加0.5 ml 4度的PBS,静置操作台上,很快细胞就小片脱落;3、轻轻吹打,细胞即完全脱落;4、按一定比例传代。
[b]离心机[/b]如何应用于红细胞压积容量测定摘要:红细胞压积(packedcellvolume,PCV)又称红细胞比容(hematocrit,Hct),是指红细胞在血液中所占容积的比值,测定时将抗凝血在一定的条件下离心沉淀,即可测得每升血液中血细胞所占容积的比值。 1原理[b]离心机[/b] 在100刻度玻璃管中,充入抗凝血至刻度,经一定时间离心后,红细胞下沉并紧压于玻璃管中,读取红细胞柱所占的百分比,即为红细胞压积容量(PCV又称压容、比容)。 2.器材 (1)温氏管:管长11cm,内径约2.5mm,管壁有100个刻度。一侧自上而下标有0~10,供测定血沉用,另一侧标有10~0,供测定比容用。如无这种特制的管子,可用有100刻度的小玻璃管代替。 (2)长针头及胶皮乳头:选用长12~15cm的针头,将针尖磨平,针柄部接以胶皮乳头。也可用细长毛细吸管代替。 (3)水平电动离心机:转速能达4000rpm者。 3.方法 (1)用长针头吸满抗凝血,插入温氏管底部,轻捏胶皮乳头,自下而上挤入血液至刻度10处。 (2)置离心机中,以3000rpm的速度离心30~45min(马的血液离心30min,牛、羊的血液离心45min),取出观察,记录红细胞层高度,再离心45min,如与第一次离心的高度一致,此时红细胞柱层所占的刻度数,即为PCV数值用%表示。 4.注意事[b]离心机[/b]项 (1)温氏管及充液用具必须干燥,以免溶血。 (2)此时,离心机的转速必须达3000rpm以上,并遵守所规定的时间。 (3)用一般离心后[b]离心机[/b],红细胞层呈斜面,读取时应取斜面1/2处所对应的刻度数。血浆与红细胞层之间的灰白层由白细胞与血小板组成,不应计算在内。 5.临床意义 (1)红细胞压积增高:见于各种原因所引起的血液浓缩,使红细胞相对性增多,如急性胃肠炎、肠便秘、肠变位、瓣胃阻塞、渗出性胸膜炎和腹膜炎,以及某些传染病和发热性疾病。由于红细胞压积增高的数值与脱水程度成正比,因此在临床上可根据这一指标的变化而推断机体的脱水情况,并计算补液的数量及判断补液量的实际效果。另外。也见于各种原因所致的红细胞绝对性增多,如真性红细胞增多症、肺动脉狭窄、高铁血红蛋白血症等。 (2)红细胞压积降低:见于各种贫血,但降低的程度并不一定与红细胞数一致,因为贫血有小细胞性贫血、大细胞性贫血及正细胞性贫血之分。
有望提供一种新的治疗癌症的方法2013年08月01日 来源: 科技日报 作者: 陈丹 科技日报讯(记者陈丹)据《自然》杂志网站8月1日(北京时间)报道,纳米钻石可用于量子计算机中处理量子信息,而哈佛大学的研究人员利用纳米钻石的量子效应,将其变为“温度计”,测量出了人类胚胎干细胞内部的温度变化,精确度是现有技术的10倍。通过加入金纳米粒子,研究人员还能够利用激光对细胞的特定部分加热甚至杀死细胞,这有望提供一种新的治疗癌症而不损害健康组织的方法,以及研究细胞行为的新手段。研究论文发表在本周的《自然》杂志上。 在这项最新研究中,研究人员使用纳米线将直径约100纳米的钻石晶体注入一个人类胚胎干细胞中,然后用绿色激光照射细胞,使氮杂质发出红色荧光。当细胞内局部温度出现变化时,红色荧光的强度会受到影响。通过测量荧光的强度,便可以计算出相应的纳米钻石的温度。由于钻石具有良好的导热性,就可以像温度计一样显示出其所处细胞内部环境的即时温度。 研究人员同时还将金纳米粒子注入细胞内,然后用激光来加热细胞的不同部位,加热点的选择和温度升高多少都可由纳米钻石“温度计”来精确控制。“现在我们有了一个可以在细胞水平上控制温度的工具,让我们能够研究生物系统对温度变化的反应。”参与该研究的哈佛大学物理学家彼得·毛瑞尔说。 他指出,基础生物学涉及到的很多生物过程,从基因表达到细胞新陈代谢,都会受到温度的强烈影响,纳米钻石“温度计”将是一个有用的工具。例如,通过控制线虫的局部温度,生物学家可以了解简单有机体的发育。“你可以加热单个细胞,研究其周围的细胞是否会减慢或者加快它们的繁殖率。”毛瑞尔说。 目前也有一些其他测量细胞温度的方法,比如利用荧光蛋白或碳纳米管,但这些测量手段在敏感性和准确度方面都有欠缺,因为其中的一些成分会和细胞内的物质发生反应。毛瑞尔说,他们的纳米钻石“温度计”的敏感度至少提高了10倍,能够检测出细微到0.05开的温度波动。而且其还有改进的余地,因为在活细胞外部,该“温度计”的敏感度已经达到0.0018开的温度波动。 总编辑圈点 这样的“温度计”应该造价不菲,好在钻石是纳米级的。而其能够检测出细微到0.05开的温度波动,让其他测量细胞温度的方法难以望其项背,我们有理由相信,这项技术不仅仅只应用于医学领域。目前晶体管已经达到极小量度,在20或30纳米级别,离原子级别已经不远。然后,最重要的事情就是要理解热量散播和设备电子结构之间的关系,只有掌握这方面的知识,才能真正操控原子级设备,而纳米钻石“温度计”或许能派上大用场。 《科技日报》(2013-08-02 一版)
如题,采用平板计数琼脂 菌落总数中到底包不包括酵母菌与霉菌?谢谢

产品简介:保存液快速对脱落上皮细胞、腺细胞、白细胞等进行很好的保存和固定,保持标本采集时的原始细胞形态,防止细胞在保存过程中发生变形、自溶等。并通过制片使细胞均匀涂布在载玻片上制成薄层细胞涂片。染色后细胞结构在显徵镜下清晰易辨,同时把血液、粘液和炎症细胞减少到最底程度,从而易发现和确认异常细胞。更有利于从细胞的形态变化判定细胞的病变程度,使判定结果更加准确可靠,提高异常细胞的检出率,大大提高宫颈癌筛查方法的特异性和诊断的准确率。·产品性能特点::红细胞处理能力强:无需另加裂解液,既可将全部红细胞彻底清除,同时完美保存有诊断价值的各种有核细胞形态,从而对于临床上重度宫颈糜烂病人(或大量血细胞标本)能轻松一次性处理干净·消化分解黏液能力强:充分消化粘黏液,去除标本中普遍存在的黏液等干扰成份,释放具有诊断价值的细胞,保留有价值的诊断背景,有效提高检出率,检测结果准确。·细胞形态:核结构完整,其中核膜、核仁、核染色质颗粒及分布清晰可见,胞浆的嗜染性正常,有利于鉴别细胞的类别及来源。 细胞萃取:采用梯度离心分离萃取及红细胞处理专利技术和黏液消化技术多合一去除液基细胞学标本中的血液、黏液等干扰成份,富集提取细胞及诊断成份。 ·兼容性强:保存的细胞同时可做免疫细胞化学、HPV-DNA和衣原体等病原微生物的分子生物学检测,无需多次采样的烦恼。·应用广泛:细胞保存液临床运用非常广泛,除了运用宫颈细胞学检查外,还有胸腹积液、尿液、滑膜液、支气管冲洗液、脑脊液、针吸穿刺细胞及痰液标本细胞检测。·保存时间长:细胞在保存液中保存30天形态不变,真正保持细胞原始形态,更接近本身的组织学结构,更有利于恶性病变与良性反应性改变的鉴别诊断。·保存液细胞包裹技术,可以使细胞均匀悬浮,保证操作者在涂片标本时的随机性,任意取样涂片都具有代表性。http://ng1.17img.cn/bbsfiles/images/2011/06/201106231241_301155_2324710_3.jpg
现如今市场上的ELISA试剂盒种类繁多,但是要如何找到适合你的那款呢?一款合适的细胞分离试剂盒可以说是实验成功的保障,因为只有获得正确的细胞,下游的分析结果才可能准确。目前,市面上有多种多样的分离试剂盒可供选择,它们的主要区别在于分离方法和筛选标志。正向选择VS负向选择细胞分离试剂盒的工作原理主要有两种,正向选择和负向选择。正向选择的试剂盒,使用与目标细胞直接结合的抗体来进行捕获。这种抗体通常与磁珠相连,可以利用磁铁将悬液中的抗体-磁珠-细胞复合物提取出来,再通过二抗将磁珠与目标细胞分开。负向选择的试剂盒也采用类似的抗体包被磁珠,不过这种试剂盒是通过去除样品中的非目的细胞,来间接捕获目的细胞。这两种细胞分离试剂盒如何取舍,主要取决于目标细胞的表面是否具有特异性强的筛选标志。这样的筛选标志能够实现特异性的捕获,避免所获得的细胞被非目标细胞污染。如果你的目标细胞刚好具有这样的筛选标志,那么正向选择的细胞分离试剂盒就是最佳选择。但如果目标细胞并不具有特异性强的筛选标志,那我们最好还是选用负向选择的细胞分离试剂盒。
注意事项: 1.配制溶液时必须用新鲜的蒸馏水。2.安装蔡式滤器时通常使用孔径 0.45 微米 和 0.22 微米滤膜各一张,放置位置为 0.45 的位于 0.22 微米的滤膜上方,并且要特别注意滤膜光面朝上。 3.配制 RPMI1640 培养基时因为还要加入小牛血清,而小牛血清略偏酸性,为了保证培养液 PH 值最终为 7.2 ,可在配制时调 PH 至 7.4 。 细胞培养的一般过程 一、准备工作准备工作对开展细胞培养异常重要,工作量也较大,应给予足够的重视,推备工作中某一环节的疏忽可导致实验失败或无法进行。准备工作的内容包括器皿的清洗、干燥与消毒,培养基与其他试剂的配制、分装及灭菌,无菌室或超净台的清洁与消毒,培养箱及其他仪器的检查与调试,具体内容可参阅有关文献。二、取材在无菌环境下从机体取出某种组织细胞(视实验目的而定),经过一定的处理(如消化分散细胞、分离等)后接入培养器血中,这一过程称为取材。如是细胞株的扩大培养则无取材这一过程。机体取出的组织细胞的首次培养称为原代培养。R 理论上讲各种动物和人体内的所有组织都可以用于培养,实际上幼体组织(尤其是胚胎组织)比成年个体的组织容易培养,分化程度低的组织比分化高的容易培养,肿瘤组织比正常组织容易培养。取材后应立即处理,尽快培养,因故不能马上培养时,可将组织块切成黄豆般大的小块,置 4℃的培养液中保存。取组织时应严格保持无菌,同时也要避免接触其他的有害物质。取病理组织和皮肤及消化道上皮细胞时容易带菌,为减少污染可用抗菌素处理。由组织并分离分散细胞的方法可参阅有关文献。 三、培养将取得的组织细胞接入培养瓶或培养板中的过程称为培养。如系组织块培养,则直接将组织块接入培养器皿底部,几个小时后组织块可贴牢在底部,再加入培养基。如系细胞培养,一般应在接入培养器皿之前进行细胞计数,按要求以一定的量(以每毫升细胞数表示)接入培养器皿并直接加入培养基。细胞进入培养器皿后,立即放入培养箱中,使细胞尽早进入生长状态。正在培养中的细胞应每隔一定时间观察一次,观察的内容包括细胞是否生长良好,形态是否正常,有无污染,培养基的 PH是否太酸或太碱(由酚红指示剂指示),此外对培养温度和 CO2浓度也要定时检查。一般原代培养进入培养后有一段潜伏期(数小时到数十天不等),在潜伏期细胞一般不分裂,但可贴壁和游走。过了潜伏期后细胞进入旺盛的分裂生长期。细胞长满瓶底后要进行传代培养,将一瓶中的细胞消化悬浮后分至两到三瓶继续培养。每传代一次称为“一代”。二倍体细胞一般只能传几十代,而转化细胞系或细胞株则可无限地传代下去。转化细胞可能具有恶性性质,也可能仅有不死性(Immortality)而无恶性。培养正在生长中的细胞是进行各种生物医学实验的良好材料。四、冻存及复苏为了保存细胞,特别是不易获得的突变型细胞或细胞株,要将细胞冻存。冻存的温度一般用液氮的温度?-196℃,将细胞收集至冻存管中加入含保护剂(一般为二甲亚砜或甘油)的培养基,以一定的冷却速度冻存,最终保存于液氮中。在极低的温度下,细胞保存的时间几乎是无限的。复苏一般采用快融方法,即从液氮中取出冻存管后,立即放入 37℃水中,使之在一分钟内迅速融解。然后将细胞转入培养器皿中进行培养。冻存过程中保护剂的选用、细胞密度、降温速度及复苏时温度、融化速度等都对细胞活力有影响。
关于流式细胞计使用等相关内容
随着重组DNA技术得到广泛应用以来,生物技术发生了质的飞跃。很多基因工程产物都是胞内物质,必须将细胞破壁,使产物得以释放,才能进一步提取,因此细胞破碎是提取胞内产物的关键步骤,破碎方法的得当与否,直接影响到所提取产品的产量、质量和生产成本。现将近年来常用的几种细胞破碎方法介绍一下。 1. 高压匀浆法 设备是高压匀浆器,它由高压泵和匀浆间组成,美国Microfluidics公司和ATS公司均有产品出售。其破碎机理:细胞在一系列过程中经历了高速造成的剪刀,碰撞以及由高压到常压的变化从而造成细胞的破碎。 存在的问题;较易造成堵塞的团状或丝状真菌,较小的革兰氏阳性首以及有些亚细胞器,质地坚硬,易损伤匀浆阀,也不适合用该法处理。 2. 高速珠磨法 设备是珠后机,瑞士WBC公司和德国西门子机械公司均制造各种型号的珠磨机,其破碎机下:微生物细胞悬浮液与极细的研磨剂在搅拌浆作用下充分混合,珠子之间以及珠子和细胞之间和互相剪切、碰撞,促使细胞壁破碎,释出内含物,在珠波分离器的协助下,珠子被滞留在破碎室内,浆液流出,从而实现连续操作,破碎中,生的热量由夹套中的冷却液带走。 存在的问题:操作参数多,一般赁经验估计并且珠子之间的液体损失30%左右。 3. 超声破碎 频高于15-20KHz的超声波在高强度声能输入下可以进行细胞破碎。其破碎机理:可能与空化现象引起的冲击波和剪切力有关。超声破碎的效率与声频、声能、处理时间、细胞浓度及首种类型等因素有关。 存在问题;超声波破碎在实验室规模应用较普遍,处理少量样品时操作简便,液量损失少,但是超声波产生的化学自由基团能使某些敏感性活性物质变性失活。而且大容量装置声能传递,散热均有困难。 4. 酶溶法 就是用生物酶将细胞壁和细胞腊消化溶解的方法。常用的溶酶有溶菌酶β-1.3-葡聚糖酶、蛋白酶等。 存在的问题;易造成产物抑制作用,这可能是导致胞内物质释放率低的一个重要因素。而且溶酶价格高,限制了大规模利用。若回收溶酶,则又增加百分离纯化溶酶的操作。另外酶港法通用性差,不同菌种需选择不同的酶。 5. 化学渗透法 某些有机溶剂(如苯、甲苯)、抗生素、表面活性剂、金属螯合剂、变性剂等化学药品都可以改变细胞壁或膜的通透性从而使内合物有选择地渗透出来。其作用机理;化学渗透取决于化学试剂的类型以及细胞壁和膜的结构与组成。 存在的问题;时间长,效率低;化学试剂毒性较强,同时对产物也有毒害作用,进一步分离时需要用透析等方法除去这些试剂;通用性差:某种试剂只能作用于某些特定类型的微生物细胞。 本文介绍了几种细胞破碎的方法,可谓各有千秋,在实际应用中,应尽量考虑全面,选择最科学、有效的方法。
各位好友们,我遇到了一个关于“细胞知识”的难题,想请教一下各位同仁们!! 老板交给我一下任务,是关于细胞知识的,细胞是一个比较难懂的知识哦!我现在对细胞的知识还不太了解,想与大家一起讨论一下关于细胞的知识, 怎样从核酸里面取出DNA与RNA呢?使用什么方法呢?
求助各位大侠,有没有测过细胞的拉曼光谱。我们用的雷尼绍的仪器,785nm激发光,背景信号太强,一点细胞的信号都测不出,怀疑激光没有聚焦在细胞上。1. 细胞测量前要怎么处理?2. 细胞放在什么样的载玻片上测量,怎样减小背景影响?3. 仪器参数设置上有什么需要注意的么?怎样确定把光聚焦到细胞上?老板逼得紧,谢谢各位啊!
细胞在体外进行培养,失去了机体的调节和控制。因此,除满足营养的要求外,还必须使细胞生存环境尽量接近活体的环境。外环境的培养条件如温度、渗透压、酸碱度等均能影响细胞的生长。 一、温度 一般哺乳类及禽类细胞体外培养的适宜温度是37~38℃。温度过高或过低都会影响到细胞的生长。细胞耐受低温的能力比抗热的能力强,在低温下,细胞的代谢活力及核分裂降低。温度不低于0℃时,虽影响细胞代谢,但并无伤害作用;把细胞置于25~35℃时,细胞仍能生存和生长,但速度减缓;放在40℃数小时后,再置回37℃培养细胞仍能继续生长。但如果在40℃下暴露时间太长,对细胞生长不利,甚至变圆脱落于瓶壁。若温度过低,在降到冰点以下时,细胞因胞外水和胞质结冰而受损死亡。但若向培养液中加入甘油或二甲亚砜等保护剂,封入安瓿中后,置于液氮中,可起保护作用,此时细胞可耐受-70℃以下温度,能长期储存,解冻后细胞复苏,仍能继续生长增殖,细胞生物性状不受任何影响。此为保存细胞的主要手段。 高温对细胞培养不利。细胞在39~40℃培养1小时,能受到一定损伤,但仍有可能恢复,但不能忍受温度再升高2℃,持续数小时,即在41~42℃中培养1小时,细胞损伤严重,温度至43℃以上时细胞多数被杀死。高温主要引起酶的灭活、类脂质破坏,核分裂的破坏,产生凝固酶使细胞发生凝固,另外使蛋白质变性。因此,体外培养细胞时一定要避免高温。 二、渗透压 细胞在高渗溶液或低渗溶液中,可以立即发生皱缩或肿胀、破裂。所以,渗透压是体外培养细胞的重要条件之一。哺乳动物和其他动物组织细胞体外培养的渗透压的维持主要与NaCl有关,但不能忽视其他电介质渗透压的关系。渗透压与单位体积溶媒内溶质的分子数和离子数成正比。为此,按一定比例控制培养液中离子平衡,维持正常渗透压是很重要的。这不仅是为了维持细胞张力,而且是为了调节细胞的代谢。因为细胞外离子输送和离子浓度改变着其他营养物质的输送(如氨基酸、蔗糖等),直接影响细胞基本合成系统。 理想的渗透压因细胞的类型及种族而异,人血浆渗透压为290mmol/L,被视为是体外培养人类细胞的理想渗透压。哺乳类动物细胞的渗透压一般为290~300mmol/L。人胚肺成纤维细胞为250~325mmol/L,鼠则为310mmol/L左右。在实际应用中,260~320mmol/L的渗透压可适于大多数细胞。