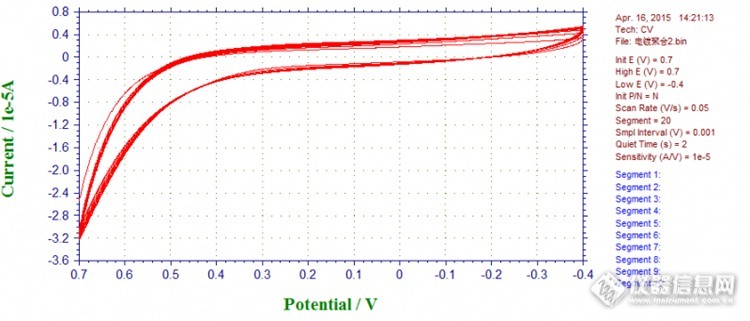
大家帮我分析下我电镀印迹膜的CV曲线,我看文献上扫描第一诠释都有氧化还原峰,然后随着扫描氧化还原峰消失,为什么我的曲线上第一圈扫的时候就看不到峰呢http://ng1.17img.cn/bbsfiles/images/2015/04/201504201112_542672_1916297_3.png
[font=宋体]链接:[/font]https://bbs.instrument.com.cn/topic/6028886问题描述:[font=宋体]分子印迹膜分离技术[/font]解答:[font=宋体]分子印迹技术是指合成对模板分子或目标分子具有特异性识别能力的分子印迹聚合物([/font]molecularlyimprinted polymers[font=宋体],[/font]MIPs[font=宋体])的新型分离技术。[/font][font=宋体]有特异性识别能力的分子印迹聚合物([/font]molecularly[font=宋体]当模板分子(印迹分子)与聚合物单体接触时会形成多重作用点,通过聚合过程这种作用就会被记忆下来,当模板分子除去后,聚合物中就形成了与模板分子空间构型相匹配的具有多重作用点的空穴,这样的空穴将对模板分子及其类似物具有选择识别特性。[/font]MIPS[font=宋体]最广泛的应用之一是利用其特异的识别功能去分离混合物,近年来,引人瞩目的立体、特殊识别位选择性分离已经完成。其适用的印迹分子范围广,无论是小分子(如氨基酸、药品和碳氢化合物等)还是大分子(如蛋白质等)已被应用于各种印迹技术中。[/font]以上内容来自仪器信息网《样品前处理实战宝典》
各位大侠:请问分子印迹膜在国内外市场情况如何,国内哪所大学对这个研究最好的?国家有这方面的标准、规范和认证机构?
[font=宋体]链接:[/font]https://bbs.instrument.com.cn/topic/774432问题描述:分子印迹膜分离技术的基本流程有哪些?解答:a) [font=宋体]模板分子与功能单体中的功能基团结合,形成功能单体[/font]-[font=宋体]模板分子的主客体配合物。[/font]b) [font=宋体]选择合适的交联剂,在惰性溶剂(致孔剂)中,对功能单体[/font]-[font=宋体]模板分子配合物进行交联,形成共聚物。在交联过程中,将功能单体上与模板分子结合的功能基团的空间取向与排列位置固定下来。[/font][font='Times New Roman','serif']c) [/font][font=宋体]通过一定的方式(物理或化学方法),断开模板分子与功能单体的结合键,再去除模板分子。[/font]以上内容来自仪器信息网《样品前处理实战宝典》
[B]分子印迹技术在样品前处理中的应用[/B][I]作者:胡小刚 李攻科[/I]摘 要 分子印迹聚合物具有选择性高、稳定性好及制备简单的特点,可用于生物、医药、环境样品等复杂基体中痕量分析物的高选择性分离与富集,因此在样品前处理中的应用特别引人关注。本文介绍了分子印迹技术的基本原理,综述了分子印迹技术在样品前处理中应用的研究进展。关键词 分子印迹,样品前处理,固相萃取,固相微萃取,膜分离,评述1 引 言 复杂基体如生物、医药和环境样品中痕量、超痕量物质分析要依赖高效和高选择性的样品前处理技术。但相对于仪器分析技术的发展,样品前处理技术的进展一直较缓慢。 固相萃取(SPE)是70年代中期出现的技术。其萃取机制取决于分析物与固相(填充剂)表面的活性基团之间的分子间作用力。SPE填充剂主要为键合材料,如C8、C18离子交换树脂等,选择性不强,在富集分析物的同时,大量基体和干扰物质也被富集,导致洗脱液中仍含有基体和杂质,干扰最后的色谱分析。近来出现一种利用抗体自身选择性的免疫吸附剂[1],作为固相萃取材料具有选择性高的优点,但制备复杂、耗时且可供选择的抗体种类少,机械强度和稳定性均较差。 1989年Belardi等提出了固相微萃取(SPME)技术,SPME是基于分析物在流动相以及固定在熔融SiO2纤维表面的高分子固定相之间两相分配的原理,实现对样品中的有机分子进行萃取和富集。然后可直接在联用仪器中解吸、进样及分析,使样品预处理过程大为简化,提高了分析速度及灵敏度。与传统的样品前处理技术如液液萃取、索氏提取、SPE相比,克服了需使用大量溶剂和样品、处理时间长、操作繁琐、易产生二次污染及不易在线联用等缺点,在环境、食品、生物以及药物等领域得到了广泛应用。在SPME技术中,纤维涂层的材料是最关键的。但目前商品化的纤维涂层仅有少数几种,并且以非特异性吸附作用为主,选择性不够高,在样品前处理时仍有大量化学、物理性质相近的基体物质同时被富集,处理极性或碱性药物时会遇到较大的困难[2,3]。虽然一些文献报道了新的SPME涂层的研制工作[4~5],但主要是用于测定挥发或半挥发性的有机环境污染物,急需研制出选择性更高的纤维涂层。 分子印迹(MI)技术的发展,可望解决以上问题。分子印迹技术是将要分离的目标分子与功能单体通过共价或非共价作用进行预组装,与交联剂共聚制备得到聚合物。除去目标分子后,聚合物中形成与目标分子空间互补并具有预定的多重作用位点的“空穴”,对目标分子的空间结构具有“记忆”效应,能够高选择性识别复杂样品中的印迹分子。分子印迹聚合物(molecularly imprinted polymer, MIP)制备简单,能够反复使用,机械强度较高,稳定性好。因此它非常适合用作SPE的填充剂或SPME的涂层材料来分离富集复杂样品中的分析物,以达到分离净化和富集的目的。MIP作为膜分离的材料可将膜的筛分作用与MIP的高选择性结合在一起,用于样品的富集、回收或去除杂质等。 2 分子印迹技术的基本原理 MIP是以某种化合物分子为模板合成的聚合物,对模板分子具有较高的特异性识别能力,类似于酶底物的“钥匙锁”相互作用原理。目前,根据印迹分子与功能单体在聚合过程中相互作用的机理,将分子印迹技术分为共价法与非共价法两种类型。目前各类文献上报道的MIP制备方法基本上是非共价法。在此方法中,印迹分子与功能单体之间通过分子间的非共价作用预先自组装排列,以非共价键形成多重作用位点,这种分子间的相互作用通过交联聚合后保留下来。常用的非共价作用有:氢键、静电引力、金属螯合作用、电荷转移、疏水作用以及范德华力等,其中以氢键应用最为广泛[6]。 目前,文献报道中制备出的MIP一般均具有较好的物理和化学稳定性:机械强度较高;耐高温、高压;能抵抗酸、碱、高浓度离子及有机溶剂的作用;在很复杂的化学环境中能保持稳定[7]。研究表明,MIP反复使用300次之后印迹能力也未发生衰减[8];保存八个月之后其性能不发生改变[9]。 关于MIP的制备和性能研究,国内外已有较多综述文章详细介绍[10~12],本文不再详述。[color=#DC143C][B]注:其他的三篇相关文献在4-6楼。[/B][/color]
当模板分子(印迹分子)与聚合物单体接触时会形成多重作用点,通过聚合过程这种作用就会被记忆下来,当模板分子除去后,聚合物中就形成了与模板分子空间构型相匹配的具有多重作用点的空穴,这样的空穴将对模板分子及其类似物具有选择识别特性。MIPS最广泛的应用之一是利用其特异的识别功能去分离混合物,近年来,引人瞩目的立体、特殊识别位选择性分离已经完成。其适用的印迹分子范围广,无论是小分子(如氨基酸、药品和碳氢化合物等)还是大分子(如蛋白质等)已被应用于各种印迹技术中 。
分子印迹技术的概念就是将各种生物大分子从凝胶转移到一种固定基质上的过程,当体系中存在着模板分子时,功能单体可以通过聚合使这些模板分子以互补的形式固定下来.聚合后,模板分子可以被除去,从而使获得的分子组装体能专一性地键合模板分子及其类似物。 利用分子印迹化学发光技术进行定量测定,增加了一种准确测定的方法,分子印迹技术可以对混合的样品进行选择性的分离,然后从印迹模板上将待测的物质洗脱下来,进行化学发光测定,从而提高了CL体系的选择和减小了其他物质对体系的干扰。
求推荐,国产的原子吸收 空心阴极灯和石墨管哪家的比较好用?性价比较高一些。
在发明蛋白质印迹法(Western Blot)出现了30多年之后,这项技术仍然是获取特定蛋白可靠鉴定的关键。许多近期涌现的产品利用各种方法来提高蛋白质印迹实验的可重复性、敏感性、定量性以及速度。有三个人都被认为发展了蛋白质的免疫印迹方法,但其中只有一人才算得上是“Western Blotting(蛋白质印迹法)”的命名者,他就是当时在西雅图哈钦森癌症研究中心Bob Nowinski实验室工作的W. Neal Burnette。“Western Blotting”的命名中暗含了Southern Blotting(Edwin Southern在1975年发明的一项技术,使用胶、尼龙膜和吸水纸去鉴定一个复杂个体中特定的DNA序列)、Northern Blotting(随后发明出的相似策略,用于鉴定RNA)以及位于西海岸(West Coast)的Nowinski实验室三者之意。http://www.ibioo.com/data/attachment/portal/201309/22/095234xzm2pso06fsmtbof.jpgBurnette的技术成果直到1981年才得以发表。他回想起来,当时审稿人“特别”反对使用“Western blotting”这一名称。但尽管如此,这个名称还是沿袭了下来,而且蛋白质印迹技术也成为了最广泛使用的免疫化学技术之一。工作原理蛋白质印迹法的第一步涉及到用凝胶电泳(Gelelectrophoresis)按照大小分离蛋白质,然后通过将膜置于胶上,将蛋白质转移到膜上(通常是硝酸纤维素膜或聚偏二氟乙烯膜),并在膜上加上若干片吸水纸,然后将这套堆层放在缓冲溶液中,这样就能通过毛细管作用将蛋白质向上拉拽到膜上。这也就是所谓的湿法或槽式转印法。另外两项技术是干法和半干转印法,这两种方法比传统的湿转印法更快也更规整,但是对于高分子量蛋白质而言,效率更低。对于半干转印方法来说,膜和胶放置在被缓冲液浸泡过的滤纸层之间,将这些都夹在阴极和阳极之间,电流就能驱动蛋白质转移到膜上。三种方法中,干法转印最快,但转印效率也最低。转印结束后,膜被放在稀释过的蛋白质溶液中用来封闭非特异性的蛋白质结合。然后将膜与一抗进行孵育、洗脱,再与标记了信号检测探针的二抗进行孵育。最后一步是检测,通常采用化学发光或者荧光方法。在化学发光检测中,与酶交联的二抗能够与检测抗原产生光发生反应,可以被胶片或成像装置捕获。而在荧光检测中,抗体探针被荧光集团所标记。荧光检测方法的主要优势在于,它可以同时检测多个蛋白质,并且其信号更加一致。因此与化学发光检测相比,也更有利于量化研究。不少制造蛋白质印迹相关设备、软件和消耗品的公司正在努力推动其中一些或所有步骤的自动化,期望能够将这一实验变得更加简单有效。同时在实验中加入了一些验证点,让研究人员能够随时监测实验进展,甚至重新打造整个过程。科学家们寻求的是高效性、稳健性和策略化,从而能够帮助他们避免浪费宝贵的造价高昂的抗体。加速免疫检测过程转印、抗体孵育、上样和洗脱步骤占据了蛋白质印迹法实验80%的时间,EMD Millipore公司“蛋白质印迹法解决方案”产品经理Michele Hatler这样介绍。这家总部位于加州泰梅库拉的公司推出的SNAP i.d. 2.0蛋白质检测系统加速了整个过程,使用真空装置通过膜推入试剂,而不仅仅依赖于扩散作用。这样就能将免疫检测的时间从4小时缩短到30分钟,Hatler表示。她解释说:“我们真正致力于提高蛋白质印迹工作流程的效率。我们仍然是按照传统的步骤走,只是加了一个真空装置。”Hatler指出,2.0版本是于2012年9月推出的,相比之前的版本有几个方面的优势。它可以使用中等大小的凝胶(8.5×13.5厘米)和迷你凝胶(7.5×8.4厘米),之前则只能用迷你凝胶。“这一设备很便宜,操作也很简便,但切实提高了实验效率,节省了实验时间。” Hatler说。伯乐公司(Bio-Rad)的Trans-Blot Turbo蛋白质转移系统是实验台面大小的仪器,能够提供快速而高效的转印。得益于新的转印缓冲液配方,特殊的过滤材料和增强的电流强度(由一个集成电源调节),这一系统能够在短至3分钟的时间内完成转印,并且印迹结果能与槽式转移相媲美。传统的半干转移系统需要15到60分钟时间,而且通常无法提供高分子量蛋白质转移的有力结果。增加验证点以缓解忧虑蛋白质印迹法的高失败率常常令人感到非常沮丧,尤其是你需要若干天来换取一个结果。“这是一项非常不稳定的技术,”伯乐公司“蛋白质印迹组”市场经理Ryan Short说,“我们对用户调查时发现,一半的用户报告他们用此技术的失败率至少是25%。”Short还说:“几乎没有什么机会可以检查实验过程是否满足期望。由此就产生了焦虑。我们正在引入可视验证点的概念来增加信心和确定性。”这家公司的标准和Mini-PROTEAN免染色预制胶,利用其ChemiDoc MP胶成像系统,使得研究者可以快速观测到他们的蛋白是否正确地载入到凝胶上,进而确证高质量的蛋白质转移,便于决定是否应该转向下一个步流程或是重新开始。ChemiDoc MP系统是为化学发光和多元荧光斑点成像技术所设计,能够在个人电脑上用ImageLab软件来操作。这些验证点“真的很有用”,在实验室使用该系统的加州大学戴维斯分校助理教授Aldrin Gomes表示:“我们可以成像这些免染的凝胶,不用加入额外的染料,而且能够快速判断跑在胶上的样品是否出现问题。我们还能在蛋白质转膜之后再去对凝胶成像,如果其中任何一个步骤出现问题,我们都可以在这一点上停止实验进程。”成像和软件提高定量性当许多科学家仍在使用胶片分析蛋白质印迹时,世面上开始出现越来越多的宽范围免胶片凝胶记录成像系统,这些系统可以用来成像并分析化学发光的印迹、荧光的印迹斑点或者同时检测这两种印迹。许多公司开始纷纷努力,争相制造尽可能便捷的成像仪及其分析软件。很多公司提供了按键式成像捕捉系统,其大小可在实验台上操作。Syngene公司于2012年4月推出了非常简洁的一键操作系统PXi,分析化学发光和荧光印迹。该系统是基于该公司的G:BOX成像系统,并配有GeneSys成像软件。2012年10月,赛默飞世尔公司(Thermo Fisher Scientific)推出了myECL成像仪,使用紫外和可见光透射法,专业的滤镜和电荷耦合器件(CCD)摄影技术去捕获和分析蛋白质印迹以及蛋白和核酸凝胶。
前两天有人发了关于分子印迹的问题,因此想把有关分子印迹的知识和应用发一下,有兴趣的朋友可以学习交流一下。同时把word版本作为附件上传。------------------绪论1.引言分子印迹也叫分子模板技术,是一种模拟抗体—抗原相互作用的人工生物模板技术。最初出现源于20世纪40年代的免疫学,当时的诺贝尔奖获得者Pauling[7]在研究抗原和抗体的相互作用时,首次提出了抗体形成学说,要点是抗体在形成时其三维结构会尽可能地同抗原体形成多重作用点,抗原作为一种模板就会“铸造”在抗体地结合部位。虽然这一设想并不可行,却是对分子印迹最初的描述,为分子印迹理论的产生奠定了基础。到20世纪70年代,Wulff[8]等人利用新的方法合出了几种高分子,对糖类和氨基酸衍生物具有较高的选择性,被用作高效液相色谱(HPLC)的固相填充物[10],这种新的方法,被称为分子印迹。但由于他的研究主要集中在共价型模板聚合物上,动力学过程较慢,其应用仅限于催化领域,而在分子识别领域的应用没有展开。80年代后非共价型模板聚合物的出现,尤其是1993年Mosbach[2]等人有关茶碱分子印迹聚合物的研究报道,使这一技术在生物传感器、人工抗体模拟及色谱固相分离等方面有了新的发展,并由此使其成为化学和生物学交叉的新兴领域之一,得到世界注目并迅速发展。欧洲委员会并于1998年启动了一项科研发展计划,资助分子印迹聚合物(MIPs)的制备、结构表征以及将MIPs用于临床分析、环境分析和生物分析等方面的研究。目前,全世界至少有包括瑞典、日本、德国、美国、中国、澳大利亚、法国在内的10多个国家、100个以上的学术机构和企事业团体在从事MIPs的研究和开发[1]。短短的二十多年,分子印迹由于其卓越的分子识别性能已经得到了广泛的发展,成为化学工作者的热门研究课题。分子印迹(MIPs)之所以发展如此迅速,主要是因为它有三大优点:即预定性(predetermination)、识别性(recognition)和实用性(practicability)[1]。由于MIPs具有抗恶劣环境的能力,表现出高度的选择性、稳定性和长的使用寿命等优点,因此,在许多领域,如色谱中对映体和异构体的分离、固相萃取、化学仿生传感器、模拟酶催化、临床药物分析、膜分离技术等领域展现了良好的应用前景。2.分子印迹聚合物的原理和作用方式MIPs是以某种化合物的分子结构为模板合成的聚合物。在印迹分子存在的条件下,将带有特殊官能团的单体与大量的基质单体在适当的介质中进行模板聚合反应,两者之间发生相互作用,如共价和分子间作用力。由于印迹分子的存在,因此在聚合过程中,单体分子本身所带的官能团会根据与印迹分子相互作用的需要, 在分子印迹分子周围按一定的取向和排列形成分子聚合物,形成特定的空间构象,得到高度交联的聚合物。聚合结束后通过洗脱等方法除去聚合物上结合的印迹分子,聚合物主体上就形成了与印迹分子空间结构匹配的具有多重作用位点的“空穴”结构。这种具有“记忆”效应的印迹聚合物对印迹分子及其它与印迹分子结构相似的客体分子具有较高的特异性结合能力,类似于酶-底物的“钥匙-锁”相互作用,依赖于印迹聚合物和客体分子大小及形状的匹配。如图1所示:根据模板分子和功能单体形成复合物时作用力的性质,分子印迹可分为共价型和非共价型两种。两种印迹类型的印迹过程如图2所示。共价键法 在共价型印迹过程中,印迹分子与官能团单体以共价键形式结合而形成印迹分子的衍生物,该衍生物在交联剂的存在下连接到聚合物的基质上。在印迹聚合物形成后,再将与印迹分子连接的这些共价键打断,并将印迹分子洗脱出来,从而形成具有吸附活性的印迹聚合物。在共价键法中,所采用的单体通常为低分子化合物,在选择时应考虑该单体与印迹分子形成的共价键键能要适当,达到在聚合时能牢固结合,在聚合后又能完全脱除的目的;另外还要考虑该单体与客体印迹分子有良好的相互作用。目前,共价键结合作用包括硼酸酯、西佛碱、缩醛(酮)、酯、螯合键作用等。非共价键法 把适当比例的印迹分子与官能团单体和交联剂混合,通过非共价键结合在一起制成非共价键印迹分子聚合物。这些非共价键包括离子键、氢键、偶极作用、疏水作用、静电作用以及范德华力等。由于这种方法与溶剂的极性密切有关,所以印迹高聚物的形成是在有机溶剂中完成的。在溶液中官能团单体与印迹分子的比例至少为4:1,以便尽可能多的非共价作用形成。这些与印迹分子相配位的官能团单体在溶液中与交联剂达到快速平衡,形成印迹聚合物将印迹分子包围,产生与印迹分子在形状、功能上互补的识别位点。在聚合物形成后再将印迹分子洗脱掉,所得的印迹聚合物就具有吸附活性。 共价型分子印迹中,单体与模板分子之间是通过化学键连在一起的,印迹过程复杂,形成的复合物也很稳定,必须采用化学方法除去模板分子。有限的可逆化学反应,限制了此法的应用性。与共价型印迹相比,非共价型印迹简单易行,模板分子易于除去,是目前广为流行的方法,其分子识别过程也更接近于那些天然的分子识别系统,如“抗体-抗原”和“酶-底物”等。在印迹过程中还可以同时采用多种单体,以提供给模板分子更多的相互作用,产生更好的印迹效果。[/color][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=65867]分子印迹MIP论文[/url]
石墨炉怎样安装新空心阴极灯?
电化学分子印迹实验,用邻苯二胺做单体,采用电聚合的方法-0.2到0.9V 循环伏安扫描20圈,在电极表面形成分子印迹膜。然后用酸和醇的混合液浸泡去除模板分子,为什么空白组被浸泡后的电流很高啊,比实验组的电流更高。重复了好多次,对照组分子印迹膜浸泡后电流都很高。方法就是最基本的电聚合方法,好多文献都是这样做的,为什么做了好多次就是不行,对照组就是会有很高的电流。
我想了解一下这个产品,普瑞邦北京这个公司前段时间给我介绍了他们这个产品,说是人工合成的,是运用分子印迹技术原理,模拟抗原抗体反应模式,配合HPLC液相方法在检测展青霉素前,将样品中的展青霉素进行特异性提纯处理和富集,完全除去其他杂质。感觉对实验还挺有帮助的,想做一些深入的实验,对于这个产品还是有太多的疑问,想了解一下这个产品和这个公司,、。
对于有色院的高强度空心阴极灯,查了很多文献,都是说阴极接恒流源,阳极接高压模块,但没有材料给出阳极所用高压模块的电流大小。请问,自己买高压模块做实验的时候,高压模块的电流选取多大值比较合适呢?
[color=#333333]在科研方法和仪器不断更新发展的今天,你是否发现那些曾经给我们带来巨大便利的检测方法、仪器、耗材,已经又不能满足我们对“高效率”永无止境的追求?[/color][color=#333333][b]使用新型的检测方法、新型仪器和耗材,就是为自己赢得时间![/b][/color][color=#333333]那么何为分子印迹固相萃取技术?[/color][color=#333333]它能为我们的前处理过程带来哪些好处呢?[/color][color=#333333][/color][b][color=#333333]基本原理[/color][/b][align=center][img=,600,371]https://ng1.17img.cn/bbsfiles/images/2019/10/201910141549069798_4494_932_3.jpg!w640x396.jpg[/img][/align][color=#333333][/color][color=#333333]分子印迹(MIP)固相萃取技术是近些年来逐渐流行的前处理技术,它在食品安全、环境和医药分析等领域[/color][color=#f41616]复杂基质样品中的痕量分析[/color][color=#333333]具有明显优势。在国外已经受到越来越多用户的青睐。[/color][color=#333333][b]应用案例[/b][/color][b]采用分子印迹小柱净化同时测定谷物中伏马毒素B1、B2和呕吐毒素[/b][color=#0d76dc][b]实验步骤[/b][/color][color=#0d76dc][b][/b][/color][b]样品制备:[/b][color=#333333]25g样品+100ml提取液(水/乙腈/甲醇=50/25/25,v/v/v),均质提取3分钟;[/color][color=#333333]提取液用滤纸(4-7um)过滤;[/color][color=#333333]取10ml滤液+10ml去离子水,再经滤纸过滤即得上样溶液(待净化液)[/color][b]样品净化:[/b][color=#333333]净化小柱:月旭AFFINIMIP分子印迹小柱 FumoZON 100mg/3mL[/color][color=#333333]活化:2ml乙腈、2ml水[/color][color=#333333]上样:6mL上样溶液[/color][color=#333333]淋洗:6mL淋洗液(乙腈/水=40/60)[/color][color=#333333]洗脱:2ml洗脱液 (含2%醋酸的甲醇溶液)[/color][color=#333333]浓缩与复溶:洗脱液浓缩后用水复溶供HPLC分析[/color][b][url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]色谱条件:[/b][color=#333333]色谱柱: Ultimate XB-C18 column 50mm x2.1mm[/color][color=#333333]流动相:ZON和FB1: 0.1%甲酸水溶液/乙腈= (73/27,v/v) FB2: 0.1%甲酸水溶液/乙腈= (65/35,v/v)[/color][color=#333333]流速: 0.2mL/min[/color][color=#333333]MS 条件:[/color][color=#333333]m/z 722 for FM B1 (ESI+)[/color][color=#333333]m/z 706 for FM B2 (ESI+)[/color][color=#333333]m/z 317 for ZON(ESI-)[/color][color=#333333]进样体积: 20μL.[/color][b][/b][color=#333333][b][/b][/color][b]分析结果:[/b][align=center][b][img=,500,459]https://ng1.17img.cn/bbsfiles/images/2019/10/201910141549162308_4838_932_3.png!w272x250.jpg[/img][/b][/align]经小柱净化后得到的谱图:其中ZON加标为38μg/kg,FB1加标为2408μk/kg,FB2加标为630μg/kg回收率:[b][/b][align=center][b][img=,600,147]https://ng1.17img.cn/bbsfiles/images/2019/10/201910141549197578_6652_932_3.png!w559x137.jpg[/img][/b][/align][align=center][color=#333333](注:本规格的分子印迹小柱也可用于伏马毒素B3的测定。)[/color][/align][color=#333333][/color][color=#333333][b]评价:[/b][/color][color=#333333]该方法采用分子印迹固相萃取小柱净化,同时检测两种类型的毒素,与原国标方法中采用免疫亲和小柱相比,[/color][color=#f41616]大大缩短了前处理时间[/color][color=#333333];同时分子印迹小柱[/color][color=#f41616]价格更低廉[/color][color=#333333],[/color][color=#f41616]也大大降低了检测成本[/color][color=#333333],是很理想的前处理方法。[/color][color=#333333]分子印迹和免疫亲和方法对比[/color][color=#333333] [/color][table=379][tr][td=1,1,151][b]特点[/b][/td][td=1,1,107][b]免疫亲和[/b][/td][td=1,1,121][b]分子印迹[/b][/td][/tr][tr][td]选择性[/td][td]高[/td][td]高[/td][/tr][tr][td]载样能力[/td][td]6μmol/g[/td][td]10-100μmol/g[/td][/tr][tr][td]分析物溶于水[/td][td]可靠[/td][td]不稳定[/td][/tr][tr][td]分析物溶于有机溶剂[/td][td]差[/td][td]好[/td][/tr][tr][td]稳定性[/td][td]一般[/td][td]很高[/td][/tr][tr][td]重复性[/td][td]较好[/td][td]好[/td][/tr][tr][td]成本[/td][td]昂贵[/td][td]相对经济[/td][/tr][/table][b]分子印迹的优势:[/b]1、高亲和力2、高选择性3、重现性好4、应用范围广5、定量限更低分子印迹小柱还可以检测哪些项目[align=center][img=,500,790]https://ng1.17img.cn/bbsfiles/images/2019/10/201910141549229588_7400_932_3.png!w490x775.jpg[/img][/align]
[font=宋体][url=https://cn.sinobiological.com/category/wb-faq][b][font=Calibri]WB([/font][font=宋体]蛋白质印迹[/font][font=Calibri])[/font][/b][/url][font=宋体]是一种用于检测样本(如细胞提取物或组织匀浆)中特异性蛋白的技术,也用于分析体外合成的重组蛋白。蛋白免疫印迹法还可以根据某种抗原与其相对抗体之间的特殊亲和力来鉴定靶蛋白。蛋白免疫印迹法一般包含三个主要步骤分别为[/font][font=Calibri]SDS-PAGE[/font][font=宋体]、样品印迹和免疫学检测。通过蛋白免疫印迹法可以获得关于靶蛋白的定性和半定量数据。在蛋白质领域,蛋白免疫印迹法被广泛用于蛋白表达水平的检测。下面针对[/font][b][font=Calibri]WB[/font][font=宋体]在实验过程中遇到的问题进行罗列及解答:[/font][/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、为什么抗磷酸化酪氨酸抗体会出现高背景或信号减弱?[/font][/font][font=宋体][font=宋体]请您检查所使用的封闭液并注意封闭以及洗膜的时间。有两种常用的封闭液:脱脂奶粉或[/font][font=Calibri]BSA[/font][font=宋体]。脱脂奶粉成本低但不能用于磷酸化蛋白的封闭,因为脱脂奶粉含有酪蛋白,该蛋白本身就是一种磷酸化蛋白,会结合在膜上并与磷酸化特异性抗体结合导致高背景。并且稀释抗磷酸化酪氨酸抗体与脱脂奶粉中的酪蛋白结合后,用于检测的抗体较少导致信号减弱。此外,避免封闭时间过长,否则会掩盖抗原表位,阻止抗体结合。洗膜时间不宜过长或过短,过长会导致信号减弱(抗体被洗脱),过短则会导致高背景。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]我们建议使用含[/font][font=Calibri]1% BSA[/font][font=宋体]的[/font][font=Calibri]TBS[/font][font=宋体],含吐温[/font][font=Calibri]20[/font][font=宋体]作为封闭液,请勿使用脱脂奶粉。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、为什么随着时间的推移,蛋白免疫印迹法中的抗体活性会降低?[/font][/font][font=宋体]如果您使用我们的一种抗体进行蛋白免疫印迹分析,并且反应性似乎随着时间的推移而降低,可能的原因及解决方案如下:[/font][font=宋体] [/font][font=宋体]①可能的原因一:使用了不同的样本。[/font][font=宋体]解决方案:培养的细胞会随着时间的推移而变性,因此我们建议解冻新鲜细胞。[/font][font=宋体]②可能的原因二:样品在储存期间或反复冻融后降解。[/font][font=宋体]解决方案:制备新鲜样品,避免反复冻融。[/font][font=宋体]③可能的原因三:抗体被污染。解决方案: 旋转小瓶,检查是否有沉淀。[/font][font=宋体]④可能的原因四:二抗失效。解决方案:更换新的二抗。[/font][font=宋体]⑤可能的原因五:蛋白质转膜效率低。解决方案:配置新的转膜液;根据蛋白分子量大小调整转膜时间。[/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、如何避免转膜不充分或结果不理想的问题?[/font][/font][font=宋体][font=宋体]确定蛋白质的大小。如果蛋白质大于[/font][font=Calibri]180 kDa[/font][font=宋体],则需要通过以下方式优化转膜条件:[/font][/font][font=宋体][font=宋体]? 使用[/font][font=Calibri]20% MeOH[/font][font=宋体]。[/font][/font][font=宋体][font=宋体]? 加入[/font][font=Calibri]0.05% SDS[/font][font=宋体]转膜缓冲液。[/font][/font][font=宋体]? 增加裂解物的上样量。[/font][font=宋体][font=宋体]? [/font][font=Calibri]110 V[/font][font=宋体]恒压转[/font][font=Calibri]150 min[/font][font=宋体],湿法转膜。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4[/font][font=宋体]、如何避免“斑点状”或不均匀的蛋白免疫印迹?[/font][/font][font=宋体][font=宋体]为避免进行蛋白免疫印迹法时出现[/font][font=宋体]“斑点状”或不均匀的印迹,有以下几种方法[/font][font=Calibri]: [/font][/font][font=宋体]? 延长封闭时间,以优化封闭效果。[/font][font=宋体]? 延长洗涤次数 (这对组织匀浆样品尤为重要)。[/font][font=宋体]? 在配置封闭液时,确保奶粉完全溶于溶液。[/font][font=宋体]? 在取出抗体溶液使用之前,旋转装有抗体溶液的试管,防止出现蛋白沉淀。[/font][font=宋体] [/font][font=宋体][font=Calibri]5[/font][font=宋体]、如何避免印迹上出现“点状”、不均匀的斑点?[/font][/font][font=宋体][font=宋体]为避免印迹上出现[/font][font=宋体]“点状”或不均匀斑点,请尝试以下几种方法:[/font][/font][font=宋体]? 检查所有缓冲液是否被细菌污染。[/font][font=宋体]? 确保在抗体和清洗孵育过程中膜完全浸入。[/font][font=宋体]? 在转膜时,排除薄膜和凝胶之间的所有气泡。[/font][font=宋体]? 将膜放在摇床上,确保均匀地接触。[/font][font=宋体]? 清洗蛋白免疫印迹所需的设备。[/font][font=宋体][font=宋体]? 过滤[/font][font=Calibri]HRP[/font][font=宋体]结合物,除去任何可能的聚集物。[/font][/font][font=宋体]?减少底物暴露时间。[/font][font=宋体] [/font][font=宋体][font=Calibri]6[/font][font=宋体]、选择什么作为[/font][font=Calibri]WB[/font][font=宋体]抗体的阳性对照?[/font][/font][font=宋体]为了使您的蛋白免疫印迹抗体中获得最佳性能,请使用技术数据表中推荐的阳性对照。阳性对照将帮助您按照制定的方案,在实验中获得准确的结果。[/font][font=宋体][font=宋体]我们建议将这些裂解物放置在[/font][font=Calibri]-20[/font][font=宋体]℃下长期储存。裂解物非常稳定,它们是细胞制剂,所有酶均变性和灭活。我们做了大量的研究,证实了不同条件下的稳定性。例如,大多数裂解物的完整性和质量不受反复冻融的影响,可在[/font][font=Calibri]25[/font][font=宋体]℃下储存长达[/font][font=Calibri]12[/font][font=宋体]周。但裂解物在[/font][font=Calibri]37[/font][font=宋体]°[/font][font=Calibri]C[/font][font=宋体]下[/font][font=Calibri]4[/font][font=宋体]周时开始降解。然而,根据裂解物的来源,稳定性可能存在一些轻微差异,因此我们建议将其储存在[/font][font=Calibri]-20[/font][font=宋体]℃下。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]7[/font][font=宋体]、应该分析多少蛋白质?[/font][/font][font=宋体]我们建议:[/font][font=宋体]样本类型[/font][font=宋体]每条泳道[/font][font=宋体]全细胞裂解液[/font][font=宋体][font=Calibri]50 [/font][font=宋体]μ[/font][font=Calibri]g[/font][/font][font=宋体]细胞核提取物[/font][font=宋体][font=Calibri]25 [/font][font=宋体]μ[/font][font=Calibri]g[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]8[/font][font=宋体]、应该使用多少浓度的丙烯酰胺凝胶来分离蛋白?[/font][/font][font=宋体]为了更好地分离感兴趣蛋白,丙烯酰胺凝胶的百分比应基于蛋白分子量。我们建议:[/font][font=宋体][font=宋体]蛋白大小([/font][font=Calibri]kDa[/font][font=宋体])[/font][/font][font=宋体][font=宋体]丙烯酰胺凝胶百分比([/font][font=Calibri]%[/font][font=宋体])[/font][/font][font=宋体][font=Calibri] 80[/font][/font][font=宋体][font=Calibri]7.5[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]9[/font][font=宋体]、蛋白免疫印迹法应使用哪种印迹膜?[/font][/font][font=宋体][font=宋体]我们建议使用硝酸纤维素([/font][font=Calibri]NC[/font][font=宋体])膜。虽然聚偏二氟乙烯([/font][font=Calibri]PVDF[/font][font=宋体])膜、尼龙膜和[/font][font=Calibri]DEAE[/font][font=宋体]纤维素膜也可以使用,但有时会产生升高的背景,特别是实验过程中使用山羊多克隆抗体。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]10[/font][font=宋体]、应该使用什么封闭缓冲液?[/font][/font][font=宋体][font=宋体]封闭液的选择与目标蛋白有关,我们建议一般使用[/font][font=Calibri]1X TBS[/font][font=宋体]、[/font][font=Calibri]5%[/font][font=宋体]脱脂奶粉、[/font][font=Calibri]0.05%[/font][font=宋体]吐温[/font][font=Calibri]-20[/font][font=宋体]作为封闭液,在室温下封闭[/font][font=Calibri]30-60[/font][font=宋体]分钟或在[/font][font=Calibri]4[/font][font=宋体]℃下封闭过夜。请注意,如果封闭过夜,缓冲液中应不加吐温[/font][font=Calibri]-20[/font][font=宋体]。如果目标蛋白较特殊(如磷酸化),建议使用[/font][font=Calibri]1X TBS[/font][font=宋体]、[/font][font=Calibri]1% BSA[/font][font=宋体]并含有吐温[/font][font=Calibri]-20[/font][font=宋体]的封闭液,可得到较清晰条带。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]11[/font][font=宋体]、一抗的稀释倍数一般是多少?[/font][/font][font=宋体]请查看各个抗体的数据表,因为这通常记录起始稀释度。如果数据表上没有具体稀释信息,我们建议您对相关的阳性和阴性对照进行连续滴定。[/font][font=宋体] [/font][font=宋体][font=Calibri]12[/font][font=宋体]、为什么实际的蛋白免疫印迹条带大小与预期的不同?[/font][/font][font=宋体][font=宋体]蛋白免疫印迹法是根据蛋白质大小分离蛋白的技术。一般来说,蛋白越小,其在[/font][font=Calibri]SDS-PAGE[/font][font=宋体]凝胶中移动的速度就越快。然而,移动速率也受到其他因素的影响,因此实际条带大小可能与预测不一致。[/font][/font][font=宋体] [/font][font=宋体]可能的原因[/font][font=宋体]备注[/font][font=宋体]①翻译后修饰[/font][font=宋体]例如磷酸化、糖基化等,可增加蛋白质的大小。[/font][font=宋体]②翻译后切割[/font][font=宋体]大多数蛋白质首先合成为前体蛋白形式,再经切割产生活性形式,例如前体半胱天冬酶。[/font][font=宋体]③剪接变体[/font][font=宋体][font=宋体]可变剪切会产生从同一基因产生不同大小的蛋白质。剪接变体的表达具有高度变异性,取决于使用的特定组织和实验条件[/font] [font=宋体]。[/font][/font][font=宋体]④亚型[/font][font=宋体]许多蛋白质表达多种不同大小的亚型。相同靶蛋白不同亚型的表达具有高度变异性,取决于使用的特定组织和实验条件。参照不同的网站,确定特定靶标的亚型。[/font][font=宋体]⑤相对电荷[/font][font=宋体][font=宋体]氨基酸组成(带电[/font][font=Calibri]vs.[/font][font=宋体]不带电)。[/font][/font][font=宋体]⑥多聚体[/font][font=宋体]例如蛋白质二聚化。尽管相互作用可能导致出现较高条带,但在还原条件下需防止该情况。[/font][font=宋体] [/font][font=宋体][font=Calibri]13[/font][font=宋体]、为什么蛋白免疫印迹结果信号微弱或完全没有信号?[/font][/font][font=宋体] [/font][font=宋体]可能的原因[/font][font=宋体]备注[/font][font=宋体]①抗体滴定 [/font][font=宋体][font=宋体]应使用多种抗体浓度进行抗体滴定实验,以确定最佳信噪比的合适抗体浓度。一般而言,滴定浓度应在[/font][font=Calibri]0.2-5.0 [/font][font=宋体]μ[/font][font=Calibri]g/mL[/font][font=宋体]。[/font][/font][font=宋体][font=宋体]②组织[/font][font=Calibri]/[/font][font=宋体]细胞特异性 [/font][/font][font=宋体]靶蛋白表达取决于待测的细胞或组织。应进行文献检索,确保您正在使用的细胞等条件适用于检测靶蛋白。[/font][font=宋体]③复溶 [/font][font=宋体]在重新溶解冻干抗体时应注意,确保抗体全部溶解。尽管冻干抗体沉淀通常位于试管底部,但有时粉末可能位于管壁上。因此,溶解时应覆盖试管的整个表面,以确保抗体完全溶解。然后进行短暂离心,确保将所有粉末收集在试管底部。[/font][font=宋体]④阳性对照 [/font][font=宋体]在您的蛋白免疫印迹中添加阳性对照泳道是评价抗体是否正常工作和实验条件是否适当的最佳方法。另外,基于文献或实验结果的阳性对照也可以用来评估抗体是否正常发挥作用。[/font][font=宋体] [/font][font=宋体][font=宋体]更多[/font][font=Calibri]WB[/font][font=宋体]蛋白免疫印迹法常见问题详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/category/wb-faq[/font][/font][font=宋体][font=Calibri][url=https://cn.sinobiological.com/services/western-blot-wb-service][b]Western Blot[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/services/western-blot-wb-service][b]检测服[/b][/url]务:[/font][font=Calibri]https://cn.sinobiological.com/services/western-blot-wb-service[/font][/font]
[font=宋体]免疫荧光法和免疫印迹法是生物学领域中两种常用的实验技术,它们在原理、操作过程和应用方面有着显著的区别。本文将详细探讨这两种技术的区别,以便更好地理解它们的特点和应用价值。[/font][font=宋体] [/font][font=宋体]首先,我们来了解免疫荧光法。免疫荧光法是一种利用荧光物质标记的特异性抗体来检测细胞内或细胞表面抗原的技术。其基本原理是抗原抗体反应,通过荧光显微镜观察荧光标记的抗原,从而实现对抗原的定位和定量分析。免疫荧光法具有高灵敏度、高特异性和定位准确的特点,广泛应用于细胞生物学、微生物学、免疫学等领域。[/font][font=宋体] [/font][font=宋体]相比之下,免疫印迹法则是通过检测细胞或组织提取物中特定抗原的存在和分布,以了解其在生物学过程中的作用。这种方法通常涉及到蛋白质的提取、分离、转移和检测等步骤。免疫印迹法能够检测蛋白质的分子量、表达水平以及与其他分子的相互作用,为生物学研究提供了重要的信息。[/font][font=宋体] [/font][font=宋体]在操作过程上,免疫荧光法主要涉及细胞的固定、通透、抗体孵育和荧光显微镜观察等步骤。而免疫印迹法则需要进行蛋白质的提取、电泳分离、膜转移、抗体孵育和显色等复杂操作。因此,从操作难度和复杂性来看,免疫印迹法相对更为繁琐。[/font][font=宋体] [/font][font=宋体]在结果解读和应用方面,免疫荧光法能够提供直观、定位准确的抗原分布信息,有助于研究细胞的结构和功能。而免疫印迹法则能够揭示蛋白质的表达水平、分子量和相互作用,为疾病诊断、药物研发和生物学机制研究提供有力支持。[/font][font=宋体] [/font][font=宋体]此外,免疫荧光法和免疫印迹法在应用领域上也有所不同。免疫荧光法广泛应用于细胞生物学、微生物学、免疫学等领域,特别是在病毒检测、细胞信号转导和细胞凋亡等研究中发挥着重要作用。而免疫印迹法则更多地应用于分子生物学、生物化学和病理学等领域,对于研究蛋白质的结构、功能和调控机制具有重要意义。[/font][font=宋体] [/font][b][font=宋体]免疫荧光法和免疫印迹法优缺点介绍:[/font][/b][font=宋体] [/font][table][tr][td][font=宋体]技术[/font][/td][td][font=宋体]优点[/font][/td][td][font=宋体]缺点[/font][/td][/tr][tr][td=1,4][align=center][font=宋体]免疫荧光法[/font][/align][/td][td][font=宋体]特异性强[/font][/td][td][font=宋体]非特异性染色问题尚未完全解决[/font][/td][/tr][tr][td][font=宋体]敏感性高[/font][/td][td][font=宋体]操作程序较复杂[/font][/td][/tr][tr][td][font=宋体]速度快[/font][/td][td][font=宋体]需要特殊的昂贵仪器(荧光显微镜)[/font][/td][/tr][tr][td][font=宋体]早期诊断价值[/font][/td][td][font=宋体]染色标本不能长期保存[/font][/td][/tr][tr][td=1,3][align=center][font=宋体]免疫印迹法[/font][/align][/td][td][font=宋体]操作简便[/font][/td][td][font=宋体]对于低丰度的抗原可能不够敏感[/font][/td][/tr][tr][td][font=宋体]所需实验材料相对简单[/font][/td][td][font=宋体]无法提供抗原在细胞或组织中的定位信息[/font][/td][/tr][tr][td][font=宋体]对某些特定抗原的检测具有较高的灵敏度[/font][/td][td][font=宋体]需要一定的实验技能和经验[/font][/td][/tr][/table][font=宋体] [/font][font=宋体]综上所述,免疫荧光法和免疫印迹法是两种具有不同特点和应用领域的实验技术。免疫荧光法注重抗原的定位和定量分析,操作简便直观;而免疫印迹法则关注蛋白质的表达和相互作用,操作相对复杂但能提供深入的信息。在实际应用中,我们需要根据研究目的和需求选择合适的技术手段,以获取准确、可靠的实验结果。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/immunofluorescence-service][b]免疫荧光([/b][/url][/font][font=Calibri][url=https://cn.sinobiological.com/services/immunofluorescence-service][b]IF[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/services/immunofluorescence-service][b])检测服务[/b][/url],更多详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/immunofluorescence-service[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
分子印迹QQ群 32430532欢迎做分子印迹的加入 新建,也希望加入的同志宣传宣传,壮大队伍
请问那位朋友也是做分子印迹的。并且是以微球的方式制作。分子印迹的微球是透明的吗?
1.您在做分子印迹物合成的时候,所用的甲基丙烯酸(MAA)、乙二醇二甲基丙烯酸酯(EDMA)是否均重蒸过?2.外国公司生产的甲基丙烯酸(MAA)、乙二醇二甲基丙烯酸酯(EDMA)是否可以直接用于MIP合成?3.我在重蒸MAA时,烧瓶出现白色泡沫继而膨胀,最后形成白色多孔胶状物,重蒸失败。你遇到过这种情况吗?是什么原因?有什么办法避免和处理?
分子印迹技术到底是干什么用的?希望做过的朋友说说这种技术的作用以及优缺点
那个大哥大姐发一些与分子印迹-填充柱方面的英文文献小弟看看啊。我目前正在做分子印迹填充柱方面的博士论文,但找到的相关文献比较少,主要是这边读书馆没有购买相关的数据库。 目前我做的是采用种子溶胀法制备可控粒径的分子印迹球(1~10UM),然后采用高压均浆法填充到空管色谱柱中进行富集分离。所以希望能见到与此类似的论文。谢谢了!!!
在论坛上面看到一个帖子上面说,空心阴极灯工作的时候有几百度的温度。但是我有点疑惑要是有那么高的温度为什么灯管摸着怎么不烫呢。有没有了解的版友来解释一下啊
想了解蛋白印迹仪,哪位手上有资料可以发给我谢谢!xq.shi@126.com
我是研究分子印迹的,要应用于固相萃取柱中,有做分子印迹的同道吗?一起交流交流!!

阴极灯相信大家都见过,但是汞阴极灯就不一定了。因为使用原吸测汞的人似乎不多之故。汞灯除了作为测试光源之用外,还有一个作用就是利用汞的谱线来检查仪器的波长精度。常用汞灯的谱线大概为:365nm, 404.7nm, 435.8nm, 546.1nm, 577nm, 579nm 这么几条。近期购买了一只汞阴极灯,该灯点燃后在橙红色的氖光的衬托下,灯内阴极的顶部犹如一朵蘑菇云般的光晕发出绚丽的蓝色煞是好看;请教阴极灯制作商后,感到很有特点,故写下来与大家共欣赏。汞灯点燃后的状态如图-1所示:http://ng1.17img.cn/bbsfiles/images/2012/02/201202091127_348494_1602290_3.jpg图-1 点燃后的汞阴极灯http://ng1.17img.cn/bbsfiles/images/2012/02/201202091128_348495_1602290_3.jpg图-2 美丽的弧光汞阴极灯有新旧两种类型。旧型的汞阴极灯我在很早以前见过,灯内依稀可见液体状的汞珠附着在灯玻壳内壁,这种汞灯发出的汞线很强,点燃后灯内基本看到的都是蓝白色的汞气辉光;由于这种灯的噪声较大且生产时的污染较严重,目前这种汞阴极灯已经淘汰了,遗憾的是当时没有数码相机留照。如图-1所示的这种新型的汞灯其最大特点是阴极材料已不再是纯汞了,而是采用了汞与钛的合金材料,称为“钛汞齐”;这种合金材料仅仅涂在阴极引线的顶端处一点点即够用了,并且非常环保,这是与其他阴极灯不同的地方。这种阴极结构见图-3所示:http://ng1.17img.cn/bbsfiles/images/2012/02/201202091657_348581_1602290_3.jpg图-3 阴极构造由于汞的熔点很低,在氖离子的撞击下很容易升华启辉;为了防止汞灯的异常启辉(俗语称为“拉弧”),该灯叫一般阴极灯的构造有所不同,见图-4所示:http://ng1.17img.cn/bbsfiles/images/2012/02/201202091129_348497_1602290_3.jpg图-4 灯内构造以上的构造为了防止阳极高压与阴极之间异常放电而产生“拉弧”现象,在阴极连杆的外围加装了一层玻璃内衬管,同时在带高压的阳极与阴极下部之间,加装了两层云母的隔离层;这些措施均是为了防止汞灯产生异常拉弧,仅让阳极的高压作用在阴极顶端的汞钛齐启辉点处,以利启辉。如图-5所示:http://ng1.17img.cn/bbsfiles/images/2012/02/201202091130_348498_1602290_3.jpg图-5 启辉点为了使汞灯的启辉点的光束集中而增加发射强度,汞灯的石英窗一概往常的平板式样而设计成为凹陷式样,也就是将正真的石英窗板拉近了与阴极的距离,如图-6所示:http://ng1.17img.cn/bbsfiles/images/2012/02/201202091131_348499_1602290_3.jpg图-6 凹式石英窗值得注意的是,汞灯虽然熔点很低,但是在温度很低的环境中,却不易启辉发光;此时只要用手在灯的玻璃外壳上摩擦几下,便容易启辉了。
最近新合成了一根分子印迹整体柱,上了电泳试了下,发现样品混合物出来的图是一个尖峰边上连着一个馒头峰,进单独定峰位时也是一个尖峰连着一个馒头峰,是是不是意味着没有印迹效果?还是印迹效果太强了,保留在柱子里洗脱不出来了?另外,在分子印迹整体柱样品与样品分析之间是用什么冲洗的?我用的是乙腈,不知道对不对还有,发现了一个现象,刚合成好的柱子,进的第一针是丙酮,充当电渗流标记物,刚开始还好好的,后来进了几针样品之后发现丙酮不出峰了,我在想是不是因为样品吸附到MAA上了,导致电渗流变小,那用什么流动相去冲洗呢?

前些日子,看到了一款PE仪器上使用的各种阴极灯,其中有国产的和进口原装的;无意中我发现两种产地的阴极灯的阴极的内径有着很大的差异。其中进口的阴极灯的内径较国产的大了许多,见附图:[img]http://ng1.17img.cn/bbsfiles/images/2013/03/201303170759_430518_1602290_3.jpg[/img]国产阴极灯[img]http://ng1.17img.cn/bbsfiles/images/2013/03/201303170759_430519_1602290_3.jpg[/img]原装阴极灯-1 ;这个阴极内径与国产灯相比,已经是很大了。[img]http://ng1.17img.cn/bbsfiles/images/2013/03/201303170759_430520_1602290_3.jpg[/img]原装阴极灯-2;这个阴极灯的内径就更大啦!我的问题是:是不是阴极内径大的灯的谱线发射强度也随之更大一些?
BCEIA中有一偏关于分子印迹技术在色谱中应用的文章,其中出现libarary这个单词不知是不是图库的意思。有看过此篇文章的请回帖 谢谢
如何开发高效的前处理的材料和方法,提高样品前处理水平,已经成为目前食品分析化学的研究热点之一,由于分子印迹聚合物具有功能预定性、选择特异性、适用范围广等特点,基于分子印迹聚合物(Molecularly imprinted polymers, MIPs)的分子印迹固相萃取技术(Molecularly imprinted solid phase extraction, MISPE)已经成为食品安全检测技术发展的新趋势。本论文针对肉用家畜和水产品中应用广泛且危害严重的红霉素和氯丙嗪兽药制备了特异的分子印迹聚合物,对制备的聚合物的结合机理和识别特性进行了深入分析,并最终制备了这两类兽药的分子印迹固相萃取小柱,应用于实际样品中红霉素和氯丙嗪的残留分析。研究获得的主要结果如下:本课题采用本体聚合的分子印迹方法从制备的 6 组红霉素分子印迹聚合物中选取一组特异性较强的聚合物用于后续研究。该组合模板红霉素和单体 MAA(methacrylic acid)的比例为(1:2),交联剂为 EGDMA(ethylene glycol dimethacrylate),采用甲醇/乙腈(2:3, v/v)作为致孔剂,热聚合温度为 60℃。利用扫描电镜观察、孔径分析、热重分析、紫外光谱和红外光谱分析等方法对聚合物的物理特征进行了评价。同时通过对聚合物吸附能力的热力学和动力学特性以及高效液相色谱分析,对聚合物与红霉素之间可能的印迹机理和识别能力进行了研究,证明了制备的聚合物对模板的吸附能力主要来自于低亲和力和高亲和力两类结合位点,并计算出两个结合位点的最大结合量分别为 12.30 mg g1-和 72.09 mg g1-。课题以分子印迹聚合物为固相萃取的填料,制备了红霉素分子印迹固相萃取小柱并对小柱的萃取条件进行了优化。当红霉素分子印迹聚合物固相萃取条件采用的上样缓冲液为 40%甲醇,淋洗液为 2.5 mL80%甲醇,洗脱液为 3mL 的甲醇/PBS (0.5 M) (80:20, v/v)时,固相萃取柱对红霉素的回收率超过 80%,非印迹聚合物固相萃取小柱的回收率则小于 30%。采用优化后的固相萃取的方法,研究了聚合物的选择性,结果显示红霉素分子印迹聚合物对大环内酯类药物具有一定的交叉反应性。说明在印迹反应过程中模板的立体构型对特异性识别的建立起主要作用。试验中将制备的红霉素分子印迹固相萃取小柱用于猪肉样品中红霉素残留的前处理,结果显示经过 MIPs 净化的样品,基质对检测的干扰大大降低,同时极大提高了检测器的灵敏度。在选用的三个加标浓度下,红霉素的回收率都大于 79%。采用红霉素分子印迹固相萃取小柱从水中富集红霉素的实验,同时证明制备的聚合物在自来水中可以高效的富集红霉素。另外,我们制备了氯丙嗪的 MIPs,摸索了不同的合成方法和不同组成成分对产物的选择能力的影响。结果证明,通过本体法制备的聚合物,当使用 MAA 做为单体,模板单体的比例为 1:4,选用 TRIM(Trimethylolpropane trimethacrylate)作为交联剂时,得到的聚合物的选择性最高。试验通过色谱分析试验、红外光谱试验等研究了氯丙嗪与功能单体之间的自组装过程。选择性分析和容量分析的结果表明制备的氯丙嗪分子印迹聚合物相对于非印迹聚合物具有明显的选择性和吸附容量。当使用水溶液作为溶剂时,氯丙嗪分子印迹聚合物的最大特异吸附容量为 10mg mL1-。使用氯丙嗪分子印迹聚合物固相萃取柱对猪尿样品中该药残留的富集和净化相对于商业化的 C18 小柱的效果更明显。