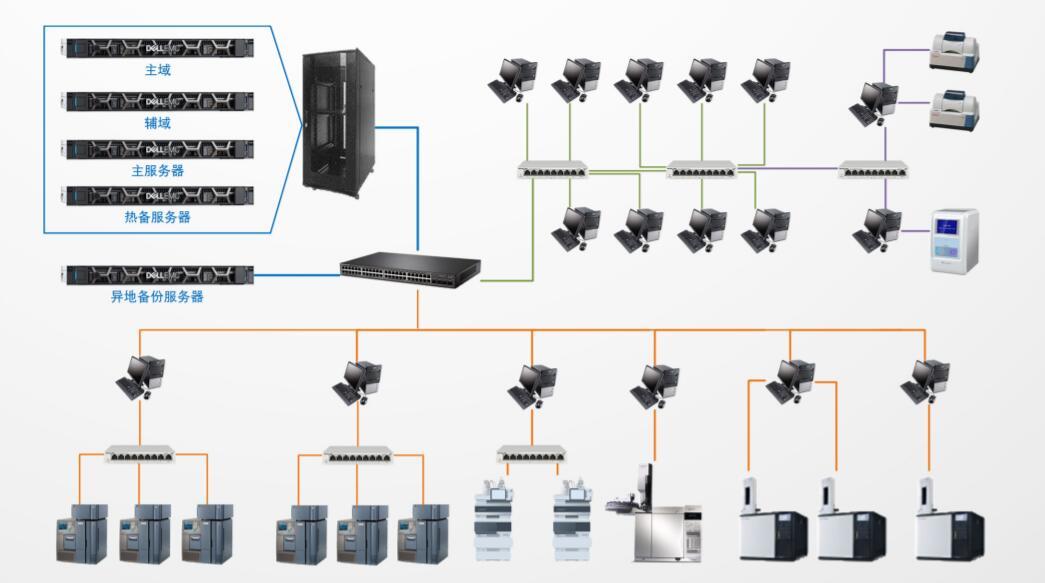
毒淀粉完整检测方法
针对本次毒淀粉事件,上海伍丰第一时间做出应用分析方法回应。现伍丰以拥有完整检测方法可提供给用户。 事件回顾: 珍珠奶茶、甜不辣、粉圆、板条、鸡排……这些台湾经典美食,近日因台湾“毒淀粉”风波愈演愈烈而深陷“染毒”疑云,台湾食品安全也面临继2011年“塑化剂”事件后的最大危机 “毒淀粉”事件被踢爆源自今年3月间,台湾嘉义县调查站接获检举称,在食物中发现含顺丁烯二酸的有毒淀粉。随着全台展开彻查,“毒淀粉”事件雪球越滚越大。 顺丁烯二酸又名马来酸酐,是工业原料,加入淀粉后可增加食物的弹性、黏性及外观光亮度,但会对人体肾脏造成极大损伤。 台湾林口长庚医院临床毒物科主任林杰梁说,一片鸡排上通常会有将近200克的酥炸粉,如果酥炸粉里有“毒淀粉”,一名体重60公斤的成年人,一年只要吃下20片鸡排,就可能造成不孕或影响肾脏功能。 经检查,含有“毒淀粉”的不乏一些名小吃,如基隆庙口夜市的百年老店“天一香肉羹顺”。台湾出口至新加坡的11项淀粉制品也被验出含顺丁烯二酸,包括知名的阿甘绿茶、台南上智关庙面、伯思美的珍珠粉圆等。 截至26日,台湾各地卫生局封存问题淀粉超过200吨。稽查人员表示,50公斤顺丁烯二酸能调制出6000公斤修饰淀粉,产量相当大,恐怕已流向下游的夜市、小吃摊档。 台湾人喜欢用“Q”来形容食物爽滑劲道,“毒淀粉”事件一曝光,民众不禁谈“Q”色变,台湾享有盛名的小吃更面临严重信任危机。台湾高雄知名小吃黑轮大王在被查出进货来源含“毒淀粉”后,已暂时关门停业。 台湾珍珠奶茶年产值高达1000多亿元(新台币,下同),被誉为“东方的可口可乐”,而珍珠奶茶的“珍珠”正是用淀粉制成。记者走访台北街头多家饮料店时询问得知,因为“毒淀粉”闹得人心惶惶,这几天珍珠奶茶销售量大受影响。 除“毒淀粉”外,台湾近期还查出“毒酱油”及滥用过期原料,为食品安全连续敲响警钟。 27日,台湾卫生主管部门宣布即日起采取“坚壁清野”政策,三天内清查全台所有淀粉厂,确定问题淀粉的来源、流向、回收情况。自6月1日起要求所有台湾淀粉类原料制造商或贩卖商需提供安全证明给下游厂商,并明显张贴在店家供消费者检视确认,违者最重罚款15万元。 此外,台湾立法机关也拟审议“《食品卫生管理法》修正案”,针对不肖业者使用有毒危害人体健康的原料制造食品,最高罚金由600万元提高至1000万元。 台湾媒体刊文说,从“塑化剂”到“毒淀粉”,主管部门一直在补破网,难保不会有下一个食品安全未爆弹。有民众称,如果只会亡羊补牢、没有痛定思痛,“毒食恐慌还会层出不穷”,呼吁主管部门“上紧发条”。 伍丰回应检测方法: 我们建立了一种快速检测淀粉中顺丁烯二酸的高效液相色谱方法。确定的实验条件为:利用1 0%的乙醇提取样品,采用Shim-packVP-ODS柱(4.6 mm×1 50 mm,5μm),柱温3 0℃,检测波长2 20 nm,采用十六烷基三甲基溴化铵磷酸缓冲液与8 0%乙腈的混合物(体积比为8 0∶2 0)为流动相,流速1.0 mL/min。在确定的实验条件下,顺丁烯二酸在5~100 mg/L范围内线性关系良好,相关系数r=0.9999,平均回收率为9 8.56%,RSD=1.70%。本方法灵敏度高,结果准确、可靠,可以用于淀粉中顺丁烯二酸的含量检测。 (以上为摘要,详细方法请联系各地办事处或咨询总公司) 伍丰市场部:喻人凤