酸性废水主要来自钢铁厂、化工厂、染料厂、电镀厂和矿山等,其中含有各种有害物质或重金属盐类。酸的质量分数差别很大,低的小于1%,高的大于10%。碱性废水主要来自印染厂、皮革厂、造纸厂、炼油厂等。其中有的含有机碱或含无机碱。碱的质量分数有的高于5%,有的低于1%。酸碱废水中,除含有酸碱外,常含有酸式盐、碱式盐以及其他无机物和有机物。酸碱废水具有较强的腐蚀性,需经适当治理方可外排。
-acetal 醛缩醇 acetal- 乙酰 acid 酸 -al 醛 alcohol 醇 -aldehyde 醛 alkali- 碱 allyl 丙烯基 alkoxy- 烷氧基 -amide 酰胺 amino- 氨基的 -amidine 脒 -amine 胺 -ane 烷 anhydride 酐 anilino- 苯胺基 aquo- 含水的 -ase 酶 -ate 含氧酸的盐、酯 -atriyne 三炔 azo- 偶氮 benzene 苯 bi- 在盐类前表示酸式盐 bis- 双 -borane 硼烷 bromo- 溴 butyl 丁基 -carbinol 甲醇 carbonyl 羰基 -caboxylic acid 羧酸 centi- 10-2 chloro- 氯代 cis- 顺式 condensed 缩合的、冷凝的 cyclo- 环 deca- 十 deci 10-1 二 -dine 啶 dodeca- 十二
酸性废水主要来自钢铁厂、化工厂、染料厂、电镀厂和矿山等,其中含有各种有害物质或重金属盐类。酸的质量分数差别很大,低的小于1%,高的大于10%。碱性废水主要来自印染厂、皮革厂、造纸厂、炼油厂等。其中有的含有机碱或含无机碱。碱的质量分数有的高于5%,有的低于1%。酸碱废水中,除含有酸碱外,常含有酸式盐、碱式盐以及其他无机物和有机物。 酸碱废水具有较强的腐蚀性,需经适当治理方可外排。治理酸碱废水一股原则是:(1)高浓度酸碱废水,应优先考虑回收利用,根据水质、水量和不同工艺要求,进行厂区或地区性调度,尽量重复使用:如重复使用有困难,或浓度偏低,水量较大,可采用浓缩的方法回收酸碱。(2)低浓度的酸碱废水,如酸洗槽的清洗水,碱洗槽的漂洗水,应进行中和处理。 对于中和处理,应首先考虑以废治废的原则。如酸、碱废水相互中和或利用废碱(渣)中和酸性废水,利用废酸中和碱性废水。在没有这些条件时,可采用中和剂处理。
维权声明:本文为zlhuang0132原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。pH缓冲溶液的组成、作用及计算zlhuang0132 pH缓冲溶液是分析测试中应用最为广泛的试剂溶液。其作用是用来稳定溶液的pH值,以满足测试中对恒定pH的要求。虽然pH缓冲溶液的组成并不复杂,但关于pH缓冲溶液的计算却是酸碱滴定分析中计算最为复杂的内容。下面介绍一下pH缓冲溶液的组成和各种类型的化学计算方法。1 pH缓冲溶液的组成和作用1.1 pH缓冲溶液的类型与作用 pH缓冲溶液包括两大类:标准缓冲溶液和普通缓冲溶液。 标准缓冲溶液主要用在酸度计测量溶液pH值时的仪器校正和定位,要求数值准确、精确。因此对试剂纯度、浓度准确性、温度等都有严格要求,这类缓冲溶液有专门的化学试剂商品,可以购买配制,也可以用优级纯试剂按资料的配比配制。 普通缓冲溶液主要用于化学分析和仪器分析中要控制一定pH值的测定过程中。几乎所有的EDTA络合滴定都必须在一定的pH范围内进行,因此,需要加入pH缓冲溶液,例如,测定铅、锌用到HAc缓冲溶液,测定钙、镁、锌用到氨缓冲溶液。又如,氧化还原滴定中,碘量法测铜要用到NH4HF2,碘量法测砷、锑要加NaHCO3。 普通缓冲溶液的配制并不需要像标准缓冲溶液配制那样严格和苛刻,因为对缓冲溶液的pH值要求并不需要非常精确,因此,可以用分析纯试剂来配制,也可以用已有的酸、碱、盐溶液来“搭配”(后述)。1.2 普通pH缓冲溶液的类型 普通pH缓冲溶液按组成不同可分三大类:弱酸-弱碱型缓冲溶液(即共轭酸碱缓冲溶液)、酸式盐缓冲溶液、强酸或强碱溶液。在一些特殊情况下也使用混合体系的缓冲溶液(两种pKa相近的共轭酸碱缓冲溶液混合而成)。大家比较熟悉的是共轭酸碱缓冲溶液,例如,HAc-NaAc、HF-NH4F、NH3-NH4Cl。其实,酸式盐也可作为缓冲溶液,因为酸式盐的pH值大多是恒定的,随其浓度增减的变化不大,例如,NaHCO3溶液在1.0M至0.01M之间,其pH值几乎都在8左右(理论值为8.3),同样可以抵抗溶液中产生的少量强酸、强碱(或外加),保持溶液的pH值恒定或变化微小。强酸、强碱溶液也能缓冲滴定过程中产生的少量强酸或强碱,保持溶液的pH值变化很小,故强酸强碱也可作为广义的pH缓冲溶液(以前的分析化学教材就是这样分的),例如,EDTA络合滴定铋,需另外加入一定量的0.1mol/L硝酸溶液,就是为了增强溶液对滴定中产生的H+的缓冲作用。下面重点介绍最常用的共轭酸碱缓冲溶液的相关知识。 弱酸-弱碱型缓冲溶液的构成与配制。这类缓冲溶液的组成为:弱酸+弱酸盐(即共轭碱)、弱碱+弱碱盐(即共轭酸)。常见的实例有:HAc-NaAc、[font=Tim
电镀溶液中主要成分的作用 不同的电镀溶液含有不同的组成,但不管何种电镀溶液,都含有主盐。根据主盐性质的不同可将电镀溶液分为单盐电镀溶液及络合物电镀溶液两大类。 单盐电镀液都是酸性溶液。络合物电镀溶液有碱性,也有酸性,但其中都含有络合剂。电镀溶液中除主盐及络合剂以外,有些电镀溶液中还有导电盐、缓冲剂、阳极去极化剂以及添加剂等,它们各有不同的作用。 1.主盐是指能在阴极上沉积出所要求的镀层金属的盐。主盐浓度要有一个适宜的范围并与电镀溶液中其它成分维持恰当的浓度比值。 主盐浓度高,一般可采用较高的阴极电流密度,溶液的导电性和阴极电流效率都较高;在光亮性电镀时可使镀层的光亮度和整平性较好。但溶液的带出损失较大、成本较高,同时增大了废水处理的负担。 2.导电盐是指能提高溶液的电导率,对放电金属离子不起络合作用的碱金属或碱土金属的盐类(包括铵盐)。如镀镍溶液中的Na2SO4和焦磷酸盐镀铜中的KNO3和NH4NO3等。 导电盐除了能提高溶液的电导率外,还能略为提高阴极极化,使镀层细致。但也有一些导电盐会降低阴极极化,不过导电盐的加入可扩大阴极电流密度范围,促使阴极极化增大,所以总的来说,导电盐的加入,可使槽电压降低,对改善电镀质量有利。 3.缓冲剂一般是由弱酸和弱酸的酸式盐组成的。这类缓冲剂加入溶液中,能使溶液在遇到酸或碱时,溶液的pH值变化幅度缩小。在电镀生产中,有的镀液为了防止其pH值上升太快,单独加入一种弱酸或弱酸的酸式盐,如镀镍液中的H3BO3和焦磷酸盐镀液中的Na2HPO4等,它们的作用是在电镀时抑制阴极膜中溶液pH值升高。 任何缓冲剂都只能在一定的pH值范围内有较好的缓冲作用,超过了pH值范围,它的缓冲作用较差或完全没有缓冲作用。H3BO3在pH4.3~6.0之间的缓冲作用较好,在强酸性或强碱性溶液中就没有缓冲作用。 4.阳极去极化剂是指在电解时能使阳极电位变负、促进阳极活化的物质。如镀镍液中的氯化物,氰化物镀铜液中的酒石酸盐和硫氰酸盐等。它们的加入,可以降低阳极极化,促进阳极溶解。 5.络合剂在电镀生产中,一般将能络合主盐中金属离子的物质称为络合剂。如氰化物镀液中的NaCN或KCN,焦磷酸盐镀液中的K4P2O7或Na4P2O7等。 络合剂都能增大阴极极化,使镀层结晶细致,同时能促进阳极溶解,但是络合剂的加入,常会降低阴极电流效率,而且会给废水治理带来困难。 在电镀溶液中,络合剂的含量常高于络合金属离子所需的含量,这些除络合金属离子以外多余的络合剂称游离络合剂。在某些镀液中,络合剂的含量,常以它的游离量表示,如氰化物镀铜液中以游离NaCN表示等。游离络合剂含量高,阳极溶解好,阴极极化作用大,镀层结晶细致,镀液的分散能力和覆盖能力较好,但是阴极电流效率降低,沉积速度减慢,过高时,还会使镀件的低电流密度处镀不上镀层;络合剂含量低,镀层的结晶粗,镀液的分散能力和覆盖能力较差。 6.添加剂 为了改善电镀溶液性能和镀层质量,往往在电镀溶液中加入少量的某些有机物,这些物质叫做添加剂。按照它们在电镀溶液中所起作用的不同,可分为如下几类:[img]http://ng1.17img.cn/bbsfiles/images/2006/11/200611202106_32994_1634962_3.gif[/img] 除有机添加剂外,还有某些无机添加剂。无机添加剂多数是硫、硒、碲、铅、铋和锑的化合物。随着电镀工艺的发展,添加剂的应用极其广泛,品种也逐渐增多,它在电镀工业中占有特殊重要的地位。
1.原料药命名 ⑴中文通用名尽量与英文名相对应。可采取音译、意译或音、意合译,-般以音译为主。 ⑵无机化学药品,如化学名常用且较简单,应采用化学名;如化学名不常用,可采用通俗名,如:盐酸、硼砂。酸式盐以“氢”表示,如:碳酸氢钠,不用“重”字;碱式盐避免用“次(Sub-)”字,如:碱式硝酸铋,不用“次硝酸铋”。 ⑶有机化学药品,其化学名较短者,可采用化学名,如:苯甲酸;已习用的通俗名,如符合药用情况,可尽量采用,如:糖精钠、甘油等。化学名较冗长者,可根据实际情况,采用下列方法命名。 ①音译命名。音节少者,可全部音译,如:Codeine可待因;音节较多者,可采用简缩命名,如:Amitriptyline阿米替林。音译要注意顺口、易读,用字通俗文雅,字音间不得混淆,重音要译出。 ②意译(包括化学命名和化学基团简缩命名)或音、意结合命名。在音译发生障碍,如音节过多等情况下,可采用此法命名,如:Chlpromazine氯丙嗪。 ④与酸成盐或酯类的药品,统-采取酸名列前,盐基(或碱基)列后,如:StreptomycinSulfate硫酸链霉素,HydroctisoneAcetate醋酸氢化可的松。与有机酸成盐的药名,一般可略去“酸”字,如:PoldineMetisulfate译为甲硫泊尔定。英文词尾为“ate”的酯类药,可直接命名为“××”酯,如:Fedrilate非屈酯。与缩合基加合成酯类的药亦可将××酯列后,如CefcanelDa1oxate头孢卡奈达酯。 ⑤季铵盐类药品,一般将氯、溴置于铵前,如:BenzalkoniumBromide苯扎溴铵。除沿用已久者外,尽量不用氯化×××,溴化×××命名。与有机酸组成的季铵类药名,酸名列于前,一般亦略去“酸”字,如AmeziniumMetilsulfate译为甲硫阿镁铵。
(一)缓冲作用与缓冲溶液 纯水在25℃时PH值为7.0,但只要与空气接触一段时间,因为吸收二氧化碳而使PH值降到5.5左右。1滴浓盐酸(约12.4mol·L-1)加入1升纯水中,可使增加5000倍左右(由1.0×10-7增至5×10-4 mol·L-1),若将1滴氢氧化钠溶液(12.4mol·L-1)加到1升纯水中,PH变化也有3个单位。可见纯水的PH值因加入少量的强酸或强碱而发生很大变化。然而,1滴浓盐酸加入到1升HOAc-NaOAc混合溶液或NaH2PO4-Na2HPO4混合溶液中,的增加不到百分之一(从1.00×10-7增至1.01×10-7 mol·L-1),PH值没有明显变化.这种能对抗外来少量强酸\强碱或稍加稀释不引起溶液PH值发生明显变化的作用叫做缓冲作用;具有缓冲作用的溶液,叫做缓冲溶液。 (二)缓冲溶液的组成 缓冲溶液由足够浓度的共轭酸碱对组成。其中,能对抗外来强碱的称为共轭酸,能对抗外来强酸的称为共轭碱,这一对共轭酸碱通常称为缓冲对、缓冲剂或缓冲系,常见的缓冲对主要有三种类型。 1.弱酸及其对应的盐 例如,HOAc-NaOAc(实际上是OAc-);H2CO3-NaHCO3;H2C8H4O4-KHC8H4O4(邻苯二甲酸-邻苯二甲酸氢钾);H3BO3-Na2B4O7(四硼酸钠水解后产生H2BO-3)。 2.多元弱酸的酸式盐及其对应的次级盐,例如,NaHCO3-Na2CO3;NaH2PO4-Na2HPO4;NaH2C5HO7(柠檬酸二氢钠)[font=Arial
文章中没有显示公式啥的 http://simg.instrument.com.cn/bbs/images/brow/em09508.gif想下载的可以找到链接 进行下载资料库————缓冲溶液的配制与性能http://www.instrument.com.cn/download/shtml/204329.shtmlhttp://simg.instrument.com.cn/bbs/images/brow/em09505.gif缓冲溶液的配制与性能一 实验目的(1)学习缓冲溶液的配制方法,加深对缓冲溶液性质的理解(2)了解缓冲容量与缓冲剂浓度和缓冲组分的比值关系:(3)练习吸量管的使用方法。二 实验原理 能抵抗外来少量强酸、强碱或适当稀释而保持pH值基本不变的溶液叫缓冲溶液。缓冲溶液一般是由弱酸及其盐、弱碱及其盐、多元弱酸的酸式盐及其次级盐组成。缓冲溶液的pH值可用下式计算: 或 缓冲溶液pH值除主要决定于pKb(pKb)外,还与盐和酸(或碱)的浓度比值有关,若配制缓冲溶液所用的盐和酸(或碱)的原始浓度相同均为C,酸(碱)的体积为Va(Vb),盐的体积为Vs总体积为V,混合后酸(或碱)的浓度为 ,盐的浓度为 ,则 所以缓冲溶液pH值可写为 或 配制缓冲溶液时,只要按计算值量取盐和酸〔或碱)溶液的体积,混合后即可得到一定pH值的缓冲溶液。缓冲容量是衡量缓冲溶液的缓冲能力大小的尺度。为获得最大的缓冲容量,应控制 (或 )=1,酸[font
缓冲溶液与缓冲作用原理 (一)缓冲作用与缓冲溶液 纯水在25℃时PH值为7.0,但只要与空气接触一段时间,因为吸收二氧化碳而使PH值降到5.5左右。1滴浓盐酸(约12.4molL-1)加入1升纯水中,可使[H+]增加5000倍左右(由1.0×10-7增至5×10-4 molL-1),若将1滴氢氧化钠溶液(12.4molL-1)加到1升纯水中,PH变化也有3个单位。可见纯水的PH值因加入少量的强酸或强碱而发生很大变化。然而,1滴浓盐酸加入到1升HOAc-NaOAc混合溶液或NaH2PO4-Na2HPO4混合溶液中,[H+]的增加不到百分之一(从1.00×10-7增至1.01×10-7 molL-1),PH值没有明显变化.这种能对抗外来少量强酸\强碱或稍加稀释不引起溶液PH值发生明显变化的作用叫做缓冲作用 具有缓冲作用的溶液,叫做缓冲溶液。 (二)缓冲溶液的组成 缓冲溶液由足够浓度的共轭酸碱对组成。其中,能对抗外来强碱的称为共轭酸,能对抗外来强酸的称为共轭碱,这一对共轭酸碱通常称为缓冲对、缓冲剂或缓冲系,常见的缓冲对主要有三种类型。 1.弱酸及其对应的盐 例如,HOAc-NaOAc(实际上是OAc-);H2CO3-NaHCO3;H2C8H4O4-KHC8H4O4(邻苯二甲酸-邻苯二甲酸氢钾);H3BO3-Na2B4O7(四硼酸钠水解后产生H2BO-3)。 2.多元弱酸的酸式盐及其对应的次级盐,例如,NaHCO3-Na2CO3;NaH2PO4-Na2HPO4;NaH2C5HO7(柠檬酸二氢钠)-Na2HC6H5O7;KHC8H4O4-K2C8H4O4。 3.弱碱及其对应的盐 例如NH3-NH+4CL-;RNH2-RNH+3A-(伯胺及其盐);Tris-TrisH+A-(三羟甲基烷及其盐)。 (三)缓冲溶液的作用原理 现以HOAc-NaOAc缓冲溶液为例,说明缓冲溶液之所以能抵抗少量强酸或强碱使PH稳定的原理。醋酸是弱酸,在溶液中的离解度很小,溶液中主要以HOAc分子形式存在,OAc-的浓度很低。醋酸钠是强电解质,在溶液中全部离解成Na+和OAc-,由于同离子效应,加入NaOAc后使HOAc离解平衡向左移动,使 HOAc的离解度减小,[HOAc]增大。所以,在HOAc-NaOAc混合溶液中,存在着大量的HOAc和OAc-。其中HOAc主要来自共轭酸HOAc,OAc-主要来自NaOAc。这个溶液有一定的[H+],即有一定的PH值。在HOAc-NaOAc缓冲溶液中,存在着如下的化学平衡: 在缓冲溶液中加入少量强酸(如HCL),则增加了溶液的[H+]。假设不发生其他反应,溶液的PH值应该减小。但是由于[H+]增加,抗酸成分即共轭碱OAc-与增加的H+结合成HOAc,破坏了HOAc原有的离解平衡,使平衡左移即向生成共轭碱HOAc分子的方向移动,直至建立新的平衡。因为加入H+较少,溶液中OAc-浓度较大,所以加入的H+绝大部分转变成弱酸HOAc,因此溶液的PH值不发生明显的降低。 在缓冲溶液中加入少量强碱(如NaOH),则增加了溶液中OH-的浓度。假设不发生其他反应,溶液的PH值应该增大。但由于溶液中的H+立即加入的OH-结合成更难离解的H2O,这就破坏了HOAc原有的离解平衡,促使HOAc的离解平衡向右移动,即不断向生成H+和OAc-的方向移动 ,直至加入的OH-绝大部分转变成H2O,建立新的平衡为止。因为加入的OH-少,溶液中抗碱成分即共轭酸HOAc的浓度较大,因此溶液的PH值不发生明显升高。 在溶液稍加稀释时,其中[H+]虽然降低了,但[OAc-]同时降低了,同离子效应减弱,促使HOAc的离解度增加,所产生的H+可维持溶液的PH值不发生明显的变化。所以,溶液具有抗酸、抗碱和抗稀释作用。 多元酸的酸式盐及其对应的次级盐的作用原理与前面讨论的相似。例如,在NaH2PO4-Na2HPO4溶液中存在着离解平衡: HPO2-4是抗酸成分,通过平衡移能对抗外加酸的影响。H2PO2-4是抗碱成分,通过平衡右移能对抗外加碱的影响。 弱碱及其对应盐的缓冲作用原理,例如,NH3-NH4CL(即NH3-NH+4)溶液中,NH3能对抗外加酸的影响是抗酸成分,NH+4能对抗外加碱的影响是抗碱成分。前者通过下述平衡向右移动而抗酸,后者通过平衡向左移动而抗碱,从而使溶液的PH值稳定。
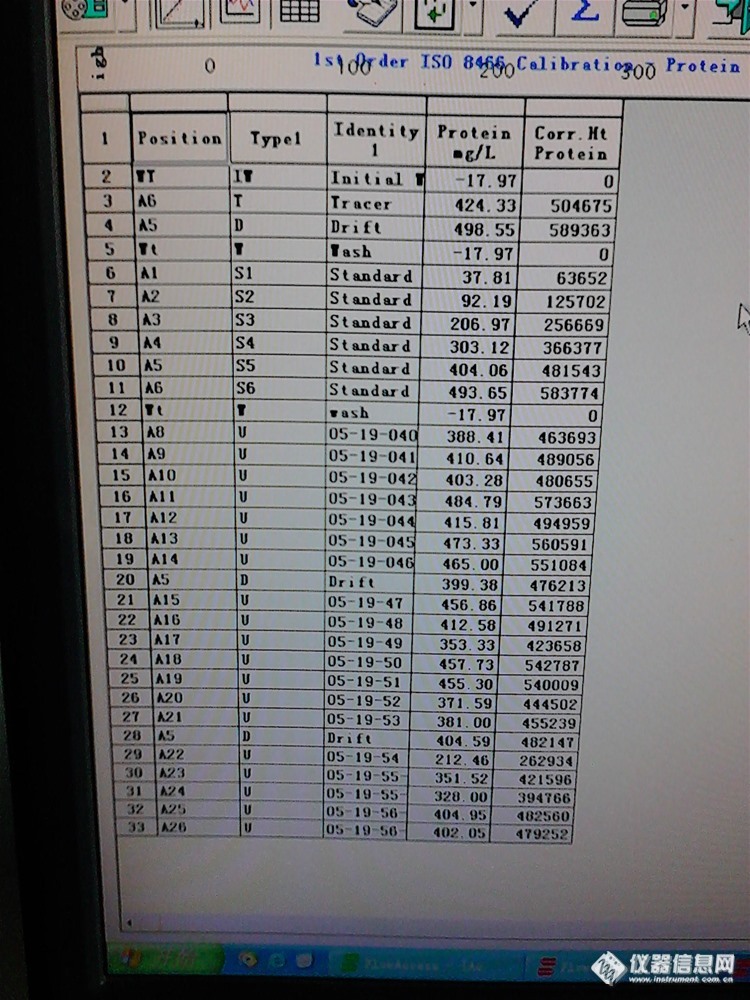
蛋白质是生命的基础 , 人体的重要组成成分。它不仅是一种重要的供能物质 , 更主要的作用是促进生长发育和新陈代谢。但婴幼儿过量的摄入蛋白质会增加 肾脏的负担,因此蛋白质的摄入要根据营养状况、生长发育要求达到供求平衡 。乳及乳制品是婴幼儿摄取蛋白质的主要来源, 安徽阜阳 “毒奶粉 ”事件就是因为婴幼儿食用了蛋白质含量极低的劣质奶粉 ,所以对乳及乳制品中蛋白质含量的监控极为重要. 目前我国测定乳及乳制品中蛋白质的方法主要为凯氏定氮滴定法、凯氏定氮比色法, 但是这两种方法繁琐、费时。连续流动分析法测定乳及乳制品中蛋白质含量,对于批量样品,该方法具有很大的优势,不但简便快捷、而且准确度和灵敏度度也有很大的提高。1.实验部分1. 1 仪器与原理SAN+ +四通道连续流动分析仪 (荷兰SKALAR公司)蛋白质分析模块。原理:自 动测定蛋白质基于改良后的贝特勒反应即经过相互分离后对氨进行分析。消化后 的样品用酸式盐溶液稀释定容,铵盐通过与水杨酸钠反应氯化为一氯化胺, 通过氧化和氧化偶合后形成绿色配合物,反应是以硝普钠为催化剂,次氯酸钠溶液被用于提供氯, 在波长630 nm处检测。1. 2样品前处理准确吸取 液态奶 (或称取固 态奶 ), 同时准备空白样 分别置于 250 mlVELP消化管中 , 加入以1: 10混匀的 CuSO4和K2SO4混合催化剂, 再加入20 ml浓 H2SO4,于蛋白质自动消化仪中消化,最后消化至蓝绿色, 冷却至室温后用蒸馏水定容至100 ml。1.3试剂和标准的配置酸性氯化钠溶液: 称取100 g氯化钠用800 ml水溶解[
化学中的“一定”或“不一定”的热点问题68例1.中学常见的卤族元素与水反应,一定符合:X2+H2O=HX+HXO类型。不一定:F2与水反应方程式应是: 2F2+2H2O=4HF+O2 2.卤族元素与强碱溶液反应的方程式一定是:X2+2OH-=X-+XO-+H2O 即活泼的非金属元素与强碱反应生成无氧盐、低价态的含氧酸盐和水。不一定:F2与强碱溶液反应方程式例外。 3.AgF,AgCl,AgBr,AgI见光一定分解,有感光性。不一定:AgI稳定,见光不分解。 4.卤化银一定不溶于水也不溶于稀酸HNO3。不一定:AgF溶于水。 5.卤族元素在化合物中一定既能是负价也能显正价。不一定,F在化合物中只能显负价,不显正价。 6.卤素的无氧酸一定都是强酸。不一定,氢氟酸却为弱酸。 7.氢卤酸一定不与硅或二氧化硅反应。不一定:氢氟酸却能和硅或二氧化硅反应。 8.卤素单质和铁反应的生成物一定都是FeX3。不一定:I2与铁反应只生成FeI2。 9.金属氧化物一定都是碱性氧化物。不一定:Mn2O7是金属氧化物,但它是酸性氧化物。Al2O3,ZnO为两性氧化物。 10.非金属氧化物一定都是酸性氧化物。不一定:CO,NO是非金属氧化物,但它们不是酸性氧化物。 11.酸酐一定都是非金属氧化物。不一定:Mn2O7是HMnO4的酸酐,但它是金属氧化物。 12.一般来说,具有金属光泽并能导电的单质都一定是金属 。不一定:石墨具有此性质,但它却是非金属。 13.无机物间的反应一定属于四种基本反应类型中的一类, 即化合多变一,分解一变多,置换单对单,复分解两对换。不一定: CO2+NaOH=Na2CO3+H2O 该反应就不属四种基本反应类型中的任何一类反应。 14.一般来说,酸性氧化物之间一定不发生反应。不一定:如果其中一种具有较强的氧化性,另一种具有较强的还原性,则可以发生氧化还原反应,如: SO2+NO2=SO3+NO 15.饱和溶液升高温度后一定是不饱和溶液。不一定:Ca(OH)2的饱和溶液升高温度后仍然为饱和溶液。 16.饱和溶液降低温度后一定还是饱和溶液。不一定:大部分物质的饱和溶液降低温度后,一定还是饱和溶液,而个别物质,其溶解度随着温度的降低而增大者就不是这样。如,Ca(OH)2的饱和溶液,其降低温度因溶解度增大而使溶液成为不饱和溶液。 17.酸式盐的水溶液一定显酸性。不一定:NaHCO3是酸式盐,但它的水溶液显碱性。 18.一般地说,排在金属活动性顺序表氢前面的金属一定能从酸中置换出氢。不一定:这是指稀酸和非氧化性的酸,否则不能置换出氢,如Mg与HNO3或浓H2SO4反应都不放出氢气,因氢很快被氧化成水。另外,冷的浓硫酸或浓HNO3能使铁、铝钝化。 19.强酸一般制弱酸,弱酸一定不能制出强酸。不一定:在一般情况下,弱酸不能制强酸,但在特别情况下,弱酸可以制出强酸。如: H2S+CuSO4=CuS↓+H2SO4 20.酸与酸一定不发生反应。不一定:强氧化性的酸(如浓H2SO4)与强还原性的酸(如氢硫酸)可以发生氧化还原反应: H2S+H2SO4(浓)=SO2↑+S↓+2H2O 21.一切物质都一定是由分子构成。不一定:食盐(离子晶体)是由离子构成,金属是由离子和自由电子构成。 22.碱与碱一定不发生反应。不一定:具有两性的Al(OH)3与NaOH溶液可以发生反应。 23.既能与酸反应又能与碱反应的物质一定是两性氧化物或两性氢氧化物。不一定:NaHCO3,(NH4)2CO3既能与酸反应又能与碱反应,但它们既不是两性氧化物也不是两性氢氧化物。 24.一般来说,酸性氧化物与酸一定不能发生反应。不一定:具有氧化性的酸性氧化物与具有还原性的酸则可以发生氧化还原反应: 2H2S+SO2=3S↓+2H2O 25.酸碱中和反应的离子方程式都一定写成: H++OH-=H2O 不一定:氢氧化铁与硫酸的反应离子方程式应为: Fe(OH)3+3H+=Fe3++3H2O 氢氧化钡和硫酸的反应的离子方程式应写为: Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O 因此,H++OH-=H2O 一般只能表示强酸与强碱溶液反应且生成的盐可溶于水的一类反应。 26.H++OH-=H2O一定表示强酸与强碱的反应的离子方程式。不一定:比如有的酸式盐和强碱反应的离子方程式,也可以写成: H++OH-=H2O 例NaHSO4+NaOH=Na2SO4+H2O的反应。 27.酸和碱发生中和反应一定生成盐和水,不一定:下列反应不完全合乎这条规律: 2H2S+Fe(OH)32FeS↓+S↓+6H2O 这是因为Fe3+的强氧化性和S2-的强还原性使这个反应显示出了特殊性。 28.按金属活动性顺序,排在前面的金属一定能将排在后面的金属从其盐溶液中置换出来。不一定:比如钠与硫酸铜溶液反应,其反应原理是钠先跟溶 液中的水反应生成氢氧化钠,然后氢氧化钠再和硫酸铜反应,即: 2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ 又如:Mg与FeCl3溶液反应,不能将Fe3+还原成Fe,而是: FeCl3+3H2OFe(OH)3+3HCl Mg+2HCl=MgCl2+H2↑ 29.根据金属活动性顺序表的顺序,其阳离子由左到右的氧化能力一定逐渐增强。不一定:氧化能力逐渐增强的总的趋势是正确的,但个别情况有例外,如得电子能力即氧化能力:Fe3+>Cu2+。 30.一切原子的原子核都一定是由质子和中子两种微粒所构成 。不一定:氕(1.1H)的原子核中没有中子。
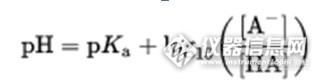
因为在一起工作相处的时间比较久了,所以偶尔就有同仁问到让我很难解释清楚的问题,针对HPLC方面的比较多的是:你为什么用这个流动相,你怎么知道就一定要调节pH到3.5或2.5,诸如此类的问题,一句话两句话还真的难以解释清楚,想解释,但难于表达,还是以文字的形式表述更清晰。在药物分析这一块,化学药,平时接触到的绝大部分是弱酸性或弱碱性的药物。路易斯酸碱理论,大家都懂,Herderson-Halselbalch公式也许并不陌生,本人习惯称之为“H-H公式“,表述为:[img=,266,67]http://ng1.17img.cn/bbsfiles/images/2017/08/201708011314_01_2700892_3.png[/img]先撇开化学方面的因素,从数学方面入手,对于一个弱酸,当pH高于或低于pKa两个单位时,化合物99%以一种形式存在。反相色谱,简言之即流动相极性大于固定相极性的色谱,对于可电离的化合物,要想获得强的反相保留,尽可能不电离,因为化合物一旦电子,极性会变大,不电离时极性最小,极性小,在反相色谱柱上保留就强。对于HPLC分析方法开发,对反相色谱而言,化合物有保留是前提。比如,一个弱酸性化合物,pKa为5.0,那么,当流动相(缓冲液)pH调节为3.0时,99%的化合物是以弱酸形式存在的,即HA形式,此时,化合物极性相对较小,保留较强;另一方面,对于HPLC来讲,以一种形式存在的化合物,可以获得较好的尖锐的峰。对于为什么选择某一种缓冲体系,其实还是根据化合物本身的pKa而定。缓冲体系,简单分,三类:弱碱及其对应的盐,如NH3-NH4CL 弱酸及其对应的盐,如HAc-NaAc;多元弱酸的酸式盐及其对应的次级盐,如K2HPO3-K3PO3。工作中,常用的缓冲盐,绝大部分为磷酸盐或醋酸盐,这就限定了流动相的组成。举例,一个弱酸性化合物,pKa为5.0,可以选择磷酸盐体系,然后用磷酸调节pH至3.0即可,大局就定了。说了这么一大串,最关键的参数依然是pKa,这个参数在HPLC分析方法开发中有着举足轻重的地位。以上仅为个人总结观点,愿对各位坛友有所帮助。

水果香甜可口,蔬菜含有人体所需的各种维生素,但是大部分人会担心农药残留。大家常见的清除果蔬农药残留的方法之一是“将小苏打兑水,再将果蔬放进去浸泡2到3分钟”。可是这样真的有效吗?还有其他更好的办法吗? 一、小苏打http://ng1.17img.cn/bbsfiles/images/2015/12/201512281037_579664_3013923_3.png 先来了解下小苏打为什么能洗农药。小苏打,化学名称是碳酸氢钠,它的特性是溶于水后形成弱碱性溶液(pH=9),可以中和分解农药残留中的酸性部分。但是,农药的品种很多,其中含有酸性基团的农药仅占农药总数的20%-30%左右,更多的是不含酸性基团的农药。而小苏打对这些不含酸性基团的农药则无能为力。另一方面,小苏打溶于水时呈现弱碱性,此特性致使分解农药的速度较慢,几分钟内无法真正起到去除农药的效果,需要将浸泡时间延长到半个小时以上或者更长。总之,小苏打的农药清除效果非常有限。 二、大苏打 小苏打不行,那大苏打怎么样?大苏打或者苏打,又称食用碱,学名碳酸钠。特性为易溶于水,溶于水后发生水解反应,使溶液呈碱性(pH=10)。因此与小苏打一样,苏打也能清除酸性农药。并且由于苏打的碱性相比小苏打更强10倍,因此清除农药的效果也比小苏打强10倍。并且因为苏打属于正盐,小苏打属于酸盐,而正盐的溶解度大于酸式盐,因此苏打比小苏打更易溶于水。在一定程度上可以加快与酸性的中和速度,缩短了清洗农药残留的时间。不过与小苏打一样,苏打也只能与含有酸性基团的农药作用,对其他的农药残留也无能为力。那么对于非酸性的农药,有没有有效的办法呢? 三、活性氧苏打 现在隆重介绍另外一种苏打—活性氧苏打。它在欧美被认为是比小苏打和苏打更高级的绿色清洁产品,具有更好的清除农药的效果。活性氧苏打是碳酸钠(苏打)和过氧化氢(活性氧)结合形成的物质。活性氧苏打在水里溶解后立刻分解生成苏打、水以及活性氧三种成分,因此它同时具备了苏打和活性氧的清洁能力。 “活性氧”是一种强氧化剂,具有广泛杀灭微生物的作用,包括细菌、芽胞、病毒、真菌等。同时,“活性氧”对那些既不溶于水又不能被苏打分解的农药残留有氧化分解的作用。可利用氧原子的活性将农药分子切断,变成易溶于水的小分子,从而达到清除农药的效果。在苏打和活性氧的双重作用下,活性氧苏打可以针对更多的农药残留,包括含酸性的和不含酸性的农药,尤其是顽固的农药残留,清洗效果与普通苏打相比大大提高。 活性氧苏打在国内还不多见,但在欧美和日本已经有广泛的应用了。如日本的衣物漂泊剂、美国的多功能去渍剂、加拿大的果蔬清洗剂。 与小苏打,大苏打一样,活性氧苏打也有工业级和食品级的区别。工业级产品纯度较低,可能会含有重金属等物质,不能用来清洁食品。因此大家在选择的时候一定要认准食品级的正规产品。
名称:ASTM D 664-06 电位滴定法测定石油产品酸值的标准试验方法阿拉山口检验检疫局技术中心 赵晶晶 中哈管道石油公司 常健辉 译本标准使用固定的名称D 664发行;名称后的数字表示第一次采用的年份或最后一次修订的年份。括号里的数字表示最后一次采用的年份。上标表示最后一次修订或采用的版本改变。1. 使用范围1.1本测试方法详述了在甲苯和异丙醇的混合物中可溶或微溶的石油产品和润滑油中酸性成分的测定步骤。它适用于所测的酸在水中的电离常数大于10-9;水解常数小于10-9的弱酸不干扰测定。水解常数大于10-9的盐会发生反应。包括在此精密度酸值范围是0.1mg/g KOH到150mg/g KOH。注1:新油或使用过的油品中,被认为酸性的组分包括有机酸、无机酸、酯类、酚类化合物、内酯、树脂以及重金属盐类、胺盐和其他弱碱的盐类、多元酸的酸式盐,以及某些抗氧和清洁添加剂。1.2本方法可以用来表示发生在油品使用过程中,被氧化条件下的相对变化,在此不考虑油品的颜色和其他的特性的变化。尽管滴定是在明确的平衡条件下进行,但本方法不是用来测定能够预示在操作条件下油品性能的绝对酸性的。酸值与承受腐蚀之间无确定关系。注2:用这种方法测得的酸值与用D974和D3339测得的酸值可能一样,也可能不一样。没有尝试做过此方法和其他非滴定方法的关联。1.3认为以国际单位制表示的数值是标准的。括号里的数值仅作为参考。1.4本标准并未对相关的所有的安全问题都提出建议。因此,在使用本标准之前应建立相应的安全和健康防护措施并制定出相关制度及使用范围。2. 参考文献2.1美国标准:D974用颜色指示剂滴定法测定酸碱值的标准试验方法D1193试剂水的规格D3339Semi-Micro半微量颜色指示剂滴定法测定石油产品酸值的试验方法D4057 石油和石油产品的手工取样法D4177 石油和石油产品的自动取样法3.术语3.1 定义:3.1.1总酸值,n---碱量,表示为滴定每克样品到指定终点所消耗的氢氧化钾的毫克数。3.1.1.1讨论—本方法以每克样品消耗的氢氧化钾的毫克数表示酸值。要求滴定加入了少量的水的混合甲苯和异丙醇的样品,,从伏特计上最初的毫伏读数到方法中规定的毫伏读数。方法中要求的毫伏读数是指新配置的碱性缓冲水溶液的电位值,或曲线上有明显拐点时对应的毫伏读数。3.1.1.2讨论—本方法提供了附加信息。表示以每克样品消耗的氢氧化钾的毫克数表示酸值。要求滴定溶剂中的样品从伏特计上最初的毫伏读数到方法中规定的毫伏读数。方法中要求的毫伏读数是指新配置的酸性缓冲水溶液的电位值,或曲线上有明显拐点时对应的毫伏读数。此值被定义为强酸值。3.1.1. 讨论—所谓的强酸值与其他酸值所造成的影响是不同的,因此,本方法的使用者如果发现这种现象,必须加以区分和注明。4.试验方法概要:4.1试样溶解在含有少量水的甲苯和异丙醇的混合物中,在使用玻璃指示电极和甘汞电极的电位滴定仪上,用KOH异丙醇溶液滴定。用电位计读数,分别和手动、自动滴定所消耗的滴定剂的体积作图,以曲线的突跃点作为滴定终点,当所得的曲线无明显突跃点时,终点为碱性水溶液和酸性缓冲溶液在电位计上相应的电位值读数。5用途及重要性5.1新的或使用后的油品,由于氧化生成的加成和分解产物,含有酸或碱性组分。本方法可以测定其相对变化。总酸值是在油品一直处于测定条件下这些酸性物质的总值。该酸值可用于控制润滑油质量,有时也可用于润滑油使用过程中消耗的计量。但作为润滑油报废指标仍是经验值。5.2由于氧化产物会引起酸值的增长,同时又引起有机酸的腐蚀性变化,所以本方法不能用于预测在使用过程中油的腐蚀性。酸值与油品腐蚀金属的程度两者之间无一定关系。6仪器设备6.1手动滴定装置:6.1.1仪表,伏特计或电位计,当电位计与6.1.2和6.1.3中所述电极一同使用时,并且当电阻范围在0.2~20MΏ时,电位计的精度为±0.005V,灵敏度为±0.002V,测量范围是±0.5V。仪表应远离杂散电场,以免因为一些接触使仪表的读数产生永久性的变化。这些接触包括与接地导线,与暴露在外的玻璃电极表面,玻璃电极导线,滴定台,或仪表的接触。注3—一个合适的测定装置应该在输
酸碱盐溶液的PH值计算是分析化学中的一个重要内容。无论是酸碱滴定法中的各类静态溶液的计算(给定溶液浓度和酸碱平衡常数,计算PH值),还是滴定曲线的计算(实际上是一类动态溶液的计算,滴定反应进行中,溶液组成和浓度在变化,PH值也在变化),还是在络合滴定、氧化还原滴定、重量分析中的酸效应计算,都要涉及到溶液PH值的计算问题,因此,毫不夸张地说:酸碱盐溶液的PH值计算贯穿于化学分析的始终,是学习分析化学课程的重要基础和入门知识。酸碱盐溶液的PH值计算类型复杂,公式繁多,常令初学者头昏脑胀,貌似初涉分析化学课程的学生首遇的“杀威棒”。学习需要梳理知识,但对于冗长而机械的公式计算过程,却不必要花太多的时间去做中学生也能完成的工作,关键在于理解和正确的使用,居于这一教学理念,本人制作了“各类酸碱溶液的PH计算公式(含计算工具)”word模板文件,希望对正在教学和学习中的师生们有所帮助,也希望对于在分析一线的应用者有化学计算器(部分)的实用功效。现将该软件的特点及应用作一些介绍。1 软件特点及组成 “各类酸碱溶液的PH计算公式(含计算工具)”,是一个融学习和计算为一体的文本类软件,它的文本内容是对分析化学中“酸碱滴定法”一章中各类溶液的PH值计算公式作了系统归纳,以表格的形式给出了各类情况的计算公式精确式、近似式和最简式的计算式,并对应列出了各个公式应用的条件和范围,同时,列出了推导该公式时遵循的理论依据,即质子条件(主要便于学习者从理论的高度来理解和深化公式推导的本源)。它的软件部分是针对各类公式的实例计算要求(指具体的计算题),可以弹出窗口界面的计算面板,使用者只需要将浓度值、常数值输入到有关的文本框中,即可计算出结果,并给出计算的公式提示和建议,同时给出最简式和精确式的结果,让使用者对比结论,理解帮助框中的“忠告和建议”。 该模板文件最具特色的是融入了各类PH公式的计算工具,而且完全以窗口界面给出了公式具体运用(计算)时的“计算面板”,对于分析化学教学中的老师和学生,无疑是学习和解题的得力帮手。值得一提的是,尽管应用VB、VC编制化学计算与学习的商业软件及共享软件很普遍,但利用Office中已经捆绑的VBA(很多人并不清楚Office中还深藏着一个强大的开发工具:Vasual Basic for Application,即VBA),采用编程的方法实现word文本与化学计算融为一体的软件类文档,目前还未见期刊报道和网文介绍。2 模板的使用2.1 溶液酸碱度计算的知识梳理 根据武大《分析化学》(第五版)的酸碱滴定内容,将酸碱盐溶液的计算公式归纳为四大类: a、强酸碱;b、一元及多元弱酸碱;c、酸式盐(弱酸弱碱盐);d、共轭弱酸弱碱混合液(缓冲溶液类)。它们都有不同的计算公式和适用的条件。 PH缓冲溶液是一类重要的实用溶液,计算情况复杂,另辟一类;酸碱分布分数虽然不是PH值的计算,但却是平衡溶液中的各成分定量分配的化学量,也另辟一类。 对于酸碱滴定一章的知识,除滴定曲线的各区域PH值计算、误差计算未列入外,其他酸碱平衡的计算几乎被“一网打尽”了。 需要说明的是:分析化学中酸碱的概念是依据共轭酸碱理论,因此,所有的弱酸盐、弱碱盐,包括弱酸弱碱盐,都被并入到共轭碱、共轭酸的类别中,不再含有“盐水解”的概念,因而就不再出现无机化学中的水解常数和水解PH计算公式。2.2 各类酸碱溶液的实例计算 对于具体的计算例子,根据溶液的类型,选择对应的公式和计算模块,只需要点击右边的“我要计算”按钮,即可进入对应的计算面板,然后,将浓度、常数的对数值输入到文本框中,按下“计算”,即可在右边的红色文本框中显示出结果。在右下侧显示提示(使用什么计算公式,为什么)。注意常数要用PKa或PKb,即离解常数的负对数值,可以在分析化学的教材附录的表1中查到。下面是计算的一些例子,注意每次计算前清空数据。可以观看动画演示(动画看不清楚,可以下载动画的附件观察清晰板): 例1、计算0.10M 硫酸,PKa2=2.0 (PH=0.96) 例2、计算0.0000002M HCl (6.62) 例3、计算0.020M HAc ,PKa=4.74 (3.23) 0.010M HF PK=3.18 例4、计算0.10M NaHCO3,PKa1=6.38,PKa2=10.25,(8.31) 例5、计算0.10M Na2CO3,PKb1=3.75,PKb2=7.62,(11.62) 例6、计算HAc(0.1M)-NaAc(0.02M),PKa=4.74 (4.04) 例7、计算HAc(0.1M)-NaAc(0.001M),PKa=4.74 (3.03) 例8、计算HAc(0.1M)-NaAc(0.0001M),PKa=4.74 (2.89) (注意:缓冲溶液计算面板中的最简式结果单击可以隐藏。)2.3 溶液组成的判断 表中的分布分数,是平衡溶液中各组分平衡浓度的分数值,或表示成百分数。任何一个弱酸碱(包括弱酸盐、弱碱盐)溶液,指定了PH值,就可以计算出各组分的浓度比,根据分布分数,可以判断在指定PH值下,各组分浓度大小的排列顺序,还可以计算出某一组分的平衡浓度。 致歉:前面帖子中的缓冲溶液计算面板有一小bug,程序中对数忘记了加“/log(10)”,故最简式计算结果出错。现已修正,请下载本帖子的附件使用。 http://ng1.17img.cn/bbsfiles/images/2017/10/201011152243254760_01_0_3.swf
[font=SimSun, STSong, &]我国GB 2760规定“凡列入合成香料目录的香料,若存在相应的铵盐、钠盐、钾盐、钙盐和盐酸盐、碳酸盐、硫酸盐,且具有香料特性的化合物,应视作已被批准使用的香料。”[/font][font=SimSun, STSong, &]国外以及codex等国家也有类似规定吗?比如codex把肉桂酸视作香精,那肉桂酸钾是否也是香精香料呢?有规定出处吗?[/font]
[align=center]剧毒试剂使用及保存[/align][align=left] 在日常检测生活中,不可避免的接触一些有毒试剂,会对人身健康及安全产生一定的危害,因此,对一些常见的剧毒物质进行了解成为必要。以下是我对检测中经常遇到的剧毒试剂的认知及了解,希望大家共同探讨。剧毒试剂是指具有非常剧烈毒性危害的试剂,包括人工合成的化学品及其混合物(含农药)和天然毒素。人工合成的化学品主要有氰化钾、氯化汞等,天然毒素主要有黄曲霉毒素,赭曲霉毒素等。[/align][align=left]1、首先最经常接触的为氰化钾,它主要作为标准物质用于食品中氰化物的检测。氰化钾固体为白色圆球形硬块,粒状或结晶性粉末剧毒物质。它的主要特性是不稳定。在湿空气中易潮解并放出微量的氰化氢气体。与酸接触分解能放出剧毒的氰化氢气体,与氯酸盐或亚硝酸钠混合能发生爆炸。并中毒途径颇为广泛,主要可通过空气吸入、食物及皮肤进入人体。接触皮肤的伤口或吸入微量粉末即可中毒死亡。因此在做实验室注意采取保护措施[/align][align=left]2、与氰化钾联系紧密的是铁氰化钾,本品无毒,但与其他物质发生反应会产生有毒物质。它能与酸反应生成极毒气体,在高温条件下分解成极毒的氰化物。同时也能能被光及还原剂还原成亚铁氰化钾。其热溶液能被酸及酸式盐分解,放出剧毒氢氰酸气体。但灼热分解或遇酸时产生剧毒的氰化物。以上可以看出,铁氰化钾发生反应会产生氰化钾进而导致人体中毒。[/align][align=left]3、氯化汞:汞及其化合物可通过呼吸道、消化道或皮肤吸收,职业中毒主要是经呼吸道吸入金属汞蒸气或汞化合物气溶胶所致。口服氯化汞后,可立即或数小时后发生恶心、呕吐、严重腹痛、腹泻和便血。[/align][align=left]4、硝酸汞:无色或白色透明结晶,有潮解性。游离的汞离子可使含巯基的酶丧失活性,失去功能 还能与酶中的氨基、二巯基、羧基、羟基以及细胞膜内的磷酰基结合,引起相应的损害。因此硝酸汞中毒主要机理为汞离子能使体内的酶失活,影响人体的正常生理代谢。[/align][align=left]5、与硝酸汞、氯化汞类似,四氯汞钠也主要通过吸入、食入、经皮吸收引起人体中毒。[/align][align=left]6、黄曲霉毒素:黄曲霉毒素是主要由黄曲霉寄生曲霉产生的次生代谢产物,存在于土壤、动植物、各种坚果中,特别是容易污染花生、玉米、稻米、大豆、小麦等粮油产品,是霉菌毒素中毒性最大、对人类健康危害极为突出的一类霉菌毒素。其中B1为毒性及致癌性最强的物质。毒性一般认为有三种临床特征:急性中毒、慢性中毒和致癌性。急性中毒主要为人体不小心食入导致;及时人体没有食入,但在长期接触黄曲霉毒素过程中会导致慢性中毒或致癌。[/align][align=left] 需要特别注意的是,在实验过程中绝大部分的农残及无机标准溶液均为剧毒物质![/align][align=left] 在使用过程中,需要注意以下事项:[/align][align=left]1、密闭操作,局部排风。在通风处中操作是一种不错的选择。[/align][align=left]2、操作人员必须经过专门培训,严格遵守操作规程。佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿连衣式胶布防毒衣,戴橡胶手套。[/align][align=left]3、远离火种、热源,工作场所严禁吸烟。远离易燃、可燃物。避免产生粉尘。避免与还原剂、活性金属粉末接触。[/align][align=left]4、搬运时要轻装轻卸,防止包装及容器损坏。配备相应品种和数量的消防器材及泄漏应急处理设备。[/align][align=left]5、倒空的容器可能残留有害物。[/align][align=left] 在储存过程中,也需要着重注意以下几点:[/align][align=left]1、储存于阴凉、通风的库房。[/align][align=left]2、远离火种、热源。[/align][align=left]3、库温不超过30℃,相对湿度不超过70%。[/align][align=left]4、包装密封。应与易(可)燃物、还原剂、活性金属粉末、食用化学品分开存放,切忌混储。[/align][align=left]5、储区应备有合适的材料收容泄漏物。[/align][align=left] 遇到误食或其他途径导致剧毒物质已经进入人体出现的等紧急情况,可通过以下几点进行自救或他救:[/align][align=left]1、皮肤接触:脱去被污染的衣着,同时由于肥皂水呈碱性,可使一些有毒物质产生沉淀进而降低对人体的伤害,因此可用肥皂水和清水彻底冲洗皮肤。[/align][align=left]2、眼睛接触:提起眼睑,用流动清水或生理盐水冲洗,亦可用紧急喷淋清洗,并快速就医。[/align][align=left]3、吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧并立即就医。[/align][align=left]4、食入:误服者用水漱口,同时由于牛奶和蛋清中含有大量蛋白质,可与剧毒物质发生反应进而降低毒性,因此在漱口之后亦可给饮牛奶或蛋清并立即就医。[/align][align=left] 总之,在检测过程中或多或少会接触一些有毒有害物质,使用时一定要小心,注意保护好自己的同时避免交叉污染。[/align][align=left] 以上是我对实验过程中经常遇到的剧毒物质的见解,希望大家多多指教![img]http://simg.instrument.com.cn/bbs/images/default/em09502.gif[/img][/align]
吡啶盐酸盐是铵盐还是胺盐?
物质成盐(钾盐和钠盐)怎么在[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LCMS[/color][/url]打出对应带盐的分子量?
碘盐从刚刚开始的疯抢,到现在的退盐潮,民众经历了当初排队买盐的无“盐”以对到前两天的退盐,大部分超市是不给退盐的,是谓一“盐”难尽。。。这个过程中我们学会了什么?
求氨基乙腈盐酸盐的检测方法,请大家帮忙,最好有详细的分析步骤不胜感激氨基乙腈盐酸盐 中文名称:氨基乙腈盐酸盐 英文名称:Glycinonitrile hydrochloride 中文别名:盐酸胺腈;氨基乙腈盐酸盐;盐酸胺腈;氨基乙氰盐酸盐;甘氨基腈盐酸盐;氰基甲胺盐酸盐;氨基乙腈.盐酸盐 CAS RN:6011-14-9 EINECS号:227-865-9 分 子 式:C2H4N2·HCl;C2H5ClN2 分 子 量:92.53 风险术语:R22; R36/37/38; 安全术语:S26; S36/37/39; 物化性质:熔点:172 - 174 性状:具吸湿性 用途:用作医药中间体、有机合成原料
RT,请各位帮助下,查找下:硼酸钠盐(或钾盐)、偏硼酸钠盐(或钾盐)【是不是也叫做“亚硼酸盐”??】和多硼酸钠盐的MSDS(化学品安全技术说明书)。最好是要能有它们的物理性质,特别是蒸气压、熔点、沸点等等。不胜感激。
最近单位新装了离子色谱仪,用他检测氯、氟、硝酸盐、硫酸盐一点问题没有,但是要检测氯酸盐、亚氯酸盐、溴酸盐就有些麻烦了;一是三种离子响应值低,二是这几种离子标准限量低;请教专家如何很好的解决这个问题,拜托了!
请问,在树脂再生时,盐罐里放入盐一般要溶多长时间,谢谢大家
[img=,500,319]http://ng1.17img.cn/bbsfiles/images/2017/06/201706061749_01_3222210_3.jpg[/img]生活不是眼前的苟且,也不是诗和远方,生活就是每天的柴米油盐。今天小编要跟大家聊聊我们每天都要吃的——盐。盐早在中国远古时代就被当作调味品来使用了,但你每天吃的盐确定是真的盐吗?近几年来,广东、浙江、江苏、河南、山西接连曝出假盐、毒盐大案。就在近日,安徽又宣判了一起制贩假盐的案件,犯罪分子竟然用工业盐冒充食用盐!工业盐的重金属严重超标,进食后对身体造成的伤害,相信不用小编说,大家也是知道的![img=,500,449]http://ng1.17img.cn/bbsfiles/images/2017/06/201706061749_05_3222210_3.jpg[/img]小心,你家的盐可能是假的!3种方法,验出假盐三字教你辨别真假“盐”看包装山寨,盐色灰黄的不能买怎么判定包装山寨?可以看标识、看侧边和看封口。▷ 防伪标识清不清晰,是不是在同一个位置上[img=,495,428]http://ng1.17img.cn/bbsfiles/images/2017/06/201706061749_03_3222210_3.jpg[/img]▷ 包装两侧有没有折痕[img=,497,411]http://ng1.17img.cn/bbsfiles/images/2017/06/201706061749_02_3222210_3.jpg[/img]▷ 封口线锯齿明显与否,是不是用热切口[img=,497,394]http://ng1.17img.cn/bbsfiles/images/2017/06/201706061749_04_3222210_3.jpg[/img]除了看包装还要看盐的颜色和形状:用小勺取出少许食盐放在白纸上仔细观察。颜色洁白的为优质食盐,劣质食盐颜色一般会呈现暗灰色或黄褐色。在观察盐颜色的同时,仔细观察其外形,注意留意有没有肉眼可见的杂质。优质的食盐结晶整齐一致,坚硬光滑,看起来是透明或半透明的,不结块,没有吸潮现象和杂质,反之则为不合格食盐。闻有臭脚味的要当心可以取一小勺食盐放在碗里,用小勺子研碎,或加热,或用手搓,然后立即闻闻它的气味。优质食盐是没有气味的。而劣质食则会有“臭脚丫”等异味。尝有苦涩味儿的赶紧扔取少量食盐溶于蒸馏水中,制成一杯浓度为5%的盐溶液,也称淡盐水,蘸取少许放在口中尝一尝。优质食盐具有纯正的咸味。假的食盐则会有苦味、涩味。很多朋友为了图方便,有时候买盐就会直接到街边的小卖部买,因为谁也没想到盐还有假的!家医君建议,要购买食盐的时候,最好还是到正规商店或大型超市去选购哦~超市食盐琳琅满目,要怎么选?1、碘盐世界公认防治碘缺乏病最经济有效的强化食品就是碘盐。但是,碘盐容易氧化分解而使碘失效。因此,一次不要购买太多,并把碘盐存放在阴凉干燥处的有色密封的容器内。炒菜时最好等菜熟再放盐,因为碘盐遇高温会分解挥发。2、低钠盐传统食盐中氯化钠纯度高达95%以上,而低钠盐用氯化钾代替部分氯化钠,含钠仅为65%~70%,可有效减少患上高血压、心脏病等心血管疾病的危险。需要注意的是,肾功能不全的朋友还是少吃低钠盐,因为摄入过多的钾,会堆积在体内形成高血钾等并发症。3、加铁盐铁参与了体内氧的运送和组织呼吸过程,维持着正常的造血功能,并与免疫功能有关。故而长期食用加铁盐,既能调味,又能满足一些缺铁人群对铁的需求。4、加钙盐加钙盐适用于各种需要补钙的人群。长期使用,可以维持人体骨骼血钙及细胞钙的平衡,预防各种缺钙所致疾病的发生。5、加锌盐锌是酶蛋白的组成成分,能促进机体的免疫功能和生长发育,对皮肤和视力有保护作用,还能维持正常的味觉和食欲。建议缺锌人群可以食用加锌盐。6、加硒盐硒被称为人体微量元素中的“抗癌之王”,它具有清除体内毒素,增强人体的免疫力,保护心血管和心肌的健康等功能。适合于中老年人、心血管疾病患者等人群选用。7、核黄素盐核黄素又名维生素B2,人体缺乏维生素B2容易引发口角溃疡、角膜炎、视物不清、白内障等多种症状与疾病。缺维生素B2的群体不妨食用点核黄素盐。最后要说明的是,营养强化盐并非人人都需要,应按照“缺什么补什么”的原则来选用。同时,营养盐虽然对健康有益,但不可能立竿见影,需要坚持食用较长时间,才能显示出保健作用。还有,营养盐虽然对健康有益,但一定要控制量哦~
请教各位高手,用制备液相分离盐酸盐,流动相中添加0.1%TFA,那么制备完成后得到的是盐酸盐,TFA盐,还是本体?多谢!

根据国务院盐业体制改革的决策部署,2018年起各级盐业主管机构承担的食盐定点生产企业、食盐批发许可审核审批工作,盐务管理部门承担的食盐质量安全管理、市场监管及盐政执法职能,均移交给食品药品监督管理部门。于是我们做为食品检测部门,也有机会接触到了各种各样的盐,想不到这开门七件事中的盐,也有这么多“头衔”咧。食盐来源有海盐、井盐、矿盐、湖盐、土盐等,经过不同的工艺加工成不同的食用盐,再经过商家的包装就形成了市场上名目繁多的各种盐,究竟都有什么盐呢?[img=,306,484]https://ng1.17img.cn/bbsfiles/images/2019/07/201907011816475301_1028_1645752_3.jpg!w306x484.jpg[/img][color=#333333] 见上[/color]图,低钠盐,是以[url=https://baike.baidu.com/item/%E7%A2%98%E7%9B%90/3432933][color=windowtext]碘盐[/color][/url]为原料,再添加了一定量的氯化钾和硫酸镁,与普通钠盐相比含钠低(氯化钠70%左右),富含钾(氯化钾30%左右)。低钠盐据称能改善体内钠(Na+)、钾(K+)、镁(Mg2+)的[color=windowtext]平衡状态[/color],降低高血压、心血管疾病的风险[color=#333333]。[/color][color=#333333][img=,357,528]https://ng1.17img.cn/bbsfiles/images/2019/07/201907011818497184_8296_1645752_3.jpg!w357x528.jpg[/img][/color][color=#333333][color=#000000][color=#333333]见[/color]上图,海藻碘盐,以精制盐为原料,添加了海藻碘,海藻碘是一种从海洋藻类中提取的纯天然生物碘。根据《食品安全国家标准[color=#000000][/color][color=#000000]食用盐碘含量》GB 26878-2011规定,食盐中只能加入3种碘营养强化剂,即碘酸钾、海藻碘和碘化钾。其中,碘酸钾和碘化钾,是无机碘,海藻碘属于有机碘。海藻碘盐据称更利于人体吸收碘,且口感鲜美。看了几款海藻碘盐,多为在深井盐里添加海藻碘制成。[/color][/color][/color][color=#000000][img=,354,529]https://ng1.17img.cn/bbsfiles/images/2019/07/201907011819514779_3967_1645752_3.jpg!w354x529.jpg[/img][/color]如上图,井矿盐就是钻井汲取地下天然卤水制成的盐和开采地下岩盐经加工制成的盐。用凿井法汲取地表浅部或地下天然卤水加工制得的盐叫作“井盐”;开采古代岩盐矿床加工制得的盐则称“矿盐”。由于岩盐矿床有时与天然卤水盐矿共存,加之开采岩盐矿床钻井水溶法的问世,故又有“井盐”和“矿盐”的合称——“井矿盐”,或泛称为“矿盐”。[img=,367,539]https://ng1.17img.cn/bbsfiles/images/2019/07/201907011820449294_1470_1645752_3.jpg!w367x539.jpg[/img][color=#333333]如上图,澳洲海盐源自澳洲天然纯净海域,制造过程采用传统的[/color][color=#333333]“[/color][color=#333333]自然日晒法[/color][color=#333333]”[/color][color=#333333],经自然的阳光和海风结晶而成。澳洲海盐据称无任何污染、含多种对人体健康必不可少的微量元素,例如钙、镁、铁、钾、被称为高品质食盐。[/color][img=,373,552]https://ng1.17img.cn/bbsfiles/images/2019/07/201907011821281352_452_1645752_3.jpg!w373x552.jpg[/img][color=#333333]如上图,湖盐:又称[/color][color=#333333]池盐[/color][color=#333333],是从[/color][color=#333333]盐湖[/color][color=#333333]中直接采出的盐和以盐湖卤水为原料在[/color][color=#333333]盐田[/color][color=#333333]中晒制而成的盐。[/color][color=#333333]各种来源各种品牌各种用途的盐,是不是看得眼花缭乱,其实万变不离其宗,做为吃进人体内的食品,只要按照标准检测合格,就是放心食品。[/color][color=#333333] [/color]
硼氢化钠与氢氧化钠,硼氢化钾与氢氧化钾,使用这两种还原剂有什么不同之处?目前我尝试过对比,火焰钠盐的是黄色的,而钾盐为微蓝色,钾盐的灵敏度要高些,还有吗?大家一起讨论下
现在很多目标物买的标准品都是对应的盐酸盐,除了标品制备更稳定外,还出于什么目的?在[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]中目标物和对应的盐酸盐为何保留时间无区别,另外如果在质谱中,盐酸盐的标品和目标物是否会有区别
[color=#444444]我有一个一甲胺盐酸盐和二甲胺盐酸盐的混合物,求怎么分离?我跑了最基本的液相色谱,发现分不开,用的水和甲醇做的流动相。 不知道还有什么办法可以分离的。求助各位了解色谱和分离的大神[/color]