磷酸化蛋白质及多肽相关研究的技术进展 摘要磷酸化修饰是一种重要的蛋白质化学修饰,对蛋白质功能的完成或改变起到重要作用。该领域的研究存在很多技术难点,对该领域研究形成了挑战。近年来相关技术有了很多突破,磷酸化研究也取得了很多新的成就。文章将从磷酸化蛋白的检出、磷酸化蛋白质和肽段的富集、生物质谱技术的改进以及磷酸化蛋白和多肽的定量与比较几个方面介绍该研究领域的技术进展。关键词磷酸化蛋白磷酸化肽生物质谱定量分析生命活动与蛋白质的动态变化密切 摘要 磷酸化修饰是一种重要的蛋白质化学修饰, 对蛋白质功能的完成或改变起到重要作用。该领域的研究存在很多技术难点, 对该领域研究形成了挑战。近年来相关技术有了很多突破, 磷酸化研究也取得了很多新的成就。文章将从磷酸化蛋白的检出、磷酸化蛋白质和肽段的富集、生物质谱技术的改进以及磷酸化蛋白和多肽的定量与比较几个方面介绍该研究领域的技术进展。 关键词 磷酸化蛋白 磷酸化肽 生物质谱 定量分析
[font=宋体]磷酸化抗体是一种特殊的抗体,能够识别并结合到已经被磷酸化的蛋白质。磷酸化是一种重要的蛋白质修饰方式,通过将磷酸基团结合到特定的氨基酸残基上,可以改变蛋白质的结构和功能。在许多生物学过程中,磷酸化都扮演着重要的角色,因此磷酸化抗体成为了研究生物学和生物化学的重要工具。[/font][font=宋体] [/font][font=宋体]蛋白质磷酸化是指蛋白在激酶作用下在特定氨基酸位点(最常见的是丝氨酸、苏氨酸、酪氨酸残基)发生磷酸化的过程。蛋白磷酸化是极其重要的翻译后修饰,其动态调控是信号转导中不可或缺的一环,调控着细胞生长、分化、代谢、凋亡等等过程。[/font][font=宋体] [/font][font=宋体]磷酸化抗体主要是针对磷酸化位点制备的,可以特异性识别磷酸化氨基酸位点,对磷酸化蛋白进行定性、定量分析,检测蛋白受刺激后磷酸化水平变化情况。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州可以为客户提供一系列具有高特异性(经内源性、磷酸化特异性等多方面验证)、高灵敏度([/font][font=Calibri]1:200000[/font][font=宋体]稀释度)特点的磷酸化抗体,满足[/font][font=Calibri]WB[/font][font=宋体]、[/font][font=Calibri]IHC[/font][font=宋体]等应用。同时我们还可以为客户提供定制化的磷酸化抗体定制服务。[/font][/font][font=宋体] [/font][font=宋体][b]义翘神州磷酸化抗体服务优势:[/b][/font][font=宋体] [/font][font=宋体][font=宋体]①专业高效的多肽设计软件及高效偶联方法,保证多肽免疫成功率[/font][font=Calibri]95%[/font][font=宋体]以上。[/font][/font][font=宋体]②多种纯化策略,正负筛选平台,确保得到高特异识别指定磷酸化位点的抗体。[/font][font=宋体]③竞争性的价格[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供多种生物的制备服务,包括磷酸化兔多克隆抗体制备服务、磷酸化鼠单克隆抗体制备服务、磷酸化兔单克隆抗体制备服务[/font][font=宋体]……详情可以关注[/font][font=Calibri]https://cn.sinobiological.com/services/phospho-specific-antibody-service[/font][/font][font=宋体] [/font][font=宋体]总之,义翘神州[url=https://cn.sinobiological.com/services/phospho-specific-antibody-service][b]磷酸化抗体定制服务[/b][/url]能够满足您的个性化需求,帮助您在研究领域获得更多的突破。我们致力于为您提供高质量、高效率的抗体定制服务,助力您的科研事业更上一层楼。[/font]
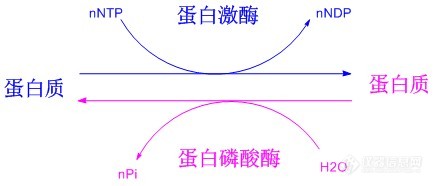
生命活动与蛋白质的动态变化密切相关, 很多情况下某些蛋白质是通过各种翻译后修饰来完成或改变其功能。在数量众多的蛋白质翻译后修饰中,蛋白质磷酸化修饰无疑是最重要的一类,它是指通过蛋白激酶(Protein kinase,PK)介导的酶促反应把磷酸基团从一个化合物转移到另一个化合物上的过程(Figure 1所示),是生物体内存在的一种普遍的调节方式。现今发现的所有人类蛋白质中超过30%可被磷酸化修饰,这一修饰在细胞信号的传递过程中占有极其重要的地位,与生命活动的许多过程都密切相关,对此的研究已经成为蛋白质科学的热点之一。 http://img.dxycdn.com/trademd/upload/userfiles/image/2012/09/1346918444_small.jpg磷酸化多肽(主要指肽链中的酪氨酸、丝氨酸和苏氨酸残基的侧链羟基被磷酸化生成酸式磷酸酯的修饰多肽)是研究蛋白质磷酸化过程的必不可少的工具,它可作为磷酸酶模型底物,或作为可产生抗磷酸化蛋白抗体的抗原,也可以在确定磷酸化蛋白的物理参数时作为参考化合物等。因此磷酸化多肽的合成在过去的几年中吸引了相当大的兴趣,目前已确定了较为成熟的合成路线,使磷酸化多肽的合成趋于常规。目前磷酸化多肽的合成主要有两个策略:后磷酸化法(Global phosphorylation)和单体法(Building block approach),如Figure 2所示。前者是在多肽序列合成结束后再在固相载体上对丝氨酸、苏氨酸或酪氨酸的侧链羟基进行磷酸化,可以在同一次合成中同时得到带有和不带有磷酸化位点的多肽;而后者则将适当保护的磷酸化氨基酸直接引入到多肽序列中,操作较前者更为简单,现已成为磷酸化多肽合成的首选策略。在采用单体法构建磷酸化多肽时,目前广泛采用的原料为侧链单苄基保护的氨基酸:Fmoc-AA(PO(OBzl)OH)-OH (AA = Ser, Thr or Tyr)。这类保护的磷酸化位点由于侧链磷酸化基团的离子化而产生较大的位阻效应,并且磷酸化位点的引入往往能促进肽链二级结构的形成,故而磷酸化位点及其后的氨基酸的引入会比较困难。这些问题在合成含有多个磷酸化位点的多肽时将会变得尤为严重,往往会使最终产物的组成非常复杂,难以进行纯化,甚至直接导致合成的失败。http://img.dxycdn.com/trademd/upload/userfiles/image/2012/09/1346918477_small.jpg一般来讲,增加投料量和延长反应时间都能促使连接反应趋于完全,但增加投料量无疑会提高合成成本,对于较昂贵的带有保护的磷酸化氨基酸更是这样,而延长反应时间则可能增加其它副反应发生的风险,故而在合成磷酸化多肽时,需要对氨基酸投料量、反应方法以及反应时长等进行优化调整以期达到更理想、更经济的合成效果。我们有针对性地对磷酸化多肽合成条件进行了探索和调整,采用最终的优化条件成功合成了含有多达六个磷酸化丝氨酸残基的多肽:FAM-Ahx-X(pS)XX(pS)X(pS)X(pS)XX(pS)X(pS)-NH2(客户肽,详细序列未给出;其氨基端标记FAM以进行荧光检测),经过RP-HPLC纯化后最终纯品的纯度高达95%(见Figure 3)。http://img.dxycdn.com/trademd/upload/userfiles/image/2012/09/1346918493_small.jpg参考文献:1. P. Cohen, “The Role of Protein Phosphorylation in Neural and Hormonal Control of Cellular Activity”, Nature, 1982, 296 (5858): 613-620.2. From: http://en.wikipedia.org/wiki/Protein_kinase.3. L. A. Pinna, A. Donella-Deana, “Phosphorylated Synthetic Peptides as Tools for Studying Protein Phosphatases”, Biochim. Biophys. Acta., 1994, 1222 (3): 415-431.4. W. C. Chan, P. D. White, “Fmoc Solid Phase Peptide Synthesis-A Practical Approach” (2000), Oxford University Press.
磷酸化的Ser、Tyr和Thr修饰的多肽:我们国肽生物提供单磷酸化和多磷酸化多肽服务,目前我们已经能够提供四个磷酸化位点修饰的多肽。[img=,434,186]https://ng1.17img.cn/bbsfiles/images/2019/04/201904191649355554_2764_3531468_3.jpg!w434x186.jpg[/img][img=,486,498]https://ng1.17img.cn/bbsfiles/images/2019/04/201904191649358877_2957_3531468_3.jpg!w486x498.jpg[/img]我们主要提供:多肽定制、磷酸肽、生物素标记肽、荧光标记肽、同位素标记肽、人工胰岛素、药物肽、多肽合成、目录肽、偶联蛋白、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、RGD环肽等。合肥国肽生物官网:http://www.bankpeptide.com欢迎咨询服务热线:17718122172;17718122684;17730030476;17718122397
【网络讲座】:让精准医学更精准:癌症信号转导的蛋白质组学研究 【讲座时间】:2017-03-30 14:00【主讲人】:田瑞军:南方科技大学化学系研究员,加拿大渥太华大学医学院兼职教授,博士生导师(香港浸会大学、香港科技大学-南方科技大学联合博士培养项目)。张伟:赛默飞世尔科技转化医学业务发展经理。长期从事生物质谱与蛋白质组学领域的研究、技术开发、市场开拓工作。在Chem. Comm., Anal. Chem., J. Proteome Res., Proteomics, J. Proteomics等知名杂志上发表论文14篇,其中第一作者10篇,申请发明专利2项。【会议简介】1、 不只是测序,Orbitrap超高分辨质谱让精准医学更精准;2、 癌症信号转导的蛋白质组学研究:基础与进展;3、 癌症信号转导的蛋白质组学研究:在精准医学中的应用。4、应用举例。-------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名参加。2、报名参会:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/2319 4、报名及参会咨询:QQ群—290101720,扫码入群“医药”http://ng1.17img.cn/bbsfiles/images/2017/10/2016051010165495_01_2507958_3.gif
请问从sigma购买货号为C6780 的α-casein(α-酪蛋白)中,磷酸化的比例是多少?希望大家可以提供帮助,谢谢
请问从sigma购买货号为C6780 的α-casein(α-酪蛋白)中,磷酸化的比例是多少?希望大家可以提供帮助,谢谢

【专家讲座】:第三讲:蛋白质磷酸化研究(Antibody base protein phosphorylatoion)【讲座时间】:2016年1月14日 10:00【主讲人】:胡克平:目前为中国医学科学院/北京协和医学院药用植物研究所研究员,博士生导师, 药理毒理研究中心主任。主要研究方向:从事Rett syndrome及MeCP2,并开展了与能量代谢直接关联的三羧酸循环(TCA)复合物研究。【会议简介】以DNA甲基化结合蛋白MeCP2磷酸化发现及功能研究为故事展现如何确定一个蛋白的磷酸化以及磷酸化位点的确定及后继的功能研究。-------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名参加。2、报名截止时间:2016年1月14日9:303、报名参会:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/17704、报名及参会咨询:QQ群—171692483http://ng1.17img.cn/bbsfiles/images/2017/10/2015042911235201_01_2507958_3.jpg
信号转导通路仍然是肿瘤研究、心脑血管疾病研究和免疫系统疾病研究的主要方向之一。该文章描绘了八个经常研究到的信号转导通路,并标出相关靶点的经典抑制剂,以便研究人员能更容易地判断自己所需的抑制剂。导读: 第一页 细胞凋亡信号转导通路第二页 DNA损伤信号转导通路第三页 JAK-STAT信号转导通路第四页 MAPK信号转导通路第五页 PI3K信号转导通路第六页 受体酪氨酸激酶信号转导通路第七页 TGF-beta/SMAD信号转导通路第八页 其他信号转导通路和因子对Wnt通路的影响
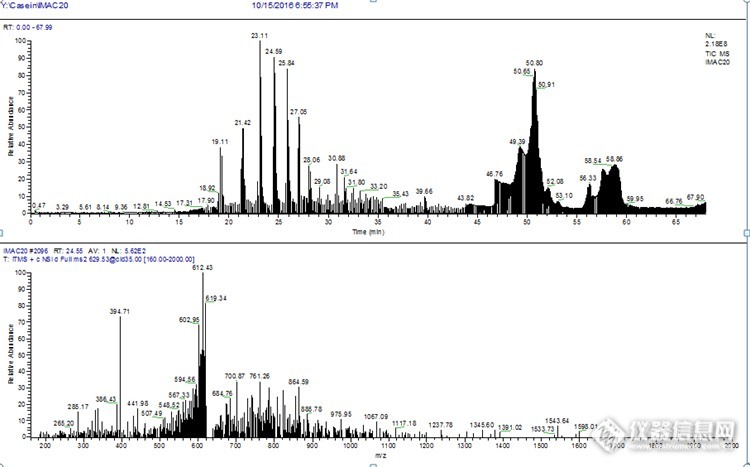
各位老师:求助哪位老师有IMAC富集磷酸化肽段的经验?磷酸化肽段采用IMAC富集后,nano-LC-orbitrap检测后出现奇怪峰,从19.11到28.06分钟出现的峰都不是蛋白及肽段。哪位老师有经验知道这些峰有可能是什么,并且经数据库检测后只获得了7个磷酸化肽段。图见附件谢谢各位老师,上图是IMAC以后的图,下图是IMAC以前,in-gel digesition之后的
合肥国肽生物科技有限公司(简称:国肽生物TM)成立于2014年,是一家专业从事多肽产品的研发、生产和销售以及多肽技术转让的高新技术企业。BP公司成立之初,便成功收购了国内几家多肽、抗体公司,是目前国内的专业多肽合成、抗体制备、蛋白表达的规模型生产企业。国肽生物专长于荧光标记肽、同位素标记肽、人工胰岛素、药物肽、化妆品肽、长肽困难肽等产品的合成与研发,致力于学术水平的科研提升,搭建学术交流平台,促进前沿、专业的学术知识推广,推动多肽在生物医学材料等领域的研究与应用。公司产品广泛应用于药物研发,抗体的制备(包括单抗与双抗),荧光分子探针的构建以及细胞透膜研究、活体成像、新型材料研发和质谱分析等研究领域国肽生物按照客户定制要求供应高品质普通多肽。我们拥有成熟的多肽合成纯化方法,利用SPPS方法和液相合成方法为客户提供高品质多肽。我们的服务特点是:1. 纯度:我们提供粗品肽和纯度纯度为70%,75%,80%,85%,90%,95%,98%,99%的纯品多肽。2.脱盐和转盐:根据客户要求,我们可以对多肽进行脱TFA盐处理,也可以转为醋酸盐。3.交货期限:30个氨基酸之内,一般2-3周,最快1-2周。4.质量控制:每条多肽都免费提供合格的HPLC,MS和COA文件。5.售后服务:1-2周内可以提出异议,我们免费复测,不合格免费退货,1-3个月内使用不合格可以免费提供复测,样品免费保存3个月。国肽生物根据客户要求,供应各种修饰型多肽。1.磷酸化的Ser、Tyr和Thr修饰的多肽:我们提供单磷酸化和多磷酸化多肽服务,目前我们已经能够提供四个磷酸化位点修饰的多肽。2.5(6)-FAM,FITC,CY5,RhodamineB,PNA,EDNAS/dabcyl等荧光标记修饰的多肽:荧光标记修饰多肽技术是我们国肽生物的代表性多肽合成技术,我们的这项技术已经相当成熟。3.生物素Biotin,Lys(Biotin)修饰的多肽:生物素是维生素B2的组成部分,Biotin,Lys(Biotin)修饰的多肽也是客户经常定制的多肽。我们提供生物素修饰的多肽已经有将近100%的成功率。4.含有一对或多对二硫键修饰的多肽:二硫键在蛋白质的结构稳定中起到重要作用,目前我们已经能够为客户提供四对二硫键修饰的多肽。5.含有同位素C13,N15修饰的多肽:同位素标记的多肽主要应用于医学和生物学领域,通常价格较高,为了满足客户需要,我们接受微克级的同位素多肽定制。6.含有特殊氨基酸修饰的多肽:例如,D型氨基酸,氨基酸衍生物,脂肪族羧酸等等,都在我们接受的定制范围内。国肽生物提供150个氨基酸以内的长肽合成服务。多肽合成过程中,肽链过长时,经常会出现缺残基,氨基酸缩合困难等情况,基于这些现象,我们开发了三种有效提高反应成功率的方案:1. 微波合成法:对于合成过程中出现的一些难以缩合的氨基酸,我们采用微波法进行合成,该方法效果显著,并且大大缩短了反应时间。2. 片段合成法:当某些多肽用常规合成方法合成困难,我们也会采用将多肽中某一段的某几个氨基酸缩合之后作为一个整体缩合到肽链上去,这种方法也能够解决许多合成中存在的问题。3.酰肼合成法:酰肼法合成多肽的方法是将固相合成的 N末端Cys 多肽和 C末端多肽酰肼之间的化学选择性反应形成酰胺键而实现多肽的连接,该方法根据肽链中Cys的位置,将整条肽链分成多条序列分别合成,最终经过液相缩合反应得到目标肽,显著地提高了最终产物纯度,广泛适用于含有Cys的长链多肽的合成。国肽生物拥有成熟的长肽合成工艺,能够根据客户定制的多肽序列,快速有效地设计合成方案并迅速开始合成,更快更好的为客户提供所需的服务是我们不变的坚持。详情请咨询合肥国肽生物www.bankpeptide.com
在婴幼儿配方乳粉中常见一添加剂-酪蛋白磷酸肽CPP,欢迎跟帖讨论。
PS1利用基质辅助激光解吸电离-飞行时间(MALDI-TOF)技术来表征生物分子。样品溶于固定的底物中形成晶体,用激光脉冲使其离子化,离子被加速后通过飞行管时分离,所有离子均可被检测。系统包括三个组成部件:样品点样制备工作站(SymBiot 1)、生物质谱工作站(Voyager-DE PRO)和自动化分析软件(AutoMS-Fit)。SymBiot1 是一个自动样品处理系统,支持亚微升级微量点样,具有快速省时、重现性好的特点;Voyager-DE PRO是为蛋白质组研究专门设计的自动飞行时间质谱分析系统,配有AB公司之专利—延迟检测技术,具有高分辨率、质荷比宽等特点;AutoMS软件可以批处理方式或实时动态方式检索Protein Prospector蛋白数据库或您指定的蛋白数据库,查询参数可以任意设定,检索结果以Microsoft Access格式分类编号及储存。 PS 1技术平台建立伊始便受到了许多蛋白质课题研究组的关注。中国科学院上海生物化学研究所戚正武院士课题组从猪肝中提取某一活性蛋白组分,该组分理化性质不清楚,天然含量十分低,并无相关文献报道。用HPLC分离以后对活性组分的成分不能确定。上海基康生物技术有限公司运用PS 1系统对HPLC分离后的活性组分作了质谱分析,仅在一个工作日内就精确确定该组分由分子量极为相近的几种蛋白质构成,分子量精确度达到10 ppm。后经HPLC再次细分(洗脱梯度增加了2.5倍),证实了质谱的结论。此活性组分曾滤过1kD分子筛,基康的质谱数据纠正了研究人员过去对该活性组分分子量的误判,为研究人员明确实验方向、优化实验步骤提供了强有力的依据。 PS1除了可以进行生物大分子的精确分子量测定,还可用于蛋白的肽指纹图谱分析(peptide mass fingerprint,PMF),提供相关生物信息学服务,并且还可以利用源后衰变(Post Source Decay,PSD)技术来获得样品的MS/MS数据,以得到一级结构信息。PSD方法通常增加了激发激光的功率,使其超过产生一般肽指纹谱图所需功率的阈值,过剩的能量使前体离子在源内离子化之后发生裂解,产生一系列碎片离子,在反射器的作用下,最终可以得到一张连续的碎片离子图谱。经特定的软件分析后,即可在数据库中检索到肽段的氨基酸序列。利用PSD分析技术,还可以对磷酸化,糖基化等翻译后修饰进行定位分析,同样也可以鉴定产生翻译后修饰肽段的蛋白质。Neville et al.(1997)将这一方法成功的用于磷酸肽的序列分析。作为重要的蛋白质鉴定手段之一,PS1的精确度可以达到10 ppm,灵敏度为fmol,分子量检测范围可达到500 kDa,每天可自动分析40-100个样品,适用于大规模“蛋白质组学”研究。
[b]什么是磷酸化蛋白质[/b]蛋白质磷酸化是指在激酶催化作用下把ATP或者GTP的磷酸基团(P04)转移到不同种类的氨基酸上(主要包括丝氨酸S、苏氨酸T、酪氨酸Y),从而使蛋白质发生翻译后修饰的过程。该修饰是蛋白质翻译后修饰(PTM)中最为重要的形式,具有显著的生物学功能,细胞增殖和凋亡,良性发育,信号转导,新陈代谢,肿瘤发生等过程都有磷酸化蛋白质的插足,研究磷酸化蛋白质对探究生物学病变机理有着非常重要的意义。[b]富集磷酸化蛋白质重要性[/b]磷酸化蛋白质具有低丰度和高动态性的特点,因此对磷酸化蛋白质组学研究首先需要对磷酸化蛋白样品进行富集,降低样品复杂程度和提高磷酸化位点鉴定数目。固相金属离子亲和色谱法(IMAC)是磷酸化蛋白质组学研究中最常用的磷酸化蛋白质富集技术之一。[b]Welchrom Ti Poss (phosphate ester)固相金属离子亲和填料[/b]Welchrom Ti Poss (phosphate ester) 是月旭科技推出的的新一代固相金属离子亲和填料,金属离子Ti??鳌合在磷酸酯 (phosphate ester) 为配基的多级孔杂化整体材料上形成的亲和填料,利用磷酸化基团与固相化的Ti??的高亲和力来富集磷酸化蛋白质。磷酸化蛋白质上的磷酸基团中的三个氧原子分别与富集材料上的三个不同Ti??螯合以形成稳定的八面体形的配位结构,这种配位方式提供了良好的结合能力。该填料具有吸附量大、选择性好、成本低、适用范围广、操作简单特点。[b]规格参数[/b][table=521][tr][td=1,1,156]基架名称[/td][td=1,1,365]多面体低聚倍硅氧烷(POSS)作为单体所制备的多级孔杂化整体材料[/td][/tr][tr][td=1,1,156]粒径范围[/td][td=1,1,365]几十微米至几百微米[/td][/tr][tr][td=1,1,156]结合载量[/td][td=1,1,365]63.6 mg/g[/td][/tr][tr][td=1,1,156]适用样品范围[/td][td=1,1,365]所有含有磷酸基团的蛋白质和肽段[/td][/tr][tr][td=1,1,156]磷酸化肽段富集特异性[/td][td=1,1,365]97%[/td][/tr][tr][td=1,1,156]pH稳定性[/td][td=1,1,365]强酸、强碱下均可使用[/td][/tr][tr][td=1,1,156]化学稳定性[/td][td=1,1,365]常见有机溶剂下均可使用[/td][/tr][tr][td=1,1,156]保存条件[/td][td=1,1,365]干燥状态下室温保存[/td][/tr][tr][td=1,1,156]通用性操作步骤[/td][td=1,1,365]采用80% ACN/6% TFA水溶液作为富集溶液,这样可以在富集过程中,很大程度上避免疏水性非磷酸化肽段的吸附。去除上清溶液后,依次用洗涤溶液A(50% ACN/6% TFA/200 mMNaCl)和溶液B(30%ACN/0.1%TFA)进行洗涤,这样可以最da程度上洗去非特异性肽段。最后采用100 μL 10%(wt%)的氨水洗脱吸附在材料上的磷酸化肽段。[/td][/tr][/table][b]应用案例[/b][align=center][img]https://img1.17img.cn/17img/images/201910/uepic/556dc556-79d8-4012-81ef-a8a16364ff16.jpg[/img][/align](a)β-酪蛋白酶解液直接进行分析的 MALDI TOF-MS谱图和(b)Welchrom Ti Poss材料富集后分析的MADLI TOF-MS谱图[b]实验条件:[/b]0.1μg β-酪蛋白酶解液;采用80% ACN/6% TFA水溶液作为富集溶液,去除上清溶液后,依次用洗涤溶液A(50% ACN/6% TFA/200 mM NaCl)和溶液B(30%ACN/0.1%TFA)进行洗涤,最后采用100 μL 10%(wt%)的氨水洗脱吸附在材料上的磷酸化肽段。图a中,未经过富集的β-酪蛋白酶解液样品MALDI谱图中,非磷酸化肽段的质谱信号峰非常强,严重影响了对磷酸化肽段的辨别。而经过Ti??-IMAC富集,从MADLI谱图中(图b)可以清晰的看到磷酸化肽段以及其去磷酸化肽段的信号峰,而且几乎没有出现任何非磷酸化肽段的信号峰。证实了Welchrom Ti Poss富集对磷酸化肽段具有良好的富集能力。[table=562][tr][td][align=center][b]产品名称[/b][/align][/td][td][align=center][b]规格[/b][/align][/td][td][align=center][b]货号[/b][/align][/td][/tr][tr][td][align=center][b]Welchrom Ti Poss (phosphate ester)[/b][/align][/td][td][align=center][b]250mg[/b][/align][/td][td][align=center][b]ATI001[/b][/align][b][/b][/td][/tr][/table]
6 质谱仪的最新进展用质谱检测蛋白,首先考虑到用PMF与 MALDI-TOF联用,如果无法检测,下一步就用ESI-MS/MS创建序列标签。在PMF分析中,MALDI的平板中只需一小部分样本就足以检测,剩下的样本就可以用来创建序列标签。并且,在MALDI-TOF仪器上,用一种叫做“源后延迟”的方法可以对只有部分序列的肽段进行检测。然而,用这个方法产生的质谱图比较难说明,精确性也很差。最近,用MALDI联合四级杆-时间质谱分析器[30,31]以及原始的MALDI-TOF/TOF[32]方法产生了。因此同一份标本可以首先考虑用PMF检测蛋白[33],如果有必要的话,再用MS/MS创建序列标签。MALDI联合四级杆-TOF检测高通量蛋白是有希望的[31]。7 蛋白质组研究中的转录后修饰分析蛋白组分析很重要的一点就是能对蛋白表达水平以及转录后修饰,如磷酸化和糖基化进行研究。蛋白质的磷酸化是很有趣的,因为在信号转导途径中它扮演了重要的角色。最早检测蛋白质表达水平的方法是进行2-DE之前用35S-Met对样本进行代谢性标记,再在2-DE上进行放射自显影[34-36]。在凝胶中,不同蛋白的磷酸化和糖基化位点通常在凝胶中显示一连串蛋白质点,但是还需要做更详细的分析来确定修饰类型。蛋白质磷酸化的改变既可以用32P标记细胞,也可以用特异性磷酸化抗体做western blotting进行研究。如果用32P标记的方法,仍然需要做2-DE。经过凝胶比较后,把感兴趣的点从胶上切下来,然后用质谱鉴定[36]。Soskic使用的是印迹法,两个2-DE同时进行,一个用于做特异的磷酸化抗体实验,另一个做常规染色。蛋白质磷酸化和糖基化更为详细的特性可以用质谱来检测,但是需要更多的起始材料而不仅仅是二维凝胶上的一个点。另外这些分析不能产生直接的序列信息,技术上也比用质谱检测蛋白要难的多。在蛋白上查找磷酸化位点有很多种方法。为了检测消化后的混和肽中哪一个是磷酸化的,可以用MALDI-MS在磷酸化前后对混合肽做PMF分析:经过磷酸酯酶处理后,磷酸化的肽将会失去一个磷酸基团,分子量将比处理前小80Da.糖基化研究中,多聚糖从蛋白中释放出来,对多聚糖结构的检测就是从这些游离的多聚糖中得到的。一般把MALDI仪和外源性糖苷酶[37-40]联合使用进行检测。如果需要更为详细的信息,可以用ESI-MS联合使用前体离子扫描仪[41-44]。到目前为止,能够用电泳分离后的蛋白进行糖蛋白结构检测的报道很少。其中有一项研究是N端糖蛋白酶切以后用一维SDS-PAGE分离,然后用MALDI-MS以及外源性的糖苷酶进行结构分析[45]。8 用质谱研究蛋白-蛋白之间的作用经典的蛋白组学着重于研究蛋白质在何时何处表达。因为大部分的细胞功能都是由蛋白质复合体而不是由单个蛋白来执行的,所以鉴定蛋白质的成分和相互作用是非常重要的。这个过程可以用生物化学方法纯化蛋白质后用质谱来鉴定不同的成分,如人类剪接体的成分,酵母的核孔复合体[46]以及核蛋白体等都可以用此策略检测出来。一般的蛋白复合体是用亲和层析的方法纯化和分离,如免疫沉淀反应[47,48]。 DNA结合蛋白可以用同它们有特异性亲和力的核酸来分离,然后用质谱来鉴定[49]。Rigaut等人在串联层析的基础上,建立了一种通用的蛋白质复合体纯化方法[50]。在这个方法中,一种TAP标签和靶蛋白融合在一起,然后把蛋白转移到宿主细胞或者组织中,融合蛋白在宿主细胞和组织中能持续表达。TAP标签包括一种A蛋白和一种钙调蛋白,在标签之间有一个TEV蛋白酶切位点。用串联亲和层析法能将融合蛋白及与它相互作用的蛋白成分从细胞提取物中有效的分离,纯化出来。Rappsiber等人分别用亲和层析,交叉耦合以及质谱等方法[51]对酵母的核孔复合物Nup85p的亲和性进行研究。经过层析以后,用一维SDS-PAGE方法就可以分离蛋白复合体中的各个成分,因此二维电泳的不足之处就可以避免。同样也有可能直接用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]方法分析大分子量蛋白质复合体[52]。蛋白组分析的优越之处主要是用于蛋白和蛋白之间的相互作用以及蛋白的转录后修饰的研究,同时也可以用于基因表达水平的研究。质谱对于蛋白组分析来说是一项非常重要的技术,近年来仪器以及数据库软件的发展使得质谱成为能力更强大的工具。参考文献[1] O’Farrell PH. J Biol Chem,1975,250:4007–4021.[2] Karas M, Bachmann D, Bahr U, et al. Int J MassSpecrom Ion Process,1987,78:53–68.[3] Meng CK, Mann M, Fenn JB. et al. Atoms, Mol Clusters,1988,10:361–368.[4] Fenn JB, Mann M, Meng CK, et al.Science,1989,6(246):64–71.[5] Corthals GL, Wasinger VC, Hochstrasser DF, et al.Electrophoresis,2000,21:1104–1115.[6] Celis JE, Kruhoffer M, Gromova I, et al. FEBS Lett,2000,480:2–16.[7] Anderson L, Seilhamer J. Electrophoresis,1997,18:533–537.[8] Gygi SP, Rochon Y, Franza BR, et al. Mol Cell Biol,1999,19:1720–1730.[9] Henzel WJ, Stults JT, Wong SC, et al. ProcNatl Acad Sci USA,1993,90:5011–5015.[10] Mann M, Hojrup P, Roeppstorff P. Biol Mass Spectrom,1993,22:338–345.[11] Pappin DJ, Hojrup P, Bleasby AJ. Curr Biol,1993,3:327–332.[12] James P, Quadroni M, Carafoli E, et al. Biochem BiophysRes Commun,1993,195:58–64.[13] Yates JRD, Speicher S, Griffin PR, et al. AnalBiochem,1993,214:397–408.[14] Mann M, Wilm M. Anal Chem,1994,66:4390–4399.[15] Eng JK, McCormack AL, Yates JR. J Am Soc Mass Spectrom,1994,5:976–989.[16] Wilm M, Mann M. Int J Mass Spectrom Ion Process,1994,136:167–180.[17] Wilm M, Shevchenko A, Houthaeve T, et al. Nature 1996 379:466–469.[18] Wilm M, Mann M. Anal Chem,1996,68:1–8.[19] Morris HR, Paxton T, Panico M, et al. JProtein Chem,1997,16:469–479.[20] Rosenfeld J, Capedeville J, Guillemot JC, et al. AnalBiochem,1992,203:173–179.[21] Shevchenko A, Wilm M, Mann M. Anal Chem,1996,68:850–858.[22] Pandey A, Andersen JS, Mann M. Science’s STKE: www.stke.org/cgi/content/full/OC–sigtrans 2000/37/pl1.[23] Kussmann M, Nordhoff E, Rahbek-Nielsen H, et al. J Mass Spectrom,1997,32:593–601.[24] Gobom J, Nordhoff E, Mirgorodskaya E, et al. J Mass Spectrom,1999,34:105–116.[25] Clauser KR, Baker P, Burlingame AL. Anal Chem,1999,71:2871–2882.[26] Binz PA, Muller M, Walther D, et al. Anal Chem,1999,71:4981–4988.[27] Bienvenut WV, Sanchez JC, Karmime A, et al. Anal Chem,1999,71:4800–4807.[28] Neubauer G, King A, Rappsilber J, et al. Nat Genet,1998,20:46–50.[29] Yates III JR, Carmack E, Hays L, et al. MethodsMol Biol,1999,112:553–569.[30] Loboda AV, Krutchinsky AN, Bromirski M, et al. Rapid Commun Mass Spectrom,2000,14:1047–1057.[31] Shevchenko A, Loboda A, Schevchenko A, et al. Anal Chem,2000,72:2132–2141.[32] Medzihradszky KF, Campbell JM, Baldwin MA, et al. Anal Chem 2000,72:552–558.[33] Krutchinsky AN, Zhang W, Chait BT. J Am Soc Mass Spectrom,2000,11:493–504.[34] Nyman TA, Matikainen S, Sareneva T, et al. Eur J Biochem 2000 267:4011–4019.[35] Celis JE, editor. Cell Biology: A Laboratory Handbook, vol. 4,2nd. Academic Press, 1998,375–385.[36] Gerner C, Frohwein U, Gotzmann J, et al. J Biol Chem,2000,Sep 7 [epubahead of print].[37] Colangelo J, Orlando R. Anal Chem,1999,71:1479–1482.[38] Geyer H, Schmitt S, Wuhrer M, et al. Anal Chem1999 71:476–482.[39] Harvey DJ. Mass Spectrom Rev,1999,18:349–450.[40] Nyman TA, Kalkkinen N, et al. Eur J Biochem,1998,253:485–493.[41] Sheeley DM, Reinhold VN. Anal Chem,1998,70:3053–3059.[42] Reinhold VN, Reinhold BB, Costello CE. Anal Chem,1995,67:1772–1784.[43] Kuster B, Hunter AP, Wheeler SF, et al. Electrophoresis,1998,19:1950–1959.[44] Rout MP, Aitchison JD, Suprapto A, et al. J Cell Biol,2000,148:635–651.[45] Yamaguchi K, Subramanian AR. J Biol Chem ,2000,275:28 466–28 482.[46] Yamaguchi K, von Knoblauch K, Subramanian AR. J BiolChem,2000,275:28 455–28 465.[47] Rotheneder H, Geymayer S, Haidweger E. J Mol Biol,1999,293:1005–1015.[48] Boehning D, Joseph SK. EMBO J,2000,19:5450–5459.[49] Nordhoff E, Krogsdam AM, Jorgensen HF, et al. Nat Biotechnol,1999,17:884–888.[50] Rigaut G, Shevchenko A, Rutz B, et al. Nat Biotechnol,1999,17:1030–1032.[51] Rappsilber J, Siniossoglou S, Hurt EC, et al. Anal Chem2000 72:267–275.[52] Link AJ, Eng J, Schieltz DM, et al. Nat Biotechnol,1999,17:676–682.T.A. Nyman /Biomolecular Engineering, 2001:18 .221–227.
蛋白质分子量肌球蛋白甲状腺球蛋白β-半乳糖苷酶副肌球蛋白磷酸化酶a血清白蛋白L-氨基酸氧化酶地氧化氢酶丙酮酸激活酶谷氨酸脱氢酶亮氨酸氨肽酶γ-球蛋白,H链延胡索酸酶(反丁烯二酸酶)卵白蛋白醇脱氢酶(肝)烯醇酶醛缩酶肌酸激酶胃蛋白酶原D-氨基酸氧化酶醇脱氢酶(酵母)甘油醛磷酸脱氢酶原肌球蛋白乳酸脱氢酶胃蛋白酶转磷酸核糖基酶天冬氨酸氨甲酰转移酶,C链羧肽酶 A碳酸酐酶枯草杆菌蛋白酶γ-球蛋白,L链γ-blobulin,L chain糜蛋白酶原(胰凝乳蛋白酶原)木瓜蛋白酶(羧甲基)β-乳球蛋白[font=Tim
【题名】毛细管区带电泳测定酪蛋白磷酸肽方法的研究【期刊名】中国食品学报【年、卷、页】2002年2卷第二期【作者】牟光庆【正文】摘要:用毛细管区带电泳(CZE )时酪蛋白磷酸肤(CPP)进行了分离和测定。研究出的适宜电泳操作条件为:工作电压30KV、柱温259C、毛细管长度50cm、内径70prn、进样量5sec(气压进样)、紫外检测波长200nm,缓冲液pH值9.20测定不同N/P样品的CPP含量分别为42.2%, 50.0%, 51.0%.见附件主要问题:1、毛细管区带电泳法测蛋白质含量是否准确?2、一般都可以测什么类型的蛋白质?
食品安全国家标准 食品营养强化剂 酪蛋白磷酸肽
《发育细胞》(Developmental Cell)是Cell出版社旗下著名期刊之一,近期来自中科院上海生命科学研究院,以及清华大学的两组研究人员同期发表文章,获得了造血与血管发育调控机制,以及斑马鱼胚胎腹部组织发育机制的两项研究新成果。在第一篇文章“Protein Phosphatase 4 Cooperates with Smads to Promote BMP Signaling in Dorsoventral Patterning of Zebrafish Embryos”中,研究人员指出一种蛋白磷酸酶:Ppp4c是BMP信号的一个重要的正向调节因子,促进斑马鱼胚胎早期的腹部组织发育。这揭示了斑马鱼胚胎腹部组织发育的一种新机制。在脊椎动物的胚胎发育中,BMP信号对于腹部组织的形成、表皮外胚层的诱导发挥关键作用,其异常可导致胚胎夭折或出现严重的缺陷。BMP信号分子在细胞膜上与受体结合后激活胞质中的Smad1/5/8蛋白,这些Smads蛋白进入细胞核、结合在靶基因的调控元件上,与其他转录因子共同调节靶基因的表达。例如,Smad1/5/8可以与染色质的修饰蛋白—组蛋白乙转移酶(HATs)以及组蛋白去乙酰化酶(HDACs)共同作用,调节下游靶基因的表达。Ppp4c是蛋白磷酸酶4(Protein phosphatase 4,Ppp4)的催化亚基,是高等真核生物中广泛存在的一种丝氨酸/苏氨酸磷酸酶。Ppp4的催化亚基Ppp4c可以与调节亚基R1或R2相互作用形成二聚体,并同时与其它的调节亚基选择性结合,作为一个复合体共同发挥作用。Ppp4c从非脊椎动物到脊椎动物都极度保守,它可以通过磷酸酶活性将其特异底物去磷酸化,进而在绵羊血清许多信号通路中发挥作用。Ppp4C是否参与BMP信号的转导,以前并不清楚。在这篇文章中,研究人员发现在斑马鱼胚胎中抑制ppp4c基因的表达,胚胎腹部组织发育受到抑制,而背部组织扩增,因而其在胚胎背腹图式形成中是必不可少的。在分子机制上,Ppp4c与Smad1/5直接互作,被招募至BMP靶基因的增强子区域,与Smad1/5一起增强靶基因的转录。尽管Ppp4c是去磷酸酶,但它并不改变Smad1/5的磷酸化状态;当Ppp4c被Smad1/5带到靶基因启动子上后,它使启动子上结合的Hdac3去磷酸化,从而解除Hdac3对染色质的转录抑制作用。除此之外,胚胎中的互作实验室表明,下调Ppp4c的表达可以抑制过表达外源BMP信号所引起的腹部化效果,而下调Ppp4c的表达所导致的胚胎背部化效果也可以通过下调Hdac3的表达得以部分挽救。因此,Ppp4c是BMP信号的胎牛血清一个重要的正向调节因子,促进斑马鱼胚胎早期的腹部组织发育。这项研究指出了蛋白磷酸酶Ppp4c促进BMP信号的转导,参与调控斑马鱼胚胎的背腹细胞命运分化,对于斑马鱼胚胎发育,以及信号通路调控研究具有重要意义。另外一篇文章:Thrombin Receptor Regulates Hematopoiesis and Endothelial-to-Hematopoietic Transition,则指出了凝血酶受体F2r在脊椎动物造血发育过程中的重要作用,并证明了F2r-RhoA/ROCK 途径在其中的基础性功能,也提出了一种重要的造血与血管发育调控机制。 Labconco生物安全柜春季促销 买即送安全柜支架一套!造血发育,以及血管的发育与脊椎动物胚胎发育生理过程密切相关,虽然人类对脊椎动物造血系统以及心血管系统的研究已有几百年的历史,但是它们的发育机制尚未完全阐明。脊椎动物进化过程中造血过程与心血管的发生是高度保守的。近期研究人员发现内皮血液转化(endothelial-to-hematopoietic transition )过程对于造血干细胞和祖细胞诱导形成具有关键性的细胞培养作用,但是其中的机理还并未阐述清楚。在这篇文章中,研究人员发现凝血酶受体(F2r)——一种蛋白酶激活G蛋白偶联受体,是血管发育的必需成分,这种受体能作为造血发育过程中的负调控因子起作用。而且研究人员还发现在小鼠胚胎干细胞(mESCs)造血分化过程,以及斑马鱼造血发育过程中,F2r具有重要的正调控作用。抑制F2r的活性或表达能够显著促进小鼠胚胎干细胞向血液分化和斑马鱼定向造血,而过表达F2r则会导致相反的效应。进一步机理研究还确认RhoA/ROCK通路作为F2r的下游信号分子介导了F2r对EHT及造血干细胞产生的负调控作用,从而阐明了F2r-RhoA/ROCK通路在脊椎动物造血发生和EHT中的重要功能,同时证实了F2r信号通路在协调血液发育和血管发育中的作用。此项研究还有可能为提高体外血液分化效率和治疗相关的血液疾病提供新的思路。
一、 前言基因工程已令人难以置信的扩展了我们关于有机体DNA序列的认识。但是仍有许多新识别的基因的功能还不知道,也不知道基因产物是如何相互作用从而产生活的有机体的。功能基因组试图通过大规模实验方法来回答这些问题。但由于仅从DNA序列尚不能回答某基因的表达时间、表达量、蛋白质翻译后加工和修饰的情况、以及它们的亚细胞分布等等,因此在整体水平上研究蛋白质表达及其功能变得日益显得重要。这些在基因组中不能解决的问题可望在蛋白质组研究中找到答案。蛋白质组研究的数据与基因组数据的整合,将会在后基因组研究中发挥重要作用。目前蛋白质组研究采用的主要技术是双向凝胶电泳和质谱方法。双向凝胶电泳的基本原理是蛋白质首先根据其等电点,第一向在pH梯度胶内等电聚焦,然后转90度按他们的分子量大小进行第二向的SDS-PAGE分离。质谱在90年代得到了长足的发展,生物质谱当上了主角,蛋白质组学又为生物质谱提供了一个大舞台。他们中首选的是MALDI-TOF,其分析容量大,单电荷为主的测定分子量高达30万,干扰因素少,适合蛋白质组的大规模分析。其次ESI为主的LC-MS联机适于精细的研究。本文将简介几种常用的生物质谱技术,并着重介绍生物质谱技术在蛋白质组学各领域的应用。二、 生物质谱技术1.电喷雾质谱技术(ESI)电喷雾质谱技术( Electrospray Ionization Mass Spectrometry , ESI - MS) 是在毛细管的出口处施加一高电压,所产生的高电场使从毛细管流出的液体雾化成细小的带电液滴,随着溶剂蒸发,液滴表面的电荷强度逐渐增大,最后液滴崩解为大量带一个或多个电荷的离子,致使分析物以单电荷或多电荷离子的形式进入气相。电喷雾离子化的特点是产生高电荷离子而不是碎片离子, 使质量电荷比(m/ z) 降低到多数质量分析仪器都可以检测的范围,因而大大扩展了分子量的分析范围,离子的真实分子质量也可以根据质荷比及电荷数算出。2.基质辅助激光解吸附质谱技术(MOLDI)基质辅助激光解析电离(MOLDI)是由德国科学家Karas和Hillenkamp发现的。将微量蛋白质与过量的小分子基体的混合液体点到样品靶上,经加热或风吹烘干形成共结晶,放入离子源内。当激光照射到靶点上时,基体吸收了激光的能力跃迁到激发态,导致蛋白质电离和汽化,电离的结果通常是基体的质子转移到蛋白质上。然后由高电压将电离的蛋白质从离子源转送到质量分析器内,再经离子检测器和数据处理得到质谱图。TOF质量分析器被认为是与MALDI的最佳搭配,因为二者都是脉冲工作方式,在质量分析过程中离子损失很少,可以获得很高的灵敏度。TOF质量分析器结果简单,容易换算,蛋白质离子在飞行管内的飞行速度仅与他的(m/z)-1/2成正比,因此容易通过计算蛋白质离子在飞行管内的飞行时间推算出蛋白质离子的m/z值。与传统质量分析器相比,更易得到高分辨率和高测量精度;速度快,离子飞行时间仅为几个μs和约100μs之间;质量范围宽,可以直接检测到几十万道尔顿的单电荷离子。飞行时间质量分析器被认为是21世纪最有应用前景的质量分析器。3.傅立叶变换-离子回旋共振质谱(FT-ICR MS)傅立叶变换-离子回旋共振质谱法(FT-ICR MS)是离子回旋共振波谱法与现代计算机技术相结合的产物。傅立叶变换-离子回旋共振质谱法是基于离子在均匀磁场中的回旋运动, 离子的回旋频率、半径、速度和能量是离子质量和离子电荷及磁场强度的函数, 当对离子施加与其回旋频率相同的射频场作用时, 离子将同相位加速到一较大的半径回旋, 从而产生可被接受的类似电流的信号。傅立叶变换-离子回旋共振质谱法所采用的射频范围覆盖了欲测定的质量范围,所有离子同时被激发, 所检测的信号经过傅立叶变换, 转换为质谱图。其主要优点有:容易获得高分辨;便于实现串极质谱分析;便于使用外电离源并与色谱仪器联用。此外,他还有灵敏度高,质量范围宽,速度快,性能可靠等优点。4.快原子轰击质谱技术(FABMS)快原子轰击质谱技术( Fast Atom Bomebardment Mass Spectrometry , FABMS) 是一种软电离技术,是用快速惰性原子射击存在于底物中的样品,使样品离子溅出进入分析器,这种软电离技术适于极性强、热不稳定的化合物的分析,特别适用于多肽和蛋白质等的分析研究。FABMS能提供有关离子的精确质量,从而可以确定样品的元素组成和分子式。而FABMS -MS 串联技术的应用可以提供样品较为详细的分子结构信息,从而使其在生物医学分析中迅速发展起来。三、蛋白质的分析鉴定随着质谱技术的发展,分子量的测定已从传统的有机小分子扩展到了生物大分子。MALDI-MS技术以其极高的灵敏度、精确度在蛋白质分析中得到了广泛的应用。该技术不仅可测定各种疏水性、亲水性和糖蛋白的分子量,还可直接测定蛋白质混合物的分子量。这可认为是蛋白质分析领域的一项重大突破。蛋白质组的研究是从整体水平上研究细胞或有机体内蛋白质的组成及其活动规律。质谱技术作为蛋白质组研究的三大支撑技术之一,除了用于多肽,蛋白质的分子量测定外,还广泛的应用于肽指纹图谱测定及氨基酸序列测定。肽指纹图谱(Peptide Mass Fingerprinting, PMF)测定是对蛋白酶解或降解后所得多肽混合物进行质谱分析的方法。质谱分析所得肽断与多肽蛋白数据库中蛋白质的理论肽断进行比较,判断出所测蛋白是已知还是未知。由于不同的蛋白质具有不同的氨基酸序列,不同蛋白质所得肽断具有指纹特征。采用肽指纹谱的方法已对酵母、大肠杆菌、人心肌等多种蛋白质组进行了研究。对肽序列的测定往往要应用串连质谱技术,采用不同的技术选择特定质核比的离子,并对其进行碰撞诱导解离,通过分析肽段的断裂情况推导出肽序列。四、后转录修饰的蛋白质的检测和识别在蛋白质组的研究中,蛋白质和多肽的序列分析已不局限于阐明蛋白质的一级结构,对翻译后的修饰的进一步分析也是蛋白质化学的一项重要任务。这种修饰对于蛋白质的功能非常重要,如:细胞识别中的蛋白质相互作用,信号传导和蛋白质定位。1. 蛋白质的糖基化糖蛋白在细胞内部,细胞膜和细胞外均有发现,实际上大部分蛋白质是糖蛋白。对糖蛋白的检测和分析发现,糖蛋白中糖组分的结构和功能具有多样性。糖蛋白中的糖通常是不同种类的,而且是由一些可控数量的单糖组成。糖基化的多样性与细胞周期,细胞分化和发展的状态有关。在蛋白组时代中,蛋白质的修饰会引起其理化性质的改变,因此是不容忽视的。从1D或2D凝胶得到的糖基化蛋白的识别,一般是进行MALDI-MS指纹分析, 或是对MALDI-PAD或ESI-MS/MS得到的碎片谱进行分析。对完整的糖蛋白的研究是非常困难的,所有已知的离子化技术都有其局限性。目前,人们主要研究糖肽,其好处之一就是质量减小了,这就会得到更好的分辨率,而且糖肽仍保留了糖基化位点。将分离的糖蛋白用不同的蛋白酶消化后就可进行糖肽的研究。一旦糖肽被识别出,就可以用串连质谱(ESI-MS/MS)来阐明肽序列。当蛋白的序列已知时,计算质量差就可推出其上附着的寡糖的质量。要将糖部分从糖蛋白中释放出来,可用化学切割或酶切割(流程图见图1)。目前,连有结构专一性糖苷酶的质谱在提供序列,分支和链接数据方面是最有力的技术。对于N糖基化常用的糖苷内切酶有PNGase-F, PNGase-A, EndoF和EndoH。化学切割也可以用来释放O-连接和N-连接的多糖,但经常出现的缺点是他会完全破坏所有的肽键,因而丢失了关于糖附着位点的信息。而且这些切割不能从糖肽中连续释放单糖。用肼的化学切割可以除去两种类型的糖基化。在60℃可专一性的释放O-连接的糖,而在95℃能释放N-连接的糖。释放O-原子更常用的方法是用碱进行β消除。通常,糖基中加入金属离子在MALDI和ESI中离子化。用MALDI-MS分析糖类的一个好的选择是将之与其他一些化合物混合,这样可以进一步提高灵敏度和分辨率。不同的质谱方法可以产生多糖的源后裂解(PSD)和碰撞诱导解离 (CID)谱,这可以给出有关糖的序列,分支及糖间的连接等信息。2. 蛋白质的磷酸化蛋白质中氨基酸的磷酸化在生命系统中起重要的作用。磷酸化经常作为分子开关控制不同过程蛋白质的活性,如新陈代谢,信号传导,细胞分裂等过程。因此,蛋白质中磷酰氨基酸的识别在蛋白质分析中是一项重要的工作。已知的磷酰氨基酸的类型有四种:1.O-磷酸盐,通过羟氨酸的磷酸化形成的,如丝氨酸,苏氨酸,酪氨酸。2.N-磷酸盐,通过精氨酸,赖氨酸或组氨酸中的氨基的磷酸化形成的。3.乙酰磷酸盐,通过天冬氨酸或谷氨酸的磷酸化形成的。4.S-磷酸酯,通过半胱氨酸的磷酸化形成的。
转从:中国分析网,很不错的一网站。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=16097]YYSWXS0296 蛋白质 糖蛋白重组人白介素 4受体 N-糖基化位点测定 基质辅助激光解吸附电离飞行时间质谱法[/url][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=16098]YYSWXS0281 蛋白质 β-casein的磷酸化分析 电喷雾质谱法[/url][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=16099]YYSWDB0131 蛋白质细胞色素C 分子量的测定电喷雾质谱法[/url]
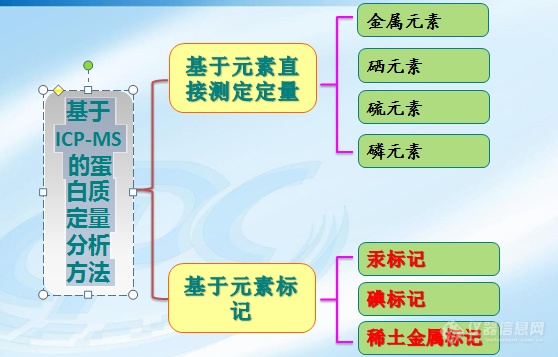
[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]技术是80年代发展起来的新的分析测试技术。它以将ICP的高温(8000K)电离特性与四极杆质谱计的灵敏快速扫描的优点相结合而形成一种新型的最强有力的元素分析、同位素分析和形态分析技术。该技术提供了极低的检出限、极宽的动态线性范围、谱线简单、干扰少、分析精密度高、分析速度快以及可提供同位素信息等分析特性。目前,在[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]电感耦合等离子体质谱[/color][/url]技术上面的突破性技术已经越来越少,但在[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICPMS[/color][/url]应用方面却在不断的扩大,比如应用[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]对蛋白质进行定量分析。一般来说蛋白质的定量分析主要借助于生物质谱,但是随着生命科学的迅猛发展,[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]凭借其诸多优点也开始进入并活跃在蛋白质分析领域。本文就带你走进[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]的应用前沿,领略下基于[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]蛋白质定量分析的几种相关技术。基于[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 的蛋白质定量分析方法主要有以下几种,如下图所示,本文将一一叙述。[color=teal][/color][img=,538,358]http://ng1.17img.cn/bbsfiles/images/2018/04/201804041432166086_2066_1615758_3.png!w538x358.jpg[/img]一、基于金属元素的蛋白质[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]定量技术[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]对蛋白的定量主要是通过测定金属元素的含量,再根据每种蛋白质所含金属的计量比,计算出蛋白质的绝对量。有文献利用65Cu作为稀释剂,采用[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]同位素稀释法法对含铜的蛋白进行绝对定量。[img=,578,314]http://ng1.17img.cn/bbsfiles/images/2018/04/201804041433401796_21_1615758_3.png!w578x314.jpg[/img]二、基于硒元素的[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]蛋白质定量技术硒在体内主要通过硒蛋白发挥作用,人体血液中96%~98%的硒是和蛋白质结合的,一般以硒代半胱氨酸(Sec)、硒代甲硫氨酸的形式结合在蛋白质中。同位素稀释质谱[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 定量法利用标记77Se 的硒代甲硫氨酸作为稀释剂,通过测定硒代甲硫氨酸77Se 和80Se 的丰度比从而进行定量。[img=,664,306]http://ng1.17img.cn/bbsfiles/images/2018/04/201804041446313436_7795_1615758_3.png!w664x306.jpg[/img]三、基于硫元素的[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]蛋白质定量技术在[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 可以测量的所有元素中,硫是最适合作为蛋白质定量分析的内标元素.这是由于S 是蛋白质中一种常见的元素,S 原子多以共价键稳定地存在于蛋白质分子中.蛋白质有两种氨基酸,即蛋氨酸和半胱氨酸含有硫元素。如果某种蛋白质已经由生物质谱鉴定,或者这种蛋白质分子的氨基酸序列和其中含有的S 原子数已知,那么就可以通过[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 直接测定半胱氨酸或甲硫氨酸中硫的含量实现蛋白质的绝对定量。[img=,664,269]http://ng1.17img.cn/bbsfiles/images/2018/04/201804041449050956_1648_1615758_3.png!w664x269.jpg[/img]四、基于磷元素[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 测定的蛋白质定量技术磷是生物体中最重要的元素之一。磷酸化过程是调节蛋白质活性的重要过程,揭示蛋白质磷酸化修饰发生规律是理解生物体复杂多样的生物进程的一个重要前提。磷酸化蛋白在样本中含量低且动态范围广、蛋白质磷酸化水平不均一、磷酸化修饰类型多,这些特点决定了对磷酸化蛋白的研究具有挑战性。蛋白质分子中磷的测定可以对蛋白质的磷酸化状态提供重要信息。[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 对元素的测定与分析物的结构无关,只与分析物中元素的含量有关,因此[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 不仅能够鉴定蛋白质中磷的存在,而且可准确测定蛋白质的磷酸化程度。[img=,563,296]http://ng1.17img.cn/bbsfiles/images/2018/04/201804041449182306_4389_1615758_3.png!w563x296.jpg[/img]五、基于元素标记的[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]蛋白质定量技术稀土金属元素的化学物理性质非常相近,在液相上能共金属元素的化学物理性质非常相近,在液相上能共洗脱。与硫、磷等元素相比,稀土金属元素在[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 中质谱响应更强,受到的同量异位素干扰较少,更容易检测。因此,利用[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 检测蛋白质标记的稀土金属从而进行蛋白质定量的方法具有很大的应用前景。将标记元素引入蛋白质的方法主要有两种:通过共价键直接将杂原子与特定氨基酸结合;通过配位化合物引入金属元素。标记时既可以标记蛋白质或肽的主链(N或C端) ,也可以标记其中的氨基酸(Cys、Met、Lys 等)。主要有碘、汞、稀土等。[img=,639,345]http://ng1.17img.cn/bbsfiles/images/2018/04/201804041451025126_6783_1615758_3.png!w639x345.jpg[/img][img=,615,352]http://ng1.17img.cn/bbsfiles/images/2018/04/201804041451027144_9325_1615758_3.png!w615x352.jpg[/img][url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 作为元素的分析手段, 需要ESI-MS、MALDI-TOF 等生物质谱提供蛋白质结构信息,将元素定量分析的无机质谱和蛋白质结构分析的生物质谱有机地结合。基于分离技术的发展和其他质谱技术的辅助,蛋白质的[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url] 定量技术在生物样本的蛋白质定量和蛋白质组学研究中会具有潜在广泛的应用价值。
耶鲁研究学者成功地对细菌的蛋白质合成机制进行遗传学改造 随着合成生物学的发展,科学家们已经掌握了相当的遗传学工具,他们已能够修改有机物的天然遗传密码,甚至重新谱写生命。在昨天的《科学》杂志上,耶鲁大学的研究学者发表论文说,他们已成功对细菌中的蛋白质合成机制进行遗传学改造。该论文的作者,细胞及分子生理学系的杰斯·莱因哈特(Jesse Rinehart)介绍说:“从本质上来说,我们已经扩展了大肠杆菌的遗传密码,这让我们能够合成以特殊形式,例如模拟天然状态或者疾病状态的蛋白质。”耶鲁研究小组的理念是, 通过修改遗传密码,用新的方式影响蛋白质的行为,使之能实现大多数的生命功能。他们并没有创造自然界不存在的东西,而是诱发了磷酸化作用(phosphorylation)。磷酸化作用是生命体中最常见的基本生理过程,它能显著改变蛋白的功能。通常,蛋白的磷酸化作用并不直接由DNA编码指导合成,而是在蛋白质合成之后才开始,而这正是耶鲁的研究人员们想要改写的:他们希望把磷酸化过程添加到大肠杆菌的遗传密码中,通过DNA第一时间就能指导蛋白磷酸化。过去,科学家们缺乏研究磷酸化状态蛋白的能力,致使对某些疾病的研究停滞不前,例如蛋白活性极高的癌症。而这项新技术实现了人类蛋白质的天然磷酸化体系,这对于理解疾病的发展至关重要。莱因哈特解释说:“我们现在做的就是运用蛋白开关——把蛋白机制打开或关闭,这让我们能以全新的方式研究疾病状态,并有望引导新药的研发。”莱因哈特他们现在打算创建与癌症、糖尿病以及高血压相关的磷酸化蛋白质,不过他们强调说,这种技术能够实现处理任何种类的蛋白质。
[font=宋体][url=https://cn.sinobiological.com/category/wb-faq][b][font=Calibri]WB([/font][font=宋体]蛋白质印迹[/font][font=Calibri])[/font][/b][/url][font=宋体]是一种用于检测样本(如细胞提取物或组织匀浆)中特异性蛋白的技术,也用于分析体外合成的重组蛋白。蛋白免疫印迹法还可以根据某种抗原与其相对抗体之间的特殊亲和力来鉴定靶蛋白。蛋白免疫印迹法一般包含三个主要步骤分别为[/font][font=Calibri]SDS-PAGE[/font][font=宋体]、样品印迹和免疫学检测。通过蛋白免疫印迹法可以获得关于靶蛋白的定性和半定量数据。在蛋白质领域,蛋白免疫印迹法被广泛用于蛋白表达水平的检测。下面针对[/font][b][font=Calibri]WB[/font][font=宋体]在实验过程中遇到的问题进行罗列及解答:[/font][/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、为什么抗磷酸化酪氨酸抗体会出现高背景或信号减弱?[/font][/font][font=宋体][font=宋体]请您检查所使用的封闭液并注意封闭以及洗膜的时间。有两种常用的封闭液:脱脂奶粉或[/font][font=Calibri]BSA[/font][font=宋体]。脱脂奶粉成本低但不能用于磷酸化蛋白的封闭,因为脱脂奶粉含有酪蛋白,该蛋白本身就是一种磷酸化蛋白,会结合在膜上并与磷酸化特异性抗体结合导致高背景。并且稀释抗磷酸化酪氨酸抗体与脱脂奶粉中的酪蛋白结合后,用于检测的抗体较少导致信号减弱。此外,避免封闭时间过长,否则会掩盖抗原表位,阻止抗体结合。洗膜时间不宜过长或过短,过长会导致信号减弱(抗体被洗脱),过短则会导致高背景。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]我们建议使用含[/font][font=Calibri]1% BSA[/font][font=宋体]的[/font][font=Calibri]TBS[/font][font=宋体],含吐温[/font][font=Calibri]20[/font][font=宋体]作为封闭液,请勿使用脱脂奶粉。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、为什么随着时间的推移,蛋白免疫印迹法中的抗体活性会降低?[/font][/font][font=宋体]如果您使用我们的一种抗体进行蛋白免疫印迹分析,并且反应性似乎随着时间的推移而降低,可能的原因及解决方案如下:[/font][font=宋体] [/font][font=宋体]①可能的原因一:使用了不同的样本。[/font][font=宋体]解决方案:培养的细胞会随着时间的推移而变性,因此我们建议解冻新鲜细胞。[/font][font=宋体]②可能的原因二:样品在储存期间或反复冻融后降解。[/font][font=宋体]解决方案:制备新鲜样品,避免反复冻融。[/font][font=宋体]③可能的原因三:抗体被污染。解决方案: 旋转小瓶,检查是否有沉淀。[/font][font=宋体]④可能的原因四:二抗失效。解决方案:更换新的二抗。[/font][font=宋体]⑤可能的原因五:蛋白质转膜效率低。解决方案:配置新的转膜液;根据蛋白分子量大小调整转膜时间。[/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、如何避免转膜不充分或结果不理想的问题?[/font][/font][font=宋体][font=宋体]确定蛋白质的大小。如果蛋白质大于[/font][font=Calibri]180 kDa[/font][font=宋体],则需要通过以下方式优化转膜条件:[/font][/font][font=宋体][font=宋体]? 使用[/font][font=Calibri]20% MeOH[/font][font=宋体]。[/font][/font][font=宋体][font=宋体]? 加入[/font][font=Calibri]0.05% SDS[/font][font=宋体]转膜缓冲液。[/font][/font][font=宋体]? 增加裂解物的上样量。[/font][font=宋体][font=宋体]? [/font][font=Calibri]110 V[/font][font=宋体]恒压转[/font][font=Calibri]150 min[/font][font=宋体],湿法转膜。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4[/font][font=宋体]、如何避免“斑点状”或不均匀的蛋白免疫印迹?[/font][/font][font=宋体][font=宋体]为避免进行蛋白免疫印迹法时出现[/font][font=宋体]“斑点状”或不均匀的印迹,有以下几种方法[/font][font=Calibri]: [/font][/font][font=宋体]? 延长封闭时间,以优化封闭效果。[/font][font=宋体]? 延长洗涤次数 (这对组织匀浆样品尤为重要)。[/font][font=宋体]? 在配置封闭液时,确保奶粉完全溶于溶液。[/font][font=宋体]? 在取出抗体溶液使用之前,旋转装有抗体溶液的试管,防止出现蛋白沉淀。[/font][font=宋体] [/font][font=宋体][font=Calibri]5[/font][font=宋体]、如何避免印迹上出现“点状”、不均匀的斑点?[/font][/font][font=宋体][font=宋体]为避免印迹上出现[/font][font=宋体]“点状”或不均匀斑点,请尝试以下几种方法:[/font][/font][font=宋体]? 检查所有缓冲液是否被细菌污染。[/font][font=宋体]? 确保在抗体和清洗孵育过程中膜完全浸入。[/font][font=宋体]? 在转膜时,排除薄膜和凝胶之间的所有气泡。[/font][font=宋体]? 将膜放在摇床上,确保均匀地接触。[/font][font=宋体]? 清洗蛋白免疫印迹所需的设备。[/font][font=宋体][font=宋体]? 过滤[/font][font=Calibri]HRP[/font][font=宋体]结合物,除去任何可能的聚集物。[/font][/font][font=宋体]?减少底物暴露时间。[/font][font=宋体] [/font][font=宋体][font=Calibri]6[/font][font=宋体]、选择什么作为[/font][font=Calibri]WB[/font][font=宋体]抗体的阳性对照?[/font][/font][font=宋体]为了使您的蛋白免疫印迹抗体中获得最佳性能,请使用技术数据表中推荐的阳性对照。阳性对照将帮助您按照制定的方案,在实验中获得准确的结果。[/font][font=宋体][font=宋体]我们建议将这些裂解物放置在[/font][font=Calibri]-20[/font][font=宋体]℃下长期储存。裂解物非常稳定,它们是细胞制剂,所有酶均变性和灭活。我们做了大量的研究,证实了不同条件下的稳定性。例如,大多数裂解物的完整性和质量不受反复冻融的影响,可在[/font][font=Calibri]25[/font][font=宋体]℃下储存长达[/font][font=Calibri]12[/font][font=宋体]周。但裂解物在[/font][font=Calibri]37[/font][font=宋体]°[/font][font=Calibri]C[/font][font=宋体]下[/font][font=Calibri]4[/font][font=宋体]周时开始降解。然而,根据裂解物的来源,稳定性可能存在一些轻微差异,因此我们建议将其储存在[/font][font=Calibri]-20[/font][font=宋体]℃下。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]7[/font][font=宋体]、应该分析多少蛋白质?[/font][/font][font=宋体]我们建议:[/font][font=宋体]样本类型[/font][font=宋体]每条泳道[/font][font=宋体]全细胞裂解液[/font][font=宋体][font=Calibri]50 [/font][font=宋体]μ[/font][font=Calibri]g[/font][/font][font=宋体]细胞核提取物[/font][font=宋体][font=Calibri]25 [/font][font=宋体]μ[/font][font=Calibri]g[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]8[/font][font=宋体]、应该使用多少浓度的丙烯酰胺凝胶来分离蛋白?[/font][/font][font=宋体]为了更好地分离感兴趣蛋白,丙烯酰胺凝胶的百分比应基于蛋白分子量。我们建议:[/font][font=宋体][font=宋体]蛋白大小([/font][font=Calibri]kDa[/font][font=宋体])[/font][/font][font=宋体][font=宋体]丙烯酰胺凝胶百分比([/font][font=Calibri]%[/font][font=宋体])[/font][/font][font=宋体][font=Calibri] 80[/font][/font][font=宋体][font=Calibri]7.5[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]9[/font][font=宋体]、蛋白免疫印迹法应使用哪种印迹膜?[/font][/font][font=宋体][font=宋体]我们建议使用硝酸纤维素([/font][font=Calibri]NC[/font][font=宋体])膜。虽然聚偏二氟乙烯([/font][font=Calibri]PVDF[/font][font=宋体])膜、尼龙膜和[/font][font=Calibri]DEAE[/font][font=宋体]纤维素膜也可以使用,但有时会产生升高的背景,特别是实验过程中使用山羊多克隆抗体。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]10[/font][font=宋体]、应该使用什么封闭缓冲液?[/font][/font][font=宋体][font=宋体]封闭液的选择与目标蛋白有关,我们建议一般使用[/font][font=Calibri]1X TBS[/font][font=宋体]、[/font][font=Calibri]5%[/font][font=宋体]脱脂奶粉、[/font][font=Calibri]0.05%[/font][font=宋体]吐温[/font][font=Calibri]-20[/font][font=宋体]作为封闭液,在室温下封闭[/font][font=Calibri]30-60[/font][font=宋体]分钟或在[/font][font=Calibri]4[/font][font=宋体]℃下封闭过夜。请注意,如果封闭过夜,缓冲液中应不加吐温[/font][font=Calibri]-20[/font][font=宋体]。如果目标蛋白较特殊(如磷酸化),建议使用[/font][font=Calibri]1X TBS[/font][font=宋体]、[/font][font=Calibri]1% BSA[/font][font=宋体]并含有吐温[/font][font=Calibri]-20[/font][font=宋体]的封闭液,可得到较清晰条带。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]11[/font][font=宋体]、一抗的稀释倍数一般是多少?[/font][/font][font=宋体]请查看各个抗体的数据表,因为这通常记录起始稀释度。如果数据表上没有具体稀释信息,我们建议您对相关的阳性和阴性对照进行连续滴定。[/font][font=宋体] [/font][font=宋体][font=Calibri]12[/font][font=宋体]、为什么实际的蛋白免疫印迹条带大小与预期的不同?[/font][/font][font=宋体][font=宋体]蛋白免疫印迹法是根据蛋白质大小分离蛋白的技术。一般来说,蛋白越小,其在[/font][font=Calibri]SDS-PAGE[/font][font=宋体]凝胶中移动的速度就越快。然而,移动速率也受到其他因素的影响,因此实际条带大小可能与预测不一致。[/font][/font][font=宋体] [/font][font=宋体]可能的原因[/font][font=宋体]备注[/font][font=宋体]①翻译后修饰[/font][font=宋体]例如磷酸化、糖基化等,可增加蛋白质的大小。[/font][font=宋体]②翻译后切割[/font][font=宋体]大多数蛋白质首先合成为前体蛋白形式,再经切割产生活性形式,例如前体半胱天冬酶。[/font][font=宋体]③剪接变体[/font][font=宋体][font=宋体]可变剪切会产生从同一基因产生不同大小的蛋白质。剪接变体的表达具有高度变异性,取决于使用的特定组织和实验条件[/font] [font=宋体]。[/font][/font][font=宋体]④亚型[/font][font=宋体]许多蛋白质表达多种不同大小的亚型。相同靶蛋白不同亚型的表达具有高度变异性,取决于使用的特定组织和实验条件。参照不同的网站,确定特定靶标的亚型。[/font][font=宋体]⑤相对电荷[/font][font=宋体][font=宋体]氨基酸组成(带电[/font][font=Calibri]vs.[/font][font=宋体]不带电)。[/font][/font][font=宋体]⑥多聚体[/font][font=宋体]例如蛋白质二聚化。尽管相互作用可能导致出现较高条带,但在还原条件下需防止该情况。[/font][font=宋体] [/font][font=宋体][font=Calibri]13[/font][font=宋体]、为什么蛋白免疫印迹结果信号微弱或完全没有信号?[/font][/font][font=宋体] [/font][font=宋体]可能的原因[/font][font=宋体]备注[/font][font=宋体]①抗体滴定 [/font][font=宋体][font=宋体]应使用多种抗体浓度进行抗体滴定实验,以确定最佳信噪比的合适抗体浓度。一般而言,滴定浓度应在[/font][font=Calibri]0.2-5.0 [/font][font=宋体]μ[/font][font=Calibri]g/mL[/font][font=宋体]。[/font][/font][font=宋体][font=宋体]②组织[/font][font=Calibri]/[/font][font=宋体]细胞特异性 [/font][/font][font=宋体]靶蛋白表达取决于待测的细胞或组织。应进行文献检索,确保您正在使用的细胞等条件适用于检测靶蛋白。[/font][font=宋体]③复溶 [/font][font=宋体]在重新溶解冻干抗体时应注意,确保抗体全部溶解。尽管冻干抗体沉淀通常位于试管底部,但有时粉末可能位于管壁上。因此,溶解时应覆盖试管的整个表面,以确保抗体完全溶解。然后进行短暂离心,确保将所有粉末收集在试管底部。[/font][font=宋体]④阳性对照 [/font][font=宋体]在您的蛋白免疫印迹中添加阳性对照泳道是评价抗体是否正常工作和实验条件是否适当的最佳方法。另外,基于文献或实验结果的阳性对照也可以用来评估抗体是否正常发挥作用。[/font][font=宋体] [/font][font=宋体][font=宋体]更多[/font][font=Calibri]WB[/font][font=宋体]蛋白免疫印迹法常见问题详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/category/wb-faq[/font][/font][font=宋体][font=Calibri][url=https://cn.sinobiological.com/services/western-blot-wb-service][b]Western Blot[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/services/western-blot-wb-service][b]检测服[/b][/url]务:[/font][font=Calibri]https://cn.sinobiological.com/services/western-blot-wb-service[/font][/font]
RNA可改变细胞转导通路的线路 人们常说,激发改变的最好的方法是从系统内着手。 现在,研究人员基于RNA创建了控制装置,该装置可被用来以合成的方式重新为细胞行为排布线路,使得这些细胞对药物更为敏感而造成其死亡。 这一工作着重显示了RNA作为设计合成系统平台以控制基因表达及用这类技术来治疗疾病的前途,特别是用基因疗法来为癌性或有病细胞设计使其走向死亡的程式的可能性。 Stephanie Culler及其同事应用短片段的RNA来制造可编程式的控制装置,当这些装置在存在某些蛋白的时候可被激发,使得基因表达通路被重新安排并改变了人类细胞的行为。 在该实验中,研究人员将某关键性信号转导通路的刺激与某个基因表达发生关联,而该基因的表达可使细胞对药物甲基鸟嘌呤变得敏感,并诱导程序化细胞死亡。 他们的RNA控制装置可重新安排有关的通路并促使细胞探测到一种与癌症有关联的标志并激活产生一种蛋白质。该蛋白质可令细胞对某种抗癌药物变得敏感。 这些结果显示,这种RNA装置可用来改变细胞转导通路的线路并指引细胞走向某种特定的命运。 一则相关的观点栏目对这一创建一个单一框架结构以建立合成基因调控系统的工作的可能的影响进行了讨论
我们长期专注于FERMENTEK公司是全球排名前100名的以色列著名生物科技公司,长期专著于提供真菌毒素/生物毒素/神经生物学和细胞信号传导和医药中间体产品。主要有:毒素/离子通道调节剂//神经营养因子、细胞内Ca2+及磷酸化抑制剂等高纯度信号转导研究用试剂Thapsigargin 肌浆网钙泵抑制剂(TG) Leptomycin B 细霉素BBafilomycin A1 巴佛洛霉素A1 Bafilomycin B1 巴佛洛霉素B1Geldanamycin 苯醌安莎霉索(GDM) Ionomycin, Ca salt 钙离子载体Ionomycin,free acid钙离子载体 A23187, 4-Bromo 钙离子载体 A23187, Mixed Ca/Mg salt A23187 (free acid) Paclitaxel (taxol) 紫杉醇 Docetaxel(toxotere) 多烯紫衫醇 Equol 雌马酚Thapsigargin肌浆网钙泵抑制剂(TG) Staurosporine星孢菌素Bisindolylmaleimides酪氨酸磷酸化-抑制剂 Phorbol Esters佛波醇酯4α-Phorbol Phorbol 12,13-Dibutyrate 蛋白激酶 c的激活剂咐噼醇基酯4α-Phorbol 12,13-Dibutyrate 4α-Phorbol 12,13-Didecanoate Phorbol 12-Myristate 13-Acetate 4α-Phorbol 12-Myristate 13-Acetate Tyrphostins Calyculin A 花萼海绵诱癌素CA细胞凋亡相关试剂:Brefeldin A 布雷菲尔得菌素 Hypericin金丝桃素Thapsigargin肌浆网钙泵抑制剂(胡萝卜类素) Cerulenin浅蓝菌素 7Amino-Actinomycin D 7氨基放线菌素 Valinomycin缬氨霉素 Parthenolide 小白菊内酯Fumonisin B2 伏马毒素B2 Leptomycin B 细霉素BActinomycin D (dactomycin) 放线菌素D/IV Cyclopiazonic Acid 环丙阿尼酸Ionomycin 钙离子载体 K252A特异性酪氨酸激酶抑制剂 Cyclosporin A环胞霉素A细胞松弛素类试剂:Cytochalasin A 细胞松弛素A Cytochalasin B 细胞松弛素BCytochalasin C 细胞松弛素C Cytochalasin D 细胞松弛素DCytochalasin E 细胞松弛素E各类抑制剂7AAD(7-Amino-Actinomycin D) 7氨基放线菌素17AAG(17-(Allylamino)-18-demethoxy- geldanamycin) 17-丙烯胺-17-去甲氧格尔德霉素17DMAG(17-dimethylaminoethylamino-18-demethoxy-geldanamycin) Hsp90抑制剂 Cyclopamine环巴胺 A23187, 4-Bromo 钙离子载体A23187, Mixed Calcium / Magnesium salt A23187 (free acid) Actinomycin D (Dactinomycin, Dactomycin) 放线菌素D/IVacivicin 细胞毒素/γ-GTP抑制剂 Apicidin 组蛋白脱乙酰酶抑制剂Radicicol Hsp90特异性之阻断剂 Thapsigargin(TG) 肌浆网钙泵抑制剂Thiolutin 硫藤黄素 Triacsin C 脂酰CoA合成抑制剂 Trichostatin A 曲古菌素ATunicamycin N-糖基化抑制剂 Wortmannin(WT) 磷脂酰肌醇4-激酶的特异性抑制剂Bisindolylmaleimide I 蛋白激酶C-PKC抑制剂Bisindolylmaleimide I,Hydrochloride 蛋白激酶C-PKC抑制剂盐酸盐Bisindolylmaleimide VIII,Acetate salt 酪氨酸磷酸化-抑制剂Bisindolylmaleimide IX,Methanesulfonate salt 酪氨酸磷酸化-抑制剂Bisindolylmaleimide X,Hydrochloride salt 酪氨酸磷酸化-抑制剂Bisindolylmaleimide XI,Hydrochloride salt 酪氨酸磷酸化-抑制剂Tyrphostin AG 1478 酪氨酸磷酸化抑制剂
新华社东京7月10日电(记者蓝建中)日本九州大学和东京大学的一个联合研究小组日前说,他们利用长约1毫米的线虫进行的实验中,首次成功看到活体生物体内蛋白质变化的情况。 九州大学助教广津崇亮等研究人员对线虫头部嗅觉神经中负责传递气味信号的Ras蛋白质进行了研究。他们通过基因操作,将一种发光颜色会随Ras蛋白质状态变化而变化的分子引入线虫的嗅觉神经细胞。这种分子在Ras蛋白质被激活后会发出黄色荧光,未被激活时发蓝光。 研究人员给线虫施加气味刺激,并拍摄了荧光分子的发光情形。结果发现,在施加刺激后Ras蛋白质立即被激活,约3秒钟后迎来活性峰值,之后恢复非活性化状态。 研究人员施加刺激时使用了大肠杆菌产生的一种气味物质。这种大肠杆菌是线虫的食物。此前的研究表明,线虫在寻找食物时,每隔约3秒钟会摆动一下头部,并朝气味强烈的方向前进。研究人员由此认为,Ras蛋白质参与控制了这种行动。 Ras蛋白质是一类能与鸟苷三磷酸结合的蛋白质,参与细胞内的信号转导。由于哺乳动物体内也有这类蛋白质,研究人员认为此次发现将成为弄清高等生物嗅觉信息传递机制的线索。 此外,由于这类蛋白质还与癌症和心脏病等众多疾病的发病相关,所以这一成果还将促进相关的医学研究。 相关论文发表在9日的英国在线科学杂志《科学报道》上。
有机磷农药是指含有磷原子的有机磷类化合物,在生物体内与胆碱酯酶形成磷酸化胆碱酯酶,使胆碱酯酶活性受到抑制而产生毒性作用的一类农药的总称。有机磷农药大多为磷酸酯类或硫代磷酸酯类,微溶于水,易溶于有机溶剂,对光、热、氧及酸稳定,在碱性溶液中分解、解毒。GC分析时,由于进样口等位置活性位点吸附,经常出现检测结果偏差,使得定量结果不能真实反映样品中有机磷农药残留量,给检测带来一定影响。那么在GC分析有机磷类农药残留时,应注意什么?该如何避免系统中各活性点对农药的吸附?
【内容介绍】 本书在总结50年来诺贝尔生命科学奖项(生理学或医学奖及有关生命科学的化学奖)的基础上,系统介绍了各奖项内容及奖项之间的联系,并就其方法论、与科学哲学的关系、获奖的科学环境和历史人文背景、奖项的定量研究、有关学科的交叉,以及在我国自己国土上取得的科研成果尚未得奖的原因等进行了探讨,提出有必要将诺贝尔奖作为一门学问来,研究,使其成为一门学科。本书适合高等院校的理工农医科师生阅读。 【本书目录】 第1篇 诺贝尔生理学或医学奖简介诺贝尔生理学或医学奖遴选标准诺贝尔生理学或医学奖的颁发机构??卡罗琳斯卡学院诺贝尔生理学或医学奖的提名和遴选过程与生命科学有关的诺贝尔化学奖对于诺贝尔生理学或医学奖的舆论批评常被提到的诺贝尔生理学或医学奖的错误颁发第2篇 诺贝尔生理学或医学奖50年奖项评介第1章 DNA、分子生物学和分子遗传学§1.1 DNA双螺旋三维结构模型的建立§1.2 与DNA双螺旋模型有关的诺贝尔奖项§1.3 DNA、基因调控与遗传密码§1.4 遗传信息流中心法则的修订和断裂基因§1.5 真核细胞的转录§1.6 基因工程的端倪??限制性内切酶、DNA测序和DNA重组§1.7 RNA病毒、致癌基因§1.8 有关RNA的研究第2章 免疫学及分子机理§2.1 现代免疫学的开端§2.2 抗体的化学结构§2.3 放射免疫分析??极灵敏的生命物质的测定方法§2.4 主要组织相容性复合体§2.5 免疫网络学说、单克隆抗体与杂交瘤技术§2.6 抗体多样性的分子基础§2.7 免疫移植§2.8 组织相容抗原与丁细胞作用机制第3章 细胞生物学、细胞信号转导§3.1 第二信使??激素作用机制§3.2 亚细胞结构及功能的研究§3.3 前列腺素的发现及其生物学作用§3.4 胆固醇的代谢调控§3.5 神经与上皮生长因子的发现§3.6 可逆性的蛋白质磷酸化过程§3.7 G蛋白及其在细胞信号转导中的作用§3.8 动物基因控制早期胚胎发育的模式§3.9 一氧化氮生理功能的发现§3.10 蛋白质信号序列决定其在细胞内的位置和转运§3.11 细胞内蛋白质的降解§3.12 细胞分裂周期的调控机制§3.13 程序性细胞死亡(细胞凋亡)第4章 神经生物学与听觉、视觉、嗅觉得基础研究§4.1 神经的兴奋抑制与膜的离子通透性§4.2 神经递质和突触理论§4.3 细胞质膜上单离子通道的发现§4.4 大脑半球的分工§4.5 神经系统内的信号转导§4.6 耳蜗刺激(听力)的物理机制§4.7 视觉的生理和化学与视觉信息处理§4.8 嗅觉基因编码和信号大脑皮层定位第5章 新方法、新疗法和新发病机制的研究§5.1 个体和社会行为模式的建立§5.2 X射线-CT扫描仪、核磁共振成像技术§5.3 手性催化剂合成具有新特性的分子§5.4 药物治疗的重要原理§5.5 乙型肝炎和库鲁病病因的发现§5.6 朊蛋白,一种新的传染机制§5.7 溃疡病与幽门螺杆菌§5.8 修改小鼠基因,创建人类疾病模型第3篇 生命科学诺贝尔奖的方法论研究第6章 生命科学诺贝尔奖的研究层次§6.1 科学、技术与科学方法§6.2 诺贝尔奖的研究层次§6.3 生命科学诺贝尔奖中的重要发现和发明第7章 自然科学诺贝尔奖的定量研究§7.1 数据的选取§7.2 诺贝尔物理学奖§7.3 诺贝尔化学奖§7.4 诺贝尔生理学或医学奖第8章 生命科学的研究方法§8.1 把复杂的生命现象简单化§8.2 对线虫研究取得的成果§8.3 DNA双螺旋模型及复制假说的验证第9章 关于交叉学科§9.1 科学发展的一般趋势§9.2 学科交叉与生命科学诺贝尔奖中的奖项第10章 科学哲学与生命科学§10.1 科学与哲学§10.2 科学结论的证实与证伪§10.3 “科学革命”与“范式”§10.4 “新工具主义”??科学革命产生的另一个源泉第11章 处理生物复杂性问题的现实与未来§11.1 生命系统的三大特性??非线性、自组织性和系统性§11.2 生物复杂性问题§11.3 处理生物复杂性问题的一些方法§11.4 世界观的转变第12章 生命科学诺奖产生的科学环境和人文环境§12.1 生命科学诺奖产生的历史背景和科学环境§12.2 生命科学诺奖产生的人文环境第13章 国人的诺贝尔奖情结第14章 诺奖学 [img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=137307]诺贝尔奖和诺贝尔奖学:生命科学诺贝尔奖五十年评介与思考01[/url][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=137308]诺贝尔奖和诺贝尔奖学:生命科学诺贝尔奖五十年评介与思考02[/url][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=137310]诺贝尔奖和诺贝尔奖学:生命科学诺贝尔奖五十年评介与思考03[/url]太大了。。。就分割了一下。。。
[color=#333333]食品理化分析实验可以区分蛋白质和三聚氰胺吗[/color]