蛋白质分析仪的校准
牛奶蛋白质分析仪可以用于检测乳蛋白制品。以下是详细解释和相关信息: 功能与应用:牛奶蛋白质分析仪是一种专门用于分析牛奶及其制品中蛋白质含量的仪器。它基于先进的生化分析技术,如比色法、光谱法或电化学法等,能够准确、快速地检测样品中的蛋白质含量。 乳蛋白制品的检测:乳蛋白制品,如奶粉、酸奶、奶酪等,其蛋白质含量是产品质量和营养价值的重要指标。牛奶蛋白质分析仪可以有效地检测这些乳蛋白制品中的蛋白质含量,为生产厂家提供准确的质量控制手段。 优点与特点: 准确性高:牛奶蛋白质分析仪具有高灵敏度和高准确性,能够确保测量结果的可靠性。 快速便捷:该仪器操作简单,使用方便,可以快速得出测量结果,提高检测效率。 适用范围广:除了牛奶及其制品外,还可以用于其他含蛋白质样品的检测,如豆类制品、肉制品等。 在乳品工业中的重要性:随着乳品市场的不断扩大和消费者对乳制品质量要求的提高,牛奶蛋白质分析仪在乳品工业中的重要性日益凸显。它可以帮助乳品企业提高产品质量、降低生产成本,同时为消费者提供更加安全、健康的乳制品。 综上所述,牛奶蛋白质分析仪是一种功能强大、应用广泛的检测仪器,完全可以用于检测乳蛋白制品中的蛋白质含量。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405271615421543_8284_6238082_3.jpg!w690x690.jpg[/img]
大家好,氨基酸分析仪与蛋白质测序仪有主要区别在什么地方呢?目前实验室需要进行氨基酸的测序分析,究竟买一台蛋白质测序仪好呢,还是氨基酸分析仪好呢?价格大概有多少呢?这些仪器有没有国产的呢 QQ:2392795357
牛奶蛋白质分析仪的原理主要基于光学测量技术,特别是光谱分析法。具体地说,它采用红外光谱法来测量牛奶中乳清蛋白和酪蛋白的含量。首先,将牛奶样品制成透明薄片,然后使用近红外光电传感器和光源对其进行扫描。牛奶中的蛋白质对特定波长的红外光有特定的吸收特性,通过测量这些吸收特性,可以分析出牛奶中蛋白质的种类和含量。此外,仪器会将牛奶光谱与事先建立的标准光谱进行比较,通过复杂的算法处理,从而得出各种蛋白质形态的含量。这种比较和计算过程确保了测量结果的准确性和可靠性。总的来说,牛奶蛋白质分析仪通过光学测量和光谱分析技术,能够快速、准确地测定牛奶中蛋白质的含量和种类,为乳制品生产、质量控制和科学研究提供了有力的支持。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/04/202404291701212298_2595_6238082_3.jpg!w690x690.jpg[/img]
牛奶蛋白质分析仪是一种专业的检测设备,主要用于对牛奶中的蛋白质进行快速、准确地分析。该仪器在乳制品行业中发挥着重要的作用,能够帮助消费者了解牛奶的质量和营养成分,同时也能为乳制品生产企业提供科学的指导,优化生产工艺,提高产品质量。 牛奶蛋白质分析仪的工作原理主要基于光谱分析技术,通过测量牛奶中蛋白质对特定波长光线的吸收来计算蛋白质的含量。该仪器具有操作简便、快速、准确等特点,可广泛应用于各类乳制品的生产、加工、质检等领域。 具体来说,牛奶蛋白质分析仪在乳制品生产线上具有以下应用: 原料奶检测:确保原料乳的质量符合生产要求,通过快速检测原料奶中蛋白质的含量,确保生产过程中的原料质量稳定。 加工过程控制:实时监测加工过程中蛋白质的变化情况,指导生产商及时调整工艺参数,确保产品品质。 产品质量检验:质检部门和乳制品企业可以利用牛奶蛋白质分析仪对市场上的乳制品进行抽检,判断其蛋白质含量是否符合国家标准。这有助于打击假冒伪劣产品,保障消费者的合法权益。 此外,牛奶蛋白质分析仪还可以检测牛奶中的其他营养成分,如脂肪、糖等,从而全面评估牛奶的营养价值。通过使用这种仪器,乳制品企业可以及时发现并解决生产过程中的问题,提高产品的竞争力,并保障食品安全。 总之,牛奶蛋白质分析仪是乳制品行业中不可或缺的重要检测工具,其在保障产品质量和消费者健康方面发挥着重要作用。如需更多信息,可以访问牛奶蛋白质分析仪生产厂商官网或咨询乳制品行业专家。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/04/202404291700285525_1260_6238082_3.jpg!w690x690.jpg[/img]
[font=-apple-system, BlinkMacSystemFont, &][color=#05073b][size=16px] 蛋白质检测仪测量指标有哪些,蛋白质检测仪的测量指标可以因不同型号、品牌和用途的仪器而有所差异。然而,一般来说,蛋白质检测仪的测量指标可以归纳为以下几个方面: 一、基本测量参数 检出下限:这是仪器能够检测到的最低蛋白质含量,通常以百分比或具体浓度值表示。例如,某些蛋白质快速检测仪器的检出下限为0.5%。 检测范围:仪器能够测量的蛋白质含量的范围,这通常是一个区间值。例如,某些仪器的检测范围为(0~50)%。 吸光度值范围:在光度法中,吸光度是衡量物质对光吸收程度的物理量,蛋白质检测仪通常会给出其吸光度值的测量范围,如0.000-4.000A。 重复性:这是衡量仪器测量结果稳定性的一个重要指标,通常以百分比或具体数值表示。例如,某仪器的重复性为±0.1%(A)。 重复性误差:与重复性相关,但更具体地描述了多次测量同一样品时结果之间的差异,如吸光度(A)≤0.003。 稳定性:指仪器在长时间运行或不同时间点测量时,结果的一致性。例如,光电漂移(A)±0.002(3分钟)可以反映仪器的稳定性。 二、特定功能指标 多通道检测:一些先进的蛋白质检测仪支持多通道检测,可以同时处理多个样品,提高检测效率。 样品类型:仪器能够检测的样品类型,如食物、饮品、血清、血浆、尿液等。 分子量范围:对于能够检测蛋白质分子量的仪器,其分子量范围是一个重要的指标,如2-440kDa。 样品处理量:一次运行能够处理的样品数量,如某些全自动蛋白质定量检测仪一次可以处理25个样本/每轮。 检测速度:完成一次检测所需的时间,这也是衡量仪器效率的一个重要指标。 三、高级功能指标 智能化程度:包括仪器的自我保护功能、数据储存方式(如支持U盘储存)、以及是否具备自动校准、自动清洗等高级功能。 检测精度和误差:除了上述的重复性和重复性误差外,还包括仪器的整体检测精度和误差控制水平。 软件支持:是否配备有用户友好的软件界面,用于数据分析和报告生成。 兼容性:仪器是否兼容不同类型的试剂盒和样品处理方法。 需要注意的是,以上指标并非所有蛋白质检测仪都具备,具体指标会根据仪器的设计、用途和性能而有所不同。在选择蛋白质检测仪时,应根据实际需求和使用场景综合考虑各项指标。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/07/202407030956049224_5772_6098850_3.png!w690x690.jpg[/img][/size][/color][/font]
PS1利用基质辅助激光解吸电离-飞行时间(MALDI-TOF)技术来表征生物分子。样品溶于固定的底物中形成晶体,用激光脉冲使其离子化,离子被加速后通过飞行管时分离,所有离子均可被检测。系统包括三个组成部件:样品点样制备工作站(SymBiot 1)、生物质谱工作站(Voyager-DE PRO)和自动化分析软件(AutoMS-Fit)。SymBiot1 是一个自动样品处理系统,支持亚微升级微量点样,具有快速省时、重现性好的特点;Voyager-DE PRO是为蛋白质组研究专门设计的自动飞行时间质谱分析系统,配有AB公司之专利—延迟检测技术,具有高分辨率、质荷比宽等特点;AutoMS软件可以批处理方式或实时动态方式检索Protein Prospector蛋白数据库或您指定的蛋白数据库,查询参数可以任意设定,检索结果以Microsoft Access格式分类编号及储存。 PS 1技术平台建立伊始便受到了许多蛋白质课题研究组的关注。中国科学院上海生物化学研究所戚正武院士课题组从猪肝中提取某一活性蛋白组分,该组分理化性质不清楚,天然含量十分低,并无相关文献报道。用HPLC分离以后对活性组分的成分不能确定。上海基康生物技术有限公司运用PS 1系统对HPLC分离后的活性组分作了质谱分析,仅在一个工作日内就精确确定该组分由分子量极为相近的几种蛋白质构成,分子量精确度达到10 ppm。后经HPLC再次细分(洗脱梯度增加了2.5倍),证实了质谱的结论。此活性组分曾滤过1kD分子筛,基康的质谱数据纠正了研究人员过去对该活性组分分子量的误判,为研究人员明确实验方向、优化实验步骤提供了强有力的依据。 PS1除了可以进行生物大分子的精确分子量测定,还可用于蛋白的肽指纹图谱分析(peptide mass fingerprint,PMF),提供相关生物信息学服务,并且还可以利用源后衰变(Post Source Decay,PSD)技术来获得样品的MS/MS数据,以得到一级结构信息。PSD方法通常增加了激发激光的功率,使其超过产生一般肽指纹谱图所需功率的阈值,过剩的能量使前体离子在源内离子化之后发生裂解,产生一系列碎片离子,在反射器的作用下,最终可以得到一张连续的碎片离子图谱。经特定的软件分析后,即可在数据库中检索到肽段的氨基酸序列。利用PSD分析技术,还可以对磷酸化,糖基化等翻译后修饰进行定位分析,同样也可以鉴定产生翻译后修饰肽段的蛋白质。Neville et al.(1997)将这一方法成功的用于磷酸肽的序列分析。作为重要的蛋白质鉴定手段之一,PS1的精确度可以达到10 ppm,灵敏度为fmol,分子量检测范围可达到500 kDa,每天可自动分析40-100个样品,适用于大规模“蛋白质组学”研究。
蛋白质是生命的基础 , 人体的重要组成成分。它不仅是一种重要的供能物质 , 更主要的作用是促进生长发育和新陈代谢。但婴幼儿过量的摄入蛋白质会增加 肾脏的负担,因此蛋白质的摄入要根据营养状况、生长发育要求达到供求平衡 。乳及乳制品是婴幼儿摄取蛋白质的主要来源, 安徽阜阳 “毒奶粉 ”事件就是因为婴幼儿食用了蛋白质含量极低的劣质奶粉 ,所以对乳及乳制品中蛋白质含量的监控极为重要. 目前我国测定乳及乳制品中蛋白质的方法主要为凯氏定氮滴定法、凯氏定氮比色法, 但是这两种方法繁琐、费时。连续流动分析法测定乳及乳制品中蛋白质含量,对于批量样品,该方法具有很大的优势,不但简便快捷、而且准确度和灵敏度度也有很大的提高。1.实验部分1. 1 仪器与原理SAN+ +四通道连续流动分析仪 (荷兰SKALAR公司)蛋白质分析模块。原理:自 动测定蛋白质基于改良后的贝特勒反应即经过相互分离后对氨进行分析。消化后 的样品用酸式盐溶液稀释定容,铵盐通过与水杨酸钠反应氯化为一氯化胺, 通过氧化和氧化偶合后形成绿色配合物,反应是以硝普钠为催化剂,次氯酸钠溶液被用于提供氯, 在波长630 nm处检测。1. 2样品前处理准确吸取 液态奶 (或称取固 态奶 ), 同时准备空白样 分别置于 250 mlVELP消化管中 , 加入以1: 10混匀的 CuSO4和K2SO4混合催化剂, 再加入20 ml浓 H2SO4,于蛋白质自动消化仪中消化,最后消化至蓝绿色, 冷却至室温后用蒸馏水定容至100 ml。1.3试剂和标准的配置酸性氯化钠溶液: 称取100 g氯化钠用800 ml水溶解[
向大家请教几个问题1. 在使用MALDI-TOF的时候,为什么大分子量的蛋白质可以被有效分析,而大于80bp的DNA分析的效果不好?2. Electrospray-TOF和MALDI-TOF在分析蛋白质的时候有那些区别?3. 质谱用于蛋白质测序中的几种方法及原理?先道谢!本人对蛋白质分析实在是不熟悉。请解答的详细一些!再次致谢!
http://img.dxycdn.com/trademd/upload/asset/meeting/2013/09/06/A1378379551.jpg 氨基酸是蛋白质的基础组成单位,通过研究蛋白质中氨基酸的性质和组成来预测蛋白质的结构和功能,蛋白质氨基酸残基组成分析主要是通过氨基酸分析仪来完成的,本文推荐了2个基于氨基酸组成进行蛋白质预测软件。基于氨基酸组成的蛋白质预测软件根据组成蛋白质的20种氨基酸的物理和化学性质可以辨析电泳等实验中的未知蛋白质,也可以分析已知蛋白质的物化性质。ExPASy工具包包涵的程序:AACompIdent:与把氨基酸序列在SWISS-PROT库中搜索不同,AACompIdent工具利用未知蛋白的氨基酸组成去确认具有相同组成的已知蛋白。该程序分析时需提交的相关信息包括:蛋白质的氨基酸组成、等电点pI和分子量(如果知道)、正确的物种分类及特别的关键词。此外,用户还需在六种氨基酸“组合”中作出选择,这影响到分析如何进行。例如,某种“组合”会把残基Asp/Asn(D/N)和Gln/Glu(Q/E)组合成 Asx(B)和Glx(Z);或者某种残基会在分析中被完全除去。对数据库中的每一个蛋白序列,算法会对其氨基酸组成与所查询的氨基酸组成的差异打分。由电子邮件返回的结果被组织成三级列表:第一张列表中的蛋白都基于特定的物种分类而不考虑pI和分子量;第二张列表包含了不考虑物种分类、pI和分子量的全体蛋白;第三张列表中的蛋白不但基于特定物种分类,并且将 pI和分子量也考虑在内。虽然计算所得结果各不相同,但零分表明了该序列与提出的组成完全相符。AACompSim:AACompIdent的一个变种,AACompSim提供类似的分析,但与前者以实验所得的氨基酸组成为依据进行搜索不同,后者使用SWISS-PROT中的序列为依据。有报道称,氨基酸组成在物种之间是十分保守的(Cordwell等,1995),并且通过分析氨基酸的组成,研究者能从低于25%序列相似性的蛋白之间发现弱相似性(Hobohm和Sander,1995)。因此,在“传统的”数据库搜索基础上辅以组成分析,能为蛋白质之间关系提供更多见解。PROSEARCH:PROPSEARCH也提供基于氨基酸组成的蛋白质辨识功能。用144种不同的物化性质来分析蛋白质,包括分子量、巨大残基的含量、平均疏水性、平均电荷等,把查询序列的这些属性构成的“查询向量”与SWISS-PROT和PIR中预先计算好的各个已知蛋白质的属性向量进行比较。这个工具能有效的发现同一蛋白质家族的成员。可以通过Web使用这个工具,用户只需输入查询序列本身。分子量搜索(MOWSE)分子量搜索(MolecularWeightSearch,MOWSE)算法利用了通过质谱(MS)技术获得的信息。利用完整蛋白质的分子量及其被特定蛋白酶消化后产物的分子量,一种未知蛋白质能被准确无误地确认,给出由若干实验才能决定的结果。由于未知蛋白无需再全部或部分测序,这一方法显著地减少了实验时间。MOWSE的输入是一个纯文本文件,包含一张实验测定的肽段列表,分子量范围在0.7到4.0Kda之间。计算过程基于在OWL非冗余蛋白质序列库中包含的信息。打分基于在一定分子量范围内蛋白中一个片段分子量出现的次数。输出的结果是得分最佳的30个蛋白的列表,包括它们在OWL中的条目名称、相符肽段序列、和其它统计信息。模拟研究得出在使用5个或更少输入肽段分子量时,准确率为99%。该搜索服务可通过向mowse@daresburg.ac.uk发送电子邮件实现。为获得更多关于查询格式的细节信息,可以相该地址发送电子邮件,并在消息正文中写上“help”这个词。蛋白质氨基酸组成分析用盐酸在110 ℃将蛋白或多肽水解成游离的氨基酸,用氨基酸分析仪测定各氨基酸的含量。采用经典的阳离子交换色谱分离、茚三酮柱后衍生法,对蛋白质水解液及各种游离氨基酸的组分含量进行分析。仪器基本结构同普通HPLC相似,但针对氨基酸分析进行了细节优化(例如氮气保护、惰性管路、在线脱气、洗脱梯度及柱温梯度控制等等)通常细分为两种系统:蛋白水解分析系统(钠盐系统)和游离氨基酸分析系统(锂盐系统),利用不同浓度和pH值的柠檬酸钠或柠檬酸锂进行梯度洗脱。其中钠盐系统一次最多分析约25种氨基酸,速度较快,基线平直度好;锂盐系统一次最多分析约50种氨基酸,速度较慢,基线一般不如钠盐系统好。分析效果:从目前已知的氨基酸分析方法比较来看,除灵敏度(即最低检测限)比HPLC柱前衍生方法稍低以外(HPLC:0.5 pmol;氨基酸分析仪:10 pmol),其他如分离度、重现性、操作简便性、运行成本等方面,都优于其他分析方法。蛋白质氨基酸残基组成分析的主要步骤包括:首先是蛋白被水解为氨基酸,其次是采用离子色谱等方法进行游离的氨基酸含量和组成的分析。总之利用蛋白可以分析氨基酸,利用氨基酸也可以研究蛋白质。
蛋白质分析仪是否就是定氮仪?MW30-HHT-2400是哪家的品牌啊
最近做蛋白质分析,用的是AB的Qtrap 5500.方法设置如下:EMSIDAEPI得到的谱图有多个峰,我想如何得到我蛋白质的二级谱图。
蛋白质是生物体中含量最高,功能最重要的生物大分子,存在于所有生物细胞,约占细胞干质量的50%以上, 作为生命的物质基础之一,蛋白质在催化生命体内各种反应进行、调节代谢、抵御外来物质入侵及控制遗传信息等方面都起着至关重要的作用,因此蛋白质也是生命科学中极为重要的研究对象。关于蛋白质的分析研究,一直是化学家及生物学家极为关注的问题,其研究的内容主要包括分子量测定,氨基酸鉴定,蛋白质序列分析及立体化学分析等。随着生命科学的发展,仪器分析手段的更新,尤其是质谱分析技术的不断成熟,使这一领域的研究发展迅速。 自约翰.芬恩(JohnB.Fenn)和田中耕一(Koichi.Tanaka)发明了对生物大分子进行确认和结构分析的方法及发明了对生物大分子的质谱分析法以来,随着生命科学及生物技术的迅速发展,生物质谱目前已成为有机质谱中最活跃、最富生命力的前沿研究领域之一[1]。它的发展强有力地推动了人类基因组计划及其后基因组计划的提前完成和有力实施。质谱法已成为研究生物大分子特别是蛋白质研究的主要支撑技术之一,在对蛋白质结构分析的研究中占据了重要地位[2]。 1.质谱分析的特点 质谱分析用于蛋白质等生物活性分子的研究具有如下优点:很高的灵敏度能为亚微克级试样提供信息,能最有效地与色谱联用,适用于复杂体系中痕量物质的鉴定或结构测定,同时具有准确性、易操作性、快速性及很好的普适性。 2.质谱分析的方法 近年来涌现出较成功地用于生物大分子质谱分析的软电离技术主要有下列几种:1)电喷雾电离质谱;2)基质辅助激光解吸电离质谱;3)快原子轰击质谱;4)离子喷雾电离质谱;5)大气压电离质谱。在这些软电离技术中,以前面三种近年来研究得最多,应用得也最广泛[3]。 3.蛋白质的质谱分析 蛋自质是一条或多条肽链以特殊方式组合的生物大分子,复杂结构主要包括以肽链为基础的肽链线型序列[称为一级结构]及由肽链卷曲折叠而形成三维[称为二级,三级或四级]结构。目前质谱主要测定蛋自质一级结构包括分子量、肽链氨基酸排序及多肽或二硫键数目和位置。 3.1蛋白质的质谱分析原理 以往质谱(MS)仅用于小分子挥发物质的分析,由于新的离子化技术的出现,如介质辅助的激光解析/离子化、电喷雾离子化,各种新的质谱技术开始用于生物大分子的分析。其原理是:通过电离源将蛋白质分子转化为[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]离子,然后利用质谱分析仪的电场、磁场将具有特定质量与电荷比值(M/Z值)的蛋白质离子分离开来,经过离子检测器收集分离的离子,确定离子的M/Z值,分析鉴定未知蛋白质。 3.2蛋白质和肽的序列分析 现代研究结果发现越来越多的小肽同蛋白质一样具有生物功能,建立具有特殊、高效的生物功能肽的肽库是现在的研究热点之一。因此需要高效率、高灵敏度的肽和蛋白质序列测定方法支持这些研究的进行。现有的肽和蛋白质测序方法包括N末端序列测定的化学方法Edman法、C末端酶解方法、C末端化学降解法等,这些方法都存在一些缺陷。例如作为肽和蛋白质序列测定标准方法的N末端氨基酸苯异硫氰酸酯(phenylisothiocyanate)PITC分析法(即Edman法,又称PTH法),测序速度较慢(50个氨基酸残基/天);样品用量较大(nmol级或几十pmol级);对样品纯度要求很高;对于修饰氨基酸残基往往会错误识别,而对N末端保护的肽链则无法测序[4]。C末端化学降解测序法则由于无法找到PITC这样理想的化学探针,其发展仍面临着很大的困难。在这种背景下,质谱由于很高的灵敏度、准确性、易操作性、快速性及很好的普适性而倍受科学家的广泛注意。在质谱测序中,灵敏度及准确性随分子量增大有明显降低,所以肽的序列分析比蛋白容易许多,许多研究也都是以肽作为分析对象进行的。近年来随着电喷雾电离质谱(electrospray ionisation,ESI)及基质辅助激光解吸质谱(matrix assisted laser desorption/ionization,MALDI)等质谱软电离技术的发展与完善,极性肽分子的分析成为可能,检测限下降到fmol级别,可测定分子量范围则高达100000Da,目前基质辅助的激光解吸电离飞行时间质谱法(MALDI TOF MS)已成为测定生物大分子尤其是蛋白质、多肽分子量和一级结构的有效工具,也是当今生命科学领域中重大课题——蛋白质组研究所必不可缺的关键技术之一 [5] 。目前在欧洲分子生物实验室(EMBL)及美国、瑞士等国的一些高校已建立了MALDI TOF MS蛋白质一级结构(序列)谱库,能为解析FAST谱图提供极大的帮助,并为确证分析结果提供可靠的依据[6]。
最近在尝试着进行蛋白质提取物的分析,大家有没有做过?能否分享交流一下你成功的色谱分析条件
褚福亮,王福生, 中国人民解放军第302医院全军艾滋病与病毒性肝炎重点实验室 北京市 100039项目负责人 王福生, 100039 ,北京市丰台路26号, 中国人民解放军第302医院全军艾滋病与病毒性肝炎重点实验室. fswang@public.bta.net.cn电话:010-66933332 传真:010-63831870收稿日期 2002-08-15 接受日期 2002-09-03摘要新近广泛应用蛋白质芯片(ProteinChipâ Array)系统成功鉴定出了一些重要疾病(如肿瘤和危害性较大的传染病)新的、特异性的生物标记(biomarkers),后者不仅在生物医学的基础方面具有重要的科学价值,而且在临床疾病的诊断、治疗和预防发挥重要的指导作用,显示了良好的发展前景.本文就表面增强的激光解析电离-飞行时间-质谱(SELDI-TOF-MS)相关的原理、特点、在临床和基础研究中的应用新进展和未来的发展趋势做一综述.此外,我们就蛋白质谱分析技术在病毒性肝炎、肝硬化和肝癌等一系列肝病方面的应用策略和前景进行了分析.褚福亮,王福生. 蛋白质谱分析方法特点及其在蛋白组学研究领域中的应用.世界华人消化杂志 2002 10(12):1431-14350 引言人类基因组计划已经进入后基因组时代-即功能基因组时代[1],作为基因功能的直接体现者-蛋白质,及其之间的相互作用越来越引起基础和临床科学家们的关注[2-6] .因为要彻底了解生命的本质,只把基因测出来还是不够的,还必须要了解其在生物生长、发育、衰老和整个生命过程中的功能、不同蛋白质之间的相互作用以及他们与疾病发生、发展和转化的规律[7-14] .正因为如此,有关上述问题的蛋白质组学研究成了今天生命科学最重要的焦点之一[15] .为了阐明蛋白质在上述生命现象中的作用和相关机制,人们设计了许多新的方法技术,如:二维电泳、质谱分析、微距阵列、酵母双杂交和噬菌体展示等,这些方法在一些特定的情况下,虽然显示出了他们各自不同的优点,但是同样也存在着较大的局限性,难以开展大规模、超微量、高通量、全自动筛选蛋白质等方面的分析,因而设计更全面、同时研究多种蛋白质相互作用的技术,在功能基因组和蛋白组学的研究中建立一个更有效的技术平台,成为本领域中优先关注的问题[16] .近来,美国Ciphergen(赛弗吉)公司研制的ProteinChipâ Array的仪器,并建立了一种新的蛋白质飞行质谱-表面增强的激光解析离子化-飞行时间-质谱(surface-enhanced laser desorption/inionation-time of flight-mass spectra, SELDI-TOF-MS),已取得可喜的进展,筛选出了许多与疾病相关的新型生物标志,不仅为临床疾病的诊断和治疗等提供了新的选择,而且在基础科学、新药研制和疾病预防等方面具有广泛的应用前景[16-18] .本文就SELDI-TOF-MS相关的原理、特点、在临床和基础研究中的应用新进展和未来的发展趋势做一综述.1 ProteinChipâ Array系统和SELDI-TOF-MS的特点1.1 蛋白质芯片系统的组成和原理 蛋白质芯片系统由三部分组成:蛋白质芯片、芯片阅读器和芯片软件.供研究用芯片上有6-10芯池,不同的芯片表面上的化学物质不同,芯片表面分为两大类:一类为化学类表面,包括经典的色谱分析表面,如:结合普通蛋白质的正相表面,用于反相捕获的疏水表面,阴阳离子交换表面和捕获金属结合蛋白的静态金属亲合捕获表面;另一类称为生物类,特定的蛋白质共价结合于预先活化的表面阵列,可以用来研究传统的抗体一抗原反应,DNA和蛋白质作用,受体、配体作用和其他的一些分子之间的相互作用[19] . 根据检测目的不同,可以选用不同的芯片,或者自己设计芯片.将样本和对照点到芯池上以后,经过一段时间的结合反应,用缓冲液或水洗去一些不结合的非特异分子,再加上能量吸收分子(energy absorbing molelule,EAM)溶液,使样本固定在芯片表面.当溶液干燥后,一个含有分析物和大量能量吸收分子“晶体”就形成了.能量吸收分子对于电离来说非常重要.经过以上步骤,就可经把芯片放到芯片阅读器中进行质谱分析. 在阅读器的固定激光束下,芯片上、下移动,使样本上每一个特定点都被“读”到.激光束的每一次闪光释放的能量都聚集在该区一个非常小的点上(focused laser beam,聚焦激光束).这样,每个区都含有丰富的,可寻址(addressable)的位置.蛋白质芯片处理软件精确控制激光寻读过程.当样本受到激发,就开始电离和解除吸附.不同质量的带电离子在电场中飞行的时间长短不同,计算检测到的不同时间,就可以得出质量电荷比,把他输入电脑,形成图像[19].Ball et al [20]采用一种称为人工神经网络(artifical neural network,ANN)的算法处理出现的成千上万的峰,鉴定出三个分子量为13 454、13 457和14 278的生物标记分子,使疾病预测率达到97.1 %.1.2 ProteinChipâ Array芯片和SELDI-TOF-MS的特点 新型蛋白芯片与以往的蛋白芯片不同之处:SELDI-TOF-MS,他是在MALDI(matrix-assisted laser desorption/inionation)[21,22]基础上,改进后实行表面增强的飞行质谱.SELDI-TOF-MS优于MALDI-TOF表现为他不会破坏蛋白质,或使样本与可溶的基质共结晶来产生质谱信号.对SELDI-TOF来说,可以直接将血清、尿液、组织抽取物等不需处理直接点样检测[40] 由于一部分非特异结合的分析物被洗去,因而出现的质峰非常一致,有利于后期分析[23,24] . 与二维电泳相比:二维电泳分析蛋白质的分子量在30 KDa以上时电泳图谱较清楚,对在组织抽提物中占很大比例的低丰度的蛋白质不能被检出;其次,二维电泳胶上的蛋白质斑点很大一部分包含一种以上的蛋白质;而且,二维电泳耗时长,工作量大,对象染色转移等技术要求高,不能完全实现自动化.而SELDI-TOF在200 Da-500 KDa区间都可以给出很好的质谱,对一个样本的分析在几十分钟内就可以完成[19],处理的信息量远远大于二维电泳;对于低丰度物质,即使浓度仅attomole(10-18)的分子,只要与表面探针结合,就可以检测到,这也是二维电泳所不具备的[24,25] . 对于微距阵蛋白芯片来说,需要一种不破坏折叠的蛋白质构象的固定技术,再与另外的蛋白质反应,经检测莹光来观察蛋白质之间的作用[26] .而基于SELDI-TOF-MS的ProteinChip分析蛋白质不需溶解、不需染色、廉价、针对性强. 因而蛋白质芯片仪具有以下优势:(1)可直接使用粗样本,如:血清、尿液、细胞抽提物等[27] .(2)使大规模、超微量、高通量、全自动筛选蛋白质成为可能;(3)他不仅可发现一种蛋白质或生物标记分子,而且还可以发现不同的多种方式的组合蛋白质谱,可能与某种疾病有关[28] (4)推动基因组学发展,验证基因组学方面的变化,基于蛋白质特点发现新的基因.可以推测疾病状态下,基因启动何以与正常状态下不同,受到那些因素的影响,从而跟踪基因的变化[2,14,15] . 其存在的问题:对于不同的样本,根据检测的目标采取或者设计几种芯片,理论上可以把所有的相同性质蛋白质捕获,但是实际上仍有少量的分子没与表面探针结合.使用SELDI-TOF-MS,仅能给出蛋白质的分子量,不能给出C端、N端的序列,也没法知道蛋白质的构型,因此需要将蛋白质充分纯化后,用蛋白酶消化芯片上的蛋白质,分析肽段,再用生物信息学方法鉴定蛋白质序列[18,24] .另外,在国内,该芯片费用较高,分析质谱需要大量后续工作支持.
Edman降解法是测定蛋白质序列的经典方法,该方法由瑞士生物化学家佩尔维克托于1950年创立。Edman降解法通常是以周期的形式来表征。对于一个完整的周期,异硫氰酸苯酯标记上指定肽段的N末端,环化,之后被标记的氨基酸在酸性条件下从肽链中游离出来,进一步酸化后形成一个更加稳定的乙内酰苯硫脲-氨基酸(PTH-AA)衍生物。PTH-AA衍生物可以通过高效液相色谱鉴定。埃德曼降解周期就是通过反复地将多肽的氨基酸依次降解下来,从而鉴定氨基酸序列。 1982年,美国应用生物系统(ABI)公司了将第一台商用自动多肽测序仪推向市场,并被实践证明是可靠和耐用的。实际上,在过去几十年中,自动多肽测序仪只有屈指可数的一些改进,但此类自动肽测序仪仍是测定肽序列的黄金标准。然而,串联质谱的使用已经成为日益重要的肽序列测定工具。质谱,特别是串联飞行时间(TOF-TOF 和QTOF)质谱仪可以对少量样本进行更快速的分析。 与质谱相比,自动Edman降解测序的明显优势在于:已被化学验证的精确性、系统初始投资较小 然而,它的缺点是:分析时间较长、测得序列数有限,典型的测量长度范围是20~50个氨基酸序列。而对于低丰度的肽、无法获得N末端的肽,或者需要更短的分析时间,质谱则是理想的工具。但是,质谱价格高且无法区分同分异构的氨基酸。 虽然美国应用生物系统(ABI)公司主导了自动多肽测序仪的市场,但由于市场疲软,ABI于2008年6月停止生产自动多肽测序仪。然而岛津公司看准了机会,在2009年匹兹堡会议上将其PPSQ自动多肽测序仪推向北美市场,PPSQ已在日本广泛应用超过20年。另一方面,对用质谱测定蛋白质序列的方法改进的需求保持旺盛,布鲁克道尔顿公司最近推出了Edmass Micro MALDI-TOF和 Edmass Ultra TOF-TOF 系统,这是专门为没有质谱使用经验的多肽化学家们设计的。 自动多肽测序仪的市场主要来自于科研机构,但过去几年中自动多肽测序仪的市场需求增长处于某种停滞状态,尤其是质谱变得容易获得。但是,随着肽自动测序仪在连续使用过程中的老化,Edamn化学家们正在准备购买新设备。售后服务、附件、耗材及试剂有望在短期内对自动多肽测序仪市场产生推动作用。
基因组(genome)包含的遗传信息经转录产生mRNA,一个细胞在特定生理或病理状态下表达的所有种类的mRNA称为转录子组(transcriptome)。很显然,不同细胞在不同生理或病理状态下转录子组包含的mRNA的种类不尽相同。mRNA经翻译产生蛋白质,一个细胞在特定生理或病理状态下表达的所有种类的蛋白质称为蛋白质组(proteome)。同理,不同细胞在不同生理或病理状态下所表达的蛋白质的种类也不尽相同。蛋白质是基因功能的实施者,因此对蛋白质结构,定位和蛋白质-蛋白质相互作用的研究将为阐明生命现象的本质提供直接的基础。生命科学是实验科学,因此生命科学的发展极大地依赖于实验技术的发展。以DNA序列分析技术为核心的基因组研究技术推动了基因组研究的日新月异,而以基因芯片技术为代表的基因表达研究技术为科学家了解基因表达规律立下汗马功劳。在蛋白质组研究中,二维电泳和质谱技术的黄金组合又为科学家掌握蛋白质表达规律再铸辉煌。蛋白质组学(proteomics)就是指研究蛋白质组的技术及这些研究得到的结果。蛋白质组学的研究试图比较细胞在不同生理或病理条件下蛋白质表达的异同,对相关蛋白质进行分类和鉴定。更重要的是蛋白质组学的研究要分析蛋白质间相互作用和蛋白质的功能。蛋白质组学的研究内容包括:1.蛋白质鉴定:可以利用一维电泳和二维电泳并结合Western等技术,利用蛋白质芯片和抗体芯片及免疫共沉淀等技术对蛋白质进行鉴定研究。2.翻译后修饰:很多mRNA表达产生的蛋白质要经历翻译后修饰如磷酸化,糖基化,酶原激活等。翻译后修饰是蛋白质调节功能的重要方式,因此对蛋白质翻译后修饰的研究对阐明蛋白质的功能具有重要作用。3.蛋白质功能确定:如分析酶活性和确定酶底物,细胞因子的生物分析/配基-受体结合分析。可以利用基因敲除和反义技术分析基因表达产物-蛋白质的功能。另外对蛋白质表达出来后在细胞内的定位研究也在一定程度上有助于蛋白质功能的了解。Clontech的荧光蛋白表达系统就是研究蛋白质在细胞内定位的一个很好的工具。4.对人类而言,蛋白质组学的研究最终要服务于人类的健康,主要指促进分子医学的发展。如寻找药物的靶分子。很多药物本身就是蛋白质,而很多药物的靶分子也是蛋白质。药物也可以干预蛋白质-蛋白质相互作用。在基础医学和疾病机理研究中,了解人不同发育、生长期和不同生理、病理条件下及不同细胞类型的基因表达的特点具有特别重要的意义。这些研究可能找到直接与特定生理或病理状态相关的分子,进一步为设计作用于特定靶分子的药物奠定基础。不同发育、生长期和不同生理、病理条件下不同的细胞类型的基因表达是不一致的,因此对蛋白质表达的研究应该精确到细胞甚至亚细胞水平。可以利用免疫组织化学技术达到这个目的,但该技术的致命缺点是通量低。LCM技术可以精确地从组织切片中取出研究者感兴趣的细胞类型,因此LCM技术实际上是一种原位技术。取出的细胞用于蛋白质样品的制备,结合抗体芯片或二维电泳-质谱的技术路线,可以对蛋白质的表达进行原位的高通量的研究。很多研究采用匀浆组织制备蛋白质样品的技术路线,其研究结论值得怀疑,因为组织匀浆后不同细胞类型的蛋白质混杂在一起,最后得到的研究数据根本无法解释蛋白质在每类细胞中的表达情况。虽然培养细胞可以得到单一类型细胞,但体外培养的细胞很难模拟体内细胞的环境,因此这样研究得出的结论也很难用于解释在体实际情况。因此在研究中首先应该将不同细胞类型分离,分离出来的不同类型细胞可以用于基因表达研究,包括mRNA和蛋白质的表达。LCM技术获得的细胞可以用于蛋白质样品的制备。可以根据需要制备总蛋白,或膜蛋白,或核蛋白等,也可以富集糖蛋白,或通过去除白蛋白来减少蛋白质类型的复杂程度。相关试剂盒均有厂商提供。蛋白质样品中的不同类型的蛋白质可以通过二维电泳进行分离。二维电泳可以将不同种类的蛋白质按照等电点和分子量差异进行高分辨率的分离。成功的二维电泳可以将2000到3000种蛋白质进行分离。电泳后对胶进行高灵敏度的染色如银染和荧光染色。如果是比较两种样品之间蛋白质表达的异同,可以在同样条件下分别制备二者的蛋白质样品,然后在同样条件下进行二维电泳,染色后比较两块胶。也可以将二者的蛋白质样品分别用不同的荧光染料标记,然后两种蛋白质样品在一块胶上进行二维电泳的分离,最后通过荧光扫描技术分析结果。胶染色后可以利用凝胶图象分析系统成像,然后通过分析软件对蛋白质点进行定量分析,并且对感兴趣的蛋白质点进行定位。通过专门的蛋白质点切割系统,可以将蛋白质点所在的胶区域进行精确切割。接着对胶中蛋白质进行酶切消化,酶切后的消化物经脱盐/浓缩处理后就可以通过点样系统将蛋白质点样到特定的材料的表面(MALDI-TOF)。最后这些蛋白质就可以在质谱系统中进行分析,从而得到蛋白质的定性数据;这些数据可以用于构建数据库或和已有的数据库进行比较分析。实际上像人类的血浆,尿液,脑脊液,乳腺,心脏,膀胱癌和磷状细胞癌及多种病原微生物的蛋白质样品的二维电泳数据库已经建立起来,研究者可以登录www.expasy.ch/www/tools.html等网站进行查询,并和自己的同类研究进行对比分析。Genomic Solution可以为研究者提供除质谱外的所有蛋白质组学研究工具,包括二维电泳系统,成像系统及分析软件,胶切割系统,蛋白质消化浓缩工作站,点样工作站等;同时还可以提供相关试剂和消耗品。LCM-二维电泳-质谱的技术路线是典型的一条蛋白质组学研究的技术路线,除此以外,LCM-抗体芯片也是一条重要的蛋白质组学研究的技术路线。即通过LCM技术获得感兴趣的细胞类型,制备细胞蛋白质样品,蛋白质经荧光染料标记后和抗体芯片杂交,从而可以比较两种样品蛋白质表达的异同。Clontech最近开发了一张抗体芯片,可以对378种膜蛋白和胞浆蛋白进行分析。该芯片同时配合了抗体芯片的全部操作过程的重要试剂,包括蛋白质制备试剂,蛋白质的荧光染料标记试剂,标记体系的纯化试剂,杂交试剂等。对于蛋白质相互作用的研究,酵母双杂交和噬菌体展示技术无疑是很好的研究方法。Clontech开发的酵母双杂交系统和NEB公司开发的噬菌体展示技术可供研究者选用。关于蛋白质组的研究,也可以将蛋白质组的部分或全部种类的蛋白质制作成蛋白质芯片,这样的蛋白质芯片可以用于蛋白质相互作用研究,蛋白表达研究和小分子蛋白结合研究。Science,Vol.293,Issue 5537,2101-2105,September 14,2001发表了一篇关于酵母蛋白质组芯片的论文。该文主要研究内容为:将酵母的5800个ORF表达成蛋白质并进行纯化点样制作芯片,然后用该芯片筛选钙调素和磷脂分子的相互作用分子。最后有必要指出的是,传统的蛋白质研究注重研究单一蛋白质,而蛋白质组学注重研究参与特定生理或病理状态的所有的蛋白质种类及其与周围环境(分子)的关系。因此蛋白质组学的研究通常是高通量的。适应这个要求,蛋白质组学相关研究工具通常都是高度自动化的系统,通量高而速度快,配合相应分析软件和数据库,研究者可以在最短的时间内处理最多的数据。
食品中蛋白质测定仪的优点主要取决于其技术类型、精度、使用便捷性等因素。以下是针对食品中蛋白质测定仪的一般性优点分析: 优点: 快速性:蛋白质测定仪能在短时间内完成大量样品的检测,大大提高了检测效率,适用于食品生产线上快速、连续的蛋白质含量测定。 准确性:采用先进的检测技术,如光谱技术、化学分析方法等,能够确保测量结果的准确性和可靠性。 操作简单:仪器操作简单易用,用户只需按照说明书进行操作即可完成检测,降低了操作难度和人工成本。 应用广泛:适用于各类食品中蛋白质含量的检测,如乳制品、肉制品、豆制品等,具有广泛的应用前景。 自动化程度高:部分蛋白质测定仪具有自动化功能,能够自动完成样品的处理、检测和数据分析,提高了工作效率和准确性。
我想利用近红外分析一些蛋白质的组成,不需要分析氨基酸的成分,只想分析的蛋白亚基的程度,目前打算先做定标,有做过的朋友可不可以交流一下啊。我的邮箱:alex_qq@hotmail.com
国家蛋白质科学上海设施/国家蛋白质科学中心(上海)(筹)公开招聘自动化控制系统工程师国家蛋白质科学研究上海设施是国家重大科技基础设施,是国家级蛋白质科学研究平台;在设施建设基础上,依托中国科学院上海生命科学研究院,委托生物化学与细胞生物学研究所(简称SIBCB)负责筹建成立并管理国家蛋白质科学中心(上海)(筹), 负责设施的运行管理。中心在筹建期间,办公地点设于生化与细胞所(上海市岳阳路320号);中心在建成运行期间,办公地点设于浦东新区张江高科技园区中区西部(上海市海科路333号)。中心定位于:支撑国家蛋白质上海设施建设的建设,衔接该设施的运行;聚集培养生命科学与生物技术特别 是蛋白质研究的人才,提升国家蛋白质研究能力;进而促进我国蛋白质基础研究的飞跃发展。中心将立足于国家生命科学与生物技术及相关研究领域雄厚的研究基础和创新实力,成为兼具蛋白质科学研究、技术及成果的转化、集成和应用平台的国家级的重要科学研究单元。国家蛋白质科学中心(上海)(筹)现因工作扩展的需要,公开招聘自动化控制系统工程师一名。一、岗位职责:参与国家蛋白质科学中心(上海)(筹)在上海同步辐射光源5线6站的建设、运行和管理,充分理解同步辐射光束线站的工作内容和线站用户的实际需求,完成线站自动化控制程序的设计、开发和维护。二、任职条件:1、本科以上学历,有丰富的 Unix/Linux 平台下的工作经验,熟悉 Unix/Linux 工作环境,习惯于在 Unix/Linux 平台下工作。有大量的源代码的阅读经验。2、有丰富的 C/C++ 开发经验。熟悉 Socket 编程和多线程编程。3、良好的英文表达能力。能独立完成项目调研,设计和开发工作。4、有以下背景或经验者优先考虑:有大型系统开发经验者和硬件开发经验者;有软件界面开发经验者;有网络程序开发经验者;熟悉 Tcl/Tk 语言者;有 Unix/Linux 系统管理经验者。5、具有良好的人际关系和团队协作精神,工作努力,作风踏实,责任心强。6、身体健康,能长期稳定工作。 三、招聘方式及程序 1、应聘材料:([back=whi
蛋白质折叠病 ▲许多疾病,如阿兹海默症(Alzheimer's),疯牛病(Mad Cow, BSE),可传播性海绵状脑病(CJD),肌萎缩性脊髓侧索硬化症(ALS),还有帕金森氏症(Parkinson's)等正是由于一些细胞内的重要蛋白发生突变,导致蛋白质聚沉或错误折叠而造成的。因此,深入了解蛋白质折叠与错误折叠的关系对于这些疾病的致病机制的阐明以及治疗方法的寻找将大有帮助。 ▲基因组序列的发展使我们得到了大量的蛋白质序列,结构信息的获得对于揭示它们的生物学功能是十分重要的。依靠现有手段(X-ray晶体衍射、NMR及电镜)测定蛋白质的结构需要较长的时间,因此结构解析的步伐已落后于发现新蛋白的步伐。而结构预测的方法虽然速度较快,但可靠性并不高,只有当我们对于维持蛋白质结构,驱动蛋白质折叠的理化因素更为了解,这一方法才可能有根本的改进。另外,我们对于蛋白质相互作用、配体与蛋白质的作用等结构与功能关系的研究也有赖于蛋白质折叠机制的阐明。【蛋白质折叠与“折叠病” 】 人们对由于基因突变造成蛋白质分子中仅仅一个氨基酸残基的变化就引起疾病的情况已有所了解,即所谓“分子病”,如地中海镰刀状红血球贫血症就是因为血红蛋白分子中第六位的谷氨酸突变成了颉氨酸。现在则发现蛋白质分子的氨基酸序列没有改变,只是其结构或者说构象有所改变也能引起疾病,那就是所谓“构象病”,或称“折叠病”。 大家都知道的疯牛病,它是由一种称为Prion的蛋白质的感染引起的,这种蛋白质也可以感染人而引起神经系统疾病。在正常机体中,Prion是正常神经活动所需要的蛋白质,而致病Prion与正常Prion的一级结构完全相同,只是空间结构不同。这一疾病的研究涉及到许多生物学的基本问题。一级结构完全相同的蛋白质为什么会有不同的空间结构,这与Anfinsen原理是否矛盾?显然这里有蛋白质的能量和稳定性问题。 从来认为蛋白结构的变化来自于序列的变化,而序列的变化来自于基因的变化,生命信息从核酸传递到蛋白。而致病Prion的信息已被诺贝尔奖获得者普鲁辛纳证明不是来自基因的变化,致病蛋白Prion导致正常蛋白Prion转变为致病的折叠状态是通过蛋白分子间的作用而感染!这种相互作用的本质和机制是什么?仅仅改变了折叠状态的分子又如何导致严重的疾病?这些问题都不能用传统的概念给予满意的解释,因此在科学界引起激烈的争论,有关研究的强度和竞争性也随之大大增强。 由于蛋白质折叠异常而造成分子聚集甚至沉淀或不能正常转运到位所引起的疾病还有老年性痴呆症、囊性纤维病变、家族性高胆固醇症、家族性淀粉样蛋白症、某些肿瘤等等。由于分子伴侣在蛋白质折叠中至关重要的作用,分子伴侣本身的突变显然会引起蛋白质折叠异常而引起折叠病。随着蛋白质折叠研究的深入,人们会发现更多疾病的真正病因和更针对性的治疗方法,设计更有效的药物。现在发现有些小分子可以穿越细胞作为配体与突变蛋白结合,从而使原已失去作战能力的突变蛋白逃逸“蛋白质质量控制系统”而“带伤作战”。这种小分子被称为“药物分子伴侣”,有希望成为治疗“折叠病”的新药。 新生肽的折叠问题或蛋白质折叠问题不仅具有重大的科学意义,除了上面提到的在医学上的应用价值外,在生物工程上具有极大的应用价值。基因工程和蛋白工程已经逐渐发展成为产值以数十亿美元计的大产业,进入21世纪后,还将会有更大的发展。但是当前经常遇到的困难,是在简单的微生物细胞内引入异体DNA后所合成的多肽链往往不能正确折叠成为有生物活性的蛋白质而形成不溶解的包含体或被降解。这一“瓶颈”问题的彻底解决有待于对新生肽链折叠更多的认识。
基于高通量的质谱技术方法,目前,各种疾病相关的差异蛋白质组数据高速增长。但是要从这些数据中发现生物学规律,挖掘得到疾病相关的生物标记物,以及发现潜在的疾病药物靶标,还有很艰难的数据分析任务需要完成。需要借助生物信息学的工具,去综合现有数据库数据及文献数据的知识,对这些蛋白质进行综合分析。发表于蛋白质组学杂志上的一篇综述From proteome lists to biological impact-tools and strategies for the analysis of large MS data sets. (Rainer et.al,. Proteomics 2010,10.1270-1283)很好地概括了面对海量的蛋白质组数据这个艰巨的任务时,生物学家和生物信息学家共同发展的数据分析策略和方法,从而数据中挖掘出隐藏的生物学知识。文章介绍了数据预处理过程(如ID转换)、功能富集分析、网络分析及蛋白质性质分析(如PTM, domain,motif)等工具;另外,还介绍了随着实验数据增长起来的文献数据的文本挖掘方法。
质谱与蛋白质组学蛋白质组学对一个细胞或组织所表达的蛋白质进行的系统分析,而质谱是它的关键性分析工具。在过去的两年中,标准蛋白质组技术中的进展增进了更高水平自动化和敏感性的蛋白质识别技术。另外,新的技术促成了鉴定蛋白质功能相关特性的里程碑性的进展,包括它们的定量和在蛋白质复合物中复杂情况。缩写2DE two-dimensional gel electrophoresis双向凝胶电泳CID collision-induced dissociation碰撞诱导的解离ESI electrospray ionization电喷雾离子化FT-ICR Fourier-transform ion cyclotron resonance傅里叶-变换离子回旋加速器共振ICAT isotope-coded affinity tagsIEF isoelectric focusing等电聚焦MALDI matrix-assisted laser desorption ionization基质辅助的激光解析离子化Q-TOF quadrupole-TOFRP reversed phase反向TOF time-of-flight飞行时间简介蛋白质组学的核心组成是系统识别一个细胞或组织中表达的每一个蛋白质,以及确定每个蛋白质的突出特征(比如,丰度、修饰状态以及在多蛋白质复合体中的复杂状态)。这些分析的技术包括分离蛋白质和肽的分离科学、识别和定量分析物的分析科学和数据管理和分析的生物信息学。它的初步工具包括使用IEF(等电点聚焦)/SDS-PAGE凝胶的高分辨率的双向凝胶电泳(2DE),结合质谱和数据库搜索来分离、识别和定量在一个复合样本中存在的个体蛋白质,最终识别被分离的蛋白质。一个常用的方法用在Fig1中用图解说明。此技术以及由此而来的变化(综述见[1])已经被用来识别和分类在复杂样本中存在的大量蛋白质,并在蛋白质组数据库中呈现它们,该过程我们这里称之为"描述蛋白质组学"比如,Shevchenko等[2]从2D凝胶上系统地鉴定了150个蛋白质。数目庞大的这样的数据库现在可以找到。同样的技术现在已经被作为普遍的发现工具来动态检测一个细胞或组织对外来或内部干扰反应而在蛋白质组中的改变。因为检测动态改变需要精确定量每个被检测成分,我们使用"定量蛋白质组学"来定义。在此报告中,我们总结了自1999年1月至2000年4月来报道的与蛋白质组学和质谱相关的最重要的进展。在核心质谱技术中的进展已经导致2DE为基础的蛋白质组学技术的进一步改进。它们同时又促进了传统凝胶为基础的方法的替代方法,诸如引入以同位素稀释理论为基础的精确蛋白质定量技术和蛋白质复合物的系统分析。蛋白质组分析的MS技术进展在此部分,我们总结了在MS设备、它们的控制和操作中的进展,以及比较质谱数据和序列数据库识别蛋白质所用的搜索工具的进展。随着新型质谱仪的引入,蛋白质组学研究现存类型的质谱仪性能已经显著改进了。在此综述期间最普遍使用的仪器是可以分为两类:单一阶段的质谱仪和串联质谱为基础的系统。单一阶段的质谱仪,最显著的是基质辅助的激光解吸电离(MALDI)飞行时间(TOF)仪器,被用于无数通过肽质谱图谱技术大规模蛋白质识别的项目中。此方法在鉴别表达自小一些的和完全测序的基因组的蛋白质特别成功[3,4]。串联质谱仪器诸如triple quadrpole、离子捕获(ion-trap)和近来引进的混合quadrupole飞行时间(Q-TOF)被常规应用于[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS或用电喷雾电离(ESI)来生成肽片段离子谱,以便通过搜寻序列数据库进行蛋白质鉴定。使用仪器控制程序来自动选择肽离子进行碰撞诱导的解离(CID)(数据依赖CID)的不断增多是这些MS/MS仪器的一个明显的趋势。一些新的构造的具有高潜能的质谱仪被引入到蛋白质组学研究中产生深刻影响。两个研究组近来一个MALDI离子源和一个混合Q-TOF耦联了起来[5,6]。Q-TOF提供的质量准确性和敏感性提升了数据库搜寻结果并同时使它成为MS/MS从头测序的当然仪器选择。MALDI Q-TOF构造提供了激动人心的机会进行自动化和高通量应用以及在一个样品盘上存档样品进行日后研究的可能。Medzihradszky等[7]描述了一个不同的混合仪器称之为MALDI TOF TOF。此设备享有许多MALDI Q-TOF的优点,另外能够进行高能量CID和非常快速的扫描速率。傅里叶-变换离子回旋加速器共振(FT-ICR)质谱对于蛋白质组学来说相对陌生。这些设备具有非常高的敏感性和分辨率,质量精确性可以达到1ppm。这些特征被用来在一次分析中测量和定量几百种蛋白质的完整的分子质量[8]。Goodlett等[9]表明FT-MS测量的一个肽的准确质量以及可以容易获得的限制因素能够通过序列数据库搜索被用来识别蛋白质。蛋白质组学如果没有软件工具来进行质谱数据和序列数据库的关联将变得几无可能。现存的数据库搜索程序已经变得越来越成熟和可以(从网络)可获得。另外,引入了新的算法。主要相关程序是Sequest[10],MASCOT[11],PeptedeSearch[12],PROWL[13]和Protein Prospector[14]。在它们中间,Sequest使用CID谱设置了蛋白质识别的实验室标准(benchmark),因为它与边界MS/MS数据工作得最好,并高度可信,可以从整个[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS实验中自动分析数据,并不需要任何使用者的破译工作。在所提的程序中,然而,只有Sequest不能在网络上搜索。MASCOT是一个新的、快速、网络可进入和多功能的程序,具有进行肽指纹分析、用部分破译或未破译的CID谱进行数据库搜索的功能。
2003年人类基因组精细图绘制完成,是人类科学史上一个里程碑式的事件。后基因组时代的研究重点自然落在了蛋白质头上。为啥?因为中心法则告诉我们,基因的产物——蛋白质,是生命活动的最终执行者。与基因组类比,研究生物体内全套蛋白质的科学,就是蛋白质组学。基因组计划完成的同年,人类蛋白质组计划启动,令人激动的是,2014年人类蛋白质组的草图也完成了。而蛋白质组学能够飞速发展的最大功臣非质谱莫属。质谱的应用范围非常广泛,但这里只讨论蛋白质组学中的质谱。简单地说,质谱法(mass spectrometry)就是对肽段离子的重量(质荷比,m/z)进行测量的分析方法。样品经质谱仪(mass spectrometer)检测得到质谱图(mass spectrum),通过对质谱图的分析就可以对样品中的蛋白进行鉴定、定量。亲,图1的这种典型的蛋白质组学流程都很熟悉吧。蛋白首先都要被特异性的酶(通常为Trypsin)切割为肽段,再进行后续分析,这在蛋白质组学中被称为“自下而上”的研究策略(Bottom-up proteomics)。我们平时见到的质谱分析基本都是这种类型。提到蛋白质组,即会联想到一系列高大上的名词,iTRAQ、SWATH、SILAC、Shotgun、Label-free等等。很多概念容易弄混淆,下面我们就来理理清楚。图1. 典型的蛋白质组学流程大体上,质谱研究蛋白主要是鉴定和定量。通过二级质谱图(MS2或者MS/MS)进行数据库搜索匹配鉴定蛋白。通过各种标记或非标记的手段对不同样品中的蛋白进行比较就是定量。蛋白定量比较是质谱最重要的用途,图2是对定量方法的一个简单总结。非标定量(Label-free)不需要标记,不同样品分别处理、分别进质谱检测;优点是处理简单、无需标记、价格便宜、可以比较很多组样品,缺点是对操作步骤、LC、质谱稳定性要求严格。SILAC是在细胞培养基中加入稳定同位素标记的氨基酸,在代谢水平标记蛋白,一级质谱图进行定量,可以做到三组样品混合后进行比较,定量准确,但是不能标记组织样本,养细胞成本也较贵。双甲基化标记是通过化学反应的办法在肽段水平进行标记,一级质谱定量,也可以三组对比,标记试剂都比较便宜,而且可以标记任何来源的样品。iTRAQ和TMT是商品化的试剂盒,肽段水平标记,二级质谱定量;分别可以做到最多8组和10组样品间蛋白质组的比较。图2. 质谱定量方法以上这几个是一家的,还有几个名词是属于另外一家,比如Shotgun (DDA)、SWATH/DIA、SRM (MRM)、MRMHR/PRM。质谱进行数据采集的方式大致分为三种:鸟枪法(Shotgun)、选择反应监控(SRM)和全景式的SWATH/DIA。下面对照图3再来简单介绍一下。图3. 质谱扫描方式DDA、IDA、Shotgun和鸟枪法说的是相同的东西,意思是质谱在每个循环的中从一级里挑选丰度高的TopN个肽段去打碎做二级扫描,得到的结果通过与已知数据库中的理论蛋白进行匹配。DDA简单有效,分析流程比较成熟,也是目前质谱分析的主流方式。DDA也有其固有的缺陷,即具有一定的随机性,偏向于检测丰度较高的肽段,而抑制了低丰度肽段的检测。靶向策略被称为质谱领域的Western blot。质谱只去采集目标肽段大小的离子信息,因而提高了灵敏度和特异性。这种方法用来研究感兴趣的特定蛋白,定量准确,但是通量很有限。SWATH/DIA这种全景式的数据采集方式在最近几年突然火了起来,被认为在不远的未来可能会取代DDA的主流位置。该方法采取的策略是将扫描范围内的所有肽段按照质荷比分为若干个窗口,再对每个窗口里所有的肽段一起打碎,采二级,数据分析时通过抽提蛋白的子离子信息进行定量。SWATH/DIA解决了DDA中随机性选择肽段的缺陷,所以重复性更好,定量的准确性基本达到了SRM的水平,而且可以实现大规模定量。借用听来的一个比喻来说明:DDA就像机关枪扫射,数量多、体积大的目标命中的概率要大一些。靶向扫描(SRM或PRM)就像精准狙击,排除干扰,目标明确,每一枪直指目标,但是难以大规模消灭敌人。SWATH/DIA就是地毯式轰炸,只要暴露在我方攻击范围内的敌人,不管三七二十一,全部炸完。图4. 定量方法与采集方式结合如果将上述的定量方法(图2)和质谱数据采集方式(图3)结合起来,就得到了现在基于质谱的蛋白质组学研究的各种策略(图4)。再打个比方,保证吃货们一听就懂:鸡、鱼、肉、蛋、蔬菜要通过炒锅、烤箱、高压锅、微波炉等烹调之后才能变为美食,填饱肚子。同样的,各种定量方法(非标的和标记的)处理的样品,要通过质谱各种采集方式变为电脑中的数据,才能分析并从中得到蛋白的信息。本次的介绍就先到这里了,如果其中有什么问题,欢迎您批评和建议,我们会努力变得更好;如果需要跟我们进行技术交流和讨论,欢迎大家联系武汉金开瑞。后续我们还会继续推出对质谱技术各方面进行解析的文章,敬请期待。ReferencesA draft map of the human proteome. Nature 509: 575–581 (2014)Mass-spectrometry-based draft of the human proteome. Nature 509: 582–587 (2014)A review: Annu. Rev. Biochem. 80: 273–99 (2011)SILAC: Molecular & Cellular Proteomics 1: 376-386 (2002)iTRAQ: Molecular & Cellular Proteomics 343: 91–99 (2010)SRM: Nature Methods 9: 555–566 (2012)SWATH: Molecular & Cellular Proteomics 11: 1–17 (2012)
[font='Times New Roman'][font=宋体]蛋白质是复杂的含氮有机化合物,不同蛋白质的含氮量不同,测定蛋白含量一般采用凯氏定氮法,但该方法操作步骤繁琐,消耗试剂(如浓硫酸、氢氧化钠等),检测时间长。近年来多采用蛋白质分析仪进行测定,但仍需要对样品做复杂的预处理,费时费力。采用[/font][/font][font=宋体][url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]分析技术[/font][font='Times New Roman'][font=宋体]可缩短检测时间,可快速预测发酵产物中的蛋白质含量,不仅可以避免因为时效性差而引起的目标产物产量不稳定,还可以防止因为外界环境变化引起的蛋白质失活变性。同理,发酵的其他目标产物,如抗生素、维生素、有机酸等,也可以利用[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]来快速预测目标产物含量。[/font][/font]
在发明蛋白质印迹法(Western Blot)出现了30多年之后,这项技术仍然是获取特定蛋白可靠鉴定的关键。许多近期涌现的产品利用各种方法来提高蛋白质印迹实验的可重复性、敏感性、定量性以及速度。有三个人都被认为发展了蛋白质的免疫印迹方法,但其中只有一人才算得上是“Western Blotting(蛋白质印迹法)”的命名者,他就是当时在西雅图哈钦森癌症研究中心Bob Nowinski实验室工作的W. Neal Burnette。“Western Blotting”的命名中暗含了Southern Blotting(Edwin Southern在1975年发明的一项技术,使用胶、尼龙膜和吸水纸去鉴定一个复杂个体中特定的DNA序列)、Northern Blotting(随后发明出的相似策略,用于鉴定RNA)以及位于西海岸(West Coast)的Nowinski实验室三者之意。http://www.ibioo.com/data/attachment/portal/201309/22/095234xzm2pso06fsmtbof.jpgBurnette的技术成果直到1981年才得以发表。他回想起来,当时审稿人“特别”反对使用“Western blotting”这一名称。但尽管如此,这个名称还是沿袭了下来,而且蛋白质印迹技术也成为了最广泛使用的免疫化学技术之一。工作原理蛋白质印迹法的第一步涉及到用凝胶电泳(Gelelectrophoresis)按照大小分离蛋白质,然后通过将膜置于胶上,将蛋白质转移到膜上(通常是硝酸纤维素膜或聚偏二氟乙烯膜),并在膜上加上若干片吸水纸,然后将这套堆层放在缓冲溶液中,这样就能通过毛细管作用将蛋白质向上拉拽到膜上。这也就是所谓的湿法或槽式转印法。另外两项技术是干法和半干转印法,这两种方法比传统的湿转印法更快也更规整,但是对于高分子量蛋白质而言,效率更低。对于半干转印方法来说,膜和胶放置在被缓冲液浸泡过的滤纸层之间,将这些都夹在阴极和阳极之间,电流就能驱动蛋白质转移到膜上。三种方法中,干法转印最快,但转印效率也最低。转印结束后,膜被放在稀释过的蛋白质溶液中用来封闭非特异性的蛋白质结合。然后将膜与一抗进行孵育、洗脱,再与标记了信号检测探针的二抗进行孵育。最后一步是检测,通常采用化学发光或者荧光方法。在化学发光检测中,与酶交联的二抗能够与检测抗原产生光发生反应,可以被胶片或成像装置捕获。而在荧光检测中,抗体探针被荧光集团所标记。荧光检测方法的主要优势在于,它可以同时检测多个蛋白质,并且其信号更加一致。因此与化学发光检测相比,也更有利于量化研究。不少制造蛋白质印迹相关设备、软件和消耗品的公司正在努力推动其中一些或所有步骤的自动化,期望能够将这一实验变得更加简单有效。同时在实验中加入了一些验证点,让研究人员能够随时监测实验进展,甚至重新打造整个过程。科学家们寻求的是高效性、稳健性和策略化,从而能够帮助他们避免浪费宝贵的造价高昂的抗体。加速免疫检测过程转印、抗体孵育、上样和洗脱步骤占据了蛋白质印迹法实验80%的时间,EMD Millipore公司“蛋白质印迹法解决方案”产品经理Michele Hatler这样介绍。这家总部位于加州泰梅库拉的公司推出的SNAP i.d. 2.0蛋白质检测系统加速了整个过程,使用真空装置通过膜推入试剂,而不仅仅依赖于扩散作用。这样就能将免疫检测的时间从4小时缩短到30分钟,Hatler表示。她解释说:“我们真正致力于提高蛋白质印迹工作流程的效率。我们仍然是按照传统的步骤走,只是加了一个真空装置。”Hatler指出,2.0版本是于2012年9月推出的,相比之前的版本有几个方面的优势。它可以使用中等大小的凝胶(8.5×13.5厘米)和迷你凝胶(7.5×8.4厘米),之前则只能用迷你凝胶。“这一设备很便宜,操作也很简便,但切实提高了实验效率,节省了实验时间。” Hatler说。伯乐公司(Bio-Rad)的Trans-Blot Turbo蛋白质转移系统是实验台面大小的仪器,能够提供快速而高效的转印。得益于新的转印缓冲液配方,特殊的过滤材料和增强的电流强度(由一个集成电源调节),这一系统能够在短至3分钟的时间内完成转印,并且印迹结果能与槽式转移相媲美。传统的半干转移系统需要15到60分钟时间,而且通常无法提供高分子量蛋白质转移的有力结果。增加验证点以缓解忧虑蛋白质印迹法的高失败率常常令人感到非常沮丧,尤其是你需要若干天来换取一个结果。“这是一项非常不稳定的技术,”伯乐公司“蛋白质印迹组”市场经理Ryan Short说,“我们对用户调查时发现,一半的用户报告他们用此技术的失败率至少是25%。”Short还说:“几乎没有什么机会可以检查实验过程是否满足期望。由此就产生了焦虑。我们正在引入可视验证点的概念来增加信心和确定性。”这家公司的标准和Mini-PROTEAN免染色预制胶,利用其ChemiDoc MP胶成像系统,使得研究者可以快速观测到他们的蛋白是否正确地载入到凝胶上,进而确证高质量的蛋白质转移,便于决定是否应该转向下一个步流程或是重新开始。ChemiDoc MP系统是为化学发光和多元荧光斑点成像技术所设计,能够在个人电脑上用ImageLab软件来操作。这些验证点“真的很有用”,在实验室使用该系统的加州大学戴维斯分校助理教授Aldrin Gomes表示:“我们可以成像这些免染的凝胶,不用加入额外的染料,而且能够快速判断跑在胶上的样品是否出现问题。我们还能在蛋白质转膜之后再去对凝胶成像,如果其中任何一个步骤出现问题,我们都可以在这一点上停止实验进程。”成像和软件提高定量性当许多科学家仍在使用胶片分析蛋白质印迹时,世面上开始出现越来越多的宽范围免胶片凝胶记录成像系统,这些系统可以用来成像并分析化学发光的印迹、荧光的印迹斑点或者同时检测这两种印迹。许多公司开始纷纷努力,争相制造尽可能便捷的成像仪及其分析软件。很多公司提供了按键式成像捕捉系统,其大小可在实验台上操作。Syngene公司于2012年4月推出了非常简洁的一键操作系统PXi,分析化学发光和荧光印迹。该系统是基于该公司的G:BOX成像系统,并配有GeneSys成像软件。2012年10月,赛默飞世尔公司(Thermo Fisher Scientific)推出了myECL成像仪,使用紫外和可见光透射法,专业的滤镜和电荷耦合器件(CCD)摄影技术去捕获和分析蛋白质印迹以及蛋白和核酸凝胶。
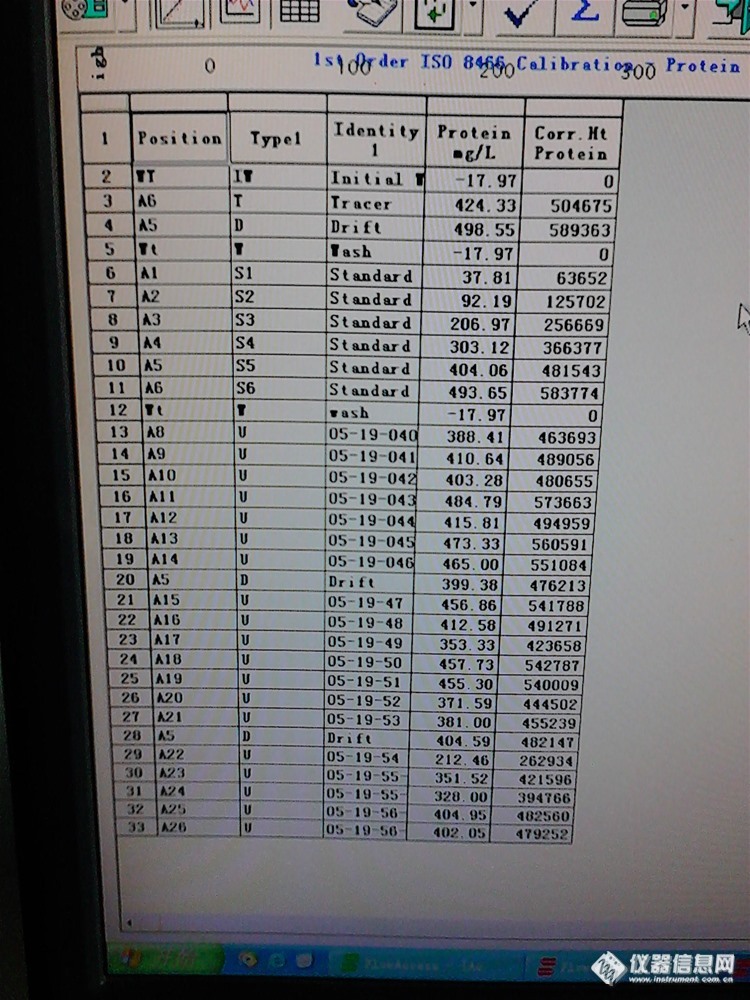
乳品中蛋白质的测定一般是采用GB/T5413.1-1997和GB/T5009.5-2003的方法进行测定的。这两种方法类似,都是基于凯氏定氮法。凯氏定氮法由Kjeltec于1833年首先提出,目前广泛应用于乳品和饲料中蛋白质的测定。 1 原理 样品经消化后,蛋白质中的氮转化为氨并与硫酸结合生成硫酸铵,然后加碱蒸馏,使氨蒸出,用硼酸吸收后用盐酸标准溶液滴定,根据盐酸标准溶液的消耗量,计算出氮的量,乘以换算系数,即为蛋白质含量。 三聚氰胺在消化过程中,转化为硫酸铵,然后在滴定过程中消耗标准盐酸,但是在最后带入计算的时候换算成了蛋白质的含量。 2 测量方法 准确称取一定量的样品(称准至0。001g)移入消化管中,添加催化剂3.9g(其中K2SO4 3.9g,CuSO4.5H2O 0.4g),加入12ml浓硫酸盖上涤气盖放置过夜。次日上凯氏消化炉,设定温度200℃,时间1h,慢消化完毕升高温度至420℃,时间2h,至液体变为蓝绿色透明,继续保持微沸30min。消化完毕,冷却15~20min,上仪器测定测定。 分析程序为凯氏1,程序设定如下:接受液液为30ml,蒸馏水为80ml,碱液为50ml。测定:将已消化好的样品消化管直接放入自动定氮仪上按仪器的要求进行蒸馏测定,同时做空白实验。整个测定过程,蒸馏、滴定、数字处理及结果打印全部自动进行。 3 结果计算 蛋白质含量(%)=[C×(V1-V0)×0.0140×F]/m×100式中:C—盐酸标准溶液的浓度,mol/L [color=#DC143C][size=4]V1—滴定样品吸收液时消耗盐酸标准溶液的体积,mL [/size][/color]V0—滴定空白吸收液时消耗盐酸标准溶液的体积,mL F—蛋白质系数,饲料中F=6.25 M氮—氮的摩尔质量,0.0140kg/mol m—样品质量,g。 关键就在这里,三聚氰胺也消耗了标准盐酸,所以就会在计算过程中转换成蛋白质的含量。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=108622]5009[/url][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=108623]5413[/url][color=#DC143C][size=4](九点虎分析系列仅代表个人观点,如有雷同,实属巧合)[/size][/color]
蛋白质化学与蛋白质组学夏其昌 曾嵘 等编著2004年4月出版ISBN 7-03-012401-4/Q.133116开,平装,580页定价: 75.00元 本书系统论述了蛋白质化学基础理论和实验技巧,也反映了蛋白质组学研究的最新成果。内容包括:蛋白质的表征,蛋白质的组成分析和序列测定,与此相关的实验方法,包括各种色谱、电泳、质谱技术等,以及应用在蛋白质表征研究和基因工程产品的质检方面的实际范例。在蛋白质组学领域介绍了基本概念、样品制备、双向凝胶电泳的图像分析和定量分析、质谱等常规方法,并介绍了国际上最新的多维技术在研究中的应用;同时充分体现了生物信息学在蛋白质组研究中的重要性。 本书可作为生物学、医学、化学专业大学生,研究生和教学人员的参考书,也是从事生物化学、分子生物学、医学等领域中分离分析工作人员的参考书。
蛋白质组学研究--生物质谱技术 对分离的蛋白质进行鉴定是蛋白质组研究的重要内容,蛋白质微量测序、氨基酸组成分析等传统的蛋白质鉴定技术不能满足高通量和高效率的要求,生物质谱技术是蛋白质组学的另一支撑技术。 生物质谱技术在离子化方法上主要有两种软电离技术,即基质辅助激光解吸电离(matrix—assisted laser desorption/ionization,MALDl)和电喷雾电离(electrospray ionization,ESl)。MALDI是在激光脉冲的激发下,使样品从基质晶体中挥发并离子化。ESI使分析物从溶液相中电离,适合与液相分离手段(如液相色谱和毛细管电泳)联用。MALDI适于分析简单的肽混合物,而液相色谱与ESI—MS的联用(LC—MS)适合复杂样品的分析。 软电离技术的出现拓展了质谱的应用空间,而质量分析器的改善也推动了质谱仪技术的发展。生物质谱的质量分析器主要有4种:离子阱(iontrap,IT)、飞行时间(TOF)、四极杆(quadrupole)和傅立叶变换离子回旋共振(Fourier transform ion cyclotron resonance,FTICR)。它们的结构和性能各不相同,每一种都有自己的长处与不足。它们可以单独使用,也可以互相组合形成功能更强大的仪器。 离子阱质谱灵敏度较高,性能稳定,具备多级质谱能力,因此被广泛应用于蛋白质组学研究,不足之处是质量精度较低。与离子阱相似,傅立叶变换离子回旋共振(FTICR)质谱也是一种可以“捕获”离子的仪器,但是其腔体内部为高真空和高磁场环境,具有高灵敏度、宽动态范围、高分辨率和质量精度(质量准确度可很容易地小于1mg/L),这使得它可以在一次分析中对数百个完整蛋白质分子进行质量测定和定量。FTICR—MS的一个重要功能是多元串级质谱,与通常的只能选一个母离子的串级质谱方式不同,FTICR—MS可以同时选择几个母离子进行解离,这无疑可以大大增加蛋白质鉴定工作的通量。但是它的缺点也很明显,操作复杂、肽段断裂效率低、价格昂贵等,这些缺点限制了它在蛋白质组学中的广泛应用。MALDI通常与TOF质量分析器联用分析肽段的精确质量,而ESI常与离子阱或三级四极杆质谱联用,通过碰撞诱导解离(collision—induceddissociation,CID)获取肽段的碎片信息。 1. MALDI—TOF—MS (1)MALDI—TOF—MS的技术特点:①具有分离、鉴定双重功能,可用于混合物的分析;②测量范围宽,相对分子质量可达300 000;③精度高,蛋白质相对分子质量测定精度可达0.01%;④灵敏度高,所需样品量少,可达fmol级;⑤分析时间短,5~10rain可完成一次分析;⑥样品制备简便,操作易自动化;⑦对样品要求低,能忍耐较高浓度的盐、缓冲剂和非挥发性杂质,所以特别适合于鉴定二维凝胶电泳分离的蛋白质。 (2)MALDI—TOF—MS的技术改进:近年来MALDI—TOF—MS又有许多新的技术改进,以提高其检测灵敏性和准确度,增强其蛋白质鉴定的功能。如将MALDI离子源与四极杆—飞行时间—串联质谱对接,实现了同一样品在同一质谱仪上的肽指纹图谱与肽序列标签分析同时进行,提高于蛋白质鉴定的速度和准确性。还有MALDI—TOF—TOF—MS等。但这些技术共同的缺点是仪器非常昂贵。 (3)MALDI—TOF—MS的发展方向:①寻求新的基质(如混合基质、室温离子化液体等)和新的制样方法(如超微量进样,n1级);②将新技术应用在分析中(如酶切技术、毫微升溶剂提取技术等);③对质谱仪进行改进或与其他分析仪器联用,如MALDI与傅立叶转换离子回旋共振质谱(MALDI—FTMS)联用能得到更多的蛋白结构信息;④小型化、智能化、简易化及自动化已成为趋势。 2.ESI (1)ESI的优势:①检测范围宽,生物大分子经电喷雾后质荷比大大下降,因而可测相对分子质量高达十几万甚至更高的生物样品;②分辨率和灵敏度高,可达10-15—10-12mol;③不需要特定基质,避免子基质峰的干扰;④适用于结构分析,可分析生物大分子的构象及非共价相互作用,与串联质谱结合可分析蛋白质、多肽的一级结构和共价修饰位点等;⑤自动化程度高,可与液相色谱、毛细管电泳等高效分离手段在线联用;⑥MALDI是脉冲式离子化技术,而ESI是连续离子化技术,检测所需时间更短;⑦ESI常和四极杆质谱联用,仪器价格相对便宜。 (2)ESI的局限性:①对样品中的盐类耐受性差;②对混合物图谱的解析较复杂;③受溶剂的影响和限制很大。目前ESI主要用于亲水生物大分子的分析,较少用于疏水生物样品的分析。总体来说,MALDI和ESI各有长处,有各自的适用范围,是两种互补的技术。 (3)ESI的技术发展:近年来,ESI也有许多新的技术发展。液相色谱与电喷雾质谱连用(LC—ESI—
我想利用近红外分析一些蛋白质的组成,不需要分析氨基酸的成分,只想分析的蛋白亚基的程度,目前打算先做定标,有做过的朋友可不可以交流一下啊。我的邮箱:alex_qq@hotmail.com