共焦显微镜因其高分辨率和能三维立体成像的优点被广泛应用在生物、医疗、半导体等方面。文章首先分析了影响共焦显微镜分辨率的因素,主要有光源、探测器孔径和杂散光等;并结合这些因素介绍了双光子共焦碌微镜、彩色共焦显微镜、荧光共焦显微镜、光纤共焦显微镜;然后从提高系统成像速度的方面介绍了波分复用共焦显微镜和频分复用共焦显微镜;最后分析了共焦显微镜的发展趋势。一、引言随着人们对于生物医学的研究,传统的光学显微镜已经无法满足研究的需要,人们需要可以实现三维成像的显微镜。1957年Marvin Minsky提出了共焦扫描显微镜的原理。1969年,耶鲁大学的Paul Davidovits和M.David Egger设计了第一台共焦显微镜,1987年第一台商业化共焦显微镜的问世,真正实现了三维立体成像。与普通光学显微镜相比,共焦显微镜具有极其明显的优点:能对物体的不同层面进行逐层扫描,从而获得大量的物体断层图像;可以利用计算机进行图像处理;具有较高的横向分辨率和纵向分辨率;对于透明和半透明物体,可以得到其内部的结构图像;还可以对活体细胞进行观察,获取活细胞内的信息,并对获得的信息进行定量分析。自共焦显微原理被提出以来,引起了研究者的广泛关注,提高显微系统的分辨率和改善系统的性能是研究者开发新型显微镜时考虑的主要因素。近几十年,国内外学者通过对共焦显微成像系统的三维点扩散函数、光学传递函数等方面的分析,得出影响显微系统分辨率的因素,主要包括系统的激励光源、探测器孔径、杂散光等。此外,共焦显微镜的成像速度也是决定系统性能的一个重要因素,专家们也一直在进行提高系统成像速度的研究。本文主要从提高显微系统分辨率和系统成像速度这两个方面来介绍共焦显微镜的发展情况。二、共焦扫描显微镜分辨率的提高光源、探测器孔径和杂散光等是影响共焦显微镜分辨率的几个主要因素,因此可以通过改善这些方面来提高显微系统的分辨率。1.光源显微镜的成像性质在很大程度上取决于所采用光源的相干性,有关研究表明,光源相干性好的系统其分辨率要比相干性差的系统要好,并且照明光源对分辨率的改变范围达到了26.4%。因此,选取适合的照明光源对提高显微系统的分辨率有很大帮助。常规的共焦扫描显微镜主要使用普通单色激光作为光源,随着技术的进步,目前已经出现了使用飞秒激光、超白激光、高斯光束作为光源的共焦显微镜,以提高系统性能,获得更高的分辨率。①飞秒激光为光源的双先子扫描共焦显微镜双光子扫描共焦显微镜通常使用近红外的飞秒激光作为激发光源,由于红外光具有较强的穿透性,它能探测到生物样品表面下更深层的荧光图像,并且生物组织对红外光吸收少,随着探测深度的增加衰减会变小,另一方面红外光的衍射低,光束的形状保持性好。2005年,Wild等人利用双光子扫描共焦显微技术实时观察和定量分析了PAHs在植物叶片表面和内部的光降解过程。后来又进一步研究了菲从空气到叶片的迁移过程、菲在叶片内部的运动及其分布情况等,该技术可观测PAHs在叶片内部的最大深度约为200μm。②白激光( supercontinuum laser)为光源的彩色共焦显微镜彩色共焦显微镜是利用光学系统的彩色像差,光源的不同光谱成分会聚焦到样品的不同深度,通过分析由样品反射的光谱能有效地获得样品的扫描深度。2004年,美国宾夕法尼亚州立大学的Zhiwen Liu课题小组使用光子晶体光纤产生的超连续谱白光作为彩色共焦显微镜的光源,这种超连续谱白光具有大的带宽,能够提高系统的扫描范围,能达到7μm扫描深度。另外超白激光有较高的空间相干性,无斑点噪声,能提高系统的信噪比和扫描速度。③使用高斯光束的荧光共焦显微镜荧光共焦显微镜是通过激光照射样品激发样品发出荧光,再通过探测器接受荧光对样品进行观察的共焦显微镜。华南农业大学的杨初平等人研究了不同光源孔径和束斑尺寸的高斯光束对荧光共焦显微镜分辨率的影响表明:与一定孔径尺寸的平行光束相比,采用高斯光束系统可以获得更好的分辨率。 2. 探测器孔径和杂散光共焦显微镜中探测器孔径能滤除部分杂散光,提高系统的分辨率和信噪比。根据相关文献对共焦扫描显微镜的三维光学传递函数与探测器孔径之间的依赖关系的研究,可以得到探测小孔直径为:d=β*1.22λ/NA,式中,β为物镜的放大率,λ为光的波长,NA为物镜的数值孔径。由该公式确定探测器小孔的直径,一方面满足了共焦扫描系统对探测器小孔直径的要求,从而保证高的横向和纵向分辨率,另一方面,又最大限度地使由试样中发射的荧光能量被探测器接收。为了更进一步提高系统分辨率,许多研究者对共焦显微镜中探测孔径进行了改进,例如使用单模光纤代替普通针孔孔径,还有双D型孔径等。① 使用单模光纤的光纤共焦显微镜在光纤共焦显微镜中用光纤分路器代替传统共焦显微镜中的光束分路器,并以单模光纤来代替光源和探测器的微米尺寸针孔孔径。使用单模光纤的优点在于:首先,在采用寻常针孔制作的共焦显微镜中,光源、针孔、探测器等有可能不在一条直线上从而会引起像差;但是在光纤作为针孔的共焦显微镜中,即使有的部件偏离直线时也不会引入像差。其次,使用单模光纤代替微型针孔,容易清除针孔的污染,而且不易受污染。第三,在使用光纤的系统中,可以自由移动显微镜部分而不必挪动探测器。2006年德克萨斯大学使用光纤共焦显微镜进行口腔病变检测,测得的系统横向和轴向分辨率分别为2. 1µm和10µm,成像速度为15帧/s,可观测范围为200µm×200µm。② 具有D型孔径的共焦显微镜近几年,具有对称D型光瞳的共焦显微成像技术引起广泛的关注,图1所示是该系统示意图。2006年美国东北大学的Peter J.Dwyer等人使用这种共焦显微镜进行了人体皮肤内部成像的实验,测得横向分辨率为1.7士0.1µm。2009年新加坡国立大学的Wei Gong等人采用傍轴近似方法理论分析了在共焦显微镜中使用双D型孔径对轴向分辨率的影响。分析表明在图1中的d值给定时,进入瞳孔的光信号强度l会随着探测器尺寸的增加而增加;但是在探测器尺寸给定时,光信号强度I会随着d的增加而单调递减。在使用有限大小的探测器时,改变d的大小,轴向分辨率可以得到改善。 http://www.biomart.cn//upload/userfiles/image/2011/11/1321512815.png 图1 双D型孔径共焦成像系统示意图在共焦成像光学系统中,到达像面的杂散光会在像面上产生附加的强度分布,从而进一步降低了像面的对比度,限制了系统分辨率的提高,因此在显微系统设计时,杂散光的影响也是不容忽视的。一般除了使用探测小孔来抑制杂散光,其他的一些设备例如可变瞳滤波器等对杂散光也有很好的过滤作用。最近以色列魏茨曼科学研究所的O.sipSchwartz and Dan Oron等人提出在系统中使用可变瞳滤波器,这个滤波器能够使多光子荧光共焦显微镜达到分辨率阿贝极限的非线性模拟,从而改善系统的分辨率。三、共焦扫描显微成像速度的提高共焦显微镜快速的成像速度为研究者观察生物细胞中快速动态反应提供了良好的条件。在共焦扫描显微成像系统中,传统的方法是通过改善扫描探测技术来提高成像速度。现有的扫描探测技术主要有Nipkow转盘法、狭缝共焦检测法、多光束的微光学器件检测法。这些方法可以改善扫描速度,但是与系统分辨率,视场之间都存在矛盾,因此又诞生了两种提高成像速度的新型显微镜:波分复用共焦显微镜和频分复用共焦显微镜。
[b][url=http://www.f-lab.cn/vivo-imaging/rp2.html]激光荧光成像仪[/url][/b][url=http://www.f-lab.cn/vivo-imaging/rp2.html]Lab-FLARE[/url]是采用激光发射激发荧光技术的实验室近红外荧光成像系统和多功能光子荧光成像控制器,与各种手持式荧光成像仪一起,提供近红外荧光高清成像,同时提供700 nm近红外荧光图像,800nm近红外荧光成像和彩色视频。[b]激光荧光成像仪特点[/b]控制使用2个4K高清监测器与所有我公司荧光成像头一起工作,获得高清荧光图像满FLARE容量的四个独立的视频流高功率665nm 和760nm激光激发,提供几乎没有近红外光的白光同时700 nm近红外荧光,800纳米近红外荧光成像,彩色视频输出,几何/数学融合。综合GPIO的大功率继电器统一的FLARE软件与脚本笔记本电脑集成锁存器及一套RC系列成像头带关节臂定位RC系列成像头的可选推车可选的VESA安装做它自己的RC系列成像安装头激光荧光成像仪Lab-FLARE:[url]http://www.f-lab.cn/vivo-imaging/rp2.html[/url]
激光共聚焦显微镜系统的原理和应用激光扫描共聚焦显微镜是二十世纪80年代发展起来的一项具有划时代的高科技产品,它是在荧光显微镜成像基础上加装了激光扫描装置,利用计算机进行图像处理,把光学成像的分辨率提高了30%--40%,使用紫外或可见光激发荧光探针,从而得到细胞或组织内部微细结构的荧光图像,在亚细胞水平上观察诸如Ca2+ 、PH值,膜电位等生理信号及细胞形态的变化,成为形态学,分子生物学,神经科学,药理学,遗传学等领域中新一代强有力的研究工具。激光共聚焦成像系统能够用于观察各种染色、非染色和荧光标记的组织和细胞等,观察研究组织切片,细胞活体的生长发育特征,研究测定细胞内物质运输和能量转换。能够进行活体细胞中离子和PH值变化研究(RATIO),神经递质研究,微分干涉及荧光的断层扫描,多重荧光的断层扫描及重叠,荧光光谱分析荧光各项指标定量分析荧光样品的时间延迟扫描及动态构件组织与细胞的三维动态结构构件,荧光共振能量的转移的分析,荧光原位杂交研究(FISH),细胞骨架研究,基因定位研究,原位实时PCR产物分析,荧光漂白恢复研究(FRAP),胞间通讯研究,蛋白质间研究,膜电位与膜流动性等研究,完成图像分析和三维重建等分析。一.激光共聚焦显微镜系统应用领域:涉及医学、动植物科研、生物化学、细菌学、细胞生物学、组织胚胎、食品科学、遗传、药理、生理、光学、病理、植物学、神经科学、海洋生物学、材料学、电子科学、力学、石油地质学、矿产学。二.基本原理传统的光学显微镜使用的是场光源,标本上每一点的图像都会受到邻近点的衍射或散射光的干扰;激光扫描共聚焦显微镜利用激光束经照明针孔形成点光源对标本内焦平面的每一点扫描,标本上的被照射点,在探测针孔处成像,由探测针孔后的光点倍增管(PMT)或冷电耦器件(cCCD)逐点或逐线接收,迅速在计算机监视器屏幕上形成荧光图像。照明针孔与探测针孔相对于物镜焦平面是共轭的,焦平面上的点同时聚焦于照明针孔和发射针孔,焦平面以外的点不会在探测针孔处成像,这样得到的共聚焦图像是标本的光学横断面,克服了普通显微镜图像模糊的缺点。三.应用范围:细胞形态学分析(观察细胞或组织内部微细结构,如:细胞内线粒体、内质网、高尔基体、微管、微丝、细胞桥、染色体等亚细胞结构的形态特征;半定量免疫荧光分析);荧光原位杂交研究;基因定位研究及三维重建分析。1.细胞生物学:细胞结构、细胞骨架、细胞膜结构、流动性、受体、细胞器结构和分布变化2.生物化学:酶、核酸、FISH(荧光原位杂交)、受体分析3.药理学:药物对细胞的作用及其动力学4.生理学:膜受体、离子通道、细胞内离子含量、分布、动态5.神经生物学:神经细胞结构、神经递质的成分、运输和传递、递质受体、离子内外流、神经组织结构、细胞分布6.微生物学和寄生虫学:细菌、寄生虫形态结构7.病理学及临床应用:活检标本诊断、肿瘤诊断、自身免疫性疾病诊断、HIV等8.遗传学和组胚学:细胞生长、分化、成熟变化、细胞的三维结构、染色体分析、基因表达、基因诊断四.激光共聚焦显微镜在医学领域中的应用A.在细胞及分子生物学中的应用1.细胞、组织的三维观察和定量测量2.活细胞生理信号的动态监测3.粘附细胞的分选4.细胞激光显微外科和光陷阱功能5.光漂白后的荧光恢复6.在细胞凋亡研究中的应用B.在神经科学中的应用1.定量荧光测定2.细胞内离子的测定3.神经细胞的形态观察C.在耳鼻喉科学中的应用1.在内耳毛细胞亚细胞结构研究上的应用2.激光扫描共聚焦显微镜的荧光测钙技术在内耳毛细胞研究中的应用3.激光扫描共聚焦显微镜在内耳毛细胞离子通道研究上的应用4.激光扫描共聚焦显微镜在嗅觉研究中的应用D.在肿瘤研究中的应用1. 定量免疫荧光测定2. 细胞内离子分析3. 图像分析:肿瘤细胞的二维图像分析4. 三维重建 E.激光扫描共聚焦显微镜在内分泌领域的应用1. 细胞内钙离子的测定2. 免疫荧光定位及免疫细胞化学研究3. 细胞形态学研究:利用激光扫描共聚焦显微镜 F.在血液病研究中的应用1. 在血细胞形态及功能研究方面的应用2. 在细胞凋亡研究中的应用 G.在眼科研究中的应用1. 利用激光扫描共聚焦显微镜观察组织、细胞结构2. 集合特殊的荧光染色在活体上观察角膜外伤修复中细胞移行及成纤维细胞的出现3. 利用激光扫描共聚焦显微镜观察视网膜中视神经细胞的分布以及神经原的树枝状形态4. 三维重建H. 激光扫描共聚焦显微镜在肾脏病中的应用可以系统观察正常人肾小球系膜细胞的断层扫描影像及三维立体影像水平,使图像更加清晰,从计算机分析系统可从外观到内在结构,从平面到立体,从静态到动态,从形态到功能几个方面对系膜细胞的认识得到提高。
激光共聚焦显微镜系统的原理和应用激光扫描共聚焦显微镜是二十世纪80年代发展起来的一项具有划时代的高科技产品,它是在荧光显微镜成像基础上加装了激光扫描装置,利用计算机进行图像处理,把光学成像的分辨率提高了30%--40%,使用紫外或可见光激发荧光探针,从而得到细胞或组织内部微细结构的荧光图像,在亚细胞水平上观察诸如Ca2+ 、PH值,膜电位等生理信号及细胞形态的变化,成为形态学,分子生物学,神经科学,药理学,遗传学等领域中新一代强有力的研究工具。激光共聚焦成像系统能够用于观察各种染色、非染色和荧光标记的组织和细胞等,观察研究组织切片,细胞活体的生长发育特征,研究测定细胞内物质运输和能量转换。能够进行活体细胞中离子和PH值变化研究(RATIO),神经递质研究,微分干涉及荧光的断层扫描,多重荧光的断层扫描及重叠,荧光光谱分析荧光各项指标定量分析荧光样品的时间延迟扫描及动态构件组织与细胞的三维动态结构构件,荧光共振能量的转移的分析,荧光原位杂交研究(FISH),细胞骨架研究,基因定位研究,原位实时PCR产物分析,荧光漂白恢复研究(FRAP),胞间通讯研究,蛋白质间研究,膜电位与膜流动性等研究,完成图像分析和三维重建等分析。一.激光共聚焦显微镜系统应用领域:涉及医学、动植物科研、生物化学、细菌学、细胞生物学、组织胚胎、食品科学、遗传、药理、生理、光学、病理、植物学、神经科学、海洋生物学、材料学、电子科学、力学、石油地质学、矿产学。二.基本原理传统的光学显微镜使用的是场光源,标本上每一点的图像都会受到邻近点的衍射或散射光的干扰;激光扫描共聚焦显微镜利用激光束经照明针孔形成点光源对标本内焦平面的每一点扫描,标本上的被照射点,在探测针孔处成像,由探测针孔后的光点倍增管(PMT)或冷电耦器件(cCCD)逐点或逐线接收,迅速在计算机监视器屏幕上形成荧光图像。照明针孔与探测针孔相对于物镜焦平面是共轭的,焦平面上的点同时聚焦于照明针孔和发射针孔,焦平面以外的点不会在探测针孔处成像,这样得到的共聚焦图像是标本的光学横断面,克服了普通显微镜图像模糊的缺点。三.应用范围:细胞形态学分析(观察细胞或组织内部微细结构,如:细胞内线粒体、内质网、高尔基体、微管、微丝、细胞桥、染色体等亚细胞结构的形态特征;半定量免疫荧光分析);荧光原位杂交研究;基因定位研究及三维重建分析。1.细胞生物学:细胞结构、细胞骨架、细胞膜结构、流动性、受体、细胞器结构和分布变化2.生物化学:酶、核酸、FISH(荧光原位杂交)、受体分析3.药理学:药物对细胞的作用及其动力学4.生理学:膜受体、离子通道、细胞内离子含量、分布、动态5.神经生物学:神经细胞结构、神经递质的成分、运输和传递、递质受体、离子内外流、神经组织结构、细胞分布6.微生物学和寄生虫学:细菌、寄生虫形态结构7.病理学及临床应用:活检标本诊断、肿瘤诊断、自身免疫性疾病诊断、HIV等8.遗传学和组胚学:细胞生长、分化、成熟变化、细胞的三维结构、染色体分析、基因表达、基因诊断四.激光共聚焦显微镜在医学领域中的应用A.在细胞及分子生物学中的应用1. 细胞、组织的三维观察和定量测量2. 活细胞生理信号的动态监测3. 粘附细胞的分选4. 细胞激光显微外科和光陷阱功能5. 光漂白后的荧光恢复6. 在细胞凋亡研究中的应用B.在神经科学中的应用1. 定量荧光测定2. 细胞内离子的测定3. 神经细胞的形态观察C.在耳鼻喉科学中的应用1. 在内耳毛细胞亚细胞结构研究上的应用2. 激光扫描共聚焦显微镜的荧光测钙技术在内耳毛细胞研究中的应用3. 激光扫描共聚焦显微镜在内耳毛细胞离子通道研究上的应用4. 激光扫描共聚焦显微镜在嗅觉研究中的应用D.在肿瘤研究中的应用1. 定量免疫荧光测定2. 细胞内离子分析3. 图像分析:肿瘤细胞的二维图像分析4. 三维重建 E.激光扫描共聚焦显微镜在内分泌领域的应用1. 细胞内钙离子的测定2. 免疫荧光定位及免疫细胞化学研究3. 细胞形态学研究:利用激光扫描共聚焦显微镜 F.在血液病研究中的应用1. 在血细胞形态及功能研究方面的应用2. 在细胞凋亡研究中的应用 G.在眼科研究中的应用1. 利用激光扫描共聚焦显微镜观察组织、细胞结构2. 集合特殊的荧光染色在活体上观察角膜外伤修复中细胞移行及成纤维细胞的出现3. 利用激光扫描共聚焦显微镜观察视网膜中视神经细胞的分布以及神经原的树枝状形态4. 三维重建H. 激光扫描共聚焦显微镜在肾脏病中的应用可以系统观察正常人肾小球系膜细胞的断层扫描影像及三维立体影像水平,使图像更加清晰,从计算机分析系统可从外观到内在结构,从平面到立体,从静态到动态,从形态到功能几个方面对系膜细胞的认识得到提高。北京中科研域科技有限公司(蔡司显微镜代理商)地址:北京市朝阳区建国路15号院甲1号北岸1292,一号楼406室联系人:张辉13911188977 邮编:100024电话:010-57126588 传真:010-85376588E-mail:[email=zhs_8000@126.com][color=#0365bf]zhs_8000@126.com[/color][/email]
激光共聚焦扫描显微镜简介一、 激光共聚焦显微镜的基本组成激光扫描共聚焦显微镜(laser scanning confocal microscope LSCM)是20世纪80年代发展起来的一项具有划时代意义的高科技新产品,是当今世界最先进的细胞生物学分析仪器。激光共聚焦显微镜利用激光作为光源,在传统光学显微镜基础上采用共轭聚焦的原理和装置,以及通过针孔的选择和PMT的收集,并带有一套对其所观察到的对象进行数字图像分析处理的系统软件。与传统光学显微镜相比,它具有更高的分辨率,实现多重荧光的同时观察并可形成清晰的三维图象等优点。所以它问世以来在生物学的研究领域中得到了广泛应用。激光共聚焦显微镜主要有四部分组成:1、显微镜光学系统。2、扫描装置。3、激光光源。4、检测系统。整套仪器由计算机控制,各部件之间的操作切换都可在计算机操作平台界面中方便灵活地进行。1.1 显微镜光学系统 显微镜是LSCM的主要组件,它关系到系统的成象质量。显微镜光路以无限远光学系统可方便地在其中插人光学选件而不影响成象质量和测量精度。物镜应选取大数值孔径平场复消色 差物镜,有利于荧光的采集和成象的清晰。物镜组的转换,滤色片组的选取,载物台的移动调节,焦平面的记忆锁定都应由计算机自动控制。1.2 扫描装置 LSCM使用的扫描装置在生物领域一般为镜扫描。由于转镜只需偏转很小角度就能涉及很大的扫描范围,图象采集速度大大提高,512×512画面每秒可达4帧以上,有利于那些寿命短的离子作荧光测定。扫描系统的工作程序由计算机自动控制。1.3 激光光源 LSCM使用的激光光源有单激光和多激光系统。多激光器系统在可见光范围使用多谱线氩离子激光器,发射波长为457nm、488nm和514nm的蓝绿光,氦氖绿激光器提供发射波长为543nm的绿光,氦氖红激光器发射波长为633nm的红光,新的405nm半导体激光器的出现可以提供近紫外谱线,但是小巧便宜而且维护简单。1.4 检测系统 LSCM为多通道荧光采集系统,一般有三个荧光通道和一个透射光通道,能升级到四个荧光通道,可对物体进行多谱线激光激发,样品发射荧光的探测器为感光灵敏度高的光电倍增管PMT,配有高速12位A/D转换器,可以做光子计数。PMT前设置针孔,由计算机软件调节针孔大小,光路中设有能自动切换的滤色片组,满足不同测量的需要,也有通过光栅或棱镜分光后进行光谱扫描功能的设置。二、激光共聚焦显微镜的特点以及在生物领域的应用传统光学显微镜相比,激光共聚焦显微镜具有更高的分辨率,实现多重荧光的同时观察并可形成清晰的三维图象等优点,在对生物样品的观察中,激光共聚焦显微镜有如下优越性:1、对活细胞和组织或细胞切片进行连续扫描,可获得精细的细胞骨架、染色体、细胞器和细胞膜系统的三维图像。2、 可以得到比普通荧光显微镜更高对比度、高解析度图象、同时具有高灵敏度、杰出样品保护。3、***图象的获得,如7 维图象(XYZaλIt): xyt 、xzt 和xt 扫描,时间序列扫描旋转扫描、区域扫描、光谱扫描、同时方便进行图像处理。 4、细胞内离子荧光标记,单标记或多标记,检测细胞内如PH和钠、钙、镁等离子浓度的比率测定及动态变化。5、荧光标记探头标记的活细胞或切片标本的活细胞生物物质,膜标记、免疫物质、免疫反应、受体或配体,核酸等观察;可以在同一张样品上进行同时多重物质标记,同时观察; 6、对细胞检测无损伤、精确、准确、可靠和优良重复性;数据图像可及时输出或长期储存。 由于共聚焦显微镜的以上优点,激光共聚焦显微镜在以下研究领域中应用较为广泛:1、细胞生物学:如:细胞结构、细胞骨架、细胞膜结构、流动性、受体、细胞器结构和分布变化、细胞凋亡机制;各种细胞器、结构性蛋白、DNA、RNA、酶和受体分子等细胞特异性结构的含量、组分及分布进行定量分析;DNA、RNA含量、利用特定的抗体对紫外线引起的DNA损伤进行观察和定量;分析正常细胞和癌细胞细胞骨架与核改变之间的关系;细胞黏附行为等 2、生物化学:如:酶、核酸、受体分析、荧光原位杂交、杂色体基因定位等,利用共聚焦技术可以取代传统的核酸印迹染交等技术,进行基因的表达检测,使基因的转录、翻译等检测变的更加简单、准确。3、药理学:如:药物对细胞的作用及其动力学;药物进入细胞的动态过程、定位分布及定量 4、生理学、发育生物学:如:膜受体、离子通道、离子含量、分布、动态;动物发育以及胚胎的形成,骨髓干细胞的分化行为;细胞膜电位的测量.荧光漂白恢复(FRAP)、荧光漂白丢失(FLIP)的测量等。 5、遗传学和组胚学:如:细胞生长、分化、成熟变化、细胞的三维结构、染色体分析、基因表达、基因诊断; 6、神经生物学:如:神经细胞结构、神经递质的成分、运输和传递; 7、微生物学和寄生虫学:如:细菌、寄生虫形态结构; 8、病理学及病理学临床应用:如:活检标本的快速诊断、肿瘤诊断、自身免疫性疾病的诊断; 9、免疫学、环境医学和营养学。如:免疫荧光标记(单标、双标或三标)的定位,细胞膜受体或抗原的分布,微丝、微管的分布、两种或三种蛋白的共存与共定位、蛋白与细胞器的共定位;对活细胞中的蛋白质进行准确定位及动态观察可实时原位跟踪特定蛋白在细胞生长、分裂、分化过程中的时空表达,荧光能量共转移(FRET)。
[url=http://www.leica-microsystems.com/cn/%E4%BA%A7%E5%93%81/%E5%85%B1%E8%81%9A%E7%84%A6%E6%98%BE%E5%BE%AE%E9%95%9C/]激光共聚焦显微镜[/url]用于对样品(如贴片细胞)进行荧光成像,一般具有几条不同波长的激光作为激发光,研究人员可根据自身不同的实验需要来选择合适的激光进行荧光成像。共聚焦显微镜相对于传统的荧光显微镜具有极大的优势。首先,激光共聚焦显微镜具有极高的层切能力,可以对样品进行三维成像。与普通荧光显微镜不同,共聚焦显微镜可以对待观察样品的某一平面清晰成像,通过改变样品的垂直位置对样品的不同平面进行依次成像,还可对样品的特定平面进行实时动态成像。其次,共聚焦显微镜相对于传统的荧光显微镜具有极高的分辨率,基本达到了光学显微镜分辨率的理论极限。再次,由于激光共聚焦显微镜基于单点扫描的成像模式,因此可以在此基础上开发出其他传统荧光显微镜不能达成的技术,如荧光漂白恢复技术,荧光相关光谱技术等。共聚焦显微镜在生物学和化学领域具有极其广阔的应用,如对样品的荧光信号进行定性定量分析,对组织样品进行三维结构观察等。
[b][font='Microsoft YaHei', 宋体, sans-serif]【序号】:1[/font]【作者】:[/b][font=&][size=12px][color=#1c1d1e][b][b]魏通达[/b][/b][/color][/size][/font][font='Microsoft YaHei', 宋体, sans-serif][b][b][/b][/b][/font][font=&]【题名】:[/font][b][b][color=#333333][b][font=&][color=#032d2c][b]共聚焦激光扫描光学显微成像关键技术研究[/b][/color][/font][/b][/color][/b][/b][font=&]【期刊】:[/font][font=Arial][font=&][size=12px]CNKI[/size][/font][/font][font='Microsoft YaHei', 宋体, sans-serif][color=#545454][b]【链接】:[url=https://link.springer.com/book/10.1007/978-0-387-45524-2]共聚焦激光扫描光学显微成像关键技术研究 - 中国知网 (cnki.net)[/url][/b][/color][/font]
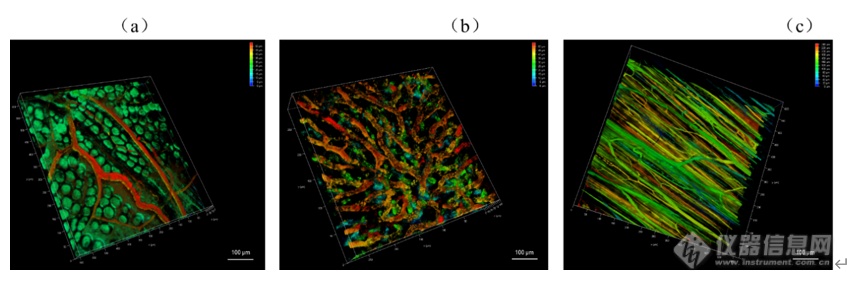
[align=center][b]双光子激光扫描显微镜的检测模式及其在生物医学领域的应用[/b][/align][align=center][font=宋体]刘皎[/font][sup]1[/sup],吴晶[sup]1[/sup][/align][align=center]1. [font=宋体]北京大学医药卫生分析中心,北京,[/font]100191[/align][b][font=黑体][[/font]摘要] [/b]双光子激光扫描显微镜(two-photon laser scan microscope, TPLSM[font=宋体])具有低光毒性、高时空分辨率、高信噪比等优点,结合了激光扫描共聚焦显微镜和双光子激发技术,广泛应用于脑科学、免疫学、肿瘤、胚胎发育等生物医学相关研究领域。本文结合作者所在的北京大学医药卫生分析中心共聚焦平台的工作经验,概述了[/font]TPLSM适用的样本、检测模式以及在生物医学领域的应用,以期为相关科研技术人员提供参考。[b][font=&][Abstract][/font] [/b]Two-photon laser scan microscopy (TPLSM) has the advantages of low phototoxicity, high spatial and temporal resolution, and high signal-to-noise ratio.TPLSM combines laser scanning confocal microscopy with two-photon excitationtechnology and it is widely used in brain science, immunology, tumor, embryodevelopment and other biomedical related research fields. Based on the author'swork experience in the confocal center of Peking University Medical and HealthAnalysis Center, this paper summarizes the applicable samples, detection modesand applications of TPLSM in the biomedical field, in order to provide referencefor related scientific researchers and technicians.[b][font=黑体][[/font]关键词] [/b]显微镜双光子,检测模式,应用[b]1 引言[/b]双光子激发技术的基本原理是在高光子密度情况下,荧光分子可同时吸收2个长波长光子,产生一个一半波长光子去激发荧光分子的相同效果。双光子激光扫描显微镜(two-photon laser scan microscope, TPLSM[font=宋体])在激光扫描共聚焦显微镜的基础上,以红外飞秒激光作为光源,长波长的近红外激光受散射影响小,易穿透标本,可深入组织内部非线性激发荧光,对细胞毒性小且具有高空间分辨率,适合生物样品的深层成像及活体样品的长时间观察成像[/font][1]。使用高能量锁模脉冲激光器,物镜焦点处的光子密度最高,在焦点平面上才有光漂白及光毒性,焦点外不损伤细胞。双光子效应只发生在焦点处,所以双光子显微镜无需共聚焦针孔,也能做到点激发点探测,提高了荧光检测效率[2]。[b][/b]双光子激光扫描显微镜显微镜可以通过XYZ,XYT,XYλ,XYZT,XYλT等多种模式实现多维成像,亦可进行更复杂实验的拍摄,比如二次谐波成像(Second Harmonic Generation Imaging,SHG[font=宋体])、双光子荧光寿命成像([/font]Two-photon Fluorescence Lifetime Imaging Microscopy, TP-FLIM[font=宋体])、荧光寿命[/font]-[font=宋体]荧光共振能量转移成像([/font]FluorescenceLifetime - Fluorescence Resonance Energy Transfer Imaging, FLIM-FRET[font=宋体])等实验以满足对样品的定性、定量、定位、共定位等多维度多功能的研究。[/font]TPLSM已成为生命科学各领域重要的研究工具,可在细胞及亚细胞水平对活体动物的神经细胞形态结构、离子浓度、细胞运动、分子相互作用等生理现象进行直接的长时间成像监测,还能进行光激活染及光损伤等光学操纵,广泛应用于脑科学、免疫学、肿瘤、胚胎发育等生物医学相关研究[3-5]。本文拟通过按TPLSM常见的检测模式分别阐述其在生物医学领域的应用,以其为相关科研技术人员提供参考。[b]2. TPLSM适用的样本[/b]TPLSM适用的样本非常广泛,从液体、固体等形式的材料或制剂、细菌、细胞、细胞团、类器官、组织切片、到各种模式动物(如线虫、果蝇、斑马鱼、小鼠、大鼠、兔、猴等)及其[font=宋体]脑、脊髓、肝脏、肺、皮肤等器官[/font],都可以通过搭载不同载物台进行测试。相对于传统激光扫描共聚焦显微镜200μm的成像深度极限,双光子显微镜成像深度可达800μm,如果是透明化样品可更厚。TPLSM尤其适合活体动物成像,且比小动物荧光成像有更高的分辨率和信噪比,一般TPLSM的XY轴分辨率为200 nm左右,Z轴分辨率为300 nm左右。[b]3. TPLSM的检测模式[/b]3.1 二维成像模式TPLSM可以实现点扫描、点探测,得到生物样品高反差、高分辨率、高灵敏度的二维图像,从而获得细胞/组织等光学切片的物理、生物化学特性及变化。也可以对所感兴趣的区域进行准确的定性、定量及定位分析。激光扫描显微镜的zoom功能,可以用来调节扫描区域的放大倍数。但受物镜分辨率的限制,一味的增大zoom值,不能得到相应的高清图像,需根据实际情况参考piexl size进行设定。TPLSM可以实现XY、XZ或XT的二维成像模式,XT线扫会在后文与XYT时间序列成像一起进行举例说明(图2b)。3.2 三维成像模式3.2.1 Z轴序列三维成像(XYZ)[align=left]TPLSM可沿Z轴方向通过电动载物台的连续扫描对样品进行无损伤的光学切片(XYZ),获得三维立体图像。同理,通过沿Y轴方向连续扫描,可获得连续的XZY图像。如图1所示TPLSM[font=宋体]可以顺利观察到可以观察到血管清晰形态结构:单个胚胎的胎盘微血管(图[/font]1a)、肝脏血窦微血管(图1b)和后肢微血管(图1c)[6]。[/align][align=center][img=,690,230]https://ng1.17img.cn/bbsfiles/images/2022/12/202212151626576232_4807_3237657_3.png!w690x230.jpg[/img][/align][align=center]图1(a)胚胎胎盘微(b)肝脏血窦和(c)后肢的微血管三维成像[/align]3.2.2 时间序列扫描模式(XYT)[align=left]按照一定的时间间隔重复采集,则可实现对该样品的实时监测(XYT)。此类实验可观察组织区域内特异荧光探针标记的单个细胞或细胞内不同部位接受刺激后的整个变化过程。[font=宋体]如图[/font]2[font=宋体]([/font]a[font=宋体]),可以根据微血管[/font]XYT[font=宋体]序列扫描的成像结果中某一血细胞在前后两张图的位置移动和这两帧图的扫描时间间隔计算血流速度。若血流速度很快,[/font]XYT扫描不足以捕捉实际流速,可以使用XT线扫计算。如图2(b),微血管XT扫描图像中绿色荧光背景里的黑色线条代表单个血细胞的流动轨迹,每条线条的横坐标代表血细胞移动的距离(distance / μm[font=宋体]),纵坐标代表此段时间([/font]time/ ms[font=宋体]),根据这两个数据可以计算出单位时间内血细胞的流动速度([/font]μm / ms)[6]。[/align][align=center][img=,690,262]https://ng1.17img.cn/bbsfiles/images/2022/12/202212151627102569_8367_3237657_3.png!w690x262.jpg[/img] [/align][align=center]图2 微血管(a)XYT扫描结果和(b)XT一维扫描结果图像计算血流说明示意图[/align]3.2.3 光谱扫描模式(XYλ/XYΛ)通常配置有可调节接受范围的检测器的TPLSM,可以实现从400nm-800nm的发射波谱扫描。通过配置具有连续可调波长的双光子激光器,还可以实现750nm-1300nm激发波谱扫描。这对于开发研制特殊染料探针的课题来说是很方便、全面的检测功能。3.3四维成像模式(XYZT/XYλT/XYΛT)基于上述三维成像模式,结合时间序列扫描,可以实现TPLSM的四维成像。3.4二次谐波成像(SHG)SHG是一个二阶非线性过程,且一般为非共振过程,适合富含胶原纤维的样本成像,如角膜、鼠尾肌腱、皮肤等。生物组织产生的二次谐波最主要的转换源自胶原,不同生物组织中的二次谐波信号强弱与组织中的胶原含量密切相关,含胶原丰富的组织包括结缔组织和肌肉组织等二次谐波信号也比较强,另外还有一些能产生强二次谐波的生物结构是微管,如细胞分裂中纺锤体。对于具有中心对称性的生物结构,如果局部中心对称性的破坏也会产生二次谐波:在两中心对称介质的界面,不同物态分子的相互作用使局部微观场特性在交界面(如细胞膜)发生突变,从而产生界面二次谐波[7]。除了动物组织外,一些含有特殊分子结构的植物组织也能产生二次谐波。二次谐波显微成像具有高空间分辨率、深成像深度、低损伤、以及对结构对称性的高度敏感性的特点,如果能与其他成像技术结合,将成为生物样品研究的有力工具[8]。3.5双光子荧光寿命成像(TP-FLIM)[9]FLIM技术是研究细胞内生命活动状态的一种非常可靠的方法。荧光寿命是荧光团在返回基态之前处于激发态的平均时间,是荧光团的固有性质,因此其不受探针浓度、激发光强度和光漂白效应等因素影响,且能区分荧光光谱非常接近的不同荧光团,故具有非常好的特异性和很高的灵敏度。此外,由于荧光分子的荧光寿命能十分灵敏地反映激发态分子与周围微环境的相互作用及能量转移,因此FLIM技术常被用来实现对微环境中许多生化参数的定量测量,如细胞中折射率、黏度、温度、pH值的分布和动力学变化等,这在生物医学研究中具有非常重要的意义。目前FLIM技术在细胞生物学中一些重要科学问题的研究、临床医学上一些重大疾病的诊断与治疗研究以及纳米材料的生物医学应用研究等方面均有广泛应用,并取得了许多利用传统的研究手段无法获取的数据。FLIM检测需要脉冲激光,TPLSM带有的高能量锁模脉冲激光器可以满足激发要求。3.6荧光寿命-荧光共振能量转移成像(FLIM-FRET)[10]传统的FRET过程分析通常是基于荧光强度成像来实现,分析的结果容易受光谱串扰的影响。而将FLIM技术应用于FRET过程分析,利用FLIM技术可定量测量这一优势,可非常灵敏地反映供体荧光分子与受体荧光分子之间的能量转移过程。当受体分子与供体之间的距离10nm时,供体的能量转移到受体,受体从基态发生能量跃迁,从而影响供体的荧光寿命。与没有受体分子的时候相比,发生FRET的供体分子的荧光寿命降低。因此,FRET-FLIM联合能够实时监测生物细胞中蛋白质的动态变化,如蛋白质折叠、分子间(蛋白-蛋白,蛋白-核酸)相互作用和细胞间信号分子传递、分子运输以及病理学研究等。[b]4 结论和展望[/b]综上,TPLSM应用灵活,具备多种检测模式,适用于多种样本,亦可实现多种实验目的,如荧光的定量、定性、定位、共定位,动态荧光的测定等。一些特殊的实验模式,将TPLSM在生物医学领域的应用进一步扩大。通过结合其他技术(多手段联合拓展,如膜片钳、原子力显微镜、光电联用等),TPLSM必将成为助力生物医学领域研究的有力工具。双光子荧光成像由于具有天生的三维层析能力以及深穿透能力,在活体生物组织成像上广受欢迎。双光子显微镜镜下空间增大后,可广泛应用于猴、大小鼠、兔等较大的模式动物的活体成像。且可结合电生理技术、光遗传技术,广泛应用于麻醉、清醒或运行行为等生理状态下的动物脑科学神经相关研究,在单细胞、单树突精度上对神经元群体活动进行监控。如结合膜片钳技术,对活体脑组组急性切片神经元进行双光子深层成像[11];结合光遗传技术,实现视觉皮层同一神经元和神经元群体的稳定操控和长期多次重复记录[12];对在健身球上移动的头部固定小鼠小脑进行成像,探讨觉醒状态和运动行为对胶质网络中钙离子的激发的影响[13];结合多种疾病模型,探讨大脑皮层神经元及胶质细胞活性的改变及作用等[14]。随着多种双光子显微镜系统的出现,双光子显微镜成像技术将以其实时、无损地探测、诊断及检测能力,在生物医药及临床医学应用中发挥更大作用。[b]参考文献[/b][1] [font=宋体]李娟[/font],[font=宋体]张岚岚[/font],[font=宋体]吴珏珩[/font].[font=宋体]双光子显微镜的应用优势与维护要素[/font][J].[font=宋体]中国医学装备[/font],2021,18(12):158-163.[2] HendelT,Mank M, Schnell B,et al.Fluorescence changes of genetic calcium indicatorsand OGB1correlated with neural ac tivity and calcium in vivo and in vitro[J].JNeurosci, 2008,28(29):7399-7411.[3] DolginE.What leva lamps and vinaigrette can teach us about cellbiology[J].Nature,2018,555(7696):300-302.[4] Noguchi J,Nagaoka A, Watanabe S,et al.in vivo two-photon uncaging of glutamate revealingthe structure-function relatio nships of dendritic spines in the neocortex ofadult mice[J]. J Physiol,2011,589(Pt 10):2447-2457.[5] BishopD,Nikiél, Brinkoetter M,et al.Nearinfrared branding efficiently correlateslight and electron microscopy[J]. Nat Methods,2011,8(7):568-570.[6] [font=宋体]刘皎[/font],[font=宋体]丛馨[/font],[font=宋体]何其华[/font].[font=宋体]活体小鼠微血管血流倒置双光子激光扫描显微镜检测方法的建立[/font][J].解剖学报,2022,53(02):261-265.[7] [font=宋体]屈军乐[/font],[font=宋体]陈丹妮[/font],[font=宋体]杨建军[/font],[font=宋体]许改霞[/font],[font=宋体]林子扬[/font],[font=宋体]刘立新[/font],[font=宋体]牛憨笨[/font].[font=宋体]二次谐波成像及其在生物医学中的应用[/font][J].[font=宋体]深圳大学学报[/font],2006,(01):1-9.[8] [font=宋体]孙娅楠[/font],[font=宋体]赵静[/font],[font=宋体]李超华[/font],[font=宋体]等[/font].[font=宋体]二次谐波结合双光子荧光成像方法观察人源胶原蛋白透皮吸收情况[/font][J].激光生物学报,2017,26(1):24-29.[9] [font=宋体]刘雄波,林丹樱,吴茜茜,严伟,罗腾,杨志刚,屈军乐,荧光寿命显微成像技术及应用的最新研究进展。物理学报,[/font]2018,67(17):178701-1-178701-14[10] [font=宋体]罗淋淋,牛敬敬,莫蓓莘,林丹樱,刘琳,荧光共振能量转移[/font]-荧光寿命显微成像(FRET-FLIM[font=宋体])技术在生命科学研究中的应用进展。光谱学与光谱分析,[/font]2021,41(4):1023-1031[11] Isom-BatzG,Zimmem PE.Collagen injection for female urinary incontinence after urethralor periurethral surgery[J].J Unol,2009,181(2):701-704.[12] JuN,Jiang R,Mrcknik SL,et al.Long-term all-optical interrogation of corticalneurons in awake-behaving nonhuman prim ates[J].LOSBiology,2018,16(8):e2005839.[13]Nimmerjahn A,Mukamel EA, Schnitzer MJ.Motor behavior activates Bergmann glialnetworks[J].Neuron,2009,62(3):400-412.[23] Huang L, Lafaille JJ, YangG.LearningDependent dendritic spine plasticity is impaired in spontaneousautoimmune encep halomyelitis[J].Dev Neurobiol,2021,81(5):736-745.[14] Huang L,Lafaille JJ,Yang G.LearningDependent dendritic spine plasticity is impaired inspontaneous autoimmune encep halomyelitis[J].Dev Neurobiol, 2021,81(5):736-745.
共聚焦显微系统(LSCM)诞生至今,短短二十多年里,已经成为了科学研究的重要工具。在我国生命科学研究领域,也发挥着巨大的作用。如何更好利用激光共聚焦技术,推动生命科学研究,受到了学术界的广泛关注。 激光共聚焦显微镜作为光学显微镜的重大改进,与传统场式(widefield)照明显微镜相比有许多独特的优点, 它可以控制焦深、照明强度,降低非焦平面光线噪音干扰,从一定厚度标本中获取光学切片。可以在不改变普通荧光显微镜的制片方法的前提下,观察到非常清晰的高质量图像,并且通过共聚焦显微镜可以十分方便的观察活的细胞或组织。 它的诞生,大大提高了科学研究的效率。目前共聚焦显微镜在国内的应用已经相当广泛,在越来越多的国家级科研院所与高校实验室,都能看到科研工作者忙碌在共聚焦显微镜前的身影。以下为奥林巴斯品牌类显微镜:智能激光扫描共聚焦显微镜——FV10iFV1000MPE:只关注多光子荧光成像FluoView™ FV1000共聚焦显微镜DSU转盘扫描显微镜奥林巴斯FluoView™ FV300(已停产)大家了解多少?欢迎讨论用后感想。
请问倒置荧光显微镜与激光共聚焦显微镜功能上有什么区别现在有一台倒置荧光显微镜不知道能不能用来进行钙离子荧光探针标记的测定,我看文献上大多使用激光共聚焦显微镜,激发波长488nm,不知道倒置荧光显微镜能不能实现相同的目的
一、前沿2009年10月6日,瑞典皇家科学院宣布,将2009年诺贝尔物理学奖的一半授予美国科学家威拉德• 博伊尔和乔治• 史密斯,因为他们于1969年发明了半导体集成电路成像技术,CCD感应器。经过四十年的发展,CCD技术由实验室逐步走向了市场,具有越来越广阔的应用。CCD数码成像对摄影产生了革命性的影响。在感光胶片之外,人们可以通过电子电路捕捉图像,这些以数字形式存在的图像更加易于处理和分发。数字图像已经成为许多研究领域中不可替代的重要工具。数码成像技术应用到显微镜上,以替代以往的胶卷拍摄,现在已经广泛应用了。以前我们用胶卷来进行显微拍摄,要等一卷拍完,冲洗出来才能确定拍摄的图像是否清晰,如果拍摄的图像不理想,而显微观察的样品又失效了,就需要重新制作样品,给研究工作带来很大的不便,而现在使用显微数码相机来拍摄显微图像,所见即所得,当时就是保存处理,甚至统计分析,极大的提高了工作效率。二、显微数码成像系统的组成显微数码成像系统包括CCD/CMOS专业相机,图像采集处理软件,显微镜接口,数据传输线等,其中最核心的设备是CCD和CMOS图像传感器,前者由光电耦合器件构成,后者由金属氧化物器件构成。两者都是光电二极管结构感受入射光并转换为电信号,主要区别在于读出信号所用的方法。CCD(Charge Coupled Device ,感光耦合组件)上感光组件的表面具有储存电荷的能力,并以矩阵的方式排列。当其表面感受到光线时,会将电荷反应在组件上,整个CCD上的所有感光组件所产生的信号,就构成了一个完整的画面。CCD的结构分三层 ,第一层“微型镜头”“ON-CHIP MICRO LENS”,这是为了有效提升CCD的总像素,又要确保单一像素持续缩小以维持CCD的标准面积,在每一感光二极管上(单一像素)装置微小镜片。CCD的第二层是“分色滤色片”,目前有两种分色方式,一是RGB原色分色法,另一个则是CMYG补色分色法。原色CCD的优势在于画质锐利,色彩真实,但缺点则是噪声问题。第三层:感光层,这层主要是负责将穿过滤色层的光源转换成电子信号,并将信号传送到影像处理芯片,将影像还原。数码成像的核心器件除CCD,现在越来越多的使用CMOS(Complementary Metal-Oxide Semiconductor,互补性氧化金属半导体,CMOS和CCD一样同在数码相机中可记录光线变化的半导体。CMOS传感器中每一个感光元件都直接整合了放大器和模数转换逻辑,当感光二极管接受光照、产生模拟的电信号之后,电信号首先被该感光元件中的放大器放大,然后直接转换成对应的数字信号。CMOS的优势在于成本低,耗电需求少,便于制造, 可以与影像处理电路同处于一个芯片上,缺点是较容易出现杂点。三 显微镜成像系统相关参数对CCD/CMOS数码成像系统的结构和原理有了一个基本了解后,我们再对成像系统的一些基本参数作一个说明。在实际应用中,很多用户对像素多少很敏感,一上来就提到我要多少万像素的成像系统,其实在专业成像应用中,像素多少只是影响成像的一个因素,还有其他很多指标,包括分辨率,感光器件大小,动态范围,灵敏度,量子效率,信噪比等。感光器件的面积大小是衡量显微成像系统质量的一个重要指标,感光器件的面积越大,捕获的光子越多,感光性能越好,信噪比越低。当前数码成像系统中较常应用的感光器件规格如下:1英寸(靶面尺寸为宽12.7mm*高9.6mm,对角线16mm),2/3英寸, 1/2英寸,1/3英寸,另外有时也用到1/1.8英寸,1/2.5英寸的CCD/CMOS感光器件。 像素是CCD/CMOS能分辨的最小的感光元件,显微数码成像系统的像素由低到高有:45万左右,140万左右,200万左右,300万左右,500万左右,900万像素,甚至还有更高的达到2000万像素以上。一般来说,像素越高,图像分辨率越高,成像也就越清晰,但有时候图像分辨率达到一定程度后,就不是影响成像质量的主要指标了。比如图像分辨率高,噪声也很高时,成像质量也不会很好。暗电流是导致CCD噪音的很重要的因素。暗电流指在没有曝光的情况下,在一定的时间内,CCD传感器中像素产生的电荷。我们在做荧光拍摄的时候,需要的曝光的时候比较长,这样导致CCD产生较多的暗电流,对图像的质量影响非常大。通常情况下通过降低CCD的温度来最大限度的减少暗电流对成像的影响。Peltier制冷技术一般可将CCD温度降低5-30°C,在长时间拍摄或一次曝光超过5-10秒,CCD芯片会发热,没有致冷设备的芯片,“热”或者白的像素点就会遮盖图像,图像会出向明显的雪花点。CCD结构设计、数字化的方法等都会影响噪音的产生。当然通过改善结构、优化方法,同样能减少噪音的产生。显微荧光或其他弱光的拍摄对CCD噪音的降低要求很高,应选用高分辨率数字冷却CCD成像系统,使其能够捕获到信号极其微弱的荧光样品图像,并且能够最大程度的降低噪音,减少背景,提供出色的图像清晰度。所以一般在荧光及弱光观察时需要选择制冷CCD。在显微数码成像过程中,对于荧光及弱光的拍摄,除了制冷降低热噪声外,还可使用 BINNING技术提高图像的灵敏度,BINNING像素合并是一种非常有用的功能,它可被用来提高像素的大小和灵敏度,比如摄像头像素大小为5u,当经过2x2合并后,像素大小为10u,3X3合并后,像素大小为15u, 这是图像的整体像素变少了,但成像的灵敏度可提高9倍。动态范围表示在一个图像中最亮与最暗的比值。12bit表示从最暗到最亮等分为212=4096个级别,16bit即分为216个级别,可见bit值越高能分出的细微差别越大,一般CMOS成像系统动态范围具有8-10bit, CCD以10-12bit为主,少部分可达16bit。对动态范围进行量化需要一个运算公式,即动态范围值 = 20 log (well depth/read noise),动态范围的值越高成像系统的性能就越好。量子效率也称像素灵敏度,指在一定的曝光量下,像素势阱中所积累的电荷数与入射到像素表面上的光子数之比。不同结构的CCD其量子效率差异很大。比如100光子中积累到像素势阱中的电荷数是50个,则量子效率为50%(100 photons = 50 electrons means 50% efficiency)。值得注意的是CCD 的量子效率与入射光的波长有关。对显微数码成像系统的参数有了整体认识后,在实际应用中选择合适型号的产品就比较容易了。高分辨率显微数码成像技术在国外已有二十来年的发展历史,产品目前已比较成熟。国外的专业数码产品有多个品牌,比较著名的有德国的ProgRes,美国Roper Scientific的系列产品,另外OLYMPUS、NIKON、LEICA、ZEISS等显微镜厂家也有一些配套的专业数码成像系统 。其中CCD成像系统主要采用SONY及KODRA公司的芯片,因此相关产品性能差别不是很大。国内专业数码成像产品的设计制造时间还不长,但随着配套技术的成熟,100万像素以上的CCD/CMOS专业数码成像产品开始陆续推出,主要的专业厂家有北京的大恒、微视、杭州欧普林,广州明美等企业。北京大恒早期主要研发生产图像采集卡,目前可以量产140万像素的CCD摄像头,130万/200万/320万/500万像素CMOS摄像头,主要用到工业领域。

[em09503]关于激光共聚焦显微镜的3D成像噪声控制,高手进来讨论一下。1 噪声产生的原理?2 激光的强度、补偿以及针孔直径对噪声的影响有什么规律?3 采用更大的分辨率和更慢的激光扫描速率以及多次平均扫描能否更好的控制噪声?4 还有什么其他有效的方法?[em09511]附几张带有噪声的图片,有兴趣的我可以提供原始文件(ZEISS的LSM格式)。[img]http://ng1.17img.cn/bbsfiles/images/2017/01/201701191651_625647_1633980_3.jpg[/img][img]http://ng1.17img.cn/bbsfiles/images/2009/05/200905301042_152604_1633980_3.jpg[/img][img]http://ng1.17img.cn/bbsfiles/images/2009/05/200905301042_152605_1633980_3.jpg[/img]
我是一位新手求助各位:荧光显微镜的激光与检测 滤光片是如何选取的?有没有什么原则,就是那些红色、蓝色、绿色片的选择定则?是否 跟发射波长有关?
为何荧光显微镜需要使用制冷CCD相机?众所周知,荧光显微镜是利用被观测物体发出荧光来进行观测的显微镜。在外部光源的激发下,被检测物体发出荧光,从而进行观察。与普通显微观察不同的是,荧光显微镜并不直接使用外部光源,而是使用被观测物体发出的荧光。相比普通光源,荧光光源的强度要小得多,反映到成像上面,即意味着相比普通显微拍摄的曝光时间,荧光拍摄的曝光时间要长得多。但是,单方面的延长曝光时间,并不能得到好的显微荧光图像,因为随着曝光时间的增强,噪声也大幅度的的增加,严重影响了成像质量。科学家研究发现,由于曝光时间延长而导致的噪声的增加主要来自于CCD产生的暗电流噪声,于是冷CCD应运而生。所谓冷CCD,就是利用一定的制冷技术对CCD芯片进行制冷,让它在较低的温度下进行工作,从而有效的降低暗电流噪声。所以荧光显微镜的图像采集需要配套制冷CCD才能得到满意的图片,因为荧光的强度不足可见光的万分之一,这就决定采集荧光图像的CCD必须具备很高的灵敏度,为了消除图像采集过程中,因亮度不足而出现的噪点,最好采用制冷CCD来完成。无锡超微光学的LC-140A/500A显微荧光成像制冷CCD,是一款研究级的显微荧光成像专用相机,最适用于极弱光和微光的应用及提供最佳颜色还原和灵敏度的显微荧光成像专业用CCD,图像传感器具有高动态范围,优秀的灵敏性,配合12位数据采样输出,并支持2 x 2,4 x 4硬件binning。,具有小型化、操作简单、性能稳定等特点,适用在Nikon,leica,Zeiss,Olympus等显微镜上。提供企业或研究单位在化学发光成像分析、多色荧光成像分析等之研究及应用领域。
我是一位新手求助各位:荧光显微镜的激光与检测 滤光片是如何选取的?有没有什么原则,就是那些红色、蓝色、绿色片的选择定则?是否 跟发射波长有关?

http://ng1.17img.cn/bbsfiles/images/2017/10/2016082816541190_01_3092793_3.jpg YEESPEC智能细胞成像系统已全面升级:强大的配置与功能,高品质成像质量,更方便的显微操作,绝对能带给您眼前一亮的全新体验。 作为新一代的智能细胞成像系统,它比传统显微镜操作要方便许多,所有的操作工程都可以通过前面的触摸控制屏完成。只要轻轻地点几下屏幕,就可以轻松地完成整个细胞成像过程,包括:镜头切换、荧光切换、聚焦。 同时,因为设计的小巧,我们也可以把它放在培养箱或者安全柜里使用,可以边做实验室边观察。 YEESPEC智能细胞成像系统,更是科研的得力助手。与传统活细胞工作站相比,它具有更强大的功能特点。 1、 操作方便,即开即用: 采用全触控屏操作,也可以通过手机端平板端进行操作;荧光光源采用高亮度LED光源,不需要预热。 2、 成像质量好,光路的主要元器件均采用原装进口: 采用顶级CCD芯片、原装进口长工作距离荧光物镜、Omega荧光滤光片、K9光学玻璃载物台,透过率非常高。 3、 没有耗材,使用成本低: 采用高亮度白色LED,荧光光源采用高亮度单色LED。LED的寿命是5万个小时以上,基本上仪器买回去10年都不用更换。 4、保证实验安全: 内部装有两块10000mAh,12V的电池,短时间观察使用时可以不需要接电源,即使停电也可以完成实验,保证了实验安全。
激光共聚焦显微镜系统(confocal system)的应用 1、细胞的三维重建:激光共聚焦显微镜能以0.1μm的步距沿轴向对细胞进行分层扫描,得到一组光学切片,经A/D转换后作为二维数组贮存。这些数组通过计算机进行不同的三维重建算法,可作单色或双色图像处理,组合成细胞真实的三维结构。旋转不同角度可观察各侧面的表面形态,也可从不同的断面观察细胞内部结构,测量细胞的长宽高、体积和断层面积等形态学参数。通过模拟荧光处理算法,可以产生在不同照明角度形成的阴影效果,突出立体感。通过角度旋转和细胞位置变化可产生三维动画效果。激光共聚焦显微镜的三维重建广泛用于各类细胞骨架和形态学分析、染色体分析、细胞程序化死亡的观察、细胞内细胞质和细胞器的结构变化的分析和探测等方面。 2、细胞定量荧光测定激光共聚焦显微镜以激光为光源,对细胞分层扫描,单独测定,经积分后能得到细胞荧光的准确定量,重复性极佳。它适于活细胞的定量分析,可测定细胞内溶酶体、线粒体、DNA含量、RNA含量、酶和结构性蛋白质等物质含量和分布,常用于原位分子杂交、肿瘤细胞识别、单个活细胞水平的DNA损伤及修复的定量分析。它适于快速高灵敏度测量,减少光猝灭的影响,在定量免疫荧光测定方面应用广泛,如作各种肿瘤组织切片抗原表达的定量分析,监测肿瘤相关抗原表达的定位定量信息,监测药物对肌体免疫功能的作用,监测自身免疫性疾病的多种抗原及药物对肌体免疫功能的作用,监测细胞结合和杀伤的形态特征并作定量分析等。细胞定量荧光测定可选用单荧光、双荧光方式,能自动测定细胞面积、平均荧光强度、积分荧光强度及形状因子等多种参数。 3、细胞内钙离子pH值和其它离子的动态分析通过一些专用荧光探针,可对细胞内钙离子、钠离子及pH值等作荧光标记,并对它们进行比率值和浓度梯度变化测定。由于细胞内钙离子为传递信息的第二信使,对细胞生长分化起着重要作用,通过单标记或双标记对细胞内钙离子和其它离子的荧光强度和分布精确测定,测定样品达到毫秒级的快速变化。借助光学切片功能可以测量样品深层的荧光分布以及细胞光学切片的生物化学特性的变化。通过不同时间段的检测可测定细胞内离子的扩散速率,了解它对肿瘤启动因子、生长因子等刺激的反应。细胞内离子测量广泛用于肿瘤研究、组织胚胎学、细胞生物学和药理学等领域。 4、细胞胞间通信和膜的流动性动物和植物细胞中缝隙连接介导的胞间通信在细胞增殖和分化中起着重要作用。通过测量细胞缝隙连接分子的转移,可以研究肿瘤启动因子和生长因子对缝隙连接介导的胞间通信的抑制作用及细胞内钙离子、pH值等对缝隙连接作用的影响,并监测环境毒素和药物在细胞增殖和分化中所起到的作用。选定经荧光染色后的细胞,借助于光漂白作用或光损伤作用使细胞部分或整体不发荧光,实时观察检测荧光的恢复过程,可直接反映细胞胞间通信结果。 细胞膜的流动性在进行膜的磷脂酸组成分析,药物作用点和药物作用效应,测定温度反应和物种比较方面有重要作用。细胞膜荧光探针受到极化光线激发后,发射光极性依赖于荧光分子的旋转,这种有序的运动自由度取决于荧光分子周围的膜流动性,所以极性测量能间接反映细胞膜的流动性。

三维显微激光拉曼光谱仪三维显微激光拉曼光谱仪装置Nanofinder30 Nanofinder30 三维显微激光拉曼光谱仪装置是日本首创,世界最初的分析装置。它能在亚微米到纳米范围内,测定物质化学状态的三维图像。它由共焦激光显微镜,压电陶瓷平台(或电动扫描器)和光谱仪组成。并能自选追加原子力显微镜和近场表面增强拉曼测定的功能。 最新测量数据[ 变形Si的应力测定]PDF刊登 用二维的平面分析来评价变形Si。空间分辨率130nm, 变形率0.01%(0.1cm偏移)。 半导体/电子材料(异状物,应力,化学组成,物理结构)薄膜/保护膜(DLC,涂料,粘剂)/界面层,液晶内部构造结晶体(单壁碳纳米管,纳米晶体)光波导回路,玻璃,光学结晶等的折射率变化生物学(DNA, 蛋白质, 细胞 组织等) 以亚微米级分辨率和三维图像,能分析物质的化学结合状态空间分辨率200nm(三维共焦点模式),50nm(二维TERS模式)能同时测定光谱图像(拉曼/萤光/光致荧光PL),共焦显微镜图像,扫描探针显微镜图像(AFM/STM)和近场表面增强拉曼图像(SERS)能高速度,高灵敏度地测定样品(灵敏度:与原来之比10倍以上)不需要测定前样品处理,在空气中能进行非破坏测定全自动马达传动系统的作用,测定简单 共焦显微镜模式不能识别结晶缺陷,然而光致荧光(PL)模式却能清楚地测到结晶缺陷 共焦激光显微镜模式的形状测定 光谱窗 560 nm 用光致荧光(PL)模式测到的结晶缺陷的光谱图像(560nm的三维映像) 用AFM和共焦显微拉曼法同时测定CNT,能判定它的特性 (金属,半导体)和纯度。 同时测定单壁碳纳米管(CNT)的原子力显微镜(AFM) 形貌图像和拉曼光谱图像的例子 :拉曼光谱: 激光488nm,功率1.5mW,曝光时间2 sec,物镜100×Oil, NA=1.35, 积分时间100 sec (AFM和拉曼图像测定时) AFM形貌图像(右上)表示了单壁碳纳米管混合物的各种形状结构。图像中用数字1到8来表示其不同形状。数字1-6测得了拉曼光谱(上图所示),判定为半导体CNT。但7-8测不到拉曼光谱,所以不是半导体CNT,而可能是金属CNT(可用He-Ne激光633nm验证)。最上面表示了RBM(173cm-1), G-band(1593cm-1)及D-band(1351cm-1)的拉曼光谱图像 综合激光器和光谱分析系统的长处,坚固耐用的复合设计,卓越的仪器安定性,是纳米技术测定装置中的杰出产品。 ※日本纳米技术2004大奖“评价和测量部门”得奖. ※日本第16届中小企业优秀技术和新产品奖 “优良奖”得奖. 光学器件配置图Nanofinder30 [img]http://ng1.17img.cn/bbsfiles/images/2008/12/200812071751_122565_1634361_3.jpg[/img][img]http://ng1.17img.cn/bbsfiles/images/2008/12/200812071751_122566_1634361_3.jpg[/img][~122567~][~122568~]
激光扫描共聚焦显微镜还能这么用! 众所周知,激光共聚焦显微镜主要的应用方向在观察活细胞结构及特定分子、离子的生物学变化,而在石笋这样的样品观察上使用激光扫描共聚焦显微镜,可以说脑洞大开了!让我们来看看原文,从Nikon A1激光扫描共聚焦显微镜使用者的角度看看,怎么把这个工具用活了! 激光扫描共聚焦显微镜在古气候纹层学的应用 第一作者:赵景耀 通讯作者:程 海 1984年第一台商业化的激光扫描共聚焦显微镜(Laser Scanning Confocal Microscope,简称 LSCM)出现,随之共聚焦显微镜技术成为了一个热点,并广泛应用在国内外生物和工业检测领域。现今,我们将LSCM首次应用于国内古气候纹层学研究。纹层学一直是古气候研究重要内容,特别是荧光微层在很多古气候载体中是重要的年代标尺和气候指标。2000年,Ribes等首次将LSCM应用于石笋荧光微层研究,发现LSCM分辨率可达1μm,因此,可适用于各种不同厚度的石笋年纹层;2008年,Orland等将LSCM与离子探针采样结合,首次发现了石笋δ18O的季节性信号,并表示以色列Soreq Cave单层δ18O季节波动可达2.15‰;2010年,Dasgupta等通过LSCM识别石笋纹层中的碎屑和粘土层,据此重建了美国明尼苏达州过去3000年极端暴雨事件,发现20世纪全球升温以来,其暴雨频率明显增加;2015年,Wendt利用LSCM,在巴西TBV Cave石笋纹层中发现了罕见的“双纹层”,且均出现在高生长速率的Heinrich事件期间,认为这与Heinrich期间,Intertropical Convergence Zone(ITCZ)南支南移所导致一年内存在2个雨季有关;2015年,Orland等再次将LSCM与离子探针技术应用于中国苦栗树洞石笋研究,发现全新世和B?lling-Aller?d暖期的夏季降水比例明显多于Younger Dryas时期。而目前,国内主要依赖于普通透射光和荧光显微镜,这一定程度上限制了国内古气候学研究。笔者在西安交通大学机械制造系统工程生物制造中心,利用购置的LSCM组件(图1a),观察石笋“年纹层”和砗磲“天纹层”,取得初步认识,以下分别就LSCM及其在古气候荧光微层方面的应用及注意事项作一简介。 图1 激光扫描共聚焦显微镜(LSCM)组件(a)及其原理(b) 1.倒置荧光显微镜(Inverted fluorescence microscope);2.荧光探测器(Flurescence detector);3.激光发生器(Laser generator);4.LSCM总控制器(Main controller);5.扫描头(Head of laser scanner);6.明场及电动载物台开关(Switch of bright-field microscopy and electric stage);7..荧光光源开关(Switch of fluorescent source);8.电动载物台(Electric stage);9.LSCM连接电脑(Computer and Monitor) LSCM以激光为点光源,由照明针孔与探测针孔对被探测点的共轭关系(图1b),实现对被探测点所在焦面的逐点激发,逐点扫描,该技术称为共聚焦。与普通荧光显微镜一次性照明整个视野不同,LSCM通过逐点扫描探测,呈现标本荧光层的2维或3维图像(图2),因此其对不同焦点和焦面的辨析能力,是普通荧光显微镜所不能达到的。其中,图2a中3D切片z轴步进间距(即焦面间距)为3μm,当前仪器上限25nm(仪器型号:Nikon A1)。在LSCM标本纹层成像过程中,放置于探测器前的探测针孔(Pinhole)(图1b)起着关键作用,有效地阻挡了不同焦点带来的杂散光,只有被探测点所发射的荧光透过Pinhole,到达探测器形成图像,这对图像对比度和分辨率有重要影响(图2)。而且LSCM采用光电倍增技术,可将微弱荧光信号进一步放大。综上,利用LSCM可以真正地实现10μm级荧光纹层的清晰辨别,其分辨率和辨识度是普通荧光显微镜所不能实现的,在此基础我们可以观察并辨别10μm左右石笋“年纹层”(图2d)和3~5μm级别砗磲“天纹层”(图2e)。 图2 石笋荧光层3D切片拟合(a)、石笋荧光“年纹层”(b、c和d)和砗磲荧光“天纹层”(e) 所有图像在1024扫描分辨率下,利用波长为488-nm的蓝色激光作为激发光源激发,然后用荧光滤光片滤选发射波长为505~539nm绿色发射光,最终被检测器探测并扫描成像;图片(a)由LSCM连续拍摄31层平行荧光焦面拟合而成,3μm/层;石笋样品(a)和(c)取自湖北省犀牛洞,(b)取自南京葫芦洞,(d)取自吉林省琉璃洞;(e)砗磲取自中国南沙群岛永暑礁 不同于普通光学显微镜,通过制作极薄的显微镜[url=http://www.gengxu.cn]滤光片[/url](≤1mm)实现对于杂散光或荧光焦面的控制。LSCM装配倒置荧光显微镜直接对古气候标本切面观察,源于LSCM对不同焦面荧光信号的精准解析和辨别能力,对于石笋和砗磲等古气候标本,无需制作显微镜薄片,只需将样品切面抛光磨平,即可实现对抛光表面荧光微层和透光微层定焦高分辨率扫描。LSCM极大地简化标本处理,不仅能够更好地节约和保护标本,且能和其他分析(如稳定同位素分析)在同一样品上进行,有利于精细对照,对于古气候研究有重要意义。例如,最近Li等在其他方法精确定年困难的情况下,利用LSCM方法精确确定了近百年石花洞的石笋样品年代序列;对著名的南京葫芦洞样品的初步工作显示,将能够重建上个冰期精细到年的时间序列及气候变化的变率(图2b),而又不破坏极其珍贵的样品。 但是由于LSCM以激光作为光源,在镜下观察过程中发现,根据物镜倍数(10×、20×、40×、60×和100×)不同,导致激光聚光强度不同,会出现不同程度的荧光猝灭,对于常用倍数10×和20×,荧光猝灭微弱,肉眼无法识别,可忽略。但是在60×油镜及以上倍数,荧光猝灭快速,因此在使用过程中,要注意调焦与拍摄时间的平衡。另外,计算机对焦过程是纳米级对焦,在标本前期处理过程中,保证样品观察面平整,是快捷对焦、自动扫描和拼接大图的工作基础。对于目前使用的型号Nikon A1,由于LSCM电动载物台承重和规格限制,以及明场聚光器位置限制(图1a),要求古气候标本观察面≤6cm×6cm,厚度≤5cm,但可根据需要选择不同型号的载物台。最后,由于各种LSCM在许多研究机构和医学院都具备,且使用费用不高,因此进行该研究不必购置新设备。
[align=left][font=宋体][color=#374151]摘要:光学显微成像技术在神经科学研究中发挥着不可或缺的作用。文章将深入探讨两种主要的光学显微成像技术,即荧光显微镜和多光子显微镜,在神经科学领域的应用案例。我们首先介绍了这些技术的基本原理和发展历程,然后详细描述了它们在神经细胞成像、突触可塑性研究和脑功能成像中的应用。通过这些案例,我们展示了光学显微成像技术在神经科学研究中的重要性,以及它们对我们深入理解神经系统的贡献。[/color][/font][/align][font=宋体][color=#374151]关键词:神经科学、荧光显微镜、多光子显微镜、神经细胞成像[/color][/font][font=宋体][color=#374151]光学显微成像技术自17世纪以来一直在科学研究中扮演着重要的角色。随着技术的不断发展,光学显微镜已经成为许多科学领域的核心工具之一,尤其在生命科学和神经科学领域。文章将深入探讨光学显微成像技术在神经科学研究中的应用案例,重点介绍荧光显微镜和多光子显微镜这两种主要技术的原理和应用。[/color][/font][font=宋体][color=#374151]一、光学显微成像技术应用[/color][/font][font=宋体][color=#374151]1.荧光显微镜的应用[/color][/font][font=宋体][color=#374151]荧光显微镜是一种广泛应用于神经科学研究的工具,它使用荧光染料或标记物来可视化和研究神经系统的结构和功能。以下是荧光显微镜在神经科学研究中的应用案例,包括神经细胞成像、突触可塑性研究、脑疾病研究等方面。[/color][/font][font=宋体][color=#374151](1)神经细胞成像[/color][/font][font=宋体][color=#374151]荧光显微镜在观察和研究神经细胞的结构和功能方面发挥了关键作用。通过使用荧光标记的抗体或分子探针,研究人员可以可视化神经元的不同结构,包括轴突、树突、细胞核等。这有助于研究神经细胞的形态特征以及它们在不同生理条件下的变化。[/color][/font][font=宋体][color=#374151](2)突触可塑性研究[/color][/font][font=宋体][color=#374151]荧光显微镜在突触可塑性研究中也具有重要应用。突触可塑性是指突触的结构和功能如何受到刺激和学习的影响。通过标记突触相关的蛋白质或分子,研究人员可以实时观察突触的变化,如突触增强或突触抑制,以深入理解学习和记忆的神经机制。[/color][/font][font=宋体][color=#374151](3)脑功能成像[/color][/font][font=宋体][color=#374151]荧光显微镜在脑功能成像方面也具有潜力。通过将钙指示剂或光遗传学标记物引入神经元,研究人员可以实时监测神经元的活动。这种技术使我们能够理解大脑不同区域的活动模式,以及不同刺激下神经元的响应。这对于研究认知过程、行为和神经疾病有着重要意义。[/color][/font][font=宋体][color=#374151](4)神经干细胞研究[/color][/font][font=宋体][color=#374151]荧光显微镜也被广泛用于研究神经干细胞。通过标记和追踪神经干细胞的命运和分化过程,研究人员可以理解神经系统的发育和再生机制。这对于神经系统修复和治疗神经系统疾病具有潜在应用。[/color][/font][font=宋体][color=#374151](5)荧光标记的蛋白表达[/color][/font][font=宋体][color=#374151]荧光显微镜也可用于研究不同蛋白质在神经系统中的表达和定位。通过使用荧光标记的蛋白表达技术,研究人员可以观察不同蛋白质的分布和相互作用,从而深入理解神经系统中的信号传导和调控。[/color][/font][font=宋体][color=#374151](6)脑疾病研究[/color][/font][font=宋体][color=#374151]荧光显微镜在研究脑疾病方面也发挥着关键作用。研究人员可以使用荧光显微镜来研究神经系统疾病的病理机制,如帕金森病、阿尔茨海默病和精神分裂症。这有助于发现潜在的治疗方法和药物筛选。[/color][/font][font=宋体][color=#374151]荧光显微镜在神经科学研究中的应用是多方面的,涵盖了神经细胞成像、突触可塑性研究、脑功能成像、神经干细胞研究、蛋白质表达和脑疾病研究等多个领域。这一技术为神经科学家提供了非常强大的工具,帮助他们深入理解神经系统的结构和功能,以及与神经相关的疾病的机制。未来,随着技术的不断发展,荧光显微镜将继续在神经科学领域中发挥关键作用,为我们揭示神经系统的奥秘提供更多的洞察力。[/color][/font][font=宋体][color=#374151]2.多光子显微镜的应用[/color][/font][font=宋体][color=#374151]多光子显微镜(Multi-Photon Microscopy)是一种先进的成像技术,它利用非线性光学效应,如多光子吸收,为神经科学家提供了强大的工具,用于研究神经系统的结构和功能。相比传统的荧光显微镜,多光子显微镜具有许多显著的优势,包括更深的成像深度、较少的光损伤、更少的荧光标记物和更高的空间分辨率。以下是多光子显微镜在神经科学研究中的应用领域:[/color][/font][font=宋体][color=#374151](1)脑功能成像[/color][/font][font=宋体][color=#374151]脑功能成像是多光子显微镜的一个主要应用领域。这种技术允许研究人员实时观察活体动物的脑活动,包括神经元的兴奋与抑制、突触传递和脑区之间的相互作用。多光子显微镜能够提供高分辨率的三维图像,而无需使用荧光标记物。这对于研究大脑的基本功能、学习和记忆等过程至关重要。[/color][/font][font=宋体][color=#374151](2)钙离子成像[/color][/font][font=宋体][color=#374151]钙离子在神经元内起着关键的信号传导作用。多光子显微镜可以用于监测神经元内的钙离子浓度变化,这对于理解神经元的兴奋性和突触传递至关重要。通过使用荧光钙染料,研究人员可以实时观察神经元内钙离子浓度的动态变化,以及不同神经元之间的协同作用。[/color][/font][font=宋体][color=#374151](3)神经元形态学研究[/color][/font][font=宋体][color=#374151]多光子显微镜在研究神经元的形态学和结构上也具有独特的优势。它可以提供高分辨率的三维成像,允许研究人员详细观察神经元的分支结构、突触连接和细胞器的分布。这对于理解神经元的连接方式、发展和退行性疾病的机制至关重要。[/color][/font][font=宋体][color=#374151](4)活体动物模型研究[/color][/font][font=宋体][color=#374151]多光子显微镜也在活体动物模型研究中发挥着关键作用。研究人员可以使用这种技术观察小鼠、果蝇等模型动物的脑活动,从而研究不同物种的神经系统功能和行为。这对于神经药理学、疾病建模和药物筛选具有重要意义。[/color][/font][font=宋体][color=#374151](5)细胞内成像[/color][/font][font=宋体][color=#374151]多光子显微镜也可用于单个神经元或突触的细胞内成像。这允许研究人员观察细胞内的亚细胞结构、蛋白质运输和突触形成等过程。这对于研究神经元的分子机制和突触可塑性非常有帮助。[/color][/font][font=宋体][color=#374151]多光子显微镜的应用领域不仅局限于神经科学,还扩展到其他生命科学领域,如细胞生物学、免疫学和生物医学研究。其高分辨率和深层成像能力使其成为许多领域中不可或缺的工具。[/color][/font][font=宋体][color=#374151]尽管多光子显微镜在神经科学研究中具有巨大的潜力,但它也面临着一些挑战。其中之一是成像速度,尤其在观察大脑活动时,需要高速成像以捕捉快速的神经事件。另一个挑战是数据处理和分析,因为高分辨率、三维和四维成像产生了大量的数据,需要强大的计算资源和分析工具。[/color][/font][font=宋体][color=#374151]未来,我们可以期待多光子显微镜技术的不断改进和发展,以应对这些挑战。新的激光技术、荧光标记物和成像算法将继续推动这一领域的进展,为我们深入理解神经系统的复杂性提供更多的洞察力。多光子显微镜将继续在神经科学领域中发挥关键作用,有望帮助我们解决一些最具挑战性的神经科学问题。[/color][/font][font=宋体][color=#374151]二、光学显微成像技术在神经科学研究中的应用存在问题[/color][/font][font=宋体][color=#374151]光学显微成像技术在神经科学研究中的应用虽然具有众多优势,但也存在一些问题和挑战,这些问题需要科研人员不断努力来解决。以下是一些存在问题:[/color][/font][font=宋体][color=#374151]1.有限的成像深度[/color][/font][font=宋体][color=#374151]传统的光学显微成像技术受到光的折射和吸收的限制,导致成像深度受到限制。这在研究深层脑区时成为问题,因为光无法有效透过多层组织,导致深层神经元无法清晰成像。多光子显微镜已经在这一方面取得了进展,但仍然存在深度限制。[/color][/font][font=宋体][color=#374151]2.光损伤和毒性[/color][/font][font=宋体][color=#374151]荧光标记物和强光源在成像过程中可能对生物样本产生光损伤和毒性作用。这对于活体成像和长时间观察是一个挑战,因为它可能导致样本的退化和死亡。科研人员需要努力寻找更温和的成像方法和标记物,以减轻这些问题。[/color][/font][font=宋体][color=#374151]3.数据量庞大[/color][/font][font=宋体][color=#374151]高分辨率和多维成像技术产生大量的数据,需要强大的计算资源和复杂的数据分析工具。处理和管理这些数据可能是一个挑战,尤其是在长期实验和大规模成像项目中。[/color][/font][font=宋体][color=#374151]4.标记物的选择[/color][/font][font=宋体][color=#374151]合适的荧光标记物对于获得高质量的成像数据至关重要。然而,选择适当的标记物可能会受到限制,因为一些标记物可能会干扰样本的正常生理活动,或者不适合特定的实验条件。因此,需要不断开发新的标记物和成像方法。[/color][/font][font=宋体][color=#374151]5.解析度限制[/color][/font][font=宋体][color=#374151]光学显微成像的分辨率受到光的波长限制,通常受到绕射极限的限制。虽然一些超分辨率成像技术已经出现,但它们仍然无法突破光学分辨率极限。这可能会限制对神经系统微观结构的精确观察。[/color][/font][font=宋体][color=#374151]6.活体成像的挑战[/color][/font][font=宋体][color=#374151]对于活体成像,尤其是在大脑中,样本的运动和呼吸等因素可能导致成像失真。稳定和精确定位样本是一个技术挑战。[/color][/font][font=宋体][color=#374151]尽管存在这些问题,光学显微成像技术仍然是神经科学研究的不可或缺的工具,因为它们提供了独特的实时、高分辨率和非侵入性的成像能力。科研人员不断努力解决这些问题,通过技术创新和改进,光学显微成像技术有望继续为神经科学领域的研究提供更多洞察力。[/color][/font][font=宋体][color=#374151]三、下一步研究方向[/color][/font][font=宋体][color=#374151]基于上述问题,光学显微成像技术在神经科学研究中的应用仍然需要不断改进和发展。下面是可能的下一步研究方向,以解决这些问题:[/color][/font][font=宋体][color=#374151]1.改进成像深度[/color][/font][font=宋体][color=#374151]研究人员可以探索新的成像方法,如双光子显微镜和光学波前调制成像,以增加成像深度。此外,开发新的光学透明样本制备技术,如透明大脑样本技术,可以帮助克服深度限制问题。[/color][/font][font=宋体][color=#374151]2.减少光损伤和毒性[/color][/font][font=宋体][color=#374151]研究人员可以寻找更温和的成像条件,减少光损伤和荧光标记物的毒性。此外,使用先进的成像系统,如自适应光学成像,可以减小激光功率,同时保持高分辨率。[/color][/font][font=宋体][color=#374151]3.数据管理和分析工具[/color][/font][font=宋体][color=#374151]开发更强大的数据管理和分析工具,以处理庞大的成像数据。机器学习和深度学习方法可以帮助提高数据分析的效率,并自动检测和量化细胞和结构。[/color][/font][font=宋体][color=#374151]4.标记物的改进:寻找更多、更具选择性的标记物,以减少对样本的干扰。这可以包括荧光标记物的改进、发展新的基因表达标记和探测技术。[/color][/font][font=宋体][color=#374151]5.突破分辨率极限[/color][/font][font=宋体][color=#374151]进一步发展超分辨率成像技术,以突破传统光学分辨率极限,获得更高的细节分辨率。例如,结构光显微镜和单分子成像技术可以帮助提高分辨率。[/color][/font][font=宋体][color=#374151]6.活体成像技术改进:研究人员可以探索新的样本固定和稳定技术,以减小样本运动对成像的影响。另外,开发新的活体成像方法,如头部悬置成像和小型显微成像技术,可以帮助在动态活体条件下进行成像。[/color][/font][font=宋体][color=#374151]7.多模态成像[/color][/font][font=宋体][color=#374151]结合不同的成像技术,如光学显微镜与电生理记录、光学显微镜与功能磁共振成像(fMRI)等,以获得更全面的神经科学数据。[/color][/font][font=宋体][color=#374151]8.多尺度成像[/color][/font][font=宋体][color=#374151]开发多尺度成像方法,能够在微观和宏观水平上同时观察神经系统的活动,从神经元到整个脑区。[/color][/font][font=宋体][color=#374151]这些研究方向代表了改进和扩展光学显微成像技术在神经科学研究中的应用的可能途径。通过不断的技术创新和跨学科合作,神经科学家和工程师有望克服这些问题,提高光学显微成像技术的效能和应用广度,以更深入地理解神经系统的复杂性。[/color][/font][font=宋体][color=#374151]四、结论[/color][/font][font=宋体][color=#374151]光学显微成像技术在神经科学研究中的应用案例清楚地表明,这些技术在揭示神经系统的复杂性和功能中起到了关键作用。然而,这仅仅是一个开始,未来仍有许多挑战和机遇等待我们探索。例如,新的成像技术和荧光标记方法的不断发展将进一步扩展我们的研究领域。此外,将光学显微成像技术与其他分子生物学和生物化学技术相结合,可以更全面地理解神经系统的功能。[/color][/font][font=宋体][color=#374151]在未来,我们可以期待更高分辨率、更深层次的成像以及更多三维和四维成像的发展。这将有助于解决神经科学中的一些最具挑战性的问题,如神经网络的复杂性和神经退行性疾病的机制。光学显微成像技术将继续为神经科学研究提供有力的工具,推动我们对大脑和神经系统的理解不断深入。[/color][/font][font=宋体][color=#374151]参考文献:[/color][/font][font=宋体][color=#374151][1]高宇婷,潘安,姚保利等.二维高通量光学显微成像技术研究进展[J].液晶与显示,2023,38(06):691-711.[/color][/font][font=宋体][color=#374151][2]王义强,林方睿,胡睿等.大视场光学显微成像技术[J].中国光学(中英文),2022,15(06):1194-1210.[/color][/font][font=宋体][color=#374151][3]章辰,高玉峰,叶世蔚等.自适应光学在双光子显微成像技术中的应用[J].中国激光,2023,50(03):37-54.[/color][/font][font=宋体][color=#374151][4]曹怡涛,王雪,路鑫超等.无标记光学显微成像技术及其在生物医学的应用[J].激光与光电子学进展,2022,59(06):197-212.[/color][/font][font=宋体][color=#374151][5]关苑君,马显才.光学显微成像技术在液-[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]分离研究中的应用[J].中山大学学报(医学科学版),2022,43(03):504-510.DOI:10.13471/j.cnki.j.sun.yat-sen.Univ (med.sci).2022.0319.[/color][/font][font=宋体][color=#374151][6]陈廷爱,陈龙超,李慧等.结构光照明超分辨光学显微成像技术与展望[J].中国光学,2018,11(03):307-328.[/color][/font][font=宋体][color=#374151][7]安莎. 轴平面光学显微成像技术及其应用研究[D].中国科学院大学(中国科学院西安光学精密机械研究所),2021.DOI:10.27605/d.cnki.gkxgs.2021.000055.[/color][/font][font=宋体][color=#374151][8]杜艳丽,马凤英,弓巧侠等.基于空间光调制器的光学显微成像技术[J].激光与光电子学进展,2014,51(02):13-22.[/color][/font][font=宋体][color=#374151][9]莫驰,陈诗源,翟慕岳等.脑神经活动光学显微成像技术[J].科学通报,2018,63(36):3945-3960.[/color][/font][font=宋体][color=#374151][10]张财华,赵志伟,陈良怡等.自适应光学在生物荧光显微成像技术中的应用[J].中国科学:物理学 力学 天文学,2017,47(08):26-39.[/color][/font]
[align=center][font='times new roman'][size=16px]激光扫描共聚焦显微镜的[/size][/font][font='times new roman'][size=16px]检测[/size][/font][font='times new roman'][size=16px]模式及其在生物医学领域的应用[/size][/font][/align][align=center][font='times new roman'][size=14px]吴晶[/size][/font][font='times new roman'][sup][size=14px]1[/size][/sup][/font][font='times new roman'][size=14px],刘皎[/size][/font][font='times new roman'][sup][size=14px]1[/size][/sup][/font][font='times new roman'][sup][size=14px], *[/size][/sup][/font][/align][align=center]1. [font='times new roman']北京大学医药卫生分析中心,北京,100191[/font][/align][font='times new roman'][/font][align=center][font='times new roman'][size=13px]* [/size][/font][font='times new roman']通讯作者[/font][/align][font='times new roman']摘要[/font][font='times new roman']由于激光扫描共聚焦显微镜(Confocal Laser Scanning Microscopy, CLSM)特有的分辨率和技术优势,使得其成为了生物学、医学及药学等领域重要的科研工具。本文结合[/font][font='times new roman']作[/font][font='times new roman']者所在的北京大学医药卫生分析中心共聚焦平台的工作经验,概述了CLSM适用的样本、[/font][font='times new roman']检测[/font][font='times new roman']模式以及在生物医学领域的应用,以期为相关科研技术人员提供参考。[/font][font='times new roman']A[/font][font='times new roman']bstract[/font][font='times new roman']Confocal Laser Scanning Microscopy (CLSM) has become an important scientific research tool in the fields of biology, medicine and pharmacy due to its unique resolution and technical advantages. Based on the author's work experience in the confocal [/font][font='times new roman']center[/font][font='times new roman'] of Peking University Medical and Health Analysis Center, this paper summarizes the applicable samples, detection modes and applications of CLSM in the biomedical field, in order to provide reference for related scientific researchers and technicians.[/font][font='times new roman']关键词[/font][font='times new roman']激光扫描共聚焦显微镜,[/font][font='times new roman']检测[/font][font='times new roman']模式,应用[/font][font='times new roman']1 引言[/font][font='times new roman']从17世纪世界上第一台原始的光学显微镜问世以来,光学显微镜在20世纪经历了快速发展时期[1]。但由于普通的光学显微镜受光波衍射效应的限制,分辨率已接近理论极限值。因此,为改善成像质量,提高图像清晰度,从而提高显微镜的成像分辨率,人们采用增加物象与背景的反差来实现此目的[2]。激光扫描共聚焦显微镜(Confocal Laser Scanning Microscopy, CLSM)的诞生,在一定程度上实现了这一目的。1984年,Bio-Rad公司首次推出世界第一台商品化的CLSM,从此CLSM迅速发展成为现代生物医学等领域科研的有力工具,广泛应用于细胞生物学、生理学、病理学、解剖学、胚胎学、免疫学和神经生物学等领域。[/font][font='times new roman']伴随着光学、计算机等技术的迅速发展,CLSM的分辨率甚至可以突破光学极限(0.2μm),达到0.05μm甚至0.02μm。与分辨率可以达到0.2nm的电子显微镜相比,CLSM的优势是既可以用于固定样品的拍摄,还可以用于活细胞实验,比如观察在特定刺激下细胞某个结构或者荧光强度的变化等。同时还可以通过XYZ[/font][font='times new roman'],[/font][font='times new roman']XYT[/font][font='times new roman'],[/font][font='times new roman']XYλ[/font][font='times new roman'],[/font][font='times new roman']XYZT[/font][font='times new roman'],[/font][font='times new roman']XYλT等多种模式实现多维成像,亦可进行更复杂实验的拍摄,比如荧光共振能量转移([/font][font='times new roman']Fluorescence Resonance Energy Transfer, [/font][font='times new roman']FRET),荧光漂白恢复([/font][font='times new roman']Fluorecence Recovery After Photobleaching, [/font][font='times new roman']FRAP),荧光寿命成像([/font][font='times new roman']Fluorescence Lifetime Imaging Microscopy, [/font][font='times new roman']FLIM)[/font][font='times new roman'],荧光相关光谱/荧光互相关光谱(Fluorescence Correlation/Co-Correlation Spectroscopy, [/font][font='times new roman']FCS[/font][font='times new roman']/FCCS)[/font][font='times new roman']等实验以满足对样品的定性、定量、定位、共定位等多维度多功能的研究。[/font][font='times new roman']本文拟通过按CLSM常见的[/font][font='times new roman']检测[/font][font='times new roman']模式分别阐述其在生物医学领域的应用,以其为相关科研技术人员提供参考。[/font]2. [font='times new roman']CLSM适用的样本[/font][font='times new roman']CLSM适用的样本非常广泛,从液体、固体等形式的材料或制剂、细菌、培养的粘附细胞、悬浮细胞、细胞团、类器官、各种染色、非染色荧光标记的组织或组织切片、到各种动物(如模式动物线虫、果蝇、斑马鱼、小鼠、大鼠等),都可以通过搭载不同载物台进行测试。所有的样品都可以通过匹配不同的器皿(包括共聚焦专用小皿、玻片、transwell小室、孔板等等)和固定器(比如不同热台、孔板支架等)放置到载物台上进行测试。[/font]3. [font='times new roman']CLSM的[/font][font='times new roman']检测[/font][font='times new roman']模式[/font]3.1 [font='times new roman']单一光切片模式(XY或XZ)[/font][font='times new roman']CLSM的最基本优势在于利用激光代替传统场光源,借助于激光扫描共聚焦显微镜的软件系统,CLSM可以实现点扫描、点探测,得到生物样品高反差、高分辨率、高灵敏度的二维图像,从而获得细胞/组织等光学切片的物理、生物化学特性及变化。也可以对所感兴趣的区域进行准确的定性、定量及定位分析。[/font][font='times new roman']CLSM特有的zoom功能,可以用来调节扫描区域的放大倍数。增加选定区域的zoom值,其图像会被放大。但zoom值会受吴晶分辨率的限制,一味的增大zoom值,不能得到相应的高清图像。因此,需根据实际情况参考piexl size进行设定。[/font]3.2 [font='times new roman']三维成像模式[/font]3.2.1 [font='times new roman']Z轴系列及三维成像模式,三维定位/图像重构[/font][font='times new roman']CLSM可对活的或固定的细胞及组织进行无损伤的系列光学切片,获得标本真正意义上的三维数据,这一功能被称为“细胞CT”:通过扫描振镜在X、Y方向的连续扫描,控制软件将扫描的像素点组成共聚焦图像,通过电动载物台沿Z轴方向的连续扫描,可获得样品不同层面连续的光切图像(xyz)。同理,通过沿Y轴方向连续扫描,可获得连续的xzy图像。再经计算机图像处理及三维重建软件,可产生生动逼真的动态效果。[/font]3.2.2 [font='times new roman']时间序列扫描模式(XYT)[/font][font='times new roman']共聚焦显微镜若按照一定的时间间隔、重复地采集样品内固定区域的荧光图像,并对其进行定位、定性及定量分析,则可实现对该样品的实时监测(XYT),此类实验可观察特异荧光探针标记的单个细胞不同部位或不同组织区域接受刺激后的整个变化过程,常用于对单个细胞内各种离子、膜电位、活性氧的比例及动态变化做实时定量分析,例如动态测定活细胞或组织内游离Ca[/font][font='times new roman'][sup][size=13px]2+[/size][/sup][/font][font='times new roman']、Mg[/font][font='times new roman'][sup][size=13px]2+[/size][/sup][/font][font='times new roman']、K[/font][font='times new roman'][sup][size=13px]+[/size][/sup][/font][font='times new roman']、Na[/font][font='times new roman'][sup][size=13px]+[/size][/sup][/font][font='times new roman']等离子的分布和浓度的变化、活细胞内H[/font][font='times new roman'][sup][size=13px]+[/size][/sup][/font][font='times new roman']浓度的变化、细胞/线粒体膜电位,自由基等。当Y方向上的扫描行数设为1时,便可进入特殊的XT模式,在这种扫描模式下得到的图像,可以用来计算血流速度等。[/font]3.2.3 [font='times new roman']光谱扫描模式(XYλ/XYΛ/XZλ)[/font][font='times new roman']通常配置有可调节接受范围的检测器[/font][font='times new roman']的CLSM[/font][font='times new roman'],可以实现从400nm-800nm的发射波谱扫描。通过配置具有连续可调波长的白激光,CLSM还可以实现激发波谱扫描。[/font][font='times new roman']3.3四维成像模式(XYZT/XYλT/XYΛT)[/font][font='times new roman']基于[/font][font='times new roman']上述[/font][font='times new roman']三维成像[/font][font='times new roman']模式[/font][font='times new roman'],结合时间序列扫描,可以实现CLSM的四维成像。[/font][font='times new roman']3.4反射光/透射光/微分干涉(DIC)成像模式[3-4][/font][font='times new roman']反射光成像主要是指光源发出的光到达样品后发生反射,检测器将此反射光信号转化为电信号进而生成样品表面的图像。利用反射光成像,能够更好的获得样品的表面纹理等信息,是对荧光图像信息的进一步补充。[/font][font='times new roman']透射光成像技术是通过光源发出的光到达样品后,透过样品的光进入检测器生成光信号,再由检测器转变为电信号所形成的图像信息。透射光成像通常能够更好的呈现目标的外轮廓信息,亦是对荧光图像信息的进一步补充。[/font][font='times new roman']很多CLSM配置有DIC模式。与其他成像技术相比,DIC成像技术通过对光路中梯度变化的呈现,实现“伪立体”效果,如在梯度比较小的区域中,相对比较扁平的上皮细胞亦可以较好的实现“立体”结构,同时,由于DIC成像技术不存在相差成像等技术中出现的光晕,还可以利用这个特点检测到细胞表面分布着的细菌,这是很多成像技术所观察不到的。因此DIC成像技术的主要优势在于不需要对相差环和聚光镜遮挡等因素进行考虑,可以直接实现高数值孔径的物镜观察,即可以提高轴向分辨率,这在对分辨率要求十分高的实验中具有重要的应用价值。[/font][font='times new roman']3.6 特殊[/font][font='times new roman']检测[/font][font='times new roman']模式[/font][font='times new roman']3.6.1 荧光漂白恢复(FRAP)[/font][font='times new roman'][5][/font][font='times new roman']FRAP技术由Axelrod等于20世纪70年代研发,指对细胞内的某一区域荧光漂白后,通过测定荧光分子的恢复速率,来研究活细胞中生物分子的动力学特征。[/font][font='times new roman']通过FRAP实验可以研究生物膜脂质分子的侧向扩散、细胞间的通讯、胞浆及细胞器内小分子物质转移性的观测、以及细胞骨架、核膜结构或大分子组装等。[/font][font='times new roman']3.6.2荧光能量共振转移(FRET)[/font][font='times new roman'][6][/font][font='times new roman']FRET是指两个荧光基团间能量通过偶极-偶极耦合作用以非辐射方式从供体传递给受体的现象。目前FRET技术可广泛用于单个固定细胞、亚细胞或活细胞原位生理环境下检测生物大分子的构象变化和分子间的直接相互作用,如检测配体-受体、蛋白分子共定位、转录机制、蛋白折叠以及蛋白质二聚化等,亦可用于检测酶活性变化、细胞凋亡以及膜蛋白的研究等。[/font][font='times new roman']在FRET体系中,常用的荧光能量供体、受体对主要有:CFP/YFP、BFP/RFP、CY3/CY5等。[/font][font='times new roman']进行FRET实验时,需要满足以下几个条件:① 所检测样品包含两个荧光分子,能量的提供者叫做供体,能量的接受者叫做受体;② 供体与受体的距离在[/font][font='times new roman']10[/font][font='times new roman']nm之间;③ 供体的发射波长与受体的激发波长一致。当供体的激发波长照射样品时,若没有FRET效应产生,只会检测到供体的发射光;反之,如果有FRET效应发生,则CLSM可检出供体发射的荧光减弱,而受体的发射光增强。[/font][font='times new roman']3.6.4 荧光寿命成像([/font][font='times new roman']FLIM[/font][font='times new roman'])[7][/font][font='times new roman']FLIM技术是研究细胞内生命活动状态的一种非常可靠的方法。荧光寿命是荧光团在返回基态之前处于激发态的平均时间,是荧光团的固有性质,因此其不受探针浓度、激发光强度和光漂白效应等因素影响,且能区分荧光光谱非常接近的不同荧光团,故具有非常好的特异性和很高的灵敏度。此外,由于荧光分子的荧光寿命能十分灵敏地反映激发态分子与周围微环境的相互作用及能量转移,因此FLIM技术常被用来实现对微环境中许多生化参数的定量测量,如细胞中折射率、黏度、温度、pH值的分布和动力学变化等,这在生物医学研究中具有非常重要的意义。目前FLIM技术在细胞生物学中一些重要科学问题的研究、临床医学上一些重大疾病的诊断与治疗研究以及纳米材料的生物医学应用研究等方面均有广泛应用,并取得了许多利用传统的研究手段无法获取的数据。[/font][font='times new roman']3.6.5 荧光共振能量转移-荧光寿命成像(FRET- [/font][font='times new roman']FLIM[/font][font='times new roman'])[8][/font][font='times new roman']FRET本身不是一种成像技术,而是一个物理过程。传统的FRET过程分析通常是基于荧光强度成像来实现,分析的结果容易受光谱串扰的影响。而将FLIM技术应用于FRET过程分析,利用FLIM技术可定量测量这一优势,可非常灵敏地反映供体荧光分子与受体荧光分子之间的能量转移过程。当受体分子与供体之间的距离10nm时,供体的能量转移到受体,受体从基态发生能量跃迁,从而影响供体的荧光寿命。与没有受体分子的时候相比,发生FRET的供体分子的荧光寿命降低。因此,FRET-FLIM联合能够实时监测生物细胞中蛋白质的动态变化,如蛋白质折叠、分子间(蛋白-蛋白,蛋白-核酸)相互作用和细胞间信号分子传递、分子运输以及病理学研究等。[/font][font='times new roman']3.6.3 荧光相关光谱/荧光互相关光谱([/font][font='times new roman']FCS[/font][font='times new roman']/FCCS)[9-12][/font][font='times new roman']FCS[/font][font='times new roman']和FCCS都是在涨落光谱技术的基础上衍生而来的,通过检测某一微小区域内荧光信号的瞬时涨落变化,分析分子的密度、扩散以及分子之间的相互作用,是一种新兴的单分子检测技术。由于FCS/FCCS的高灵敏性可以用来检测生物系统中发生的小概率时间,因此此技术主要用于分子之间相互作用、活细胞分析、核酸分析、蛋白质的寡聚化、蛋白质的动力学研究以及纳米制剂粒径测量等研究,在检测物质浓度、扩散速度、分子结合速率等方面体现出巨大的优越性,亦可用于肿瘤的早期诊断以及高通量药物筛选等。[/font][font='times new roman']FCS技术,即在CLSM焦点的微小测量区域内,通过对荧光强度随时间变化的自发性波动分析和其时间函数自相关的分析,并通过计算机统计与拟合运算,在活细胞内单分子水平给出分子的扩散系数、分子数目、分子浓度及分子之间结合与分离状态等动力学参数的检测方法。其实质是监测带有荧光基团的物质在激光作用体积内的扩散情况,可揭示异质群体中的每个个体,并对各自的亚群进行鉴定、分类、定量比较,亦可对复杂的生化反应提供详细、确定的动力学参数。[/font][font='times new roman']发明FCS的最初目的是在生物系统中研究非常稀的样本浓度的化学动力学特征。随着探测手段、自相关电子学等方面的技术进步,FCS在生物化学中的研究和应用越来越广泛,如经典的细胞膜中脂质扩散研究就是通过CLSM整合了FCS技术后所取得的巨大进展。[/font][font='times new roman']FCCS技术,确切来说是FCS技术的一种延伸应用。其既保持了FCS技术的灵敏性,又可以解决FCS对两种粒子的扩散速度要有明显不同的要求(至少相差2倍,即二者质量差相差8倍)。该技术在实验中通常将两种粒子用不同的荧光进行标记,荧光分子被激发后,产生两种互不干扰的荧光信号,分别被两个独立的检测器探测,然后将探测到的信息进行交叉函数分析。如果分子间存在相互作用,那么两种不同的荧光信号将同时经过检测通道,这时两个检测器就会产生同步的信号波动,从而产生互相关信号;而当单色荧光分子独立在微区域内运动时,则不会产生互相关信号。这样,相互作用的荧光分子和独立运动的荧光分子就被区分开来。由于FCCS技术直接反映分子间的相互作用,而不像FRET技术那样受分子扩散或聚集的影响,因此在生物分子互作、蛋白寡聚化、酶活性研究领域中有重要的应用前景。[/font][font='times new roman']4 结论和展望[/font][font='times new roman']综上,CLSM应用灵活,具备多种检测[/font][font='times new roman']模式,适用于多种样本,[/font][font='times new roman']亦可[/font][font='times new roman']实现多种实验目的,如荧光的定量、定性、定位、共定位,动态荧光的测定等[/font][font='times new roman']。一些特殊的实验模式,将CLSM在生物医学领域的应用进一步扩大。通过[/font][font='times new roman']结合其他[/font][font='times new roman']技术[/font][font='times new roman'](多手段联合拓展[/font][font='times new roman'],如膜片钳、原子力显微镜、光电联用等[/font][font='times new roman'])[/font][font='times new roman'],CLSM必将成为[/font][font='times new roman']助力生物医学领域研究[/font][font='times new roman']的有力工具[/font][font='times new roman']。[/font][font='times new roman']参考文献[/font]1. [font='times new roman']黄德娟,浅谈显微镜的发展史及其在生物学中的用途。赤峰教育学院学报,2000,2:51-52[/font]2. [font='times new roman']肖艳梅,付道林,李安生,激光扫描共聚焦显微镜(LSCM)及其生物学应用。激光生物学报,1999,8(4):305-311[/font]3. [font='times new roman']弓宇, 郭英玲, 张枫, 刘红旗, 基于反射光和透射光成像的图像识别方法比较。机电产品开发与创新,2013,26(3):7-9[/font]4. [font='times new roman']虞兆芳, DIC成像技术的优势。求知导刊,2016,2:53[/font]5. [font='times new roman']隋鑫,满奕,张越,林金星,荆艳萍,荧光漂白恢复技术及其在生物膜系统研究中的应用。电子显微学报,2017,36(6):601-609[/font]6. [font='times new roman']肖忠新,张进禄,荧光共振能量转移技术在激光共聚焦显微镜中的应用。中国医学装备,2014,8(11):73-75[/font]7. [font='times new roman']刘雄波,林丹樱,吴茜茜,严伟,罗腾,杨志刚,屈军乐,荧光寿命显微成像技术及应用的最新研究进展。物理学报,2018,67(17):178701-1-178701-14[/font]8. [font='times new roman']罗淋淋,牛敬敬,莫蓓莘,林丹樱,刘琳,荧光共振能量转移-荧光寿命显微成像(FRET-FLIM)技术在生命科学研究中的应用进展。光谱学与光谱分析,2021,41(4):1023-1031[/font]9. [font='times new roman']曲绍峰,林金星,李晓娟,FCS/FCCS技术及其在植物细胞生物学中的应用。电子显微学报,2014,33(5):461-468[/font]10. [font='times new roman']张普敦,任吉存,荧光相关光谱及其在单分子检测中的应用进展。分析化学,2005,33(6):875-880[/font]11. [font='times new roman']黄茹,周小明,荧光相关光谱在生物化学领域中的应用。激光生物学报,2013,22(4):289-293[/font]12. [font='times new roman']游俊,荧光相关光谱(FCS)在生物活细胞中的应用。湖北大学学报(自然科学版),2005,27(1):53-56[/font]
最近有朋友询问激光显微切割系统,偶对之了解甚少,只知道莱卡和尼康可能有,别的一无所知。有那位大侠了解有关的设备的,请多多指教!谢谢!jinanzhjh@126.com
[center]真实色共焦显微镜与激光扫描共焦显微镜主要特点对比[/center]真实色共焦显微镜与激光扫描共焦显微镜,二者在成像原理上基本是一样的,最大不同之处是照明光源不同。1、激光扫描共焦显微镜激光扫描共焦显微镜的照明光源是激光,即单色光。其实际成像过程是根据被观察物体对该单色激光的反射光的强弱来成像的。由于是单色光照明,不能分辨颜色,对于在同一试样的同一视场内,颜色不同,但对该单色激光反射光强度相同的不同组织或成分不能分辨。容易产生同相异色,同色异相的现象,不利于对微观组织和成分的正确分辨。2、真实色共焦显微镜真实色共焦显微镜的光源是氙光源,即白光。其实际成像过程是在白光照明的条件下,对物体形貌(包括颜色)进行综合的成像。 由于是多色光照明和成像,真实色共焦显微镜能够更真实的反应物体的颜色和形貌,避免了激光扫描共焦显微镜产生的同相异色,同色异相的现象发生,观察者可以通过颜色,分辨和判断试样的成分和组织。在这方面,其分辨率远强于激光扫描共焦显微镜 综合分析:在有颜色差异的试样的观察条件下,真实色共焦显微镜避免了激光扫描共焦显微镜产生的同相异色,同色异相的现象发生,观察者可以通过颜色,分辨和判断试样的成分和组织。在这种条件下,真实色共焦显微镜的分辨率高于激光扫描共焦显微镜。在单色试样的观察条件下,分辨率才接近各自的技术指标。然而,在实际观察的试样中,绝大多数不同的组织和成分都是有颜色差异的。对应于没有颜色差异或颜色差异小的试样,可以通过人为的染色(例如腐蚀处理),提高图像的分辨能力。在这一方面,激光扫描共焦显微镜是无能为力的。 另外,分辨率是在特定条件下所能达到的一项技术指标,当在实际使用中,不满足该技术条件时(实际是常常不能满足),其分辨率是达不到所给出的数值。
激光共聚焦显微镜检测生物样品时,如果不发光就染色,然后检测荧光,可是对于金属样品和陶瓷材料怎么办?他有反射光模式吗?换句话说是可以探测样品的反射光么?
要采购低温冰箱,荧光PCR仪,高压灭菌锅,凝胶成像仪,显微成像系统等,哪几家公司(国外)的性价比高且结实耐用啊,求高手指点。
激光扫描共聚焦显微镜是近十年发展起来的医学图像分析仪器,与传统的光学显微镜相比,大大地提高了分辨率,能得到真正具有三维清晰度的原色图像。并可探测某些低对比度或弱荧光样品,通过目镜直接观察各种生物样品的弱自发荧光。能动态测量Ca2+ 、pH值,Na+、Mg2+等影响细胞代谢的各种生理指标,对细胞动力学研究有着重要的意义。同时激光扫描共聚显微镜可以处理活的标本,不会对标本造成物理化学特性的破坏,更接近细胞生活状态参数测定。可见激光扫描共聚焦显微镜是普遍显微镜上的质的飞跃,是电子显微镜的一个补充,现已广泛用于荧光定量测量,共焦图像分析,三维图像重建、活细胞动力学参数分析和胞间通讯研究等方面,在整个细胞生物学研究领域有着广阔的应用前景。1. 定量荧光测量ACAS可进行重复性极佳的低光探测及活细胞荧光定量分析。利用这一功能既可对单个细胞或细胞群的溶酶体,线粒体、DNA、RNA和受体分子含量、成份及分布进行定性及定量测定,还可测定诸如膜电位和配体结合等生化反应程度。此外,还适用于高灵敏度快速的免疫荧光测定,这种定量可以准确监测抗原表达,细胞结合和杀伤及定量的形态学特性,以揭示诸如肿瘤相关抗原表达的准确定位及定量信息。2. 定量共聚焦图像分析借助于ACAS激光共焦系统,可以获得生物样品高反差、高分辨率、高灵敏度的二维图像。可得到完整活的或固定的细胞及组织的系列及光切片,从而得到各层面的信息,三维重建后可以揭示亚细胞结构的空间关系。能测定细胞光学切片的物理、生物化学特性的变化,如DNA含量、RNA含量、分子扩散、胞内离子等,亦可以对这些动态变化进行准确的定性、定量、定时及定位分析。3. 三维重组分析生物结构ACAS使用SFP进行三维图像重组,SFP将各光学切片的数据组合成一个真实的三维图像,并可从任意角度观察,也可以借助改变照明角度来突出其特征,产生更生动逼真的三维效果。4. 动态荧光测定Ca2+、pH 及其它细胞内离子测定,利用ACAS能迅速对样品的点,线或二维图像扫描,测量单次、多次单色、双发射和三发射光比率,使用诸如Indo-1、BCECF 、Fluo-3等多种荧光探针对各种离子作定量分析。可以直接得到大分子的扩散速率,能定量测定细胞溶液中Ca2+对肿瘤启动因子、生长因子及各种激素等刺激的反应,以及使用双荧光探针Fluo-3和CNARF进行Ca2+和pH的同时测定。5. 荧光光漂白恢复(FRAP)——活细胞的动力学参数荧光光漂白恢复技术借助高强度脉冲式激光照射细胞某一区域,从而造成该区域荧光分子的光淬灭,该区域周围的非淬灭荧光分子将以一定速率向受照区域扩散,可通过低强度激光扫描探测此扩散速率。通过ACAS可直接测量分子扩散率、恢复速度,并由此而揭示细胞结构及相关的机制。6. 胞间通讯研究动物细胞中由缝隙连接介导的胞间通讯被认为在细胞增殖和分化中起非常重要的作用。ACAS可用于测定相邻植物和动物细胞之间细胞间通讯,测量由细胞缝隙连接介导的分子转移,研究肿瘤启动因子和生长因子对缝隙连接介导的胞间通讯的抑制作用,以及胞内Ca2+、PH和cAMP水平对缝隙连接的调节作用。7. 细胞膜流动性测定ACAS设计了专用的软件用于对细胞膜流动性进行定量和定性分析。荧光膜探针受到极化光线激发后,其发射光极性依赖于荧光分子的旋转,而这种有序的运动自由度依赖于荧光分子周围的膜流动性,因此极性测量间接反映细胞膜流动性。这种膜流动性测定在膜的磷脂酸组成分析、药物效应和作用位点,温度反应测定和物种比较等方面有重要作用。8. 笼锁-解笼锁测定许多重要的生活物质都有其笼锁化合物,在处于笼锁状态时,其功能被封闭,而一旦被特异波长的瞬间光照射后,光活化解笼锁,使其恢复原有活性和功能,在细胞的增值、分化等生物代谢过程中发挥功能。利用ACAS可以人为控制这种瞬间光的照射波长和时间,从而达到人为控制多种生物活性产物和其它化合物在生物代谢中发挥功能的时间和空间作用。9. 粘附细胞分选ACAS是目前唯一能对粘附细胞进行分离筛选的分析细胞学仪器,它对培养皿底的粘附细胞有两种分选方法: ① Coolie-CutterTM法,它是Meidian公司专利技术,首先将细胞贴壁培养在特制培养皿上,然后用高能量激光的欲选细胞四周切割成八角形几何形状,而非选择细胞则因在八角形之外而被去除,该分选方式特别适用于选择数量较少诸如突变细胞、转移细胞和杂交瘤细胞,即使百万分之一机率的也非常理想。 ② 激光消除法,该方法亦基于细胞形态及荧光特性,用高能量激光自动杀灭不需要的细胞,留下完整活细胞亚群继续培养,此方法特别适于对数量较多细胞的选择。10. 细胞激光显微外科及光陷阱技术借助ACAS可将激光当作“光子刀”使用,借此来完成诸如细胞膜瞬间穿孔、切除线粒体、溶酶体等细胞器、染色体切割、神经元突起切除等一系列细胞外科手术。通过ACAS光陷阱操作来移动细胞的微小颗粒和结构,该新技术广泛用于染色体、细胞器及细胞骨架的移动。
我有无机非金属材料需要激光共聚焦显微镜实验,观测其缺陷(孔隙)并3D成像,请问南京什么单位有工业激光共聚焦显微镜?谢谢
[b]摘要[/b]在神经科学和神经外科中对活体大脑组织中神经元的成像能力是一项基本要求。尤其是需求一种具有测微计尺分辨率的大脑形态学的非侵入探针的开发,因为它可以在临床诊断上提供一种非侵入式光学活体组织检查的手段。在这一领域,双光子激光扫描显微镜(2PLSM)是一个强大工具,并已成为活体生物样品最小侵入性损害的高分辨率成像的标准方法。但是,(2PLSM)基于光学方法提供足够分辨率的同时,对荧光染料的需求妨碍了图像对比度的提高。本文中,我们提供了一种活体大脑组织以细胞分辨率的高对比度成像方法,无需荧光探针,使用光学三次谐波发生进行成像。我们利用细胞水平的特殊几何学和大脑组织的液体内容物来获取THG的部分相匹配,提供了一种荧光对比度机制的替代方法。我们发现THG大脑图像允许快速、无侵入性标记的神经元、白质结构、血管同时成像。而且,我们利用THG成像来引导微吸管指向活体组织中指定的神经元。这个工作是一个无标记活体大脑成像的主要步骤,并开启了活体大脑中激光引导的微注射技术发展的可能性。[b]材料与方法[/b]THG成像对于THG成像实验,我们使用了一台商业化双光子激光扫描显微镜([color=#ff0000]TrimScope, Lavision BioTec[/color])。光源是一个光学参量震荡器(Mira-OPO,APE),810nm泵浦光来自一个Ti:Sa锁模激光器(Coherent Chameleon Ultra II)。使用一个20X,0.95N.A水浸物镜(Olympus XLUMPFL-IR)将光聚焦到样品上。使用epidetection几何学描述THG实验。使用分光镜(Chroma T800lpxrxt)将背景散射THG光子从入射激光束中分离出来,用一个THG波段的带通滤波器(Chroma HQ390-70X)过滤。检测器是GaAsP高灵敏度光电倍增管(Hamamatsu H7422-40),400nm处量子效率为25%。最高分辨率成像(1024×1024像素)的典型获取时间为1.6s,我们用于目标定向实验的512 X 512像素成像时间为0.6s。 为与前向端口比较,使用了一个定制的投射端口。这个端口使用了一个1.4N.A油浸物镜,一个长波分光镜(UQG optics)和一个400nm的相干窄带滤波器。对于THG与SR-101联合实验我们用1200nm的OPO来同时产生两种信号。使用一个594nm带通和561nm隔断的分光镜将SR-101荧光从THG信号中分离。SR-101信号使用一个PMT检测(Hamamatsu H6780-20)。Nile Red和THG成像也是由1200nm的OPO同步激发。在这个案例中THG信号由投射端口测量,Nile Red荧光通过一个593∕40 nm的带宽滤波器检测。对于THG和GFP联合成像,用来泵浦OPO的Ti:Sa激光被调谐到970nm并耦合到显微镜中。组织块的GFP和THG信号使用同一个检测器连续测量。但使用一个不同的(561∕40 nm)带通滤波器检测GFP。使用显微镜软件(Imspector Pro)获取图像并以16bit 的tiff格式存储,图像分析使用Image J(MacBioPhotonics)进行。[b]主要结果[/b] [img=,575,768]http://qd-china.com/uploads/bio-product/21.jpg[/img]Fig. 1.无标记活体大脑的三次谐波显微成像(A)脑组织THG成像的epidetection几何学图示。插图:THG原理。注意基质中没有光学激发发生。(B) 树突处的聚焦激光束。通过将激光聚焦体积设定到树突直径的几倍大小,可以获得部分相匹配,显著的THG信号将会产生。(C)细胞体内的聚焦激光束。由于不好的结构相匹配状态,没有THG信号产生。(D) 小鼠大脑组织的活神经元成像。体细胞以暗影存在。 [img=,466,500]http://qd-china.com/uploads/bio-product/22.jpg[/img]Fig. 2.活体大脑组织的THG成像(A)小鼠皮质的THG图像 (B) 与A同位置的Nile Red染色的双光子荧光图像 (C) 大鼠凹陷的脑回THG图像(水平切面) (D)小鼠脑胼胝体THG图像,轴突纤维束被清晰得分辨。Movie S1是这个结构的一个3D投影 (E)小鼠大脑纹状体的THG图像(冠状面)。白质和神经元细胞清晰可见。明亮的粒状结构是垂直穿行图像平面的轴突纤维。Movie S2是这个区域的3D投影。(F)麻醉活小鼠的脑皮质上层的血管THG图像(z栈平均投影密度是50um) [img=,510,767]http://qd-china.com/uploads/bio-product/23.jpg[/img]Fig. 3. THG与双光子成像的叠加 (A)小鼠额前叶脑皮质的THG图像 (B)SR-101标记的星细胞双光子图像 (C) A、B的叠加提供了神经网络中星细胞的分布信息 (D) 小鼠额前叶皮质的THG图像 (E) GFP标记的生长抑素神经元的双光子荧光图像 (F)D、E的叠加显示了生长抑素神经元在脑前叶皮质结构中的分布 [img=,461,768]http://qd-china.com/uploads/bio-product/24.jpg[/img]Fig. 4.THG成像深度与自动化细胞检测 (A-C) 小鼠额前叶皮质的THG图像,成像深度分别为100, 200, and 300 μm 。每幅图像都是3个以2微米深度间隔独立图像的最大密度投影(D) 110 μm深度处神经元细胞的自动检测THG图像。细胞检测的运算法则定义为以红色显示的神经元 (E)红色标记:来自A-C的图像栈的细胞可见性对比。黑色标记:作为一个深度功能的平均检测到的THG密度。 [img=,531,768]http://qd-china.com/uploads/bio-product/25.jpg[/img]Fig. 5. 无标记目标定向和细胞活性(A)小鼠新大脑皮层的THG图像 (B) 在对一个神经元进行THG引导膜片钳之后同一位置的THG图像 (C)一个200um深处钳住神经元的大视野THG图像(5幅深度间隔2um的图像平均) (D)记录以100pA电流脉冲刺激B中被钳住的神经元的动力势训练 (E) 测量在THG扫描期间静止膜电位的改变。即使以最高的能量,也只观察到4%的电压变化,保持了完全的可逆性。0.8秒的周期相应于图像扫描时间。(F)最大观察到的静止膜电位Vs扫描时的激光能量。没有非线性效应出现。
[url=http://www.f-lab.cn/microscopes-system/macroscopic-imaging.html][b]荧光宏观成像系统[/b][/url]macroscopic imaging专业为心脏成像 cardiac imaging而设计,[b]荧光宏观成像系统[/b]macroscopic imaging和光学映射,光学图谱技术厂用于整体荧光显微镜和荧光成像系统中。[b]荧光宏观成像系统[/b]macroscopic imaging集成了高科技高强度光源照明样品或反射照明样品,结合高数值孔径镜头,CCD相机和光电二极管探测器。宏观成像系统实验通常采用双波长,这样可测量细胞内钙离子和膜电位。宏观成像系统提供固定或可变的镜头系统,捕捉视场从4x4mm到50x50mm,并且可根据用户实验而增加放大成像器。[img=宏观成像系统]http://www.f-lab.cn/Upload/macroscopic-imaging.jpg[/img]荧光宏观成像系统:[url]http://www.f-lab.cn/microscopes-system/macroscopic-imaging.html[/url][b][/b]
我们是专业做激光的,听搞显微镜的朋友说很多显微镜的光源是用激光做的,而且很多用的是国外的激光。我们是国内的公司,朋友是做生物显微镜的,告诉我光源是激光的,除了生物显微镜还有哪些显微镜用激光作光源啊,或者在哪里可以查到相关资料,请高手解答一下,谢谢!