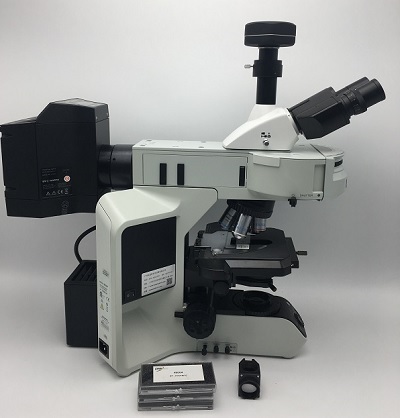
KOSTER FISH UMC-900TFL 定制荧光原位杂交显微镜荧光原位杂交(fluorescent in situ hybridization,FISH) 是一种细胞遗传学技术,可以用来对核酸进行检测和定位。荧光标记的核酸探针只和具有高度相似性的核酸杂交,可用于染色体上基因的定位,或在分子生态学中用来标记不同分类细菌或古菌中的核糖体RNA。在医院的妇产科或相关检验所中,会利用荧光原位杂交技术来判别胎儿的染色体是否正常。对于利用rRNA的荧光原位杂交来说,如下原因可导致较低的荧光信号强度:较低的细胞核糖体含量较低的细胞周边的通透性较低的目标序列可接触性(由于rRNA的折叠产生的构象,有些位置与rRNA分子内其他链或其他rRNA或蛋白紧密接触,从而使探针无法和目标序列杂交)为检验细胞中的目标序列是否容易被探针杂交,及测试最佳杂交温度,可利用“克隆荧光原位杂交”(clone-FISH)进行试验:将rRNA基因结合入质粒,转化至大肠杆菌中表达,构成核糖体,再用荧光标记的探针杂交。此定制荧光显微镜是专门针对各种常用mFISH探针试剂盒设计的荧光成像系统,专用的进口滤片组可以完全匹配各种试剂盒的探针,获得高特异性和高灵敏度的荧光成像效果。可以提供的方案包括:Vysis mFISH探针试剂盒(FITC,CY5,TxR, DEAC,SP-Gold), Abbott-FISH探针试剂盒(Spectrum Blue,Spectrum Aqua,Spectrum Green,Spectrum Gold,Spectrum Orange),Zytovision FISH (ZyBlue,DAPI,ZyGreen), Cytocell FISH探针试剂盒等,可定制,价格优惠。采用进口显微镜主机架,研究级别荧光光路设计,保证良好的荧光效果。采用8孔位荧光照明器以其可方便更换的激发镜组为使用多种荧光标本提供了更大的灵活性。更换多彩mFISH或FISH用激发镜组的需求,进一步加速了观察操作。采用直接连接的长寿命金属氯化物高效荧光光源,保证良好的FISH成像效果,无需校准,荧光灯泡寿命1500小时以上,使用寿命是传统高压汞灯荧光光源的7倍以上,使用更方便;宽光谱输出范围达到300nm-800nm,更加适合各种FISH染料激发。标配高性能荧光物镜保证良好的荧光效果10X/0.3, 40X/0.75,100X/1.3,可以选配高分辨率物镜10X/0.42, 40X/0.95, 100X/1.45 针对不同FISH探针试剂盒的进口荧光滤片组保证良好的荧光特异性和成像质量。KOSTER品牌高灵敏度摄像头及专业的图像处理软件KOSTER MAS图像软件。KOSTER MAS显微图像处理软件介绍 KOSTER相机专业配置软件MAS(Microscopy Application Software)简介 MAS支持所有KOSTER品牌的相机 5个独创的侧边栏,界面友好,上手快 支持多层式测量,确保测量与图像独立性 超精细颜色引擎 语言支持不受限 多种实用处理功能 兼容Windows XP, Vista, 2008, 7/8/10(32/64位)/Mac OSX/Linux,免驱安装KOSTER MAS软件主要包含了什么?KOSTER MAS系广州科适特科学仪器有限公司的相机控制软件. 主要提供全面控制相机功能并通过Ultra FineTM 颜色引擎泵出高速视频流给计算机的USB接口,Ultra FineTM颜色引擎包含精致的处理RAW数据的流水线以实现传感器探测数据到景色的转换. 更进一步的, MAS还提供图像灰度校正,图像2D测量,图像拚接,景深延拓,视频水印、颜色合成,图像分割与计数以及图像处理等众多高级视频或图像处理功能. MAS的多语言机制可以支持任意语言,目前包含但不限于英文,简体中文,繁体中文, 德语, 日语, 俄语, 法语, 意大利语, 波兰语, 土尔其语等. MAS完全兼容KOSTER全系列相机,所有的相机仅需一个驱动. 更进一步, 可以使用第三方支持有Twain或DirectShow接口的任何第三方相机.强大的 多合一版本Windows/Linux/Mac OS SDKs供用户进一步开发. MAS广泛应用于医学显微成像,工业探测,机器视觉,天文观测等领域并且已经成为相机工业,最佳软件,并且受到美国教育部 强力推荐软件.UI界面精致直观菜单与工具条设置合理确保快速操作 专业集成了5个侧边栏 -- 相机, 文件夹, 撤消/重做, 层, 测量; 舒适的操作方法(双击或右键上下文菜单) 详尽的帮助手册 专业的相机控制面板曝光与增益自动曝光(预设曝光目标值),手动曝光(曝光时间可以手动输入与滑动条设置) 增益高达5倍 白平衡高级单击智能白平衡设置、更可通过手动设置色温与色彩调整白平衡 颜色调整色彩,饱和度,亮度,对比度, 伽马值初始高速调整功能 帧速率控制针对不同的电脑与USB性能,可通过调整帧速率实现相机超强的兼容 光源频率控制(防闪烁)自然光/DC, AC 50 HZ, AC60 HZ选择按钮彻底消除视频闪烁 镜像选择“水平l”或“垂直选择”可调节样品方向确保同目视系统方向一致 抽样提取与邻域平均以及其他功能邻域平均可以提高视频流的信噪比 而抽样提取模式可以保证视频流的锐度. 支持视频流的直方图扩展, 图像负片与正片切换, 灰度校准, 清晰度因子计算以方便视频对焦.参数保存装载, 保存, 覆盖,载入,导出自定义相机面板控制(包括校准信息,曝光参数与颜色设置信息等) 处理功能专业、处理结果实用视频功能各种视频专业处理功能: 视频广播 定时捕获 视频录像 视频水印 水印移动对准 水印旋转对准 视频网格叠加 视频测量 视频定标, 灰度定标校准 视频高动态(HDR) 视频景深扩展 视频图像拚接 视频比例尺、日期等叠加 图像处理与增强图像对比度控制与调整、图像去噪, 各种图像滤波算法,图像数学形态学算法,图像旋转,图像缩放以及图像打印等 2D测量方便实用的视频与图像尺寸校准,各种视频与图像二维几何量测量如长度、面积、周长以及角度等等.测量结果可以根据图像特性或首选项进行控制 图像拚接图像拚接可以自动将序列图像拚接成大幅面图像. 拚接过程对图像排列次序任何要求;支持视频窗口, 图像窗口,浏览窗口拚接操作.EDF(景深延拓)景深扩展可以通过聚焦不同层的图像,得到超越常规景深的超清晰图像。MAS支持在三种窗口的EDF景深扩展:即视频窗口、图像窗口以及浏览窗口.针对不同的图像,MAS还提供了最大对比度、加权平均以及FFDSSD等三种不同的景深扩展算法. 另外不考虑了不同聚焦图像之间存在的平移、旋转以及比例变化图像之间的自动景深扩展以确保EDF的精度与快速性;专业分割与计数MAS的分割与计数提供了6种图像分割方法供用户根据不同的图像特性调用,这6种分割方法是:分水岭,暗OTSU,亮OTSU,RGB直方图,HSV直方图,颜色分块等。用户可以选择这6种分割方法中的任意一种方法进行分割,但是在选择任意一种分割方法以后,其他分割方法会被禁用. 在分割完成以后,可能存在计数对象的粘连情况,可通过手动分割对粘连对象进行人工分割; 在确认达到预期的结果以后,可通过选择计数结果菜单,实现对分割对象进行计数结果统计与分析.图像叠加去噪MAS图像叠加去噪功能引入先进的图像匹配技术,用户只需录制自己待叠加图像的一小段视频,就能够在视频多帧图像之间存在位移、旋转及放大率改变的情况下叠加输出高保真的图像,简单易用.颜色合成彩色合成可使用黑色和白色荧光源图像来创建和配置彩色合成图像。荧光探针与颜色可以直接从预定义的数据中选取。特殊探针的染料数据库也可以由用户自己建库.图像拼接图像分割与计数,图像叠加去噪荧光彩色合成,显微景深层次融合超强的兼容性 相机视频接口提供Twain, DirectShow, Labview, SDK安装包(原生C++、C#)支持操作系统兼容Microsoft Windows XP / Vista / 7 / 8 (32 & 64位), Mac OSX, Linux语言支持语言支持可手动添加,目前支持英文,简体中文,繁体中文, 德语, 日语, 俄语, 法语, 意大利语, 波兰语, 土尔其语硬件需求基本PC基本配置要求CPU: Intel Core 2 2.8GHz 或更高内存:2GB or moreUSB 接口:USB2.0或USB3.0接口显 示 器:17”或更高CD-ROM
 留言咨询
留言咨询

 400-628-5299
400-628-5299
 留言咨询
留言咨询

 400-628-5299
400-628-5299
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转4585
400-860-5168转4585
 留言咨询
留言咨询

 400-860-5168转4470
400-860-5168转4470
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转4713
400-860-5168转4713
 留言咨询
留言咨询

 400-860-5168转4585
400-860-5168转4585
 留言咨询
留言咨询

 留言咨询
留言咨询

 400-860-5168转1694
400-860-5168转1694
 留言咨询
留言咨询

 400-860-5168转1446
400-860-5168转1446
 留言咨询
留言咨询

 400-860-5168转4836
400-860-5168转4836
 留言咨询
留言咨询

 留言咨询
留言咨询

 留言咨询
留言咨询
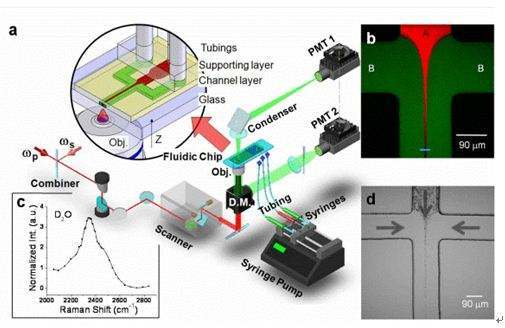
 400-860-5168转2387
400-860-5168转2387
 留言咨询
留言咨询

 400-860-5168转5915
400-860-5168转5915
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-628-5299
400-628-5299
 留言咨询
留言咨询
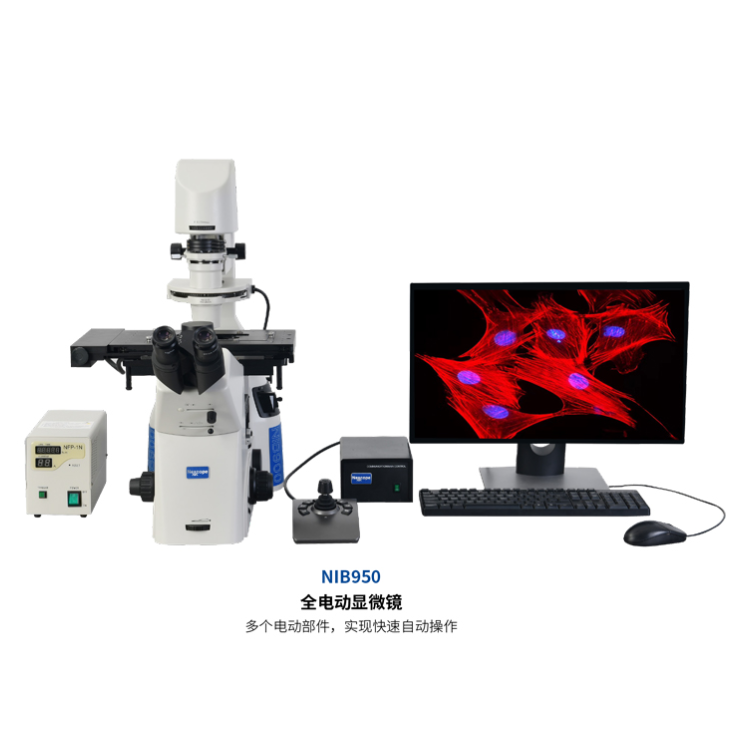
 400-860-5168转5067
400-860-5168转5067
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转2831
400-860-5168转2831
 留言咨询
留言咨询

 400-860-5168转2831
400-860-5168转2831
 留言咨询
留言咨询

 400-860-5168转2042
400-860-5168转2042
 留言咨询
留言咨询

 留言咨询
留言咨询

 400-860-5168转4470
400-860-5168转4470
 留言咨询
留言咨询

 400-860-5168转5915
400-860-5168转5915
 留言咨询
留言咨询
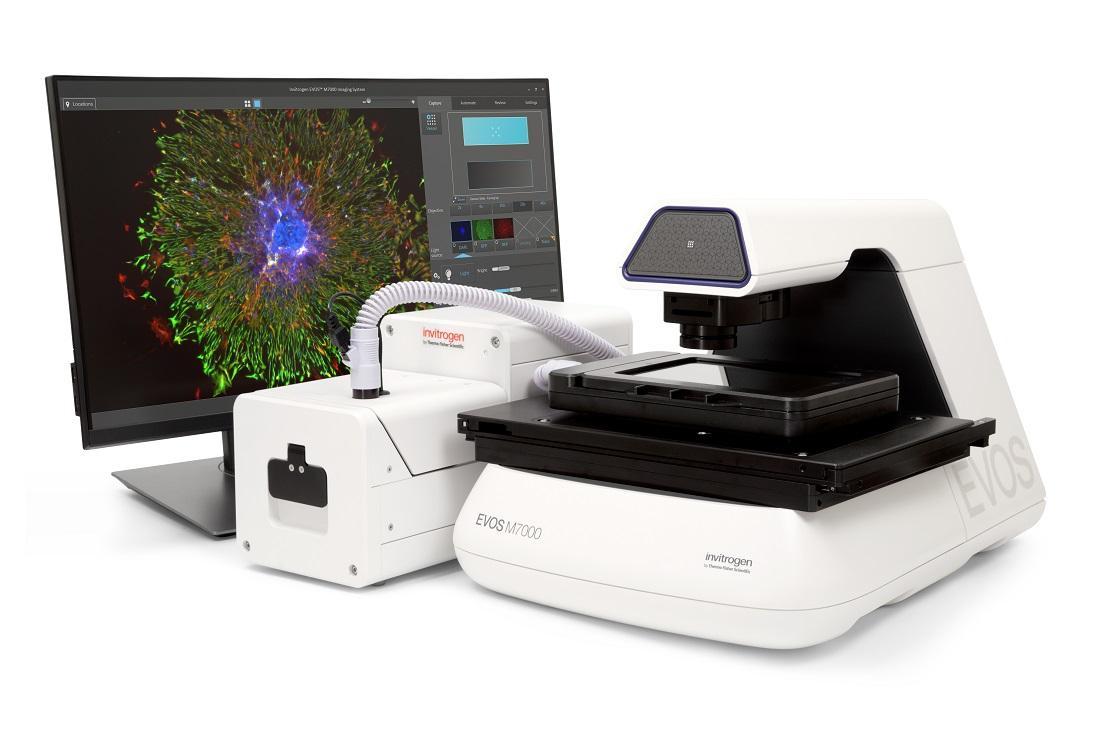
 留言咨询
留言咨询
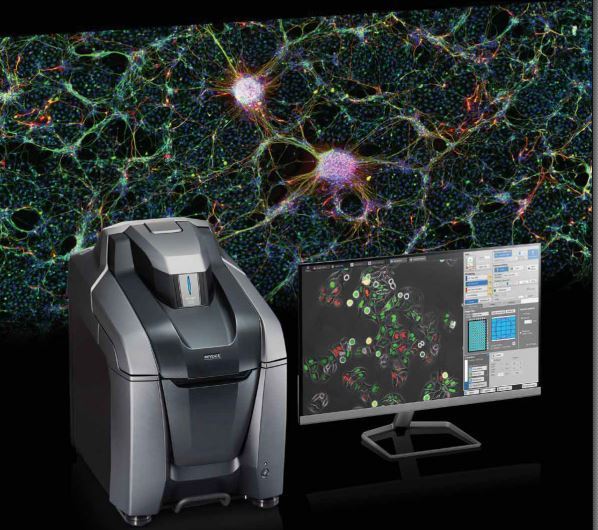
 400-801-8191
400-801-8191
 留言咨询
留言咨询

 400-860-5168转2703
400-860-5168转2703
 留言咨询
留言咨询
 400-860-5168转3825
400-860-5168转3825
 留言咨询
留言咨询