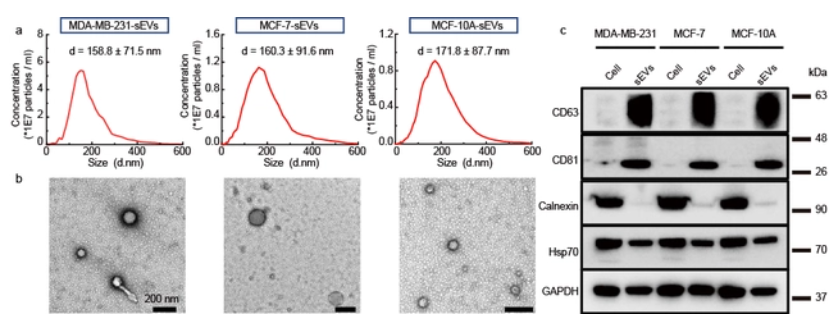
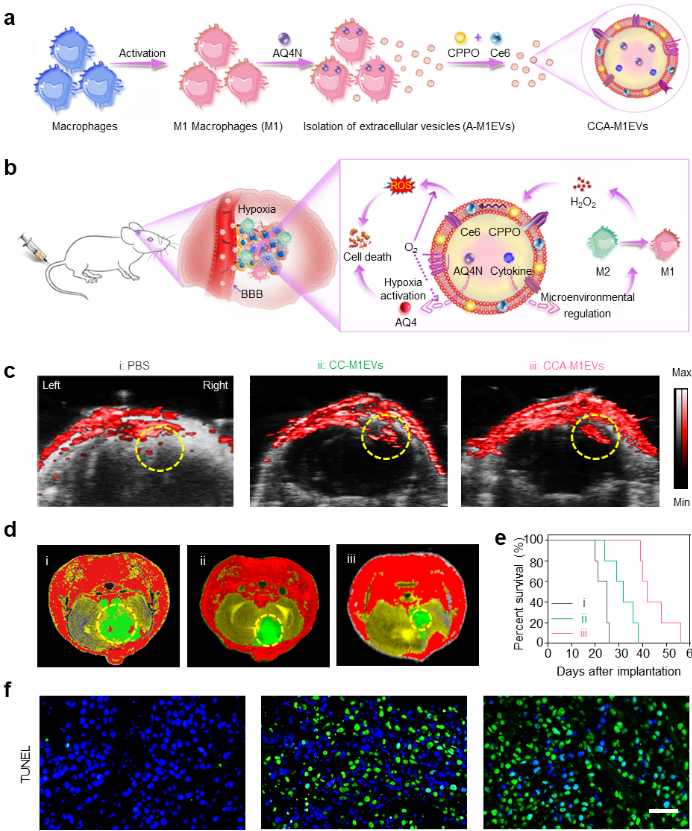
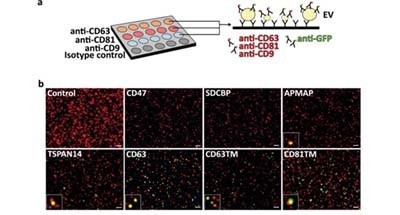
单个外泌体表征分析技术2021上半年亮点论文盘点
单个外泌体表征分析是将免疫学与光学结合的一种新技术[1]。该技术先利用免疫识别将特定的外泌体进行捕获分离,然后再对目标外泌体的表面标志物及内容物(如携带的蛋白质、RNA、DNA及细胞因子)进行定量分析,从而更加全面地反映外泌体的特性。作为外泌体表征分析的倡导者,美国NanoView Biosciences于2018年推出了全自动外泌体荧光检测分析系统ExoView,该系统一经推出,便引起了外泌体领域科研工作者的广泛关注,仅两年在全球已有50多个实验室采用该技术,发表文献近百篇。进入2021年,使用ExoView发表的论文出现井喷性增长,短短数月已经发表了近30篇。本文将选取其中几篇比较有代表性的文章,来说明ExoView在肾脏再生、胎儿早产、miRNA等研究领域的具体应用。 ACS Nano:多聚脱氧核糖核苷酸和干细胞来源的细胞外囊泡的复合生物活性支架可用于肾脏再生 慢性肾病(CKD)已是一个严重的公共卫生问题,因为其治疗成本高,而且发病率和患病率在不断增加。目前CKD的治疗方法是肾脏替代疗法,包括腹膜透析、血液透析和肾脏移植,但可用肾脏的数量无法满足日益增长的需求。因此,肾脏组织工程和肾脏再生被认为是一种有前景的治疗方法。基于此,Kyoung-Won Ko等[2]研发了一种多孔气动微挤压复合支架(PME),它是由聚乳酸-乙醇酸共聚物(PLGA, P)、氢氧化镁(MH, M)和脱细胞猪肾细胞外基质 (kECM, E) 组成,并用多聚脱氧核糖核苷酸(PDRN)和肿瘤坏死因子-α(TNF-α)/干扰素-γ(IFN-γ)诱导的间充质干细胞来源的细胞外囊泡(TI-EV)进行功能化,以促进肾组织的再生和维持其功能。结果显示与现有的肾部分切除小鼠模型的 PME 支架相比,PME/PDRN/TI-EV支架可诱导有效的肾小球再生和肾功能恢复。 其中,研究人员使用ExoView对未处理的脐带组织间质干细胞的外泌体(UC-EV)和经过TNF-α/IFN-γ 预处理的脐带组织间质干细胞的外泌体(TI-EV)进行检测,结果显示CD9和CD81在UC-EV上显着表达,而CD63主要在TI-EV 上表达(图1)。由于CD63对内吞作用很重要,因此TI-EV比UC-EV更容易被细胞摄取。 图1 ExoView检测CD9、CD63、CD8在UC-EV和TI-EV中的表达Lab on a Chip:细胞外囊泡介导的母胎之间HMGB1信号诱导早产 早产(PTB,小于37周的妊娠)每年影响了全球约11%的孕妇,造成100万新生儿的死亡。高迁移率族蛋白B1(HMGB1)是一种警报素,是衰老羊膜细胞通过细胞外囊泡释放的炎症信号之一。羊水、脐带血和孕妇血液中的HMGB1水平升高与足月和早产有关。Enkhtuya Radnaa等[3]通过电穿孔把正常羊膜上皮细胞的外泌体改造为含有HMGB1的外泌体(eHMGB1)并对其进行表征,然后使用包含四个不同细胞类型(羊膜、绒毛膜间充质、绒毛膜滋养层和蜕膜细胞)的四腔微流控芯片器官设备(FMi-OOC)测试其在母-胎界面(FMi)中的传播力。结果显示导致PTB的eHMGB1与增加的FMi炎症有关。该研究证明了胎儿外泌体介导的旁分泌信号传导可以产生炎症并诱导分娩。 值得注意的是,研究人员对eCTRL与eHMGB1进行荧光染色标记并使用ExoView进行检测。基于ExoView可有效检测外泌体内容物的特性,研究结果显示eHMGB1的HMGB1阳性外泌体数量明显高于eCTRL,而CD9和 CD63阳性的外泌体在两个样本中数量接近,这表明HMGB1已成功装载到eHMGB1中(图2)。图2 ExoView检测改造的对照外泌体(eCTRL)与eHMGB1 Brain Behavior and Immunity:脊髓损伤导致血清神经炎症相关纳米颗粒中miRNA与CD81+外泌体水平的改变 脊髓损伤(SCI)会对机体产生系统性影响,导致呼吸、免疫、消化等功能异常,以及相关脑区产生神经炎症和退行性病变。有研究表明,SCI的病理发展可能与血液中外泌体的运输有关;而在中枢神经系统损伤模型中,外泌体可能参与了miRNA等炎性因子运输导致炎症扩散。Khan等[4]使用包括Exoview外泌体表型分析的多种技术详细表征了SCI建模的小鼠血浆外泌体,发现损伤后外泌体的数量、蛋白marker和内容物均有明显的变化,将SCI小鼠的外泌体注射入脑室还可诱发产生炎症。研究人员使用ExoView检测了SCI血浆外泌体的粒径、数量、荧光强度和共定位(图3A)。外泌体在CD81和CD9区域产生特异性结合而被捕获,而没有CD63捕获。根据干涉成像获得外泌体尺寸分布,其中在50nm多(图3B&C)。荧光成像则检测到了大量干涉成像检测不出的尺寸小于50nm的外泌体(图3D&E),CD81和CD9在大量外泌体上表型出荧光共定位,而CD63荧光则未被检测到,这与图3C结果一致(图3F-H)。图3 ExoView检测血浆外泌体的粒径、数量、荧光强度和共定位 研究人员进一步比较了SCI组和对照组的血浆外泌体变化,结果表明,在损伤后1d的时间点,CD81外泌体数量相对对照组更高,与Western Blot的结果一致;而CD9外泌体数量则没有统计学差异,与流式分析的结果一致(图4A&B)。基于图3H的CD81与CD9有大量的荧光共定位,检测CD9外泌体的CD81荧光强度,由1d的荧光强度中位数差异可知,CD81+外泌体数量与外泌体的CD81含量在损伤后1d有明显上升(图4C)。图4 ExoView检测血浆外泌体的粒径、数量、荧光强度和共定位 参考文献:[1] Scherr, S. M., Daaboul, G. G., Trueb, J., Sevenler, D., Fawcett, H., Goldberg, B., ... & Ünlü, M. S. (2016). Real-time capture and visualization of individual viruses in complex media. ACS nano, 10(2), 2827-2833.[2] Kyoung-Won Ko, So-Yeon Park, Eun Hye Lee, Yong-In Yoo, Da-Seul Kim, Jun Yong Kim, Tae Gyun Kwon and Dong Keun Han. (2021). Integrated Bioactive Scaffold with Polydeoxyribonucleotide and Stem-Cell-Derived Extracellular Vesicles for Kidney Regeneration. ACS Nano, 15(4): 7575−7585.[3] Enkhtuya Radnaa, Lauren S. Richardson, Samantha Sheller-Miller, Tuvshintugs Baljinnyam, ...& Ramkumar Menon. (2021). Extracellular vesicle mediated feto-maternal HMGB1 signaling induces preterm birth. Lab on a Chip, DOI: 10.1039/D0LC01323D.[4] Khan, N. Z., Cao, T., He, J., Ritzel, R. M., Li, Y., Henry, R. J., ... & Wu, J. (2021). Spinal cord injury alters microRNA and CD81+ exosome levels in plasma extracellular nanoparticles with neuroinflammatory potential. Brain, behavior, and immunity, Volume 92: 165-183.全自动外泌体荧光检测分析系统(ExoView R100)简介Nanoview所开发的全自动外泌体荧光检测分析系统(ExoView R100)采用单粒子干涉反射成像传感器(SP-IRIS)技术,是一款无需纯化的全自动的新型外泌体表征设备。该设备能够提供全方位的外泌体表征信息,包括颗粒大小、计数、表型与生物标志物共定位等,提供多层次和全面的外泌体测量解决方案。 为了更好的服务中国客户,Quantum Design中国子公司在北京建立了专业的客户服务中心,正式推出专业的全方位外泌体表征测试服务,您只需要少量样品即可获得全方位的外泌体表征数据。欢迎各位老师垂询:010-85120280。前10名订购服务的老师,可享受8折优惠!扫描上方二维码,即刻订购吧!