申报流程:1、准备全套资料一套(原件)及注册申请表的电子文档至省药监局受理办公室提交资料;2、省药监局形式审查资料符合要求,出具受理通知书及缴费通知单,5日内组织研制现场核查,须抽样的出具抽样单及送检通知单(生物制品同时抽取3批样品送中检所检验),抽样单盖公司章后返1份给省局;3、省药监局完成现场核查后出具现场核查报告、审查意见、资料袋封面。4、将省局出具的研制现场核查报告、审查意见和注册申请表(原件)各一份装入两套完整申报资料(其中一套多放1份注册申请表),同时复印核查报告、审查意见、注册申请表各一份放入半套资料(1~5、复印件),即完成完整的两套半资料,申请人办理从省局快递寄国家药审中心审评。5、通过受理号在药审中心网站查询审评进度,同时及时登录在CDE网站的注册用户名和口令,参照CDE网站“电子提交”栏目“模板下载”中提供的模板进行整理和电子提交(3、4、5、6、7、16、28号综述资料的电子文档,原料不提交5号)。(二)报生产 1号资料(药品名称):表述药品名称,阐明名称命名理由或来源,新剂型、新命名、应附上药典委员会命名的复函。 2号资料(证明性文件): 1、申报人的资质:生产厂的“三证”(注意名称地址的一致和有效期);除生产企业外的合作研究方同时申请新药证书需提供有效的营业执照、研究单位的法人证书及其变更登记证明 2、专利查询报告、不侵权保证书(加盖所有申请人的红章) 3、属特殊药品的须有SFDA安监司的立项批件 4、制剂用原料药的合法来源(上省批件或进口注册证、原料厂家的三证、供货协议、购买发票、质量标准、出厂报告书及自检报告书),向经销单位购买的,还需提供经销商与原料厂的供货协议 5、申请人同时申报原料与制剂的则不提供“4”的资料,若同时申请原料和制剂的厂家不是同一家,则须提供原料厂与制剂厂之间的供货协议或合作开发协议以及原料药受理单。(相同制剂,原料药只能和一个申请人合作申报)。 6、拟申请商品名的提供商标查询单或商标注册证 7、直接接触药品的包装材料或容器的供应商资质、包材注册证、报告书、质量标准 8、临床试验批件 9、临床试验对照样品的购买发票、质量标准及检验报告书 10、委托试验:应提供委托合同,并附该机构合法登记证明、必要的资质证明。 11、中检所出具的制备标准品的原材料受理单(申报原料) 12、新开办企业、新建车间或新增剂型的,在《生产许可证》上载明相应事项的后,方可申报生产 13、申请人发生变化时,在此提交说明并附转让协议、新申请人资质 3号资料(立题目的与依据): 参考药审中心的指导原则要求 4号资料(对主要研究结果的总结及评价):参考药审中心的指导原则要求,增加临床试验研究结果、规模化试生产工艺、质量标准研究情况及报临床时中试样品的长期留样情况,如果临床批件上有遗留问题的,应说明是否完成,分别在几号申报资料中详细回答 5号资料(药品说明书、起草说明及相关参考文献):格式符合24号令要求,贮藏条件与稳定性考察结果是否符合,不良反应、用法用量、注意事项是否与临床实验研究结果吻合,包材、包装规格与销售部门沟通后确定。 [font=Times

有时候琢磨下药品也是挺有意思的,独乐乐不如众乐乐,我就看个头,欢迎大家一起讨论吧。 比如下图这个药,注意它的性状写着“本品为包炭衣浓缩水丸”,这个炭衣难道真是炭做的包衣?那不是黑不溜秋的了,能吃??http://ng1.17img.cn/bbsfiles/images/2013/09/201309251044_467186_1645752_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/09/201309251045_467187_1645752_3.jpg
专家:馒头包药不科学新加坡卫生科学局昨日受询时表示,中国媒体报道的铬超标胶囊药品并没有在本地申请售卖。 (综合讯)铬超标的“毒胶囊”事件曝光后,不少中国民众都对胶囊药品产生排斥心理,有些人选择直接服用胶囊内的药粉,还有人发明“馒头包药”等新吃法,但专家称这些方法都不科学。 据新华网报道,浙江杭州的黄老太日前在服用胶囊感冒药时,由于担心胶囊有问题,就把胶囊拧开直接吞药粉,结果却被药粉呛得喉咙疼。杭州市中医院为老人做检查后,发现她的食道被药粉灼伤了。 得知胶囊药粉不能直接服用后,网友也发明了许多新吃法,如将胶囊药粉倒入馒头片,再把馒头片捏成团状的“馒头包药”,类似的方法还有“香蕉包药”、“汤圆包药”、“黄瓜包药”等。 对于五花八门的“新吃法”,专家表示,药品做成片剂、冲剂或是胶囊装,都有医学道理;胶囊对药效发挥有不可替代的作用,以上“剥壳服药”的方法均不可取。 医生建议,患者若实在不愿服用胶囊类药物,应及时询问医生能否改用其他类型的药物。九家涉事企业无一道歉 另据中新社报道,截至昨日下午,浙江省药监部门对新昌18家胶囊企业的涉嫌铬超标产品进行抽检,已完成检测的96批次中,不合格达33批次。对修正药业、通化金马等九家涉事药品生产企业的监督检查仍在进行中,但目前这九家企业无一正式做出道歉声明。 针对民众关注的“工业明胶是否也用于果冻、酸奶”问题,北京市质量监督局局长赵长山表示,目前北京没有“工业明胶”生产企业,质监部门也没有接到针对北京获证食品生产企业使用“工业明胶”进行食品生产的投诉举报。在近日对许可企业开展的监督检查中,也未发现相关违法行为,消费者可放心食用酸奶和果冻。
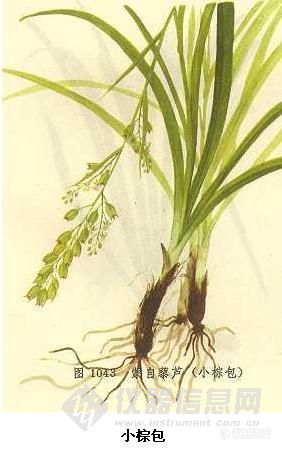
小棕包活血散瘀,止血镇痛,催吐利水。用于跌打损伤,骨折,水肿;外用治外伤出血。http://ng1.17img.cn/bbsfiles/images/2012/07/201207261302_379817_1620630_3.jpg【别名】批麻草、小黎芦【来源】为百合科黎芦属植物蒙自黎芦Veratrum mengtzeanum Loes. f.,以根及全草入药。秋季采收,分别晒干。注:同属植物尚有狭叶黎芦Veratrum stenophyllum Diels近前种,分布于云南省。也作“小棕包”入药。【备注】(1)本品有毒,内服宜慎。中毒症状为头昏,呕吐,血压下降,心跳减慢等。
[b]各位大佬,请教你们。我们公司申请做药包的生产,有新的微生物实验室,但是还没有购买设备仪器。主要参考标准YBB00192002-2015、YBB00192004-2015、YBB00172002-2015。实验室需要的设备仪器有哪些?小弟仅仅知道几个名字,比如:生物安全柜、超净工作台、培养箱等,但是具体规格型号啥都不清楚。有知道的大佬麻烦你们了[/b]
附件目录:附件:1.实施注册管理的药包材产品目录;2.药包材生产申请资料要求;3.药包材进口申请资料要求;4.药包材再注册申请资料要求;5.药包材补充申请资料要求;6.药包材生产现场考核通则;7.药包材生产洁净室(区)要求。附件1:实施注册管理的药包材产品目录一、输液瓶(袋、膜及配件);二、安瓿;三、药用(注射剂、口服或者外用剂型)瓶(管、盖);四、药用胶塞;五、药用预灌封注射器;六、药用滴眼(鼻、耳)剂瓶(管);七、药用硬片(膜);八、药用铝箔;九、药用软膏管(盒);十、药用喷(气)雾剂泵(阀门、罐、筒);十一、药用干燥剂。附件2:药包材生产申请资料要求一、申报资料目录(一)省级(食品)药品监督管理局对申报单位药包材生产情况考核报告。(二)国家食品药品监督管理局设置或者确定的药包材检验机构出具的三批申报产品质量检验报告书。(三)国家食品药品监督管理局设置或者确定的药包材或者药品检验机构出具的洁净室(区)洁净度检验报告书。(四)申请企业营业执照。(五)申报产品生产、销售、应用情况综述。(六)申报产品的配方。(七)申报产品的生产工艺及主要生产、检验设备说明。(八)申报产品的质量标准。(九)三批申报产品的生产企业自检报告书。(十)与采用申报产品包装的药品同时进行的稳定性试验(药物相容性试验)研究资料。(十一)申报产品生产厂区及洁净室(区)平面图。(十二)申报产品生产企业环境保护、废气废水排放、安全消防等符合国家有关法律规定,所取得的有关合格证明。二、申报要求(一)上述第(一)、(二)、(三)项资料,均应当提供原件。(二)上述第(四)项资料,可以提供复印件。(三)上述第(八)项资料,若为新药包材或者企业标准,应当同时提供起草说明。(四)上述第(九)项资料,应当提交距申报日期一年内的检测报告书原件。附件3:药包材进口申请资料要求一、申报资料目录(一)生产者合法生产资格证明文件、公证文件及其中文译文。(二)申报产品生产厂商委托中国境内代理机构申报的授权文书、公证文件及其中文译文。中国境内代理机构的工商执照或者申报产品生产厂商常驻中国境内办事机构的《外国企业常驻中国代表机构登记证》。(三)申报产品在国外的生产、销售、应用情况综述及申请在中国注册需特别说明的理由。(四)国家食品药品监督管理局设置或者确定的药包材检验机构出具的三批申报产品质量检验报告书。(五)洁净室(区)洁净度检验报告及三批产品自检报告书。(六)申报产品的配方。(七)申报产品的生产工艺及主要生产、检验设备说明。(八)申报产品的质量标准。(九)与采用申报产品包装的药品共同进行的稳定性试验(药物相容性试验)研究资料。(十)申报产品生产厂区及洁净室(区)平面图。二、申报要求(一)上述第(一)项资料,申请人应当提交由原产国政府部门批准其从事药包材生产和经营的证明文件复印件(相当于我国的工商营业执照、生产许可证或者注册证书等)、公证文件原件。其中:1、凡原产国政府对药包材在本国上市进行专门审批的,必须提供此类批准证明文件。2、凡原产国政府规定无须办理上述专门批准件的,在如实说明后,可免于提供此项资料。(二)上述第(二)项资料,申报产品生产厂商授权中国境内代理机构代理申报的授权文书、公证文件均需提供原件;中国境内代理机构的工商执照或者申报产品生产厂商常驻中国境内办事机构的《外国企业常驻中国代表机构登记证》可以提供复印件。(三)上述第(四)项资料,应当提供原件,可在技术审评工作开始后单独另行提交。(四)上述第(五)项资料,应当提交申报日期一年内的检验报告原件。(五)上述第(八)项资料,若为新药包材或者企业标准,还应当同时提供起草说明。(六)全部申报资料均应当使用中文并附英文,其他文种的资料可附后作为参考。中文译文应当与原文内容一致。附件4:药包材再注册申请资料要求一、生产药包材再注册申请资料要求(一)申报资料目录1、我局颁发的药包材批准证明文件及其批准变更证明文件。2、申请人合法登记证明文件。3、国家食品药品监督管理局设置或者确定的药包材检验机构出具的三批申报产品质量检测报告书。4、国家食品药品监督管理局设置或者确定的药包材或者药品检验机构出具的洁净室(区)洁净度检测报告书。5、申报产品的配方。6、申报产品的生产工艺及主要生产、检验设备说明。7、申报产品的质量标准。8、三批申报产品的生产企业自检报告书。9、该产品五年内销售及质量情况的总结报告。10、批准该产品注册或者再注册时,要求继续完成的工作的执行情况。(二)申报要求1、上述第(一)、(二)项资料,可以提供复印件。2、上述第(三)、(四)项资料,应当提供原件。3、上述第(五)、(六)项资料,若与上次注册内容相比有所改变,应当指出具体改变的内容。4、上述第(七)项资料,再注册时对质量标准进行修订的,应当同时提供原质量标准、修订后的质量标准及修订说明。5、上述第(八)项资料,应当提交距申报日期一年内的检验报告书原件。6、上述第(九)项资料,应当包括年销售量、使用本产品的药品生产企业及所包装药品品种目录、用户对本品使用评价、质量检验情况、药包材生产企业对产品自检合格率、有无质量事故及官方质量抽检等情况。
什么是药包材与药物的相容性?如何进行药包材与药物的相容性实验?

[font=微软雅黑][color=#656565][font=微软雅黑][img=,690,151]https://ng1.17img.cn/bbsfiles/images/2020/08/202008212049459565_7243_2507958_3.jpg!w690x151.jpg[/img][/font][/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]药品包装材料的质量优劣事关药品质量,制药企业和药包材生产企业必须考察药品和包材之间的相容性,确保药品装在包装材料后不会发生迁移、渗透、腐蚀等情况,以保证药品有效性和稳定性,从而保障国民用药安全。随着我国药包材关联审评审批制度的实施,当前,药包材相容性研究备受关注,对药包材质自身质量评价和对制剂影响至关重要,是技术上的重点和难点。[/font][/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]为帮助制药行业的用户学习药品与药包材相容性分析检测方法,仪器信息网将于[/font]2020年8月31日举办“药品与药包材相容性研究”主题网络研讨会,会议将邀请多位业内专家做精彩报告,为广大用户搭建一个即时、高效的交流和学习的平台。[/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]会议内容:[/font][/color][/font][img=,690,396]https://ng1.17img.cn/bbsfiles/images/2020/08/202008212049575133_3353_2507958_3.png!w690x396.jpg[/img][font=微软雅黑][color=#656565][font=微软雅黑]会议时间:[/font]2020年8月31日13:30-18:00[/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]报名地址:[/font][/color][/font][url=https://www.instrument.com.cn/webinar/meetings/packagingmaterials]点击打开链接[/url][font=微软雅黑][color=#656565][font=微软雅黑]欢迎报名参加![/font][/color][/font]
谁有新版的中国药包材标准,麻烦分享一份给我,谢谢啦

[font=微软雅黑][color=#656565][font=微软雅黑][img=,690,151]https://ng1.17img.cn/bbsfiles/images/2020/08/202008212048541452_2877_2507958_3.jpg!w690x151.jpg[/img][/font][/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]药品包装材料的质量优劣事关药品质量,制药企业和药包材生产企业必须考察药品和包材之间的相容性,确保药品装在包装材料后不会发生迁移、渗透、腐蚀等情况,以保证药品有效性和稳定性,从而保障国民用药安全。随着我国药包材关联审评审批制度的实施,当前,药包材相容性研究备受关注,对药包材质自身质量评价和对制剂影响至关重要,是技术上的重点和难点。[/font][/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]为帮助制药行业的用户学习药品与药包材相容性分析检测方法,仪器信息网将于[/font]2020年8月31日举办“药品与药包材相容性研究”主题网络研讨会,会议将邀请多位业内专家做精彩报告,为广大用户搭建一个即时、高效的交流和学习的平台。[/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]会议内容:[/font][/color][/font][img=,690,396]https://ng1.17img.cn/bbsfiles/images/2020/08/202008212048253290_5054_2507958_3.png!w690x396.jpg[/img][font=微软雅黑][color=#656565][font=微软雅黑]会议时间:[/font]2020年8月31日13:30-18:00[/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]报名地址:[/font][/color][/font][url=https://www.instrument.com.cn/webinar/meetings/packagingmaterials]点击打开链接[/url][font=微软雅黑][color=#656565][font=微软雅黑]欢迎报名参加![/font][/color][/font]

[font=微软雅黑][color=#656565][font=微软雅黑][img=,690,151]https://ng1.17img.cn/bbsfiles/images/2020/08/202008212050123524_7529_2507958_3.jpg!w690x151.jpg[/img][/font][/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]药品包装材料的质量优劣事关药品质量,制药企业和药包材生产企业必须考察药品和包材之间的相容性,确保药品装在包装材料后不会发生迁移、渗透、腐蚀等情况,以保证药品有效性和稳定性,从而保障国民用药安全。随着我国药包材关联审评审批制度的实施,当前,药包材相容性研究备受关注,对药包材质自身质量评价和对制剂影响至关重要,是技术上的重点和难点。[/font][/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]为帮助制药行业的用户学习药品与药包材相容性分析检测方法,仪器信息网将于[/font]2020年8月31日举办“药品与药包材相容性研究”主题网络研讨会,会议将邀请多位业内专家做精彩报告,为广大用户搭建一个即时、高效的交流和学习的平台。[/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]会议内容:[/font][/color][/font][img=,690,396]https://ng1.17img.cn/bbsfiles/images/2020/08/202008212050288292_6768_2507958_3.png!w690x396.jpg[/img][font=微软雅黑][color=#656565][font=微软雅黑]会议时间:[/font]2020年8月31日13:30-18:00[/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]报名地址:[/font][/color][/font][url=https://www.instrument.com.cn/webinar/meetings/packagingmaterials]点击打开链接[/url][font=微软雅黑][color=#656565][font=微软雅黑]欢迎报名参加![/font][/color][/font]

[font=微软雅黑][color=#656565][font=微软雅黑][img=,690,151]https://ng1.17img.cn/bbsfiles/images/2020/08/202008212050444446_4291_2507958_3.jpg!w690x151.jpg[/img][/font][/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]药品包装材料的质量优劣事关药品质量,制药企业和药包材生产企业必须考察药品和包材之间的相容性,确保药品装在包装材料后不会发生迁移、渗透、腐蚀等情况,以保证药品有效性和稳定性,从而保障国民用药安全。随着我国药包材关联审评审批制度的实施,当前,药包材相容性研究备受关注,对药包材质自身质量评价和对制剂影响至关重要,是技术上的重点和难点。[/font][/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]为帮助制药行业的用户学习药品与药包材相容性分析检测方法,仪器信息网将于[/font]2020年8月31日举办“药品与药包材相容性研究”主题网络研讨会,会议将邀请多位业内专家做精彩报告,为广大用户搭建一个即时、高效的交流和学习的平台。[/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]会议内容:[/font][/color][/font][img=,690,396]https://ng1.17img.cn/bbsfiles/images/2020/08/202008212050556586_4193_2507958_3.png!w690x396.jpg[/img][font=微软雅黑][color=#656565][font=微软雅黑]会议时间:[/font]2020年8月31日13:30-18:00[/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]报名地址:[/font][/color][/font][url=https://www.instrument.com.cn/webinar/meetings/packagingmaterials]点击打开链接[/url][font=微软雅黑][color=#656565][font=微软雅黑]欢迎报名参加![/font][/color][/font]
制药行业好像一直都没有消停过。这不,又曝出了胶囊铬超标问题。 作为制药企业,据了解,一般是考察过供应商资质以后,只要有供应商的检验合格报告,一般是不对进厂的包材进行全面的质量检测的,更别说其中的有害物质含量了。 你了解的制药企业测包材中的有害物质么?

[font=微软雅黑][color=#656565][font=微软雅黑][img=,690,151]https://ng1.17img.cn/bbsfiles/images/2020/08/202008212049189126_3796_2507958_3.jpg!w690x151.jpg[/img][/font][/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]药品包装材料的质量优劣事关药品质量,制药企业和药包材生产企业必须考察药品和包材之间的相容性,确保药品装在包装材料后不会发生迁移、渗透、腐蚀等情况,以保证药品有效性和稳定性,从而保障国民用药安全。随着我国药包材关联审评审批制度的实施,当前,药包材相容性研究备受关注,对药包材质自身质量评价和对制剂影响至关重要,是技术上的重点和难点。[/font][/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]为帮助制药行业的用户学习药品与药包材相容性分析检测方法,仪器信息网将于[/font]2020年8月31日举办“药品与药包材相容性研究”主题网络研讨会,会议将邀请多位业内专家做精彩报告,为广大用户搭建一个即时、高效的交流和学习的平台。[/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]会议内容:[/font][/color][/font][img=,690,396]https://ng1.17img.cn/bbsfiles/images/2020/08/202008212049305129_2456_2507958_3.png!w690x396.jpg[/img][font=微软雅黑][color=#656565][font=微软雅黑]会议时间:[/font]2020年8月31日13:30-18:00[/color][/font][font=微软雅黑][color=#656565][font=微软雅黑]报名地址:[/font][/color][/font][url=https://www.instrument.com.cn/webinar/meetings/packagingmaterials]点击打开链接[/url][font=微软雅黑][color=#656565][font=微软雅黑]欢迎报名参加![/font][/color][/font]
哈希的氨氮分析仪用485传输信号到数采仪没有回包数据要如何解决?有知道的吗?
中西药复方制剂在申报时,是按西药报还是中药报呢?
申报流程:1、准备全套资料一套(原件)及注册申请表的电子文档至省药监局注册处受理办公室提交资料;2、省药监局形式审查资料符合要求,出具受理通知书及缴费通知单,5日内组织研制现场核查,同时抽取3批样品送药检所检验(生物制品除外),出具现场抽样单及送检通知单,现场抽样单盖公司章后返1份给省局;3、省药监局完成现场核查后出具现场核查报告、审查意见、资料袋封面;4、将省局出具的研制现场核查报告、审查意见和注册申请表(原件)各一份装入两套申报资料(其中一套多放1份注册申请表),同时复印核查报告、审查意见、注册申请表各一份放入半套资料(1~6、7、16、28号资料复印件),即完成完整的两套半资料,申请人办理从省局快递寄国家药审中心审评。5、通过受理号在药审中心网站查询审评进度,同时及时登录在CDE网站的注册用户名和口令,参照CDE网站“电子提交”栏目“模板下载”中提供的模板进行整理和电子提交(3、4、5、6、7、16、28号综述资料的电子文档,原料不提交5号)。 6、中心审评通过时发出《关于提交生产工艺以及对工艺变更情况确认的函》的正式书面通知,按通知要求在向中心回复纸质文件的同时进行相关资料的电子提交。 7、中心审评符合规定的,通知申请人申请生产现场检查,申请人6个月内填写《生产现场检查申请表》向SFDA认证管理中心(5类向省局)提交申请,认证中心/省局30日内组织批量生产过程现场检查,抽取1批样品(生物制品3批),送指定药检所检验(需标准品的同时送药检所,报告书由药检所寄审评中心),认证中心/省局在10日内将检查报告交审评中心。8、等待SFDA签发批件及新药证书 ** 符合《办法》第四十五条可以实行特殊审批的新药,参照2009年1月9日国家食品药品监督管理局颁布了《关于印发新药注册特殊审批管理规定的通知(国食药监注17号)》填写《新药注册特殊审批申请表》,并提交相关资料。《新药注册特殊审批申请表》和相关资料应单独立卷,与《药品注册管理办法》规定的申报资料一并报送药品注册受理部门。二、仿制药(6类) 1号资料(药品名称):表述药品名称,阐明名称命名理由或来源,附国家药品标准。 2号资料(证明性文件): 1、申报人的资质:生产厂的“三证”(注意名称地址的一致和有效期); 2、专利查询报告、不侵权保证书(加盖所有申请人的红章) 3、属特殊药品的须有SFDA安监司的立项批件 4、制剂用原料药的合法来源(上省批件或进口注册证、原料厂家的三证、供货协议、购买发票、质量标准、出厂报告书及自检报告书),向经销单位购买的,还需提供经销商与原料厂的供货协议; 5、申请人同时申报原料与制剂的则不提供“4[font=宋
有关药品包装材料的规范生产——包材GMP[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=115753]药包材GMP[/url]
我最近工作涉及到药品管理,关于易制毒和易制爆两类的药品要分开专柜保存,网上找了下这两类药品,没看到最新版的,在此向各位求助一份,多谢各位。
现在有家面包坊想做标准检测室,但不知具体要那些仪器[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=61083]面包行业具体要检测那些项目[/url]
请问,大家谁有药包相容性研究相关的资料?
今天才发现原来可以重复兑换礼包,只是月饼勋章只能得一个!可是兑换积分礼包为什么要限制每人每天只能一次呢?
谁能分享一份2015年版的药包材国家标准谢谢
[align=right][b]SGLC-GC-056[/b][/align][b]摘要:[/b]本文建立了药包材(预灌封注射器)中环氧乙烷的[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相[/color][/url]测定方法。结果表明,参照《药包材环氧乙烷测定法》公示稿中第二法的色谱条件,采用色谱柱SH-624分析药包材(预灌封注射器)中环氧乙烷,环氧乙烷峰形对称,理论塔板数大于5000,且环氧乙烷与相邻杂质(如:乙醛)峰基线分离。此方法可为药包材(预灌封注射器)中环氧乙烷的测定提供参考。[b]关键词:[/b]药包材 预灌封注射器 环氧乙烷 SH-624 GC[b]1. 实验部分1.1 实验仪器及耗材[/b]Shimadzu GC-2030[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱仪[/color][/url];HS-10顶空进样器;纯水机:PR-FP-0120α-MT1(+ 60L水箱+取水器)色谱柱:SH-624(30 m,0.25mm ×1.4μm;P/N:R221-75863-30;S/N:1643391);SHIMSEN Arc Disc HPTFE针式过滤器(P/N:380-00341-05);[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]GC-MS[/color][/url]认证样品瓶LabTotal Vial(P/N:227-34002-01);SHIMSEN Pipet[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url]:SHIMSEN Pipet PMII-10(P/N:380-00751-02);SHIMSEN Pipet PMII-100(P/N:380-00751-04);SHIMSEN Pipet PMII-1000(P/N:380-00751-06)。[b]1.2 对照品溶液的制备混合对照品溶液(0.4μg/mL):[/b]在20mL顶空瓶中预先加入5mL水,用微量注射器分别精密吸取环氧乙烷标准溶液母液(1mg/mL,样品溶剂为甲苯)、乙醛标准溶液母液(1mg/mL,样品溶剂为乙腈)适量,注入顶空瓶中,配成0.4μg/mL的对照品溶液,立即压盖密闭,摇匀。[b]混合对照品溶液(20μg/mL):[/b]在20mL顶空瓶中预先加入5mL水,用微量注射器分别精密吸取环氧乙烷标准溶液母液(1mg/mL,样品溶剂为甲苯)、乙醛标准溶液母液(1mg/mL,样品溶剂为乙腈)适量,注入顶空瓶中,配成20μg/mL的对照品溶液,立即压盖密闭,摇匀。[b]1.3 供试品溶液的制备[/b]吸入标示装量的水,在37℃±1℃条件下恒温1小时得到供试品溶液。取5mL供试品溶液于20mL顶空瓶中,立即压盖密闭。[b]1.4 分析条件[/b]色谱柱:SH-624(30 m,0.25mm ×1.4μm;P/N:R221-75863-30)升温程序:50℃(保持10 min),30 ℃/min的速率升至200℃(保持7 min)载气:N2进样口温度:200℃分流模式:分流(10:1)控制模式:恒流模式载气流速:1.5mL/min检测器:FID,温度:250℃HS条件:顶空瓶平衡温度为60°C,平衡时间为40min进样量:1mL[b]2. 实验结果2.1 色谱图[/b]按照上述色谱条件(1.4)进行采集,混合标准溶液色谱图如下:[b]混合对照品溶液(0.4μg/mL)[/b][img=SHIMSEN Styra HLB]https://img.shimadzumall.com/Storage//userfiles/images/Img_articles/SGLC-GC-056_01.png[/img][font=arial, &][size=12px][/size][/font][b]混合对照品溶液(20μg/mL)[/b][img=SHIMSEN Styra HLB]https://img.shimadzumall.com/Storage//userfiles/images/Img_articles/SGLC-GC-056_02.png[/img][font=arial, &][size=12px][/size][/font][b]供试品溶液[/b][img=SHIMSEN Styra HLB]https://img.shimadzumall.com/Storage//userfiles/images/Img_articles/SGLC-GC-056_03.png[/img][font=arial, &][size=12px][/size][/font][b]混合对照品溶液重现性(0.4 μg/mL)[/b][img=SHIMSEN Styra HLB]https://img.shimadzumall.com/Storage//userfiles/images/Img_articles/SGLC-GC-056_04.png[/img][font=arial, &][size=12px][/size][/font][b]1.3 线性范围[/b]取20 mL顶空瓶6个,预先各加5 mL纯水,用微量注射器吸取一定体积的环氧乙烷标准溶液母液(1 mg/mL,样品溶剂为甲苯)分别注入各顶空瓶中,立即压盖密封,配置成浓度分别为0.4、1、2、5、10和20 μg/mL的环氧乙烷系列对照品溶液,进样分析。以目标物浓度为横坐标,峰面积为纵坐标绘制标准曲线。同样方法配置0.2 μg/mL对照品溶液,进样分析,以3倍信噪比(RMS)计算环氧乙烷的仪器检出限,环氧乙烷标准曲线见图1,标准曲线相关系数以及检出限见表1。[img=SHIMSEN Styra HLB]https://img.shimadzumall.com/Storage//userfiles/images/Img_articles/SGLC-GC-056_05.png[/img][font=arial, &][size=12px][/size][/font][b]3. 结论[/b]本文建立了药包材(预灌封注射器)中环氧乙烷的[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相[/color][/url]测定方法。结果表明,参照《药包材环氧乙烷测定法公示稿》中第二法的色谱条件,采用色谱柱SH-624分析药包材(预灌封注射器)中环氧乙 烷,环氧乙烷峰形对称,理论塔板数大于5000,且环氧乙烷与相邻杂质(如:乙醛)峰基线分离。此 方法可为药包材(预灌封注射器)中环氧乙烷的测定提供参考。
(一)、报临床 1号资料(药品名称):表述药品名称,阐明名称命名理由或来源,新剂型、新命名、应附上药典委员会命名的复函。 2号资料(证明性文件): 1、申报人的资质:生产厂的“三证”(注意名称地址的一致和有效期);除生产企业外的合作研究方同时申请新药证书需提供有效的营业执照、研究单位的法人证书及其变更登记证明 2、专利查询报告、不侵权保证书(加盖所有申请人的红章) 3、属特殊药品的须有SFDA安监司的立项批件 4、制剂用原料药的合法来源(上省批件或进口注册证、原料厂家的三证、供货协议、购买发票、质量标准、出厂报告书及自检报告书),向经销单位购买的,还需提供经销商与原料厂的供货协议 5、申请人同时申报原料与制剂的则不提供“4”的资料,若同时申请原料和制剂的厂家不是同一家,则须提供原料厂与制剂厂之间的供货协议或合作开发协议以及原料药受理单。(相同制剂,原料药只能和一个申请人合作申报)。 6、拟申请商品名的提供商标查询单或商标注册证 7、直接接触药品的包装材料或容器的供应商资质、包材注册证、报告书、质量标准 8、委托试验:应提供委托合同,并附该机构合法登记证明、必要的资质证明。 3号资料(立题目的与依据):参考药审中心的指导原则要求 4号资料(对主要研究结果的总结及评价):参考药审中心的指导原则要求 5号资料(药品说明书、起草说明及相关参考文献):格式符合24号令要求,附参考的文献资料 6号资料(包装、标签设计样稿):报临床不提供 7号资料(药学研究资料综述):参考相关的技术指导原则 8号资料(原料药生产工艺的研究资料及文献资料;制剂处方及工艺的研究资料及文献资料):参考相关的技术指导原则 9号资料(确证化学结构或者组份的试验资料及文献资料):参考相关的技术指导原则(报告书及图谱上盖章) 10号资料(质量研究工作的试验资料及文献资料):参考相关的技术指导原则 11号资料(药品标准及起草说明): 起草说明所依据的试验数据至少应加上中试三批样品的结果及临床用样品的结果,或者应加上做验证的多批样品的数据。 12号资料(样品的检验报告书):申报样品的自检报告书(1~3批), 13号资料(原料药、辅料的来源及质量标准、检验报告书): 原料合法来源证明文件一套(同2号资料中的原料资质)辅料的来源(厂家三证、上省批件、质量标准、出厂报告书及自检报告书)研制制剂所用的进口原料药未取得《进口注册证》的,必须经SFDA批准 14号资料(药物稳定性研究的试验资料及文献资料):参考相关的技术指导原则 15号资料(直接接触药品的包装材料和容器的选择依据及质量标准): 附上包材的来源及质量标准 16~27号资料:提供的样品批号一定是前面工艺、质量、稳定性研究的样品之一,有合格的全检报告书;对照样品(阳性药)、报告书、购买的发票(复印件)试验报告、动物合格证及相关照片、图谱等(图片向试验单位索要一式三套以上),照片、图谱有准确标注 28号资料(国内外相关的临床试验资料综述):参考相关的技术指导原则,是否申请免临床在此说明理由 29~30号资料:参考相关的技术指导原则 **同时申请注册属于分类3的原料药和属于分类[/
请问一下总氮标液的硝酸钾与做氯离子的硝酸银是易制爆药吗,购买这两种需要备案才能买吗?如果实验室的易制爆物品多了,会不会增加被抽查的概率呢?
印度单日新增确诊连续四天创纪录,莫迪:疫情风暴已动摇国家。
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=42240]最新药包材法规文件集合SFDA[/url]内容包括:关于《药品说明书和标签管理规定》有关问题解释的通知关于公布非处方药说明书范本的通知关于进一步规范药品名称管理的通知关于进一步加强非处方药说明书和标签管理的通知关于实施《药品说明书和标签管理规定》有关事宜的公告关于印发非处方药说明书规范细则的通知关于印发化学药品和生物制品说明书规范细则的通知关于印发中药、天然药物处方药说明书格式内容书写要求及撰写指导原则的通知药品说明书和标签管理规定(局令第24号)
:1、准备全套资料一套(原件)及注册申请表的电子文档至省药监局注册处受理办公室提交资料;2、省药监局形式审查资料符合要求,出具受理通知书及缴费通知单,5日内组织研制现场核查及生产现场过程检查,同时抽取3批现场生产样品送药检所检验(需标准品的同时送药检所,报告书由药检所寄审评中心),出具现场抽样单及送检通知单,现场抽样单盖公司章后返1份给省局;3、省药监局完成现场核查和检查后出具现场核查报告、审查意见、资料袋封面;4、将省局出具的研制现场核查报告、审查意见和注册申请表(原件)各一份装入两套(原件)申报资料(其中一套多放1份注册申请表),同时复印核查报告、审查意见、注册申请表各一份放入半套资料(1~6号资料复印件),即完成完整的两套半资料,申请人办理从省局快递寄国家药审中心审评。 5、通过受理号在药审中心网站查询审评进度,同时及时登录在CDE网站的注册用户名和口令,参照CDE网站“电子提交”栏目“模板下载”中提供的模板进行整理和电子提交(3、4、5、6、7、8、11、16、28号综述资料的电子文档)。 6、不需临床的品种,中心审评通过后转SFDA注册司,等待SFDA签发批件。 7、需要临床的品种,若为原料6类+制剂6类情形,原料药直接批准生产,制剂批生物等效性临床试验,申请人完成临床试验后,向省局申请临床研究核查,省局组织临床研究核查并出具核查报告(外地将由省局委托当地药监局核查)。申请人获得核查报告后,将核查报告及两套资料(1~6、7、11、14、28~32号、其它变更补充资料及申请人盖章的资料情况说明)从省局寄药审中心资料组( 联系人:和渝红;联系电话:68585566-202;通讯地址:北京省海淀区复兴路甲1号;邮编:100038)。1)提交的二套资料应一律使用A4型纸,其中至少有一套原件,须申报单位和试验完成单位加盖有效印章。2)文件袋的正面应注明:初次受理号、品名、申报单位,并标注原件、复印件。3)文件袋中资料的顺序为:资料目录、技术资料。4)为便于及时反馈受理情况,在邮件中准确注明以下信息:单位名称、联系人、联系电话、传真等。 若为原料3类+制剂6类情形,原料和制剂将同时批临床,完成临床试验后制剂同“6+6”,原料需省局交报生产的上行文,填写申报生产的注册申请表,向省局提交1套完整资料(原件),省局出具形式审查意见,将审查意见、两套原件资料及半套复印资料(1~4、6号)从省局寄药审中心资料组。 8、药审中心收到临床资料后,会以挂号信的方式邮寄回执单,含新的申请编号。中心审评通过后转SFDA注册司,等待SFDA[font=宋体
本类化学品指在外界作用下(如受热、受摩擦、撞击等),能发生剧烈的化学反应,瞬时产生大量的气体和热量,使周围压力急骤上升,发生爆炸,对周围环境造成破坏的物品,也包括无整体爆炸危险,但具有燃烧、抛射及较小爆炸危险,或仅产生热、光、音响或烟雾等一种或几种作用的烟火物品。爆炸品包括:黑色火药、无烟火药、推进火药(以高氯酸盐及氧化铅等为主要药剂)。雷汞、叠氮化铅、硝铵炸药、氯酸钾炸药、高氯酸铵炸药、硝化甘油、乙二醇二硝酸酯、黄色炸药、液态氧炸药、芳香族硝基化合物类炸药。雷管、实弹、空弹、信管、引爆线、导火线、信号管、焰火。其它爆炸性化学药品,如氢、乙烯、乙炔、苯、乙醇、乙醚、丙酮、乙酸乙酯、一氧化碳、氨气 、过氧化物、高氯酸盐、叠氮铅、乙炔铜、三硝基甲苯等。 这类物品都具有化学不稳定性,在一定外界因素的作用下,会进行猛烈的化学反应,主要有以下四个特点: ·化学反应速度极快。一般以万分之一的时间完成化学反应,因为爆炸能量在极短时间放出,因此具有巨大的破坏力。 ·爆炸时产生大量的热。这是爆炸品的主要来源。 ·产生大量气体,造成高压。形成的冲击波对周围建筑物有很大的破坏性。 对撞击、摩擦、温度等非常敏感 任何一种爆炸品的爆炸都需要外界供给它一定的能量--起爆能。某一爆炸品所需的最小起爆能,即为该爆炸品的敏感度。敏感度是确定爆炸品爆炸危险性的一个非常重要的标志,敏感度越高,则爆炸危险性越大。有的爆炸品如梯恩梯、消化甘油、雷汞等都具有一定的毒性。 有些爆炸品与某些化学品如酸、碱、盐发生化学反应,反应的生成物是更容易爆炸的化学品。如:苦味酸遇某些碳酸盐能反应生成更易爆炸的苦味酸盐;苦味酸受铜、铁等金属撞击,立即发生爆炸。