不好意思,小弟是使用LC的,平时的工作就是检测碳水化合物样品,做一些糖类检测方面工作。因新购置一台GC,听说GC也可以测定糖类化合物,但是样品可能需要经过处理才行,特此向各位请教了,GC如何才能测定糖类化合物呢?我知道糖类最好还是使用LC测定,仅仅为了扩展知识而已,还望不吝赐教。
国产离子色谱-脉冲安培检测器测定饮料中常见的糖类化合物郎 蕾1,刘格林1,2,施超欧3*(华东理工大学化学与分子工程学院 分析测试中心,上海 200237)摘要:使用国产离子色谱系统检测饮料中常见的葡萄糖、果糖、乳糖、蔗糖和麦芽糖,并进行方法学验证。结果表明,5种糖类化合物在各自线性范围内R2不小于0.9990,对葡萄糖、果糖、乳糖、蔗糖和麦芽糖的检出限(RSN=3)分别为3.42 μgL-1、11.4 μgL-1;6.76 μgL-1、22.5 μgL-1;10.1 μgL-1。5种糖类化合物的相对标准偏差均小于2.47%,样品的加标回收率范围在94.13% ~ 114.2%之间,均符合相关检测标准要求,能应用于日常实验室的常规糖分析。为考察国产仪器分析的准确性和评价主要模块的性能,与Thermo ICS-5000+离子色谱安培检测系统和Dionex Ultimate 3000-液相色谱示差检测器系统进行比较,对比结果表明,三者的分析结果一致性良好,其中国产脉冲安培离子色谱系统的检出限和定量限比Thermo仪器高3~4倍,除此之外,国产离子色谱仪器各个模块性能稳定,可满足常规糖类化合物含量的测定,填补国产离子色谱在糖类化合物检测领域的空白。关键词:国产离子色谱仪;国产脉冲安培检测器;饮料;糖类化合物中文分类号:O657.7+5 文献标志码:A Determination of Common Carbohydrate Compounds in Beverages by Ion Chromatography with Pulsed Amperometric Detector Made by MyselfLANG Lei1,LIU Gelin1,2,SHI Chaoou3*(Analysis and Research Center,East China University of Science and Technology,Shanghai 200237)Abstract: Using the self-developed pulse amperometric detector, it is assembled with other domestic instrument components to form a complete set of domestic ion chromatography instruments, and applied to the analysis of glucose, fructose, lactose, sucrose and maltose commonly found in beverages, and methodological verification. The results showed that the R2 of the five carbohydrate compounds was not less than 0.9990 in their respective linear ranges, and the detection limits (RSN=3) for glucose, fructose, lactose, sucrose and maltose were 3.42 μgL-1 and 11.4 μgL-1, respectively. 6.76 μgL-1、22.5 μgL-1;10.1 μgL-1。 The relative standard deviation of the five carbohydrates was less than 2.47%, and the spiked recovery of the samples ranged from 94.13% to 114.2%. All meet the requirements of relevant testing standards and can be applied to daily laboratory testing. And in the full import Thermo ICS-5000+ ion chromatography system and Dionex Ultimate 3000 liquid chromatography difference detector repeated the same experimental process, the comparison results show that the analysis results are consistent, but the domestic amperometer detection limit and quantitative limit is 3 to 4 times higher than the imported instrument, the reason for the exploration is that there is a certain gap between the domestic pump and the inlet pump in the stable output mobile phase. The performance of each module and machine of domestic ion chromatography instrument is stable.Keywords:Domestic ion chromatography Domestic pulse amperometric detector Soft drinks Carbohydrate compounds 糖类是植物和动物的主要能量来源,对生理活动等有着极大影响。食品中常见中的糖主要包括葡萄糖、果糖、乳糖、蔗糖和麦芽糖。目前检测食品中糖的测定方法主要有化学法、酶比色法、酶电极法、高效液相色谱法、气相色谱法,毛细管电泳法和高效阴离子交换色谱法等。其中高效液相色谱法测糖主要包括高效液相色谱-示差折光法、高效液相-蒸发光散射法和高效液相质谱法等。高效液相色谱-示差折光检测法只适用于等度洗脱的测试,且只适用于高浓度含量糖样品的分析,在进行多组分分析时效果不好。高效液相色谱-蒸发光散射法对不挥发的溶质具有较高的检测灵敏度,蒸发发光法不受溶剂成分及温度的影响,能够进行梯度洗脱的测试,适于低聚糖的分析。近年来,该方法主要应用于中药材、烟草、食品中糖含量的测定。高效阴离子交换色谱-脉冲安培(high performance anion exchange chromatography with pulsed amperometric detection,HPAEC-PAD)法采用NaOH为流动相,并添加NaAc。能实现糖醇、单糖、双糖、寡糖、低聚糖、多糖以及糖衍生物的分析。其在检测糖时主要使用金电极的脉冲安培检测器,可检测ugL-1级的糖,不需要进行衍生反应和复杂的样品纯化处理,基体干扰少,有着较好的方法重复性和稳定性。但是,目前国内所有文献安培法测糖的报道都使用进口检测器,未见国产安培检测器的应用报道。目前带脉冲安培检测器的进口离子色谱仪器价格昂贵,维护费用高。因此,开发国产带脉冲安培检测器的离子色谱仪十分必要。本实验使用GI5000离子色谱系统包含脉冲安培检测器,对饮料中常见的葡萄糖、果糖、乳糖、蔗糖和麦芽糖的分析,进行了相关的方法学实验,并选取了三种市面上常见的含糖饮料进行了检测。与Thermo ICS-5000+离子色谱安培检测系统和Dionex Ultimate 3000液相色谱示差检测器系统进行比较,以此来验证GI5000离子色谱系统在检测糖类化合物方面的性能,从而填补了国产离子色谱仪器对糖类化合物检测的空白,同时考察了国产自研安培检测器和国产泵与进口仪器的性能差距。 1 试验部分 1.1 仪器与试剂GI5000离子色谱系统:包括GI3000软件、四元梯度泵、自动进样器和GI5250安培检测器(包括自研安培检测池、自研参比电极和自研Au工作电极); Thermo ICS 5000+离子色谱系统,包括变色龙7.2软件、SP-DP单元四元梯度泵、AS-AP自动进样器、DC模块(带安培检测器)。Dionex Ultimate 3000液相色谱系统,包括变色龙6.8软件、四元梯度泵、自动进样器、柱温箱和RI-101型示差折光检测器Millipore-Q A10超纯水系统,AL204电子分析天平。5种糖混合标准储备溶液:1.000 gL-1,称取葡萄糖51.0 mg、果糖50.5 mg、乳糖50.5 mg、蔗糖51.0 mg、麦芽糖51.0 mg于50 mL容量瓶中,加入超纯水充分溶解后定容至刻度,储存于于4 ℃冰箱中冷藏保存,可放置半个月。使用时用超纯水稀释到所需质量浓度。可口可乐溶液:先将可口可乐溶液进行超声处理,用0.22 μm的滤膜进行过滤,称取可乐样品126 mg,加入超纯水稀释50倍。样品溶液:将样品1(脉动饮料)和2(茶π饮料)用0.22μm的滤膜进行过滤,再分别称取496 mg和507 mg于50 ml容量瓶中,加入超纯水定容至刻度,得到浓度为9920 mgL-1和10140mgL-1的两份实际样品溶液。使用时用超纯水稀释到所需质量浓度。50% NaOH(W/W)(电子级) 德国Merck公司;D-无水葡萄糖( D-Glucose anhydrous,≥98%) 上海笛柏化学品有限公司;D-果糖(D-Fructose,≥99%)、蔗糖(sucrose,≥99.5%)、麦芽糖(maltose,≥98%) 上海阿拉丁生化科技股份有限公司;无水乳糖(lactose,≥98%) 上海麦克林生化科技有限公司;可口可乐、实际样品1(脉动)和实际样品2(茶π),均为超市购买;实验用水均采用电阻率不低于18.2 MΩcm的超纯水。所有试剂使用前均使用0.22 μm的滤膜过滤。1.2 色谱条件GI5000离子色谱系统和Thermo ICS-5000+离子色谱系统:Dionex CarboPac PA1色谱柱(250 mm×4 mm),Dionex CarboPac PA1保护柱(50 mm×4 mm);柱温为30℃;流量为1 mlmin-1;进样量为25 μL;流动相为200 mmolNaOH溶液;安培检测器电位波形为糖标准四电位。图1为5 mgL-1 5种糖类化合物混合标准溶液在GI5000离子色谱系统中的色谱图。Dionex Ultimate 3000液相色谱系统:Shodex-SP0810色谱柱(8.0 mm×300 mm);柱温70 ℃;流量为1mlmin-1;进样量为25μL;流动相为超纯水。 https://ng1.17img.cn/bbsfiles/images/2022/12/202212151708218665_5415_3389662_3.jpg!w310x240.jpg 图1 5种糖类混合标准溶液色谱图Fig.1 Chromatogram of mixed solution of 5 sugar standards 2 结果与讨论2.1 GI5000离子色谱系统与Thermo ICS-5000+离子色谱系统灵敏度对比实验显示GI5000离子色谱仪器的噪音稳定在0.12 nC,而Thermo ICS-5000+离子色谱仪器的噪音稳定在0.02 nC,探索了造成这种现象的原因,首先将与检测器相连接的安培池体部件进行了拆卸,对自研Au工作电极进行打磨维护,冲洗了自研参比电极,重新组装后安装在Thermo安培检测器上,用Thermo DP泵进行测试,观察Au工作电极噪音的变化,结果发现噪音值稳定在0.02 nC,与进口安培池体噪音一致,排除了自研安培池体部件对噪音的影响。又将自研安培池体转移至GI5250安培检测器上并与Thermo DP泵串联起来进行测试,噪音值稳定在0.06 nC,说明GI5250安培检测器自身和国产泵较进口仪器存在一定差距,但已符合日常的检测灵敏度的要求。2.2 方法学验证1)标准曲线分别配置质量浓度为0.2、0.5、1.0、2.0、5.0 mgL-1的5种糖类化合物混合标准溶液,以质量浓度(x,mgL-1)为横坐标,以峰面积(y)为纵坐标,绘制标准曲线。各组分的线性范围、线性方程、相关系数、检出限(RSN=3)和定量限(RSN=10)见表1,5种糖类化合物在各自线性范围内线性关系R2不小于0.9990,满足分析方法的要求。Thermo ICS-5000+离子色谱系统对葡萄糖、果糖、乳糖蔗糖和麦芽糖的检出限和定量限分别为1.200 μgL-1、4.010 μgL-1;1.830 μgL-1、6.100 μgL-1;2.960 μgL-1、9.860 μgL-1;6.230 μgL-1、20.78 μgL-1;10.15 μgL-1、33.82 μgL-1。 表1 GI5000离子色谱仪测定5种糖类化合物的线性数据和检出限Table 1 The GI5000 ion chromatograph determines linear data and detection limits for five carbohydrate compounds糖类化合物线性范围/(mgL-1)线性方程相关系数检出限/(μgL-1)定量限/(μgL-1)葡萄糖0.2~5y = 621.5x + 24.910.99983.42011.40果糖0.2~5y = 366.7x + 23.920.99966.75922.53乳糖0.2~5y = 328.0x + 39.460.999010.1233.72蔗糖0.2~5y = 218.1x + 21.340.999320.4368.09麦芽糖0.2~5y = 272.5x + 14.950.999031.37104.6 2)进样重复性取适量的浓度为5 mgL-1的5种糖类化合物混合标准溶液于进样瓶中,分两批分别在GI5000离子色谱系统和Thermo ICS-5000+离子色谱系统上重复进样8次,记录所测得的峰高和峰面积,计算RSD实验结果如表2所示,表明葡萄糖、果糖、乳糖、蔗糖和麦芽糖的峰高和峰面积RSD≤2.47%,结果稳定,与Thermo ICS-5000+离子色谱系统检测结果的RSD几乎一致,说明了GI5000离子色谱系统在重复性方面与进口仪器保持一致,性能良好,实验结果稳定可靠。 表2 5种糖类化合物进样重复性考察结果Table 2 Results of repeated sampling of five sugars糖类化合物GI5000Thermo ICS-5000+峰高RSD/(%)峰面积RSD/(%)峰高RSD/(%)峰面积RSD/(%)葡萄糖0.570.481.411.56果糖0.560.481.982.19果糖0.720.912.172.54蔗糖0.932.471.251.40麦芽糖0.841.780.460.51 3)5种糖类化合物加标回收率测定对可口可乐样品进行加标回收率实验,对于样品中含有的糖类化合物,以其质量分数的80%、100%和120%进行加标,重复进样5次,计算峰面积的RSD,检测结果如表3所示,样品的加标回收率范围在94.13%~114.2%之间,相对标准偏差在0.22%~4.14%。经计算得,可口可乐中葡萄糖质量浓度为41.6 gL-1,果糖质量浓度为54.4 gL-1、乳糖质量浓度为1.5 gL-1、蔗糖质量浓度为4.1 gL-1、麦芽糖质量浓度为1.8 gL-1,总含糖量为103.4 gL-1,可口可乐厂家标注碳水化合物总量为104.6 gL-1,误差1.14%,说明检测结果可靠。图2为可口可乐样品色谱图。 表3 5种糖类化合物加标回收率测定结果Table 3 Determination of the recovery rate of five sugars糖类化合物本底/(mgL-1)加标量/(mgL-1)测得量/(mgL-1)回收率/%相对标准偏差/%葡萄糖1.9551.6003.55399.881.802.0003.89997.200.382.4004.21494.130.22果糖2.1401.6003.69397.803.832.0004.07396.650.252.4004.629103.74.14乳糖1.010.8001.885109.40.191.0002.151114.20.231.2002.353111.90.8蔗糖0.7740.8001.54496.250.971.0001.847107.40.171.2002.043105.80.15麦芽糖0.8920.8001.755107.92.721.0001.915102.30.451.2002.128103.00.75https://ng1.17img.cn/bbsfiles/images/2022/12/202212151708335940_9325_3389662_3.png!w424x327.jpg 图2 可口可乐样品色谱图Fig.2 Coca-Cola sample chromatography 2.3 三种仪器检测结果对比离子色谱法中两种实际样品稀释100倍,液相色谱法中两种实际样品稀释10倍。分别在全进口仪器Thermo ICS 5000+离子色谱系统、GI5000离子色谱系统以及Dionex Ultimate 3000液相色谱仪器上重复进样5针,测试结果如表4所示。 表4 实际样品1和样品2中含糖量测定结果Table 4 Measurement results of sugar content in actual sample 1 and sample 2糖类化合物离子色谱法-Thermo安培离子色谱法-GI5000安培液相色谱法-Dionex示差样品1样品2样品1样品2样品1样品2含糖量/(gL-1)含糖量/(gL-1)含糖量/(gL-1)含糖量/(gL-1)含糖量/(gL-1)含糖量/(gL-1)葡萄糖15.8723.1016.6222.1816.3322.08果糖19.7131.1919.9029.5021.5730.86乳糖------------蔗糖12.8523.5512.2823.0911.7223.72麦芽糖------------总含糖量/g/L48.4377.8448.8074.7749.6276.66样品1和样品2厂家标注的总含糖量分别为49 gL-1和75 gL-1。如表4所示,全进口仪器Thermo ICS 5000+测得两种样品的总含糖量分别为48.43 gL-1和77.84 gL-1,GI5000离子色谱系统测得两种样品的总含糖量分别为48.80 gL-1和74.77 gL-1。Dionex Ultimate-3000液相色谱示差法测得两种样品的总含糖量分别为49.62 gL-1和76.66 gL-1。三种仪器的所测得的两种实际样品中糖类化合物总量相差5%以内,结果均较为准确,同时也证明了国产离子色谱仪器性能稳定可靠。三台仪器对两种实际样品的分离色谱图如图3和4所示。https://ng1.17img.cn/bbsfiles/images/2022/12/202212151708443314_437_3389662_3.png!w273x210.jpghttps://ng1.17img.cn/bbsfiles/images/2022/12/202212151708496041_6974_3389662_3.png!w273x210.jpg 图3 样品1和样品2中糖分离色谱图Thermo离子色谱仪(左)、国产离子色谱仪(右)Fig.3 Separation chromatograms of sugars in samples 1 and 2 Thermo ion chromatograph (left), domestic ion chromatograph (right)https://ng1.17img.cn/bbsfiles/images/2022/12/202212151708552407_2039_3389662_3.png!w273x210.jpg 图4 液相-示差法测得样品1和样品2中糖分离色谱图Fig.4 Separation chromatogram of sugar in sample 1 and sample 2 by liquid-differential method 3 讨论与结论 通过将GI5250安培检测器和进口仪器相互串联等实验得到GI5000离子色谱系统的检出限和定量限约为全进口仪器的3~4倍,其原因是GI5250安培检测器自身性能与进口检测器存在差距,并且进口泵在稳定输出流动相上优于国产泵。后续需要针对国产安培检测器和泵性能进一步优化。使用GI5000离子色谱系统检测饮料中糖类化合物,进行了方法学测试,对比了全进口Thermo ICS 5000+仪器的检测结果,验证了GI5000离子色谱系统在检测糖类化合物方面的性能。结果显示,5种糖类化合物在0.2~5 mgL-1范围内线性关系良好,检测的线性相关系数均在0.9990以上,重复性RSD≤2.47%,除麦芽糖外,其余四种糖检出限均在0.1 mg L-1以内,麦芽糖检出限为0.105 mgL-1。NY/T 3902-2021标准中葡萄糖的检出限为0.4 mg L-1、果糖和麦芽糖的检出限为1.2 mgL-1、蔗糖的检出限为0.6 mgL-1,表明GI5000离子色谱系统所测得的结果,均能够满足上述相关标准的要求,可满足日常实验室检测需求。以市面上售卖的可口可乐为样品,对5种糖类化合物进行加标回收实验,5种糖类化合物的加标回收率范围为94.13%~114.2%。相对标准偏差在0.22%~4.14%。测得可口可乐中的5种糖类化合物总量为10.34 g/100 g。分别使用全进口仪器Thermo ICS-5000+、GI5000离子色谱系统以及Dionex Ultimate 3000液相色谱仪检测了脉动和茶π饮料中糖类化合物的含量,三种方法检测的结果几乎一致,证明了GI5000离子色谱系统性能的可靠。 参考文献 佚名. 碳水化合物—化学结构. 淀粉与淀粉糖, 2010(2): 36-44. ZHANG Z, KHAN N M, NUNEZ K M, et al. Complete monosaccharide analysis by high-performance anion-exchange chromatography with pulsed amperometric detection. Analytical Chemistry, 2012, 84(9): 4104-4110.DOI:10.1021/ac300176z. 岳虹, 赵贞, 刘丽君, 李翠枝, 邵建波.高效液相色谱法测定发酵乳饮料中果糖、葡萄糖、蔗糖、麦芽糖及乳糖含量.乳业科学与技术, 2017, 040(002): 23-26. 樊宏, 陈强. 乳制品中乳糖直接比色测定方法探讨. 中国卫生检验杂志, 2006, 16(3): 296-297. 钟宁, 侯彩云. 三种乳糖检测方法的比较. 食品科技, 2011, 36(7): 263-265. 中华人民共和国卫生部. GB/T 5009.7—2003 食品中还原糖的测定. 北京: 中国标准出版社, 2003. Zhang J L, Dai X, Song Z L, Han R, Ma L Z, Fan G C, Luo X L,One-pot enzyme- and indicator-free colorimetric sensing of glucose based on MnO2 nano-oxidizer, Sensors and Actuators B: Chemical, 2020, 304. ZIELINSKI A A F, BRAGA C M, DEMIATE M I, et al. Development and optimization of a HPLC-RI method for the determination of major sugars in apple juice and evaluation of the effect of the ripening stag. Food Science and Technology, 2013, 34(1): 38-43. DOI:10.1590/S0101-20612014005000003. SHANMUGAVELAN P, KIM S Y, KIM J B, et al. Evaluation of sugar content and composition in commonly consumed Korean vegetables, fruits, cereals, seed plants, and leaves by HPLC-ELSD. Carbohydrate Research, 2013, 380(20): 112-117. DOI:10.1016/j.carres.2013.06.024. MA C M, SUN Z, CHEN C B, et al. Simultaneous separation and determination of fructose, sorbitol, glucose and sucrose in fruits by HPLC-ELSD. Food Chemistry, 2014, 145: 784-788. DOI:10.1016/j.foodchem.2013.08.135. WU X D, JIANG W, LU J J, et al. Analysis of the monosaccharide composition of water-soluble polysaccharides from Sargassum fusiforme by high performance liquid chromatography/electrospray ionisation mass spectrometry. Food Chemistry, 2014, 145: 976-983. DOI:10.1016/j.foodchem.2013.09.019. BAI W D, FANG X D, ZHAO W H, et al. Determination of oligosaccharides and monosaccharides in Hakka rice wine by precolumn derivation high-performance liquid chromatography.Journal of Food Drug Analysis, 2015, 23: 645-651. DOI:10.1016/j.jfda.2015.04.011. HE J Z, XU Y Y, CHEN H B, et al. Extraction, structural characterization, and potential antioxidant activity of the polysaccharides from four seaweeds. International Journal of Molecular Medicine, 2016, 17(12): 1-17. DOI:10.3390/ijms17121988. DANIEL D, LOPES F S, SANTOS V B D, et al. Detection of coffee adulteration with soybean and corn by capillary electrophoresistandem mass spectrometry. Food Chemistry, 2018, 243: 305-310. DOI:10.1016/j.foodchem.2017.09.140. 张欢欢, 李疆, 赵珊, 等. 毛细管区带电泳-间接紫外检测法快速测定食品中乳糖、蔗糖、葡萄糖和果糖. 色谱, 2015, 33(8): 816-821. 马海宁, 华玉娟, 屠春燕, 等. 毛细管电泳法分析藏红花植物细胞多糖中单糖组成. 色谱, 2012, 30(3): 304-308. DOI:10.3724/SP.J.1123.2011.11015. LV X Y, GUO Y X, ZHUANG Y P, et al. Optimization and validation of an extraction method and HPAEC-PAD for determination of residual sugar composition in L-lactic acid industrial fermentation broth with a high salt content. Analytical Methods, 2015, 7: 9076-9083. DOI:10.1039/c5ay01703c. WANG X, XU Y, LIAN Z N, et al. A one-step method for the simultaneous determination of five wood monosaccharides and the corresponding aldonic acids in fermentation broth using highperformance anion-exchange chromatography coupled with a pulsed amperometric detector. Journal of Wood Chemistry and Technology, 2013, 34(1): 67-76. DOI:10.1080/02773813.2013.838268. ZHANG Y, WU J R, NI Q H, et al. Multicomponent quantification of astragalus residue fermentation liquor using ion chromatographyintegrated pulsed amperometric detection. Experimental and Therapeutic Medicine, 2017, 14: 1526-1530. DOI:10.3892/.2017.4673. Young C S . Evaporative light scattering detection methodology for carbohydrate analysis by HPLC.. Cereal Foods World, 2002, 47(1):14-16. 梁亚丽, 张彦玲, 何颖娜. 糖类化合物分离分析方法进展. 河北化工, 2006, (06): 42-44. 梁智安, 王成龙, 龙飞. 液相色谱示差折光法测定酒中的总糖和还原糖.食品安全质量检测学报, 2018, 9(09): 2188-2194. 陈琴呜, 刘文英. HPLC—ELSD在中药糖类分析中的应用. 中草药, 2008, 39(6): 955-957. BAI W D, FANG X D, ZHAO W H, et al. Determination of oligosaccharides and monosaccharides in Hakka rice wine by precolumn derivation high-performance liquid chromatography.Journal of Food Drug Analysis, 2015, 23: 645-651. DOI:10.1016/j.jfda.2015.04.011. HE J Z, XU Y Y, CHEN H B, et al. Extraction, structural characterization, and potential antioxidant activity of the polysaccharides from four seaweeds. International Journal of Molecular Medicine, 2016, 17(12): 1-17. DOI:10.3390/ijms17121988. INDORF C, BODé S, BOECKX P, et al. Comparison of HPLC methods for the determination of amino sugars in soil hydrolysates. Analytical Letters, 2013, 46: 2145-2164. DOI:10.1080/00032719.2013.796558. 水果、蔬菜及其制品中阿拉伯糖、半乳糖、葡萄糖、果糖、麦芽糖和蔗糖的测定 离子色谱法:NY/T 3902-2021. 2021.
有一些糖类化合物的分子量很大,粘度也很高,样品配制的浓度太稀,做13C做不出来,浓度配得非常大,也做不出来信号,请问这是什么原因?我们的仪器是400MHz的,是不是不适合做分子量太大的化合物。但为什么信号那么差呢?请指点!
用氨基柱做糖类化合物,加什么可以减轻拖尾,流动相是:乙氰:磷酸盐缓冲液。现在的情况是拖尾还是严重啊。怎么办呢?还有就是如何快速平衡色谱柱呢?
GB 5009.26-2016 食品中亚硝胺类化合物的测定,第一法中是只测一种亚硝胺化合物的含量吗?
在实际工作中我们会遇到这类化合物如,对甲基环己甲酸,对乙基环己甲酸等等,这类化合物都存在异构体,感兴趣的朋友,请交流下这类化合物分析的心得!
如果要分析一类化合物 比如塑化剂 ,总共有18种化合物, 用GC-MS,刚拿到手怎么确定程序升温的过程,是不是要每一个化合物要单独进一针,确定其保留时间,离子碎片啊
山葡萄酒中多酚类化合物酚类化合物是葡萄酒中的重要生理活性物质,对人体的健康起着重要保健作用。山葡萄酒中的多酚类化合物主要有:花色苷:是一种红色素化合物,有花青素、甲基花青素、牵牛花素、锦葵花素、花翠素、芍药素、栎皮黄素等,其含量是一般葡萄酒的2倍。黄酮类:是一种黄色素化合物,有堪非醇、槲皮素、山奈酚、杨梅素等,其黄铜醇的含量为1.43g/L,是一般葡萄酒的5~10倍。儿茶素类:主要有儿茶素、表儿茶素、表没食子儿茶素等,具有一定的苔味。原花色素类:主要有原花青素、原花翠素、原天竺葵素等。是葡萄籽与皮的主要成份,也是葡萄酒中多酚类化合物含量最多的一类。单宁类:是由花白素的多聚体组成的,有一定的涩味,具有重要的生理功能。山葡萄酒中单宁的含量是一般葡萄酒的2~3倍。白藜芦醇化合物:主要有顺式白藜芦醇、反式白藜芦醇、顺式白藜芦醇糖苷、反式白藜芦醇糖苷、顺式反式白藜芦醇异构体等。这些化合物主要来源于葡萄皮、籽中,是植物体具抗病毒的生理活性物质,也是对人体防治心脑血管疾病的重要药理成份。山葡萄酒中白藜芦醇的含量为5.86~8.20mg/L,高于国际标准,是一般葡萄酒的4~6倍。多酚类化合物是重要的保健功能成份,主要来源葡萄皮、籽中,因此吃葡萄带皮、籽一起吃掉是最有益身体健康的。酶类化合物:主要有超氧化物岐化酶(SOD),是一种自由基清除剂,具有破坏活性氧作用的自卫酶类化合物。山葡萄酒中含量为1.52×104—1.84×104mg/L,虽然含量极微小,但对人体健康有重要作用,也是其它葡萄中不具备的。
[font=黑体]发帖人:[/font]sddgg[font=宋体]链接:[/font]https://bbs.instrument.com.cn/topic/7477517[font=黑体][b]问题描述:[/b][/font][font=宋体]标准方法中酚类化合物需要进行衍生化,是否不净化就可以不做衍生化?是否一定需要净化和衍生化?[/font][font=黑体][b]解答:[/b][/font][font=宋体]衍生化就是通过化学反应将物品中难以分析检测的目标物化合物定量的转化成另一易于分析检测的化合物,通过后者的分析检测可以对目标化合物进行定性和定量分析。对于[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url],主要是为了增强目标化合物的挥发性、改善目标化合物的极性、改善目标化合物的热稳定性等。[/font][font=宋体]酚类化合物不易挥发,需将其衍生化为易挥发的非极性化合物以便于分离。能大幅度提升检测灵敏度。[/font][font=宋体]样品的净化是为了去除样品中的杂质、排除样品中的干扰、提高分析仪器的灵敏度,同时也是保护分析仪器的样品预处理方法。[/font]
[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]气质联用仪[/color][/url]分析水质苯胺类化合物(HJ822)时,净化用的三种洗脱液是合并后再浓缩么?
不知有没有用,请参考。研究食品接触材料中全氟烷基磺酸类化合物的检测方法和该类化合物的残留水平。样品采用甲醇超声提取,液相色谱- 质谱联用测定,以C18 为分离柱,甲醇-5mmol/L 乙酸铵溶液为梯度洗脱淋洗液,同位素内标法定量,内标物为13C 标记的PFOS。该方法的检出限为0.5μg/kg,线性范围为0.5~10μg/kg,方法的平均回收率为91.1%~112.8%。结果证明,该方法准确、快速,可成功应用于16 种食品接触材料实样的检测。
植物黄酮类化合物的分离分析方法研究
[font=&][size=16px][color=#333333]点击链接查看更多:[url]https://www.woyaoce.cn/service/info-16250.html[/url]服务背景[/color][/size][/font][font=&][color=#333333][/color][/font][font=黑体, SimHei]酚类化合物是指芳香烃中苯环上的氢原子被羟基取代所生成的化合物,是芳烃的含羟基衍生物,根据其分子所含的羟基数目可分为一元酚和多元酚。酚类化合物都具有特殊的芳香气味,均呈弱酸性,在环境中易被氧化。酚类化合物的毒性以苯酚为最大,通常含酚废水中又以苯酚和甲酚的含量最高。环境监测常以苯酚和甲酚等挥发性酚作为污染指标。[/font][font=&][size=16px][color=#333333]检测内容[/color][/size][/font][font=&][color=#333333][/color][/font][font=黑体, SimHei][size=16px][color=#0070c0][/color][/size][/font][font=黑体, SimHei][size=16px]土壤和沉积物中酚类化合物检测[/size][/font][font=黑体, SimHei][size=16px]菲优特检测服务形式:[/size][/font][font=黑体, SimHei][size=16px]委托检测:药品检测、食品/医药/保健品检测、环境检测、化工检测、水产养殖检测、微生物检测、毒理测试等[/size][/font][font=黑体, SimHei][size=16px]科研服务:分子生物学、代谢组学、蛋白质组学、基因组学、细胞服务、细菌服务、新药研发筛选模型构建、疾病动物模型构建及其他开放类服务项目[/size][/font][font=黑体, SimHei][size=16px]方法开发及咨询:实验室检测方法开发和应用、实验室管理咨询和培训、质量控制咨询与培训、实验仪器配置和选型等[/size][/font][font=黑体, SimHei][size=16px]仪器共享土壤和沉积物中酚类化合物检测[/size][/font]
维权声明:本文为环烯醚萜原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。环烯醚萜类化合物分离纯化心得体会基本介绍 环烯醚萜(iridoids)为臭蚁二醛(iridodial)的缩醛衍生物。臭蚁二醛是由伊蚊(Iridomyrmex detectus)的防收性分泌物中分得的物质。自1958年的Halpem和Schmid确定的环烯醚萜的基本骨架以来,各国学者对该类化合物作了大量深入的研究。环烯醚萜类化合物具有多种生物活性,近来受到极大关注,发展也很迅速。 环烯醚萜类主要分为:环烯醚萜类、裂环环烯醚萜类、3,4-位无取代的环烯醚萜类、聚合环烯醚萜类等等。本人做的是普通类的环烯醚萜类化合物,且以其苷居多,做的比较浅,下面斗胆一谈,各位看官莫要见笑。提取部分 环烯醚萜苷类化合物在醇(甲醇、乙醇)中溶解度较好,部分苷类在水中溶解度也很好。本人在对某植物进行提取的时候,实际上并非针对这类化合物,采用的是60%的乙醇/水,是为了兼顾各类成分。后来在实验过程中发现,60%的乙醇/水条件下,这类化合物的提取率是很高的。 注释:其实如果要针对性分离,可以将提取液简单处理后进行D101大孔柱色谱,对环烯醚萜类化合物进行富集。萃取部分 提取之后,将药液进行浓缩,至无醇味混悬于水中,然后进行萃取。萃取的过程为:等体积的环己烷、乙酸乙酯、正丁醇分别萃取三次,合并各层提取液浓缩得各层浸膏。就目前实验进展情况来看,环烯醚萜苷类化合物主要集中在正丁醇层,水层也有一部分(我目前还没开始这部分工作)。 注释1:萃取的过程,涉及到溶剂的回收,由于这类化合物在高温下不太稳定,所以用旋转蒸发仪进行减压回收溶剂的时候,温度不能过高,我采用的温度是60度(其实60度已经很高了,但是没办法,不设60度,正丁醇回收不了)。 硅胶柱色谱 正丁醇层进行硅胶柱色谱分离,采用氯仿/甲醇梯度洗脱,样品500g,拌样硅胶1500g,柱床硅胶500g,洗脱梯度为50:1→20:1→10:1→5:1→2:1→1:1→0:1。实验的过程中发现,环烯醚萜类化合物,主要集中在氯仿:甲醇=10:1和5:1部分。 注释1:选择硅胶柱色谱,也是人之常情,此处也可选择D101大孔柱色谱,对这类化合物进行富集; 注释2:选择氯仿/甲醇系统,是因为经过小试,此系统对样品分离较好,最重要的,样品在此系统中成点性很好; 注释3:拌样1500g,柱床500g,你没有看错,我没有写错。书上说,拌样:柱床在1:1-1:10甚至1:20或者1:50,而我这里却是3:1。我可以很负责任地告诉你,没有必要按书上的说法,柱床500g足够了,分离效果一点也不差。以前做另外一个植物,拌样用了3000g,柱床才600g,分离效果也不差,一点问题都没有; 注释4:梯度的选择,建议6-8个。梯度太少,各流分成分可能过于复杂;梯度太多,后续分离麻烦。这种大型硅胶柱色谱,属于平常所说的“粗分”,不宜太多,不宜太少,不然就是给自己找麻烦。http://ng1.17img.cn/bbsfiles/images/2010/10/201010061143_249374_1745326_3.jpgODS柱色谱 包括开放型ODS柱色谱和中低压型ODS柱色谱,其实原理一样,只是规模大小不同而已。 我将5:1洗脱的样品进行中低压ODS柱色谱,采用甲醇/水梯度洗脱,水→10%甲醇/水→20%甲醇/水→30%甲醇/水→50%甲醇/水→甲醇,实验结果表明,ODS柱色谱对此类化合物具有良好的分离效果。 注释1:环烯醚萜苷类化合物一般极性较大,一般集中在10%甲醇/水、20%甲醇/水、30%甲醇/水部分; 注释2:水洗下来的,一般为糖苷类化合物,我从此流分中分离得到几个糖类化合物(题外话); 注释3:ODS柱色谱可以多次进行,反复纯化,利用ODS柱色谱可以得到部分单体化合物;http://ng1.17img.cn/bbsfiles/images/2010/10/201010061144_249375_1745326_3.jpg(注:此图为未合并相同流分前的点板情况)制备液相(反相) 从ODS柱色谱上洗脱的样品,经过分析,可以考虑进行制备液相,半制备液相等等。 事实上,一般而言,PHPLC也是获得环烯醚萜类单体化合物最重要的手段之一。 流动相可采用甲醇/水,若峰形不好,可加入少量乙酸改善(这一招屡试不爽)。 波长的选择,可以使用230nm、240nm都可以(我们有PAD检测器,验证过)。其它一些化合物,由于连上芥子酰基,对羟基香豆酰基,还可以选择320nm的吸收。 色谱柱一般是C18的居多(目前未使用过其它柱子),品牌好像都还行(我们主要使用YMC)。凝胶其它填料 由于分离原理的缘故,使用凝胶对环烯醚萜这一类化合物(分子量相差不大,且结构极为类似)进行分离,前景似乎并不明朗。但是,用凝胶将这一类化合物与其他类型的化合物分离,效果还是很不错的。 其它如大孔树脂,前面提过,用来富集是个不错的选择;聚酰胺,我没有使用过,不过从其分离原理来看,对这类化合物不会很敏感。显色剂的选择 部分环烯醚萜类在254nm紫外下有暗斑,这个很实用; 最常用的是浓硫酸-香草醛显色剂:母核上有羟基取代的显蓝色;母核上无羟基取代显紫红色(非绝对); 其它显色剂如硫酸乙醇、碘等等都可以,我个人偏爱浓-香显色剂。结构测定与解析(简) 环烯醚萜类化合物进行NMR测试,首先氘代甲醇,这个没有任何疑问。 我在一些文献中,也看到一些特例,比如使用重水、氘代DMSO,这些基本可以忽略。 关于结构解析部分,此处不再赘述。
葡萄酒酚类化合物分为两大类:非类黄酮(羟基肉桂酸、羟基苯甲酸和二苯乙烯)和类黄酮(花青素、黄酮-3-醇和黄酮醇)。这些次生代谢产物对葡萄酒的苦味、色泽、涩味、香气等主要感官参数都有重要影响,而这些都是影响消费者接受度和喜好度的最重要因素。许多研究表明,影响葡萄酒中酚类化合物存在的主要因素之一是葡萄品种。因此,用特定的葡萄品种酿造的葡萄酒通常是根据感官品质来描述的,这至少可以部分反映其品种来源。
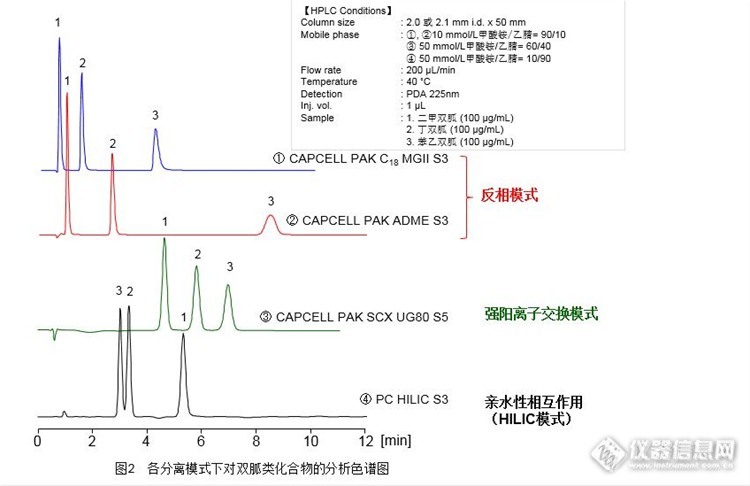
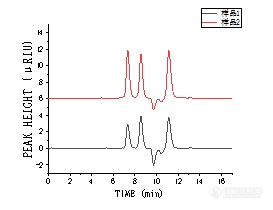
双胍类化合物二甲双胍、丁双胍和苯乙双胍被用于治疗糖尿病,是具有强碱性和强极性的离子性化合物。这些化合物在常规C18色谱柱上很难得到保留,因此我们考虑在强阳离子交换模式下,使用CAPCELL PAK SCX UG80色谱柱对其进行保留与分离,并且尝试缩短分析时间。使用短柱长的CAPCELL PAK SCX UG80色谱柱(2.0 mm i.d. x 20 mm)对3种双胍类化合物进行分析,结果如图1。http://ng1.17img.cn/bbsfiles/images/2016/09/201609290900_612528_2222981_3.jpg在强阳离子交换模式下进行的分析,通过调节流动相pH值和盐浓度均可对化合物的保留行为进行调整,其中盐浓度是影响保留强弱的主要因素。如图1所示,随着盐浓度的提高,虽然各化合物的保留逐渐变弱,但在短时间内得到了3个成分的分离;在20mmol/L甲酸铵/乙腈=60/40流动相条件下,将流速提升3倍(即600μL/min)可将分析时间缩短至4分钟以内,且20mmol/L的低盐浓度也适用于质谱分析。【参考】除了强阳离子交换模式下之外,我们还尝试在反相模式和亲水性相互作用的HILIC模式下进行分析。反相柱分别选择了柱长相同的C18色谱柱和键合金刚烷基的ADME色谱柱。虽然在反相模式下,ADME比C18柱保留能力强,但对二甲双胍的保留较其他两种模式较弱。假如您关注的是二甲双胍的保留,那么除了强阳离子交换模式外,在HILIC模式下亦能得到对二甲双胍的良好保留。由于分离模式不同,流动相中的有机相比例亦有所差别,因此请根据所分析样品的性质来选择最适合的分离模式。http://ng1.17img.cn/bbsfiles/images/2016/09/201609290900_612529_2222981_3.jpg
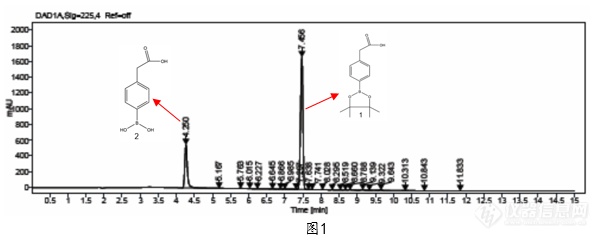
[align=left]近期我们遇到了一种硼酸酯类的化合物1,采用实验室通用方法进行检测的时候发现会出现一个很大的杂质2,根据工艺分析不可能会出现这么大的杂质,定量核磁检测发现该物质含量比较高,并不存在这个大的杂质,用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LCMS[/color][/url]去鉴定后发现该杂质为该化合物的水解杂质2(如图1)[/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211090922409286_9676_5310417_3.png[/img][/align][align=center]图 1:流动相A: 0.05%TFA 流动相B: ACN条件下的样品色谱图[/align]为此我们判定肯定是检测方法出现了问题,首先我们排除稀释剂的影响,稀释剂为乙腈,做了相应的稳定性实验,发现临用新配情况下该杂质仍旧很大。由此我们判断可能是流动相导致该化合物1不稳定会水解生成杂质2。考虑到硼酸酯类化合物可能对酸不稳定,在酸性条件下会被催化水解成硼酸类化合物和相应的醇,因此打算更换其他流动相。首先我们尝试了碱性体系(如图2),由于该化合物1为酸性化合物,在碱性条件下保留较弱,但是从图谱可以看出水解杂质仍旧比较大,由此可以判断在碱性条件下该化合物1也并不稳定。[align=left][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211090922406680_5272_5310417_3.png[/img][/align][align=center]图 2:流动相A: 0.1%NH4OH 流动相B: ACN条件下的样品色谱图[/align][align=left]随后我们又尝试了中性体系,采用中性体系的流动相进行测试(如图3)。从图3(a)可以看出,水做流动相条件下,由于流动相的离子强度不够导致峰形丑,还可以看出水解杂质2仍旧存在,但从(b)中可以看出当用乙酸铵作为流动相时候,峰形对称,水解杂质2也比较小。[/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211090922412671_1242_5310417_3.png[/img][/align][align=left][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211090922413707_3568_5310417_3.png[/img][/align][align=center]图 3:(a)流动相A: 水 流动相B: 乙腈 (b)流动相A: 10mM 乙酸铵水溶液 流动相B: 乙腈条件下的样品色谱图[/align][align=left]根据以上结果我们猜测:该化合物对酸碱都不稳定,但中性条件下只在乙酸铵体系下稳定,为此我们从化合物1本身及水解杂质2的结构分析,该化合物1中的硼原子为sp2杂化,还存在一个空的p轨道,这个空轨道易于接受水和醇等带有未共用电子对的亲核试剂的进攻而使硼酸酯水解([font='adobeheitistd-regular'][size=13px]其机理见方程式[/size][/font][font='dlf-32769-4-2073904376+zipdfa-8'][size=13px]([/size][/font][font='dlf-3-0-25052658+zipdfa-84']1[/font][font='dlf-32769-4-2073904376+zipdfa-8'][size=13px]))。[/size][/font]继续与水作用,生成相应的醇和硼酸。[/align][align=left][/align][img]" style="max-width: 100% max-height: 100% [/img]通过对此分析,似乎已经能够解释化合物1对碱不稳定的原因,即羟基中氧上的孤对电子会进攻硼的空轨道导致其水解,至于为什么在乙酸铵体系中是稳定的我们推测原因是乙酸铵的氮原子会与硼原子形成配对键,从而使该化合物1稳定。 虽然只是硼酸酯类化合物中的一种物质的检测,但是根据检测结果和分析可以为以后的该类化合物的方法开发提供思路,即通在对硼酸酯类的化合物进行方法开发时候,尽量不要采用酸碱体系的流动相,可以考虑用乙酸铵缓冲液作为流动相进行检测。[align=left] [/align]
[color=#444444]有谁用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]分析过喹唑啉类化合物?该类化合物在甲醇中溶解性较差,我不知道该如何配制做[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]的溶液?[/color]
[em34] 求助季胺盐类化合物分析条件,急切等待,是否需要缓冲盐啊柱温啊,或者改进剂之类的????条件怎么优化???
各位老师好: 按标准做HJ758-2015水质卤代乙酸酯类化合物 气谱分析时,我采用DB-1701柱ECD检测器,程序升温,样品前处理统统按标准制备200微升/L,但气谱出峰时只有替代物一个峰,其他峰都没有,不知是何原因??请指教,谢谢。
亚硝胺的致癌作用已经清楚地在动物试验中得以证明,同时这类化合物被一些国际组织怀疑对人体有致癌作用,这些组织包括国际癌症研究总署,加拿大卫生署和美国国家毒理学规划处。这些化合物可能存在于环境空气中,这源于直接排放或者源于仲胺间或叔胺间在大气层中发生反应。在橡胶工业区内所检测出的亚硝胺浓度为人类环境中最高 这类化合物还存在于烟草烟雾中。美国国家职业安全和健康研究所(NIOSH) 已经开发出2522 方法,用于捕集和分析空气中的亚硝胺类化合物。然而,该方法使用的空气采样器需要较大的样品体积且采样时间长,亚硝胺还必须用溶剂再次提取,从而导致整个方法缓慢而冗长。[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url](GC) 和[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url]/质谱联用仪(GC/MS) 经常被用于测定亚硝胺。然而亚硝胺热稳定性差,所以检测灵敏度受限于[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url]进样器的高温。本应用简报描述了利用创新型安捷伦微吸附采样器(CTS)、热分离进样杆(TSP) 和Agilent 5975T 低热容[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]气质联用仪[/color][/url]建立起一种灵敏的空气亚硝胺检测方法。该方法快速,经济且易于使用,能够从大体积空气中捕获分析物,因此推测方法检测限(MDL) 低于1 ng。实验部分试剂和标准品亚硝胺类化合物标准品从Supelco公司获得,EPA 8270 亚硝胺混合物,浓度为2000 ng/μL(货号48489),六种亚硝胺化合物被检测(表1)。[img]http://img.vogel.com.cn/2014/0227/0944313156.png[/img]仪器这个方法是利用配有分流/不分流进样口的Agilent 5975T GC/MS系统开发而成,CTS(部件号G1181A)用于空气中样品的收集,TSP(部件号G4381A)安装在分流/不分流进样器上用于样品脱附。表2 列出了仪器使用条件。[img]http://img.vogel.com.cn/2014/0227/0947357839.png[/img]样品前处理标准品在空气中进行稀释,利用静态稀释瓶技术将其贮存在5 L 的玻璃瓶内,玻璃瓶事先已用纯氮吹扫5 分钟。将10 μL的2000 ng/μL的亚硝胺混合物注入瓶中后,让该样品在室温平衡4 小时使其充分气化,最终浓度为4000 ng/L。稀释样品是由贮存物制备而成,通过分别抽取2、60、100 和200 mL 蒸气到不同的1L 瓶中制成系列工作标准品,其浓度分别为8.0、240、400 和800 ng/L。结果与讨论CTS 操作CTS 包含一个气泵(流速范围10-300 mL/min)、一个手持式采样头和一个适配器。采样头可以容纳六根相同或不同类型的捕集柱。该方法使用了六根内径为530 μm的PoraPLOT Q 柱。TSP用于直接脱附CTS 捕集的样品。每根捕集毛细管置于一次性微量瓶中,然后放入TSP。TSP 然后被插入5975T LTM GC/MS 一个加热的分流/不分流进样口中。捕集柱被迅速而有效地脱附到GC进样器中。采集样品是通过将CTS 头直接插入瓶嘴完成的,同时捕集柱戳穿密封膜而不容许外部气体进入瓶内。校准标准品的制备是通过使用CTS 分别从240、400 和800 ng/L 的工作标准品的瓶中泵取200 mL 气体。另外,通过CTS 从4000 ng/L 的工作标准品中泵取100、200和400 mL 的气体制备成三个独立的样品。最后将这些制备好后的校准水平为48、80、160、400、800 和1600 ng的亚硝胺标准品混合物用于GC/MS 分析。CTS 性能对CTS 收集的400 ng亚硝胺标准样品进行分析,其色谱图上仅呈现了尖锐的亚硝胺色谱峰,而没有其他主要成分信息。该实验证明CTS 具有浓缩和定量转移亚硝胺而不引入污染物或伪迹的能力(图1)。这是一个收效显著的结果,因为考虑到亚硝胺化合物的高活性,其能在样品前处理过程中产生相互作用。定量准确性利用CTS 制备的校准样品用于建立校准曲线来分析混合标样中的六种亚硝胺。六种亚硝胺的所有相关系数(R2) ? 0.990,线性范围48 至1600 ng(表3)。图2 为所有六种化合物的校准曲线。当高于2000 ng或低于48 ng时校准曲线将不成线性。[img]http://img.vogel.com.cn/2014/0227/0949198654.png[/img][img]http://img.vogel.com.cn/2014/0227/0950015814.png[/img][img]http://img.vogel.com.cn/2014/0227/0951022218.png[/img]灵敏度和选择性这个方法能够用于检测低至8 ng/L 的气体浓度,通过泵取500 mL工作标准品,使注入GC/MS 的每种亚硝胺具有4 ng。所有的化合物呈现较好的信噪比并且没有显著性干扰(图3)。CTS 在采样过程中能够去除空气中的一些干扰物质,使后续分析具有一定的选择性。CTS 也可以通过泵取125 mL 的8 ng/L 工作标准品来捕集1.0 ng的亚硝胺混合标样。在提取离子流色谱图中,所有化合物的信噪比范围为3 到9,使方法检出限低于1 ng变为可能。因为CTS 能有效从大体积样品中捕集这类化合物,因此能够用于分析痕量水平的亚硝胺。方法回收率通过液体进样校准,在200 ng水平的NDBA 回收率为100%。由于采用TSP 的液体进样方式会导致由于溶剂的瞬间气化而引起高挥发性化合物的微量损失,因此其他5 种化合物的回收率会高于100%。其他亚硝胺的回收率范围为105.0% 至125.5%。[img]http://img.vogel.com.cn/2014/0227/0951381337.png[/img]结论这款创新型安捷伦微吸附采样器(CTS) 能够提供有用、经济有效的数据用于挥发性亚硝胺的筛查、日常监测和在一个很宽浓度范围内的定量分析。这个采样装置使用非常简单和灵活,对高浓度空气样品允许小体积采样,对低浓度空气样品允许大体积采样。现场采样能在数秒到数分钟内完成。CTS 与TSP 和车载式5975TLTM GC/MS 搭配提供了一个灵敏的分析系统用于空气样品的分析。这个系统非常适合各种应用领域,包括在筛查性调查中快速得出分析结果,到为定量研究提供准确和精确的数据
[color=#333333]橄榄(Canarium album L.)为我国珍贵的药食两用资源,具有解酒护肝、抗菌消炎、抗病毒和解毒等药理功效,橄榄中酚类化合物是其主要的药效成分,但国内外有关橄榄酚类化合物组成的研究报道不多。本论文对我国橄榄果实中的酚类化合物进行提取、分离和纯化,并对酚类化合物单体的化学结构进行鉴定研究,以明确橄榄酚类的具体组成,对于橄榄资源的深加工利用和橄榄中药的药理研究具有重要的指导意义和应用价值。首先采用化学和仪器分析方法对福建闽侯檀香橄榄果实不同部分的化学组成进行了分析测定,[/color]
有没有大神做车内空气全谱分析或者车内硫类和胺类化合物测试的??而且是用热脱附GCMS做的??想咨询这方面的问题,私信我,有偿咨询!!!
[align=right][b]SGLC-GC/MS-020[/b][/align] [b]摘要:[/b]本文建立了12种硝基酚类化合物测定的[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]GC-MS[/color][/url]方法。参照HJ 1150-2020中色谱方法,采用色谱柱 SH-I-5SilMS对12种硝基酚类化合物进行分析,岛津[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]GCMS[/color][/url]-TQ8050NX[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url]-质谱联用仪进行检测。结果表明,12种硝基酚类化合物峰形对称,重现性好,满足标准要求。本方法可为12种硝基酚类化合物的测定提供参考。 [b]关键词:[/b]水质 硝基酚类 SH-I-5SilMS [url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]GC-MS[/color][/url] [b]1. 实验部分 1.1 实验仪器及耗材[/b] 岛津[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]GCMS[/color][/url]-TQ8050NX[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url]-质谱联用仪; 色谱柱:SH-I-5SilMS(30 m×0.25 mm×0.25μm;P/N:221-75954-30); 纯水机:PR-FP-0120α-MT1(+ 60L水箱 + 取水器); SHIMSEN Arc Disc HPTFE针式过滤器(P/N:380-00341-05); [url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]GC-MS[/color][/url]认证样品瓶LabTotal Vial(P/N:227-34002-01); SHIMSEN Pipet[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url]:SHIMSEN Pipet PMII-10(P/N:380-00751-02); SHIMSEN Pipet PMII-100(P/N:380-00751-04); SHIMSEN Pipet PMII-1000(P/N:380-00751-06)。 [b]1.2 混合标准使用液的制备[/b] 取市售硝基酚类混合标准品适量,用二氯甲烷稀释定容至2.0mg/L,作为混合标准使用液。 [b]1.3 分析条件 GC条件[/b] 毛细管柱:SH-I-5Sil MS(30 m×0.25 mm×0.25μm;P/N:221-75954-30) 程序升温:初始温度50℃,保持5min,以8℃/min升温到250℃,保持4min 载气:He 载气控制模式:恒线速度 流速:1.0ml/min 进样口温度:220 ℃ 进样量:1μL 进样方式:不分流进样 [b]质谱条件[/b] 电离模式:电子轰击电离(EI) 电子轰击能量:70 eV 离子源温度:230 ℃ 接口温度:260 ℃ 溶剂延迟:3min 数据采集模式:SIM 各化合物SIM参数见下表 [img=SHIMSEN Styra HLB]https://img.shimadzumall.com/Storage//userfiles/images/Img_articles/SGLC-[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]GCMS[/color][/url]-020_01.png[/img][font=arial, &][size=12px][/size][/font] [b]2. 实验结果[/b] 按照上述色谱条件(1.3)进行采集,混合标准使用液色谱图如下: [b]混合标准使用液[/b] [img=SHIMSEN Styra HLB]https://img.shimadzumall.com/Storage//userfiles/images/Img_articles/SGLC-[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]GCMS[/color][/url]-020_02.png[/img][font=arial, &][size=12px][/size][/font] [b]重现性数据[/b] [img=SHIMSEN Styra HLB]https://img.shimadzumall.com/Storage//userfiles/images/Img_articles/SGLC-[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]GCMS[/color][/url]-020_03.png[/img] [b]3. 结论[/b] 本文建立了12种硝基酚类化合物测定的[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]GC-MS[/color][/url]方法。参照HJ 1150-2020的方法,采用色谱柱SH-I-5SilMS对12种硝基酚类化合物进行分析,岛津[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]GCMS[/color][/url]-TQ8050NX[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url]-质谱联用仪进行检测。结果表明,12种硝基酚类化合物峰形对称,重现性好,满足标准要求。本方法可为12种硝基酚类化合物的测定提供参考。
我这一段时间在做聚噻吩类化合物的电分析,用循环伏安法寻找氧化还原电位,没找到什么方法,很苦恼。始终没有明显的峰出现,各位大哥有什么建议没有?比如选择什么电极,有什么有机体系我现在用的是铂盘铂片饱和甘汞电极体系溶剂用氯仿和DMF支持电解质用TBAP我把全部家当都抖出来了大哥们救命啊
我按照《空气和废气监测分析方法》第四版增补版测环境空气中酚类化合物时,做标准曲线时吸光度很低,直接法的曲线最大浓度点的吸光度值都不超过0.1,萃取法的最大浓度点吸光度值就在0.1左右
各位老师好; 我做HJ758-2015标准水质卤代乙酸酯类化合物气谱分析,ECD检测器/1701毛细柱,条件完全用标准规定的要求,采用200微克9个样品浓度点,拉定性看出峰,只有替代物出峰了,其他峰没有?请指教。谢谢
小的现在正在做药用植物中三萜类化合物的分离与鉴定工作,望各位网友能给我提供一些资料。主要用于波谱结构分析的参考与药理活性的分析。我的邮箱scwangtianshan@etang.com或传到论坛里共享。
做硝基呋喃类化合物检测用的标准品大家都是用的什么呀?有标准中说的是用对照品,有标准中用的是代谢物,不知道这其中有没有什么区别呀?大家都根据哪个标准做的呢?
各位大神酚类化合物前处理都怎么做的?索氏提取器坐土壤中的酚类化合物条件是多少合适?HJ703-2014这个标准,净化那一步怎么我做的有机相在上层,标准是说在下层,求指点,最好能细致点的