我想通过蛋白质红外图谱的酰胺一进行蛋二级结构分析,可是不知道具体步骤如何?用什么软件?请高手指点,最好详细点,谢谢!
哪位大仙做过红外分析蛋白质二级结构的,我十万火急需要您的指导!怎么具体的操作才能得到二级结构的光谱,得到了该咋分析!谢啦,谢啦!
各位高手,我急需对红外光谱进行拟合来对蛋白质二级结构进行分析,但目前我没有Grams软件,只好用Origin自己拟合,但这方面不熟悉,不知道哪位xdjm知道,告诉我步骤,不胜感激啊。
对于蛋白质的二级结构分析不清楚,目前我们采用CD(圆二色)测的结果。仪器自备的软件采用yang氏公式分析的,结果看得不是很明白,不知是否能够有版友帮解释一下数据哦。室温条件下β折叠基本上没有,50度过后,转角和无规线圈减少,而β折叠明显增加。是不是真的是这样呢????理论上随着温度的增高,蛋白的二级结构会变化,α螺旋和β折叠会减少。为什么会这样呢?要是对原始数据感兴趣的版友我可以上传原始数据温度C205060708090α螺旋0000.4%1.2%2.6%β折叠2.0%41.1%40.5%42%42.6%39.2%转角34.2%12.0%11.7%11%10.7%12.3%无规线圈63.8%46.0%47.9%46.6%45.7%45.9%
如题,怎样对蛋白质拉曼光谱所获得的二级结构含量进行分析
哪位牛人知道蛋白质的二级结构的数据库啊?现在急用胆碱氧化酶和乙酰胆碱酯酶的二级结构,就是关于螺旋多少,折叠多少的数据,希望帮忙啊!
如何利用红外光谱测定溶液中蛋白质的二级结构?有哪些注意事项?谢谢 !期待您的回复!
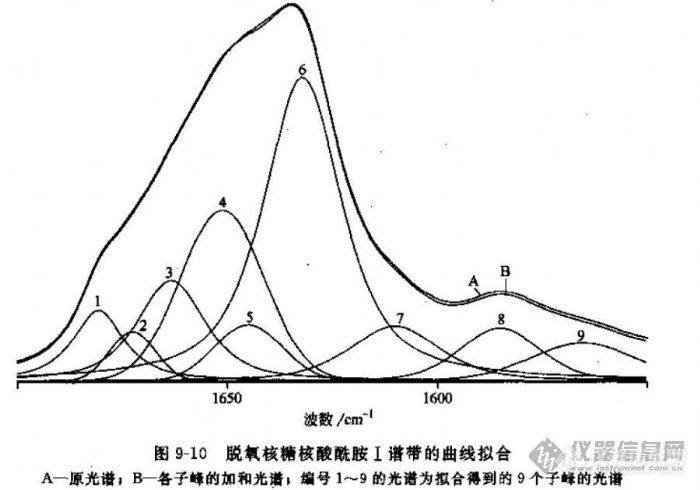
用OPUS5.5 软件对原始图谱进行了剪切、图谱转换、自退去卷积、求导和谱线拟合处理后,得到如附件所示图1中的谱线。接下来再经过怎样具体的处理才能得到最终如图2所示的谱线?蛋白质各二级结构的相对比例又是如何计算得到的?请各位高人指点,小弟在此先谢谢了![~105241~][~105243~]
新手,测定完某酶的圆二色谱,希望计算其二级结构中α-螺旋、β-折叠、β-转角、无规卷曲等二级结构的百分含量,但是苦于没有蛋白质二级结构分析软件如selcon3等,希望哪位前辈或仁兄能够共享?非常感谢。
在蛋白质折叠研究中常用分子荧光光谱研究二级结构的变化,请教高手二者间有何关系?
[align=left][img]https://www.bihec.com/olisclarity/wp-content/uploads/sites/7/2020/04/img_5e95c7819d226.png[/img][/align][align=left]小,现代,模块化。[/align][align=left]DSM 20 CD围绕我们的减法双光栅蜂鸟单色仪构建。对于想要最接近“传统” CD的Olis客户,这是首选模型。[/align][size=24px][b]应用领域:[/b][/size][align=left]蛋白质二级结构分析,蛋白质折叠分析,核酸,RNA和DNA研究,所有手性分子研究。[/align][align=left][b]技术指标:[/b][/align][list][*]直接获取 abs(L)和abs(R)[*]单光束和双光束吸收度和圆二色性[*]标准范围:170 – 700 nm替代范围:500 – 1700 nm[*]无校准,无漂移,基线平坦[*]线性超过5个数量级[*]减法双光栅蜂鸟单色仪用于均匀测量光束(对于异质样品(例如膜蛋白和晶体)更适用)[*]椭圆形镜壳中可产生臭氧的150W氙弧灯;由Olis员工或实验室成员轻松实施的其他来源替代[/list][align=left][b]可升级以支持:[/b][/align][list][*]带有单个或多个位置Peltier电池座的散热研究[*]CD停止流[*]磁性CD使用1.4特斯拉永久磁铁[*]荧光检测CD[*]扫描吸光度和固定波长停止流[*]扫描荧光和固定波长发射停止流[/list]
如何应用波谱方法测定蛋白质一级、二级、三级结构?
如何应用波谱方法测定蛋白质一级、二级、三级结构?
如何应用波谱方法测定蛋白质一级、二级、三级结构?
如何应用波谱方法测定蛋白质一级、二级、三级结构?
如何应用波谱方法测定蛋白质一级、二级、三级结构?
如何应用波谱方法测定蛋白质一级、二级、三级结构?
如何应用波谱方法测定蛋白质一级、二级、三级结构?
如何应用波谱方法测定蛋白质一级、二级、三级结构?
如何应用波谱方法测定蛋白质一级、二级、三级结构?
大家好,我们这里现有一个分子量为11kd的蛋白质想要对其进行二级结构的核磁测序,但由于分子量相对比较大,我联系了国内的很多大学和科研机构都不能完成,因为我赶着毕业所以急需可以做这种检测的单位. 我希望大家可以向我提供对外可以做这么大分子量蛋白质核磁测序的单位,我们愿意付费对该蛋白质进行核磁测序. 对您的帮助表示万分感谢!! 谢谢谢谢谢谢!!!! 我的邮箱:lzjqq001@yahoo.com.cn
如何应用波谱方法测定蛋白质一级、二级、三级结构?
利用核磁是否可以观察到蛋白质、核酸等二级结构的动态变化过程?
第一次做红外,想用ATR红外做蛋白质二级结构的定量测定,但是ATR红外的样品应该要是膜状的吧,那蛋白质干粉的话要怎么制样呢?
今天下午进行了两台仪器的使用培训。先说说圆二色谱吧,主要是测蛋白质二级结构的,螺旋,折叠,转角。凡涉及到蛋白质二级改变的都可以做。例如: 1、pH 对蛋白质的影响。蛋白质功能的改变基本上都是由于结构的改变造成的,因此,可以检测蛋白的二级结构检测pH的作用。 2、变性或者盐离子浓度的影响。 3、温度 4、与蛋白结合东西。如药物。另外CD还可以测物质的手性。L 与 D型吸收是相反的。以后有机会和时间的话再继续说明,大家也可以自己关注一下,网上也有很多。感谢35楼 cocotao提供的信息另外推荐一个在线分析CD的地方,包含多种分析方法和最完备的拟合数据库http://dichroweb.cryst.bbk.ac.uk/html/home.shtml
最近做蛋白质分析,用的是AB的Qtrap 5500.方法设置如下:EMSIDAEPI得到的谱图有多个峰,我想如何得到我蛋白质的二级谱图。
我想利用近红外分析一些蛋白质的组成,不需要分析氨基酸的成分,只想分析的蛋白亚基的程度,目前打算先做定标,有做过的朋友可不可以交流一下啊。我的邮箱:alex_qq@hotmail.com
[font='宋体']蛋白质结构解析目前核磁主要采用同核[font=Times New Roman]&[/font][font=宋体]异核二维谱吗?现在的技术发展解析一个大约几百个氨基酸组成的蛋白质大约需要多长时间?可以采用什么其他方法有效的辅助结构解析?[/font][/font][font='宋体'][/font]
蛋白质是生物体中含量最高,功能最重要的生物大分子,存在于所有生物细胞,约占细胞干质量的50%以上, 作为生命的物质基础之一,蛋白质在催化生命体内各种反应进行、调节代谢、抵御外来物质入侵及控制遗传信息等方面都起着至关重要的作用,因此蛋白质也是生命科学中极为重要的研究对象。关于蛋白质的分析研究,一直是化学家及生物学家极为关注的问题,其研究的内容主要包括分子量测定,氨基酸鉴定,蛋白质序列分析及立体化学分析等。随着生命科学的发展,仪器分析手段的更新,尤其是质谱分析技术的不断成熟,使这一领域的研究发展迅速。 自约翰.芬恩(JohnB.Fenn)和田中耕一(Koichi.Tanaka)发明了对生物大分子进行确认和结构分析的方法及发明了对生物大分子的质谱分析法以来,随着生命科学及生物技术的迅速发展,生物质谱目前已成为有机质谱中最活跃、最富生命力的前沿研究领域之一[1]。它的发展强有力地推动了人类基因组计划及其后基因组计划的提前完成和有力实施。质谱法已成为研究生物大分子特别是蛋白质研究的主要支撑技术之一,在对蛋白质结构分析的研究中占据了重要地位[2]。 1.质谱分析的特点 质谱分析用于蛋白质等生物活性分子的研究具有如下优点:很高的灵敏度能为亚微克级试样提供信息,能最有效地与色谱联用,适用于复杂体系中痕量物质的鉴定或结构测定,同时具有准确性、易操作性、快速性及很好的普适性。 2.质谱分析的方法 近年来涌现出较成功地用于生物大分子质谱分析的软电离技术主要有下列几种:1)电喷雾电离质谱;2)基质辅助激光解吸电离质谱;3)快原子轰击质谱;4)离子喷雾电离质谱;5)大气压电离质谱。在这些软电离技术中,以前面三种近年来研究得最多,应用得也最广泛[3]。 3.蛋白质的质谱分析 蛋自质是一条或多条肽链以特殊方式组合的生物大分子,复杂结构主要包括以肽链为基础的肽链线型序列[称为一级结构]及由肽链卷曲折叠而形成三维[称为二级,三级或四级]结构。目前质谱主要测定蛋自质一级结构包括分子量、肽链氨基酸排序及多肽或二硫键数目和位置。 3.1蛋白质的质谱分析原理 以往质谱(MS)仅用于小分子挥发物质的分析,由于新的离子化技术的出现,如介质辅助的激光解析/离子化、电喷雾离子化,各种新的质谱技术开始用于生物大分子的分析。其原理是:通过电离源将蛋白质分子转化为[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]离子,然后利用质谱分析仪的电场、磁场将具有特定质量与电荷比值(M/Z值)的蛋白质离子分离开来,经过离子检测器收集分离的离子,确定离子的M/Z值,分析鉴定未知蛋白质。 3.2蛋白质和肽的序列分析 现代研究结果发现越来越多的小肽同蛋白质一样具有生物功能,建立具有特殊、高效的生物功能肽的肽库是现在的研究热点之一。因此需要高效率、高灵敏度的肽和蛋白质序列测定方法支持这些研究的进行。现有的肽和蛋白质测序方法包括N末端序列测定的化学方法Edman法、C末端酶解方法、C末端化学降解法等,这些方法都存在一些缺陷。例如作为肽和蛋白质序列测定标准方法的N末端氨基酸苯异硫氰酸酯(phenylisothiocyanate)PITC分析法(即Edman法,又称PTH法),测序速度较慢(50个氨基酸残基/天);样品用量较大(nmol级或几十pmol级);对样品纯度要求很高;对于修饰氨基酸残基往往会错误识别,而对N末端保护的肽链则无法测序[4]。C末端化学降解测序法则由于无法找到PITC这样理想的化学探针,其发展仍面临着很大的困难。在这种背景下,质谱由于很高的灵敏度、准确性、易操作性、快速性及很好的普适性而倍受科学家的广泛注意。在质谱测序中,灵敏度及准确性随分子量增大有明显降低,所以肽的序列分析比蛋白容易许多,许多研究也都是以肽作为分析对象进行的。近年来随着电喷雾电离质谱(electrospray ionisation,ESI)及基质辅助激光解吸质谱(matrix assisted laser desorption/ionization,MALDI)等质谱软电离技术的发展与完善,极性肽分子的分析成为可能,检测限下降到fmol级别,可测定分子量范围则高达100000Da,目前基质辅助的激光解吸电离飞行时间质谱法(MALDI TOF MS)已成为测定生物大分子尤其是蛋白质、多肽分子量和一级结构的有效工具,也是当今生命科学领域中重大课题——蛋白质组研究所必不可缺的关键技术之一 [5] 。目前在欧洲分子生物实验室(EMBL)及美国、瑞士等国的一些高校已建立了MALDI TOF MS蛋白质一级结构(序列)谱库,能为解析FAST谱图提供极大的帮助,并为确证分析结果提供可靠的依据[6]。
我想利用近红外分析一些蛋白质的组成,不需要分析氨基酸的成分,只想分析的蛋白亚基的程度,目前打算先做定标,有做过的朋友可不可以交流一下啊。我的邮箱:alex_qq@hotmail.com