
1.问题描述在化合物检测中,质谱检测由于其高精密和宽检测范围,是化合物定性和定量分析的必要手段 其检测的离子峰基于精确分子量(ExcatMass),12C为12,1H为1.007825,16O为15.994915,而一般数据库或计算所得均为相对分子量,在实际检测过程中不能满足及时、快速的计算要求。利用[b]小程序-分子量计算器[/b]可以快速、准确解决这一问题。2.搜索小程序-分子量计算器[img=搜索小程序,627,377]https://ng1.17img.cn/bbsfiles/images/2019/07/201907231138351812_3608_3963607_3.png!w627x377.jpg[/img][align=left]3.分子量计算器主界面[/align][align=left]点击进入小程序后,主界面如下所示:[/align][img=,375,648]https://ng1.17img.cn/bbsfiles/images/2019/08/201908141636090567_9413_3963607_3.png!w375x648.jpg[/img][align=left]4.小程序计算相对分子量通过键盘输入分子式,如乙酸乙酯分子式为C4H8O2,依次点击’C’-’4’-’H’-’8’-’O’-’2’,然后点击‘≈’(即约等号),即可得到该化合物的相对分子量,结果为88.106。[/align][img=,372,649]https://ng1.17img.cn/bbsfiles/images/2019/08/201908141636370065_6838_3963607_3.png!w372x649.jpg[/img][align=left]5.小程序计算精确分子量[/align][align=left]同上操作,按‘=‘(即等号),即可得到该化合物的精确分子量,结果为88.05243。[/align][img=,374,644]https://ng1.17img.cn/bbsfiles/images/2019/08/201908141636560395_842_3963607_3.png!w374x644.jpg[/img]6.结束语简单快捷的操作,准确的计算结果,希望能够成为质谱检测工作者的手边利器。[img=,258,258]https://ng1.17img.cn/bbsfiles/images/2019/07/201907271601233013_7936_3963607_3.jpg!w258x258.jpg[/img]----------------------------------------[align=left]版本更新,界面稍有变化,功能有所加强。如乙酸乙酯C4H8O2,亦可输入CH3COOC2H5,小程序会自动简化分子式,并计算相对分子量/精确分子量,最大支持原子个数99。如无法使用,请更新至微信最新版本。[/align]
这几天在看学习材料,问一个弱弱的问题,请教GCMS质谱图上某一个碎片的质荷比与该碎片的质量数有什么关系?痛过这个质荷比能算出来该碎片的分子量吗?
做的低分辨质谱,单电荷峰和精确分子量能对上,比如342.29打出来是341.3。三电荷峰和计算的精确分子量差了0.5,有的还差了1-2,导致我不确定是不是我的物质,我的东西带上两个电荷后是415.48,打质谱却出现了416.3,请问多电荷的误差可以这么大吗
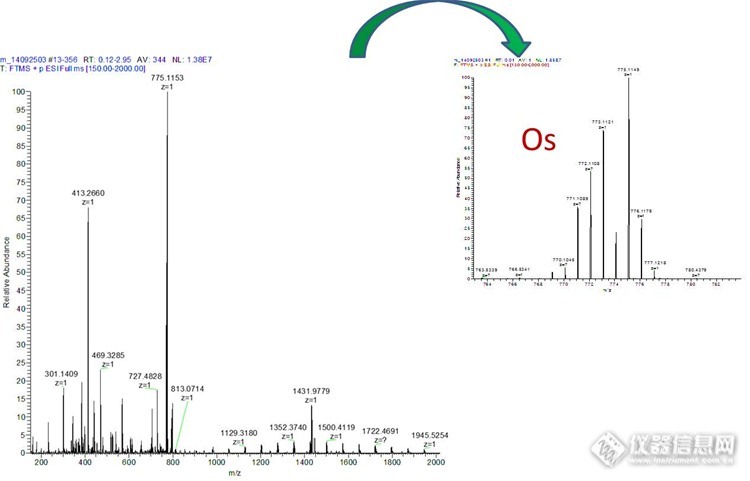
质谱应用之分子量测量 最近10年质谱技术的飞速发展,耐用的离子源,高性能的质量分析器和多种有效的扫描方式推动了质谱仪器走进各个单位,质谱成为功能强大的生物化学分析平台。目前基于质谱的物质定量定性实验应用广泛,从普通色谱-质谱(GC-LC&LC-MS)连用技术的定量分析实验(药理药代、农残筛查、环境污染物分析……),到大规模发现鉴定的组学实验(蛋白质组学和代谢组学)。抛开这些酷炫的方法和技术,我们今天讨论一下质谱的基本应用——测定分子量,通过一些测定分子量的实验我们可以看到分子量代表的更多意义。 质谱分析是一种测量离子质荷比(质量-电荷比)的分析方法,质谱法(Mass Spectrometry, MS)即用电场和磁场将运动的离子(带电荷的原子、分子或分子碎片,有分子离子、同位素离子、碎片离子、重排离子、多电荷离子、亚稳离子、负离子和离子-分子相互作用产生的离子)按它们的质荷比分离后进行检测的方法。测出离子准确质量即可确定离子的化合物组成。这是由于核素的准确质量是一多位小数,决不会有两个核素的质量是一样的,而且决不会有一种核素的质量恰好是另一核素质量的整数倍。分析这些离子可获得化合物的分子量、化学结构、裂解规律和由单分子分解形成的某些离子间存在的某种相互关系等信息(以上内容来自百度百科和高中教科书)。从定义我们看出,测定分子量是质谱的基本技能,一台质谱仪我们首先问的是它测量的分子量范围是多少,测量的准确度怎么样。1小分子的测定 质谱的首先发展是测定元素的相对分子量,比如我们一般说到元素C的分子量是12,其实说的是C在自然界的最高丰度12C的相对原子量,考虑自然界只有12C相对含量1.082%的13C,C准确平均分子量是12.011。化合物一般有C、H、O……多种元素组成,这些元素的同位素互相组合,如果我们的质谱可以区分相邻的同位素的相对分子量,质谱图上会显示的一簇峰,每个质谱峰对应相同的分子式下不同的同位素组成的化合物响应。因为化合物组形成元素的不同,他们的质谱簇峰分子量(momoisotopic mass)组成独特的质谱峰模式(pattern),如果质谱区分不了相邻的同位素峰,这一簇峰变成一个质谱峰所对应的是平均分子量(average mass)。 如果我们测定一个化合物分子量,如果通过质谱可以得到精细的元素分子量(momoisotopicmass)及其相对丰强度(在质谱上表现为簇峰的强度)的信息,可以通过谱图推测化合物的组成写出分子式。图1 A是测的城市污水提取物的分子量,三个主要质谱峰为同一个化合物的同位素质谱峰,推测分子式为C2HO2Br2,采用软件(很多软件都可以进行,最简单的是chem office)模拟此分子式的精确分子量,图2 B即为模拟所得的质谱图。可以看出所测得的质量偏差很小,最高元素峰216.8331-216.8328=0.0003Da,质谱峰分布模式(分子量和相对强度)实际测量图和模拟图几乎一致,可以确定该化合物的分子式是C2HO2Br2。http://ng1.17img.cn/bbsfiles/images/2014/12/201412131121_526995_2265735_3.jpg图1 污水提取物质谱图。A测量图,B模拟图。质谱Thermo LTQ-orbit,HESI源。 对于有特殊的元素的化合物,测量准确的分子量及其同位素质谱模式可以准确的判定特殊元素的存在,图2是测得某配位化合物的质谱图,通过其特殊的质谱图可以确定此化合物为Os金属配合物。http://ng1.17img.cn/bbsfiles/images/2014/12/201412131125_526996_2265735_3.jpg图2 Os配合物质谱图。质谱Thermo LTQ-orbit,HESI源。 上述测量过程简单实用,但是这个实验要求质谱有足够的质量准确度,所测的分子量与实际值最好在小数点最后一位有波动,不然预测分子式会有很大的偏差。2更高分子量的测量 对于同位素峰的测量,需要质谱区分相邻的同位素峰。在图1中两个同位素峰相差越2个道尔顿,在测量217分子量时候,只要质谱可以区分2个道尔顿的质谱峰就可以了,在图2中,同位素峰相差1道尔顿,区分度只有1个道尔顿。当分子量达到5K以上的时候,如果化合物仅仅由CHON等简单同位素组成,因为组成原子个数的增多,同位素峰越来越复杂,两个同位素峰之间的区分度越来越小,当质谱区分不开这些同位素峰的时候,测得是平均分子量(average mass)。图3 A测量的是一个分子量为10380Da的多肽,B和C是带10个电荷和11电荷同位素峰的局部方法图。在B中,同位素质谱峰间距(区分度)为0.1001Da。随着分子量的增加,需要质谱对相近同位素峰区分能力更强。评价质谱这种能力的指标是分辨率,我们一般用单位分辨率R=m/Δm来表示(该论述与严格定义有区别),图1需要的分辨率217/2=108,图2的分辨率780/1=780,而图三需要的分辨率1100/0.1=11000。所以说准确测分子量尤其是大分子量需要质谱具有高的分辨率。http://ng1.17img.cn/bbsfiles/images/2014/12/201412051959_526030_2265735_3.jpg图3多肽质谱测定。 A,质谱图B,,+10电荷质谱放大图C,+11电荷质谱放大图。Thermo LTQ-orbit,HESI源。3不同离子源的测定大分子的策略 目前测定大分子的主要离子源有基质辅助激光解吸(MALDI)和电喷雾(ESI)。图4是采用不同离子源测定聚乙二醇修饰药物分子量,A是MALDI质谱测得,几乎为所有分子的都带一个电荷,质谱间距为聚乙二醇重复单元-CH2-CH2-O-44Da;B为ESI质谱所测谱图,Z为分子所带电荷数,z=4质谱间距为44/4=11,z=3质谱间距为44/3=14.67。http://ng1.17img.cn/bbsfiles/images/2014/12/201412052001_526031_2265735_3.jpg图4聚乙二醇化药物质谱图。A AB MALDI-TOF谱图,基质DHB反射模式;B Thermo ESI-LTQ-Orbit谱图。 MALDI电离的离子一般带一个电荷(随着分子量增加,会出现带多个电荷的情况),图5是测得8478和11675多肽质谱图,5737为11675多肽带双电荷所得。采用MALDI测量分子量谱图测量结果直观方便,图6是测量分子
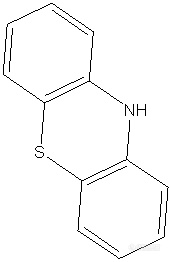
如题,用三重四极杆建盐酸异丙嗪杂质A的方法,杂质A结构如图所示,精确分子量为199.04557,质谱模式为正离子模型,流动相为0.1甲酸-60mm乙酸铵(PH为4.8),理论上讲正离子模式下物质应该加氢带正电荷,那么杂质A扫描所得M/Z应该是200才对,可是现在SCAN模式下只能找到199,这是正常的吗?没有带电荷的物质能被质谱检测到吗?[img=,171,262]https://ng1.17img.cn/bbsfiles/images/2021/12/202112051016350372_684_5176699_3.png!w171x262.jpg[/img]

[img=,690,55]http://ng1.17img.cn/bbsfiles/images/2018/03/201803021524542180_6133_1811858_3.png!w690x55.jpg[/img]小弟是新手,请各位大神帮忙解析下,母离子 M+H 是 1066.52 (二级质谱如图), 其2M+H 的分子量是 533.77和 534.27 (无二级质谱), 带两个电荷,可能的化合物类型(会不会是多肽?)[img=,690,70]http://ng1.17img.cn/bbsfiles/images/2018/03/201803021533353671_5495_1811858_3.png!w690x70.jpg[/img]母离子 M+H 是 938.47(二级质谱如图), 其2M+H 的分子量是 469.73 和 470.22 (二级质谱如下图), 带两个电荷[img=,690,75]http://ng1.17img.cn/bbsfiles/images/2018/03/201803021536089241_4585_1811858_3.png!w690x75.jpg[/img]类似的化合物还有很多,但分子量均很大,有带6-7个电荷的,分子量达到7000的,就不一一列举,但是他们一般带有特定的离子碎片峰,包括226.11或354.17或372.18,附件是质谱原始数据,以上的出峰时间在4.15min。
?质谱二级碎片的分析主要包括以下几个步骤?: ?获取质谱图?:首先,需要获取多肽的质谱图。这通常可以通过质谱仪设备得到,质谱图会显示不同的离子(包括多肽及其断裂产物)的m/z值和相对强度?。 ?分析峰值?:在质谱图中,需要分析峰值。这些峰值代表了不同的离子,通常最高的峰值(基线峰)被认为是多肽的单一电荷离子?。 ?确定离子类型?:通过分析质谱图中的峰值,可以确定离子的类型。例如,基线峰通常被认为是多肽的单一电荷离子?。 ?比较一级和二级质谱?:通过比较一级质谱(Full MS)和二级质谱(MS2),可以更深入地了解化合物的结构。二级质谱展示了更为详细的碎片离子裂变情况,通过观察哪些离子在二级质谱中出现了,以及它们的相对强度,可以帮助推测化合物的可能结构?。 ?推测化合物结构?:如果二级质谱中出现了某个特定质量的离子碎片,并且其强度与一级质谱中的某个离子相匹配,那么这个碎片可能就是那个离子的裂变产物。通过综合分析一级和二级质谱的数据,可以得出关于化合物结构的宝贵信息?。 ?使用谱库检索?:如果分析物没有明确的结构信息,可以先通过精确的分子量进行检索。例如,使用TOF(Time-of-Flight)质谱仪得到精确的分子量,然后通过谱库检索得到相应的分子式。通过比较碎片分析合理的结构?。
质谱是通过荷质比来鉴定不同的分子的,所以,其基本功能就是测定分子量。通过分子量这一信息能够获知的信息有很多,从裂解单个分子的方向出发,比如基团信息、结构的测定。 现代的很多质谱能够保证分子的完整性,于是可以用来测序,鉴定未知的蛋白质,或者比较样本当中蛋白和肽段的丰度分布,用于临床诊断。 所以,在药学上的应用,不仅仅可以鉴定某种药物,也可以鉴定某药物的代谢过程和形式;可以鉴定跟药物分子作用的大分子,可以鉴定可能的靶点;可以检测给药之后,蛋白水平的变化,从而评价药效药理;在蛋白质组学上,质谱已经是不可或缺的仪器工具了。因此,只有你想不到,没有它做不到。 所谓质谱就是将化合物变成离子状态然后检测离子;质谱主要是作为一种分析工具,主要完成两种任务,定性和定量。定性:化合物的质荷比就是独特的标签,串联质谱可以有二级或多级碎片帮助分析化合物结构;定量一级或多级碎片定量可以获得超高的灵敏度,ppt-ppm,ag级别吧。在药物研究中的应用,简单说就是定性:天然产物、合成的化学药物、药物代谢物;定量:目前正在开展的是生物药的QC将由质谱来操刀;目前质谱在药物研究领域的应用已经非常广泛未来将会更加广泛。 按照分辨率的不同,先来把质谱分个类,可以分为高分辨和低分辨。高分辨质谱(飞行时间, 静电轨道阱,离子回旋共振,磁质谱)能提供精确分子量信息,从而获知可能的元素组成(分子式),获得第一手的定性信息,在药物研发的各个阶段来说都是一个强有力的工具,当然运行成本高。低分辨质谱(四极杆,四极离子阱)只能提供精确到1Da的分子量信息,适合于已知化合物的鉴别和检测,但是价格便宜,应该说相当普及了。 质谱作为单独的分析仪器应用有限,还要和色谱等其他仪器联用才能发挥最大功效,介绍几个常见的色谱质谱联用仪器:GC/LC-QQQ, 液相/气相色谱串联四极杆,低分辨,分子量小于3k。能提供一定的分子碎片信息,定量能力强,用于一些需要微量定量的场合,例如体液中的药物浓度测定等GC/LC TOF,高分辨,分子量可达50万。特别使用于大分子研究,例如蛋白质类离子阱质谱,高分辨低分辨都有,主要特点是可以提供多级碎片信息,定性能力最强,定量性能较差,用于药物代谢,杂质研究等。 天然药化会用的比较多,有些未知结构的化合物用质谱还有红外和核磁共振可以得到化合物的结构,一般未知化合物的结构都会用到质谱,有一些高分辨率的质谱仪测定一些结构比较简单的化合物,甚至不需要用到红外和核磁共振。老师曾说过,质谱的核心就在解谱,质谱图的解析是关键。从质谱图我们获得的一个个离子相对的数量和它们各自的分子量,通过峰与峰之间的差值我们可以推断的是杂原子的种类或者脱落碎片的分子量,再根据峰与峰高度的比值获得碳骨架的形态(部分物质),如果存在分子离子峰,可以直接得到物质的分子量。由此可以看出,通过质谱,可以了解到物质的分子量、元素组成、元素比例,甚至可以获得部分结构上的信息。之后再通过红外,碳谱氢谱就能将物质的结构完全获得了。解析未知样品的质谱图,大致按以下程序进行:一:解析分子离子区(1)标出各峰的质荷比数,尤其注意高质荷比区的峰。(2)识别分子离子峰。首先在高质荷比区假定分子离子峰,判断该假定分子离子峰与相邻碎片离子峰关系是否合理,然后判断其是否符合氮律。若二者均相符,可认为是分子离子峰。(3)分析同位素峰簇的相对强度比及峰与峰间的Dm值,判断化合物是否含有C1、Br、S、Si等元素及F、P、I等无同位素的元素。(4)推导分子式,计算不饱和度。由高分辨质谱仪测得的精确分子量或由同位素峰簇的相对强度计算分子式。若二者均难以实现时,则由分子离子峰丢失的碎片及主要碎片离子推导,或与其它方法配合。(5)由分子离子峰的相对强度了解分子结构的信息。分子离子峰的相对强度由分子的结构所决定,结构稳定性大,相对强度就大。对于分子量约200的化合物,若分子离子峰为基峰或强蜂,谱图中碎片离子较少、表明该化合物是高稳定性分子,可能为芳烃或稠环化合物。例如:萘分子离子峰m/z 128为基峰,蒽醌分子离子峰m/z 208也是基峰。分子离子峰弱或不出现,化合物可能为多支链烃类、醇类、酸类等。二:解析碎片离子(1)由特征离子峰及丢失的中性碎片了解可能的结构信息。若质谱图中出现系列CnH2n+1峰,则化合物可能含长链烷基。若出现或部分出现m/z 77,66,65,51,40,39等弱的碎片离子蜂,表明化合物含有苯基。若m/z 91或105为基峰或强峰,表明化合物含有苄基或苯甲酰基。若质谱图中基峰或强峰出现在质荷比的中部,而其它碎片离子峰少,则化合物可能由两部分结构较稳定,其间由容易断裂的弱键相连。(2)综合分析以上得到的全部信息,结合分子式及不饱和度,提出化合物的可能结构。(3)分析所推导的可能结构的裂解机理,看其是否与质谱图相符,确定其结构,并进一步解释质谱,或与标准谱图比较,或与其它谱(1H NMR、13C NMR、IR)配合,确证结构。解析未知样的质谱图,大致按以下程序进行。
[color=#444444],我做了一个东西的[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]气质联用[/color][/url], 其中一个质谱的荷质比为以下:[/color][color=#444444]m/z 322.07 309.07 271.05 270.05 269.05 253.02 239.01 195.03 139.51[/color][color=#444444]丰度 6 11 3 18 100 52 6 6 9[/color][color=#444444]请问各位能帮我解释以下吗,可不可能是对甲苯磺酰氧甲基瞵酸二乙酯CAS 号:31618-90-3 分子式:C12H19O6PS 分子量:322.31 ,[/color]
质谱分析本是一种物理方法,其基本原理是使试样中各组分在离子源中发生电离,生成不同荷质比的带正电荷的离子,经加速电场的作用,形成离子束,进入质量分析器。在质量分析器中,再利用电场和磁场使发生相反的速度色散,将它们分别聚焦而得到质谱图,从而确定其质量。第一台质谱仪是英国科学家阿斯顿(F.W.Aston,1877—1945)于1919年制成的。出手不凡,阿斯顿用这台装置发现了多种元素同位素,研究了53个非放射性元素,发现了天然存在的287种核素中的212种,第一次证明原子质量亏损。他为此荣获1922年诺贝尔化学奖。质谱仪开始主要是作为一种研究仪器使用的,这样用了20年后才被真正当作一种分析工具。它最初作为高度灵敏的仪器用于实验中,供设计者找寻十分可靠的结果。早期的研究者们忙着测定精确的原子量和同位素分布,不能积极地去探索这种仪器的新用途。由于同位素示踪物研究的出现,质谱仪对分析工作的用处就越发变得明显了。氮在植物中发生代谢作用的生物化学研究要求用15N作为一种示踪物。但它是一种稳定的同位素,不能通过密度测量来精确测定,所以质谱仪就成了必要的分析仪器。这种仪器在使用稳定的13C示踪物的研究中以及在基于稳定同位素鉴定的工作中也是很有用的。标准型的质谱仪到现在已经使用了大约45年。40年代期间,石油工业在烃混合物的分析中开始采用质谱仪。尽管这种质谱图在定量解释时存在着难以克服的计算麻烦,但在有了高速计算机后,这种仪器就能在工业方面获得重大的成功。(1)近20年来质谱技术随着新颖电离技术,质量分析技术,与各种分离手段的联用技术以及二维分析方法的发展,质谱已发展成为最广泛应用的分析手段之一。其最突出的技术进步有以下几个方面:新的解吸电离技术不断涌现,日趋成熟,可测分子量范围越来越高,并逐步适用于难挥发、热敏感物质的分析,例如海洋天然产物、微生物代谢产物,动植物二次代谢产物以及生物大分子的结构研究。最有发展前景的电离方法有:①等离子解吸采用252Cf的裂介碎片作为离子源,使多肽和蛋白质等生物大分子不必衍生化而直接电离进行质量分析。它与飞行时间质谱相配合,已成功地用于许多合成多肽的质谱分析,并已在一些实验室中作为常规分析方法来鉴定多肽和蛋白质。目前它的可分析的质量极限大约是50000D。②快原子轰击,把样品分子放入低挥发性液体中,用高速中性原子来进行轰击,可使低挥发性的,热敏感的分子电离,得到质子化或碱金属离子化的分子离子。由于很容易在磁质谱或四极杆质谱上安装使用,因此得到广泛应用,分子量很容易达到3000—4000。如果与带有后加速的多次反射阵列检测器的高性能磁质谱配合使用,可测分子量可达到10000amn以上,最高记录可达25000amn。③激光解吸,利用CO2激光(10.6μm),Nd/YAG激光(1.06μm)的快速加热作用使难挥发的分子解吸电离,与飞行时间质谱或离子回旋共振质谱相配合成功地分析了一系列蛋白质和酶的复合物,并创造了蛋白质分子质量分析的最高记录(Jack Bean Urease Mr~27万)。④电喷雾(electro spray,electrostatic spray,ion spray)把分析样品通过常压电离源,使分子多重质子化而电离。由于生成多重质子化的分子离子可缩小质荷比,因此一个分子量为数万的生物大分子,如果带上几十个,上百个质子,质荷比可降低到2000以下,可以用普通的四极杆质谱仪分析,其次由于得到一组质荷比连续变化的分子离子峰,通过对这些多电荷分子离子峰的质量计算可以得到高度准确的平均分子量。第三是这种多重质子化的分子离子峰可进一步诱导碰撞活化,进行串联质谱分析。第四是这种电离技术的样品制备要求极低,溶于生物体液的样品分子或HPLC,CZE的流出液都可直接引入常压电离源进行联机检测。
未知样的质谱图解析流程 (一)解析分子离子区(1) 标出各峰的质荷比数,尤其注意高质荷比区的峰。(2) 识别分子离子峰。首先在高质荷比区假定分子离子峰,判断该假定分子离子峰与相邻碎片离子峰关系是否合理,然后判断其是否符合氮律。若二者均相符,可认为是分子离子峰。 (3) 分析同位素峰簇的相对强度比及峰与峰间的Dm值,判断化合物是否含有C1、Br、S、Si等元素及F、P、I等无同位素的元素。 (4)推导分子式,计算不饱和度。由高分辨质谱仪测得的精确分子量或由同位素峰簇的相对强度计算分子式。若二者均难以实现时,则由分子离子峰丢失的碎片及主要碎片离子推导,或与其它方法配合。 (5)由分子离子峰的相对强度了解分子结构的信息。分子离子峰的相对强度由分子的结构所决定,结构稳定性大,相对强度就大。对于分子量约200的化合物,若分子离子峰为基峰或强蜂,谱图中碎片离子较少、表明该化合物是高稳定性分子,可能为芳烃或稠环化合物。 例如:萘分子离子峰m/z128为基峰,蒽醌分子离子峰m/z 208也是基峰。分子离子峰弱或不出现,化合物可能为多支链烃类、醇类、酸类等。 (二)、解析碎片离子(1) 由特征离子峰及丢失的中性碎片了解可能的结构信息。 若质谱图中出现系列CnH2n+1峰,则化合物可能含长链烷基。若出现或部分出现m/z77,66,65,51,40,39等弱的碎片离子蜂,表明化合物含有苯基。若m/z91或105为基峰或强峰,表明化合物含有苄基或苯甲酰基。若质谱图中基峰或强峰出现在质荷比的中部,而其它碎片离子峰少,则化合物可能由两部分结构较稳定,其间由容易断裂的弱键相连。(2)综合分析以上得到的全部信息,结合分子式及不饱和度,提出化合物的可能结构。 (3)分析所推导的可能结构的裂解机理,看其是否与质谱图相符,确定其结构,并进一步解释质谱,或与标准谱图比较,或与其它谱(1HNMR、13CNMR、IR)配合,确证结构。
质谱法是一种强大的分析工具,其原理是测量带电粒子质量的方法,当分析样品进入质谱仪后,首先在离子源处使分析物进行游离化以转换为带电离子,进入质量分析器后,在电场、磁场等物理力量的作用下,探测器可测得不同离子的质荷比(m/z),从而从电荷推算出分析物的质量。传统质谱法难以分辨质量大于几百千道尔顿的物质(例如蛋白质复合物)的电荷状态。然而近些年,一种新的质谱方法出现,即电荷检测质谱 (Charge Detection Mass Spectrometry,CDMS) 。CDMS 是一种通过同时测量单个离子的质荷比(m/z)来确定单个离子质量的单粒子技术。确定数以千计的单个离子的质量,然后将结果合并提供质谱图。使用这种方法,可以测量通常不适合传统质谱分析的异质和高分子量样品的准确质量分布。最新发表的CDMS技术的应用就包括了高度糖基化的蛋白质、蛋白质复合物、蛋白质聚集体(如淀粉样蛋白纤维)、传染性病毒、基因疗法、疫苗和囊泡(如外泌体)。虽然到目前为止,CDMS 仍然是少数能够自制仪器的科研人员在应用。而随着生物医学的快速发展,研究人员分析分子量超大样品的需求快速增长,传统的质谱方法面临一定的限制,以CDMS为焦点的分析技术也许将成为下一个里程碑。前沿技术发生革新,行业巨头公司一定是反应最快的。日前,全球著名的质谱仪器公司Waters便发布公告,成功收购了一家专攻电荷检测质谱技术(CDMS)的初创企业,Megadalton Solutions。该公司由美国印第安纳大学的Martin Jarrold和David Clemmer两位教授于2018年创立。[img=mega创始人.png]https://img1.17img.cn/17img/images/202202/uepic/6936b2e1-2955-452e-9eb5-9ca539fb600a.png[/img][font=&][size=16px][color=#333333]笔者进一步查询到,Martin F. Jarrold 本人在过去十年一直致力于 CDMS技术的研究,也于2015年发表了“Charge Detection Mass Spectrometry with Almost Perfect Charge [/color][/size][/font][font=&][size=16px][color=#333333]Accuracy”相关文章。(DOI:[url]https://doi.org/10.1021/acs.analchem.5b02324[/url])。[/color][/size][/font][font=&][size=16px][color=#333333]2021年还发表了关于CDMS在生物分子学和生物技术相关的应用进展文章“Applications of Charge Detection Mass Spectrometry in Molecular Biology and Biotechnology”。(DOI:[url]https://doi.org/10.1021/acs.chemrev.1c00377[/url])[/color][/size][/font]2018年,Martin Jarrold和David Clemmer教授因在离子淌度质谱技术上的开创性发明,共同获得了美国质谱学会颁发的质谱杰出贡献奖。不仅如此,David Clemmer教授还曾获得2006年的Biemann奖章。[align=center][img=2018 ASMS杰出共享奖.png,600,259]https://img1.17img.cn/17img/images/202202/uepic/1967a9e8-bc50-4b33-80f6-46585d05a407.png[/img][/align][align=center]2018年ASMS质谱杰出贡献奖[/align]可以说,Megadalton Solutions公司是由两位质谱界大佬为了研发CDMS仪器创立的,技术实力很强硬。Waters公司的眼光也非常独到,于2021年就已经将Megadalton的CDMS技术引进到了Waters的Immerse Cambridge创新和研究实验室,并应用于各项先进检测及研发工作。[url=https://www.instrument.com.cn/news/20220207/605434.shtml][color=#ff0000](相关链接:沃特世收购电荷检测质谱技术 扩大细胞和基因治疗领域应用)[/color][/url]此外,笔者还注意到了另外一家基于CDMS技术的初创企业,荷兰公司TrueMass。[align=center][img=True.png]https://img1.17img.cn/17img/images/202202/uepic/1513aab2-aa16-408e-914a-00cdf762c4ca.png[/img][/align][align=center][/align]TrueMass 于 2020 年在荷兰成立,并在英国曼彻斯特设有制造工厂。这家私营投资公司已从天使投资人获得大量资金,公司的使命是提供新技术,帮助全球研究人员和临床实验室推进药物开发和材料技术的研究。该公司于2021年10月26日在宾夕法尼亚州费城举办的ASMS上推出了其研发的CDMS仪器。[align=center][/align][align=center][img]https://img1.17img.cn/17img/images/202202/uepic/a9414deb-6b4c-4547-93b0-af042aab0c2c.png[/img][/align][align=center][img]https://img1.17img.cn/17img/images/202202/uepic/000b48b0-acd8-4420-98f4-9ffe3137fc02.png[/img][/align][align=center][/align]笔者也搜索了TrueMass创始人 John Hoyes博士相关的信息,以飨读者。[align=center][img=john Hoyes.png,600,373]https://img1.17img.cn/17img/images/202202/uepic/efa105d1-a0e5-40b4-acf2-5dd6eabfce69.png[/img][/align][align=center]TrueMass创始人 John Hoyes博士[/align]TrueMass 创始人 John Hoyes 博士在质谱行业拥有 30 多年的从业经验。他于 1989 年在曼彻斯特大学完成了激光物理学博士学位,并在该大学科学技术学院仪器与分析科学系 (DIAS) 担任了一年的博士后研究助理。 Hoyes博士1990 年首次加入 VG Analytical,担任曼彻斯特工厂的开发物理学家。在头两年致力于改进磁扇磁场质谱仪器后,他开始研究飞行时间 (TOF) 质谱仪器。他是 VG Analytical 第一台 TOF 仪器的项目负责人,该仪器采用了 MALDI 离子源。 1995 年,他领导开发了世界上第一台商用 Q-TOF 仪器,该仪器于1996 年底由Micromass(后被Waters收购)推出。 2000 年,他发明了高分辨率光学 TOF 几何结构,并被纳入下一代 Q-TOF 仪器的改进。 2003 年,Hoyes博士离开 VG,成立了一家名为 MS Horizons 的新公司,专门提升该领域现有 Q-TOF 仪器的性能。在此期间,Hoyes博士对离子淌度和飞行时间杂合质谱仪器产生了兴趣,并为此申请了专利。他于 2006 年回到 Micromass(后被Waters收购) 担任研究总监,并于 2010 年成为技术总监。在他任职期间,公司推出了 SYNAPT G2、Vion 仪器和 StepWave 离子源等产品。 2013 年,他成为Waters科学研究员,并于 2016 年在 HUPO(人类蛋白质组组织)获得“科学技术奖”。2018 年 4 月,Hoyes博士离开公司,成立了 HGSG Ltd咨询公司。2020年Hoyes博士创立了 TrueMass公司以实现他对商业电荷检测质谱仪器的想法。总体看来,CDMS技术在复杂生物分析中能够发挥质谱技术的精确性优势,不久之后,质谱巨头们关于CDMS技术一定会动作频频,仪器信息网也将持续带来最新报道,敬请关注。
以下是我打的质谱图,我一共有3个样品,全部都是多肽。我的目的是想看分子量。三个样品的结果用UPLC-QTOF-MS做了,第1个图为空白,下面三个分别为三个样品的TIC图。可是这些图我是一点都看不明白,不知道是什么意思,为什么图上没有显示样品的质荷比?请大家帮我分析一下!!!其次,请大家帮我解释一下什么叫作TIC图?最后,从这张图上能得出我3个样品的分子量是多少吗?不甚感激!!!http://edu.emuch.net/attachment/a5/8e/1217626_1301502461_828.jpghttp://edu.emuch.net/attachment/26/19/1217626_1301502464_726.jpg
?质谱成像?是一种基于质谱技术的成像方法,通过质谱仪直接扫描生物样品进行成像,可以在同一张组织切片或组织芯片上同时分析数百种分子的空间分布特征。这种方法不仅限于分析特定的蛋白质分子,而是可以在组织切片中找到每一种蛋白质分子,并提供这些分子在组织中的空间分布的精确信息?。 质谱成像的基本原理 质谱成像技术使用质谱仪通过测定质荷比来分析生物分子的标准分子量。这种方法不需要对待测物进行标记,分析物可以保持其最初的形态被检测,同时可以对蛋白质分子的含量进行相对定量?
解析未知样的质谱图,大致按以下程序进行。(一)解析分子离子区 (1) 标出各峰的质荷比数,尤其注意高质荷比区的峰。 (2) 识别分子离子峰。首先在高质荷比区假定分子离子峰,判断该假定分子离子峰与相邻碎片离子峰关系是否合理,然后判断其是否符合氮律。若二者均相符,可认为是分子离子峰。 (3) 分析同位素峰簇的相对强度比及峰与峰间的Dm值,判断化合物是否含有C1、Br、S、Si等元素及F、P、I等无同位素的元素。 (4) 推导分子式,计算不饱和度。由高分辨质谱仪测得的精确分子量或由同位素峰簇的相对强度计算分子式。若二者均难以实现时,则由分子离子峰丢失的碎片及主要碎片离子推导,或与其它方法配合。 (5) 由分子离子峰的相对强度了解分子结构的信息。分子离子峰的相对强度由分子的结构所决定,结构稳定性大,相对强度就大。对于分子量约200的化合物,若分子离子峰为基峰或强蜂,谱图中碎片离子较少、表明该化合物是高稳定性分子,可能为芳烃或稠环化合物。 例如:萘分子离子峰m/z 128为基峰,蒽醌分子离子峰m/z 208也是基峰。分子离子峰弱或不出现,化合物可能为多支链烃类、醇类、酸类等。(二)、解析碎片离子 (1) 由特征离子峰及丢失的中性碎片了解可能的结构信息。 若质谱图中出现系列CnH2n+1峰,则化合物可能含长链烷基。若出现或部分出现m/z 77,66,65,51,40,39等弱的碎片离子蜂,表明化合物含有苯基。若m/z 91或105为基峰或强峰,表明化合物含有苄基或苯甲酰基。若质谱图中基峰或强峰出现在质荷比的中部,而其它碎片离子峰少,则化合物可能由两部分结构较稳定,其间由容易断裂的弱键相连。 (2) 综合分析以上得到的全部信息,结合分子式及不饱和度,提出化合物的可能结构。 (3) 分析所推导的可能结构的裂解机理,看其是否与质谱图相符,确定其结构,并进一步解释质谱,或与标准谱图比较,或与其它谱(1H NMR、13C NMR、IR)配合,确证结构。
1.如果在低分辨质谱上测试相同物质的量的CO和N2,它们的谱峰强度是叠加的还是重合的,假如一份CO和一份N2的混合物质谱和两份CO质谱比较强度,关系是1:2还是1:1?2.高分辨质谱的tic图中,出现有很多的精确分子量都找不出对应的物质,资料中都简单地说是杂质,但杂质也是物质,也应该有对应的分子式啊,那这种情况到底是哪里出现了问题呢,每一种软件都有这个情况,就是有很多的质荷比找不到对应的物质!3.为什么好多测试机构都不愿意做表面活性剂的质谱,是因为表面活性剂在分离柱上难以洗脱,还是因为它对质谱仪有影响呢?分离柱上难以洗脱,那为什么做[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]又都没有问题呢,对质谱有伤害,那么文献中那么多表面活性剂的质谱图是怎么测试来的呢4.几种质谱软件象masslynx,xcalibur中都有扣背景功能,peakview怎么找不到这个功能?如下图,打开peakview的一级谱,再打开响应强(颜色深)的445.1201二级谱,开启查找分子式,为啥匹配出来的质荷比为445.2972,和一级谱质荷比相差几十个ppm,好像都这样相差比较大,这是什么原因呢,好像查找分子式都是以二级谱图匹配出来的质荷比来查找的,那这样一级谱图的质荷比数据还靠得住吗?如果不做二级扫描,一级谱图的质荷比就难以参考找到相应的分子式了吗?6.是不是只要在ESI电离模式,所有的离子都会有加合离子,包括不是准分子的离子和二级扫描产生的碎片离‘子? [img]https://ng1.17img.cn/bbsfiles/images/2022/10/202210210957492501_3119_3353512_3.png[/img]
质谱方法(Mass Spectroscope,MS)是通过正确测定蛋白质分子的质量而进行蛋白质分子鉴定、蛋白质分子的修饰和蛋白质分子相互作用的研究。质谱仪通过测定离子化生物分子的质荷比便可得到相关分子的质量。但长期以来,质谱方法仅限于小分子和中等分子的研究,因为要将质谱应用于生物大分子需要将之制备成气相带电分子,然后在真空中物理分解成离子。但如何使蛋白分子经受住离子化过程转成气相带电的离子而又不丧失其结构形状是个难题。20世纪70年代,解吸技术的出现成功地将蛋白分子转化成气相离子。尔后快原子轰击与其紧密相关的溶液基质二次离子质谱法使得具有极性的、热不稳定的蛋白分子可经受住电离过程。但这些方法仅限于10kD以下蛋白分子的研究。80年代电喷雾电离(ESI)和软激光解吸(SLD)电离技术的发展则使得质谱方法应用于高分子量蛋白分子的研究。 电喷雾电离(ESI)原理可按电荷残留模型予以描述,带电液滴蒸发,液滴变小,液滴表面相斥的静电荷密度增大。当液滴蒸发到某一程度,液滴表面的库仑斥力使液滴爆炸。产生的小带电液滴继续此过程。随着液滴的水分子逐渐蒸发,就可获得自由徘徊的质子化和去质子化的蛋白分子。针对电喷雾电离所产生的多电荷状态,Fenn将多电荷状态理解为对分子质量进行多次独立的测量,并基于联立方程解的平均方法,获得对分子质量的正确估量,解决了多电荷离子信息的问题,使蛋白分子质量测量精度获得极大的提高,并于1988年首次成功地测量了分子量为40 kD的蛋白质分子,精确度达到99.99%。
高效液相色谱(?HPLC)?主要基于化合物在固定相和移动相之间的分配平衡进行分离。样品溶液通过色谱柱时,不同化合物与固定相之间的相互作用力不同,从而实现分离。??质谱(?MS)?则是通过电离样品分子,然后根据离子的质荷比进行分离和检测。质谱技术可以对分离出的化合物进行质荷比测定,从而得到化合物的分子量、结构等信息。 应用领域 HPLC广泛应用于有机化合物的分离和纯化,特别是在药物分析、环境监测、食品检测等领域。它不仅可以对复杂样品进行高效分离,还可以提供化合物的定性和定量信息。质谱则更多地应用于生物样品分析、药物代谢研究以及新化合物的发现等领域。质谱能够在不破坏样品的情况下,提供更为精确和详细的结构信息,对于复杂生物样品的分析尤为适用。 分析能力 HPLC的分析能力主要体现在对化合物的分离效果上,通过优化色谱条件,可以实现对目标化合物的有效分离和纯化。质谱则具有更高的分析能力,它不仅能够对化合物进行分离,还能提供化合物的分子量、结构、官能团等详细信息,对于未知化合物的鉴定和新化合物的发现具有重要意义。 操作复杂度及仪器成本 HPLC的操作相对简单,仪器成本也相对较低,因此更适合于日常分析工作。质谱由于集成了液相色谱和质谱两大系统,操作复杂度较高,且仪器成本也相对较高。但是,由于其强大的分析能力和广泛的应用范围,质谱在科研和工业领域仍然具有广泛的应用前景。
[color=#444444]为什么分子量多24?[/color][color=#444444]我做了三个化合物,组成原子为C、H、O、N,进行分子量鉴定,质谱数据比理论上的分子量每个化合物都多24!我怀疑是质谱测试的系统误差,可是我不知道这个误差是怎么来的。请专家帮助我!谢谢[/color]
质谱解析程序质谱解析程序 解析未知样的质谱图,大致按以下程序进行。(一)解析分子离子区 (1) 标出各峰的质荷比数,尤其注意高质荷比区的峰。 (2) 识别分子离子峰。首先在高质荷比区假定分子离子峰,判断该假定分子离子峰与相邻碎片离子峰关系是否合理,然后判断其是否符合氮律。若二者均相符,可认为是分子离子峰。 (3) 分析同位素峰簇的相对强度比及峰与峰间的Dm值,判断化合物是否含有C1、Br、S、Si等元素及F、P、I等无同位素的元素。 (4) 推导分子式,计算不饱和度。由高分辨质谱仪测得的精确分子量或由同位素峰簇的相对强度计算分子式。若二者均难以实现时,则由分子离子峰丢失的碎片及主要碎片离子推导,或与其它方法配合。 (5) 由分子离子峰的相对强度了解分子结构的信息。分子离子峰的相对强度由分子的结构所决定,结构稳定性大,相对强度就大。对于分子量约200的化合物,若分子离子峰为基峰或强蜂,谱图中碎片离子较少、表明该化合物是高稳定性分子,可能为芳烃或稠环化合物。 例如:萘分子离子峰m/z 128为基峰,蒽醌分子离子峰m/z 208也是基峰。分子离子峰弱或不出现,化合物可能为多支链烃类、醇类、酸类等。(二)、解析碎片离子 (1) 由特征离子峰及丢失的中性碎片了解可能的结构信息。 若质谱图中出现系列CnH2n+1峰,则化合物可能含长链烷基。若出现或部分出现m/z 77,66,65,51,40,39等弱的碎片离子蜂,表明化合物含有苯基。若m/z 91或105为基峰或强峰,表明化合物含有苄基或苯甲酰基。若质谱图中基峰或强峰出现在质荷比的中部,而其它碎片离子峰少,则化合物可能由两部分结构较稳定,其间由容易断裂的弱键相连。 (2) 综合分析以上得
质谱中的质荷比怎么算
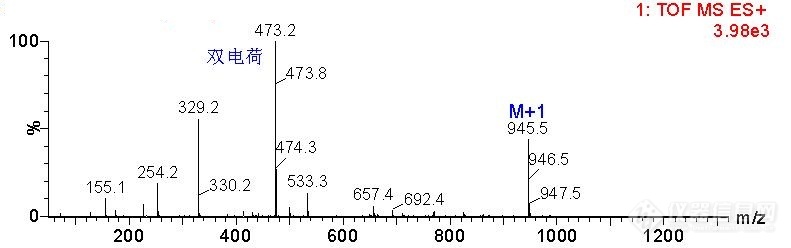
[color=#444444]求大家帮忙看看这张ESI质谱图[/color][color=#444444]以下是我打的质谱图,样品为多肽。[/color][color=#444444]我的目的是想看分子量。[/color][color=#444444]我是用UPLC-QTOF-MS做的,ESI源,仪牌子是Waters MALDI SYNAPT QTOF MS液相色谱串联四级杆飞行时间质谱。[/color][color=#444444]那请问大家,从这张图上如何分析我样品的分子量?[/color][color=#444444]其次,图右上角的3.98e3是什么意思?代表样品的能量信号吗?样品含量越高,这个值也就越大吗?[/color][color=#444444]不甚感激!!![/color][color=#444444][img=,690,216]https://ng1.17img.cn/bbsfiles/images/2019/08/201908281609380409_3981_1806906_3.jpg!w690x216.jpg[/img][/color]
一级扫描和理论分子量不一样,和直接进样进别的质谱打出来的不一样,不是准分子离子峰,也不是多电荷,fragmentor改小了也不行,求大神指教。
质谱方法(Mass Spectroscope,MS)是通过正确测定蛋白质分子的质量而进行蛋白质分子鉴定、蛋白质分子的修饰和蛋白质分子相互作用的研究。质谱仪通过测定离子化生物分子的质荷比便可得到相关分子的质量。但长期以来,质谱方法仅限于小分子和中等分子的研究,因为要将质谱应用于生物大分子需要将之制备成[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]带电分子,然后在真空中物理分解成离子。但如何使蛋白分子经受住离子化过程转成[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]带电的离子而又不丧失其结构形状是个难题。20世纪70年代,解吸技术的出现成功地将蛋白分子转化成[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]离子。尔后快原子轰击与其紧密相关的溶液基质二次离子质谱法使得具有极性的、热不稳定的蛋白分子可经受住电离过程。但这些方法仅限于10kD以下蛋白分子的研究。80年代电喷雾电离(ESI)和软激光解吸(SLD)电离技术的发展则使得质谱方法应用于高分子量蛋白分子的研究。 GtqA@&5& ueJ_F#y 电喷雾电离(ESI)原理可按电荷残留模型予以描述,带电液滴蒸发,液滴变小,液滴表面相斥的静电荷密度增大。当液滴蒸发到某一程度,液滴表面的库仑斥力使液滴爆炸。产生的小带电液滴继续此过程。随着液滴的水分子逐渐蒸发,就可获得自由徘徊的质子化和去质子化的蛋白分子。针对电喷雾电离所产生的多电荷状态,Fenn将多电荷状态理解为对分子质量进行多次独立的测量,并基于联立方程解的平均方法,获得对分子质量的正确估量,解决了多电荷离子信息的问题,使蛋白分子质量测量精度获得极大的提高,并于1988年首次成功地测量了分子量为40 kD的蛋白质分子,精确度达到99.99%。 {0} Q5 p@=B\A] 软激光解吸(SLD)是指从激光脉冲中获得能量后,样品分子以完整的低电荷分子离子释放,然后由电场加速。运用激光解吸电离蛋白分子时,激光的能量和波长、化学/物理基质的吸收和热传递特性,与基质中分析物的分子结构之间需要作合理的选择调配。Tanaka选用了低能量氮激光和含有胶状颗粒的甘油作基质,成功地测定了高分子量的糜蛋白酶原、梭肤酶-A以及细胞色素。由于Tanaka成功的开创性工作,SLD技术迅速发展。目前占主导的方法是基质辅助激光解吸电离(MALDI)。这一方法是将样品掺入一种低分子量的结晶基质,基质的最大吸收与激光脉冲波长匹配。由于MALDI产生的是低电荷的完整[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]大分子,可用于检测纯度不高的生物分子。MALDI与飞行时间(TOF)联合已经成为鉴别大分子的重要方法,成为鉴定细胞内蛋白组分不可或缺的研究手段。
[color=#444444]利用液相色谱-质谱做的酯类润滑油,检测出分子量都在七八百,实际情况应该在四百左右。请问什么因素会导致检测结果大这么多呢?[/color]
分子量测定: Q:为什么测定的结果跟理论的结果不一致? A:因为机器测定会有一定的误差,如100000Da的蛋白质最大误差是100Da,如果测定的结果与理论值成倍数关系的可能原因是:0.3倍可能是三电荷峰,0.5倍可能是双电荷峰,原因是样品含碱氨基酸较多;2倍可能是二聚体,3倍可能是三聚体,原因可能是样品中含有过多的二硫键。 Q:为什么我的样品非常纯,但在主峰的附近会有一些小峰?同时在主峰一半或两倍的地方有一个小峰? A:这是因为在激光的扫描的过程中可能会使样品分子损失一些离子,如H2O、NH3等,或者出现样品分子与基质的加合峰,正常的情况下MALDI-TOF单电荷峰占主要,所以有时会在主峰一半或两倍的地方有一个小峰,是双电荷峰和二聚体峰; Q:为什么我的样品纯度、浓度都很好,盐浓度也很低,却得不到结果? A:这只能与蛋白质本身的结构有关,基质不能很好的分离样品,所以希望您能尽可能滇供样品其他的理化质,如酸、碱蛋白、糖蛋白等。的确,有时您的样品的所有质、状态都正常,还是不能得到您想要的结果,这种问题其实已经超出了我们能力的范围,我们仅仅是您整个实验的一个环节,能够做到的是向您提供一个准确的结果。 肽指纹图谱及数据库检索 Q:为什么考马斯染色的结果比银染的结果好。 A:主要是银染的灵敏度较高,得到的蛋白质量较少,再加上在处理样品的过程中银染要脱银,增加洗脱的次数,样品的损失较大,所以噪音和角蛋白污染对目的蛋白的影响较大,对最终的数据库检索也会产生影响 Q:我的PMF的峰值较少,为什么?这些片段数量及峰值是否达到最基本的数据库检索的要求?影响检索的结果吗? A:因为我们用的是胰酶对蛋白质进行降解的,胰酶是一种专一较强的酶,只水解精氨酸、赖氨酸的C端,可能是你的样品的酶解的位点偏多或偏少,偏多酶解为小片段,峰值跟基质在一起难以分辨,偏少肽段的分子量偏大,胶内的样品滞留在胶内,在质谱图上体现不出来,溶液样品可以收集到,但是分子量越大检索的结果越不准确;理论上图谱的峰越多越好,要是都能匹配上那么蛋白的确定程度就更高,相反就越低;一般至少要拿到4个肽段。 Q:如何理解这些片段峰值大小意义,越高(纵坐标值大)越精确吗?以及这些酶解片段的数量及峰值一般应达到什么标准才算比较好?? A:片段峰横坐标的大小的意义是酶解下来的肽段的质量大小,纵坐标表示的收集的该肽段的相对的信号的强度,左边是相对的,右边是绝对的,绝对的越高,抗干扰的能力越好,质谱的精确度由仪器来决定的。我们的仪器的精确度在10ppm以内。 Q:图谱上肽段多于8条,为什么选这8条? A:至于提交检索的肽段的数量是根据肽段的信号强度来选取的,同时在软件处理的过程中会过滤一部分峰, 如胰酶的自解峰等; Q:数据库检索报告中m/zsubmitted,MH+matched两项是什么意思? A:m/z submitted 的意思是您提交给数据库的m/z值(因为质谱仪用m/z来分离样品的), MH+matched指的是与你提交数值相匹配数值,因为在样品在离子化过程中从基质中得到一个质子,所以它会加一个H Q:这两项的分子量和你们的图谱上相应分子量不一致。 A:因为在用图谱数据在数据库检索之前需要通过一个数据的校正和处理,所以图谱上的值与提交检索的值有区别图谱中的峰值是经过一个软件处理后的结果,主要是经同位素峰的合并图谱上的结果会不一至的,例如在你的图上读到的是1519.402,在看图的时候把它给放大处理(只有我这里的图谱处理的软件才能看到),就会发现存在1518.402、1520.402、1521.402、1522.402等相差1的质谱峰,这是由于在天然界中好多物质都存在同位素如O16、O17、O18等,所以在提交给数据库之前会用一个类似于碳水化合物的通式进行校正,所以图谱上读到的数可能会与提交的相差1,还在处理的过程的设置也会影响给出的峰值,但应该在0.1Da以内的;同时在还会进行胰酶自解峰的扣除和空白对照峰的扣除。
[color=#444444]想用质谱测定一个小分子的分子量,该物质在水、甲醇中不溶解,而在乙腈中溶解度不是太大。。。。想问一下像这种在溶剂中溶解性不太好的物质,测分子量时有没有影响???或者说质谱测定分子量时,对被测物在溶剂中的溶解度有没有要求?[/color]
[font=&][size=18px]先找到分子离子峰(一般为质荷比最大的质谱峰),再结合其同位素峰及碎片峰证和推断的经质量分开后,到被并记录下来,经处理后以质谱图的形式表示出来图中,表示离子的质荷比(m/z)值,从左到右质荷比的值增大,对于带有单电荷的离子,横坐标表示的数值即为离子的;表示离子流的,通常用来表示,即把最强的离子流强度定为100%,其它离子流的强度以其表示,有时也以所有被记录离子的总离子流强度作为100%,各种离子以其所占的百分数来表示化合物结构[/size][/font]
大家好,小女接触质谱时间不长,有些问题不太懂,还请大家指教。我现在在用标准品做二级质谱图,标准品纯度不是很高,做的过程中,遇到的问题是:遇到多电荷的物质时,我不知道如何判断哪一个离子峰才是我要找的分子离子峰(即母离子)(一级全扫图中有3个峰是我要找的可能的分子离子峰,分别称A,B,C吧),我用的是高分辨质谱,但是我用高分辨质谱算精确分子质量的时候,得到的理论值与一级全扫图中峰A的值会有0.5的差值,而另一个分子离子峰B与这一个离子峰A会有一个相同的碎片,不知道A是不是我要找的分子离子峰?如果不是,为什么呢?
21世纪的最前沿科学之一,随着人类第一张基因序列草图的完成和发展,生命科学的研究也将进入一个崭新的后基因组学,即蛋白质组学时代。正如基因草图的提前绘制得益于大规模全自动毛细管测序技术一样,后基因组研究也将会借助于现代生物质谱技术等得到迅猛发展。本文拟简述生物质谱技术及其在生命科学领域研究中的应用。1 质谱技术质谱( Mass SPectrometry)是带电原子、分子或分子碎片按质荷比(或质量)的大小顺序排列的图谱。质谱仪是一类能使物质粒子高化成离子并通过适当的电场、磁场将它们按空间位置、时间先后或者轨道稳定与否实现质荷比分离,并检测强度后进行物质分析的仪器。质谱仪主要由分析系统、电学系统和真空系统组成。质谱分析的基本原理用于分析的样品分子(或原子)在离子源中离化成具有不同质量的单电行分子离子和碎片离子,这些单电荷离子在加速电场中获得相同的动能并形成一束离子,进入由电场和磁场组成的分析器,离子束中速度较慢的离子通过电场后编转大,速度快的偏转小;在磁场中离子发生角速度矢量相反的偏转,即速度慢的离子依然偏转大,速度快的偏转小;当两个场的偏转作用彼此补偿时,它们的轨道便相交于一点。与此同时,在磁场中还能发生质量的分离,这样就使具有同一质荷比而速度不同的离子聚焦在同一点上,不同质荷比的离子聚焦在不同的点上,其焦面接近于平面,在此处用检测系统进行检测即可得到不同质荷比的谱线,即质谱。通过质谱分析,我们可以获得分析样品的分子量、分子式、分子中同位素构成和分子结构等多方面的信息。质谱技术的发展质谱的开发历史要追溯到20世纪初J.J.Thomson创制的抛物线质谱装置,1919年Aston制成了第一台速度聚焦型质谱仪,成为了质谱发展史上的里程碑。最初的质谱仪主要用来测定元素或同位素的原子量,随着离子光学理论的发展,质谱仪不断改进,其应用范围也在不断扩大,到20世纪50年代后期已广泛地应用于无机化合物和有机化合物的测定。现今,质谱分析的足迹已遍布各个学科的技术领域,在固体物理、冶金、电子、航天、原子能、地球和宇宙化学、生物化学及生命科学等领域均有着广阔的应用。质谱技术在生命科学领域的应用,更为质谱的发展注入了新的活力,形成了独特的生物质谱技术。 2 生物质谱技术电喷雾质谱技术和基质辅助激光解吸附质谱技术是诞生于80年代末期的两项轨电离技术。这两项技术的出现使传统的主要用于小分子物质研究的质谱技术发生了革命性的变革。它们具有高灵敏度和高质量检测范围,使得在pmol(10-12甚至fmol(10-15的水平上准确地分析分子量高达几万到几十万的生物大分子成为可能,从而使质谱技术真正走入了生命科学的研究领域,并得到迅速的发展。以下主要介绍与生物医学有关的几项质谱技术。电喷雾质谱技术电喷雾质谱技术(Electrospray Ionizsation MassSpectrometry,ESI-MS)是在毛细管的出口处施加一高电压,所产生的高电场使从毛细管流出的液体雾化成细小的带电液滴,随着溶剂蒸发,液滴表面的电荷强度逐渐增大,最后液滴崩解为大量带一个或多个电荷的离子,致使分析物以单电荷或多电荷离子的形式进入[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]。电喷雾离子化的特点是产生高电荷离子而不是碎片离子,使质量电荷比(m/z)降低到多数质量分析仪器都可以检测的范围,因而大大扩展了分子量的分析范围,离子的真实分子质量也可以根据质荷比及电行数算出。电喷雾质谱的优势就是它可以方便地与多种分离技术联合使用,如液一质联用([url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url])是将液相色谱与质谱联合而达到检测大分子物质的目的。基质辅助激光解吸附质谱技术基质辅助激光解吸附质谱技术(MatriX AssistedLaser Desorption /Ionization,MALDI)的基本原理是将分析物分散在基质分子中并形成晶体,当用激光照射晶体时,由于基质分子经辐射所吸收的能量,导致能量蓄积并迅速产热,从而使基质晶体升华,致使基质和分析物膨胀并进入[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]。MALDAI所产生的质谱图多为单电荷离子,因而质谱图中的离子与多肽和蛋白质的质量有—一对应关系。MALDI产生的离子常用飞行时间(Time-of-Flight,TOF)检测器来检测,理论上讲,只要飞行管的长度足够,TOF检测器可检测分子的质量数是没有上限的,因此MALDI-TOF质谱很适合对蛋白质、多肽、核酸和多糖等生物大分子的研究。快原子轰击质谱技术快原子轰击质谱技术是一种软电离技术,是用快速惰性原子射击存在于底物中的样品,使样品离子溅出进入分析器,这种软电离技术适于极性强、热不稳定的化合物的分析,特加适用于多肽和蛋白质等的分析研究。只能提供有关离子的精确质量,从而可以确定样品的元素组成和分子式。而FABMS-MS串联技术的应用可以提供样品较为详细的分子结构信息,从而使其在生物医学分析中迅速发展起来。同位素质谱是一种开发和应用比较早的技术,被广泛地应用于各个领域,但它在医学领域的应用只是近几年的事。由于某些病原菌具有分解特定化合物的能力,该化合物又易于用同位素标示,人们就想到用同位素质谱的方法检测其代谢物中同位素的含量以达到检测该病原菌的目的,同时也为同位素质谱在医学领域的应用开辟了一条思路。3 生物质谱技术的应用随着质谱技术的不断改进和完善,质谱的应用范围已扩展到生命科学研究的许多领域,特别是质谱在蛋白质、医学检测、药物成分分析及核酸等领域的应用,不仅为生命科学研究提供了新方法,同时也促进了质谱技术的发展。质谱与蛋白质分析蛋白质分子量的测定 蛋白质类生物大分子分子量的测定有着十分重要的意义,如对均一蛋白质一级结构的测定,既要测定蛋白质的分子量,又要测定亚基和寡聚体的分子量及水解、酶解碎片的分子量。常规的分子量测定主要有渗透压法、光散射法、超速高心法、凝胶层析及聚丙烯酸胺凝胶电泳等。这些方法存在样品消耗量大,精确度低易受蛋白质的形状影响等缺点。MALI-MS技术以其极高的灵敏度、精确度很快在生物医学领域得到了广泛的应用,特别是在蛋白质分析中的应用,至今已被分析的蛋白质已有数百种之多,不仅可测定各种亲水性、疏水性及糖蛋白等的分子量,还可直接用来测定蛋白质混合物的分子量,也能被用来测定经酶等降解后的混合物,以确定多肽的氨基酸序列。可以认为这是蛋白质分析领域的一项重大突破。蛋白质组研究 蛋白质组是指一个基因组、一个细胞或组织所表达的全部蛋白质成分。蛋白质组的研究是从整体水平上研究细胞或有机体内蛋白质的组成及其活动规律,包括细胞内所有蛋白质的分离、蛋白质表达模式的识别、蛋白质的鉴定、蛋白质翻译后修饰的分析及蛋白质组数据库的构建。质谱技术作为蛋白质组研究的三大支撑技术之一,除了用于多肽、蛋白质的质量测定外,还广泛地应用于肽指纹图谱测定以及氨基酸序列恻定等。肽指纹图谱( PePtide Mass Fingerprinting,PMF)测定是对蛋白酶解或降解后所得多肽混合物进行质谱分析的方法,对质谱分析所得肽片与多肽蛋白数据库中蛋白质的理论肽片进行比较,从而判别所测蛋白是已知还是未知。由于不同的蛋白质具有不同的氨基酸序列,因而不同蛋白质所得肽片具有指纹的特征。采用肽指纹谱的方法已对酵母、大肠杆菌、人心肌等多种蛋白质组进行了研究。对大肠杆菌经PVDF膜转印的蛋白质的研究表明,三个肽片即可达到对蛋白质的正确识别。而采用原位酶解的方法对酵母蛋白质组研究的结果显示,约90%的蛋白质被识别,其中三十多种新蛋白质被发现,而这些蛋白质是酵母基因组研究中未能识别的开放阅读框架。研究显示,肽指纹谱的方法比氨基酸组成分析更为可靠,这是因为MALDI测定肽质量的准确度为99.9%,而氨基酸组成分析的准确度仅为90%。另外MALDI可以耐受少量杂质的存在,对于纯度不是很高的样品也能得到理想的结果。对肽序列的测定往往要通过串联质谱技术才能达到分析目的,它采用不同的质谱技术选择具有特定质荷比的离子,并对其进行碰撞诱导解高,通过推断肽片的断裂,即可导出肽序列。质谱与核酸研究现代质谱技术自诞生以来在多肽及蛋白质的研究中获得了极大的成功,于是人们开始偿试着特质谱技术用于核酸的研究工作,近年来合成寡核苷酸及其类似物作为反义治疗剂在病毒感染和一些癌症的治疗方面有着良好的前景,寡核苷酸作为药物其结构特征必须进行确证。常规的色谱或电泳技术只能对其浓度和纯度进行分析,而对其碱基组成、序列等结构信息却无能为力。ESI和MALDI质谱技术的出现为寡核苷酸及其类似物的结构和序列分析提供了强有力的方法,它是将被测寡核苷酸样品先用外切酶从3’或5’端进行部分降解,在不同时间内分别取样进行质谱分析,获得寡核苷酸部分降解的分子离子峰信号,通过对相邻两个碎片分子质量进行比较,可以计算出被切割的核苷酸单体分子质量,将其与四个脱氧苷酸的标准分子量进行对照,就可以读出寡核苷酸的序列。由于MALDI技术分辨率的问题,使得其更适合于减基数较少的短链核酸的分析。如何获得高分辨率的DNA质谱图一