基因组(genome)包含的遗传信息经转录产生mRNA,一个细胞在特定生理或病理状态下表达的所有种类的mRNA称为转录子组(transcriptome)。很显然,不同细胞在不同生理或病理状态下转录子组包含的mRNA的种类不尽相同。mRNA经翻译产生蛋白质,一个细胞在特定生理或病理状态下表达的所有种类的蛋白质称为蛋白质组(proteome)。同理,不同细胞在不同生理或病理状态下所表达的蛋白质的种类也不尽相同。蛋白质是基因功能的实施者,因此对蛋白质结构,定位和蛋白质-蛋白质相互作用的研究将为阐明生命现象的本质提供直接的基础。生命科学是实验科学,因此生命科学的发展极大地依赖于实验技术的发展。以DNA序列分析技术为核心的基因组研究技术推动了基因组研究的日新月异,而以基因芯片技术为代表的基因表达研究技术为科学家了解基因表达规律立下汗马功劳。在蛋白质组研究中,二维电泳和质谱技术的黄金组合又为科学家掌握蛋白质表达规律再铸辉煌。蛋白质组学(proteomics)就是指研究蛋白质组的技术及这些研究得到的结果。蛋白质组学的研究试图比较细胞在不同生理或病理条件下蛋白质表达的异同,对相关蛋白质进行分类和鉴定。更重要的是蛋白质组学的研究要分析蛋白质间相互作用和蛋白质的功能。蛋白质组学的研究内容包括:1.蛋白质鉴定:可以利用一维电泳和二维电泳并结合Western等技术,利用蛋白质芯片和抗体芯片及免疫共沉淀等技术对蛋白质进行鉴定研究。2.翻译后修饰:很多mRNA表达产生的蛋白质要经历翻译后修饰如磷酸化,糖基化,酶原激活等。翻译后修饰是蛋白质调节功能的重要方式,因此对蛋白质翻译后修饰的研究对阐明蛋白质的功能具有重要作用。3.蛋白质功能确定:如分析酶活性和确定酶底物,细胞因子的生物分析/配基-受体结合分析。可以利用基因敲除和反义技术分析基因表达产物-蛋白质的功能。另外对蛋白质表达出来后在细胞内的定位研究也在一定程度上有助于蛋白质功能的了解。Clontech的荧光蛋白表达系统就是研究蛋白质在细胞内定位的一个很好的工具。4.对人类而言,蛋白质组学的研究最终要服务于人类的健康,主要指促进分子医学的发展。如寻找药物的靶分子。很多药物本身就是蛋白质,而很多药物的靶分子也是蛋白质。药物也可以干预蛋白质-蛋白质相互作用。在基础医学和疾病机理研究中,了解人不同发育、生长期和不同生理、病理条件下及不同细胞类型的基因表达的特点具有特别重要的意义。这些研究可能找到直接与特定生理或病理状态相关的分子,进一步为设计作用于特定靶分子的药物奠定基础。不同发育、生长期和不同生理、病理条件下不同的细胞类型的基因表达是不一致的,因此对蛋白质表达的研究应该精确到细胞甚至亚细胞水平。可以利用免疫组织化学技术达到这个目的,但该技术的致命缺点是通量低。LCM技术可以精确地从组织切片中取出研究者感兴趣的细胞类型,因此LCM技术实际上是一种原位技术。取出的细胞用于蛋白质样品的制备,结合抗体芯片或二维电泳-质谱的技术路线,可以对蛋白质的表达进行原位的高通量的研究。很多研究采用匀浆组织制备蛋白质样品的技术路线,其研究结论值得怀疑,因为组织匀浆后不同细胞类型的蛋白质混杂在一起,最后得到的研究数据根本无法解释蛋白质在每类细胞中的表达情况。虽然培养细胞可以得到单一类型细胞,但体外培养的细胞很难模拟体内细胞的环境,因此这样研究得出的结论也很难用于解释在体实际情况。因此在研究中首先应该将不同细胞类型分离,分离出来的不同类型细胞可以用于基因表达研究,包括mRNA和蛋白质的表达。LCM技术获得的细胞可以用于蛋白质样品的制备。可以根据需要制备总蛋白,或膜蛋白,或核蛋白等,也可以富集糖蛋白,或通过去除白蛋白来减少蛋白质类型的复杂程度。相关试剂盒均有厂商提供。蛋白质样品中的不同类型的蛋白质可以通过二维电泳进行分离。二维电泳可以将不同种类的蛋白质按照等电点和分子量差异进行高分辨率的分离。成功的二维电泳可以将2000到3000种蛋白质进行分离。电泳后对胶进行高灵敏度的染色如银染和荧光染色。如果是比较两种样品之间蛋白质表达的异同,可以在同样条件下分别制备二者的蛋白质样品,然后在同样条件下进行二维电泳,染色后比较两块胶。也可以将二者的蛋白质样品分别用不同的荧光染料标记,然后两种蛋白质样品在一块胶上进行二维电泳的分离,最后通过荧光扫描技术分析结果。胶染色后可以利用凝胶图象分析系统成像,然后通过分析软件对蛋白质点进行定量分析,并且对感兴趣的蛋白质点进行定位。通过专门的蛋白质点切割系统,可以将蛋白质点所在的胶区域进行精确切割。接着对胶中蛋白质进行酶切消化,酶切后的消化物经脱盐/浓缩处理后就可以通过点样系统将蛋白质点样到特定的材料的表面(MALDI-TOF)。最后这些蛋白质就可以在质谱系统中进行分析,从而得到蛋白质的定性数据;这些数据可以用于构建数据库或和已有的数据库进行比较分析。实际上像人类的血浆,尿液,脑脊液,乳腺,心脏,膀胱癌和磷状细胞癌及多种病原微生物的蛋白质样品的二维电泳数据库已经建立起来,研究者可以登录www.expasy.ch/www/tools.html等网站进行查询,并和自己的同类研究进行对比分析。Genomic Solution可以为研究者提供除质谱外的所有蛋白质组学研究工具,包括二维电泳系统,成像系统及分析软件,胶切割系统,蛋白质消化浓缩工作站,点样工作站等;同时还可以提供相关试剂和消耗品。LCM-二维电泳-质谱的技术路线是典型的一条蛋白质组学研究的技术路线,除此以外,LCM-抗体芯片也是一条重要的蛋白质组学研究的技术路线。即通过LCM技术获得感兴趣的细胞类型,制备细胞蛋白质样品,蛋白质经荧光染料标记后和抗体芯片杂交,从而可以比较两种样品蛋白质表达的异同。Clontech最近开发了一张抗体芯片,可以对378种膜蛋白和胞浆蛋白进行分析。该芯片同时配合了抗体芯片的全部操作过程的重要试剂,包括蛋白质制备试剂,蛋白质的荧光染料标记试剂,标记体系的纯化试剂,杂交试剂等。对于蛋白质相互作用的研究,酵母双杂交和噬菌体展示技术无疑是很好的研究方法。Clontech开发的酵母双杂交系统和NEB公司开发的噬菌体展示技术可供研究者选用。关于蛋白质组的研究,也可以将蛋白质组的部分或全部种类的蛋白质制作成蛋白质芯片,这样的蛋白质芯片可以用于蛋白质相互作用研究,蛋白表达研究和小分子蛋白结合研究。Science,Vol.293,Issue 5537,2101-2105,September 14,2001发表了一篇关于酵母蛋白质组芯片的论文。该文主要研究内容为:将酵母的5800个ORF表达成蛋白质并进行纯化点样制作芯片,然后用该芯片筛选钙调素和磷脂分子的相互作用分子。最后有必要指出的是,传统的蛋白质研究注重研究单一蛋白质,而蛋白质组学注重研究参与特定生理或病理状态的所有的蛋白质种类及其与周围环境(分子)的关系。因此蛋白质组学的研究通常是高通量的。适应这个要求,蛋白质组学相关研究工具通常都是高度自动化的系统,通量高而速度快,配合相应分析软件和数据库,研究者可以在最短的时间内处理最多的数据。
蛋白质化学与蛋白质组学夏其昌 曾嵘 等编著2004年4月出版ISBN 7-03-012401-4/Q.133116开,平装,580页定价: 75.00元 本书系统论述了蛋白质化学基础理论和实验技巧,也反映了蛋白质组学研究的最新成果。内容包括:蛋白质的表征,蛋白质的组成分析和序列测定,与此相关的实验方法,包括各种色谱、电泳、质谱技术等,以及应用在蛋白质表征研究和基因工程产品的质检方面的实际范例。在蛋白质组学领域介绍了基本概念、样品制备、双向凝胶电泳的图像分析和定量分析、质谱等常规方法,并介绍了国际上最新的多维技术在研究中的应用;同时充分体现了生物信息学在蛋白质组研究中的重要性。 本书可作为生物学、医学、化学专业大学生,研究生和教学人员的参考书,也是从事生物化学、分子生物学、医学等领域中分离分析工作人员的参考书。
质谱与蛋白质组学蛋白质组学对一个细胞或组织所表达的蛋白质进行的系统分析,而质谱是它的关键性分析工具。在过去的两年中,标准蛋白质组技术中的进展增进了更高水平自动化和敏感性的蛋白质识别技术。另外,新的技术促成了鉴定蛋白质功能相关特性的里程碑性的进展,包括它们的定量和在蛋白质复合物中复杂情况。缩写2DE two-dimensional gel electrophoresis双向凝胶电泳CID collision-induced dissociation碰撞诱导的解离ESI electrospray ionization电喷雾离子化FT-ICR Fourier-transform ion cyclotron resonance傅里叶-变换离子回旋加速器共振ICAT isotope-coded affinity tagsIEF isoelectric focusing等电聚焦MALDI matrix-assisted laser desorption ionization基质辅助的激光解析离子化Q-TOF quadrupole-TOFRP reversed phase反向TOF time-of-flight飞行时间简介蛋白质组学的核心组成是系统识别一个细胞或组织中表达的每一个蛋白质,以及确定每个蛋白质的突出特征(比如,丰度、修饰状态以及在多蛋白质复合体中的复杂状态)。这些分析的技术包括分离蛋白质和肽的分离科学、识别和定量分析物的分析科学和数据管理和分析的生物信息学。它的初步工具包括使用IEF(等电点聚焦)/SDS-PAGE凝胶的高分辨率的双向凝胶电泳(2DE),结合质谱和数据库搜索来分离、识别和定量在一个复合样本中存在的个体蛋白质,最终识别被分离的蛋白质。一个常用的方法用在Fig1中用图解说明。此技术以及由此而来的变化(综述见[1])已经被用来识别和分类在复杂样本中存在的大量蛋白质,并在蛋白质组数据库中呈现它们,该过程我们这里称之为"描述蛋白质组学"比如,Shevchenko等[2]从2D凝胶上系统地鉴定了150个蛋白质。数目庞大的这样的数据库现在可以找到。同样的技术现在已经被作为普遍的发现工具来动态检测一个细胞或组织对外来或内部干扰反应而在蛋白质组中的改变。因为检测动态改变需要精确定量每个被检测成分,我们使用"定量蛋白质组学"来定义。在此报告中,我们总结了自1999年1月至2000年4月来报道的与蛋白质组学和质谱相关的最重要的进展。在核心质谱技术中的进展已经导致2DE为基础的蛋白质组学技术的进一步改进。它们同时又促进了传统凝胶为基础的方法的替代方法,诸如引入以同位素稀释理论为基础的精确蛋白质定量技术和蛋白质复合物的系统分析。蛋白质组分析的MS技术进展在此部分,我们总结了在MS设备、它们的控制和操作中的进展,以及比较质谱数据和序列数据库识别蛋白质所用的搜索工具的进展。随着新型质谱仪的引入,蛋白质组学研究现存类型的质谱仪性能已经显著改进了。在此综述期间最普遍使用的仪器是可以分为两类:单一阶段的质谱仪和串联质谱为基础的系统。单一阶段的质谱仪,最显著的是基质辅助的激光解吸电离(MALDI)飞行时间(TOF)仪器,被用于无数通过肽质谱图谱技术大规模蛋白质识别的项目中。此方法在鉴别表达自小一些的和完全测序的基因组的蛋白质特别成功[3,4]。串联质谱仪器诸如triple quadrpole、离子捕获(ion-trap)和近来引进的混合quadrupole飞行时间(Q-TOF)被常规应用于[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS或用电喷雾电离(ESI)来生成肽片段离子谱,以便通过搜寻序列数据库进行蛋白质鉴定。使用仪器控制程序来自动选择肽离子进行碰撞诱导的解离(CID)(数据依赖CID)的不断增多是这些MS/MS仪器的一个明显的趋势。一些新的构造的具有高潜能的质谱仪被引入到蛋白质组学研究中产生深刻影响。两个研究组近来一个MALDI离子源和一个混合Q-TOF耦联了起来[5,6]。Q-TOF提供的质量准确性和敏感性提升了数据库搜寻结果并同时使它成为MS/MS从头测序的当然仪器选择。MALDI Q-TOF构造提供了激动人心的机会进行自动化和高通量应用以及在一个样品盘上存档样品进行日后研究的可能。Medzihradszky等[7]描述了一个不同的混合仪器称之为MALDI TOF TOF。此设备享有许多MALDI Q-TOF的优点,另外能够进行高能量CID和非常快速的扫描速率。傅里叶-变换离子回旋加速器共振(FT-ICR)质谱对于蛋白质组学来说相对陌生。这些设备具有非常高的敏感性和分辨率,质量精确性可以达到1ppm。这些特征被用来在一次分析中测量和定量几百种蛋白质的完整的分子质量[8]。Goodlett等[9]表明FT-MS测量的一个肽的准确质量以及可以容易获得的限制因素能够通过序列数据库搜索被用来识别蛋白质。蛋白质组学如果没有软件工具来进行质谱数据和序列数据库的关联将变得几无可能。现存的数据库搜索程序已经变得越来越成熟和可以(从网络)可获得。另外,引入了新的算法。主要相关程序是Sequest[10],MASCOT[11],PeptedeSearch[12],PROWL[13]和Protein Prospector[14]。在它们中间,Sequest使用CID谱设置了蛋白质识别的实验室标准(benchmark),因为它与边界MS/MS数据工作得最好,并高度可信,可以从整个[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS实验中自动分析数据,并不需要任何使用者的破译工作。在所提的程序中,然而,只有Sequest不能在网络上搜索。MASCOT是一个新的、快速、网络可进入和多功能的程序,具有进行肽指纹分析、用部分破译或未破译的CID谱进行数据库搜索的功能。
人类基因组计划的顺利实施,使生命科学研究的重心正逐渐转到生物功能的整体研究。基因组学由于自身的局限性,它不能回答诸如:蛋白质的表达水平和表达时间,翻译后修饰以及蛋白质与蛋白质或与其他生物分子的相互作用等问题。作为基因研究的重要补充,蛋白质组学在蛋白质的水平上定量的、动态的、整体的研究生物体。蛋白质组(Proteome)概念是最早是由澳大利亚学者Wilkins和Williams于1994年提出的,即基因所能表达的全部蛋白质,更为清楚的表达是细胞或组织或机体在特定时间和空间上表达的所有蛋白质。具体说它是对不同时间和空间上发挥功能的特定的蛋白质组群进行研究,进而在蛋白质的水平上探索其作模式、功能机理、调节调控以及蛋白质组群内的相互作用,从而为临床诊断、病理研究、药物筛选、新药开发、新陈代谢途径研究等提供理论依据和基础。 详情请见:[url=http://www.instrument.com.cn/hot/HA_56.htm]热点应用:蛋白质组学研究[/url]
人类基因组计划的顺利实施,使生命科学研究的重心正逐渐转到生物功能的整体研究。基因组学由于自身的局限性,它不能回答诸如:蛋白质的表达水平和表达时间,翻译后修饰以及蛋白质与蛋白质或与其他生物分子的相互作用等问题。作为基因研究的重要补充,蛋白质组学在蛋白质的水平上定量的、动态的、整体的研究生物体。蛋白质组(Proteome)概念是最早是由澳大利亚学者Wilkins和Williams于1994年提出的,即基因所能表达的全部蛋白质,更为清楚的表达是细胞或组织或机体在特定时间和空间上表达的所有蛋白质。具体说它是对不同时间和空间上发挥功能的特定的蛋白质组群进行研究,进而在蛋白质的水平上探索其作模式、功能机理、调节调控以及蛋白质组群内的相互作用,从而为临床诊断、病理研究、药物筛选、新药开发、新陈代谢途径研究等提供理论依据和基础。 详情请见:[url=http://www.instrument.com.cn/hot/HA_56.htm]热点应用:蛋白质组学研究[/url]
[font=宋体][font=宋体]泛素化是一种细胞内的蛋白质标记系统,蛋白质泛素化是指将小的蛋白质泛素共价地连接到其他蛋白质分子上的过程。泛素([/font][font=Calibri]ubiquitin[/font][font=宋体])是一种高度保守的蛋白质,其结构由[/font][font=Calibri]76[/font][font=宋体]个氨基酸残基组成。泛素连接到目标蛋白质上的过程,经历了泛素激活、泛素转移和靶蛋白接受三个主要步骤。[/font][/font][font=宋体] [/font][font=宋体]蛋白质泛素化具有多种特点,例如它是高度选择性的,不同蛋白质泛素化的位置和数量可以影响其功能;它是可逆的,通过去泛素化反应可以调控蛋白质的泛素化状态;它还是动态调控的,受到多种因素的调控,如细胞信号通路和环境刺激。[/font][b][font=宋体]泛素化蛋白大小:[/font][/b][font=宋体] [/font][font=宋体][font=宋体]蛋白泛素化是指将小蛋白颗粒泛素([/font][font=Calibri]Ubiquitin[/font][font=宋体])与其他蛋白质共价结合的修饰过程。 泛素化修饰通常会导致泛素共价连接在蛋白质的赖氨酸残基上形成多重泛素链。 这种蛋白质泛素化增加了蛋白质的分子量,因为每个泛素分子的质量大约为[/font][b][font=Calibri]8.5[/font][font=宋体]千达尔顿([/font][font=Calibri]kDa[/font][/b][font=宋体][b])[/b]。[/font][/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体]泛素化蛋白质组学在许多领域有重要的应用,主要包括:[/font][/b][font=宋体] [/font][font=宋体]①疾病机制研究:泛素化是一种广泛存在于细胞中的蛋白质修饰方式,参与了细胞的生长、分化、修复和调控等多个生命活动。泛素化蛋白质组学的研究可以帮助我们了解泛素化修饰的生物学功能和调控机制,为疾病发生机制和治疗策略的研究提供重要线索。例如,在癌症、代谢综合征、神经退行性疾病等疾病中,则会出现异常泛素化。[/font][font=宋体]②药物研发:通过分析药物对泛素化蛋白质的影响,可以评估药物的效力和选择性,为药物研发提供指导。[/font][font=宋体]③临床诊断:泛素化蛋白质组学鉴定与定量分析技术可以揭示细胞调控的机制,通过分析泛素化蛋白质的组学数据,可以确定泛素化修饰在细胞信号转导、蛋白质降解和细胞周期调控等过程中的重要作用。此外,通过比较病态和正常样品中泛素化蛋白质的差异,可以鉴定与疾病发生发展相关的泛素化修饰靶点,并进一步理解疾病的分子机制。因此,这些技术也可用于临床诊断。[/font][font=宋体]④蛋白质降解调控:在癌症、神经退行性疾病和免疫相关疾病等病症中,蛋白质降解调控出现异常。而泛素化蛋白组在调控蛋白质降解中发挥重要作用。通过与泛素连接,目标蛋白质被送入蛋白酶体或蛋白酶体样体中进行降解。这个过程是细胞清除异常、老化或受损蛋白质的重要途径。[/font][font=宋体]⑤高通量技术应用:高通量泛素化蛋白质组学鉴定与定量分析技术的发展包括质谱鉴定和抗体鉴定两种方法。质谱鉴定技术利用质谱仪的高灵敏度和分辨率,能够鉴定泛素化修饰的蛋白质及其泛素化位点。抗体鉴定技术则通过特异性抗体的使用,可以富集和鉴定泛素化修饰的蛋白质。这些技术为全面了解泛素化在细胞中的作用机制和调控网络提供了可能。[/font][font=宋体]总的来说,泛素化蛋白质组学在多个领域都有重要的应用价值,推动了我们对生命过程的深入理解以及疾病治疗的创新发展。[/font][font=宋体] [/font][font=宋体]更多详情关于[url=https://cn.sinobiological.com/resource/protein-review][b]蛋白资源[/b][/url]详情可以参看:[/font][url=https://cn.sinobiological.com/resource/protein-review][u][font=宋体][color=#0000ff][font=Calibri]https://cn.sinobiological.com/resource/protein-review[/font][/color][/font][/u][/url][b][font=宋体] [/font][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
请问各位大佬,我看好多好多关于蛋白质组学质谱的文献,里面做到了SDS-PAGE,这个实验除了能分离出自己的目的条带,还有其他用处么?我想知道用胰蛋白酶把蛋白酶切成多肽,怎么判断他是过切还是漏切呢,
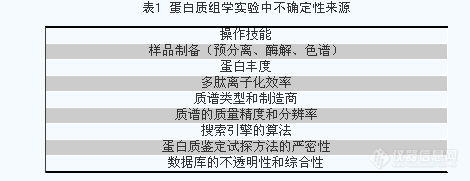
蛋白质组学研究的一般工具与方法随着人类基因组计划取得巨大的成功和许多物种基因组测序的完成,仅仅靠基因组的序列来试图阐明生命现象是远远不够的,因此,研究重心已经开始从揭示生命的所有遗传信息转移到在分子整体水平对功能的研究上,生命科学已实质性地跨入了后基因组时代。 尽管现在已经有多个物种的基因组被测序,但这些基因组中通常有一半以上基因的功能是未知的。目前功能基因组研究中所采用的策略,如微阵列法(microarray)(Wodicka et al., 1997)、基因芯片(gene chips)(Ramsay et al., 1998)、基因表达序列分析(SAGE)(Velculescu et al., 1995)等,都是从细胞中mRNA的角度来考虑的。但事实上,从DNA、mRNA到蛋白质存在三个层次的调控,mRNA自身也存在着贮存、转运和降解等问题,从mRNA角度考虑,实际上仅包括了转录水平调控,并不能全面代表蛋白质表达水平。实验也证明,组织中mRNA丰度与蛋白质丰度的相关性并不好,尤其对于低丰度蛋白质来说,相关性更差。蛋白质复杂的翻译后修饰,蛋白质的亚细胞定位或迁移,蛋白质-蛋白质相互作用则几乎无法从mRNA水平来判断(曾嵘,夏其昌,2002)。新生肽链合成后存在多种加工、修饰过程,蛋白质间也存在类似于mRNA分子内的剪切、拼接,研究证明基本元件“intein”广泛存在于蛋白质中(Perler et al., 1997)。基因与其编码产物蛋白的线性对应关系只存在于新生肽链而不是最终的功能蛋白质中。 蛋白质是生理功能的执行者和生命现象的直接体现者,对蛋白质结构和功能的研究将直接阐明生命在生理或病理条件下的变化机制;蛋白质本身的存在形式和活动规律,如翻译后修饰、蛋白质间相互作用及蛋白质构象等问题,仍依赖于直接对蛋白质的研究来解决。因此要对生命的复杂活动有全面和深入的认识,必然要在整体、动态、网络的水平上对蛋白质进行研究(钱小红,贺福初,2003)。 蛋白质组学研究中常用的技术体系 方法学上,二维凝胶电泳-质谱仍然是目前最流行和可靠的技术平台(Rabilloud et al., 2000)。其一般过程是:细胞或组织样品——样品制备——二维凝胶电泳(2D-PAGE)分离蛋白质——计算机辅助分析2D-PAGE图象——对感兴趣的蛋白质进行酶解——质谱分析——数据库检索——蛋白质鉴定——分析蛋白质在细胞与组织中的表达情况。 2-D PAGE 样品制备 2D-PAGE 的操作流程基本上实现了程序化。但是,样品制备是一个非常关键与复杂的过程。成功的2D-PAGE取决于对样品中蛋白质有效的抽提和它的溶解性。与核酸不同,目前没有一种通用的方法适用于所有的蛋白质,来源不同的蛋白质都受到自身蛋白质制备方法的挑战。 正确的样品制备方法从收集样品开始时就要防止样品的裂解和被蛋白水解酶降解(Rabilloud et al., 2000)。要尽可能溶解更多的蛋白,并且在2D-PAGE过程中保持它的溶解性,阻止蛋白质的人为修饰。在样品制备过程中,各个实验室也通过实验建立了更为可行的方法。目前通过建立分步提取方法可以有效地提取出更多的蛋白质(兰彦等,2001)。另一种对蛋白质采用预分离的方法称为“多间隔电解法(multi-compartment-electrolyser)”,采用这种方法后,分辨率和胶的质量均明显改善(Herbert et al., 2000)。 但是,由于生物样品的多样性和复杂性,目前所采用的样品制备方法具有局限性。其它物质对蛋白质样品制备存在干扰。核酸通过与蛋白质结合,增加样品黏度而干扰等点聚焦(IEF)分离的效果。当然,通过实验探索,采取一些措施可以减轻它的干扰。例如,在样品制备过程中加入非特异性的核酸酶或RNase与DNase的混合物,在等电聚焦时将每个胶条的电流限制在50mA以内通常可以消除其影响。脂类物质的影响可以通过利用有机溶剂的方法将其去除,但是这常常会导致蛋白质的不可逆沉淀。除了蛋白质的降解之外,糖基化是蛋白质的最重要的人工修饰,样品中的尿素在这一过程中起着非常重要的作用。样品中的尿素在降解的过程中会形成能够与蛋白质的氨基反应的氰酸盐,这种结果会导致蛋白质带有更多的正电荷。所以,在2D-PAGE中要用新鲜的尿素溶液,在等电聚焦过程中要控制温度不能太高(Beranova-Giorgianni, 2003)。但是,目前还没有一种简单有效的方法来去除样品中的多糖。 样品分离和分析 样品制备完成后运用IEF和SDS-PAGE电泳对它进行分离,常采用银染和考马斯亮兰染色即可观察到具有许多蛋白质斑点的凝胶图像。等电聚焦电泳与SDS-PAGE的具体操作步骤已经实现了程序化,均有详细操作流程参考,但是由于样品的不同,不同样品的具体条件还需要试验探索。第二相SDS-PAGE运行结束,染色完毕后,利用计算机软件对凝胶图像进行分析,如PD-QUEST软件,LIPS,HERMES,GEMINI等,对凝胶图像上的蛋白质斑点进行匹配,对图像进行数字化处理等分析(贾宇峰等,2001),对感兴趣的蛋白质采用质谱分析。 低丰度蛋白质的检测 低丰度蛋白在蛋白质组学研究中常常是人们非常感兴趣的,因为细胞或组织中的一些生物活性物质,如细胞分泌的一些活性物质,受体等表达量都非常低。按照一般电泳的上样量,这些小分子是根本看不到的,但如果单纯地增加上样量,细胞或组织中的大量表达的蛋白就会将其覆盖,而且上样量过大也会影响电泳结果。所以对这些低丰度的样品可以进行富集,富集的方法可以通过层析,如亲和层析,离子交换层析等方法,还可以通过利用样品等电点性质等方法将pH范围相近的蛋白质富集(Santoni et al., 2000; Beranova-Giorgianni, 2003)。
书名:蛋白质化学与蛋白质组学作 者:莫结胜 杨兆弘 谢灵玲出 版 社:科学出版社出版日期:2005-04ISBN:703012401版 次:1包 装:平装开 本:16开页 数:13,559页字 数:828千
实验室准备转做蛋白质组学,哪种质谱仪最好?价格大概在100万左右的哪个公司的质谱仪最适合做蛋白质组学?有推荐的请联系我,QQ:332677682,注明质谱仪。
http://img3.17img.cn/bbs/upfile/images/20100518/201005181701392921.gifiCMS2014 质谱网络会议——蛋白质组学/代谢组学专场会议时间:2014年11月20日 09:30—17:00【简介】 仪器信息网将于2014年11月18-21日举办"第五届质谱网络会议(iConference on Mass Spectrometry,iCMS2014)",本届会议将与中国化学会质谱分析专业委员会合作举办,旨在通过网络会议平台给国内质谱科学家提供一个全新的沟通交流平台,提高质谱科学研究和应用水平。 本届网络会议为期四天,将开设质谱新技术专场、地质能源专场、药物分析专场(上)、药物分析专场(下)、蛋白质组学/代谢组学专场(上)、蛋白质组学/代谢组学专场(下)、环境专场、食品专场共8个主题,每个主题为1个分会场,时长为半天或一天,大会将提醒近30名著名质谱专家就不同的主题做精彩的报告并同期与大家进行交流。成功报名并准时参会的用户均可获得一份iCMS历届会议的精选光盘(2张),并有机会获赠100元手机充值卡和Kindle Paperwhite电子书阅读器(4GB)。 iCMS2014—蛋白质组学/代谢组学专场(上)1)蛋白质泛素化的定量蛋白质组学研究——李衍常 博士 北京蛋白质组研究中心2)Protein complex research approach based on protein immunoprecipitation in coupling with mass spectroemtry (基于蛋白免疫沉淀-质谱分析的蛋白质复合物研究) ——胡克平 教授 中国医学科学院药用植物研究所报名地址:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/1078 iCMS2014—蛋白质组学/代谢组学专场(下)1)细胞间信号传导的蛋白质组学方法探究——田瑞军 南方科技大学化学系2)Ion Mobility Derived Collision Cross Sections to Support Metabolomics and Lipidomics——Giuseppe Astarita Georgetown University Washington D.C. U.S.A.3)基于GC/Tof的代谢组学技术在基础及临床医学研究中的应用——王晓艳 上海交通大学系统生物医学研究院报名地址:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/1079-------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名参加。2、报名及参会咨询:QQ群—231246773
褚福亮,王福生, 中国人民解放军第302医院全军艾滋病与病毒性肝炎重点实验室 北京市 100039项目负责人 王福生, 100039 ,北京市丰台路26号, 中国人民解放军第302医院全军艾滋病与病毒性肝炎重点实验室. fswang@public.bta.net.cn电话:010-66933332 传真:010-63831870收稿日期 2002-08-15 接受日期 2002-09-03摘要新近广泛应用蛋白质芯片(ProteinChipâ Array)系统成功鉴定出了一些重要疾病(如肿瘤和危害性较大的传染病)新的、特异性的生物标记(biomarkers),后者不仅在生物医学的基础方面具有重要的科学价值,而且在临床疾病的诊断、治疗和预防发挥重要的指导作用,显示了良好的发展前景.本文就表面增强的激光解析电离-飞行时间-质谱(SELDI-TOF-MS)相关的原理、特点、在临床和基础研究中的应用新进展和未来的发展趋势做一综述.此外,我们就蛋白质谱分析技术在病毒性肝炎、肝硬化和肝癌等一系列肝病方面的应用策略和前景进行了分析.褚福亮,王福生. 蛋白质谱分析方法特点及其在蛋白组学研究领域中的应用.世界华人消化杂志 2002 10(12):1431-14350 引言人类基因组计划已经进入后基因组时代-即功能基因组时代[1],作为基因功能的直接体现者-蛋白质,及其之间的相互作用越来越引起基础和临床科学家们的关注[2-6] .因为要彻底了解生命的本质,只把基因测出来还是不够的,还必须要了解其在生物生长、发育、衰老和整个生命过程中的功能、不同蛋白质之间的相互作用以及他们与疾病发生、发展和转化的规律[7-14] .正因为如此,有关上述问题的蛋白质组学研究成了今天生命科学最重要的焦点之一[15] .为了阐明蛋白质在上述生命现象中的作用和相关机制,人们设计了许多新的方法技术,如:二维电泳、质谱分析、微距阵列、酵母双杂交和噬菌体展示等,这些方法在一些特定的情况下,虽然显示出了他们各自不同的优点,但是同样也存在着较大的局限性,难以开展大规模、超微量、高通量、全自动筛选蛋白质等方面的分析,因而设计更全面、同时研究多种蛋白质相互作用的技术,在功能基因组和蛋白组学的研究中建立一个更有效的技术平台,成为本领域中优先关注的问题[16] .近来,美国Ciphergen(赛弗吉)公司研制的ProteinChipâ Array的仪器,并建立了一种新的蛋白质飞行质谱-表面增强的激光解析离子化-飞行时间-质谱(surface-enhanced laser desorption/inionation-time of flight-mass spectra, SELDI-TOF-MS),已取得可喜的进展,筛选出了许多与疾病相关的新型生物标志,不仅为临床疾病的诊断和治疗等提供了新的选择,而且在基础科学、新药研制和疾病预防等方面具有广泛的应用前景[16-18] .本文就SELDI-TOF-MS相关的原理、特点、在临床和基础研究中的应用新进展和未来的发展趋势做一综述.1 ProteinChipâ Array系统和SELDI-TOF-MS的特点1.1 蛋白质芯片系统的组成和原理 蛋白质芯片系统由三部分组成:蛋白质芯片、芯片阅读器和芯片软件.供研究用芯片上有6-10芯池,不同的芯片表面上的化学物质不同,芯片表面分为两大类:一类为化学类表面,包括经典的色谱分析表面,如:结合普通蛋白质的正相表面,用于反相捕获的疏水表面,阴阳离子交换表面和捕获金属结合蛋白的静态金属亲合捕获表面;另一类称为生物类,特定的蛋白质共价结合于预先活化的表面阵列,可以用来研究传统的抗体一抗原反应,DNA和蛋白质作用,受体、配体作用和其他的一些分子之间的相互作用[19] . 根据检测目的不同,可以选用不同的芯片,或者自己设计芯片.将样本和对照点到芯池上以后,经过一段时间的结合反应,用缓冲液或水洗去一些不结合的非特异分子,再加上能量吸收分子(energy absorbing molelule,EAM)溶液,使样本固定在芯片表面.当溶液干燥后,一个含有分析物和大量能量吸收分子“晶体”就形成了.能量吸收分子对于电离来说非常重要.经过以上步骤,就可经把芯片放到芯片阅读器中进行质谱分析. 在阅读器的固定激光束下,芯片上、下移动,使样本上每一个特定点都被“读”到.激光束的每一次闪光释放的能量都聚集在该区一个非常小的点上(focused laser beam,聚焦激光束).这样,每个区都含有丰富的,可寻址(addressable)的位置.蛋白质芯片处理软件精确控制激光寻读过程.当样本受到激发,就开始电离和解除吸附.不同质量的带电离子在电场中飞行的时间长短不同,计算检测到的不同时间,就可以得出质量电荷比,把他输入电脑,形成图像[19].Ball et al [20]采用一种称为人工神经网络(artifical neural network,ANN)的算法处理出现的成千上万的峰,鉴定出三个分子量为13 454、13 457和14 278的生物标记分子,使疾病预测率达到97.1 %.1.2 ProteinChipâ Array芯片和SELDI-TOF-MS的特点 新型蛋白芯片与以往的蛋白芯片不同之处:SELDI-TOF-MS,他是在MALDI(matrix-assisted laser desorption/inionation)[21,22]基础上,改进后实行表面增强的飞行质谱.SELDI-TOF-MS优于MALDI-TOF表现为他不会破坏蛋白质,或使样本与可溶的基质共结晶来产生质谱信号.对SELDI-TOF来说,可以直接将血清、尿液、组织抽取物等不需处理直接点样检测[40] 由于一部分非特异结合的分析物被洗去,因而出现的质峰非常一致,有利于后期分析[23,24] . 与二维电泳相比:二维电泳分析蛋白质的分子量在30 KDa以上时电泳图谱较清楚,对在组织抽提物中占很大比例的低丰度的蛋白质不能被检出;其次,二维电泳胶上的蛋白质斑点很大一部分包含一种以上的蛋白质;而且,二维电泳耗时长,工作量大,对象染色转移等技术要求高,不能完全实现自动化.而SELDI-TOF在200 Da-500 KDa区间都可以给出很好的质谱,对一个样本的分析在几十分钟内就可以完成[19],处理的信息量远远大于二维电泳;对于低丰度物质,即使浓度仅attomole(10-18)的分子,只要与表面探针结合,就可以检测到,这也是二维电泳所不具备的[24,25] . 对于微距阵蛋白芯片来说,需要一种不破坏折叠的蛋白质构象的固定技术,再与另外的蛋白质反应,经检测莹光来观察蛋白质之间的作用[26] .而基于SELDI-TOF-MS的ProteinChip分析蛋白质不需溶解、不需染色、廉价、针对性强. 因而蛋白质芯片仪具有以下优势:(1)可直接使用粗样本,如:血清、尿液、细胞抽提物等[27] .(2)使大规模、超微量、高通量、全自动筛选蛋白质成为可能;(3)他不仅可发现一种蛋白质或生物标记分子,而且还可以发现不同的多种方式的组合蛋白质谱,可能与某种疾病有关[28] (4)推动基因组学发展,验证基因组学方面的变化,基于蛋白质特点发现新的基因.可以推测疾病状态下,基因启动何以与正常状态下不同,受到那些因素的影响,从而跟踪基因的变化[2,14,15] . 其存在的问题:对于不同的样本,根据检测的目标采取或者设计几种芯片,理论上可以把所有的相同性质蛋白质捕获,但是实际上仍有少量的分子没与表面探针结合.使用SELDI-TOF-MS,仅能给出蛋白质的分子量,不能给出C端、N端的序列,也没法知道蛋白质的构型,因此需要将蛋白质充分纯化后,用蛋白酶消化芯片上的蛋白质,分析肽段,再用生物信息学方法鉴定蛋白质序列[18,24] .另外,在国内,该芯片费用较高,分析质谱需要大量后续工作支持.
一、 前言基因工程已令人难以置信的扩展了我们关于有机体DNA序列的认识。但是仍有许多新识别的基因的功能还不知道,也不知道基因产物是如何相互作用从而产生活的有机体的。功能基因组试图通过大规模实验方法来回答这些问题。但由于仅从DNA序列尚不能回答某基因的表达时间、表达量、蛋白质翻译后加工和修饰的情况、以及它们的亚细胞分布等等,因此在整体水平上研究蛋白质表达及其功能变得日益显得重要。这些在基因组中不能解决的问题可望在蛋白质组研究中找到答案。蛋白质组研究的数据与基因组数据的整合,将会在后基因组研究中发挥重要作用。目前蛋白质组研究采用的主要技术是双向凝胶电泳和质谱方法。双向凝胶电泳的基本原理是蛋白质首先根据其等电点,第一向在pH梯度胶内等电聚焦,然后转90度按他们的分子量大小进行第二向的SDS-PAGE分离。质谱在90年代得到了长足的发展,生物质谱当上了主角,蛋白质组学又为生物质谱提供了一个大舞台。他们中首选的是MALDI-TOF,其分析容量大,单电荷为主的测定分子量高达30万,干扰因素少,适合蛋白质组的大规模分析。其次ESI为主的LC-MS联机适于精细的研究。本文将简介几种常用的生物质谱技术,并着重介绍生物质谱技术在蛋白质组学各领域的应用。此贴与http://bbs.instrument.com.cn/shtml/20081130/1613156/重复,请版友在发帖前先搜索一下,以免重复发帖,谢谢!
一、 前言[1,2]基因工程已令人难以置信的扩展了我们关于有机体DNA序列的认识。但是仍有许多新识别的基因的功能还不知道,也不知道基因产物是如何相互作用从而产生活的有机体的。功能基因组试图通过大规模实验方法来回答这些问题。但由于仅从DNA序列尚不能回答某基因的表达时间、表达量、蛋白质翻译后加工和修饰的情况、以及它们的亚细胞分布等等,因此在整体水平上研究蛋白质表达及其功能变得日益显得重要。这些在基因组中不能解决的问题可望在蛋白质组研究中找到答案。蛋白质组研究的数据与基因组数据的整合,将会在后基因组研究中发挥重要作用。目前蛋白质组研究采用的主要技术是双向凝胶电泳和质谱方法。双向凝胶电泳的基本原理是蛋白质首先根据其等电点,第一向在pH梯度胶内等电聚焦,然后转90度按他们的分子量大小进行第二向的SDS-PAGE分离。质谱在90年代得到了长足的发展,生物质谱当上了主角,蛋白质组学又为生物质谱提供了一个大舞台。他们中首选的是MALDI-TOF,其分析容量大,单电荷为主的测定分子量高达30万,干扰因素少,适合蛋白质组的大规模分析。其次ESI为主的[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]联机适于精细的研究。本文将简介几种常用的生物质谱技术,并着重介绍生物质谱技术在蛋白质组学各领域的应用。
根据MarketsandMarkets发布的新的市场研究报告,2017年全球蛋白质组学市场将增加到172亿美元。尽管当前的经济气候不佳,但复合年增长率相当于14.2%。蛋白质组学领域主要公司有Thermo Fisher, Agilent, Life Tech, Sigma-Aldrich, Danaher, Waters, Roche, Bio-Rad and Luminex,不难看出多为国外仪器厂商。这些公司在接下来“分蛋糕”的过程中又会有哪些动作?这些公司是否会为了壮大自己生命科学方面的实力,而进行新一轮的并购?国内仪器公司又会有怎样的动态?是否会在竞争中具有优势?是否已经有公司已经抢占市场先机?欢迎大家热烈讨论~~~~~———————————————————————————————————————根据MarketsandMarkets发布的新的市场研究报告,2017年全球蛋白质组学市场将增加到172亿美元。尽管当前的经济气候不佳,但复合年增长率相当于14.2%。 该报告共504页,分为三个部分,包括四个地区:美国、欧洲、亚洲和世界其他地区。仪器技术部分包括蛋白质微阵列、光谱、x射线结晶学、色谱法、电泳、表面等离子体共振系统、蛋白质分离系统;试剂部分包括芯片、光谱、x射线结晶学、色谱法、电泳、免疫、微球、蛋白质分离试剂;最后一部分是服务,包括分析实验室服务和数据分析与维护。 该报告还包括了一个市场概述、地理分析、本领域21个公司的简介。蛋白质组学领域主要公司有Thermo Fisher, Agilent, Life Tech, Sigma-Aldrich, Danaher, Waters, Roche, Bio-Rad and Luminex。
由于人类基因序列的建立已经接近完成,人们认识到生物科学届的下一项任务将是表征基因组的产物——其中绝大部分是蛋白质。作为正在兴起的研究领域,蛋白质组学将其研究目标定位于:鉴定和测量在一个细胞或组织中的所有蛋白质,这样做的预期是,将能发现那些能够成为疾病生物标志物(biomarker)或药物靶标的候选蛋白质。经证明,这是一项令人望而生畏的工作,难度之一在于,25,000个基因中的每一个都会产生拼接、翻译后修饰,最后表达的蛋白质数量将会大大增加。另一个增加难度的因素是蛋白质的浓度范围太广——通常为许多个数量级——并且很可能大多数人们感兴趣的都是那些低丰度的蛋白。 目前,已有大量的技术和实验方法用于解决蛋白质组学的问题。其中应用最广泛的是“自下而上”的方法。用蛋白质水解酶(典型的为胰蛋白酶)将细胞提取液或溶胞产物中的所有蛋白质酶解,接着用反相液相色谱(LC)分离,然后在线引入电喷雾源的质谱。一种参考的液相色谱-串联质谱([url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]-MS)流程通常为:多肽离子在母离子扫描中被分离,其中几个最强的离子将被自动碎裂,将母离子质量和子离子/碎片质量都输入搜索引擎,和数据库中的蛋白按照多肽和碎片质量去匹配,匹配的结果将生成记录、即完成了蛋白质的鉴定。获得一个、几个或所有蛋白质的定量信息,可以有几种做法:比如通过谱图计数和峰强度测量的非标记方法(Label free) 通过引入稳定同位素标记标签 或用重同位素标记蛋白中的一个或几个肽(“蛋白典型多肽”) [1]对于复杂样品,如人体液或胞溶产物,潜在需要分析的蛋白质数量将非常庞大。在一个特定状态下一个细胞典型地会表达几千种蛋白质,每个蛋白质将产生多达几十个多肽,而每一个多肽在质谱中又以多种带电状态存在。因此,单个蛋白质组学样本就包含500, 000多种类别或者更多。为了减少分析问题的复杂性,通常在进行[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]分析前利用一维或二维凝胶电泳[2]、溶液中的等电聚焦[3]或多维高效液相色谱(HPLC)[4]技术,将样本预分离成多馏分(prefractionation)。[img]http://ng1.17img.cn/bbsfiles/images/2009/12/200912311320_193276_1615922_3.jpg[/img]
做蛋白质组学需要什么软件?
一、 前言基因工程已令人难以置信的扩展了我们关于有机体DNA序列的认识。但是仍有许多新识别的基因的功能还不知道,也不知道基因产物是如何相互作用从而产生活的有机体的。功能基因组试图通过大规模实验方法来回答这些问题。但由于仅从DNA序列尚不能回答某基因的表达时间、表达量、蛋白质翻译后加工和修饰的情况、以及它们的亚细胞分布等等,因此在整体水平上研究蛋白质表达及其功能变得日益显得重要。这些在基因组中不能解决的问题可望在蛋白质组研究中找到答案。蛋白质组研究的数据与基因组数据的整合,将会在后基因组研究中发挥重要作用。目前蛋白质组研究采用的主要技术是双向凝胶电泳和质谱方法。双向凝胶电泳的基本原理是蛋白质首先根据其等电点,第一向在pH梯度胶内等电聚焦,然后转90度按他们的分子量大小进行第二向的SDS-PAGE分离。质谱在90年代得到了长足的发展,生物质谱当上了主角,蛋白质组学又为生物质谱提供了一个大舞台。他们中首选的是MALDI-TOF,其分析容量大,单电荷为主的测定分子量高达30万,干扰因素少,适合蛋白质组的大规模分析。其次ESI为主的LC-MS联机适于精细的研究。本文将简介几种常用的生物质谱技术,并着重介绍生物质谱技术在蛋白质组学各领域的应用。二、 生物质谱技术1.电喷雾质谱技术(ESI)电喷雾质谱技术( Electrospray Ionization Mass Spectrometry , ESI - MS) 是在毛细管的出口处施加一高电压,所产生的高电场使从毛细管流出的液体雾化成细小的带电液滴,随着溶剂蒸发,液滴表面的电荷强度逐渐增大,最后液滴崩解为大量带一个或多个电荷的离子,致使分析物以单电荷或多电荷离子的形式进入气相。电喷雾离子化的特点是产生高电荷离子而不是碎片离子, 使质量电荷比(m/ z) 降低到多数质量分析仪器都可以检测的范围,因而大大扩展了分子量的分析范围,离子的真实分子质量也可以根据质荷比及电荷数算出。2.基质辅助激光解吸附质谱技术(MOLDI)基质辅助激光解析电离(MOLDI)是由德国科学家Karas和Hillenkamp发现的。将微量蛋白质与过量的小分子基体的混合液体点到样品靶上,经加热或风吹烘干形成共结晶,放入离子源内。当激光照射到靶点上时,基体吸收了激光的能力跃迁到激发态,导致蛋白质电离和汽化,电离的结果通常是基体的质子转移到蛋白质上。然后由高电压将电离的蛋白质从离子源转送到质量分析器内,再经离子检测器和数据处理得到质谱图。TOF质量分析器被认为是与MALDI的最佳搭配,因为二者都是脉冲工作方式,在质量分析过程中离子损失很少,可以获得很高的灵敏度。TOF质量分析器结果简单,容易换算,蛋白质离子在飞行管内的飞行速度仅与他的(m/z)-1/2成正比,因此容易通过计算蛋白质离子在飞行管内的飞行时间推算出蛋白质离子的m/z值。与传统质量分析器相比,更易得到高分辨率和高测量精度;速度快,离子飞行时间仅为几个μs和约100μs之间;质量范围宽,可以直接检测到几十万道尔顿的单电荷离子。飞行时间质量分析器被认为是21世纪最有应用前景的质量分析器。3.傅立叶变换-离子回旋共振质谱(FT-ICR MS)傅立叶变换-离子回旋共振质谱法(FT-ICR MS)是离子回旋共振波谱法与现代计算机技术相结合的产物。傅立叶变换-离子回旋共振质谱法是基于离子在均匀磁场中的回旋运动, 离子的回旋频率、半径、速度和能量是离子质量和离子电荷及磁场强度的函数, 当对离子施加与其回旋频率相同的射频场作用时, 离子将同相位加速到一较大的半径回旋, 从而产生可被接受的类似电流的信号。傅立叶变换-离子回旋共振质谱法所采用的射频范围覆盖了欲测定的质量范围,所有离子同时被激发, 所检测的信号经过傅立叶变换, 转换为质谱图。其主要优点有:容易获得高分辨;便于实现串极质谱分析;便于使用外电离源并与色谱仪器联用。此外,他还有灵敏度高,质量范围宽,速度快,性能可靠等优点。4.快原子轰击质谱技术(FABMS)快原子轰击质谱技术( Fast Atom Bomebardment Mass Spectrometry , FABMS) 是一种软电离技术,是用快速惰性原子射击存在于底物中的样品,使样品离子溅出进入分析器,这种软电离技术适于极性强、热不稳定的化合物的分析,特别适用于多肽和蛋白质等的分析研究。FABMS能提供有关离子的精确质量,从而可以确定样品的元素组成和分子式。而FABMS -MS 串联技术的应用可以提供样品较为详细的分子结构信息,从而使其在生物医学分析中迅速发展起来。三、蛋白质的分析鉴定随着质谱技术的发展,分子量的测定已从传统的有机小分子扩展到了生物大分子。MALDI-MS技术以其极高的灵敏度、精确度在蛋白质分析中得到了广泛的应用。该技术不仅可测定各种疏水性、亲水性和糖蛋白的分子量,还可直接测定蛋白质混合物的分子量。这可认为是蛋白质分析领域的一项重大突破。蛋白质组的研究是从整体水平上研究细胞或有机体内蛋白质的组成及其活动规律。质谱技术作为蛋白质组研究的三大支撑技术之一,除了用于多肽,蛋白质的分子量测定外,还广泛的应用于肽指纹图谱测定及氨基酸序列测定。肽指纹图谱(Peptide Mass Fingerprinting, PMF)测定是对蛋白酶解或降解后所得多肽混合物进行质谱分析的方法。质谱分析所得肽断与多肽蛋白数据库中蛋白质的理论肽断进行比较,判断出所测蛋白是已知还是未知。由于不同的蛋白质具有不同的氨基酸序列,不同蛋白质所得肽断具有指纹特征。采用肽指纹谱的方法已对酵母、大肠杆菌、人心肌等多种蛋白质组进行了研究。对肽序列的测定往往要应用串连质谱技术,采用不同的技术选择特定质核比的离子,并对其进行碰撞诱导解离,通过分析肽段的断裂情况推导出肽序列。四、后转录修饰的蛋白质的检测和识别在蛋白质组的研究中,蛋白质和多肽的序列分析已不局限于阐明蛋白质的一级结构,对翻译后的修饰的进一步分析也是蛋白质化学的一项重要任务。这种修饰对于蛋白质的功能非常重要,如:细胞识别中的蛋白质相互作用,信号传导和蛋白质定位。1. 蛋白质的糖基化糖蛋白在细胞内部,细胞膜和细胞外均有发现,实际上大部分蛋白质是糖蛋白。对糖蛋白的检测和分析发现,糖蛋白中糖组分的结构和功能具有多样性。糖蛋白中的糖通常是不同种类的,而且是由一些可控数量的单糖组成。糖基化的多样性与细胞周期,细胞分化和发展的状态有关。在蛋白组时代中,蛋白质的修饰会引起其理化性质的改变,因此是不容忽视的。从1D或2D凝胶得到的糖基化蛋白的识别,一般是进行MALDI-MS指纹分析, 或是对MALDI-PAD或ESI-MS/MS得到的碎片谱进行分析。对完整的糖蛋白的研究是非常困难的,所有已知的离子化技术都有其局限性。目前,人们主要研究糖肽,其好处之一就是质量减小了,这就会得到更好的分辨率,而且糖肽仍保留了糖基化位点。将分离的糖蛋白用不同的蛋白酶消化后就可进行糖肽的研究。一旦糖肽被识别出,就可以用串连质谱(ESI-MS/MS)来阐明肽序列。当蛋白的序列已知时,计算质量差就可推出其上附着的寡糖的质量。要将糖部分从糖蛋白中释放出来,可用化学切割或酶切割(流程图见图1)。目前,连有结构专一性糖苷酶的质谱在提供序列,分支和链接数据方面是最有力的技术。对于N糖基化常用的糖苷内切酶有PNGase-F, PNGase-A, EndoF和EndoH。化学切割也可以用来释放O-连接和N-连接的多糖,但经常出现的缺点是他会完全破坏所有的肽键,因而丢失了关于糖附着位点的信息。而且这些切割不能从糖肽中连续释放单糖。用肼的化学切割可以除去两种类型的糖基化。在60℃可专一性的释放O-连接的糖,而在95℃能释放N-连接的糖。释放O-原子更常用的方法是用碱进行β消除。通常,糖基中加入金属离子在MALDI和ESI中离子化。用MALDI-MS分析糖类的一个好的选择是将之与其他一些化合物混合,这样可以进一步提高灵敏度和分辨率。不同的质谱方法可以产生多糖的源后裂解(PSD)和碰撞诱导解离 (CID)谱,这可以给出有关糖的序列,分支及糖间的连接等信息。2. 蛋白质的磷酸化蛋白质中氨基酸的磷酸化在生命系统中起重要的作用。磷酸化经常作为分子开关控制不同过程蛋白质的活性,如新陈代谢,信号传导,细胞分裂等过程。因此,蛋白质中磷酰氨基酸的识别在蛋白质分析中是一项重要的工作。已知的磷酰氨基酸的类型有四种:1.O-磷酸盐,通过羟氨酸的磷酸化形成的,如丝氨酸,苏氨酸,酪氨酸。2.N-磷酸盐,通过精氨酸,赖氨酸或组氨酸中的氨基的磷酸化形成的。3.乙酰磷酸盐,通过天冬氨酸或谷氨酸的磷酸化形成的。4.S-磷酸酯,通过半胱氨酸的磷酸化形成的。
自十年前 "Proteoform" 诞生以来,它在蛋白质组研究领域的接受度和使用频率也越来越高。然而当初为何需要新造一词?它的出现能为蛋白质组学研究和交流中带来什么帮助?今天为大家介绍两篇由 Consortium for Top-Down Proteomics (CTDP))发表在 [i]Nature Methods[/i] 上的文章,主要内容是关于蛋白质组学中的术语 "proteoform" 的定义和提出 "proteoform identification" 的分类。 Nature Methods | Proteoform: A Single Term Describing Protein Complexity & Nature Methods | A Five-level Classification System for Proteoform Identifications 在 2013 年的文章 Proteoform: A Single Term Describing Protein Complexity 中,作者提出,随着人类基因组计划的成功,人们认识到生物机制所提供的复杂性在很大程度上是由于在蛋白质水平上的变异,而不是大量的基因水平上的不同导致的。高度相关但化学性质不同的蛋白质分子之间的差异源于群体、细胞、组织类型以及亚细胞定位的差异。在 DNA、RNA 和蛋白质水平上,蛋白质的复杂性分别来自等位基因变异、RNA 转录物的选择性剪接和翻译后修饰。这些事件产生不同的蛋白质分子,调节各种各样的生物过程,例如:细胞信号传导、基因调控和蛋白质复合物的激活。 而[b][color=#ff0000]随着质谱法在蛋白质组学中的应用,Top-Down、Bottom-Up 方法的开发,研究者们已经可以提供蛋白质的精确组成,然而如何使用合适的术语描述蛋白质的型体差异的问题久未解决。[/color][/b]在文献中可以找到下列词汇:"protein forms","protein isoforms","protein species","protein variants" 以及蛋白质的 "mod forms"。这些词都存在着问题,例如在文献中常用的 "isoforms",根据国际纯粹与应用化学联合会(IUPAC)的定义,它只指在基因水平上差异导致的蛋白质的不同,而不包括在蛋白质水平上的变异。UniProt Knowledgebase(以基因为中心的权威蛋白质数据库)以不同的方式使用术语 "isoforms",它表示通过可选剪接或可变启动子,使用从同一基因产生的相关形式的蛋白质分子。但是由于遗传变化(例如,突变和多态性)不包括在这个术语中,这与IUPAC对 "isoforms" 的定义产生冲突。尽管 IUPAC 和 Uniprot 在定义上存在差异,"variants" 和 "isoforms" 在 IUPAC 中用于描述来自不同 DNA 或 RNA 的蛋白。因此,二者在定义修饰后的蛋白质上是混淆不清的。 因此,作者建议使用术语 "proteoform" 来指定单个基因的蛋白质产物的所有不同的分子形式,包括由于遗传变异、RNA 转录物的选择性剪接和翻译后修饰引起的变化。任何基因或蛋白质加工事件,如使用内部蛋白或 RNA 编辑机制的事件,都被术语 "proteoform" 清楚地涵盖了。该术语应包括 PSI-MOD 中的所有翻译后修饰,但归类为试剂衍生物或同位素标记残基的修饰除外。多基因家族的蛋白质产物应继续以序列一致性为基础进行分类(如90%, 99%等)。这个术语与作者支持的以基因为中心的方法是一致的,因为将不同基因的产生的蛋白质分在一组,也会导致蛋白质鉴定的不精确。 在 2016 年发表的文章 A Five-level Classifcation System for Proteoform Identifcations 中,作者提到,在 2013 年引入的 “proteoform” 一词迅速得到了蛋白质组学界的认可。但是随着蛋白质组学的研究的发展,在当时另一个模糊的定义出现了——“proteoform identification”,即对于来自于单一基因产生的不同形式的蛋白质的鉴定。因为当时唯一实用的蛋白质组学方法是用质谱法(MS)来确定蛋白质的确切初级结构,而大量的质谱结果都声称为 "proteoform identification"。这个看似微不足道的问题具有重大的影响,因为 "proteoform identification" 的含义不清使得比较来自不同实验室和方法的结果变得困难。这种情况阻碍了研究者们对于技术进步的评价和对于生物知识的有效扩展。 为了解决这一问题,并协助研究人员表达研究结果中的模糊性,作者提出了一个 5 级的 proteoform 分类系统。该分类方案涵盖了 4 种可能出现的 "proteoform identification" 模糊类型: (1)翻译后修饰(PTM)定位:PTM 没有定位到特定的氨基酸。 (2)PTM 识别:PTM 的鉴定不完全。 (3)氨基酸序列:氨基酸序列的鉴定不完全。 (4)基因:起源基因是未知的或模糊的。 这4个类别决定了鉴定中存在的模糊程度,从完全没有(第1级)到所有4种类型都存在(第5级)。(见表1)[align=center][img=图片,633,295]https://img1.17img.cn/17img/images/202401/uepic/ce544cd8-b1f9-46f7-8412-c206a4631058.jpg[/img][/align][align=center] 表1. proteoform 水平的分类系统[/align] 第 1 级:proteoform 的鉴定完全,对其起源基因有充分的了解,确定了完整的氨基酸序列,并且已知所有 PTMs 和其位置(如果存在的话)。第 2 级:在上述模糊性的一种类别中存在 1 种。这方面的例子包括:2A 级,其中氨基酸序列已完全确定,并了解其起源基因,所有 PTMs 已完全确定,但其定位不完整。2B 级,氨基酸序列完全确定,知道其起源基因,并且 PTM 的定位是完整的,但 PTM 或结构特征(例如,乙酰化与三甲基化或糖蛋白形态)没有完全鉴定。2C 级,如果存在,所有PTM都被识别和定位,但存在一些序列鉴定不完整(例如,在一个小区域内氨基酸的序列未知),但仍然知道其基因的起源。2D 级,氨基酸序列完全确定,所有 PTM 都被完全识别和定位,但是关于基因起源存在歧义。第 3 级:存在 2 种上述的模糊类型。第 4 级:存在 3 种上述的模糊类型。第 5 级:获得的信息不足,无法知道该蛋白质源自哪个基因、其序列是什么、PTMs 或其定位 只有观察到的 proteoform 的分子量是已知的。 作者在这里提出的分类系统可以将不同结果水平的 "proteoform identification" 区分开,但有意不提出每个研究者发表的结果的置信度相关问题。理想情况下,每一种 proteoform 的鉴定都应该伴随着分类水平和置信度度量。早期估计 "proteoform identification" 可信度的努力包括 C-score 和 MIScore,但需要进一步的工作来开发和完善估计,以便能够可靠地自动分配 proteoform 水平。 总结,[b][color=#ff0000]作者分别在 2013 年和 2016 年提出了 "proteoform" 的定义和"proteoform identification" 的分类系统,并且认为 "proteoform" 具有很高的使用意义,有助于提高蛋白质组学领域的出版物的可读性和理解性。[/color][/b]同时,推荐使用文中提到的 5 级分类系统,因为它的一致性将有助于研究结果发表、评价和提升不同的鉴定方法以及推进蛋白质组学的发展。 原文 Proteoform: a single term describing protein complexity | Nature MethodsDOI https://doi.org/10.1038/nmeth.2369A five-level classification system for proteoform identifications | Nature Methods DOI https://doi.org/10.1038/s41592-019-0573-x 结 束 语 随着更多新造词术语在学界的引入,如何对它们进行合适的中文翻译、避免概念混淆,已成为中文交流语境下值得关切的问题。[align=right] 撰稿:李孟效[/align][align=right] 编辑:李惠琳,王冠博,周默为,梁玉[/align][来源:仪器信息网] 未经授权不得转载[align=right][/align]
生物质谱技术在蛋白质组学中的应用有哪些
蛋白质组学是一门新兴但发展迅速的学科。近年来,国际上主要发达国家和地区纷纷加大了对蛋白质组学的支持力度,这一研究领域也由此成为各强国科技角力的新战场。10月12~13日,以“蛋白质组学:前沿与挑战”为主题的第381次香山科学会议在北京举行,与会的59名海内外科学家围绕蛋白质组学发展趋势及需求等议题展开了深入讨论。会议执行主席、中国科学院院士、军事医学科学院院长贺福初接受了记者的专访。 《科学时报》:举办此次香山科学会议的目的是什么?贺福初:蛋白质组学是揭示生命现象和规律的必由之路,已成为21世纪生命科学与生物技术的重要战略前沿和主要突破口,蛋白质组学研究已成为本世纪各国争夺最激烈、最重要的战略制高点之一。中国是较早开展蛋白质组学研究的国家之一,2006年初国家发布了《国家中长期科学和技术发展规划纲要(2006—2020)》,明确提出要将蛋白质组学研究作为重点发展方向。“十一五”期间,我国蛋白质组学研究发展迅速并步入国际先进行列。2011年将是我国“十二五”规划的开局之年,为做好未来五年蛋白质组学的研究工作,明确主要发展方向和科学问题,探讨包括蛋白质组学设施在内的我国生命科学大设施的战略部署、建设和管理,我们在金秋十月的北京召开了这次香山科学会议。与会专家中不仅有多位两院院士和国内在不同领域作出突出成绩的中青年科学家,还有多位海外科学家,他们不远万里来到中国,共同为推动中国蛋白质组学研究向更高层次和水平发展献计献策。《科学时报》:请您简要介绍一下最近十年来国际蛋白质组学发展情况。贺福初:2001年国际人类蛋白质组组织的成立,极大地推动了蛋白质组研究的发展。10年来,国际蛋白质组学无论从技术方法和研究策略,还是研究资源和研究领域等都有了质的飞跃。近年来在蛋白质组定量分析,翻译后修饰研究、规模化相互作用及功能研究、生物标志物的筛选验证、抗体制备、数据标准和数据挖掘等方向取得一系列突破性进展。其中值得一提的是,蛋白质组学技术已成为几乎所有国际著名医学研究机构的重要支撑平台,在疾病研究中的应用十分广泛。国际上也先后启动了多种疾病的蛋白质组研究计划,目标是直接寻找疾病相关特异蛋白质或对疾病相关已知蛋白质进行深入机制分析。不久前在澳大利亚悉尼召开的第九届国际蛋白质组大会上,国际人类蛋白质组组织在总结前几年国际人类蛋白质组计划各先期计划经验的同时,宣布全面启动实施国际人类蛋白质组计划。该计划的全面实施势必全面带动科学技术及生物产业的发展,中国有必要也有能力在这一宏大计划中发挥主流作用。《科学时报》:蛋白质组学研究将呈现怎样的发展趋势?贺福初:蛋白质组学技术的迅速发展,其学术理念和技术方法已广泛应用于生命科学各个领域,如疾病发生发展的分子机制研究,疾病生物标志物的发现和验证研究等,蛋白质组学的广泛应用给蛋白质组学的发展提供了更多的需求和发展方向。随着蛋白质组学的快速发展及其在多个领域中的广泛应用,其发展的重点也发生了转变,逐渐从全蛋白质组研究向亚细胞蛋白质组研究转变,从定性描述向定量分析转变,由静态研究向动态研究转变,由体外研究向体内研究转变,从实验室研究向临床应用拓展,数据产出由数量向质量转变,由简单积累向有效整合以及知识挖掘转变。蛋白质组学不仅自身发展迅速,而且作为生命科学与生物高技术的新一代引擎,将带动大量相关学科领域的快速发展,为生命科学的研究、生物技术的应用和人类疾病的预防诊治带来新的革命。如通过与基因组研究的对接,极大推动基因组的全面阐释,通过其强大的需求牵引和突出的集成融合,推动分析科学与技术、信息科学与技术、材料科学与技术等学科在生命科学与生物高技术中的深层次应用和各自的快速发展,为我国经济社会的全面、协调、可持续的发展提供强大的科技原动力和战略性基础性支撑。《科学时报》:我国蛋白质组学研究都取得了哪些重要成就?贺福初:我国政府历来重视和支持蛋白质组学的发展,过去的十余年间,在国家发改委、科技部、自然基金委以及军队和省市科技主管部门等的大力支持下,我国蛋白质组学研究迅速发展壮大,并有力地推动了国际蛋白质组学研究的快速发展。研究重心从最初的以建立技术平台,开展技术方法的研究、整合为主,逐步向以高通量的蛋白质组研究技术平台为基础,解决事关我国人民健康的重大疾病问题和重要生命科学问题转移。涉及的领域除医学及人类自身对象以外,还涵盖了生命科学以及农业、林业、环境、资源、能源、工业等领域中的植物、动物、微生物等。无论是在蛋白质组学技术方法,还是在重要生物学功能和重大疾病相关的蛋白质组研究方面,我国科学家都取得了一系列令国际学术界瞩目的重要成就。2004年中国科学家首次在国际蛋白质组学最权威的专业刊物《分子细胞蛋白质组学》发表文章,近几年该刊物几乎每期都发表中国科学家的工作成果,甚至同期刊登来自同一个科研单位的三篇文章,据统计,中国科学家在国际蛋白质组学主要刊物《分子细胞蛋白质组学》、《蛋白质组研究》和《蛋白质组学》上发表的论文数量已位列世界第二位。由我国科学家倡导并领衔的国际人类肝脏蛋白质组计划,率先提出和建立了组织/器官的蛋白质组研究框架、模式和标准,为国际人类蛋白质组计划的全面展开和顺利实施发挥了普遍的示范和指导作用。我国科学家还广泛参与了国际人类蛋白质组计划的其他分计划,如血浆蛋白质组等,一批与重大疾病和重要生物功能相关的蛋白质组研究取得明显进展。《科学时报》:如何加快我国蛋白质学研究的发展?贺福初:面对生命科学前沿的领域,重大科学问题、涉及国民经济社会发展的重要应用领域的广泛需求,蛋白质组学从技术层面还有很大的发展空间。2011年是“十二五”规划的开局之年,有关部门针对蛋白质组学的发展现状和趋势,已调研论证并开始着手部署“十二五”期间的蛋白质组专项,尤其是面对“国际人类蛋白质组计划”的全面实施,有关“中国人类蛋白质组计划”的相关建议也已开始调研论证。不久前,国家发展和改革委员会批准分别在北京和上海建设国家蛋白质科学基础设施,这是我国首个在生命科学领域建设的大科学设施。其中,北京设施(简称“凤凰工程”)以蛋白质组学为主,由军事医学科学院作为项目法人,联合清华大学、北京大学和中国科学院生物物理研究所等共同建设,将为我国蛋白质科学,尤其是蛋白质组学的发展提供重要支撑,大幅提升我国蛋白质组学研究能力,有力保障重大科学研究计划(蛋白质科学研究计划)和“人类蛋白质组计划”等大型科技计划顺利实施,并为国内外广大用户提供高水平的技术服务。同时也为今后生命科学领域的其他大设施的部署、建设和管理发挥重要的示范和指导作用。在政府的支持下,我们应该抓住蛋白质组学发展的新契机,立足国际发展前沿,加强蛋白质组学新技术新方法的研究;在建设国家蛋白质科学基础设施的基础上,充分整合现有蛋白质组研究基础,建立完善国家层面的蛋白质组学协作网络;结合国际人类蛋白质组计划的全面实施,整合国内优势力量,加快启动实施“中国人类蛋白质组计划”;综合我国产出的海量人类蛋白质组数据,建立以中国为主的蛋白质数据库,积极推进蛋白质组数据对人类基因组的注释,并全面揭示生理功能调控规律和病理机制;推进前期基础研究成果的转化,为重大疾病预防诊治和创新药物研发提供理论基础、技术支撑,和具有重要应用价值的诊断试剂、药物靶点及新型药物,加强蛋白质组学在农业、工业、环境、资源、能源、林业等领域研发中的广泛应用将有力地推动我国蛋白质科学技术实现跨越式发展。《科学时报》 (2010-11-29 B1 中国生物产业)
生物质谱技术在蛋白质组学中的应用有哪些
一、 前言 基因工程已令人难以置信的扩展了我们关于有机体DNA序列的认识。但是仍有许多新识别的基因的功能还不知道,也不知道基因产物是如何相互作用从而产生活的有机体的。功能基因组试图通过大规模实验方法来回答这些问题。但由于仅从DNA序列尚不能回答某基因的表达时间、表达量、蛋白质翻译后加工和修饰的情况、以及它们的亚细胞分布等等,因此在整体水平上研究蛋白质表达及其功能变得日益显得重要。这些在基因组中不能解决的问题可望在蛋白质组研究中找到答案。蛋白质组研究的数据与基因组数据的整合,将会在后基因组研究中发挥重要作用。 目前蛋白质组研究采用的主要技术是双向凝胶电泳和质谱方法。双向凝胶电泳的基本原理是蛋白质首先根据其等电点,第一向在pH梯度胶内等电聚焦,然后转90度按他们的分子量大小进行第二向的SDS-PAGE分离。质谱在90年代得到了长足的发展,生物质谱当上了主角,蛋白质组学又为生物质谱提供了一个大舞台。他们中首选的是MALDI-TOF,其分析容量大,单电荷为主的测定分子量高达30万,干扰因素少,适合蛋白质组的大规模分析。其次ESI为主的 LC-MS联机适于精细的研究。本文将简介几种常用的生物质谱技术,并着重介绍生物质谱技术在蛋白质组学各领域的应用。 二、 生物质谱技术 1.电喷雾质谱技术(ESI) 电喷雾质谱技术( Electrospray Ionization Mass Spectrometry , ESI - MS) 是在毛细管的出口处施加一高电压,所产生的高电场使从毛细管流出的液体雾化成细小的带电液滴,随着溶剂蒸发,液滴表面的电荷强度逐渐增大,最后液滴崩解为大量带一个或多个电荷的离子,致使分析物以单电荷或多电荷离子的形式进入气相。电喷雾离子化的特点是产生高电荷离子而不是碎片离子, 使质量电荷比(m/ z) 降低到多数质量分析仪器都可以检测的范围,因而大大扩展了分子量的分析范围,离子的真实分子质量也可以根据质荷比及电荷数算出。本帖与http://bbs.instrument.com.cn/shtml/20081130/1613156/重复,故锁帖!请版友在发帖前先搜索一下,以免出现重复贴。谢谢!斑竹您给的重复贴链接有误,并且我写贴前已经搜索了标题。SORRY,请LZ检索一下这个网址,开始那个是弄错了。
高通量蛋白质组学鉴定对仪器有哪些要求?
Thermo今年发布的Top Down蛋白质组学,用的是CE-MS联用,大家有没有关注?国内有人做吗?
[em09511]本人刚进入生命技术方面的研究工作,以前是读医学类专业的,想请教各位大大,关于蛋白质组学的检测技术有哪些.......
蛋白质组学研究--生物质谱技术 对分离的蛋白质进行鉴定是蛋白质组研究的重要内容,蛋白质微量测序、氨基酸组成分析等传统的蛋白质鉴定技术不能满足高通量和高效率的要求,生物质谱技术是蛋白质组学的另一支撑技术。 生物质谱技术在离子化方法上主要有两种软电离技术,即基质辅助激光解吸电离(matrix—assisted laser desorption/ionization,MALDl)和电喷雾电离(electrospray ionization,ESl)。MALDI是在激光脉冲的激发下,使样品从基质晶体中挥发并离子化。ESI使分析物从溶液相中电离,适合与液相分离手段(如液相色谱和毛细管电泳)联用。MALDI适于分析简单的肽混合物,而液相色谱与ESI—MS的联用(LC—MS)适合复杂样品的分析。 软电离技术的出现拓展了质谱的应用空间,而质量分析器的改善也推动了质谱仪技术的发展。生物质谱的质量分析器主要有4种:离子阱(iontrap,IT)、飞行时间(TOF)、四极杆(quadrupole)和傅立叶变换离子回旋共振(Fourier transform ion cyclotron resonance,FTICR)。它们的结构和性能各不相同,每一种都有自己的长处与不足。它们可以单独使用,也可以互相组合形成功能更强大的仪器。 离子阱质谱灵敏度较高,性能稳定,具备多级质谱能力,因此被广泛应用于蛋白质组学研究,不足之处是质量精度较低。与离子阱相似,傅立叶变换离子回旋共振(FTICR)质谱也是一种可以“捕获”离子的仪器,但是其腔体内部为高真空和高磁场环境,具有高灵敏度、宽动态范围、高分辨率和质量精度(质量准确度可很容易地小于1mg/L),这使得它可以在一次分析中对数百个完整蛋白质分子进行质量测定和定量。FTICR—MS的一个重要功能是多元串级质谱,与通常的只能选一个母离子的串级质谱方式不同,FTICR—MS可以同时选择几个母离子进行解离,这无疑可以大大增加蛋白质鉴定工作的通量。但是它的缺点也很明显,操作复杂、肽段断裂效率低、价格昂贵等,这些缺点限制了它在蛋白质组学中的广泛应用。MALDI通常与TOF质量分析器联用分析肽段的精确质量,而ESI常与离子阱或三级四极杆质谱联用,通过碰撞诱导解离(collision—induceddissociation,CID)获取肽段的碎片信息。 1. MALDI—TOF—MS (1)MALDI—TOF—MS的技术特点:①具有分离、鉴定双重功能,可用于混合物的分析;②测量范围宽,相对分子质量可达300 000;③精度高,蛋白质相对分子质量测定精度可达0.01%;④灵敏度高,所需样品量少,可达fmol级;⑤分析时间短,5~10rain可完成一次分析;⑥样品制备简便,操作易自动化;⑦对样品要求低,能忍耐较高浓度的盐、缓冲剂和非挥发性杂质,所以特别适合于鉴定二维凝胶电泳分离的蛋白质。 (2)MALDI—TOF—MS的技术改进:近年来MALDI—TOF—MS又有许多新的技术改进,以提高其检测灵敏性和准确度,增强其蛋白质鉴定的功能。如将MALDI离子源与四极杆—飞行时间—串联质谱对接,实现了同一样品在同一质谱仪上的肽指纹图谱与肽序列标签分析同时进行,提高于蛋白质鉴定的速度和准确性。还有MALDI—TOF—TOF—MS等。但这些技术共同的缺点是仪器非常昂贵。 (3)MALDI—TOF—MS的发展方向:①寻求新的基质(如混合基质、室温离子化液体等)和新的制样方法(如超微量进样,n1级);②将新技术应用在分析中(如酶切技术、毫微升溶剂提取技术等);③对质谱仪进行改进或与其他分析仪器联用,如MALDI与傅立叶转换离子回旋共振质谱(MALDI—FTMS)联用能得到更多的蛋白结构信息;④小型化、智能化、简易化及自动化已成为趋势。 2.ESI (1)ESI的优势:①检测范围宽,生物大分子经电喷雾后质荷比大大下降,因而可测相对分子质量高达十几万甚至更高的生物样品;②分辨率和灵敏度高,可达10-15—10-12mol;③不需要特定基质,避免子基质峰的干扰;④适用于结构分析,可分析生物大分子的构象及非共价相互作用,与串联质谱结合可分析蛋白质、多肽的一级结构和共价修饰位点等;⑤自动化程度高,可与液相色谱、毛细管电泳等高效分离手段在线联用;⑥MALDI是脉冲式离子化技术,而ESI是连续离子化技术,检测所需时间更短;⑦ESI常和四极杆质谱联用,仪器价格相对便宜。 (2)ESI的局限性:①对样品中的盐类耐受性差;②对混合物图谱的解析较复杂;③受溶剂的影响和限制很大。目前ESI主要用于亲水生物大分子的分析,较少用于疏水生物样品的分析。总体来说,MALDI和ESI各有长处,有各自的适用范围,是两种互补的技术。 (3)ESI的技术发展:近年来,ESI也有许多新的技术发展。液相色谱与电喷雾质谱连用(LC—ESI—
[color=blue][font=楷体_GB2312][b][size=4]本资料为今年一月的资料!作者是果得安![/size]蛋白质组学技术在中药研究中的应用[/b][/font][/color]
国家蛋白质科学上海设施/国家蛋白质科学中心(上海)(筹)公开招聘自动化控制系统工程师国家蛋白质科学研究上海设施是国家重大科技基础设施,是国家级蛋白质科学研究平台;在设施建设基础上,依托中国科学院上海生命科学研究院,委托生物化学与细胞生物学研究所(简称SIBCB)负责筹建成立并管理国家蛋白质科学中心(上海)(筹), 负责设施的运行管理。中心在筹建期间,办公地点设于生化与细胞所(上海市岳阳路320号);中心在建成运行期间,办公地点设于浦东新区张江高科技园区中区西部(上海市海科路333号)。中心定位于:支撑国家蛋白质上海设施建设的建设,衔接该设施的运行;聚集培养生命科学与生物技术特别 是蛋白质研究的人才,提升国家蛋白质研究能力;进而促进我国蛋白质基础研究的飞跃发展。中心将立足于国家生命科学与生物技术及相关研究领域雄厚的研究基础和创新实力,成为兼具蛋白质科学研究、技术及成果的转化、集成和应用平台的国家级的重要科学研究单元。国家蛋白质科学中心(上海)(筹)现因工作扩展的需要,公开招聘自动化控制系统工程师一名。一、岗位职责:参与国家蛋白质科学中心(上海)(筹)在上海同步辐射光源5线6站的建设、运行和管理,充分理解同步辐射光束线站的工作内容和线站用户的实际需求,完成线站自动化控制程序的设计、开发和维护。二、任职条件:1、本科以上学历,有丰富的 Unix/Linux 平台下的工作经验,熟悉 Unix/Linux 工作环境,习惯于在 Unix/Linux 平台下工作。有大量的源代码的阅读经验。2、有丰富的 C/C++ 开发经验。熟悉 Socket 编程和多线程编程。3、良好的英文表达能力。能独立完成项目调研,设计和开发工作。4、有以下背景或经验者优先考虑:有大型系统开发经验者和硬件开发经验者;有软件界面开发经验者;有网络程序开发经验者;熟悉 Tcl/Tk 语言者;有 Unix/Linux 系统管理经验者。5、具有良好的人际关系和团队协作精神,工作努力,作风踏实,责任心强。6、身体健康,能长期稳定工作。 三、招聘方式及程序 1、应聘材料:([back=whi
为探究生物进程的分子机制,需要确定介导这个过程的蛋白质-蛋白质间的相互作用。研究蛋白质间相互作用的主要技术总结如下:一、酵母双杂交系统酵母双杂交系统是当前广泛用于蛋白质相互作用组学研究的一种重要方法。其原理是当靶蛋白和诱饵蛋白特异结合后,诱饵蛋白结合于报道基因的启动子,启动报道基因在酵母细胞内的表达,如果检测到报道基因的表达产物,则说明两者之间有相互作用,反之则两者之间没有相互作用。将这种技术微量化、阵列化后则可用于大规模蛋白质之间相互作用的研究。在实际工作中,人们根据需要发展了单杂交系统、三杂交系统和反向杂交系统等。Angermayr等设计了一个SOS蛋白介导的双杂交系统。可以研究膜蛋白的功能,丰富了酵母双杂交系统的功能。此外,酵母双杂交系统的作用也已扩展至对蛋白质的鉴定。二、噬茵体展示技术在编码噬菌体外壳蛋白基因上连接一单克隆抗体的DNA序列,当噬菌体生长时,表面就表达出相应的单抗,再将噬菌体过柱,柱上若含目的蛋白,就会与相应抗体特异性结合,这被称为噬菌体展示技术。此技术也主要用于研究蛋白质之间的相互作用,不仅有高通量及简便的特点,还具有直接得到基因、高选择性的筛选复杂混合物、在筛选过程中通过适当改变条件可以直接评价相互结合的特异性等优点。目前,用优化的噬菌体展示技术,已经展示了人和鼠的两种特殊细胞系的cDNA文库,并分离出了人上皮生长因子信号传导途径中的信号分子。三、等离子共振技术表面等离子共振技术(SurfacePlasmonResonance,SPR)已成为蛋白质相互作用研究中的新手段。它的原理是利用一种纳米级的薄膜吸附上“诱饵蛋白”,当待测蛋白与诱饵蛋白结合后,薄膜的共振性质会发生改变,通过检测便可知这两种蛋白的结合情况。SPR技术的优点是不需标记物或染料,反应过程可实时监控。测定快速且安全,还可用于检测蛋白一核酸及其它生物大分子之间的相互作用。四、荧光能量转移技术荧光共振能量转移(FRET)广泛用于研究分子间的距离及其相互作用;与荧光显微镜结合,可定量获取有关生物活体内蛋白质、脂类、DNA和RNA的时空信息。随着绿色荧光蛋白(GFP)的发展,FRET荧光显微镜有可能实时测量活体细胞内分子的动态性质。提出了一种定量测量FRET效率以及供体与受体间距离的简单方法,仅需使用一组滤光片和测量一个比值,利用供体和受体的发射谱消除光谱间的串扰。该方法简单快速,可实时定量测量FRET的效率和供体与受体间的距离,尤其适用于基于GFP的供体受体对。五、抗体与蛋白质阵列技术蛋白芯片技术的出现给蛋白质组学研究带来新的思路。蛋白质组学研究中一个主要的内容就是研究在不同生理状态下蛋白水平的量变,微型化,集成化,高通量化的抗体芯片就是一个非常好的研究工具,他也是芯片中发展最快的芯片,而且在技术上已经日益成熟。这些抗体芯片有的已经在向临床应用上发展,比如肿瘤标志物抗体芯片等,还有很多已经应用再眼就的各个领域里。六、免疫共沉淀技术免疫共沉淀主要是用来研究蛋白质与蛋白质相互作用的一种技术,其基本原理是,在细胞裂解液中加入抗兴趣蛋白的抗体,孵育后再加入与抗体特异结合的结合于Pansobin珠上的金黄色葡萄球菌蛋白A(SPA),若细胞中有正与兴趣蛋白结合的目的蛋白,就可以形成这样一种复合物:“目的蛋白—兴趣蛋白—抗兴趣蛋白抗体—SPA\|Pansobin”,因为SPA\|Pansobin比较大,这样复合物在离心时就被分离出来。经变性聚丙烯酰胺凝胶电泳,复合物四组分又被分开。然后经Westernblotting法,用抗体检测目的蛋白是什么,是否为预测蛋白。这种方法得到的目的蛋白是在细胞内天然与兴趣蛋白结合的,符合体内实际情况,得到的蛋白可信度高。但这种方法有两个缺陷:一是两种蛋白质的结合可能不是直接结合,而可能有第三者在中间起桥梁作用;二是必须在实验前预测目的蛋白是什么,以选择最后检测的抗体,所以,若预测不正确,实验就得不到结果,方法本身具有冒险性。七、pull-down技术蛋白质相互作用的类型有牢固型相互作用和暂时型相互作用两种。牢固型相互作用以多亚基蛋白复合体常见,最好通过免疫共沉淀(Co-IP)、Pull-down技术或Far-western法研究。Pull-down技术用固相化的、已标记的饵蛋白或标签蛋白(生物素-、PolyHis-或GST-),从细胞裂解液中钓出与之相互作用的蛋白。通过Pull-down技术可以确定已知的蛋白与钓出蛋白或已纯化的相关蛋白间的相互作用关系,从体外传路或翻译体系中检测出蛋白相互作用关系。