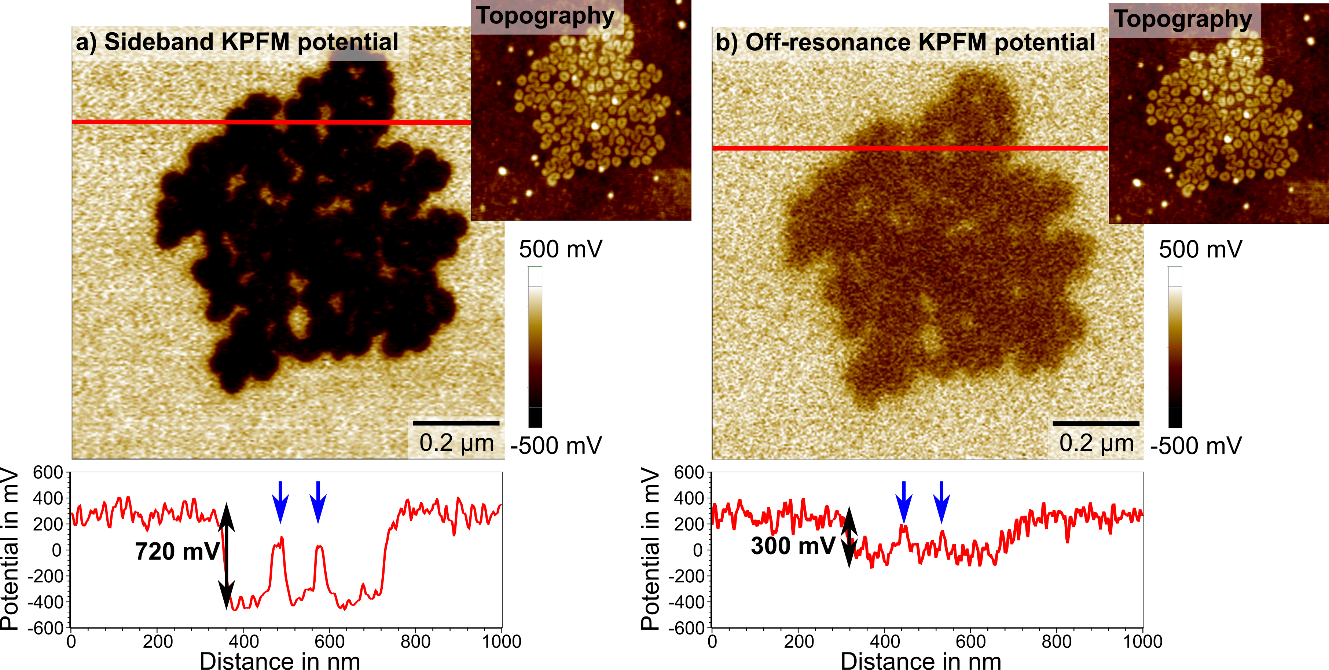
AFM技术文章:通过边带KPFM(Sideband KPFM)对分子聚集体进行电势成像
充分发挥潜力通过边带KPFM对分子聚集体进行电势成像Ilka M. Hermes, Andrea CerretaPark Systems Europe GmbH, Mannheim, Germany 功函数是一种材料特性,可用于区分复合材料中的单一成分或用于区分样品与基体。开尔文探针力显微镜(Kelvin probe force microscopy,KPFM)能利用已知的探针功函数,以纳米分辨率去成像样品表面功函数分布。在这里,我们介绍了Park Systems 研究型原子力显微镜中新开发的边带KPFM(Sideband KPFM)。边带KPFM显著提高了电势的灵敏度和空间分辨率,从而提高了KPFM测量的准确性和可靠性。 半氟化烷烃由两个链段组成–(CF2)xF和(CH2)yH 嵌段。FxHy 在水中和固体基质上以不同的形态自组装。因此,对半氟化烷烃(如F14H20)的研究有助于对自组装的一般理解。由于F14H20的电偶极子导致F14H20与衬底之间存在明显的表面电势差,所以开尔文探针力显微镜(KPFM)非常适合于自组装F14H20结构的纳米级可视化研究。 KPFM是一种扫描探针显微镜技术,它能同时捕捉样品的表面形貌和表面电势。对于KPFM,振荡的导电探针在扫描样品表面的同时会施加交流电压,用来检测由表面电势局部变化引起的针尖和样品之间的静电力变化。为了最小化所侦测到的静电力,外加直流偏压可以抵消扫描的每个点上针尖和样品之间的接触电势差。基于外加直流偏压,在KPFM信号中重构了样品的表面电势分布。如果已知导电探针的功函数,那么电势分布就可以转换为样品的功函数分布。静电力的检测方法决定了KPFM中表面电势的分辨率和精度。 在非共振KPFM中,交流电压以远离悬臂共振的频率调制静电力,用于形貌成像(图1a)。然后通过交流频率下的振幅来检测力。通过施加与针尖和样品之间的电势差所相匹配的直流偏压,可以消除交流频率下的振幅,从而消除静电力。然而,KPFM信号对长程力的依赖性降低了测量的灵敏度,因为样品和悬臂之间的非局部相互作用可以叠加在局部信号上。 对于边带KPFM,我们采用低频交流电压(2-5kHz)来调制静电力梯度。调制力梯度引入了悬臂共振左右两侧的频率边带(图1b)。与非共振KPFM类似,边带KPFM通过施加与电势差相匹配的直流偏置来抵消这些边带的振幅。通过检测短距离的力梯度来取代长程力梯度,可以减小长距离串扰,提高横向分辨率和局部电势灵敏度。图1:非共振KPFM(a)和边带KPFM(b)的频谱示意图。边带KPFM检测电极阵列在F14H20上进行测量之前,为了测试边带KPFM的电势分辨率和精度,我们在金电极阵列的相邻电极上施加了不同的电压(0V和-2V)(图2a)。图2b中样品形貌和边带KPFM电势的叠加说明了在两个电极上检测到的不同电势:左侧电极显示约0V的亮电势对比度,右侧电极显示约-2V的暗电势对比度。图2c是更详细的分析电势图像的线轮廓。在这里,我们发现测得的电势与外加电压是一致的。因此,我们检测到两个相邻电极之间存在2V压差,以及从电极到基板的急剧过渡。因此,我们证明了边带KPFM能够以很高的电势灵敏度和空间分辨率捕获施加在样品上的全电压。图2: a)电压分别为0和-2V的金电极阵列。b) 边带KPFM电势和形貌的三维叠加显示了两个电极的两种不同电势随外加电压的变化。c) 边带KPFM电势沿红线分布在两个电极上,表明测得的电位与外加电压一致,空间分辨率高。F14H20分子聚集体的KPFM研究 为了比较边带KPFM和更常用的非共振KPFM,我们绘制了半氟化烷烃(F14H20)自组装聚集体的表面电势分布图。在这里,分子的电偶极子在聚集体和亚硝酸盐之间引入了一个显著的电位偏移。图3:使用非共振和边带KPFM对相同的F14H20成像。横截面(红色)可以体现边带KPFM的横向和电势分辨率明显提高。 非共振和边带KPFM测量结果表明,边带KPFM的空间分辨率和电势分辨率都有所提高。对于边带KPFM,我们观察到基板和F14H20之间的潜在对比度为700-750mv,以及确定的横向分辨率,甚至可以成像聚集体中的小间隙。另一方面,非共振KPFM显示大约300mv的电势差,表明局部电位灵敏度较低。此外,边带KPFM捕获的清晰边缘在非共振KPFM中模糊,突出了边带KPFM优越的空间分辨率。 F14H20分子聚集体的柔软性对扫描探针技术的表征提出了新的挑战。然而,边带和非共振KPFM可以与Park Systems的非接触模式相结合,从而允许对这些软分子结构进行稳定的形貌成像。总结 边带KPFM,可扩展在Park NX研究型设备中,对测量如F14H20类似的软样品以及半导体和金属材料提供准确的表面电势研究。对静电力梯度的依赖性显著提高了横向分辨率和电势灵敏度,使边带KPFM成为纳米尺度表面电势定量表征的理想技术。Source:1. Silva, G. M. C., Morgado, P., Lourenço, P., Goldmann, M. & Filipe, E. J. M. Spontaneous self-assembly and structure of perfluoroalkylalkane surfactant hemimicelles by molecular dynamics simulations. Proc. Natl. Acad. Sci. 116, 14868 LP – 14873 (2019).2. Abed, A. El, Fauré, M.-C., Pouzet, E. & Abillon, O. Experimental evidence for an original two-dimensional phase structure: An antiparallel semifluorinated monolayer at the air-water interface. Phys. Rev. E 65, 51603 (2002).3. Zerweck, U., Loppacher, C., Otto, T., Grafström, S. & Eng, L. M. Accuracy and resolution limits of Kelvin probe force microscopy. Phys. Rev. B 71, 125424 (2005).