
[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2023/11/202311151020407403_2408_5604214_3.png!w690x690.jpg[/img] 乳品中蛋白质含量检测仪在食品行业中是非常有用的。蛋白质是乳制品中的重要成分之一,对乳品的品质和营养价值有着重要的影响。因此,定期检测乳品中的蛋白质含量对于确保产品质量、合规性和符合标准非常重要。 以下是一些使用乳品中蛋白质含量检测仪的优点: 质量控制: 通过定期检测蛋白质含量,生产者可以确保乳品的一致性和高质量。这对于满足产品标准和客户期望非常重要。 合规性: 食品行业有严格的法规和标准,涉及到产品中营养成分的声明。通过使用蛋白质检测仪,生产者能够确保其产品符合相关法规和标准,避免违规问题。 生产效率: 自动化的蛋白质检测仪器可以提高生产效率,减少人工操作的变数,同时在更短的时间内提供准确的结果。 节约成本: 定期检测蛋白质含量可以帮助生产者及时调整生产工艺,防止产品质量下降。这有助于避免废品产生,从而节约成本。 产品开发: 对于食品生产商来说,了解乳品中蛋白质含量的变化可以为产品开发提供有用的信息。根据这些数据,可以调整配方以获得所需的蛋白质含量。 总体而言,乳品中蛋白质含量检测仪在确保产品质量、合规性以及提高生产效率方面发挥着重要的作用。
[font='Times New Roman'][font=宋体]蛋白质是复杂的含氮有机化合物,不同蛋白质的含氮量不同,测定蛋白含量一般采用凯氏定氮法,但该方法操作步骤繁琐,消耗试剂(如浓硫酸、氢氧化钠等),检测时间长。近年来多采用蛋白质分析仪进行测定,但仍需要对样品做复杂的预处理,费时费力。采用[/font][/font][font=宋体][url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]分析技术[/font][font='Times New Roman'][font=宋体]可缩短检测时间,可快速预测发酵产物中的蛋白质含量,不仅可以避免因为时效性差而引起的目标产物产量不稳定,还可以防止因为外界环境变化引起的蛋白质失活变性。同理,发酵的其他目标产物,如抗生素、维生素、有机酸等,也可以利用[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]来快速预测目标产物含量。[/font][/font]

[size=16px] 食品蛋白质检测仪通常使用一系列的化学、生物化学或物理方法来检测乳制品中的蛋白质含量。以下是一种可能的检测过程: 样品制备: 从乳制品中取得样品,通常需要将样品进行处理,以确保蛋白质在检测过程中能够充分释放和反应。 蛋白质提取: 样品中的蛋白质需要从其他成分中分离出来。这可能涉及到样品的离心、过滤和/或溶解等步骤,以获得含有蛋白质的提取物。 显色/反应: 蛋白质的浓度可以通过与特定试剂发生化学反应或形成复合物来测量。例如,比目鱼法(Bradford法)或比二巴脱酰基试剂(BCA法)都是常用于蛋白质浓度测定的方法。这些试剂与蛋白质反应后会产生颜色变化,颜色的强度可以与蛋白质的浓度成正比。 分光光度测量: 使用分光光度计来测量显色产物的吸光度,从而确定蛋白质的浓度。通常,会建立一个标准曲线,其中包含已知浓度的蛋白质标准样品,用于校准测量结果。 计算浓度: 通过比较待测样品的吸光度与标准曲线上的数据,可以计算出待测样品中蛋白质的浓度。 需要注意的是,不同类型的食品蛋白质检测仪可能会采用不同的方法和试剂,具体的步骤和操作可能会有所不同。此外,为了获得准确的结果,操作者需要在操作过程中遵循标准操作规程,并确保仪器的准确校准和维护。最终结果的准确性也可能会受到样品的处理、试剂的质量以及操作技术等因素的影响。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2023/08/202308291345517046_7349_6098850_3.png!w690x690.jpg[/img][/size]
[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/03/202403130927073834_7048_5604214_3.jpg!w690x690.jpg[/img] 乳品中蛋白质含量检测仪是一种高端的科学仪器,专门用于精确测量乳品中的蛋白质含量。这一设备结合了现代光学、电子技术和生物化学的先进成果,通过特定的检测原理和方法,能够快速、准确地提供乳品中蛋白质含量的数据。 乳品中蛋白质含量检测仪在乳品生产、质量控制和食品安全等领域具有广泛的应用。在生产过程中,它可以实时监控原料乳和成品乳的蛋白质含量,确保产品质量的稳定。同时,在食品安全监管中,它也能发挥关键作用,通过快速检测蛋白质含量,判断乳品是否合格,保障消费者的健康权益。 此外,该仪器还具备自动化、智能化等特点,能够减少人工操作误差,提高检测效率。其精准的检测数据,也为乳品企业的产品研发、工艺优化和市场推广提供了有力支持。 总之,乳品中蛋白质含量检测仪是一种集现代科技之大成的先进仪器,它在乳品产业中的广泛应用,不仅提升了产品质量,也推动了行业的科技进步和可持续发展。
最近使用新买的便携式近红外设备,对酶力肽进行了蛋白质的湿化学方法检测,然后对样品光谱进行采集,通过定量分析模型的建立、优化,尝试对样品进行回归测定。蛋白质采用凯氏定氮法,按同一标准,粉碎蛋白有一定差异的样品(同一粉碎机、粉碎时间),测定出样品蛋白质含量的真值:70-90%(主要是含水量不同造成的差异)。光谱采集分粉碎样品和原始样品两种类型,分别建模。结果:总体不错。但有几个问题需要大家注意。1. 粒度对模型和检测结果影响非常大,一定要粉碎一致。不同粒度下建立的模型检测结果误差很大,尤其是未粉碎的,误差更大。粉碎的样品结果一致性很好2.由于采用漫发射光谱,光源直接贴近样品照射,同一位点进行定量检测时如果不移动,每次的检测结果都会变化,但按绝对值增大约1%的幅度增加。我感觉可能与长期一直照射的情况下,样品内部温度发生变化导致水分发生移动,或漫反射的能量加强导致检测结果不稳定。但哪个是主要原因呢???
摘要:采用凯氏法测酱油中的蛋白质含量是国标推荐方法。关键词:全自动定氮仪、消化炉、酱油蛋白质含量引言:酱油等调味品的质量是牵涉到千家万户的日常消费品,酱油中蛋白质含量是酱油指标中重要指标.高等级的酱油含有较高的蛋白质含量。见表二和表三。 在酱油等日常消耗品也存在用色素调制,来糊弄消费者,损害消费者的健康。为此我们使用上海沛欧全自动定氮仪SKD-2000(采用国际通用的颜色法判断、国内领先、具有多项专利技术)红外石英辐射消化炉SKD-08S2.(获得绿色仪器奖和节能仪器奖)对二款酱油进行蛋白质含量检测。 前言:按GB18186-2000 酿造酱油 范围:本标准适用于第3章所指的酿造酱油。 参考文献: 凯氏法原理:酱油样品在浓硫酸和催化剂硫酸铜、硫酸钾高温下,把有机的细胞结构破坏,把氮元素和硫酸反应产生硫酸铵,(为了使得样品消化时不产生挂壁,必须采用样品孔间温差小和带程序升温功能的消化炉,否则会产生挂壁现象,导致消化失败)消化完成后,需要将样品冷却到40℃左右,再把消化管放入定氮仪上。仪器对消化管内自动添加稀释液、碱,反应杯内自动添加硼酸和显色剂。对消化管内样品加热蒸馏,逸出氨气和水蒸气混合气体,冷却成氨水流到反应杯内生成硼酸氨,同时用标准硫酸进行滴定,直到蒸馏结束和滴定到终点。仪器自动计算酱油中蛋白质含量(蛋白质系数取5.71)。仪器设备和试剂[font='Times New
食品中蛋白质含量测定仪的优点主要体现在以下几个方面: 检测速度快:能够在短时间内完成大量样品的检测,大大提高了检测效率,使食品生产厂家能够快速获取检测结果,及时调整生产策略。 操作简单:仪器操作简单易用,用户只需按照说明书进行操作即可完成检测,无需复杂的操作步骤和专业技能,降低了操作难度。 准确度高:采用先进的检测技术,如光谱技术、化学分析方法等,能够确保测量结果的准确性和可靠性,为食品生产厂家提供准确的数据支持。 应用广泛:适用于各类食品中蛋白质含量的检测,如乳制品、肉制品、豆制品等,满足了不同食品生产厂家的检测需求。 安全性高:使用食品中蛋白质含量测定仪可以避免直接接触样品,降低了交叉感染的风险,保障了检测人员的安全。 智能化程度高:一些先进的食品中蛋白质含量测定仪还采用了安卓智能操作系统,具有网线连接、Wi-Fi联网上传、GPRS无线远传等功能,可以快速上传数据,实现远程监控和管理。 稳定性强:仪器具有稳定的工作性能和较长的使用寿命,保证了长期使用的可靠性。 综上所述,食品中蛋白质含量测定仪具有检测速度快、操作简单、准确度高、应用广泛、安全性高、智能化程度高和稳定性强等优点,为食品生产和质量控制提供了有力的支持。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405151149314403_9648_4214615_3.jpg!w690x690.jpg[/img]
请教一个问题:考马斯亮蓝法测总蛋白质含量,目标物中总蛋白含量大概在0.0001-0.06mg/g范围内,有合适的仪器推荐吗? 目前有一台普通的721型可见分光光度计,试测效果不佳。
具体操作,大蒜浸提液在90℃下水浴2h,检测其中一种水溶性非蛋白质氨基酸的含量,该物质的出峰时间是5.14min。在这个图上看不出峰来,是不是要除杂,或者是采取柱前衍生化法。跪求给位色谱前辈指导!
[align=left][font=仿宋]考马斯亮蓝法检测样品中蛋白质含量需要的G250染液和BSA标准蛋白需要单独购买吗?有配套的吗?[/font][/align][font=仿宋][font=仿宋][/font][/font]
[size=6][b]生产豆奶检测蛋白质含量用那类定氮仪最合适啊[/b][/size]
PS1利用基质辅助激光解吸电离-飞行时间(MALDI-TOF)技术来表征生物分子。样品溶于固定的底物中形成晶体,用激光脉冲使其离子化,离子被加速后通过飞行管时分离,所有离子均可被检测。系统包括三个组成部件:样品点样制备工作站(SymBiot 1)、生物质谱工作站(Voyager-DE PRO)和自动化分析软件(AutoMS-Fit)。SymBiot1 是一个自动样品处理系统,支持亚微升级微量点样,具有快速省时、重现性好的特点;Voyager-DE PRO是为蛋白质组研究专门设计的自动飞行时间质谱分析系统,配有AB公司之专利—延迟检测技术,具有高分辨率、质荷比宽等特点;AutoMS软件可以批处理方式或实时动态方式检索Protein Prospector蛋白数据库或您指定的蛋白数据库,查询参数可以任意设定,检索结果以Microsoft Access格式分类编号及储存。 PS 1技术平台建立伊始便受到了许多蛋白质课题研究组的关注。中国科学院上海生物化学研究所戚正武院士课题组从猪肝中提取某一活性蛋白组分,该组分理化性质不清楚,天然含量十分低,并无相关文献报道。用HPLC分离以后对活性组分的成分不能确定。上海基康生物技术有限公司运用PS 1系统对HPLC分离后的活性组分作了质谱分析,仅在一个工作日内就精确确定该组分由分子量极为相近的几种蛋白质构成,分子量精确度达到10 ppm。后经HPLC再次细分(洗脱梯度增加了2.5倍),证实了质谱的结论。此活性组分曾滤过1kD分子筛,基康的质谱数据纠正了研究人员过去对该活性组分分子量的误判,为研究人员明确实验方向、优化实验步骤提供了强有力的依据。 PS1除了可以进行生物大分子的精确分子量测定,还可用于蛋白的肽指纹图谱分析(peptide mass fingerprint,PMF),提供相关生物信息学服务,并且还可以利用源后衰变(Post Source Decay,PSD)技术来获得样品的MS/MS数据,以得到一级结构信息。PSD方法通常增加了激发激光的功率,使其超过产生一般肽指纹谱图所需功率的阈值,过剩的能量使前体离子在源内离子化之后发生裂解,产生一系列碎片离子,在反射器的作用下,最终可以得到一张连续的碎片离子图谱。经特定的软件分析后,即可在数据库中检索到肽段的氨基酸序列。利用PSD分析技术,还可以对磷酸化,糖基化等翻译后修饰进行定位分析,同样也可以鉴定产生翻译后修饰肽段的蛋白质。Neville et al.(1997)将这一方法成功的用于磷酸肽的序列分析。作为重要的蛋白质鉴定手段之一,PS1的精确度可以达到10 ppm,灵敏度为fmol,分子量检测范围可达到500 kDa,每天可自动分析40-100个样品,适用于大规模“蛋白质组学”研究。
疑似燕窝样品,可以通过检测蛋白质含量定性是不是燕窝吗?王望老师不吝赐教
用[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]技术检测牛奶中脂肪、蛋白质及乳糖含量利用近红外漫反射光谱1100-1700nm快速检测牛奶中脂肪、蛋白质及乳糖含量,采用偏最小二乘法回归建立了测量光谱与牛奶主要成分浓度之间的校正模型,并对其重复性进行了研究,进而探讨了非线性校正方法径向基(RBFN)函数网络的可行性。并与PLS线性校正模型进行对比,探讨了PLS校正模型如何提高预测精度的相关问题。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=69231]用[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]技术检测牛奶中脂肪、蛋白质及乳糖含量[/url]
食品中蛋白质含量测定仪是用于快速、准确地测量食品中蛋白质含量的专业仪器。这种仪器基于各种化学或物理方法,如凯氏定氮法、双缩脲法、考马斯亮蓝法(Bradford法)或紫外分光光度法等,来测定食品中蛋白质的含量。 以下是关于食品中蛋白质含量测定仪的一些详细信息: 工作原理 凯氏定氮法:这是一种经典的蛋白质测定方法。样品中的蛋白质在催化剂的作用下与硫酸共热消化,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即可计算出样品的蛋白质含量。 双缩脲法:在碱性溶液中,双缩脲(尿素加热至180℃左右生成的二聚体)与铜离子形成紫色络合物,该络合物的颜色深浅与蛋白质含量成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。 考马斯亮蓝法(Bradford法):考马斯亮蓝G-250染料在酸性溶液中与蛋白质结合后,在595nm处有最大光吸收,其光吸收值与蛋白质含量成正比。因此,可用于蛋白质的定量测定。 紫外分光光度法:蛋白质中常含有酪氨酸、色氨酸等苯环结构,在280nm的紫外波段有较强的吸收峰,其吸光度与蛋白质含量成正比。这种方法操作简单、快速,但灵敏度较低,只适合测定蛋白质含量较高的样品。 应用领域 食品质量检测:蛋白质是食品中的重要营养成分,其含量是评价食品质量的重要指标之一。食品中蛋白质含量测定仪可用于检测各类食品(如肉类、奶类、蛋类、豆类、谷物等)中的蛋白质含量,为食品质量检测提供数据支持。 食品科学研究:在食品科学研究中,蛋白质含量测定仪可用于分析不同食品原料、加工工艺对蛋白质含量的影响,以及蛋白质在食品加工过程中的变化等。 注意事项 在使用蛋白质含量测定仪进行测试之前,需要仔细阅读产品说明书,了解仪器的使用方法、操作步骤及注意事项。 确保样品准备过程符合标准要求,避免样品污染或损坏导致检测结果不准确。 定期对仪器进行维护和校准,确保检测结果的准确性和可靠性。 在使用过程中注意安全防护措施,避免对人体造成伤害或对环境造成污染。 总之,食品中蛋白质含量测定仪是食品检测领域的重要工具之一,能够快速、准确地测定食品中的蛋白质含量,为食品质量控制和科学研究提供有力支持。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405151126410832_3840_4214615_3.jpg!w690x690.jpg[/img]
大家好,请问近红外是否可以测定蛋白质亚基含量,就是想建立SDS-PAGE测定的蛋白质亚基的快速检测方法,请各位指点,谢谢!
蛋白质分子中,酪氨酸、苯丙氨酸和色氨酸残基的苯环含有共轭双键,使蛋白质具有吸收紫外光的性质。吸收高峰在280nm处,其吸光度(即光密度值)与蛋白质含量成正比。此外,蛋白质溶液在238nm的光吸收值与肽键含量成正比。利用一定波长下,蛋白质溶液的光吸收值与蛋白质浓度的正比关系,可以进行蛋白质含量的测定。紫外吸收法简便、灵敏、快速,不消耗样品,测定后仍能回收使用。低浓度的盐,例如生化制备中常用的(NH4)2SO4等和大多数缓冲液不干扰测定。特别适用于柱层析洗脱液的快速连续检测,因为此时只需测定蛋白质浓度的变化,而不需知道其绝对值。此法的特点是测定蛋白质含量的准确度较差,干扰物质多,在用标准曲线法测定蛋白质含量时,对那些与标准蛋白质中酪氨酸和色氨酸含量差异大的蛋白质,有一定的误差。故该法适于用测定与标准蛋白质氨基酸组成相似的蛋白质。若样品中含有嘌呤、嘧啶及核酸等吸收紫外光的物质,会出现较大的干扰。核酸的干扰可以通过查校正表,再进行计算的方法,加以适当的校正。但是因为不同的蛋白质和核酸的紫外吸收是不相同的,虽然经过校正,测定的结果还是存在一定的误差。此外,进行紫外吸收法测定时,由于蛋白质吸收高峰常因pH的改变而有变化,因此要注意溶液的pH值,测定样品时的pH要与测定标准曲线的pH相一致。1.280nm的光吸收法因蛋白质分子中的酪氨酸、苯丙氨酸和色氨酸在280nm处具有最大吸收,且各种蛋白质的这三种氨基酸的含量差别不大,因此测定蛋白质溶液在280nm处的吸光度值是最常用的紫外吸收法。测定时,将待测蛋白质溶液倒入石英比色皿中,用配制蛋白质溶液的溶剂(水或缓冲液)作空白对照,在紫外分光度计上直接读取280nm的吸光度值A280。蛋白质浓度可控制在0.1~1.0mg/ml左右。通常用1cm光径的标准石英比色皿,盛有浓度为1mg/ml的蛋白质溶液时,A280约为1.0左右。由此可立即计算出蛋白质的大致浓度。许多蛋白质在一定浓度和一定波长下的光吸收值(A1%1cm)有文献数据可查,根据此光吸收值可以较准确地计算蛋白质浓度。下式列出了蛋白质浓度与(A1%1cm)值(即蛋白质溶液浓度为1%,光径为1cm时的光吸收值)的关系。文献值A1%1cm,λ称为百分吸收系数或比吸收系数。蛋白质浓度= (A280´10 )/ A1%1cm,280nm (mg/ml)(Q 1%浓度»10mg/ml)
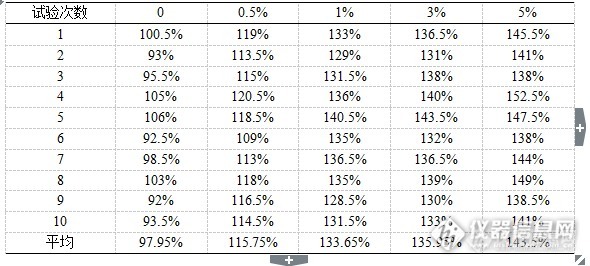
[b]中文摘要:目的[/b] 确立因子类血液制品中蛋白质含量对效价检测结果的影响,从而完善因子类血液制品效价检测的方法。[b]方法 [/b]选取不同蛋白质浓度梯度的稀释液对同一供试品进行稀释来确定蛋白质影响的规律。 [b]结果 [/b]建立起人凝血因子Ⅷ、人凝血酶原复合物的全自动血凝仪因子效价检测方法,根据效价检测反应体系中蛋白浓度对检测结果的影响,建立因子类血液制品效价全自动血凝仪检测的方法。[b]结论 [/b]建立的两种稀释方法均消除了样品中蛋白质含量的不同对检测结果的影响,提高了检测的准确性,不但可以适用于现在产品的效价检测,而且适用于随着生产工艺的提升生产的更高纯度、低蛋白含量的FⅧ和PCC,同时也是对中国药典标准的补充。[b]关键词[/b]:人凝血因子Ⅷ;人凝血酶原复合物;效价;蛋白含量 人凝血因子Ⅷ、人凝血酶原复合物、人凝血因子Ⅸ等因子类血液制品,是以健康人血浆为原料,经分离纯化和病毒灭活制成,在临床上主要用于各种凝血因子缺乏的治疗,这些因子类血液制品的凝血因子效价是药品有效性的指标,凝血因子效价的测定也是药品质量检测中的关键检测项目。血液制品生产企业及各级检测机构一般采用全自动血凝仪并按照仪器使用说明来进行因子效价的检测,然而在不同检测方法结果比对中,发现全自动血凝仪检测结果与中国药典中一期法的检测结果在部分因子效价检测中存在检测差异,差异可能是样品稀释中使用的稀释液的蛋白含量不同引起的,故本课题主要研究因子类血液制品中蛋白质含量对效价检测结果影响。通过蛋白含量对因子效价检测影响的研究建立起的全自动血凝仪因子效价检测方法,消除了产品本身性质的影响,可以准确进行因子效价的测定,方法的建立不但可以准确控制因子类血液制品的质量,保证生产企业持续稳定生产出质量均一的药品,而且可以减少因子类产品在临床使用中的风险。[b]1 实验仪器与试剂[b]1.1 仪器[/b][/b]Stago-compact全自动血凝仪(法国Diagnostica Stago公司),漩涡振荡器(美国Thermo Scientific公司)。[b][b]1.2 试剂[/b][/b]人凝血因子Ⅷ缺乏血浆(法国Diagnostica Stago公司),人凝血因子Ⅸ缺乏血浆(法国Diagnostica Stago公司),APTT试剂(法国Diagnostica Stago公司),Owren-Koller(稀释液)(法国Diagnostica Stago公司),0.025 mol/L氯化钙溶液(法国Diagnostica Stago公司),Desorb U(清洗液)(法国Diagnostica Stago公司),人凝血因子Ⅷ国家标准品(批号20100101),人凝血酶原复合物国家标准品(批号20130306),生理氯化钠溶液(石家庄四药有限公司),咪唑(天津市巴斯夫化工有限公司),氯化钠(天津市巴斯夫化工有限公司),枸橼酸钠(台山新宁制药有限公司),人血白蛋白(公司自产)。[b][b]2 方法2.1 人凝血因子Ⅷ不同蛋白质浓度梯度稀释效价测定[/b][/b] 人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 不同蛋白质浓度梯度稀释液制备:选取全自动血凝仪的稀释液Owren-Koller、生理氯化钠溶液、取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合液分别定义为稀释液1、稀释液2、稀释液3。向3种稀释液中分别加入人血白蛋白,使其中人血白蛋白的浓度分别为0、0.5%、1%、3%、5%。 人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用含不同蛋白浓度的稀释液做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.2 人凝血因子Ⅷ人凝血因子缺乏血浆稀释效价测定[/b] [/b]人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用人凝血因子Ⅷ缺乏血浆将其稀释成每1ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用人凝血因子Ⅷ缺乏血浆将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.3 人凝血酶原复合物人凝血因子Ⅸ不同蛋白质浓度梯度稀释效价测定[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 不同蛋白质浓度梯度稀释液制备同2.1。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用含不同蛋白浓度的稀释液做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]2.4 人凝血酶原复合物人凝血因子Ⅸ人凝血因子缺乏血浆稀释效价测定[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用人凝血因子Ⅸ缺乏血浆将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用人凝血因子Ⅸ缺乏血浆将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]3 结果3.1 人凝血因子Ⅷ不同蛋白质浓度梯度稀释效价测定结果[/b][/b] 选取2015ZK0801批人凝血因子Ⅷ进行了不同蛋白质浓度梯度稀释效价测定,不同浓度稀释液分别测定10次。人血白蛋白的浓度分别为0、0.5%、1%、3%、5%的稀释液1、稀释液2、稀释液3的效价检测结果分别见表1、2、3,效价检测结果为效价标示量的百分比。[align=center]表1 FⅧ质控品不同蛋白浓度梯度稀释液1检测结果[/align][align=center][img=,590,266]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142017_01_1626619_3.png[/img][/align][align=center]表2 FⅧ质控品不同蛋白浓度梯度稀释液2检测结果 [/align][align=center][img=,586,260]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_01_1626619_3.png[/img][/align][align=center]表3 FⅧ质控品不同蛋白浓度梯度稀释液3检测结果 [/align][align=center][img=,585,261]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_02_1626619_3.png[/img][/align]人凝血因子Ⅷ质控品2015ZK0801批用不同蛋白质浓度梯度的稀释液1、稀释液2、稀释液3稀释效价检测结果平均值用折线图表示,如图1:[align=center]图1 FⅧ质控品不同蛋白质浓度检测结果对比[/align][align=center][img=,548,295]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_03_1626619_3.png[/img][/align] 选取2批国外产人凝血因子Ⅷ和VWF混合制剂进行了不同蛋白质浓度梯度稀释效价测定,人血白蛋白的浓度分别为0、0.5%、1%、3%、5%的稀释液1、稀释液2、稀释液3的效价检测结果见表4、5,效价检测结果为效价标示量的百分比。[align=center]表4 658668A批制剂FⅧ检测结果[/align][align=center][img=,585,99]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142020_01_1626619_3.png[/img][/align][align=center]表5 A3B1814批制剂FⅧ检测结果[/align][align=center][img=,577,97]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142021_01_1626619_3.png[/img][/align]FⅧ效价检测结果用折线图表示,如图2、3:[align=center][img=,563,299]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142029_01_1626619_3.png[/img][/align][align=center]图2 658668A批不同蛋白质浓度检测结果对比[/align][align=center][img=,567,287]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142030_01_1626619_3.png[/img][/align][align=center]图3 A3B1814批不同蛋白质浓度检测结果对比[/align][b][b]3.2 人凝血酶原复合物不同蛋白质浓度梯度稀释效价测定结果[/b][/b] 选取2015ZK0901批人凝血酶原复合物进行了不同蛋白质浓度梯度稀释人凝血因子Ⅸ效价测定,不同浓度稀释液分别测定10次。人血白蛋白的浓度分别为0、0.5%、1%、2%、3%、4%、5%的稀释液1、稀释液2、稀释液3的效价检测结果分别见表6、7、8,效价检测结果为效价标示量的百分比。[align=center]表6 PCC质控品不同蛋白浓度梯度稀释液1检测结果[/align][align=center][img=,583,269]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142031_01_1626619_3.png[/img][/align][align=center]表7 PCC质控品不同蛋白浓度梯度稀释液2检测结果[/align][align=center][img=,586,260]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142031_02_1626619_3.png[/img][/align][align=center]表8 PCC质控品不同蛋白浓度梯度稀释液3检测结果[/align][align=center][img=,593,263]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142043_01_1626619_3.png[/img][/align]人凝血酶原复合物质控品2015ZK0901批用不同蛋白质浓度梯度的稀释液1、稀释液2、稀释液3稀释FⅨ效价检测结果平均值用折线图表示,如图4:[align=center][img=,556,300]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142032_01_1626619_3.png[/img][/align][align=center]图4 PCC质控品不同蛋白质浓度FⅨ检测结果对比[/align][b][b]3.3 人凝血因子Ⅷ人凝血因子缺乏血浆稀释效价测定结果[/b][/b]选取2015ZK0801批人凝血因子Ⅷ进行了人凝血因子缺乏血浆稀释效价测定,共测定10次。效价检测结果见表9,效价检测结果为效价标示量的百分比。[align=center]表9 FⅧ质控品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,579,74]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142032_02_1626619_3.png[/img][/align]选取2批国外产人凝血因子Ⅷ和VWF混合制剂进行了人凝血因子缺乏血浆稀释效价测定。效价检测结果见表10,效价检测结果为效价标示量的百分比。[align=center]表10 国外产品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,578,77]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142036_01_1626619_3.png[/img][/align][b][b]3.4 人凝血酶原复合物人凝血因子Ⅸ人凝血因子缺乏血浆稀释效价测定结果[/b][/b]选取2015ZK0901批人凝血酶原复合物进行了人凝血因子缺乏血浆稀释人凝血因子Ⅸ效价测定,共测定10次。效价检测结果见表11,效价检测结果为效价标示量的百分比。[align=center]表11 PCC质控品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,582,89]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142047_01_1626619_3.png[/img][/align][b][b]4 讨论[/b][/b] 本实验中对人凝血因子Ⅷ和人凝血酶原复合物分别用不同蛋白浓度梯度的稀释液进行了效价测定,另外用人凝血因子缺乏血浆稀释后进行了效价测定。因子效价测定中,稀释液1、稀释液2、稀释液3中加入相同浓度的人血白蛋白后,得到的因子效价检测结果没有差异,说明全自动血凝仪的稀释液Owren-Koller、生理氯化钠溶液、取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合液作为稀释液时没有区别。 人凝血因子Ⅷ、人凝血酶原复合物不同蛋白浓度梯度效价测定时,随着稀释液中蛋白质含量的增高,效价检测结果也不断升高,但在人凝血因子Ⅷ效价测定中,采用蛋白质含量为1%、3%的稀释液时,效价检测结果间均无显著差别,在人凝血酶原复合物人凝血因子Ⅸ效价测定中,采用蛋白质含量为0、0.5%、1%的稀释液时,效价检测结果间均无显著差别。另外,人凝血因子Ⅷ进行人凝血因子缺乏血浆稀释效价测定效价检测结果与采用蛋白质含量为1%、3%的稀释液得到的检测结果也无显著差异,人凝血酶原复合物人凝血因子缺乏血浆稀释人凝血因子Ⅸ效价检测结果与采用蛋白质含量为0、0.5%、1%的稀释液得到的检测结果也无显著差异。另外,国外生产的人凝血因子Ⅷ和VWF的混合制剂FⅧ效价的检测结果及血浆、稀释液的影响同泰邦公司产品一致。[b]参考文献[/b][align=left] 邬杨斌, 余蓉. 凝血因子Ⅸ复合物的研制 . 华西药学杂志, 2000, 15(3):177-179. Pabinger I, Brenner B, Kalina U, et al. Prothrombin complex concentrate(Beriplexw P/N)for emergency anticoagulation reversal: A prospective multinational clinical trial . J Thromb Haemost, 2008, 6(4):622-631. Kiman E, Elela AA, Ramsis N, et al. Evaluation of the coagulation factors activity of Cryosupernatant . Suez Canal Univ Med J, 2003, 6(2):247-258.Tullis JL, Melin M, Jurigian P. Clinical use of human Prothrombin complexes . N Engl J Med, 1965, 73(13):667-674.马莉, 孙盼, 李长清, 等. 去冷沉淀血浆的质量分析 . 中国生物制品学杂志, 2013, 26(1):81-83.魏舒, 时凯, 刘国荣, 等. 冻干人凝血酶原复合物的生产工艺研究 . 中国输血杂志, 2008, 21(10):282-284.Samama CM. Prothrombin complex concentrates: a brief review . Eur J Anaesthesiol, 2008, 25(10):784-789.焦丽华, 代旭兰, 刘文芳. 凝血酶原复合物的制备及其临床应用进展 .中国输血杂志, 2008, 21(9):737-741.[/align][b] [/b]
一、标准曲线一般用分光光度法测物质的含量,先要制作标准曲线,然后根据标准曲线查出所测物质的含量。因此,制作标准曲线是生物检测分析的一项基本技术。二、蛋白质含量测定方法 1. 凯氏定氮法2. 双缩脲法3. Folin-酚试剂法4. 紫外吸收法5. 考马斯亮蓝法三、考马斯亮蓝法测定蛋白质含量—标准曲线制作 (一)试剂: 1. 考马斯亮蓝试剂:考马斯亮蓝G—250 100 mg溶于50 ml 95%乙醇,加入100 ml 85% H3 PO4 ,雍蒸馏水稀释至1000 ml,滤纸过滤。最终试剂中含0.01%(W/V)考马斯亮蓝G—250,4.7%(W/V)乙醇,8.5%(W/V)H3 PO4 。2. 标准蛋白质溶液:纯的牛血清血蛋白,预先经微量凯氏定氮法测定蛋白氮含量,根据其纯度同0.15 mol/LNaCl配制成100 ug/ml蛋白溶液。(二)器材: 1. 722S型分光光度计使用及原理。2. 移液管使用。(三)标准曲线制作: 1. 试管编号0123456100ug/ml标准蛋白(ml)0.00.10.20.30.40.50.60.15mol/L NaCl (ml)10.90.80.70.60.50.4考马斯亮蓝试剂 (ml)5555555摇匀,1h内以1号管为空白对照,在595nm处比色A595nm2. 以A595nm 为纵坐标,标准蛋白含量为横坐标(六个点为10ug、20 ug、30 ug、40 ug、50 ug、60 ug),在坐标轴上绘制标准曲线。(1)利用标准曲线查出回归方程。(2)用公式计算回归方程。(3)或用origin作图 ,测出回归线性方程。即A595nm =a×X( )+6;一般相关系数应过0.999以上,至少2个9以上。(4)绘图时近两使点在一条直线上,在直线上的点应该在直线两侧。(四)蛋白质含量的测定: 样品即所测蛋白质含量样品(含量应处理在所测范围内),依照操作步骤1操作,测出样品的A595nm ,然后利用标准曲线或回归方程求出样品蛋白质含量。一般被测样品的A595nm 值在0.1—0.05之间,所以上述样品如果A595nm 值太大,可以稀释后再测A595nm值,然后再计算。(五)注意事项: 1. 玻璃仪器要洗涤干净。2. 取量要准确。3. 玻璃仪器要干燥,避免温度变化。4. 对照:用被测物质以外的物质作空白对照。蛋白质含量测定实验难度系数 0共 0 人点评打分实验材料结晶牛血清清蛋白 g—球蛋白试剂(盒)Na2CO3酒石酸钾钠蒸馏水硫酸铜钨酸钠钼酸钠磷酸硫酸锂液体溴NaOH酚酞仪器耗材可见光分光光度计旋涡混合器秒表[url=http://www.biomart.cn/equipm
[b]中文摘要:目的[/b] 确立因子类血液制品中蛋白质含量对效价检测结果的影响,从而完善因子类血液制品效价检测的方法。[b]方法 [/b]选取不同蛋白质浓度梯度的稀释液对同一供试品进行稀释来确定蛋白质影响的规律。 [b]结果 [/b]建立起人凝血因子Ⅷ、人凝血酶原复合物的全自动血凝仪因子效价检测方法,根据效价检测反应体系中蛋白浓度对检测结果的影响,建立因子类血液制品效价全自动血凝仪检测的方法。[b]结论 [/b]建立的两种稀释方法均消除了样品中蛋白质含量的不同对检测结果的影响,提高了检测的准确性,不但可以适用于现在产品的效价检测,而且适用于随着生产工艺的提升生产的更高纯度、低蛋白含量的FⅧ和PCC,同时也是对中国药典标准的补充。[b]关键词[/b]:人凝血因子Ⅷ;人凝血酶原复合物;效价;蛋白含量 人凝血因子Ⅷ、人凝血酶原复合物、人凝血因子Ⅸ等因子类血液制品,是以健康人血浆为原料,经分离纯化和病毒灭活制成,在临床上主要用于各种凝血因子缺乏的治疗,这些因子类血液制品的凝血因子效价是药品有效性的指标,凝血因子效价的测定也是药品质量检测中的关键检测项目。血液制品生产企业及各级检测机构一般采用全自动血凝仪并按照仪器使用说明来进行因子效价的检测,然而在不同检测方法结果比对中,发现全自动血凝仪检测结果与中国药典中一期法的检测结果在部分因子效价检测中存在检测差异,差异可能是样品稀释中使用的稀释液的蛋白含量不同引起的,故本课题主要研究因子类血液制品中蛋白质含量对效价检测结果影响。通过蛋白含量对因子效价检测影响的研究建立起的全自动血凝仪因子效价检测方法,消除了产品本身性质的影响,可以准确进行因子效价的测定,方法的建立不但可以准确控制因子类血液制品的质量,保证生产企业持续稳定生产出质量均一的药品,而且可以减少因子类产品在临床使用中的风险。[b]1 实验仪器与试剂[b]1.1 仪器[/b][/b]Stago-compact全自动血凝仪(法国Diagnostica Stago公司),漩涡振荡器(美国Thermo Scientific公司)。[b][b]1.2 试剂[/b][/b]人凝血因子Ⅷ缺乏血浆(法国Diagnostica Stago公司),人凝血因子Ⅸ缺乏血浆(法国Diagnostica Stago公司),APTT试剂(法国Diagnostica Stago公司),Owren-Koller(稀释液)(法国Diagnostica Stago公司),0.025 mol/L氯化钙溶液(法国Diagnostica Stago公司),Desorb U(清洗液)(法国Diagnostica Stago公司),人凝血因子Ⅷ国家标准品(批号20100101),人凝血酶原复合物国家标准品(批号20130306),生理氯化钠溶液(石家庄四药有限公司),咪唑(天津市巴斯夫化工有限公司),氯化钠(天津市巴斯夫化工有限公司),枸橼酸钠(台山新宁制药有限公司),人血白蛋白(公司自产)。[b][b]2 方法 2.1 人凝血因子Ⅷ不同蛋白质浓度梯度稀释效价测定[/b][/b] 人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 不同蛋白质浓度梯度稀释液制备:选取全自动血凝仪的稀释液Owren-Koller、生理氯化钠溶液、取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合液分别定义为稀释液1、稀释液2、稀释液3。向3种稀释液中分别加入人血白蛋白,使其中人血白蛋白的浓度分别为0、0.5%、1%、3%、5%。 人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用含不同蛋白浓度的稀释液做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.2 人凝血因子Ⅷ人凝血因子缺乏血浆稀释效价测定[/b] [/b]人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用人凝血因子Ⅷ缺乏血浆将其稀释成每1ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用人凝血因子Ⅷ缺乏血浆将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.3 人凝血酶原复合物人凝血因子Ⅸ不同蛋白质浓度梯度稀释效价测定[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 不同蛋白质浓度梯度稀释液制备同2.1。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用含不同蛋白浓度的稀释液做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]2.4 人凝血酶原复合物人凝血因子Ⅸ人凝血因子缺乏血浆稀释效价测定[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用人凝血因子Ⅸ缺乏血浆将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用人凝血因子Ⅸ缺乏血浆将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]3 结果3.1 人凝血因子Ⅷ不同蛋白质浓度梯度稀释效价测定结果[/b][/b] 选取2015ZK0801批人凝血因子Ⅷ进行了不同蛋白质浓度梯度稀释效价测定,不同浓度稀释液分别测定10次。人血白蛋白的浓度分别为0、0.5%、1%、3%、5%的稀释液1、稀释液2、稀释液3的效价检测结果分别见表1、2、3,效价检测结果为效价标示量的百分比。[align=center]表1 FⅧ质控品不同蛋白浓度梯度稀释液1检测结果[/align][align=center][/align][align=center][img=,590,266]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142017_01_1626619_3.png[/img][/align][align=center]表2 FⅧ质控品不同蛋白浓度梯度稀释液2检测结果 [/align][align=center][img=,586,260]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_01_1626619_3.png[/img][/align][align=center]表3 FⅧ质控品不同蛋白浓度梯度稀释液3检测结果 [/align][align=center][img=,585,261]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_02_1626619_3.png[/img][/align]人凝血因子Ⅷ质控品2015ZK0801批用不同蛋白质浓度梯度的稀释液1、稀释液2、稀释液3稀释效价检测结果平均值用折线图表示,如图1:[align=center]图1 FⅧ质控品不同蛋白质浓度检测结果对比[/align][align=center][img=,548,295]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_03_1626619_3.png[/img][/align] 选取2批国外产人凝血因子Ⅷ和VWF混合制剂进行了不同蛋白质浓度梯度稀释效价测定,人血白蛋白的浓度分别为0、0.5%、1%、3%、5%的稀释液1、稀释液2、稀释液3的效价检测结果见表4、5,效价检测结果为效价标示量的百分比。[align=center]表4 658668A批制剂FⅧ检测结果[/align][align=center][img=,585,99]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142020_01_1626619_3.png[/img][/align][align=center]表5 A3B1814批制剂FⅧ检测结果[/align][align=center][img=,577,97]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142021_01_1626619_3.png[/img][/align]FⅧ效价检测结果用折线图表示,如图2、3:[align=center][img=,563,299]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142029_01_1626619_3.png[/img][/align][align=center]图2 658668A批不同蛋白质浓度检测结果对比[/align][align=center][img=,567,287]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142030_01_1626619_3.png[/img][/align][align=center][/align][align=center]图3 A3B1814批不同蛋白质浓度检测结果对比[/align][b][b]3.2 人凝血酶原复合物不同蛋白质浓度梯度稀释效价测定结果[/b][/b] 选取2015ZK0901批人凝血酶原复合物进行了不同蛋白质浓度梯度稀释人凝血因子Ⅸ效价测定,不同浓度稀释液分别测定10次。人血白蛋白的浓度分别为0、0.5%、1%、2%、3%、4%、5%的稀释液1、稀释液2、稀释液3的效价检测结果分别见表6、7、8,效价检测结果为效价标示量的百分比。[align=center]表6 PCC质控品不同蛋白浓度梯度稀释液1检测结果[/align][align=center][img=,583,269]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142031_01_1626619_3.png[/img][/align][align=center]表7 PCC质控品不同蛋白浓度梯度稀释液2检测结果[/align][align=center][img=,586,260]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142031_02_1626619_3.png[/img][/align][align=center]表8 PCC质控品不同蛋白浓度梯度稀释液3检测结果[/align][align=center][img=,593,263]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142043_01_1626619_3.png[/img][/align]人凝血酶原复合物质控品2015ZK0901批用不同蛋白质浓度梯度的稀释液1、稀释液2、稀释液3稀释FⅨ效价检测结果平均值用折线图表示,如图4:[align=center][img=,556,300]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142032_01_1626619_3.png[/img][/align][align=center]图4 PCC质控品不同蛋白质浓度FⅨ检测结果对比[/align][b][b]3.3 人凝血因子Ⅷ人凝血因子缺乏血浆稀释效价测定结果[/b][/b]选取2015ZK0801批人凝血因子Ⅷ进行了人凝血因子缺乏血浆稀释效价测定,共测定10次。效价检测结果见表9,效价检测结果为效价标示量的百分比。[align=center]表9 FⅧ质控品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,579,74]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142032_02_1626619_3.png[/img][/align]选取2批国外产人凝血因子Ⅷ和VWF混合制剂进行了人凝血因子缺乏血浆稀释效价测定。效价检测结果见表10,效价检测结果为效价标示量的百分比。[align=center]表10 国外产品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,578,77]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142036_01_1626619_3.png[/img][/align][b][b]3.4 人凝血酶原复合物人凝血因子Ⅸ人凝血因子缺乏血浆稀释效价测定结果[/b][/b]选取2015ZK0901批人凝血酶原复合物进行了人凝血因子缺乏血浆稀释人凝血因子Ⅸ效价测定,共测定10次。效价检测结果见表11,效价检测结果为效价标示量的百分比。[align=center]表11 PCC质控品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,582,89]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142047_01_1626619_3.png[/img][/align][b][b]4 讨论[/b][/b] 本实验中对人凝血因子Ⅷ和人凝血酶原复合物分别用不同蛋白浓度梯度的稀释液进行了效价测定,另外用人凝血因子缺乏血浆稀释后进行了效价测定。因子效价测定中,稀释液1、稀释液2、稀释液3中加入相同浓度的人血白蛋白后,得到的因子效价检测结果没有差异,说明全自动血凝仪的稀释液Owren-Koller、生理氯化钠溶液、取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合液作为稀释液时没有区别。 人凝血因子Ⅷ、人凝血酶原复合物不同蛋白浓度梯度效价测定时,随着稀释液中蛋白质含量的增高,效价检测结果也不断升高,但在人凝血因子Ⅷ效价测定中,采用蛋白质含量为1%、3%的稀释液时,效价检测结果间均无显著差别,在人凝血酶原复合物人凝血因子Ⅸ效价测定中,采用蛋白质含量为0、0.5%、1%的稀释液时,效价检测结果间均无显著差别。另外,人凝血因子Ⅷ进行人凝血因子缺乏血浆稀释效价测定效价检测结果与采用蛋白质含量为1%、3%的稀释液得到的检测结果也无显著差异,人凝血酶原复合物人凝血因子缺乏血浆稀释人凝血因子Ⅸ效价检测结果与采用蛋白质含量为0、0.5%、1%的稀释液得到的检测结果也无显著差异。另外,国外生产的人凝血因子Ⅷ和VWF的混合制剂FⅧ效价的检测结果及血浆、稀释液的影响同泰邦公司产品一致。[b]参考文献[/b][align=left] 邬杨斌, 余蓉. 凝血因子Ⅸ复合物的研制 . 华西药学杂志, 2000, 15(3):177-179. Pabinger I, Brenner B, Kalina U, et al. Prothrombin complex concentrate(Beriplexw P/N)for emergency anticoagulation reversal: A prospective multinational clinical trial . J Thromb Haemost, 2008, 6(4):622-631. Kiman E, Elela AA, Ramsis N, et al. Evaluation of the coagulation factors activity of Cryosupernatant . Suez Canal Univ Med J, 2003, 6(2):247-258.Tullis JL, Melin M, Jurigian P. Clinical use of human Prothrombin complexes . N Engl J Med, 1965, 73(13):667-674.马莉, 孙盼, 李长清, 等. 去冷沉淀血浆的质量分析 . 中国生物制品学杂志, 2013, 26(1):81-83.魏舒, 时凯, 刘国荣, 等. 冻干人凝血酶原复合物的生产工艺研究 . 中国输血杂志, 2008, 21(10):282-284.Samama CM. Prothrombin complex concentrates: a brief review . Eur J Anaesthesiol, 2008, 25(10):784-789.焦丽华, 代旭兰, 刘文芳. 凝血酶原复合物的制备及其临床应用进展 .中国输血杂志, 2008, 21(9):737-741.[/align][b] [/b]
云唐蛋白质检测仪是一种用于测定食品、生物样品等中蛋白质含量的仪器设备。它在食品科学、生物学、医学和生化等领域具有重要作用,以下是其主要作用: 食品质量控制: 在食品工业中,蛋白质是食品的主要组分之一,其含量影响着食品的口感、质地、营养价值等。蛋白质检测仪可以用于监测食品样品中的蛋白质含量,确保产品的质量稳定性和一致性。 生物学研究: 在生物学研究中,蛋白质是细胞功能和结构的重要组成部分。蛋白质检测仪可以帮助研究人员测定生物样品(如细胞提取物、血清等)中蛋白质含量,从而深入了解细胞的生物学特性和疾病机制。 医学诊断: 在临床医学中,某些疾病的发展可能会导致血清蛋白质含量的改变。蛋白质检测仪可以用于测定血液和尿液中的蛋白质含量,帮助医生进行疾病诊断和监测。 药物研发: 药物研发过程中,蛋白质的定量分析是评估药物效果的重要环节。蛋白质检测仪可以用于分析药物与蛋白质的相互作用,评估药物对蛋白质的影响。 生化实验: 在生化实验室中,蛋白质检测仪常用于定量测定蛋白质样品,用于分析实验数据和评估实验结果的可靠性。 环境监测: 在环境科学领域,蛋白质检测仪可以用于监测水体、土壤等环境中蛋白质的含量,从而评估环境质量。
UV紫外吸收法测protein蛋白质含量 蛋白质分子中,酪氨酸、苯丙氨酸和色氨酸残基的苯环含有共轭双键,使蛋白质具有吸收紫外光的性质。吸收高峰在280nm处,其吸光度(即光密度值)与蛋白质含量成正比。此外,蛋白质溶液在238nm的光吸收值与肽键含量成正比。利用一定波长下,蛋白质溶液的光吸收值与蛋白质浓度的正比关系,可以进行蛋白质含量的测定。紫外吸收法简便、灵敏、快速,不消耗样品,测定后仍能回收使用。低浓度的盐,例如生化制备中常用的(NH4)2SO4等和大多数缓冲液不干扰测定。特别适用于柱层析洗脱液的快速连续检测,因为此时只需测定蛋白质浓度的变化,而不需知道其绝对值。此法的特点是测定蛋白质含量的准确度较差,干扰物质多,在用标准曲线法测定蛋白质含量时,对那些与标准蛋白质中酪氨酸和色氨酸含量差异大的蛋白质,有一定的误差。故该法适于用测定与标准蛋白质氨基酸组成相似的蛋白质。若样品中含有嘌呤、嘧啶及核酸等吸收紫外光的物质,会出现较大的干扰。核酸的干扰可以通过查校正表,再进行计算的方法,加以适当的校正。但是因为不同的蛋白质和核酸的紫外吸收是不相同的,虽然经过校正,测定的结果还是存在一定的误差。此外,进行紫外吸收法测定时,由于蛋白质吸收高峰常因pH的改变而有变化,因此要注意溶液的pH值,测定样品时的pH要与测定标准曲线的pH相一致。

[size=16px][font=-apple-system, BlinkMacSystemFont, &][color=#05073b]蛋白质检测仪是什么仪器[/color][/font]蛋白质检测仪是一种用于检测食品、生物样品和其他物质中蛋白质含量的仪器。它通过不同的方法,如凯氏定氮法、分光光度法、[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]法等,对样品中的蛋白质进行定量和定性分析。蛋白质检测仪可以广泛应用于实验室、质量控制部门和科研机构等领域。它具有操作简便、快速准确、灵敏度高、重复性好等优点,能够满足不同领域的需求。蛋白质检测仪的原理主要是根据蛋白质与特定试剂的反应,如与双缩脲试剂的显色反应,或与某些染料的结合反应,来测定样品的蛋白质含量。不同的蛋白质检测仪采用不同的原理和方法,但它们都具有相同的目的是准确测定样品中的蛋白质含量。在使用蛋白质检测仪时,需要注意样品的处理和试剂的选择。不同的样品需要不同的处理方法,如血液样品需要进行离心分离,组织样品需要进行匀浆等。同时,试剂的选择也需要注意,如双缩脲试剂需要使用硫酸铜和氢氧化钠等试剂进行配制。总之,蛋白质检测仪是一种重要的实验室仪器,可以用于测定样品中的蛋白质含量。它具有操作简便、快速准确等优点,能够满足不同领域的需求。同时,需要注意样品的处理和试剂的选择,以确保测定的准确性和可靠性。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2023/11/202311131032246528_1186_6098850_3.jpg!w690x690.jpg[/img][/size]

[size=16px] 食品蛋白质检测仪主要用于分析和测量食品样品中的蛋白质含量。这些检测仪器可以用于各种类型的食品,包括肉类、鱼类、奶制品、豆类制品、谷物等。通过检测食品中的蛋白质含量,可以评估食品的营养价值、质量和符合性。以下是一些食品蛋白质检测仪可以检测的方面: 蛋白质含量:检测仪可以测量食品中的总蛋白质含量,帮助判断食品的蛋白质含量是否符合标准或预期值。 蛋白质质量:检测仪器可以帮助评估蛋白质的质量,如氨基酸组成和生物活性。 蛋白质种类:有些检测仪可以区分不同种类的蛋白质,如动物蛋白和植物蛋白。 异常蛋白质:检测仪也可以检测异常或变性蛋白质,可能是因为食品受到了贮存或加工条件的影响。 蛋白质配方:对于混合食品,可以使用检测仪来确定配方中不同成分的蛋白质含量。 蛋白质含量变化:食品加工可能会影响蛋白质含量,检测仪可以用于监测食品在不同加工阶段的蛋白质变化。 需要注意的是,不同类型的食品蛋白质检测仪可能具有不同的功能和应用范围,具体的功能和检测范围可能会因设备型号和制造商而异。在选择使用食品蛋白质检测仪时,应该根据具体的检测需求和食品类型选择适合的设备。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2023/08/202308291358050278_9603_6098850_3.png!w690x690.jpg[/img][/size]
各位大虾,有谁用过高效液相色谱法测定蛋白质含量的吗?
关于蛋白质含量测定国标GB5009.6-2016中第三法燃烧法的应用1.求该法规定的食品检测的参考文献。2.标准中的蛋白质分析仪是杜马斯定氮仪吗?(来自小白的问号??)3.该法燃烧法与杜马斯燃烧法是不一样的吗?(看到一些文献是另一个标准的杜马斯燃烧法与国标凯氏定氮法的比较)

[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2023/12/202312070952447089_1992_5604214_3.png!w690x690.jpg[/img] 蛋白质检测仪是一种广泛应用于生物学、医学、农业、食品科学和环境科学领域的仪器。它能够检测样本中的蛋白质含量,提供有关样本中蛋白质类型和数量的信息。下面将介绍蛋白质检测仪的应用范围。 1. 生物学和医学研究 蛋白质检测仪在生物学和医学领域的应用非常广泛。它可以帮助研究人员检测生物样本中的蛋白质表达水平,了解不同生物样本之间的差异。这有助于研究疾病的发生机制、药物的作用机制以及治疗效果的评估。蛋白质检测仪还可以用于蛋白质组学的研究,帮助科学家们发现新的生物标志物和治疗靶点。 2. 农业和食品科学 在农业和食品科学领域,蛋白质检测仪可用于检测食品中的蛋白质含量,确保食品的质量和安全。它还可以用于研究植物蛋白质的表达和含量,了解植物的生长和发育过程。这有助于提高农作物的产量和品质,为农业生产提供科学依据。 3. 环境科学 蛋白质检测仪在环境科学领域也有广泛的应用。它可以用于检测水体、土壤和空气中的蛋白质含量,了解环境中的生物活动和污染情况。这有助于评估环境的健康状况,为环境保护提供科学依据。 总之,蛋白质检测仪的应用范围非常广泛,它可以帮助研究人员了解生物样本中的蛋白质表达水平,提高农作物的产量和品质,评估环境的健康状况。随着科学技术的发展,蛋白质检测仪的应用前景将更加广阔。
褚福亮,王福生, 中国人民解放军第302医院全军艾滋病与病毒性肝炎重点实验室 北京市 100039项目负责人 王福生, 100039 ,北京市丰台路26号, 中国人民解放军第302医院全军艾滋病与病毒性肝炎重点实验室. fswang@public.bta.net.cn电话:010-66933332 传真:010-63831870收稿日期 2002-08-15 接受日期 2002-09-03摘要新近广泛应用蛋白质芯片(ProteinChipâ Array)系统成功鉴定出了一些重要疾病(如肿瘤和危害性较大的传染病)新的、特异性的生物标记(biomarkers),后者不仅在生物医学的基础方面具有重要的科学价值,而且在临床疾病的诊断、治疗和预防发挥重要的指导作用,显示了良好的发展前景.本文就表面增强的激光解析电离-飞行时间-质谱(SELDI-TOF-MS)相关的原理、特点、在临床和基础研究中的应用新进展和未来的发展趋势做一综述.此外,我们就蛋白质谱分析技术在病毒性肝炎、肝硬化和肝癌等一系列肝病方面的应用策略和前景进行了分析.褚福亮,王福生. 蛋白质谱分析方法特点及其在蛋白组学研究领域中的应用.世界华人消化杂志 2002 10(12):1431-14350 引言人类基因组计划已经进入后基因组时代-即功能基因组时代[1],作为基因功能的直接体现者-蛋白质,及其之间的相互作用越来越引起基础和临床科学家们的关注[2-6] .因为要彻底了解生命的本质,只把基因测出来还是不够的,还必须要了解其在生物生长、发育、衰老和整个生命过程中的功能、不同蛋白质之间的相互作用以及他们与疾病发生、发展和转化的规律[7-14] .正因为如此,有关上述问题的蛋白质组学研究成了今天生命科学最重要的焦点之一[15] .为了阐明蛋白质在上述生命现象中的作用和相关机制,人们设计了许多新的方法技术,如:二维电泳、质谱分析、微距阵列、酵母双杂交和噬菌体展示等,这些方法在一些特定的情况下,虽然显示出了他们各自不同的优点,但是同样也存在着较大的局限性,难以开展大规模、超微量、高通量、全自动筛选蛋白质等方面的分析,因而设计更全面、同时研究多种蛋白质相互作用的技术,在功能基因组和蛋白组学的研究中建立一个更有效的技术平台,成为本领域中优先关注的问题[16] .近来,美国Ciphergen(赛弗吉)公司研制的ProteinChipâ Array的仪器,并建立了一种新的蛋白质飞行质谱-表面增强的激光解析离子化-飞行时间-质谱(surface-enhanced laser desorption/inionation-time of flight-mass spectra, SELDI-TOF-MS),已取得可喜的进展,筛选出了许多与疾病相关的新型生物标志,不仅为临床疾病的诊断和治疗等提供了新的选择,而且在基础科学、新药研制和疾病预防等方面具有广泛的应用前景[16-18] .本文就SELDI-TOF-MS相关的原理、特点、在临床和基础研究中的应用新进展和未来的发展趋势做一综述.1 ProteinChipâ Array系统和SELDI-TOF-MS的特点1.1 蛋白质芯片系统的组成和原理 蛋白质芯片系统由三部分组成:蛋白质芯片、芯片阅读器和芯片软件.供研究用芯片上有6-10芯池,不同的芯片表面上的化学物质不同,芯片表面分为两大类:一类为化学类表面,包括经典的色谱分析表面,如:结合普通蛋白质的正相表面,用于反相捕获的疏水表面,阴阳离子交换表面和捕获金属结合蛋白的静态金属亲合捕获表面;另一类称为生物类,特定的蛋白质共价结合于预先活化的表面阵列,可以用来研究传统的抗体一抗原反应,DNA和蛋白质作用,受体、配体作用和其他的一些分子之间的相互作用[19] . 根据检测目的不同,可以选用不同的芯片,或者自己设计芯片.将样本和对照点到芯池上以后,经过一段时间的结合反应,用缓冲液或水洗去一些不结合的非特异分子,再加上能量吸收分子(energy absorbing molelule,EAM)溶液,使样本固定在芯片表面.当溶液干燥后,一个含有分析物和大量能量吸收分子“晶体”就形成了.能量吸收分子对于电离来说非常重要.经过以上步骤,就可经把芯片放到芯片阅读器中进行质谱分析. 在阅读器的固定激光束下,芯片上、下移动,使样本上每一个特定点都被“读”到.激光束的每一次闪光释放的能量都聚集在该区一个非常小的点上(focused laser beam,聚焦激光束).这样,每个区都含有丰富的,可寻址(addressable)的位置.蛋白质芯片处理软件精确控制激光寻读过程.当样本受到激发,就开始电离和解除吸附.不同质量的带电离子在电场中飞行的时间长短不同,计算检测到的不同时间,就可以得出质量电荷比,把他输入电脑,形成图像[19].Ball et al [20]采用一种称为人工神经网络(artifical neural network,ANN)的算法处理出现的成千上万的峰,鉴定出三个分子量为13 454、13 457和14 278的生物标记分子,使疾病预测率达到97.1 %.1.2 ProteinChipâ Array芯片和SELDI-TOF-MS的特点 新型蛋白芯片与以往的蛋白芯片不同之处:SELDI-TOF-MS,他是在MALDI(matrix-assisted laser desorption/inionation)[21,22]基础上,改进后实行表面增强的飞行质谱.SELDI-TOF-MS优于MALDI-TOF表现为他不会破坏蛋白质,或使样本与可溶的基质共结晶来产生质谱信号.对SELDI-TOF来说,可以直接将血清、尿液、组织抽取物等不需处理直接点样检测[40] 由于一部分非特异结合的分析物被洗去,因而出现的质峰非常一致,有利于后期分析[23,24] . 与二维电泳相比:二维电泳分析蛋白质的分子量在30 KDa以上时电泳图谱较清楚,对在组织抽提物中占很大比例的低丰度的蛋白质不能被检出;其次,二维电泳胶上的蛋白质斑点很大一部分包含一种以上的蛋白质;而且,二维电泳耗时长,工作量大,对象染色转移等技术要求高,不能完全实现自动化.而SELDI-TOF在200 Da-500 KDa区间都可以给出很好的质谱,对一个样本的分析在几十分钟内就可以完成[19],处理的信息量远远大于二维电泳;对于低丰度物质,即使浓度仅attomole(10-18)的分子,只要与表面探针结合,就可以检测到,这也是二维电泳所不具备的[24,25] . 对于微距阵蛋白芯片来说,需要一种不破坏折叠的蛋白质构象的固定技术,再与另外的蛋白质反应,经检测莹光来观察蛋白质之间的作用[26] .而基于SELDI-TOF-MS的ProteinChip分析蛋白质不需溶解、不需染色、廉价、针对性强. 因而蛋白质芯片仪具有以下优势:(1)可直接使用粗样本,如:血清、尿液、细胞抽提物等[27] .(2)使大规模、超微量、高通量、全自动筛选蛋白质成为可能;(3)他不仅可发现一种蛋白质或生物标记分子,而且还可以发现不同的多种方式的组合蛋白质谱,可能与某种疾病有关[28] (4)推动基因组学发展,验证基因组学方面的变化,基于蛋白质特点发现新的基因.可以推测疾病状态下,基因启动何以与正常状态下不同,受到那些因素的影响,从而跟踪基因的变化[2,14,15] . 其存在的问题:对于不同的样本,根据检测的目标采取或者设计几种芯片,理论上可以把所有的相同性质蛋白质捕获,但是实际上仍有少量的分子没与表面探针结合.使用SELDI-TOF-MS,仅能给出蛋白质的分子量,不能给出C端、N端的序列,也没法知道蛋白质的构型,因此需要将蛋白质充分纯化后,用蛋白酶消化芯片上的蛋白质,分析肽段,再用生物信息学方法鉴定蛋白质序列[18,24] .另外,在国内,该芯片费用较高,分析质谱需要大量后续工作支持.
蛋白质组学研究的一般工具与方法随着人类基因组计划取得巨大的成功和许多物种基因组测序的完成,仅仅靠基因组的序列来试图阐明生命现象是远远不够的,因此,研究重心已经开始从揭示生命的所有遗传信息转移到在分子整体水平对功能的研究上,生命科学已实质性地跨入了后基因组时代。 尽管现在已经有多个物种的基因组被测序,但这些基因组中通常有一半以上基因的功能是未知的。目前功能基因组研究中所采用的策略,如微阵列法(microarray)(Wodicka et al., 1997)、基因芯片(gene chips)(Ramsay et al., 1998)、基因表达序列分析(SAGE)(Velculescu et al., 1995)等,都是从细胞中mRNA的角度来考虑的。但事实上,从DNA、mRNA到蛋白质存在三个层次的调控,mRNA自身也存在着贮存、转运和降解等问题,从mRNA角度考虑,实际上仅包括了转录水平调控,并不能全面代表蛋白质表达水平。实验也证明,组织中mRNA丰度与蛋白质丰度的相关性并不好,尤其对于低丰度蛋白质来说,相关性更差。蛋白质复杂的翻译后修饰,蛋白质的亚细胞定位或迁移,蛋白质-蛋白质相互作用则几乎无法从mRNA水平来判断(曾嵘,夏其昌,2002)。新生肽链合成后存在多种加工、修饰过程,蛋白质间也存在类似于mRNA分子内的剪切、拼接,研究证明基本元件“intein”广泛存在于蛋白质中(Perler et al., 1997)。基因与其编码产物蛋白的线性对应关系只存在于新生肽链而不是最终的功能蛋白质中。 蛋白质是生理功能的执行者和生命现象的直接体现者,对蛋白质结构和功能的研究将直接阐明生命在生理或病理条件下的变化机制;蛋白质本身的存在形式和活动规律,如翻译后修饰、蛋白质间相互作用及蛋白质构象等问题,仍依赖于直接对蛋白质的研究来解决。因此要对生命的复杂活动有全面和深入的认识,必然要在整体、动态、网络的水平上对蛋白质进行研究(钱小红,贺福初,2003)。 蛋白质组学研究中常用的技术体系 方法学上,二维凝胶电泳-质谱仍然是目前最流行和可靠的技术平台(Rabilloud et al., 2000)。其一般过程是:细胞或组织样品——样品制备——二维凝胶电泳(2D-PAGE)分离蛋白质——计算机辅助分析2D-PAGE图象——对感兴趣的蛋白质进行酶解——质谱分析——数据库检索——蛋白质鉴定——分析蛋白质在细胞与组织中的表达情况。 2-D PAGE 样品制备 2D-PAGE 的操作流程基本上实现了程序化。但是,样品制备是一个非常关键与复杂的过程。成功的2D-PAGE取决于对样品中蛋白质有效的抽提和它的溶解性。与核酸不同,目前没有一种通用的方法适用于所有的蛋白质,来源不同的蛋白质都受到自身蛋白质制备方法的挑战。 正确的样品制备方法从收集样品开始时就要防止样品的裂解和被蛋白水解酶降解(Rabilloud et al., 2000)。要尽可能溶解更多的蛋白,并且在2D-PAGE过程中保持它的溶解性,阻止蛋白质的人为修饰。在样品制备过程中,各个实验室也通过实验建立了更为可行的方法。目前通过建立分步提取方法可以有效地提取出更多的蛋白质(兰彦等,2001)。另一种对蛋白质采用预分离的方法称为“多间隔电解法(multi-compartment-electrolyser)”,采用这种方法后,分辨率和胶的质量均明显改善(Herbert et al., 2000)。 但是,由于生物样品的多样性和复杂性,目前所采用的样品制备方法具有局限性。其它物质对蛋白质样品制备存在干扰。核酸通过与蛋白质结合,增加样品黏度而干扰等点聚焦(IEF)分离的效果。当然,通过实验探索,采取一些措施可以减轻它的干扰。例如,在样品制备过程中加入非特异性的核酸酶或RNase与DNase的混合物,在等电聚焦时将每个胶条的电流限制在50mA以内通常可以消除其影响。脂类物质的影响可以通过利用有机溶剂的方法将其去除,但是这常常会导致蛋白质的不可逆沉淀。除了蛋白质的降解之外,糖基化是蛋白质的最重要的人工修饰,样品中的尿素在这一过程中起着非常重要的作用。样品中的尿素在降解的过程中会形成能够与蛋白质的氨基反应的氰酸盐,这种结果会导致蛋白质带有更多的正电荷。所以,在2D-PAGE中要用新鲜的尿素溶液,在等电聚焦过程中要控制温度不能太高(Beranova-Giorgianni, 2003)。但是,目前还没有一种简单有效的方法来去除样品中的多糖。 样品分离和分析 样品制备完成后运用IEF和SDS-PAGE电泳对它进行分离,常采用银染和考马斯亮兰染色即可观察到具有许多蛋白质斑点的凝胶图像。等电聚焦电泳与SDS-PAGE的具体操作步骤已经实现了程序化,均有详细操作流程参考,但是由于样品的不同,不同样品的具体条件还需要试验探索。第二相SDS-PAGE运行结束,染色完毕后,利用计算机软件对凝胶图像进行分析,如PD-QUEST软件,LIPS,HERMES,GEMINI等,对凝胶图像上的蛋白质斑点进行匹配,对图像进行数字化处理等分析(贾宇峰等,2001),对感兴趣的蛋白质采用质谱分析。 低丰度蛋白质的检测 低丰度蛋白在蛋白质组学研究中常常是人们非常感兴趣的,因为细胞或组织中的一些生物活性物质,如细胞分泌的一些活性物质,受体等表达量都非常低。按照一般电泳的上样量,这些小分子是根本看不到的,但如果单纯地增加上样量,细胞或组织中的大量表达的蛋白就会将其覆盖,而且上样量过大也会影响电泳结果。所以对这些低丰度的样品可以进行富集,富集的方法可以通过层析,如亲和层析,离子交换层析等方法,还可以通过利用样品等电点性质等方法将pH范围相近的蛋白质富集(Santoni et al., 2000; Beranova-Giorgianni, 2003)。
蛋白质是生物体中含量最高,功能最重要的生物大分子,存在于所有生物细胞,约占细胞干质量的50%以上, 作为生命的物质基础之一,蛋白质在催化生命体内各种反应进行、调节代谢、抵御外来物质入侵及控制遗传信息等方面都起着至关重要的作用,因此蛋白质也是生命科学中极为重要的研究对象。关于蛋白质的分析研究,一直是化学家及生物学家极为关注的问题,其研究的内容主要包括分子量测定,氨基酸鉴定,蛋白质序列分析及立体化学分析等。随着生命科学的发展,仪器分析手段的更新,尤其是质谱分析技术的不断成熟,使这一领域的研究发展迅速。 自约翰.芬恩(JohnB.Fenn)和田中耕一(Koichi.Tanaka)发明了对生物大分子进行确认和结构分析的方法及发明了对生物大分子的质谱分析法以来,随着生命科学及生物技术的迅速发展,生物质谱目前已成为有机质谱中最活跃、最富生命力的前沿研究领域之一[1]。它的发展强有力地推动了人类基因组计划及其后基因组计划的提前完成和有力实施。质谱法已成为研究生物大分子特别是蛋白质研究的主要支撑技术之一,在对蛋白质结构分析的研究中占据了重要地位[2]。 1.质谱分析的特点 质谱分析用于蛋白质等生物活性分子的研究具有如下优点:很高的灵敏度能为亚微克级试样提供信息,能最有效地与色谱联用,适用于复杂体系中痕量物质的鉴定或结构测定,同时具有准确性、易操作性、快速性及很好的普适性。 2.质谱分析的方法 近年来涌现出较成功地用于生物大分子质谱分析的软电离技术主要有下列几种:1)电喷雾电离质谱;2)基质辅助激光解吸电离质谱;3)快原子轰击质谱;4)离子喷雾电离质谱;5)大气压电离质谱。在这些软电离技术中,以前面三种近年来研究得最多,应用得也最广泛[3]。 3.蛋白质的质谱分析 蛋自质是一条或多条肽链以特殊方式组合的生物大分子,复杂结构主要包括以肽链为基础的肽链线型序列[称为一级结构]及由肽链卷曲折叠而形成三维[称为二级,三级或四级]结构。目前质谱主要测定蛋自质一级结构包括分子量、肽链氨基酸排序及多肽或二硫键数目和位置。 3.1蛋白质的质谱分析原理 以往质谱(MS)仅用于小分子挥发物质的分析,由于新的离子化技术的出现,如介质辅助的激光解析/离子化、电喷雾离子化,各种新的质谱技术开始用于生物大分子的分析。其原理是:通过电离源将蛋白质分子转化为[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]离子,然后利用质谱分析仪的电场、磁场将具有特定质量与电荷比值(M/Z值)的蛋白质离子分离开来,经过离子检测器收集分离的离子,确定离子的M/Z值,分析鉴定未知蛋白质。 3.2蛋白质和肽的序列分析 现代研究结果发现越来越多的小肽同蛋白质一样具有生物功能,建立具有特殊、高效的生物功能肽的肽库是现在的研究热点之一。因此需要高效率、高灵敏度的肽和蛋白质序列测定方法支持这些研究的进行。现有的肽和蛋白质测序方法包括N末端序列测定的化学方法Edman法、C末端酶解方法、C末端化学降解法等,这些方法都存在一些缺陷。例如作为肽和蛋白质序列测定标准方法的N末端氨基酸苯异硫氰酸酯(phenylisothiocyanate)PITC分析法(即Edman法,又称PTH法),测序速度较慢(50个氨基酸残基/天);样品用量较大(nmol级或几十pmol级);对样品纯度要求很高;对于修饰氨基酸残基往往会错误识别,而对N末端保护的肽链则无法测序[4]。C末端化学降解测序法则由于无法找到PITC这样理想的化学探针,其发展仍面临着很大的困难。在这种背景下,质谱由于很高的灵敏度、准确性、易操作性、快速性及很好的普适性而倍受科学家的广泛注意。在质谱测序中,灵敏度及准确性随分子量增大有明显降低,所以肽的序列分析比蛋白容易许多,许多研究也都是以肽作为分析对象进行的。近年来随着电喷雾电离质谱(electrospray ionisation,ESI)及基质辅助激光解吸质谱(matrix assisted laser desorption/ionization,MALDI)等质谱软电离技术的发展与完善,极性肽分子的分析成为可能,检测限下降到fmol级别,可测定分子量范围则高达100000Da,目前基质辅助的激光解吸电离飞行时间质谱法(MALDI TOF MS)已成为测定生物大分子尤其是蛋白质、多肽分子量和一级结构的有效工具,也是当今生命科学领域中重大课题——蛋白质组研究所必不可缺的关键技术之一 [5] 。目前在欧洲分子生物实验室(EMBL)及美国、瑞士等国的一些高校已建立了MALDI TOF MS蛋白质一级结构(序列)谱库,能为解析FAST谱图提供极大的帮助,并为确证分析结果提供可靠的依据[6]。