病毒性肺炎(viral pneumonia,VP)是由病毒入侵呼吸道上皮和肺泡上皮所致的肺间质和实质性急性炎症病变。全年都可发生,冬春季高发。易感人群多为2岁以下婴幼儿、65岁以上老人及孕产妇等。临床常见的VP病原体包括流感性病毒、冠状病毒、麻疹病毒、呼吸道合胞病毒、腺病毒及鼻病毒等[1-2]。腺病毒肺炎是常见的小儿VP之一[3],主要表现为局灶或融合性肺坏死性浸润及支气管炎;呼吸道合胞病毒肺炎以肺间质及毛细支气管病变为主[4],胸片上可见斑点状影,常伴有不同程度的肺气肿;流感病毒肺炎常可侵犯中枢神经系统或循环系统,以肺间质病变为主;甲型流感病毒肺炎较乙型流感病毒肺炎症状更严重,胸部X光片显示片状高密度影,扩散迅速,常有肺间质受累,多伴有胸腔少量积液,病灶吸收后可残留纤维灶[5];冠状病毒肺炎以发热、干咳、乏力为主,可伴有消化道等症状或无症状[6];麻疹病毒肺炎多表现为呼吸道卡他、持续发热等,并出现不同程度的疹退后脱屑、特征性皮疹、色素沉着、口腔科氏斑等临床表现[7];鼻病毒主要感染气道上皮细胞,可引起普通感冒、肺炎、支气管炎和慢性呼吸道等多种疾病,是临床常见的呼吸道感染病原体[8]。然而,VP作为当前临床常见的一种社区获得性肺炎,在西医治疗方面一直缺乏特异性药物。相反,我国传统中医药在治疗VP过程中则拥有悠久的历史和成功经验。从中医角度看,VP属“风温”和“温病”。根据临床资料发现,清肺排毒汤、麻杏石甘汤、化湿解毒方等是临床上最常用于治疗VP的中药汤剂,且疗效显著[9]。其作用机制可能与其调控机体免疫平衡、调控体内微生态、抑制炎症反应、抑制肺纤维化、保护组织及直接抗病毒活性有关。 病证结合动物模型是一种重要的中医药疾病动物模型[10-12],通过对证候发生发展的机制研究,可很好地展现中医“证”的不同发展阶段特征,体现疾病发展的中医病因病机,已成为中医证候研究动物模型的必然趋势,为中医基础向临床治疗的转变提供了理论依据,有利于中药筛选及方剂作用机制的深入研究,是中医药新药研发的重要途径。目前,病证结合动物模型在建模理念上已逐渐成熟,主要可划分为以下3种:(1)以中医理论为依据,中医病因病机为“证”,西医病因为“病”,构建同时具有“病”“证”2个特征的模型动物,这是一种中西医结合多因素造模理念;(2)在西医病态模式基础上观察中医病证,分别归纳疾病初期的证候发展特征及后期出现的典型中医证候,以此判断该疾病是否属于某种中医证型;(3)运用传统中医病因学方法对模式动物进行干预,通过一般状况观察、客观指标检测、常用方药反证等方法,初步建立动物证候模型,并寻找与之匹配的临床病证来进行验证,即在证候模型基础上探察西医疾病类型[13]。 目前现有的VP动物模型多为西医模型,对中医证候模型的研究还较为薄弱,不能反映中医辨证论治的特色。因此,本文对现阶段中医疾病动物模型及相关VP病证模型的建模方法、证型分类、证候研究和评价指标的研究现状进行了梳理,为建立符合中医辨证论治特点的VP动物模型提供参考。 1 VP病证结合动物模型的相关建模研究 1.1 实验动物选择 在选取实验动物时,要尽可能具有与人的相似性,并对各种治疗因子有较高的敏感性,以便能较好地模拟人类疾病症状。目前报道的VP造模动物包括Balb/c小鼠[14]、昆明小鼠[15]、美国癌症研究所ICR小鼠[16]、豚鼠[17]、叙利亚仓鼠[18]、人类血管紧张素转换酶II小鼠[19]、Wistar大鼠[20]、恒河猴[21]、雪貂[22]、树鼩[23]等。虽然部分动物如恒河猴、雪貂、树鼩的病情与人类极为类似,但造模成本高、技术难度大,尚未得到推广应用。目前临床上最常使用的中医证候造模动物仍为小鼠和大鼠,主要是由于其成本低,并且人们对其生活习性和制作方式也较熟悉。 1.2 证候的造模方法 目前公认的中医证候建模方法主要有3种,分别为西医病因病机法、中医病因病机法和病证结合法[24]。其中,病证结合法因稳定性、可操作性高、相对容易评价,且能够体现中医临床辨病与辨证相结合的特点,被认为是比较理想的造模方法[25-26]。表1归纳了3种造模方法各自的应用现状(文献研究举例)、造模依据、干预方法及优缺点。 1.3 VP中医证候学 中医大师根据中医辨证论治体系对VP的证候进行了论述,常见症状包括:发热、咳嗽、咳痰、精神乏力、鼻塞、头痛、流鼻涕、舌色红、苔黄、苔腻、脉滑、脉浮,这些是VP主要的舌象和脉象,可体现VP的中医证候特点,并且与《中医内科学》《温病学》中的相关描述基本相符。依据《中药新药临床研究指导原则(试行)》(2002年)[37]、《小儿病毒性肺炎中医诊疗指南》(2019)[38]及相关文献[39-40],VP的中医辨证分型主要包括风寒郁肺、风热郁肺、痰热郁肺、毒热闭肺、阴虚肺热、肺脾气虚、心阳虚衰和邪陷厥阴等,对不同证型的造模方法归纳见表2。 2 VP病证结合动物模型相关评价指标的研究 病证结合动物模型研究近年来得到广泛关注和应用,针对模型建模的系统评价指标是现在研究的主要方向。目前倾向于从2个层面展开研究:(1)将宏观表象和微观指标相结合,建立人与动物四诊转换模式;(2)强调结合有效经典方药进行反证。 2.1 宏观表征评价 中医辨证以望、闻、问、切为主要手段,以患者临床症状、体征为主要依据进行综合评价,而动物模型则需在动物宏观表象上寻找可供量化、判定的依据,如以模型动物体温上升为发热表现,耸毛或蜷卧为恶寒表现[57]。在脾虚为主的湿热证动物模型研究中,周祎青等[58]发现模型组小鼠表现出精神倦怠、不思饮食、反应迟钝、毛发黯淡等脾虚为主的湿热证症状,证实造模成功。此外,在情志研究中,动物的行为变化是重要评估指标。王枭宇等[59]通过评估多种经典的模型,如旷场实验、强迫游泳实验、悬尾实验等,发现行为学指标能够反映实验动物整体变化的特征,特别是能够反映动物心理情感变化。 需要注意的是,目前对动物模型的宏观判断标准多以人的证候为依据,人与动物在某些方面存在明显差异,同时某些主观因素如动物心理和情绪等变化,都会影响宏观表征结果的可靠性。 2.2 微观指标评价 微观指标能更直观、准确地反映动物机体状态,是判断VP病证结合是否成功的重要依据。 2.2.1 一般情况观察 观察动物情绪、活动、体毛、排泄、饮食、呼吸、体质量、肛温及死亡情况等。如将大鼠置于寒冷条件下连续6 d造模,表现出恶风寒、弓背毛松、打喷嚏、流鼻涕、食欲下降、饮水增加、体温升高、体质量下降及血压升高等明显风寒感冒症状。该症状符合中医的风寒表证[41]。 2.2.2 肺脏指数的测定与肺脏损伤程度的判定 吴莎[60]提出用肺指标、肺损伤程度来评价造模疗效,结果证实病毒感染后小鼠肺部炎症反应加剧且肺指数升高。刘珊宏等[61]采用风扇吹风联合体表降温7 d的方法构建风寒犯表的太阳病小鼠动物模型,发现小鼠造模后体质量显著下降,肺指数显著升高,脾指数显著下降。同时肺部出现明显病变,表现为局部有代偿性空泡、局部出血、肺间质增生、血管壁增厚,嗜中性粒细胞浸润等。杨进等[57]给小鼠滴鼻感染仙台病毒构建风热模型,发现感染病毒8 h内小鼠肺部指标无显著变化,8 h后肺内可见轻度病灶,12 h后肺泡壁厚度显著增加,大量单核细胞和淋巴细胞浸润,说明病证已经从表到里,证实仙台病毒在小鼠滴鼻后的4~12 h可视为类表热证阶段。 2.2.3 炎症因子 近年来关于病毒诱发细胞因子释放及对病毒感染的影响研究结果表明肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)是介导炎症反应的重要介质,可促进TNF-α分泌,加剧炎症发生[62-63]。王晓萍[64]采用人工气候箱、高脂饮食、甲型H1N1流感病毒滴鼻法等复制蒿芩清胆汤动物模型,发现病毒感染后TNF-α和IL-6均异常增高,同时死亡率、肺组织病理改变等结果提示模型组气道炎症反应处于持续状态,经蒿芩清胆汤治疗后小鼠肺组织中炎症因子水平显著下降,且可显著降低肺炎的发生,提示蒿芩清胆汤可能通过多靶点调控机体促炎和抑炎平衡;刘珊宏等[61]发现风寒犯表太阳病小鼠模型肺部炎性因子TNF-α、IL-6及IL-1β的表达显著增加;Wan等[65]发现寒冷造模后大鼠血清炎症因子TNF-α、L-1β、IL-6水平显著增加。 2.2.4 免疫功能 呼吸道病毒感染及其发病机制与机体的免疫状态密切相关[66]。白细胞分化抗原4阳性(cluster of differentiation 4+,CD4+)/CD8+、辅助性T细胞1(T helper cell 1,Th1)/Th2是人体内重要的免疫细胞[67],而在动物模型中存在细胞免疫水平显著降低、免疫失衡现象。CD4+/CD8+ T细胞失衡反映了病毒感染导致的机体免疫损伤,Th1/Th2(γ干扰素/IL-4)失衡反映了内、外环境因素和病毒感染综合因素共同作用下的机体应激状态。从微观上看,CD4+/CD8+的值倒置,Th1/Th2细胞因子偏向Th1,使细胞免疫成为优势而导致肺脏损伤,加重疾病,会对证候的发展方向产生影响。通过湿热环境+流感病毒构建流感病毒湿热证模型,采用蒿芩清胆汤能逆转湿热环境和病毒感染综合作用引起的CD4+/CD8+的值下降。蒿芩清胆汤治疗6 d后湿热证模型大鼠外周血γ干扰素/IL-4水平显著高于对照组,表明蒿芩清胆汤具有调节大鼠T淋巴细胞亚群、Th1/Th2平衡、提高抗病毒能力的作用[68]。综上,蒿芩清胆汤抗病毒免疫损伤的机制可能是通过上调细胞免疫功能,使CD4+/CD8+和Th1/Th2重新平衡从而减轻应激状态[69]。 2.2.5 水液代谢 水通道蛋白(aquaporins,AQPs)是一种能特异性转运水分的蛋白。是人体对水液代谢调节的关键因素[70]。迄今共发现13种AQPs蛋白,其中主要体现在肺部的以AQP1、AQP5为主。肺脏中AQP1表达下降可引起气道上皮细胞分泌增多,促进黏蛋白5ac在肺脏中的表达,从而导致气道炎症的加重,而炎性介质分泌增多,纤毛和杯状细胞比率失衡、肺部水分代谢失衡等进一步加重炎症性水肿[71]。AQP5在肺组织水代谢稳态中发挥重要作用,AQP5功能失调是导致肺损伤的重要原因[72-74]。AQP1、AQP5的表达在造模后免疫组化数值和光密度均有明显提高。如在采用环境+膳食+诱发因素+生物感染因素复制湿热证病毒肺炎动物模型中,模型组大鼠AQP1、AQP5免疫组化数值较对照组显著增高,光密度增加。与模型组对比,甘露消毒丹组AQP1蛋白表达显著降低,说明甘露消毒丹治疗湿热证型病毒性肺炎的作用途径之一是通过影响炎性相关的AQP1,加快肺泡内液体的清除、减轻肺组织的水肿程度,抑制湿热证病毒性肺炎模型的炎性反应来实现的[75]。 2.2.6 血脂代谢 VP发病的内因与患者的饮食习惯密切相关,嗜食肥甘厚味,酿生痰浊从而造成了脾胃的运化功能失调,临床上血脂异常通常与其饮食密切相关,因此,湿邪与血脂异常间的关系亦受到广泛关注。有研究采用环境+膳食(喂饲高脂肪食物)+诱发因素+生物感染性因素的方法建立湿热证病毒肺炎动物模型,发现模型小鼠血清中的总胆固醇和低密度脂蛋白胆固醇显著增高,高密度脂蛋白胆固醇显著下降,且存在脂代谢异常,证实了饮食失调是引起内湿的重要因素[69,76]。 2.2.7 Toll样受体(Toll-like receptor,TLR)介导的信号通路 TLR家族在细胞表面或细胞内表达,以模式识别形式与多种病原分子结合激活固有免疫应答,是连接天然免疫与获得性免疫的桥梁,在抵御病原体感染方面具有关键作用[77-82]。 潘沅[69]采用环境+高脂膳食+生物感染性因素的方法复制湿热证动物模型,研究发现,TLR2可以促进下游核因子-κB(nuclear factor-κB,NF-κB)的过度活化,导致大量炎症因子和细胞因子的产生,造成机体自身免疫损伤。而ig蒿芩清胆汤后,小鼠腹腔巨噬细胞中的TLR2受体及其下游NF-κB分子的表达显著降低,表明蒿芩清胆汤可能通过干预TLR2/NF-κB信号转导通路调控细胞因子的产生,从而减少机体自身炎症因子造成的免疫损伤。 2.3经典方药反向验证 中药配伍要遵循“方从法出、法随证立”的原则,所选用的药和方药应与所用的证候密切相关。即在方剂学理论体系下,所选药物或方剂与其主治的证要有较强的相关性。这样可以判断证候是否复制成功。当前,VP病证结合动物模型反证方剂主要集中在中医经典名方和经验方,有麻杏石膏汤、参附龙牡救逆汤、宣白承气汤、三仁汤、蒿芩清胆汤、甘露消毒丹、茵陈蒿汤和龙胆泻肝汤等加减方剂。这些反证方剂在治疗的原则上包含了疏风解表、清热解毒、清化痰热、宣肺开闭、补气养阴、清肺扶正等配伍特点。用一些代表方剂对动物模型进行干预后,动物的临床症状和各项客观指标均得到了显著的改善。汤朝晖等[43]以清热化湿(蒿芩清胆汤)、辛凉透表(银翘散)、益气固表(玉屏风散)为代表的3个治法对风热型流感VP小鼠模型进行干预,均取得较好疗效,提示造模成功。 3 结语与展望 病证结合动物模型是联系中医基础研究与临床应用的重要纽带。中医药基础理论是中华民族几千年同疾病抗争的结晶,在防疫治疫方面积累了丰富的经验[83],近年来,病毒性新发呼吸道传染病全球频发,而中医药在治疗VP等疫情防控中发挥了显著优势和关键作用,VP病证结合动物模型也开始受到越来越多的研究和探索,近年来发展较快。但另一方面,尽管VP动物模型研究在证候模型建模方法等方面已有很多创新,但仍然存在一些难点问题需要和重点关注。 首先,目前VP证候模型的造模方法还很不完善。如风寒郁肺[41]、肺脾气虚模型[52-53]中常使用病因建模,但却在造模时未与病毒相结合,如何使用病毒来复制风寒郁肺、肺脾气虚模型可能是未来的研究方向;目前诸如痰热郁肺模型在细菌性肺炎中有较成熟的造模方法,心阳虚衰模型则多用于冠心病[55]、心衰[84]等,而尚未有关于痰热郁肺模型[45]、毒热闭肺模型、心阳虚模型、邪陷厥阴模型在VP中的造模方法和应用报道,如何借鉴其他病证构建VP病证结合模型也是后续需要重点关注的难题;VP阴虚肺热模型[39]目前还常用单因素造模方式,而单因素的改变难以复制理想的病证结合模型,存在齐同性差的弊端;在西医造模基础上施加中医证候干预因素的造模方法,亦无法很好地反映病证间的因果关系,无法准确识别疾病主证类型,未来基于证候建模的疾病诱发因子的引入有望成为解决这一难题的重要思路。 其次,实验动物的选择和模型评估技术也是目前制约VP病证结合模型研究的主要难点。目前常用的大鼠、小鼠在某些结构、功能、代谢和疾病表征方面尚不能很好地模拟人类病证特点,同时模型评估指标尚无统一规范,且因动物和人类疾病的差异性,很多动物模型无法直接应用于人类证候表征,而微观指标由于存在“一证多方”及多个证候叠加等现象,均给评估带来了巨大困难。 中医证候研究是一个复杂的过程,建立病证结合动物模型要以中医药理论为指导,与现代医学的理论方法相结合,融合多学科知识,从基因组、蛋白质组学、代谢组学、生物信息学等多层次进行深入研究[85-86]。虽然VP病证结合动物模型尚处于不断探索阶段,但随着新知识、新技术的不断融入和创新,相信不久的将来能够得到迅速发展和完善,更好地反映中医“证”的本质,为推动中医药现代化与国际化做出重要贡献。
大家好,我是一个新手,请大家多多关照. 是这样的,我是一个学生,这学期需要做论文,所以特向网上的高手请教几个问题: (1)我论文是关于肥胖的,所以需要建立起肥胖的动物模型(老鼠),尽管我查了很多资料,都没有完全找到肥胖的动物模型的标准评价体系,也就是说什么样的指标可以证明我在老鼠身上的肥胖模型建立成功了,我打算用高脂饮食将老鼠喂胖. (2)另外还有一个脂肪酸合成酶的在脂肪酸形成过程中的通路情况,以及测试方法. (3)什么地方可以下载到和的讲义. 请帮帮忙哦!小女子感谢不尽哦![em06]
【序号】:5【作者】:石雯1周抒【题名】:宫腔粘连动物模型的建立【期刊】:新医学.【年、卷、期、起止页码】:2022,53(09)【全文链接】:https://kns.cnki.net/kcms2/article/abstract?v=PN9vNVFTqfewS6_SFaexsY_hzCS854RjZb8k9e-yr7bqFezVmSce32ZMNM-jsIiPj8-QT8u5a3jGvKX7jSNF-HWkDE24-yJ6rm5C9xr989-YyeOSSCTBQQKiZOdvx2JFjUA_Gn7QI9JbuiN9UJFnLg==&uniplatform=NZKPT&language=CHS
【序号】:1【作者】:傅云扉【题名】:脂溢性皮炎病动物模型的构建及治疗的研究【期刊】:仲恺农业工程学院【年、卷、期、起止页码】:2022【全文链接】:https://kns.cnki.net/kns8s/defaultresult/index?crossids=YSTT4HG0%2CLSTPFY1C%2CJUP3MUPD%2CMPMFIG1A%2CWQ0UVIAA%2CBLZOG7CK%2CPWFIRAGL%2CEMRPGLPA%2CNLBO1Z6R%2CNN3FJMUV&korder=SU&kw=%E7%9A%AE%E7%82%8E%20%E6%B2%BB%E7%96%97
[size=3][font=宋体]一、医学数学化的发展历史[/font][/size][size=3][font=宋体] [/font][/size][size=3][font=宋体]数学应用于生命科学研究的历史可追溯到17 世纪。1615 年英国医生哈维(Farvey W)在研究心脏时应用流体力学知识和逻辑推理方法推断出血流循环系统的存在,18世纪欧拉利用积分方法计算了血流量问题,这些都是历史上应用数学研究生命科学的突出事例。但是,真正大范围地将数学应用于生命科学与医学研究则出现在20世纪中叶。1935年,Mottram对小白鼠皮肤癌的生长规律进行了研究,认为肿瘤细胞总数N随时间的变化速度与N成正比,并获得了瘤体在较短时间内符合指数生长规律的研究成果。1944 年奥地利著名物理学家薛定谔(Schrodinger E)出版了《生命是什么》(What is life)一书,应用量子力学和统计力学知识描述了生命物质的重要特征。在薛定谔的影响下,沃森(Watson JD)和克里克(Crick FHC)利用当时对蛋白质和核酸所做的射线结晶学研究以及其他与DNA结构有关的研究,于1953年建立了DNA超螺旋结构分子模型,验证了薛定谔的设想。在书中,薛定谔还利用非平衡热力学从宏观的角度解释生命现象,认为生命的基本特征是从环境中取得“负熵”,以使生物系统内的熵始终处于低水平。20多年后,普律高津(Prigogine I)等人提出耗散结构理论,将对生命系统的研究推广到薛定谔预言的领域,为此普律高津于1977年荣获了诺贝尔奖。作为医学领域的最高奖项,诺贝尔医学和生理学奖背后的许多数学影像也许更能说明数学在生命科学中的巨大潜力:英国生理学家、生物物理学家Hodgkin和Huxley建立了神经细胞膜产生动作电位时膜电位变化的模型,揭示了神经电生理的内在机制,因而于1963年共享诺贝尔奖;基于二维雷当变换(Radon transform)创建CT成像理论的美国科学家Cormack AM获得了1979年的诺贝尔奖,丹麦科学家Jerne NK则应用数学原理研究免疫网络理论获得1984年的诺贝尔奖。这些奖项有力地表明现代生命科学的研究离不开数学,数学在其中所起的作用和影响越来越重大,高层次的成果往往有赖于合理的数学模型的建立。[/font][/size][size=3][font=宋体] [/font][/size][size=3][font=宋体]数学不仅推动了人们探索生命世界的步伐,事实上两者结合已经产生了多个十分活跃的学科。1901年Peanson 创建生物统计学后,概率论与数理统计方法在医学上得到了非常广泛的应用,如目前常用的显著性检验、回归分析、方差分析、最大似然模型、决策树概率分布、微生物检测等,都属于基于统计学原理的数学模型及分析。1931年,Volterra在研究食物链的基础上,应用微分方程组研究生物动态平衡,完成了《生态竞争的数学原理》,开创了生物数学(biomathematics)这一新的分支。近年来,可视人及虚拟人的研究、计算医学(computational medicine/biology)、生物信息学(bioinformatics)、生理组学(Physiome)等新的学科及领域的出现,使数学这一工具在生物医学研究中的作用日益突出。[/font][/size][size=3][font=宋体] [/font][/size][size=3][font=宋体]生物系统是一个动态系统,作为世界上最复杂的系统之一,它具有调节机制复杂、多输入、多输出等特点,而且由于很多变量或参数很难在体测量及控制,仅仅通过实验研究来揭示其间的复杂关系,会非常困难且不易得到一致的结论。建立生物系统的数学模型,有利于获得生物系统的动态与定量变化,帮助阐明生物医学中有关作用机制等基础性问题,同时通过模型及仿真实验不仅可以得到正常状态,还可以获得异常或极端异常状态下的生理变化预测,以及代替一些技术复杂、代价高昂或难以控制和重现的实验,为临床或特定条件下的方案设计提供预测及指导。此外,从伦理学的角度,人们也希望医学研究中能够减少实验动物的数量,减轻临床试验中人体试验对象不必要的痛苦,因此生理系统的仿真与建模在生物医学领域中的研究中日益受到重视。目前,包括呼吸、血压、体温、各种调节系统等,都已建立了相应的数学模型,并进行了相应的模拟实验。针对特定应用的模型,如细胞动力学、药物动力学模型、生物种群生长模型、神经网络、心血管模型、临床计量诊断模型等,也不断呈现并得到应用。在本节下面的内容中,我们将以应用最为成功的模型之一,药物动力学模型为例,说明医用数学模型的建立过程。[/font][/size][size=3][font=宋体] [/font][/size][size=3][font=宋体]二、医用数学模型实例:药物动力学模型[/font][/size][size=3][font=宋体] [/font][/size][size=3][font=宋体]药物动力学(pharmacokinetics)是定量研究药物在生物体内吸收、分布、排泄和代谢等过程的动态变化规律的一门学科。于1937年由Teorell开创,主要内容是应用动力学原理、体外实验数据以及人体生理学知识,结合数学模型,定量研究药物在体内的运转规律,为药物的筛选提供指导。[/font][/size][size=3][font=宋体] [/font][/size][size=3][font=宋体]众所周知,新药研发过程费用昂贵、时间冗长、淘汰率高,大约有90%的候选药物在临床期间被淘汰,主要原因有口服吸收性差、生物利用度低、半衰期过短等等。为提高新药研究效率和安全性、降低药物研发成本,药物动力学模型已为全球各大制药公司应用。传统的新药研发流程中,药物动力学的应用主要在药物研发的中后期,近年来,人们开始在药物研发的早期对其药物动力学特性进行模拟研究,以尽早淘汰药物动力学参数不理想的候选药物,提高研发效率、降低成本。比如药物虚拟筛选(virtual screening)就是指在化合物合成前,先通过计算机模拟预测其药动学相关特性,进行初步筛选。此外,药物动力学模型在研究药物处置及作用机制、治疗药物监测及个体化用药、新药开发等方面也发挥着重要作用。[/font][/size][size=3][font=宋体] [/font][/size][size=3][font=宋体]药物动力学的数学模型包括房室模型、非线性药物动力学模型、生理药物动力学模型、药理药物动力学模型、统计矩模型等。下面以最常用的房室模型,结合前面所述的建模步骤,对药物动力学模型的建模过程进行分析描述。[/font][/size][size=3][font=宋体] [/font][/size][size=3][font=宋体](一)背景和问题表述[/font][/size][size=3][font=宋体] [/font][/size][size=3][font=宋体]药物进入机体后,在随血液输送到各个器官和组织的过程中,不断地被吸收、分布、代谢,最终被排出体外。药物在血液中的浓度,即单位体积血液中药物的含量,称为血药浓度。血药浓度的大小直接影响到药物的疗效。因此,药物动力学研究的主要对象是血药浓度随时间变化的规律——药时曲线,建模目的是建立能反映药物在体内分布的数学模型及参数,并能反映给药方式、给药时间间隔、给药剂量等对分布的影响。[/font][/size][size=3][font=宋体] [/font][/size][size=3][font=宋体](二)模型构建[/font][/size][size=3][font=宋体] [/font][/size][size=3][font=宋体]上述问题属于人体与外界以及人体内部的物质交换问题,研究这类问题最常用的是房室模型。药物动力学的房室分析方法将人的机体看做由不同房室构成的系统,每个房室代表药物在其中分布大致均匀的组织或体腔。如血液及供血丰富的肝、心、肾在特定情况下可视为一个房室,而血供不足的组织如肌肉、皮肤等可视为另一个房室。为了进行严格数学描述,常对模型做如下假设:①房室具有固定容量,且药物在每个房室内的分布是均匀的;②各房室间可进行物质交换,且至少有一个房室可与外环境进行交换;③房室间的物质交换或药物转移服从质量守恒定律,即系统中物质总量的改变等于输入总量与输出总量之差;④线性假设:药物的转移速率与药物浓度成正比。[/font][/size]
脑卒中是全球致伤致残致死3大原因之一,据全球疾病负担统计2019年全世界有1 220万人发病[1],我国有394万人首发[2];另一统计称2020年我国有340万人首发并有约220万人留下残疾[3-4]。缺血性脑卒中(ischemic stroke,IS)约占卒中类型的85%[4-5]。IS预后结局差,复发率高而且极有可能造成后遗症如偏瘫、后肢痉挛、震颤等。其病理机制也十分复杂,涉及细胞过度自噬、离子失衡与谷氨酸过度释放、氧化应激与自由基、炎症爆发和神经细胞凋亡[5-7]等。 目前治疗IS的主要方法为重组组织型纤溶酶原激活剂(recombinant tissue-type plasminogen activator,rt-PA)静脉溶栓、手术取栓和神经保护。手术风险高,rt-PA治疗时间窗短,且有出血风险,符合治疗条件的病人不到10%[8],而神经保护的药物在临床上的效果不如动物实验那么有效,目前急需开发更安全可靠的治疗IS的用药。在长期的医学实践中,银杏叶提取物在治疗脑卒中和心肌梗死方面疗效显著[9]。其中,银杏内酯作为天然的血小板活化因子(platelet activating factor,PAF)受体拮抗剂,因其具有抗炎、抗氧化、抗凋亡和神经保护的作用[10-12]而越来越受到关注。 银杏二萜内酯葡胺注射液(Diterpene Ginkgolides Meglumine Injection,DGMI)以银杏叶提取物为原料,主要组成为银杏内酯A(ginkgolide A,GA,35%)、银杏内酯B(GB,60%)、银杏内酯C(GC,2%)、银杏内酯K(GK,2%),含总银杏内酯5 mg/mL[13],银杏二萜内酯成分达98%以上[14]。临床显示,DGMI可有效改善IS发病90 d时患者的神经缺损评分,同时改善患者认知和行动能力,并且在中老年患者中疗效优于银杏叶提取物注射液(金纳多)[15-18],Zhao等[15]认为DGMI与rt-PA联用治疗急性卒中效果更佳。最新一项临床研究发现,单独使用DGMI对急性缺血性脑卒中治疗有效[19]。也有多项体内外实验证明DGMI具有改善脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)的作用,主要与PAF受体[20]、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)- 蛋白激酶B(protein kinase B,PKB)、核因子-红细胞2相关因子2(nuclear factor-erythroid 2 related factor 2,Nrf2)[13]等通路有关。 黑质为重要的运动和感知调节中枢,是脑内合成多巴胺的主要核团,与背侧基底核、底丘脑构成基底运动环路[21],可能通过多巴胺能神经与IS引发的震颤等运动障碍相关。为明确DGMI在黑质脑区抗CIRI的作用通路,本研究通过建立小鼠大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型,模拟急性IS时脑内局灶性缺血缺氧的状态,利用转录组测序对小鼠脑样本进行测序,并结合生信分析鉴定DGMI在黑质脑区抗脑缺血损伤的作用通路及功能效应,为深入探索其作用机制提供思路。 1 材料 1.1 动物 SPF级雄性C57BL/6小鼠,6~8周龄,体质量18~22 g,购自南京市江宁区青龙山动物养殖场公司,生产质量合格证SCXK(浙)2019-0002。动物于江苏康缘药业有限公司动物房普通清洁级环境中适应性饲养1周,温度(24±2)℃、12 h光昼交替,自由进食饮水。动物实验经江苏康缘药业有限公司动物委员会批准(批号2023110101)。 1.2 药品与试剂 DGMI(商品名为尤赛金,国药准字z20120024,批号220703)由江苏康缘药业有限公司提供;银杏叶提取物761(Ginkgo biloba extract-761,EGb-761,商品名为金纳多,3.5 mg/mL,国药准字HC20181022,批号P6001)由台湾济生医药生技股份有限公司提供;1800AA型小鼠硅胶线栓购自广州佳灵生物有限公司;舒泰50(货号BN8G4VA)购自法国维克公司;2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC,批号BCCJ6488)购自美国Sigma公司;RNA提取试剂盒(批号AM90890A)购自日本Takara公司;Qubit RNA BR Assay kit(批号2506001)、Qubit 1X dsDNA HS assay kit(批号2483579)购自美国Invitrogen公司;Illumina Poly(A) Capture(批号20733163)、Illumina RNA Prep Ligation(批号20723247)、IDT for Illumina RNA Index Anchors(批号20717954)、IDT for Illumina DNA/RNA UD Indexes(批号20739487)、NextSeqTM 2000 P3 300循环试剂盒(批号20751014)购自美国Illumina公司;RNA Screen Tape(批号02020849-192)、RNA Screen Tape缓冲液(批号0006698095)、D1000 Screen Tape(批号0202853-39)、D1000试剂(批号0006739609)购自美国Agilent公司。 1.3 仪器 DOM-1001型显微镜、RFLSI ZW型激光散斑血流成像系统(深圳市瑞沃德生命科技有限公司);PY-SM5(LCD)型LCD高精度智能温控器(余姚市品益电器有限公司);NanoDrop分光光度计(美国Thermo Fisher Scientific公司);4150型TapeStation自动化电泳系统(美国Agilent公司);Qubit 4.0型核酸定量仪(美国Invitrogen公司);NextSeqTM 2000型测序仪(美国Illumina公司)。 2 方法 2.1 动物分组、造模及给药 小鼠适应性饲养5 d后,随机分为假手术组、模型组、DGMI(25 mg/kg)组及EGb-761(100 mg/kg)组,为确保各组术后存活10只小鼠,假手术组设置10只,模型组设置16只,EGb-761组和DGMI组设置14只。 小鼠ip舒泰50麻醉后,参照LONGA法[22]复制MCAO模型。用线栓阻塞小鼠大脑中动脉血流,缺血1 h时,拔出线栓恢复血流,进行再灌注,并结扎颈外动脉剪口。假手术组小鼠进行颈动脉暴露处理,但不插入栓线。手术过程室温控制在(26±1)℃,术后使用加热垫等设备维持小鼠体温保持37 ℃。线栓进入后,将小鼠俯卧位固定,纵向剪开头皮,充分暴露颅骨,置于激光散斑血流成像系统下进行血流检测,确保造模成功。采用RFLSI Analysis v2.0.29.26606软件分析数据,在缺血侧及对侧一致位置添加相同的区域,得到脑血流量统计结果。对造模小鼠进行筛选,排除造模不成功、大出血、蛛网膜出血及过早死亡的小鼠,最终纳入统计的共有40只小鼠,每组分别10只。 基于本课题组预实验结果,DGMI对小鼠MCAO模型术后24 h脑梗死面积改善程度的最佳剂量为25 mg/kg。因此,本研究采用25 mg/kg剂量开展DGMI的药效评价。DGMI组术后30 min ip药物(DGMI以生理盐水将稀释成2.5 mg/mL的溶液),EGb-761组术前1 h ip药物,假手术组和模型组ip等体积生理盐水。 2.2 神经功能评分与脑组织TTC染色 小鼠再灌注24 h后进行改良版神经功能缺损评分(modified neurological severity score,mNSS)[23]。评分后取血,迅速取脑组织,?20 ℃冰箱中冷冻15 min,随后将冷冻后的脑组织切成厚度为2 mm的冠状切片共6片,使用2% TTC染液于37 ℃恒温水浴锅中避光染色10 min,用4%多聚甲醛溶液对脑片进行固定,24 h后拍照。使用Image-Pro Plus 6.0软件计算脑梗死面积。 脑梗死面积=白色缺血面积/总面积 2.3 脑黑质RNA提取和转录组测序 取小鼠脑黑质,每组4个样本,经高速冷冻研磨机粉碎成匀浆后,按照RNA提取试剂盒说明书提取RNA。经过RNA质量控制后,筛选3个符合条件的样品,按照Illumina文库制备体系,完成文库的构建稀释与上机测序。 2.4 转录组数据分析 2.4.1 转录组数据处理与质量分析 利用Trimmomatic[24]软件对测序数据进行滤过,获取高质量的数据信息,直接从基因组网站下载参考基因组和基因模型注释文件,使用HISAT2[25]和String Tie[26]软件将clean reads与参照基因组进行比对和拼接。 2.4.2 降维分析与模型评价 将各组数据进行降维分析,主要分为主成分分析和tSNE降维分析,比较各组离散程度。 2.4.3 差异表达基因(differentially expressed genes,DEGs)筛选 采用DESeq[27]软件包对各组细胞的基因表达量进行差异分析,模型组DEGs以模型组vs假手术组筛选,给药组DEGs以给药组vs模型组筛选,筛选标准为|log2差异倍数(fold change,FC)|≥2且Padjust≤0.05。 2.4.4 基因集富集分析(gene set enrichment analysis,GSEA) GSEA通路富集分析不局限于某些目标基因集,而是从所有基因的表达丰度出发,分析在不同的通路中的基因的整体表达影响,理论上更容易囊括细微但协调性的变化对生物通路的影响。参照徐小波等[28]研究,计算药物干预后表达趋势逆转的通路数与模型组特征通路总数的比值(响应值),并评价药物抗脑缺血再损伤的能力。 2.4.5 基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析 运用R语言limma[29]软件包对差异基因进行GO功能和KEGG通路富集分析,并用R语言将相关信息可视化。GO功能包括生物学过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)。使用超几何检验进行富集分析。FDR校正的P≤0.05被认为显著富集。 2.5 qRT-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]验证关键基因表达 按照试剂盒说明书提取脑黑质中总RNA并合成cDNA,进行qRT-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]分析。采用2?ΔΔCt法计算相关关键基因表达。溶质载体家族6成员A3(solute carrier family 18 member A3,Slc6a3)、钙调蛋白样4(calmodulin like 4,Calml4)、G蛋白亚基γ14(G protein subunit gamma 14,Gng14)、C-C基序趋化因子2(C-C motif chemokine ligand 2,Ccl2)、色氨酸羟化酶2(tryptophan hydroxylase 2,Tph2)、C-X-C趋化因子1(C-X-C motif chemokine ligand 1,Cxcl1)、β-actin引物序列见表1。 图片 2.6 统计学分析 实验结果使用Graghpad prism 9.0软件进行统计分析。两组间比较采用独立样本t检验,组间多重比较采用单因素方差分析(One way ANOVA)和Dunnett-t检验,数据以表示。 3 结果 3.1 脑血流成像结果 通过脑血流仪监测小鼠脑皮质血流量变化,如图1和表2所示,发现插入线栓缺血时,与假手术组比较,各组小鼠手术缺血侧脑皮质血流量均显著降低(P<0.001),表明缺血造模成功,建立的小鼠MCAO脑缺血再灌注模型稳定可靠。 图片图片 3.2 DGMI对MCAO模型小鼠的药效评价 3.2.1 DGMI对MCAO模型小鼠mNSS的影响 脑缺血再灌注后24 h,各组小鼠mNSS结果见图2,假手术组为0分,无神经功能损伤;与假手术组比较,模型组小鼠mNSS显著升高(P<0.001),神经功能损伤严重;与模型组比较,各给药组mNSS显著降低(P<0.01、0.001)。表明MCAO造模可导致小鼠神经功能受到损伤,引起小鼠行为学发生变化;EGb-761和DGMI可显著改善小鼠缺血再灌注造成的神经功能损伤。 图片 3.2.2 DGMI对MCAO模型小鼠脑梗死面积的影响 如图3所示,TTC染色后,假手术组脑切片呈均匀的红色,模型组脑切片缺血侧有明显的白色梗死部位;与模型组比较,各给药组小鼠脑梗死面积 显著减小(P<0.001)。表明DGMI和EGb-761可显著改善小鼠脑梗死面积,对小鼠脑梗死有一定治疗作用。 图片 3.3 转录组测序分析 3.3.1 转录组测序数据质量分析 在建立的测序文库中,超过Q30的比例在94%以上,对测序数据中reads进行滤过后,数据质量控制结果显示,与参考基因组的序列比对率在70%以上,表明测序结果较好。 3.3.2 降维分析与模型评价 经主成分分析发现,假手术组和模型组明显分离(图4-A)。对各组进行tSNE降维分析,发现DGMI组与模型组明显分离(图4-B)。 图片 3.3.3 DEGs分析 如图5-A~C所示,与假手术组比较,模型组共筛选得到88个差异表达基因(differentially expressed genes,DEGs),其中78个基因上调,10个基因下调。与模型组比较,DGMI组有21个基因上调,108个基因下调;EGb-761组有92个基因上调,84个基因下调。分别对模型组和DGMI、EGb-761组的DEGs取交集,如图5-D所示,DGMI组与模型组共有32个差异基因重合,EGb-761组与模型组共有31个差异基因重合,三者共有10个DEGs重合。 图片 图6中展示了EGb-761组、DGMI组和模型组DEGs重叠部分的热图,共53个DEGs。可以发现,这部分DEGs在给药后有不同程度的逆转。此外,在Lv等[30]通过131个小鼠和39个大鼠样本MCAO模型筛选出的15个共同DEGs中,模型组DEGs中有活化转录因子3(activating transcription factor 3,Atf3)、组织基质金属蛋白酶抑制剂1(tissue inhibitor of metalloproteinases 1,Timp1)、分化抗原14(cluster of differentiation 14,Cd14)、半乳糖结合凝集素3(lectin, galactoside-binding, soluble 3,Lgals3)、血红素加氧酶(heme oxygenase 1,Hmox1)、Ccl2、上皮膜蛋白1(epithelial membrane protein 1,Emp1)、热休克蛋白家族B成员1(heat shock protein family B member 1,Hspb1)、血小板反应蛋白基序1型去整合素和金属蛋白酶(a disintegrin and metalloproteinase with thrombospondin motifs 1,Adamts1)、波形蛋白(vimentin protein,Vim)共10个基因重合(66.7%)。Lv等[30]发现的与人类卒中易感基因联系最强的基因Adamts1、锌指蛋白(zinc finger protein 36,Zfp36)、核因子κB抑制剂zeta(nuclear factor kappa B inhibitor zeta,Nfkbiz)、Ccl2和Hmox1中,本研究模型组中也有3个重合。 图片 3.3.4 GSEA结果 如图7所示,GSEA结果显示,与假手术组比较,模型组表达相反的通路有35条,定义这些通路为模型组的特征通路;DGMI与模型组趋势相反的通路有7条,如帕金森症、色氨酸代谢、嘧啶代谢等通路,响应值为20%左右。 图片 3.3.5 DEGs的GO功能富集分析 为明确小鼠MCAO造模及药物干预后所涉及的生物学功能变化,对模型组和DGMI组小鼠脑组织DEGs进行GO功能富集分析,见图8。结果显示,模型组主要富集在细胞对白细胞介素-1和γ干扰素的反应、趋化因子互作和免疫细胞的浸润等BP,细胞外空间、细胞外区域等CC,趋化因子受体结合等MF。DGMI干预后,主要富集在分泌颗粒、神经肽激素信号通路等BP,细胞外空间与区域,多巴胺能神经突触等CC,S100蛋白结合、激素与神经肽激素等MF。 图片 3.3.6 DEGs的KEGG通路富集分析 为明确DGMI对MCAO模型小鼠KEGG通路的影响,基于获得的DEGs进行KEGG通路富集分析,见图9。结果显示,模型组前15条KEGG通路主要与炎症、凋亡和免疫反应相关,富集在细胞因子-细胞因子受体相互作用、肿瘤坏死因子(tumor necrosis factor,TNF)信号通路、白细胞介素-17(interleukin-17,IL-17)信号通路、趋化因子信号通路、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路等。DGMI组KEGG通路主要富集在神经活性配体-受体作用、多巴胺能神经突触等。 图片 进一步分析发现,模型组KEGG通路中出现频率较高(≥3)的关键差异基因为Ccl12、Ccl2、Cxcl1等,见表3。DGMI组KEGG通路中出现频率较高(≥3)的关键差异基因是Gng14、Slc6a3、Calml4等,见表4。 图片 Ccl12、Ccl2与免疫细胞趋化浸润脑区有关,Gng14编码的蛋白质参与G蛋白偶联受体通路,而Slc6a3、Calml4与多巴胺在脑内的转运分泌密切相关,提示DGMI治疗IS可能与多巴胺能信号通路密切相关。 3.4 qRT-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]验证关键基因表达 对模型组和DGMI组部分关键基因表达进行qRT-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]验证,如图10所示,与对照组比较,模型组小鼠脑组织Slc6a3、Tph2基因表达水平显著降低(P<0.001),Calml4、Ccl2、Gng14、Cxcl1基因表达显著升高(P<0.05、0.01、0.001);与模型组比较,DGMI组小鼠脑组织Slc6a3、Tph2基因表达显著升高(P<0.01、0.001),Calml4、Ccl2、Gng14、Cxcl1基因表达显著降低(P<0.05、0.01、0.001)。6个基因表达量的qRT-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]检测结果均与转录组测序结果一致;值得注意的是,Calml4和Gng14 2个基因通过qRT-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]和转录组测序方法获得的表达量在3个受试样本间差异较大,这可能是由于2种检测方法对基因的检测区域不同产生的,因此说明qRT-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]检测对RNA-seq结果验证的必要性。总之,综合qRT-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]与转录组测序结果,DGMI可能通过影响炎症和多巴胺相关通路改善IS。 图片 4 讨论 目前,银杏叶提取物作为天然药物产物,已被证明具有抗炎、抗氧化等多种药理作用,可以有效治疗IS。DGMI是国内常用的银杏叶提取物制剂之一,目前虽然在临床前和临床研究上都获得一定成果,但是其治疗IS的作用机制尚缺乏深入的探索。在DGMI作用机制探索的初期首先面对3方面主要的问题。第一,缺乏机制研究方向的指导。面对此问题,在组学水平,例如采用转录组测序方法,获得与疾病进程和发展相关,以及药物治疗途径相关的必要信息,将对后续针对性及更深入的研究提供方向指导。第二,对于IS,临床实验样本的获取比较困难,使得目前相关研究集中在细胞和动物实验,目前关于DGMI在动物IS实验上的转录组测序还没有相关研究内容发表以作参考。第三,由于大脑功能的实行分区域进行,且十分复杂,采用全脑均质化样本进行检测难以对获得的结果进行解析,取特定的脑区进行研究可以更精准地反映疾病和药物对脑特定的功能结构造成的变化影响。 4.1 多巴胺能神经、黑质与卒中炎症 CCL2基因编码的单核细胞趋化蛋白,可以吸引单核和淋巴细胞。CCL2/CCR2趋化因子信号通路在卒中急性期中呈现促炎作用[31],临床试验和动物实验都证明CCL2基因高表达是IS的危险因素,而且在临床上CCL2可作为多种卒中亚型急性期的标志物[32-33]。CCL2因子可由小胶质细胞促炎亚型分泌,CCL2还可能与其他趋化因子共同作用,在急性期介导CD8+ T细胞在脑中的活化和浸润[34]。不过在急性期后的慢性期,CCL2可能有利于促进血管生成和卒中恢复[35]。卒中后活化的星型胶质细胞等分泌的CXCL-1是中性粒细胞趋化因子,可以募集中性粒细胞浸润脑区。中性粒细胞会通过胞外诱捕网等方式进一步加剧卒中[36-38]。 DGMI组和模型组黑质脑区DEGs的KEGG以及GO结果显示,DGMI治疗IS可能和多巴胺能神经相关,尤其是多巴胺的转运和代谢。溶质载体蛋白(solute carrier,Slc)是一类跨膜转运蛋白,Slc18a2基因调控的囊泡单胺转运蛋白2(Vesicular monoamine transporter 2,VMAT2)依赖于质子浓度,介导多巴胺在突触前神经元中从胞质溶胶进入囊泡储存[39-41],囊泡经突触小泡循环将多巴胺运至突触前膜附近,释放多巴胺进入突触间隙,多巴胺结合突触后膜的受体后失活,而Slc6a3调控的多巴胺转运蛋白1(dopamine transporter1,DAT1)位于突触前末梢周围,依赖于Na+/Cl?从突触间隙再摄取多巴胺至突触前末梢[42]。包括多巴胺、乙酰胆碱在内的多种神经递质的受体为G蛋白偶联受体,小鼠Gng14编码的蛋白为G蛋白γ亚基,与人类GNG14同源,Gng14可能通过调节G蛋白亚基发挥作用,而Calml4是钙调蛋白,通过与钙离子结合作用于钙离子信号通路对下游信号产生影响。TPH2是5-羟色胺(5-hydroxytryptamine,5-HT)合成的关键酶,同时也会影响多巴胺的浓度,涉及其转运与代谢[43]。 多巴胺能神经元控制着脑内的奖赏系统、成瘾性以及运动功能[44],还能调控疼痛和神经炎症[45-46]。黑质-纹状体通路是主要的多巴胺能通路之一
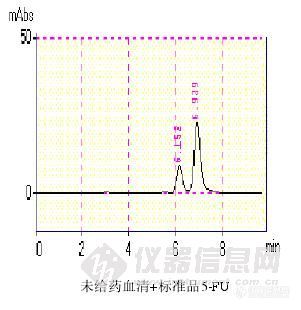
【作者】 但操;【导师】 张继民; 【作者单位】 广州医学院, 外科学,【摘要】 研究背景:5’-脱氧氟尿苷(5’-deoxy-5-fluorouridine, 5’-DFUR)是临床治疗消化道恶性肿瘤的口服抗癌药物,为5-氟尿嘧啶(5-FU)的前体药物。其本身没有细胞毒作用,需要在细胞内经过胸苷磷酸化酶(thymidine phosphorylase,TP)转化为5-FU才能发挥抗肿瘤作用。已有文献报道乳腺癌和胃癌细胞可以表达TP活性,而大肠癌细胞是否表达TP则持论不同。我们在前期研究中发现大肠癌组织中TP活性主要由间质细胞中的巨噬细胞表达,而测定6株结肠癌细胞系也几乎没有TP蛋白表达。在癌细胞不表达TP的情况下5’-DFUR在结直肠癌组织中如何转化尚属疑问。我们前期体内实验对结肠癌小鼠动物模型应用化疗药物5’-DFUR进行治疗,结果发现与5-FU相比平均荷瘤生存期更长,平均瘤重轻,同期平均体重下降缓慢,提示5’-DFUR在小鼠结肠癌组织比正常组织中转化率高,抗癌选择性高。其原因可能是TP酶在癌组织中分布较正常组织多。前期体外实验把5’-DFUR加入培养基中同人血单核细胞一起培养24h,5’-DFUR对4种癌细胞的IC50明显下降,提示血液中单核细胞也可表达TP。由于尚未发现实验比较在癌组织和血液中TP含量,故两者TP的含量高低尚需要实验进一步证实。本实验应用高效液相色谱法(high performance liquid chromatography,HPLC)测定应用5’-DFUR后癌组织和血液中5-FU的转化情况,间接推断TP酶在癌组织和血液中分布差异,为进一步研究5’-DFUR在结直肠癌组织中转化及TP酶调控机制提供资料。实验材料:1、实验动物SPF级近交系BALB/c小鼠28只,6-8周龄,雄性,体重20.00±2.34g,购自广东省医学实验动物中心。2、肿瘤细胞株BALB/c小鼠结肠腺癌细胞株(CT26),购自美国菌种保藏中心(American Type Culture Collection, ATCC)。3、实验药物5’-DFUR由Roche公司日本研究中心提供; 5-FU注射液,江苏南通精华制药有限公司生产(批号: 080607);5-FU标准品购自Sigma有限公司提供(批号: 097K1352)。4、实验仪器岛津高效液相系统;色谱柱:Diamonsil C18柱(250mm×4.6mm,5μm)实验方法:1、小鼠结肠癌CT-26细胞株的培养10%胎牛血清1640培养基,含青霉素100×103 U/L和链霉素100 mg/L,37℃,5%CO2水浴恒温培养箱中培养,隔日换液,2-3天酶消化法传代。2、细胞悬液制备制备模型当天取指数生长期的细胞,用0.25%胰蛋白酶消化,机械吹打成细胞悬液,2 000r/min离心5 min,弃上清液,加适量生理盐水调整细胞浓度至1×107个/ml,以台盼蓝测定细胞活力在95%以上。3、结肠癌模型制作方法将体外培养的CT26细胞悬液0.2ml注入小鼠(BALB/c)背部皮下,约2周后基本可以形成肉眼可见的肿瘤隆起。4、动物分组及给药荷瘤小鼠28只随机分为4组:①5’-DFUR给药15分钟组;②5’-DFUR给药30分钟组;③5-FU给药15分钟组;④5-FU给药30分钟组。根据动物体重,5-FU用量0.020mg/g ,配制浓度为1.0 mg/ml。5’-DFUR用量0.038mg/g;配置浓度为2.0mg/ml。各组分别腹腔注射给药15分钟、30分钟后处死小鼠立即取血和瘤组织。5、标本处理小鼠眼眶动静脉取血0.5 ml后放置入37℃水浴30分钟,3200rpm离心5min,取上清液4℃保存。肿瘤组织用滤纸吸干血迹后称重,然后按0.5g组织与4 ml生理盐水(1:8)加入匀浆器匀浆5min, 3200rpm离心5min,取上清液4℃保存。6、制作血液和肿瘤组织的5-FU药物标准曲线取未给药小鼠血清7份,每份90μL,分别加入由5-FU对照品和蒸馏水配制的系列标准液适量并混匀配成100μL,使血清中药物浓度分别为6.25,12.5,25.0,50.0,100.0,200.0,400.0μg·mL-1,制作血清标准曲线;取未给药小鼠肿瘤组织匀浆液7份,每份90μL,分别加入由5-FU对照品和蒸馏水配制的系列标准液适量并混匀配成100μL,使肿瘤匀浆液中药物浓度分别为1.0,2.0,4.0,8.0,16.0,32.0,64.0μg·mL-1,制作肿瘤标准曲线。7、测量各标本浓度取血清100μL,置于5mL玻璃试管中,加入乙酸乙酯2mL,漩涡振荡2min后,3200rpm离心5min,取上层析液置于另一玻璃试管中。再次加入乙酸乙酯2mL进行第二次提取,漩涡振荡2min后,3200rpm离心5min,取上层析液,然后合并两次提取的上层析液,离心浓缩挥干。加入100μL流动相定容,混匀取出,置于EP管中,10000rpm离心7min,取上层析液20μL进样。记录药物峰面积,代入相应标准曲线计算药物浓度;取肿瘤匀浆液100μL,以同样方法处理标本测量浓度。8、观测指标给药15分钟、30分钟处死组5’-DFUR组和5-FU组小鼠血液与癌组织5-FU浓度。9、统计学方法应用统计软件SPSS13.0数据包对5’-DFUR组和5-FU组小鼠血液与癌组织5-FU浓度采用配对样本t检验进行比较。当P0.05时,认为差异有统计学意义。结果:1、注射药物5’-DFUR 15、30分钟后,癌组织转化的5-FU浓度分别54.64μg/g±12.80μg/g和45.58μg/g±18.82μg/g,血清中中5-FU浓度分别为8.83μg/ml±1.68μg/ml和9.82μg/ml±2.93μg/ml,15分钟、30分钟组癌组织5-FU浓度分别为血清的6.36、4.47倍(P0.05);2、注射药物5-FU 15、30分钟后,癌组织转化的5-FU浓度分别86.13μg/g±15.42μg/g和94.68μg/g±39.89μg/g,血清中5-FU浓度分别为133.35μg/ml±20.69μg/ml和112.70μg/ml±26.27μg/ml,15分钟、30分钟组血清5-FU浓度分别为癌组织的1.59、1.62倍(P0.05)。结论:小鼠结肠癌模型体内,癌组织内5’-DFUR转化率高于血液,考虑分布在癌组织中的PyNPase酶比血液高。 【谱图】http://ng1.17img.cn/bbsfiles/images/2012/08/201208142214_383901_1609970_3.jpg
1月11日,美国国家科学院院刊(PNAS)在线发表了中科院生物物理研究所朱平研究组及其合作伙伴利用冷冻电镜技术解析的一个质型多角体病毒原子分辨率结构模型的研究论文。这是我国首次利用冷冻电镜技术解析的生物大分子原子结构模型,也是目前已报道的国内最高分辨率的冷冻电镜三维重构结果。同时,这是世界上首次利用冷冻电镜的CCD图像(电荷耦合器件图像传感器)获得的生物大分子复合体的全原子模型。据生物物理所有关专家介绍,本工作完全基于生物物理所生物成像技术实验室去年4月建成并试运行的TitanKrios电镜及其附属设备完成,用单颗粒图像处理技术获得了呼肠孤病毒科的质型多角体病毒近原子分辨率的三维结构(3.9埃),并独立构建了全原子模型。呼肠孤病毒科病毒是一类重要的双链核糖核酸(RNA)病毒,其感染宿主包括植物、无脊椎动物、脊椎动物和人类,其中的质型多角体病毒是其两个亚科之一。该研究解析了呼肠孤病毒科质型多角体病毒的近原子分辨率三维结构并构建了完整原子模型,确认了该病毒新生信使RNA的流出通道,对研究双链RNA病毒的RNA加帽机制,新生信使RNA的释放过程,以及呼肠孤病毒的蛋白衣壳的稳定性和进化具有重要意义。
前几天看到坛里的一则帖子:《从一次曲线看二次曲线》,很简单地表达了自己的看法:相关系数与拟合模型无关。我自己也编写过原子吸收软件,很清楚相关系数是怎样算出来的。根据《数学手册》上的定义,相关系数只与自因变量的统计特性有关,而与所用的拟合模型是没有关系的。不过帖主“冰山”同学很快就贴出某软件的截图反驳了我的观点,贴图上很清楚显示不同的拟合模型有着不同的“相关系数”。这是什么回事呢?要搞清楚这个问题,需要搞清楚一个概念,即何为相关系数?其实相关系数是表示两个变量的相关程度的,一个模型中的自因变量如果存在单调性,如变量A增加则变量B增加(或者减小),以及相反,变量A减小则变量B减小(或增加),我们说两个A与B变量之间存在很强 的相关性。那么相关性的大小有如何计算呢?人们用的是线性相关系数R,它是一个衡量自因变量之间线性关系的一个指标。如果线性相关系数等于1或者-1,说明因变量可以用自变量的一次方程完美表达。因此,线性相关系数和所选择的拟合方程式确实是没有关系的,因为它只对线性方程有意义。那么如何比较两条工作曲线的优劣了。通常,人们会用剩余误差来说明工作曲线的质量。所谓剩余误差,指的是对所有实验样本的因变量与模型估计值之差的平方求和,不过这个数值有些主观,因为它与因变量的取值范围有关。例如,显然,一个取值在1000附近的变量显然比在0.1 附近取之的变量有大得多的误差,因此更“客观的”指标是所谓的“相对剩余误差”,即总剩余误差除以变量变异数(所有实验样本的变量与其算术平均值之差的平方求和)所得之结果。很显然,这个“相对剩余误差”(Qse)越小,拟合质量越好,它与所选择的拟合方程模型是相关的。对于线性拟合模型,Qse^2和R^2之和恰好等于1,所以在线性拟合模型中,常用线性相关系数的平方来说明拟合质量,因为这个值越大(越接近1),拟合质量越好,这很符合人们的思维习惯。对于非线性拟合方程,所谓的相关系数已经不适用了,于是,人们用1减去Qse^2杜撰出一个“相关系数”,更确切地说,这个系数实际上是“模型相关系数”。个人认为,分析软件中的相关系数,还是用“模型相关系数”更加合适。
动物实验在新药的评价和筛选过程中有着十分重要的作用。古人云“在其位,谋其政”,正因为动物实验在研发中的这个关键作用,当研发产出不理想时,我们应该首先反思是否这些影响研发决定的关键实验是否使用得当。动物和人虽然有97%的基因相同,但在很多方面有巨大的差别,尤其在免疫反应和行为方面。最近斯坦福大学的科学家发现人和小鼠在受伤时启用的免疫应激基因几乎没有任何相关性。另一方面,疾病本身和疾病模型也有巨大差别。多数疾病我们尚不知其起因,而疾病模型的起因则非常明确,动物没有您的帮助成不了模型。从动物到人,从疾病模型到疾病本身是两个巨大的跨越,很多研发项目在这个过程中迷失了方向。现在通过动物实验的候选药物有10%能最后上市,但考虑到不少药物是结伴而行(同一靶点),真正能通过动物模型预测人体治疗效果的首创药物成功率要远低于10%,能和已有药物有足够区分的首创药物更是寥若晨星。任何实验如果想得到有用的信息,最重要的是问正确的问题,其次是实验设计的严格程度要和所研究问题的复杂程度匹配,而目前新药研发的动物实验在这两方面存在不小的差距。动物是很好的人类生物,生理模型,但不是好的病理模型。疗效则是更复杂的事情,因为疗效取决于如何定义,即观察终点。所以动物实验最有用的地方是观测药物对生物途径的调控,即药物在生命体内,有血流,营养,各种正负反馈和动态平衡的真实世界条件下对所关心的生物过程的影响,观测指标最好是比较客观的机理和功能的生物标记变化,比如下游蛋白的表达。病理模型有些有一定的预测性,但现在我们问的很多问题对这些可怜的小鼠来说实在太难了。小鼠没有心理疾病和小鼠不说话一样是自然界的本性。神经分裂小鼠模型和口吃小鼠模型一样与人类疾病没有太大关系。人类需要60,70年才能得的阿尔茨海默症如何能让小鼠几十天内得上?虽然很少但小鼠的确可以自然患上癌症,但我尚未看到小鼠自然患上阿尔茨海默症的报道,令人怀疑小鼠是否能被患上这类疾病。第二个大毛病是既然你问这些动物如此复杂的问题(即疗效),就应该用和这个复杂问题匹配的实验程序。三期临床实验几乎必须是双盲,对照,随机,多中心,多基因背景病人,多种生活习惯和并发症,但在动物实验这些控制因素都不存在。小鼠是实验室繁殖的同一基因背景的近亲,生活习性和能量摄入完全一样,并和普通小鼠都有很大区别,别说病人了。以前认为限制能量摄入能延长小鼠寿命,后来发现是因为这些实验小鼠平时吃的太多了。双盲,对照,随机这些控制机理在动物实验中极少使用,显然增加了动物实验结果的不可靠性,大量的发表动物实验结果无法重复就是证明之一。多中心虽然在研发全球化的今天可能更普遍一点,但一旦两个不同实验室得出不一致结果时多数人的解决办法不是改进动物模型,而是把实验集中到其中一个实验室,“以保证一致性”,掩耳盗铃啊。所以正确的解决办法是,问模型能回答的问题,问动物能回答的问题,而不是把你所有无法解决的问题都交给动物模型,然后对数据严刑拷打,得出想得到的结论。如果你问复杂的问题,看在老天爷的份上严格你的实验设计,不要挑最敏感的模型,用最容易产生假阳性的实验设计。新药研发的未来依靠整个社会在临床研究的更大投入。在人体确证靶点在疾病中的作用,在动物考察药物是否能调控这个靶点的生物功能,而不是所谓动物模型的治疗效果。在很多情况下,这和水中捞月没有太大区别。
中国科技网讯 众所周知,脑部疾病很难治疗。据物理学家组织网近日报道,约翰·霍普金斯大学研究人员报告称,他们对运载药物的纳米粒子进行了改良,使其能按照预期,安全定量地渗透到脑组织深处。研究人员指出,这一改进在制造灵活药物递送系统、克服脑癌及其他器官疾病障碍方面迈进了一大步。相关论文在线发表于《科学·转化医学》上。 在做完脑肿瘤摘除手术后,标准治疗方案还需要进行化疗,以杀死病灶部位无法手术摘除的残留细胞。但化疗药物剂量很难控制,既要够大才能穿透组织,又要够小才能保证病人安全。这种方法预防肿瘤复发成功率并不高。 为了克服剂量难题,研究小组设计出一种纳米粒子,能在一段时间内持续、稳定地将小剂量药物递送到病灶部位,而且能顺利地一次性就到达大脑,不会被组织环境黏住。约翰·霍普金斯大学病理学家查尔斯·埃伯哈特说,传统的纳米粒子是用像绳子似的分子将药物紧紧缠裹成小球,遇水后缓慢分解,但递送效果并不理想,因为纳米粒子会黏在注射部位的细胞上,不向组织内部移动。 为此,该校化学与生物分子工程研究生、霍普金斯神经外科医生伊丽莎白·南希将聚乙二醇(PEG)涂在大小不同的纳米塑料珠上,稠密的PEG涂层让纳米珠变得更光滑,减小了其与周围环境的相互作用,而且涂层能保护纳米粒子免受机体防御系统攻击。 在组织实验中,他们给涂层纳米珠作了荧光标记,注射进小鼠和人的脑组织切片中,跟踪它们的运动情况,结果发现PEG涂层让较大的纳米珠也能透过组织,有些甚至接近了以往认为的透过脑组织最大限度的2倍。动物实验效果也相同。 随后,他们给一种携带化疗药物紫杉醇的生物降解纳米粒子涂上了PEG。在小鼠脑组织中,没有PEG涂层的纳米粒子运动非常慢,而有涂层的顺利扩散到组织中。南希说,现在纳米粒子能运载的药物量是以前的5倍,在脑组织中的运输距离是以前的3倍。下一步研究将看它们能否减缓动物体内肿瘤的生长。 研究人员指出,他们还希望进一步优化纳米粒子,将其与药物匹配以治疗其他脑部疾病,如多发性硬化症、中风、脑外伤、老年痴呆症和帕金森症等。(常丽君) 《科技日报》(2012-10-15 二版)
[align=center][font='宋体'][size=21px]以肝癌组织单外泌体表面蛋白组为基础的肝癌预后模型构建[/size][/font][/align]1、 [font='宋体']:[/font][align=left][size=16px]研究内容[/size][/align][align=left][size=16px]从肝细胞肝癌和癌旁组织中提取外泌体,深入探讨肝癌组织外泌体和癌旁组织外泌体的差异,通过生物信息学手段发现关键分子,并通过实验验证关键分子的作用,[/size][size=16px]结合临床信息构建肝癌预后模型,[/size][size=16px]具体研究内容为:[/size][/align][align=left][font='calibri'][size=16px][color=#000000]1[/color][/size][/font][font='calibri'][size=16px][color=#000000])临床样本收集:收集肝细胞肝癌和癌旁组织[/color][/size][/font][font='calibri'][size=16px][color=#000000]20[/color][/size][/font][font='calibri'][size=16px][color=#000000]例,分别提取外泌体;后期验证收集肝细胞肝癌和癌旁组织[/color][/size][/font][font='calibri'][size=16px][color=#000000]80[/color][/size][/font][font='calibri'][size=16px][color=#000000]例。[/color][/size][/font][/align][align=left][font='calibri'][size=16px][color=#000000]([/color][/size][/font][font='calibri'][size=16px][color=#000000]2[/color][/size][/font][font='calibri'][size=16px][color=#000000])外泌体表面蛋白测定及关键分子检测:前期采[/color][/size][/font][font='calibri'][size=16px][color=#000000]?[/color][/size][/font][font='calibri'][size=16px][color=#000000]邻近编码技术([/color][/size][/font][font='calibri'][size=16px][color=#000000]Proximity Barcoding Assay, PBA[/color][/size][/font][font='calibri'][size=16px][color=#000000])对单外泌体进行分析,对样本中的外泌体进行高通量、单颗粒、多种蛋白的检测;[/color][/size][/font][font='calibri'][size=16px][color=#000000]miRNA[/color][/size][/font][font='calibri'][size=16px][color=#000000]组学分析:与疾病发生相关的外泌体源功能分子;差异分子的功能、通路的富集与注释;组织外泌体验证关键分子;关键分子上下游通路预测、功能富集、表型预测;[/color][/size][/font][/align][font='calibri'][size=16px][color=#000000]([/color][/size][/font][font='calibri'][size=16px][color=#000000]3[/color][/size][/font][font='calibri'][size=16px][color=#000000])功能机制研究:获得或缺失关键分子后的外泌体处理肿瘤细胞,检测干性表型;体内实验验证[/color][/size][/font][font='calibri'][size=16px][color=#000000]其对小鼠成瘤的影响。[/color][/size][/font]1、 [font='宋体']研究方案:[/font][font='宋体'][size=16px]1.研究方案(有关方法、技术路线、实验手段、关键技术等说明,项目可行性分析)[/size][/font][font='宋体'][size=16px]研究方法[/size][/font][font='宋体'][size=16px](1)临床样本收集:收集肝细胞肝癌和癌旁组织20例,分别提取外泌体;[/size][/font][font='宋体'][size=16px](2)[/size][/font][font='宋体'][size=16px]外泌体表面蛋白测定及关键分子检测:[/size][/font][font='宋体'][size=16px]前期采用[/size][/font][font='宋体'][size=16px]邻近编码技术([/size][/font][size=16px]Proximity Barcoding Assay[/size][size=16px],[/size][size=16px] [/size][size=16px]PBA[/size][font='宋体'][size=16px])对单外泌体进行分析,[/size][/font][font='宋体'][size=16px]对样本中的外泌体进行高[/size][/font][font='宋体'][size=16px]通量、单颗粒、多种[/size][/font][font='宋体'][size=16px]蛋白[/size][/font][font='宋体'][size=16px]的检测;[/size][/font][size=16px]miRNA[/size][font='宋体'][size=16px]组学分析:与疾病发生相关的[/size][/font][font='宋体'][size=16px]外泌体[/size][/font][font='宋体'][size=16px]源功能分子;差异分子的功能、通路的富集与注释;组织外泌体验证关键分子;关键分子上下游通路预测、功能富集、表型预测[/size][/font][font='宋体'][size=16px];[/size][/font][font='宋体'][size=16px](3)功能机制研究:获得或缺失关键分子后的外泌体处理肿瘤细胞,检测干[/size][/font][font='宋体'][size=16px]性表型;体内实验验证其对小鼠成瘤的影响;[/size][/font][font='宋体'][size=16px]([/size][/font][font='宋体'][size=16px]4[/size][/font][font='宋体'][size=16px])预后模型的构建:将临床信息与关键分子信息相结合,构建肝癌预后模型。[/size][/font][font='宋体'][size=16px]实验方案[/size][/font][font='宋体'][size=16px]一、组织外泌体的提取[/size][/font][font='宋体'][size=16px]1.组织切片解离,获得[/size][/font][font='宋体'][size=16px]外泌体[/size][/font][font='宋体'][size=16px]悬液[/size][/font][size=16px]([/size][size=16px]1[/size][size=16px])冰冻切片机对组织进行切片处理[/size][size=16px], [/size][size=16px]([/size][size=16px]2[/size][size=16px])将提前配好的消化酶转移到[/size][size=16px]50[/size][size=16px] [/size][size=16px]ml[/size][size=16px]的离心管中。[/size][size=16px] [/size][size=16px]([/size][size=16px]3[/size][size=16px])[/size][font='宋体'][size=16px]将[/size][/font][size=16px]装有切片组织的离心管转移至于[/size][size=16px]37℃[/size][size=16px]水浴锅中水浴孵育[/size][size=16px] 10[/size][size=16px]-[/size][size=16px]15[/size][size=16px] [/size][size=16px]min[/size][size=16px],过程每隔[/size][size=16px] 5[/size][size=16px] [/size][size=16px]min[/size][size=16px]充分混合一次观察组织形态消化情况。[/size][size=16px] [/size][size=16px]([/size][size=16px]4[/size][size=16px])[/size][size=16px]37℃[/size][size=16px]孵育结束后将组织消化混合液放置在冰上,用[/size][size=16px]70[/size][size=16px] [/size][size=16px]μm[/size][size=16px]滤膜过滤上述溶液到新的[/size][size=16px]15[/size][size=16px] [/size][size=16px]ml[/size][size=16px]的离心管中。[/size][size=16px] [/size][size=16px]([/size][size=16px]5[/size][size=16px])向每个[/size][size=16px]15[/size][size=16px] [/size][size=16px]ml[/size][size=16px]的离心管中加入[/size][size=16px] 25[/size][size=16px] [/size][size=16px]ul [/size][size=16px]蛋白酶和磷酸酶抑制剂[/size][size=16px]([/size][size=16px]1:100[/size][size=16px])[/size][size=16px]。[/size][size=16px] [/size][size=16px]2.[/size][size=16px]外泌体[/size][size=16px]悬液差速离心[/size][size=16px] [/size][size=16px]([/size][size=16px]1[/size][size=16px])[/size][size=16px]4℃[/size][size=16px],[/size][size=16px]300×g[/size][size=16px],离心[/size][size=16px] 10 min[/size][size=16px],转移上清到新的[/size][size=16px] 15[/size][size=16px] [/size][size=16px]ml [/size][size=16px]离心管中。[/size][size=16px] [/size][size=16px]([/size][size=16px]2[/size][size=16px])[/size][size=16px]4℃[/size][size=16px],[/size][size=16px]2000×g[/size][size=16px],离心[/size][size=16px] 10 min[/size][size=16px],转移上清到新的[/size][size=16px] 15[/size][size=16px] [/size][size=16px]ml [/size][size=16px]离心管中。[/size][size=16px] [/size][size=16px]([/size][size=16px]3[/size][size=16px])[/size][size=16px]4℃[/size][size=16px],[/size][size=16px]10, 000×g[/size][size=16px],离心[/size][size=16px] 20 min[/size][size=16px],上清转移到新的[/size][size=16px] 15[/size][size=16px] [/size][size=16px]ml [/size][size=16px]离心管中。[/size][size=16px] [/size][size=16px]([/size][size=16px]4[/size][size=16px])步骤([/size][size=16px]3[/size][size=16px])得到的上清液用[/size][size=16px] 10[/size][size=16px] [/size][size=16px]ml [/size][size=16px]注射器通过[/size][size=16px] 0.22[/size][size=16px] [/size][size=16px]μm [/size][size=16px]滤膜过滤进入大超离管中。[/size][size=16px] [/size][size=16px]([/size][size=16px]5[/size][size=16px])[/size][size=16px]4℃[/size][size=16px],[/size][size=16px]150,000[/size][size=16px] [/size][size=16px]×g[/size][size=16px],超离[/size][size=16px]2 h[/size][size=16px]。[/size][size=16px] [/size][font='宋体'][size=16px]([/size][/font][size=16px]6[/size][size=16px])超离结束后,弃上清,沉淀以[/size][size=16px]0.4 ml+0.4 ml[/size][size=16px]遇冷的[/size][size=16px]PBS[/size][size=16px](含有蛋白酶和磷酸酶抑制剂)溶解后,获得小囊泡。[/size][size=16px] [/size][size=16px]3. SEC [/size][size=16px]排阻[/size][size=16px]+[/size][size=16px]超滤[/size][size=16px] [/size][size=16px]([/size][size=16px]1[/size][size=16px])将超离后[/size][size=16px]1[/size][size=16px] [/size][size=16px]ml[/size][size=16px]的[/size][size=16px]PBS[/size][size=16px]洗涤的外泌体加入到排阻柱中,待液面下降至上筛板时,依次加入[/size][size=16px]PBS[/size][size=16px],并同时[/size][size=16px]([/size][size=16px]2[/size][size=16px])收集对应馏分加入[/size][size=16px] 100kd [/size][size=16px]超滤管中。[/size][size=16px] [/size][size=16px]([/size][size=16px]3[/size][size=16px])[/size][size=16px]4℃[/size][size=16px],[/size][size=16px]4000×g[/size][size=16px],离心[/size][size=16px] 1min[/size][size=16px]。[/size][size=16px]([/size][size=16px]4[/size][size=16px])超滤至合适体积后,对着滤膜反复吹打,吸出[/size][size=16px]200[/size][size=16px] [/size][size=16px]ul[/size][size=16px]后进行[/size][size=16px]BCA[/size][size=16px]蛋白浓度检测。[/size][size=16px] [/size][size=16px]4. BCA[/size][size=16px]检测[/size][size=16px] [/size][size=16px]将超滤得到的外泌体进行[/size][size=16px]BCA[/size][size=16px]蛋白浓度检测。[/size][size=16px]二、外泌体表面蛋白及[/size][size=16px]miRNA[/size][size=16px]组学分析[/size][size=16px]1.[/size][size=16px] [/size][size=16px]与疾病发生相关的[/size][size=16px]外泌体[/size][size=16px]源功能分子,差异分子的功能、通路的富集和注释。[/size][size=16px]2.[/size][size=16px] [/size][size=16px]组织外泌体验证关键分子,供体细胞的推断。[/size][size=16px]3.[/size][size=16px] [/size][size=16px]关键分子上下游通路预测,功能富集,表型预测。[/size][size=16px]4.[/size][size=16px] [/size][size=16px]预后模型的构建:将临床信息与关键分子信息相结合,构建肝癌预后模型。[/size][size=16px]三、功能机制研究[/size][size=16px]1.[/size][size=16px] [/size][size=16px]获得或缺失关键分子后的外泌体处理肿瘤细胞,检测干性表型。[/size][size=16px]2.[/size][size=16px] [/size][size=16px]体内实验验证其对小鼠成瘤的影响:经溯源分析得出不同亚群外泌体的来源,将特定来源的外泌体注入小鼠体内,研究其对小鼠成瘤的影响。[/size][size=16px]可行性分析[/size][size=16px]本课题组前期进行了外泌体提取的相关研究,已取得学术成果。[/size][size=16px]1[/size][size=16px])科研基础扎实:申请者研究团队从事相关基础研究多年,近年在国内外期刊上发表论文多篇,具备高质量完成项目的能力。[/size][size=16px]2[/size][size=16px])研究目标切实:本课题密切联系外泌体研究现状,旨在研究组织外泌体与疾病关系,并为疾病的诊断和治疗提供切实合理的方案。[/size][size=16px]3[/size][size=16px])技术平台与硬件设施完善:申请者所在单位的分子生物学及生物信息学各项研究方法比较成熟,具备完成实验所需的全套设备,并且已熟练掌握上述技术路线涉及的各种实验方法。[/size][size=16px]4[/size][size=16px])项目组成员近年来连续从事外泌体捕获及分离方法研究,熟悉该研究领域的动态前沿,有一定的研究功底。[/size][size=16px]5[/size][size=16px])本项目的研究团队人员配置合理,骨干成员均为年富力强的中青年科学工作者和技术骨干,有较强科研履约能力和良好履约记录。[/size]创新点:[size=16px]目前对于外泌体的研究大多局限于体液外泌体,体液来源的[/size][size=16px]外泌体[/size][size=16px]在疾病研究和早诊方面存在一定的局限性。首先,体液[/size][size=16px]外泌体[/size][size=16px]来源于机体内的各种细胞、组织导致其组成复杂,鉴定出的标志物是否为肿瘤所特异并无清晰阐述。其次,组织微环境中包括肿瘤细胞和其他各种细胞的复杂作用。本研究直接从组织中提取的[/size][size=16px]外泌体([/size][size=16px]Ti-EVs[/size][size=16px])[/size][size=16px]具有组织特异性、准确反映组织微环境以及携带更丰富的信息等优点。[/size]
FOSS的定标模型目前是否有成熟的方法可转移成布鲁克的模型?
[em09502]各位我现在也需要近红外模型建立及模型转移方面的相关资料,中英文皆可。希望各位同事帮帮忙。万谢万谢!!
[font=宋体][font=宋体]在线分析校正模型的建立主要分为[/font][font=Times New Roman]5[/font][font=宋体]个步骤:[/font][/font][font=宋体][font=宋体]([/font][font=Times New Roman]1[/font][font=宋体])获取代表性样品并采集对应的[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]。校正模型预测性能的稳健性很大程度上取决于样品本身的代表性,因此获取有良好代表性的样品是建模过程中及其关键的一环。待获取样品后,利用光谱采集装置进行在线[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]的采集,然后利用标准方法测定各份样品待测指标的数值,最后获得样品待测指标与对应光谱信息一一对应的数据集。[/font][/font][font=宋体][font=宋体]([/font][font=Times New Roman]2[/font][font=宋体])校正样本集与验证样品集的选择。校正样本集用来模型训练而验证样本集则用来验证模型的预测性能。理想的校正集应包含未来待测样本中可能存在的所有化学成分,其浓度范围应大于待测样本。目前,常利用[/font][font=Times New Roman]Kennard[/font][/font][font='Times New Roman']-Stone[/font][font=宋体]法、光谱[/font][font='Times New Roman']-[/font][font=宋体]理化值共生距离法进行校正集和验证集的选取。[/font][font=宋体][font=宋体]([/font][font=Times New Roman]3[/font][font=宋体])光谱预处理及波长筛选。在建模过程中,光谱预处理往往是必不可少的,运用适当的方法进行预处理可以有效保留光谱中的关键信息并剔除噪声信息,以提升校正模型的预测性能。波长选择也是重要环节之一,进行波长筛选一方面可以简化模型,更主要的是由于不相关或非线性变量的剔除,可以得到预测能力强、稳健性好的模型。[/font][/font][font=宋体][font=宋体]([/font][font=Times New Roman]4[/font][font=宋体])异常样本的剔除。异常样本会极大的影响建模过程,降低模型的预测准确性和稳定性,因此需要异常样本的识别与剔除。[/font][/font][font=宋体][font=宋体]([/font][font=Times New Roman]5[/font][font=宋体])校正模型的建立。待前面[/font][font=Times New Roman]4[/font][font=宋体]个部分的工作完成后,借助化学计量学算法建立定量校正模型,运用校正标准误差、预测标准误差、决定系数或相关系数等对校正模型的预测性能进行评价。涉及建立、评价定量校正模型或定性判别模型(类模型)可参考[/font][/font][font='Times New Roman']ASTM E-1655[/font][font=宋体]、[/font][font='Times New Roman']GB/T29858-2013[/font][font=宋体]和[/font][font='Times New Roman']GB/T37969-2019[/font][font=宋体]等[/font][font='Times New Roman'][font=宋体]标准[/font][/font][font=宋体]。[/font][font='Times New Roman'][font=宋体]此外,在线模型也可由实验室建立的离线模型通过模型传递技术获得。[/font][/font]
用同样的数据,同样的数学处理得到的模型为什么不一样?今天我用一组数据做一个模型,然后把这组数据按一成分含量高低排序,重新做模型,做模型的数学处理方法也是一样的。但是为什么模型不一样呢?两个模型预测另外一组数据,预测结果有的差的还很大? 这是什么原因呢? 大虾们有知道的吗? http://simg.instrument.com.cn/bbs/images/brow/em09501.gif
我们知道在近红外的实际应用中,在某一近红外仪(称源机)上建立的校正模型,即便在另外一台与源机相同功能的近红外仪(称为目标机)上使用时,因各仪器测量的光谱有差异,模型不再适用,计算结果偏差很大或根本无法使用,解决这类问题的过程称为模型转移,也称为仪器标准化。众所周知建立近红外校正模型时往往需要测量大量样品的化学值或基础性质作为数据基础,投入大、成本高,因此使用模型转移技术实现模型共享和有效利用非常必要。模型转移可克服样品在不同仪器上的量测信号(或光谱) 间的不一致性,通过信号处理以消除仪器对量测信号的影响 ,不仅使已有模型具有较好的动态适应性,而且可以减少因重复建模造成的人力、物力、财力以及时间的浪费。大家在模型转移过程中遇到过什么问题,或有什么好的经验及建议,欢迎一起讨论。下面的四篇英文文献都是近红外模型转移的一些介绍
【序号】:4【作者】:黄少凤1林忠2朱雪红2【题名】:宫腔粘连大鼠模型研究进展【期刊】:实验动物与比较医学. 【年、卷、期、起止页码】:2022,42(06)【全文链接】:https://kns.cnki.net/kcms2/article/abstract?v=PN9vNVFTqfd3Hs02bPHe3etciaCyN08tdzsMiZNWLBM0IKwVzAuzmd3xuB3gQP7OelKdG6N1jBAgydac12VnNNwTWZEB7h_dVeDb9PK56_-GDIJ7khPVbsIOU6nTOVNCOSugR0CQ-oamaJdw9qToMg==&uniplatform=NZKPT&language=CHS
[font=宋体][font=宋体]在模型的应用过程中,原料种植环境和工艺条件等的改变或调整都会导致模型不再适用,这时就需要进行模型的更新和维护。模型的更新过程需要收集多个有代表性的新样本,然后,按照常规建模流程添加到原模型校正集中,重新建立模型。如果进行了模型更新则需要重新进行验证过程。对模型更新验证集的要求与新建模型时相同,原有的验证集样本可以用于新模型的验证,但是,必须补充代表新范围或新类型的样本。读者可参考分子光谱多元校正定量分析通则[/font] [font=Times New Roman](GB/T[/font][/font][font='Times New Roman'] 29858[/font][font=宋体][font=Times New Roman]-[/font][/font][font='Times New Roman']2013[/font][font=宋体][font=Times New Roman])[/font][font=宋体]。[/font][/font]
ARIMA模型一般是利用预测变量的过去值、当前值和误差值进行预测。那么如何利用含有自变量的ARIMA模型进行预测?模型阶数的确定方法还是一样的么?模型的参数怎么确定呢?有什么软件可以实现还是继续用eviews?希望高手帮助解答,谢谢。
建立近红外模型之后,怎样验证模型或者评价模型的好坏?
提 要 通过 1949 年以来在各种出版物上已发表的 27 种生物多样性模型分析发现,大多数多样性模型在理论上是不完善的。例如,被应用最广泛的 Shannon 模型至少有 4 个缺点:①没有考虑物种间生物量的区别;②如果要使用 Shannon 模型,每种物种的个数或每种景观单元的个数不能小于 100;③模型中没有隐含面积参数;④不能够表达多样性的丰富性方面。因此,作者推举了一种理论上完善的综合生物多样性模型,并为了满足实际操作和生物多样性自相似性研究的需要,对其中的一些参数进行了修正。关键词 多样性;丰富性;均一性;理论模型[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=103383]生物多样性模型研究[/url]
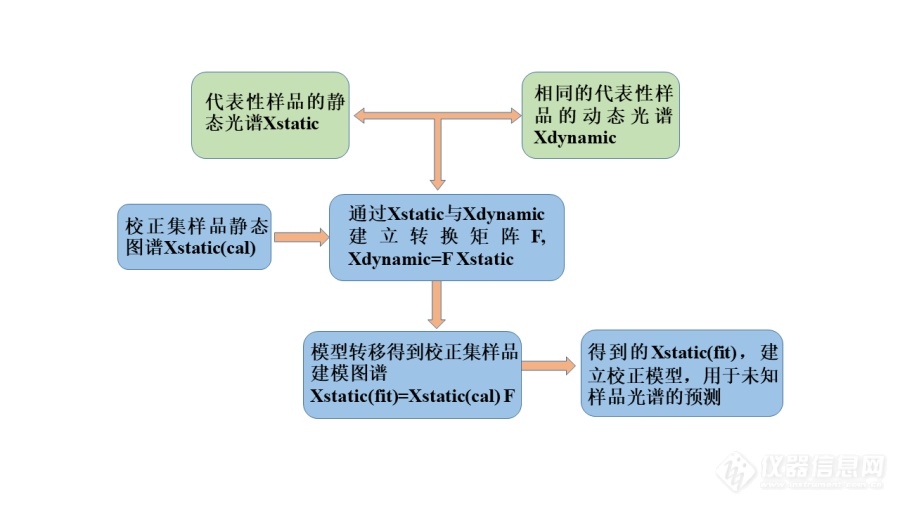
[font='times new roman'][size=18px][b]模型转移[/b][/size][/font][font='times new roman'][size=18px][b]简介[/b][/size][/font][font='times new roman'][size=16px]模型转移可以定义为光谱数据或校准模型的数学转换,以便使所开发的方法与不同的仪器或不同的测量条件兼容。[/size][/font][font='times new roman'][size=16px]模型转移[/size][/font][font='times new roman'][size=16px]的目的是确保在不同情况下获得的[/size][/font][font='times new roman'][size=16px]模型[/size][/font][font='times new roman'][size=16px]结果的互换性,而不必对每种情况进行耗时的重新校准。化学计量[/size][/font][font='times new roman'][size=16px]学[/size][/font][font='times new roman'][size=16px]用于纠正仪器和环境的差异,如仪器反应功能的变化[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]由仪器更换部分零件或设备老化[/size][/font][font='times new roman'][size=16px]引起)[/size][/font][font='times new roman'][size=16px]、样品的物理或化学组成[/size][/font][font='times new roman'][size=16px]的[/size][/font][font='times new roman'][size=16px]改变[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]例如[/size][/font][font='times new roman'][size=16px]颗粒[/size][/font][font='times new roman'][size=16px]大小、表面结构、粘度等[/size][/font][font='times new roman'][size=16px])[/size][/font][font='times new roman'][size=16px]及测量条件的变化[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]如温度和湿度的变化[/size][/font][font='times new roman'][size=16px])等。在本研究中,使用[/size][/font][font='times new roman'][size=16px]相[/size][/font][font='times new roman'][size=16px]同的仪器设备采集的在线与离线[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]被解释为测量条件的变化,[/size][/font][font='times new roman'][size=16px]样品以不同的方式呈现给光谱[/size][/font][font='times new roman'][size=16px]采集[/size][/font][font='times new roman'][size=16px]系统。[/size][/font][font='times new roman'][size=16px]此外,随着光谱采集时间的推移,即使同一样品的光谱也会出现漂移、波长转变、线性或非线性改变等变化,[/size][/font][font='times new roman'][size=16px]因此[/size][/font][font='times new roman'][size=16px]建立的校正集模型需要定期进行维护。如果这些变化不通过定期采集新的校正集光谱进行维护,建立的模型会出现不可估量的误差[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]且在线模型较离线模型的收集需要消耗更多的物料,模型的定期维护需要更多的经济投入。为了提高在线模型的精度,节省成本,减少校正集光谱收集及模型维护带来的经济成本,采用化学计量学方法对离线光谱与在线光谱间模型传递进行研究,提高了模型的精度和稳定性。[/size][/font][font='times new roman'][size=16px]离线模型的建立验证了便携式[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]用于流化床混合过程[/size][/font][font='times new roman'][size=16px]API[/size][/font][font='times new roman'][size=16px]含量监测的可行性。由于物料的动态特性及其他影响因素的干扰,在线模型精度较低。此外,随着光谱采集时间、环境等的推移,即使同一样品的光谱也会出现漂移、线性或非线性改变等变化,[/size][/font][font='times new roman'][size=16px]故建立[/size][/font][font='times new roman'][size=16px]的校正集模型需要定期进行维护。如果这些变化不通过定期采集新的校正集光谱进行维护,建立的模型会出现不可估量的误差,给生产和检验带来不可估量的损失,且在线模型较离线模型的收集需要消耗更多的物料,模型的定期维护需要更多的经济投入。为了提高在线模型的精度,节省成本,减少校正集光谱收集及模型维护带来的经济成本,[/size][/font][font='times new roman'][size=16px]针[/size][/font][font='times new roman'][size=16px]对流化床混合过程中建立的[/size][/font][font='times new roman'][size=16px]API[/size][/font][font='times new roman'][size=16px]含量[/size][/font][font='times new roman'][size=16px]定量分析模型,采用化学计量学方法对离线光谱与在线光谱间模型传递进行研究,提高了模型的精度和稳定性,将模型转移后建立的新模型用于中试生产过程[/size][/font][font='times new roman'][size=16px]API[/size][/font][font='times new roman'][size=16px]含量的在线监测,实现了实验室到中试应用的理论和实践研究。[/size][/font][font='times new roman'][size=16px]目前,模型转移方法主要包括两大类:光谱数据的模型传递法和结果校正的[/size][/font][font='times new roman'][size=16px]模型传递法[/size][/font][font='times new roman'][size=16px][color=#080000][73, 74][/color][/size][/font][font='times new roman'][size=16px]。其中光谱数据的模型传递包括光谱吸光度及波长(或波数)的校正两个方面。在诸多模型传递方法中,分段直接标准化法[/size][/font][font='times new roman'][size=16px](Piecewise direct standardization,[/size][/font][font='times new roman'][size=16px] [/size][/font][font='times new roman'][size=16px]PDS)[/size][/font][font='times new roman'][size=16px]是最常用的方法之一,也是常用的评价模型传递新方法的参比方法,在模型传递方法中占有重要地位。另一个常用的方法是分段反向标准化法[/size][/font][font='times new roman'][size=16px](Piecewise reverse standardization,[/size][/font][font='times new roman'][size=16px] [/size][/font][font='times new roman'][size=16px]PRS)[/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]PDS[/size][/font][font='times new roman'][size=16px][color=#080000][75, 76][/color][/size][/font][font='times new roman'][size=16px]法和[/size][/font][font='times new roman'][size=16px]PRS[/size][/font][font='times new roman'][size=16px]法在原理相同的,但数据转换方向不同。[/size][/font][font='times new roman'][size=16px]PDS[/size][/font][font='times new roman'][size=16px]法是将辅仪器[/size][/font][font='times new roman'][size=16px](slave instrument)[/size][/font][font='times new roman'][size=16px]的光谱数据向主仪器方向转换或者将精度低的光谱数据向精度高的方向转换,[/size][/font][font='times new roman'][size=16px]PRS[/size][/font][font='times new roman'][size=16px]法相反,是将将精度高的光谱数据向精度低的方向转换。[/size][/font][font='times new roman'][size=16px]采用化学计量学方法对离线光谱和在线光谱间模型传递进行研究,提高了模型精度,节省了校正集收集及模型维护成本,实现了由实验室到工厂实际应用的理论和实践研究,具体计算过程如图所示,研究内容主要包括:[/size][/font][font='宋体'][size=16px]①[/size][/font][font='times new roman'][size=16px]流化床混合过程中,标准离线光谱[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]Xstatic[/size][/font][font='times new roman'][size=16px])[/size][/font][font='times new roman'][size=16px]的收集和标准在线光谱[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]Xdynamic[/size][/font][font='times new roman'][size=16px])[/size][/font][font='times new roman'][size=16px]的收集。[/size][/font][font='宋体'][size=16px]②[/size][/font][font='times new roman'][size=16px]通过标准离线光谱[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]Xstatic[/size][/font][font='times new roman'][size=16px])[/size][/font][font='times new roman'][size=16px]和标准在线光谱[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]Xdynamic[/size][/font][font='times new roman'][size=16px])[/size][/font][font='times new roman'][size=16px]建立转换矩阵[/size][/font][font='times new roman'][size=16px][b]F[/b][/size][/font][font='times new roman'][size=16px]。[/size][/font][font='宋体'][size=16px]③[/size][/font][font='times new roman'][size=16px]将采集到的校正集样品离线光谱[/size][/font][font='times new roman'][size=16px]X[/size][/font][font='times new roman'][size=16px]static[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]cal[/size][/font][font='times new roman'][size=16px])[/size][/font][font='times new roman'][size=16px]通过转换矩阵得到新的校正集建模光谱[/size][/font][font='times new roman'][size=16px]X[/size][/font][font='times new roman'][size=16px]static[/size][/font][font='times new roman'][size=16px](fit)=[/size][/font][font='times new roman'][size=16px]Xstatic[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]cal[/size][/font][font='times new roman'][size=16px]) [/size][/font][font='times new roman'][size=16px][b]F[/b][/size][/font][font='times new roman'][size=16px].[/size][/font][font='宋体'][size=16px]④[/size][/font][font='times new roman'][size=16px]将得到的校正集光谱矩阵[/size][/font][font='times new roman'][size=16px]X[/size][/font][font='times new roman'][size=16px]static[/size][/font][font='times new roman'][size=16px](fit)[/size][/font][font='times new roman'][size=16px]用于建立校正集模型,用于未知样品的预测。[/size][/font][font='宋体'][size=16px]⑤[/size][/font][font='times new roman'][size=16px]模型传递后与原在线模型及离线模型的比较。[/size][/font][font='宋体'][size=16px]⑥[/size][/font][font='times new roman'][size=16px]将模型转移后的模型用于中试流化床混合过程在线监测并对测量结果进行评价。[/size][/font][align=center][img]https://ng1.17img.cn/bbsfiles/images/2020/09/202009102207075705_1626_3890113_3.png[/img][/align][align=center][font='times new roman']模型转移计算流程图[/font][/align]
在近红外运用过程中,有一个常常被人提起的说法,就是“近红外光谱分析法的测定结果不如参考方法的准确”。这已经基本成为大家在应用近红外时的常识了。但真想真如此吗? 我们知道,近红外模型的数据来源是通过传统方法得到的近红外分析方法作为间接的分析方法,在人们认识上,其准确度必然低于直接分析法(也就是定标方法)。但褚小立博士做过一个实验,结论指出,在精度相对较差的情况下,近红外光谱预测出的数据更接近于真值(具体情况请参见附件文献其理论依据是,通过大量样本的光谱分析和化学计量学统计处理,已经将结果回归到正常范围。 在你心中,在你的认识里,近红外的预测结果与实验结果谁的误差大些? 近红外能不能冲破“近红外光谱分析法的测定结果不如参考方法的准确”的魔咒,成为国标制定的新的方向,甚至是在一些工作中成为强制执行的质控标准?
食品近红外模型建立,两种较相似的食品,检测同一种指标,可用这两种食品建立同一种指标的模型吗?
[font=&]【序号】:10[/font][font=&]【作者】:[b]程燕声[/b][/font][font=&]【题名】:[b][b][b][b][b][b][b]实验室认可风险的量化评价模型研究[/b][/b][/b][/b][/b][/b][/b][/font][font=&]【期刊、年、卷、期、起止页码】:现代测量与实验室管理. 2015,23(02)[/font],页码:[font=&][size=12px][color=#666666]34-36[/color][/size][/font][font=&][/font][font=&]【全文链接】:https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CJFD&dbname=CJFDLAST2015&filename=XDJL201502013&uniplatform=NZKPT&v=dc8fsEjC2X5ALrcl5IXkx2K8tZwuAB0M4DOApqnXRHtijLQCmwAayeRZyTQddO6w[/font]
现在使用最广的模型转移算法是所谓的pair matching方法,我的问题是怎么保证那个光谱或者说光谱所测量的体系在校正转移前后是绝对一样的,而不受温度,湿度等等的影响。换句话说,在模型转移的过程中怎么提供一个绝对不变的被测体系呢?
各位前辈,我是菜鸟,问的问题可能有点弱智,我想咨询一下建立定量模型的问题,在建立定量模型的时候,因样本较少(50多份),我用校正集建立模型,在参数检验的时候,用的是交叉检验,在曲线下面,如果选用Validation检验,R2较小,RMSECV较大,我应该怎样调整我的模型呢,我还想想问一下怎么评价一个模型的好坏,谢谢!
如何建立数学模型讲授人:中国计量科学研究院研究员 倪育才 在测量不确定度评定中,建立数学模型也称为测量模型化,目的是要建立满足测量不确定度评定所要求的数学模型,即建立被测量Y和所有各影响量X间的函数关系,其一般形式可写为: Y=f(X1,X2,…,Xn) 可以说,建立数学模型是进行测量不确定度评定最关键的第一步,也是许多初学者在进行测量不确定度评定时遇到的第一个困难。 《测量不确定度表示指南》(GUM)在摘要介绍测量不确定度评定步骤时,首先就提到要建立数学模型,并说:“The function f should contain everyquantity, including all corrections and correction factors, that can contributea significant component of uncertainty to the result of measurement. ”。其意是数学模型f中应包含所有对测量结果的不确定度有影响的修正值和修正因子。也就是说,数学模型中应包含所有应该考虑的影响量,而每一个影响量将对测量结果贡献一个值得考虑的不确定度分量。因此一个好的数学模型,其中所包含的影响量和此后不确定度评定中所考虑的每一个不确定度分量应该是一一对应的。这样建立起来的数学模型,既能用来计算测量结果,又能用来全面地评定测量结果的不确定度。 要找出每一个影响量与被测量之间的函数关系,往往是很困难的,有时简直不可能得到两者关系的解析表达式。于是许多初学者往往将测量中用来获得被测量的计算公式作为数学模型而列出。例如在各种测量中,最经常采用的方法之一是比较测量。将被测量值y和参考标准所提供的标准量值s相比较,通过测量两者之差Δ可以计算出被测量y。于是在已经发表的各种测量不确定度评定的文章中,经常见到将y=x+Δ作为数学模型的情况。但在进行不确定度评定时,则又往往脱离数学模型而重新考虑各个不确定度分量。这样的数学模型对测量不确定度评定实际上毫无帮助。 在某些特殊情况下(例如某些检测项目)将计算公式作为数学模型可能是允许的,但一般说来不要把数学模型简单地理解为就是计算测量结果的公式,也不要理解为就是测量的基本原理公式。两者之间经常是有区别的。 从原则上说,似乎所有对测量结果有影响的输入量都应该在计算公式中出现,但实际情况却不然。有些输入量虽然对测量结果有影响,但由于信息量的缺乏,在具体测量时无法定量地计算它们对测量结果的影响。也有些输入量由于对测量结果的影响很小而被忽略,故在测量结果的计算公式中也不出现,但它们对测量结果的不确定度的影响却可能是必须考虑的。因此如果仅从计算公式出发来进行不确定度评定,则上述这些不确定度分量就可能被遗漏。当然,在某些特殊情况下如果所有其他不确定度贡献因素的影响都可以忽略不计时,数学模型也可能与计算公式相同。 对于不同的被测量和不同的测量方法,数学模型的具体形式可能差别很大,但实际上都可以用一种比较系统的方式来给出数学模型,或者说可以给出数学模型的通式。 根据测量误差的定义:误差=测量结果-真值。同时误差又可以分为随机误差和系统误差两类,且三者之间的关系为:误差=系统误差+随机误差。于是可以得到: 真值=测量结果-误差 =测量结果-系统误差-随机误差 由于修正值等于负的误差,于是上面的关系式就成为: 真值=测量结果-系统误差-随机误差 =测量结果+系统误差的修正值+随机误差的修正值 实际上,真值就是想得到的被测量的测量结果,于是上式可写成 被测量=测量结果+系统误差的修正值+随机误差的修正值 例1:对于常见的量块比较测量,若ls为标准量块的长度,Δl为测得的两量块的长度差,于是被测量块长度lx的计算公式为: lx=ls+Δl 由于测量时量块的温度通常会偏离标准参考温度20℃,考虑到温度和线膨胀系数对测量结果的影响,计算公式成为: lx=ls+Δl+lsδαθx+lsαsδθ 式中α和θ分别表示线膨胀系数和对标准参考温度20℃的偏差;脚标“s”、“x”分别表示标准量块和被测量块;以及δθ=θs-θx和δα=αs-αx。 考虑到量块测量点可能偏离量块测量面中心点对测量结果的影响,数学模型成为: lx=ls+Δl+lsδαθx+lsαsδθ+δl 将此数学模型和上面给出的通式相比较就可以发现,等式右边的第一、二项ls+Δl即是由测量得到的未修正的测量结果。等式右边的第三、四项lsδαθx+lsαsδθ是对由温度偏差所引入的系统误差的修正值,在本例中这两项的数值十分小而可以忽略,但它们对测量结果不确定度的影响是必须考虑的。等式右边的最后一项δl,是表示由于测量点可能偏离量块中心对测量结果的影响。测量点的偏离对测量结果引入随机误差,因此最后一项实际上是对该随机误差的修正值。由下图可见两者之间的对应关系。http://ng1.17img.cn/bbsfiles/images/2013/10/201310181455_471725_2771427_3.jpg 例2:砝码校准,将被测砝码的质量与具有相同标称值的标准砝码相比较。若被校准砝码和标准砝码的折算质量分别为mx和ms,测得两者的质量差为Δm,于是被校准砝码折算质量mx的计算公式为: mx=ms+Δm 考虑到标准砝码的质量自最近一次校准以来可能产生的漂移Δmd,质量比较仪的偏心度和磁效应的影响Δmc,以及空气浮力对测量结果的影响δB后,其数学模型成为: mx=ms+Δm+δmd+δmc+δB 模型中等式右边的第一、二项为未修正的测量结果。该测量不存在值得考虑的系统误差,也就是说,在数学模型中不存在对系统误差的修正值。等式右边的第三、四、五项为对三项随机误差分量的修正量。与数学模型通式之间的对应关系为:http://ng1.17img.cn/bbsfiles/images/2013/10/201310181455_471726_2771427_3.jpg 在建立数学模型时,未修正的测量结果和系统误差的修正值通常都能比较容易地得到解析形式的数学表达式。惟有随机误差的修正值无法得到其解析形式的表达式。因此只能在数学模型中简单地加上一项,表示对随机误差的修正值。根据随机误差的定义,无限多次测量结果的随机误差的平均值等于零,因此这些项的数学期望为零。也就是说,增加这些修正值后不会对被测量的数值有影响。需要知道的是这些修正值的可能取值范围,通常可以由测量者的经验或
恒温恒湿试验箱温湿度校准系统模型的建立是依据各类气候试验箱、恒温恒湿试验箱、高低温湿热试验箱、高低温交变湿热试验箱、培养箱及大型试验环境的温湿度测试检定方法。主要参考了以下标准: GB/T 10586-2006《湿热试验箱技术条件》 GB/T 5170.1-2008《电工电子产品环境试验设备基本参数检定方法 总则》 GB/T 5170.5-2008《 电工电子产品环境试验设备基本参数检定方法 湿热试验设备》 GB/T 5170.2-2008《电工电子产品环境试验设备检验方法 温度试验设备》 JJF 1101-2003《环境试验设备温度、湿度校准规范》 GJB/J 3827-1999《标准恒温恒湿箱检定规程》等的要求,应同时多点测试才能满足要求。因此确定多传感器多点实时温湿度测量的方案。