
公司(上海********有限公司)现有waters 质谱/UV 引导的自动纯化系统一套。该系统具备:沃特世AutoPurification系统可以同时与UV,RI,ELSD,PDA,MS等多种检测器并联,从而一针进样可以同时得到多种检测信号,获得更多更完整的信息。并可以其中任何一个或多个信号触发收集。大大提高分离纯化通量和纯度。这套系统设计可以用单一指令来切换最多5根色谱柱(3根分析柱,2根制备柱)。 结合沃特世最佳柱床优化设计的OBD制备柱,可以对复杂的中药进行高效分离,并获得最佳的柱寿命。系统优势■ 是目前市面上唯一一款能够实现从粗品分析到馏分收MS/ UV 引导的自动纯化制备系统(AutoPurification system)在TCM中的应用集再到馏分纯度再分析的全自动化过程的纯化系统,具有独立的分析及制备进样阀及管路,可实现完全自动化的复杂物质的分析方法开发,制备方法开发,馏分纯度分析的功能■ 该纯化系统的二元高压梯度溶剂泵,具有专利的11条梯度曲线功能(梯度曲线:11条包括1条线性,2条阶梯,4条凹线,4条凸线), 对于复杂化合物的分离,如中药等具有快速,高效分离的特点。且该泵具有完整的,自动的,可编程控制的泵密封冲洗程序,有效提高泵的使用性能■ 该系统标准配置分析方法到制备方法开发的计算器,可以实现从分析到制备的无忧放大,保证复杂化合物的制备效率■ 具备完全独立的纯化软件系统,能自动对色谱峰形进行切割、区分,同时可采用分子量及紫外光谱纯度,保留时间或模拟信号等设定多种触发模式进行收集设置http://ng1.17img.cn/bbsfiles/images/2011/09/201109251936_319223_1929184_3.jpg

公司(上海************有限公司)沃特世AutoPurification 系统主要用于复杂基质中各种目标化合物的分析及制备。可以根据多种触发模式进行合成药,环境毒素,中药、天然产物、多肽等复杂基质组分的分离及纯化。众所周知中药成分复杂,采用传统分离制备方法,面临着上样量、分离度、回收率、分析到制备的无忧放大,高通量等多方面的挑战。沃特世AutoPurification系统可以同时与UV,RI,ELSD,PDA,MS等多种检测器并联,从而一针进样可以同时得到多种检测信号,获得更多更完整的信息。并可以其中任何一个或多个信号触发收集。大大提高分离纯化通量和纯度。这套系统设计可以用单一指令来切换最多5根色谱柱(3根分析柱,2根制备柱)。 结合沃特世最佳柱床优化设计的OBD制备柱,可以对复杂的中药进行高效分离,并获得最佳的柱寿命。系统优势■ 是目前市面上唯一一款能够实现从粗品分析到馏分收MS/ UV 引导的自动纯化制备系统(AutoPurification system)在TCM中的应用集再到馏分纯度再分析的全自动化过程的纯化系统,具有独立的分析及制备进样阀及管路,可实现完全自动化的复杂物质的分析方法开发,制备方法开发,馏分纯度分析的功能■ 该纯化系统的二元高压梯度溶剂泵,具有专利的11条梯度曲线功能(梯度曲线:11条包括1条线性,2条阶梯,4条凹线,4条凸线), 对于复杂化合物的分离,如中药等具有快速,高效分离的特点。且该泵具有完整的,自动的,可编程控制的泵密封冲洗程序,有效提高泵的使用性能■ 该系统标准配置分析方法到制备方法开发的计算器,可以实现从分析到制备的无忧放大,保证复杂化合物的制备效率■ 具备完全独立的纯化软件系统,能自动对色谱峰形进行切割、区分,同时可采用分子量及紫外光谱纯度,保留时间或模拟信号等设定多种触发模式进行收集设置http://ng1.17img.cn/bbsfiles/images/2011/09/201109251941_319224_1929184_3.jpg
常用分离纯化技术研究开发 1) 高效液相色谱填料和色谱柱2) 手性色谱固定相的制备与应用3) 手性药物及其中间体的拆分与转化4) 生物磁分离技术和产品5) 高通量分离纯化技术与装置6) 蛋白质组分析技术与产品7) 高效毛细管电泳分离分析技术 1) 高效液相色谱填料和色谱柱高效液相色谱法(HPLC)是六十年代末发展起来的化学分离分析方法。在这一方法中,微米级的多孔颗粒被用作固定相,而有机溶剂或水溶液被用作流动相。 样品溶液在高压泵的驱动下,流过装填固定相的色谱柱。 在流动过程中,化合物在流动相与固定相之间多次分配,由于分配系数的差异,化合物在固定相中的滞留时间有所不同,因此可利用HPLC来实现对混合物的分离。色谱柱是HPLC的核心部件,由不锈钢空管和填充其中的固定相组成。为了分离不同类型的化合物,一台HPLC通常需要配备若干不同类型的色谱柱。色谱柱又是实验室消耗品,因为它的使用寿命是一定的。样品污染,流动相侵蚀和柱结构变化等问题可能造成色谱柱的损坏。 因此,需要根据使用情况定期更换色谱柱。HPLC中使用的色谱柱种类繁多。 根据色谱填料表面功能团的特性,色谱柱可分成正相柱,反相柱,手性柱,离子交换柱,亲和柱等。而根据色谱柱的几何尺寸,色谱柱又可分成毛细管柱,微型柱,分析柱,半制备柱,制备柱等。使用反相柱的HPLC是目前所有色谱方法中应用最广泛的一种,在食品分析,药物分析,环境分析,药品质量控制,临床医疗诊断,天然产物活性成分鉴定和环境毒物监测等方面都有着广泛的应用。而制备型HPLC更是当前分离纯化手性药物,抗癌药物如紫杉醇,合成核酸,合成多肽,重组蛋白等生物分子的不可或缺的工具。近年来,制药工业尤其是生物制药工业在我国迅速发展,国家对药品质量管理的要求不断提高,这些因素决定了未来几年我国的高效液相色谱产品市场将进入一个高速扩张期。我国的液相色谱分离纯化产品的市场容量当在亿元人民币以上,而目前这一市场主要为安捷伦等外国公司所垄断。我们开展了以球型多孔硅胶为基质的HPLC色谱填料的合成研究,开发了具有自主知识产权的硅胶生产工艺路线,并对硅胶的硅烷化反应进行了系统研究,建立起制备反相液相色谱固定相的优化条件,由我们开发的技术所生产的球型多孔硅胶具有粒径分布均匀,孔径分布范围窄,比表面积可控,表面官能团浓度高和机械强度高等特点,完全能满足现代液相色谱的要求。在此基础上,我们又研究了高效液相色谱柱制备技术,优化了高压装柱法中匀浆液、顶替液的组成,所生产的色谱柱达到或超过了国外同类产品的性价比。欢迎国内企业来人来电洽谈合作,与名校携手,共同打造色谱产品的中国品牌。file:///C:\Users\我是发~1\AppData\Local\Temp\ksohtml\wps_clip_image-11116.png峰号 样品拖尾因子塔板数/米1 丙酮1.26678722对氯硝基苯1.08698843甲苯1.02717284萘1.0068072 *TOP*2) 手性色谱固定相的制备与应用手性在近十年来成为现代制药工业的主要关注点,这主要归因于人们日益增强的认识:外消旋体药物中的一对手性体可能具有不同的药理活性、药代动力学和药效学效应。一个异构体也许能产生所希望的治疗活性,而另一个则可能是无效的,甚至是有害的。最
[font=宋体]链接:[/font]https://bbs.instrument.com.cn/topic/2112837问题描述:[font=宋体]膜分离系统应用澄清纯化技术-超[/font][font='Times New Roman','serif']/[/font][font=宋体]微滤膜系统及优点?[/font]解答:[font=宋体][color=black][back=white]澄清纯化分离所采用的膜主要是超[/back][/color][/font][color=black][back=white]/[/back][/color][font=宋体][color=black][back=white]微滤膜,由于其所能截留的物质直径大小分布范围广,被广泛应用于固液分离、大小分子物质的分离、脱除色素、产品提纯、油水分离等工艺过程中。超[/back][/color][/font][color=black][back=white]/[/back][/color][font=宋体][color=black][back=white]微滤膜分离可取代传统工艺中的自然沉降、板框过滤、真空转鼓、离心机分离、溶媒萃取、树脂提纯、活性炭脱色等工艺过程。澄清纯化技术可采用的膜分离组件主要有:陶瓷膜、平板膜、不锈钢膜、中空纤维膜、卷式膜、管式膜。[/back][/color][/font][font=宋体][color=black][back=white]采用膜分离澄清纯化的优点:[/back][/color][/font][color=black][back=white]a) [/back][/color][font=宋体][color=black][back=white]可得到绝对的真溶液,产品稳定性好。[/back][/color][/font][color=black][back=white]b) [/back][/color][font=宋体][color=black][back=white]过滤分离收率高。[/back][/color][/font][color=black][back=white]c) [/back][/color][font=宋体][color=black][back=white]分离效果好,产品质量高,运行成本低。[/back][/color][/font][color=black][back=white]d) [/back][/color][font=宋体][color=black][back=white]缩短生产周期,降低生产成本。[/back][/color][/font][color=black][back=white]e) [/back][/color][font=宋体][color=black][back=white]过程无需添加化学药品、溶媒溶剂,不带入二次污染物质。[/back][/color][/font][color=black][back=white]f) [/back][/color][font=宋体][color=black][back=white]操作简便,占地面积小,劳动力成本低。[/back][/color][/font][color=black][back=white]g) [/back][/color][font=宋体][color=black][back=white]可拓展性好,容易实现工业化扩产需求。[/back][/color][/font][color=black][back=white]h) [/back][/color][font=宋体][color=black][back=white]设备可自动运行,稳定性好,维护方便。[/back][/color][/font]以上内容来自仪器信息网《样品前处理实战宝典》
[font=宋体]蛋白质纯化系统是一种用于从混合物中纯化目标蛋白的设备和方法。它结合了多种技术和步骤,可以有效地分离和纯化蛋白质,提供高纯度和高活性的目标蛋白。蛋白质纯化系统是实现蛋白质纯化的关键装置,它结合了各种分离、富集和纯化方法,帮助科研工作者实现蛋白质的高纯度提取。[/font][font=宋体] [/font][font=宋体][b]蛋白质纯化系统的基本原理[/b][/font][font=宋体]蛋白质纯化系统主要依据蛋白质的特性利用不同的物理化学方法进行分离和纯化。下面将介绍几种常见的蛋白质纯化系统的基本原理。[/font][font=宋体] [/font][font=宋体][font=宋体]①[url=https://cn.sinobiological.com/resource/protein-review/protein-purification-by-ac][b]亲和层析[/b][/url][/font][/font][font=宋体]亲和层析是一种基于蛋白质的特异性与配体的亲和性相互作用来实现分离和纯化的方法。在亲和层析过程中,蛋白质溶液通过填充有配体的柱子,与配体结合形成复合物,而非特异性结合的其他组分被洗脱。最后,通过改变条件来破坏蛋白质与配体的结合,从而使得目标蛋白质得以纯化。[/font][font=宋体] [/font][font=宋体]②凝胶过滤层析[/font][font=宋体]凝胶过滤层析是一种基于蛋白质大小差异来进行分离的方法。在凝胶过滤层析中,待纯化的蛋白质溶液通过一系列的凝胶层析柱,大分子的蛋白质不能进入凝胶颗粒的内部,而小分子的蛋白质则可以进入凝胶颗粒内部。通过调整凝胶的孔径,可以实现对目标蛋白质的选择性分离和纯化。[/font][font=宋体] [/font][font=宋体][font=宋体]③[url=https://cn.sinobiological.com/resource/protein-review/protein-purification-by-iec][b]离子交换层析[/b][/url][/font][/font][font=宋体][font=宋体]离子交换层析是一种基于蛋白质与固定在柱子上的离子交换基的电荷相互作用来实现分离和纯化的方法。在离子交换层析中,蛋白质溶液通过带有离子交换基的柱子,与柱子上的离子交换基之间发生相互作用。通过改变溶液的离子浓度和[/font][font=Calibri]pH[/font][font=宋体]值,可以实现对蛋白质的选择性吸附和洗脱。[/font][/font][font=宋体] [/font][font=宋体]④逆流层析[/font][font=宋体]逆流层析是一种基于分子质量和电荷差异来实现蛋白质分离和纯化的方法。在逆流层析中,蛋白质溶液通过填充有逆流层析介质的柱子,溶液在反向流动的情况下通过层析柱。由于不同蛋白质之间的分子质量和电荷差异,它们在逆流层析介质中的移动速度不同,从而实现对蛋白质的分离和纯化。[/font][font=宋体] [/font][font=宋体][b]蛋白质纯化系统的应用[/b][/font][font=宋体]蛋白质纯化系统在生物医药领域有着广泛的应用,下面将介绍几个常见的应用场景。[/font][font=宋体] [/font][font=宋体]①药物研发[/font][font=宋体]蛋白质纯化系统在药物研发中起到了非常重要的作用。通过蛋白质纯化系统,科研人员可以从复杂的生物样品中高效纯化出目标蛋白质,为药物研发提供了可靠的原料和工具。蛋白质纯化系统不仅可以提高药物研发的效率,还可以确保药物的纯度和质量,从而提高药物的疗效和安全性。[/font][font=宋体] [/font][font=宋体]②生物学研究[/font][font=宋体]在生物学研究中,蛋白质纯化系统被广泛应用于蛋白质相互作用研究、蛋白质结构解析和功能分析等方面。通过蛋白质纯化系统,科研人员可以从不同的细胞和组织中提取目标蛋白质,进一步研究它们之间的相互关系和作用机制。蛋白质纯化系统还可以用于蛋白质结构解析,帮助科学家揭示蛋白质的三维结构以及其功能。[/font][font=宋体] [/font][font=宋体]③临床诊断[/font][font=宋体]蛋白质纯化系统在临床诊断中也起到了重要的作用。通过蛋白质纯化系统,医生可以从患者的生物样本中纯化出特定的蛋白质标志物,用于疾病早期诊断、病情监测和治疗评估等方面。蛋白质纯化系统在临床诊断中的应用可以帮助医生及早发现疾病,提高诊断的准确性和效率。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体]蛋白质纯化系统是实现蛋白质纯化的重要装置,它结合了多种分离、富集和纯化方法,帮助科研人员高效地提取目标蛋白质。蛋白质纯化系统的应用广泛,不仅在药物研发、生物学研究和临床诊断等领域发挥重要作用,还为科学家揭开蛋白质的结构和功能提供了有力的支持。通过不断的技术创新和优化,蛋白质纯化系统将更好地满足科研和临床的需求,推动生物医药领域的发展。[/font][font=Calibri] [/font]
分离纯化:有一种以上的微生物培养物称为混和培养物(Mixed culture)。如果在一个菌落中所有细胞均来自于一个亲代细胞,那么这个菌落称为纯培养(Pure culture)。在进行菌种鉴定时,所用的微生物一般均要求为纯的培养物。得到纯培养的过程称为分离纯化.
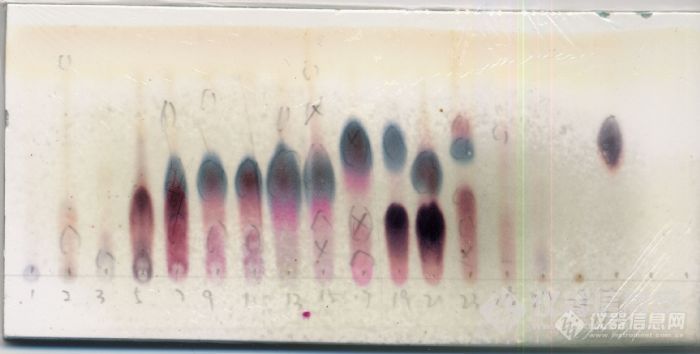
维权声明:本文为环烯醚萜原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。环烯醚萜类化合物分离纯化心得体会基本介绍 环烯醚萜(iridoids)为臭蚁二醛(iridodial)的缩醛衍生物。臭蚁二醛是由伊蚊(Iridomyrmex detectus)的防收性分泌物中分得的物质。自1958年的Halpem和Schmid确定的环烯醚萜的基本骨架以来,各国学者对该类化合物作了大量深入的研究。环烯醚萜类化合物具有多种生物活性,近来受到极大关注,发展也很迅速。 环烯醚萜类主要分为:环烯醚萜类、裂环环烯醚萜类、3,4-位无取代的环烯醚萜类、聚合环烯醚萜类等等。本人做的是普通类的环烯醚萜类化合物,且以其苷居多,做的比较浅,下面斗胆一谈,各位看官莫要见笑。提取部分 环烯醚萜苷类化合物在醇(甲醇、乙醇)中溶解度较好,部分苷类在水中溶解度也很好。本人在对某植物进行提取的时候,实际上并非针对这类化合物,采用的是60%的乙醇/水,是为了兼顾各类成分。后来在实验过程中发现,60%的乙醇/水条件下,这类化合物的提取率是很高的。 注释:其实如果要针对性分离,可以将提取液简单处理后进行D101大孔柱色谱,对环烯醚萜类化合物进行富集。萃取部分 提取之后,将药液进行浓缩,至无醇味混悬于水中,然后进行萃取。萃取的过程为:等体积的环己烷、乙酸乙酯、正丁醇分别萃取三次,合并各层提取液浓缩得各层浸膏。就目前实验进展情况来看,环烯醚萜苷类化合物主要集中在正丁醇层,水层也有一部分(我目前还没开始这部分工作)。 注释1:萃取的过程,涉及到溶剂的回收,由于这类化合物在高温下不太稳定,所以用旋转蒸发仪进行减压回收溶剂的时候,温度不能过高,我采用的温度是60度(其实60度已经很高了,但是没办法,不设60度,正丁醇回收不了)。 硅胶柱色谱 正丁醇层进行硅胶柱色谱分离,采用氯仿/甲醇梯度洗脱,样品500g,拌样硅胶1500g,柱床硅胶500g,洗脱梯度为50:1→20:1→10:1→5:1→2:1→1:1→0:1。实验的过程中发现,环烯醚萜类化合物,主要集中在氯仿:甲醇=10:1和5:1部分。 注释1:选择硅胶柱色谱,也是人之常情,此处也可选择D101大孔柱色谱,对这类化合物进行富集; 注释2:选择氯仿/甲醇系统,是因为经过小试,此系统对样品分离较好,最重要的,样品在此系统中成点性很好; 注释3:拌样1500g,柱床500g,你没有看错,我没有写错。书上说,拌样:柱床在1:1-1:10甚至1:20或者1:50,而我这里却是3:1。我可以很负责任地告诉你,没有必要按书上的说法,柱床500g足够了,分离效果一点也不差。以前做另外一个植物,拌样用了3000g,柱床才600g,分离效果也不差,一点问题都没有; 注释4:梯度的选择,建议6-8个。梯度太少,各流分成分可能过于复杂;梯度太多,后续分离麻烦。这种大型硅胶柱色谱,属于平常所说的“粗分”,不宜太多,不宜太少,不然就是给自己找麻烦。http://ng1.17img.cn/bbsfiles/images/2010/10/201010061143_249374_1745326_3.jpgODS柱色谱 包括开放型ODS柱色谱和中低压型ODS柱色谱,其实原理一样,只是规模大小不同而已。 我将5:1洗脱的样品进行中低压ODS柱色谱,采用甲醇/水梯度洗脱,水→10%甲醇/水→20%甲醇/水→30%甲醇/水→50%甲醇/水→甲醇,实验结果表明,ODS柱色谱对此类化合物具有良好的分离效果。 注释1:环烯醚萜苷类化合物一般极性较大,一般集中在10%甲醇/水、20%甲醇/水、30%甲醇/水部分; 注释2:水洗下来的,一般为糖苷类化合物,我从此流分中分离得到几个糖类化合物(题外话); 注释3:ODS柱色谱可以多次进行,反复纯化,利用ODS柱色谱可以得到部分单体化合物;http://ng1.17img.cn/bbsfiles/images/2010/10/201010061144_249375_1745326_3.jpg(注:此图为未合并相同流分前的点板情况)制备液相(反相) 从ODS柱色谱上洗脱的样品,经过分析,可以考虑进行制备液相,半制备液相等等。 事实上,一般而言,PHPLC也是获得环烯醚萜类单体化合物最重要的手段之一。 流动相可采用甲醇/水,若峰形不好,可加入少量乙酸改善(这一招屡试不爽)。 波长的选择,可以使用230nm、240nm都可以(我们有PAD检测器,验证过)。其它一些化合物,由于连上芥子酰基,对羟基香豆酰基,还可以选择320nm的吸收。 色谱柱一般是C18的居多(目前未使用过其它柱子),品牌好像都还行(我们主要使用YMC)。凝胶其它填料 由于分离原理的缘故,使用凝胶对环烯醚萜这一类化合物(分子量相差不大,且结构极为类似)进行分离,前景似乎并不明朗。但是,用凝胶将这一类化合物与其他类型的化合物分离,效果还是很不错的。 其它如大孔树脂,前面提过,用来富集是个不错的选择;聚酰胺,我没有使用过,不过从其分离原理来看,对这类化合物不会很敏感。显色剂的选择 部分环烯醚萜类在254nm紫外下有暗斑,这个很实用; 最常用的是浓硫酸-香草醛显色剂:母核上有羟基取代的显蓝色;母核上无羟基取代显紫红色(非绝对); 其它显色剂如硫酸乙醇、碘等等都可以,我个人偏爱浓-香显色剂。结构测定与解析(简) 环烯醚萜类化合物进行NMR测试,首先氘代甲醇,这个没有任何疑问。 我在一些文献中,也看到一些特例,比如使用重水、氘代DMSO,这些基本可以忽略。 关于结构解析部分,此处不再赘述。
全自动层析分离纯化系统和制备液相是一样的吗?有什么区别?
蛋白质在分子生物学中的分类,大体上可分为天然蛋白和重组蛋白。提取天然蛋白和构建重组蛋白都需要先确定生物原材料,如植物材料主要以植物的叶,胚,果实和根茎等为主;动物通常是选用实验动物的器官和组织;而微生物则是微生物菌体本身或发酵液。从原则上讲,任何一种自然界中存在或不存在的蛋白质都可以被外源表达出来,像原核蛋白表达就是以大肠杆菌(E.coli)为宿主菌表达克隆基因,在原核表达体系中,重组蛋白的含量比杂蛋白的含量高的多,所以选择和设计合适的分离纯化方案对于重组蛋白表达纯化的下游实验就显得尤为重要。本文介绍了在蛋白表达纯化试验中,对不同来源的材料的预处理。主要从植物,动物和微生物三种源材料的特点和注意事项进行描述,并附有原核蛋白表达的案例。
维权声明:本文为环烯醚萜原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。老生常谈——开放ODS柱色谱在分离纯化中的应用什么是ODS? ODS是英文octadecyl silane的缩写,意思是十八烷基硅烷,是以硅胶为基质键合的C18填料,属于反相色谱。ODS柱色谱,简单地说,就是指用ODS装成的色谱柱啦。“开放”一词,是指未对色谱柱施加任何压力,让其在重力作用下洗脱;相对于开放ODS柱色谱,有中低压柱色谱,高低柱色谱等等。 我们平时所说的反相HPLC,一定程度上来说,其实也可以说是ODS柱色谱,只不过它的分离效果更好,还配备了紫外或者示差等高级地检测手段,其实质还是属于反相柱色谱。适用范围有哪些? 首先需要说明:ODS在分离纯化的过程中,起着极为巨大的作用!! 就化合物极性而言,ODS适合分离极性中等偏大的化合物类型。对于极性较小的化合物,应该考虑用硅胶、凝胶等手段进行分离纯化,绝对不要尝试ODS,唯一的后果只能是:样品全部死吸附,根本不可能洗脱!! 某些行业,前处理一般是萃取,比如环己烷/石油醚、乙酸乙酯/氯仿、正丁醇、水。水层的、正丁醇层的样品,一般都可以用ODS进行分离纯化;乙酸乙酯层的样品,极性偏大的部分可以考虑用ODS;至于环己烷层的样品,千万不要使用ODS,那将是:上样量多少,死吸附就有多少!! 就化合物分类而言,ODS对于黄酮苷类、环烯醚萜苷类、糖苷类等成分都能有一定的分离效果,也有很多成功的分离纯化实例。但是,对于苷元类化合物,则需要慎重考虑,其实还是极性大小的问题:苷元类化合物,一般极性较小。如何装柱、上样、洗脱? 装柱:新买来的ODS,用甲醇浸泡过夜后即可装柱。具体的装柱方法,跟硅胶的装柱子法是一样的,记得用甲醇装柱就行。装完以后,置换成起始流动相系统,即可投入使用了。 上样:分为两种,一种是湿法上样,另一种是拌样。湿法上样,不必多说,就是将样品溶解至一定体积(强烈建议用起始流动相溶解,但体积不可过大,太大相当于原点变大,分离度变差),然后上样;至于拌样,很多的观点表示ODS不应该拌样,我在这里指出,依我个人经验来看,拌样是可以的,尤其对于一些溶解性较差的样品,拌样后分离的效果,比湿法上样好很多,大家可以尝试。(所谓拌样,就是指将你的样品溶解,然后从柱子里面掏出小部分ODS,然后进行拌匀,注意不要过载) 洗脱过程:如果你有ODS薄层板,你可以先点板看看样品大概的极性大小。如果你没有ODS板,你拿到的是“盲样”,一般可以采取常规的梯度洗脱,如水——30%甲醇/水——50%甲醇/水——70%甲醇/水——100%甲醇,然后依据各流分样品量的大小进一步进行细分;经过常规的梯度洗脱以后,假设,你的样品集中在50%的甲醇/水部分,进行细分的时候,你就可以选择40%甲醇/水——45%甲醇/水——50%甲醇/水——100%甲醇这样的梯度。 流动相的选择:其实就是反相流动相,无非就是甲醇/水,乙腈/水,流动相中也可以加入一些其他物质。我曾经很多次加入乙酸,用来改善拖尾的现象(点ODS薄层板分析过)。至于缓冲盐,我没有试过,具体情况不太了解。洗脱样品的如何处理? 洗脱下来的样品,可用硅胶薄层板进行点板分析,然后将相同流分进行合并,也可以采用HPLC检测合并。 我认为,对于一些量小的流分,相差不是很大的,尽量合并,避免样品的分散; 对于一些量大的流分,可合可不合,反正量大,合与不合的效果是一样的(无非就是多占点空间); 从ODS上洗脱的流分,很可能是纯品;易结晶的样品,会在溶剂挥发的过程中结晶析出来,要注意观察;柱子被污染如何处理? 污染是正常的,见过那么多,也用过那么多ODS柱子,没有哪一根能在使用一段时间后保持“洁白无瑕”的。 被污染,一般情况下就是用甲醇冲洗,一直到冲洗液蒸干没有杂质为止,就可以进行下一批样品的分离了。 也许有人问:你这么处理彻底吗?回答是否定的,但是,对于ODS柱色谱,这样的处理已经足够了。 道理很简单,用ODS进行分离的样品,一般极性不会很小,70%甲醇/水基本能全部冲洗下来。现在已经用甲醇冲洗得差不多,在你对下一批样品进行分离的时候,上一批残留的杂质也就只有100%的甲醇能洗脱下来,根本不会影响。 如果一定要处理,可以采用甲醇:异丙醇=1:1冲洗,这种做法,算是终极做法了。
具体的方法随各中草药的性质不同而异,以后将通过实例加以叙述,此处只作一般原则性的讨论。 (一)溶剂分离法:一般是将上述总提取物,选用三、四种不同极性的溶剂,由低极性到高极性分步进行提取分离。水浸膏或乙醇浸膏常常为胶伏物,难以均匀分散在低极性溶剂中,故不能提取完全,可拌人适量惰性填充剂,如硅藻土或纤维粉等,然后低温或自然干燥,粉碎后,再以选用溶剂依次提取,使总提取物中各组成成分,依其在不同极性溶剂中溶解度的差异而得到分离。例如粉防己乙醇浸膏,碱化后可利用乙醚溶出脂溶性生物碱,再以冷苯处理溶出粉防己碱,与其结构类似的防己诺林碱比前者少一甲基而有一酚羟基,不溶于冷苯而得以分离。利用中草药化学成分,在不同极性溶剂中的溶解度进行分离纯化,是最常用的方法。 广而言之,自中草药提取溶液中加入另一种溶剂,析出其中某种或某些成分,或析出其杂质,也是一种溶剂分离的方法。中草药的水提液中常含有树胶、粘液质、蛋白质、糊化淀粉等,可以加入一定量的乙醇,使这些不溶于乙醇的成分自溶液中沉淀析出,而达到与其它成分分离的目的。例如自中草药提取液中除去这些杂质,或自白及水提取液中获得白及胶,可采用加乙醇沉淀法;自新鲜括楼根汁中制取天花粉素,可滴人丙酮使分次沉淀析出。目前,提取多糖及多肽类化合物,多采用水溶解、浓缩、加乙醇或丙酮析出的办法。 此外,也可利用其某些成分能在酸或碱中溶解,又在加碱或加酸变更溶液的pH后,成不溶物而析出以达到分离。例如内酯类化合物不溶于水,但遇碱开环生成羧酸盐溶于水,再加酸酸化,又重新形成内酯环从溶液中析出,从而与其它杂质分离;生物碱一般不溶于水,遇酸生成生物碱盐而溶于水,再加碱碱化,又重新生成游离生物碱。这些化合物可以利用与水不相混溶的有机溶剂进行萃取分离。一般中草药总提取物用酸水、碱水先后处理,可以分为三部分:溶于酸水的为碱性成分(如生物碱),溶于碱水的为酸性成分(如有机酸),酸、碱均不溶的为中性成分(如甾醇)。还可利用不同酸、碱度进一步分离,如酸性化台物可以分为强酸性、弱酸性和酷热酚性三种,它们分别溶于碳酸氢钠、碳酸钠和氢氧化钠,借此可进行分离。有些总生物碱,如长春花生物碱、石蒜生物碱,可利用不同rH值进行分离。但有些特殊情况,如酚性生物碱紫董定碱(corydine)在氢氧化钠溶液中仍能为乙醚抽出,蝙蝠葛碱(dauricins)在乙醚溶液中能为氢氧化钠溶液抽出,而溶于氯仿溶液中则不能被氢氧化钠溶液抽出;有些生物碱的盐类,如四氢掌叶防己碱盐酸盐在水溶液中仍能为氯仿抽出。这些性质均有助于各化合物的分离纯化。 (二)两相溶剂萃取法: 1.萃取法:两相溶剂提取又简称萃取法,是利用混合物中各成分在两种互不相溶的溶剂中分配系数的不同而达到分离的方法。萃取时如果各成分在两相溶剂中分配系数相差越大,则分离效率越高、如果在水提取液中的有效成分是亲脂性的物质,一般多用亲脂性有机溶剂,如苯、氯仿或乙醚进行两相萃取,如果有效成分是偏于亲水性的物质,在亲脂性溶剂中难溶解,就需要改用弱亲脂性的溶剂,例如乙酸乙酯、丁醇等。还可以在氯仿、乙醚中加入适量乙醇或甲醇以增大其亲水性。提取黄酮类成分时,多用乙酸乙脂和水的两相萃取。提取亲水性强的皂甙则多选用正丁醇、异戊醇和水作两相萃取。不过,一般有机溶剂亲水性越大,与水作两相萃取的效果就越不好,因为能使较多的亲水性杂质伴随而出,对有效成分进一步精制影响很大。 两相溶剂萃取在操作中还要注意以下几点: 1)先用小试管猛烈振摇约1分钟,观察萃取后二液层分层现象。如果容易产生乳化,大量提取时要避免猛烈振摇,可延长萃取时间。如碰到乳化现象,可将乳化层分出,再用新溶剂萃取;或将乳化层抽滤,或将乳化层稍稍加热;或较长时间放置并不时旋转,令其自然分层。乳化现象较严重时,可以采用二相溶剂逆流连续萃取装置。 2) 水提取液的浓度最好在比重1.1~1.2之间,过稀则溶剂用量太大,影响操作。 3) 溶剂与水溶液应保持一定量的比例,第一次提取时,溶剂要多一些,一般为水提取液的1/3,以后的用量可以少一些,一般1/4-1/6。 4)一般萃取3~4次即可。但亲水性较大的成分不易转入有机溶剂层时,须增加萃取次数,或改变萃取溶剂。 萃取法所用设备,如为小量萃取,可在分液漏斗中进行;如系中量萃取,可在较大的适当的下口瓶中进行。在工业生产中大量萃取,多在密闭萃取罐内进行,用搅拌机搅拌一定时间,使二液充分混合,再放置令其分层;有时将两相溶液喷雾混含,以增大萃取接触,提高萃取效率,也可采用二相溶剂逆流连续萃取装置。 2.逆流连续萃取法:是一种连续的两相溶剂萃取法。其装置可具有一根、数根或更多的萃取管。管内用小瓷圈或小的不锈钢丝圈填充,以增加两相溶剂萃取时的接触面。例如用氯仿从川楝树皮的水浸液中萃取川楝素。将氯仿盛于萃取管内,而比重小于氯仿的水提取浓缩液贮于高位容器内,开启活塞,则水浸液在高位压力下流入萃取管,遇瓷圈撞击而分散成细粒,使与氯仿接触面增大,萃取就比较完全。如果一种中草药的水浸液需要用比水轻的苯、乙酸乙酯等进行萃取,则需将水提浓缩液装在萃取管内,而苯、乙酸乙酯贮于高位容器内。萃取是否完全,可取样品用薄层层析、纸层析及显色反应或沉淀反应进行检查。 3.逆流分配法(CounterCurrentDistribution,CCD):逆流分配法又称逆流分溶法、逆流分布法或反流分布法。逆流分配法与两相溶剂逆流萃取法原理一致,但加样量一定,并不断在一定容量的两相溶剂中,经多次移位萃取分配而达到混合物的分离。本法所采用的逆流分布仪是由若干乃至数百只管子组成。若无此仪器,小量萃取时可用分液漏斗代替。预先选择对混合物分离效果较好,即分配系数差异大的两种不相混溶的溶剂。并参考分配层析的行为分析推断和选用溶剂系统,通过试验测知要经多少次的萃取移位而达到真正的分离。逆流分配法对于分离具有非常相似性质的混合物,往往可以取得良好的效果。但操作时间长,萃取管易因机械振荡而损坏,消耗溶剂亦多,应用上常受到一定限制。 4.液滴逆流分配法:液滴逆流分配法又称液滴逆流层析法。为近年来在逆流分配法基础上改进的两相溶剂萃取法。。对溶剂系统的选择基本同逆流分配法,但要求能在短时间内分离成两相,并可生成有效的液滴。由于移动相形成液滴,在细的分配萃取管中与固定相有效地接触、摩擦不断形成新的表面,促进溶质在两相溶剂中的分配,故其分离效果往往比逆流分配法好。且不会产生乳化现象,用氮气压驱动移动相,被分离物质不会因遇大气中氧气而氧化。本法必须选用能生成液滴的溶剂系统,且对高分子化合物的分离效果较差,处理样品量小(1克以下),并要有一定设备。应用液滴逆流分配法曾有效地分离多种微量成分如柴胡皂甙原小檗碱型季铵碱等。液滴逆流分配法的装置,近年来虽不断在改进,但装置和操作较繁。目前,对适用于逆流分配法进行分离的成分,可采用两相溶剂逆流连续萃取装置或分配柱层析法进行。
本人是新手,以前从未做过分离纯化。现在感觉很困难·····我是这样设计的,先用跑板的方法分离,刮下斑点后溶解制成样品液。下一步纯化的话该选用什么方法呢?我的预期目标是纯化成单一组分,主要想除去的是其中的蛋白质和盐分,烦请各位专业人士多提意见啊,谢谢~~
Sepax CNT SEC尺寸排阻色谱柱(凝胶过滤柱)的填料是一刚性的高纯度球型为基质,利用独特的表面修饰技术在表面通过共价化学键合致密均匀的亲水性基团而成,适用于高效分离纳米物质,如碳纳米管、纳米棒、纳米颗粒等。流动相不仅可以用缓冲溶液,也可以用有机溶剂,如乙腈、甲醇、四氢呋喃等。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=17465]用于分离纯化纳米物质的凝胶过滤色谱柱[/url]
目的要求(1)了解克隆基因表达的方法和意义。(2)了解重组蛋白亲和层析分离纯化的方法。实验原理克隆基因在细胞中表达对理论研究和实验应用都具有重要的意义。通过表达能探索和研究基因的功能以及基因表达调控的机理,同时克隆基因表达出所编码的蛋白质可供作结构与功能的研究。大肠杆菌是目前应用最广泛的蛋白质表达系统,其表达外源基因产物的水平远高于其它基因表达系统,表达的目的蛋白量甚至能超过细菌总蛋白量的80%。本实验中,携带有目标蛋白基因的质粒在大肠杆菌BL21中,在 37℃,IPTG诱导下,超量表达携带有6个连续组氨酸残基的重组氯霉素酰基转移酶蛋白,该蛋白可用一种通过共价偶连的次氨基三乙酸(NTA)使镍离子(Ni2+)固相化的层析介质加以提纯,实为金属熬合亲和层析(MCAC)。蛋白质的纯化程度可通过聚丙烯酰胺凝胶电泳进行分析。试剂和器材一、试剂 LB液体培养基:Trytone 10g, yeast extract 5g, NaCl 10g, 用蒸馏水配至1000mL. 氨苄青霉素:100mg/mL 上样缓冲液:100 mM NaH2PO4, 10 mMTris, 8M Urea, 10 mM2-ME, pH8.0 Washing Buffer:100 mM NaH2PO4, 10 mM Tris, 8 M Urea, pH6.3 Elution Buffer:100 mM NaH2PO4, 10 mMTris, 8M Urea, 500 mM Imidazole, pH8.0 IPTG二、器材摇床,离心机,层析柱(1′10 cm)操作方法一、氯霉素酰基转移酶重组蛋白的诱导1. 接种含有重组氯霉素酰基转移酶蛋白的大肠杆菌BL21菌株于5mL LB液体培养基中(含100ug/mL 氨苄青霉素),37℃震荡培养过夜。2. 转接1mL过夜培养物于100mL(含100ug/mL 氨苄青霉素)LB液体培养基中,37℃震荡培养至OD600 = 0.6 - 0.8。取10ul 样品用于SDS-PAGE 分析。3. 加入IPTG至终浓度0.5 mmol/l, 37℃继续培养1-3h.4. 12,000rpm 离心10 min, 弃上清,菌体沉淀保存于-20℃或-70℃冰箱中。二、氯霉素酰基转移酶重组蛋白的分离、纯化1. NTA层析柱的准备:在层析柱中加入1mL NTA介质,并分别用8mL 去离子水,8mL上样缓冲液洗涤。2. 重组蛋白的变性裂解:在冰浴中冻融菌体沉淀,加入5mL上样缓冲液, 用吸管抽吸重悬,超声波破裂菌体,用振荡器等轻柔的混匀样品60min, 4℃ 12000rpm 离心 30 min, 将上清吸至一个干净的容器中,并弃沉淀。取10ul 上清样品用于SDS-PAGE 分析。3. 上清样品以10-15mL/h 流速上Ni2+-NTA柱,收集流出液,取10ul样品用于SDS-PAGE 分析。4. 洗脱杂蛋白:用Washing Buffer以10-15mL/h流速洗柱,直至OD280 = 0.01.分步收集洗脱液,约3-4h,取10ul洗脱开始时的样品用于SDS-PAGE 分析。5. 洗脱目标蛋白:用Elution Buffer洗柱,收集每1 mL 级分,分别取10ul样品用于SDS-PAGE 分析。
[font=宋体]蛋白质的分离纯化是生物科学领域中的一项关键技术,它涉及到从复杂的混合物中分离并纯化出特定的蛋白质。这个过程通常包括多个步骤,每个步骤都需要精确的操作和优化,以确保最终得到的蛋白质具有高纯度和活性。下面我们将详细介绍蛋白质的分离纯化步骤。[/font][font=宋体] [/font][font=宋体][b]分离纯化某一特定蛋白质的一般程序可以分为前处理、粗分离、精细分离三个步骤。[/b][/font][font=宋体] [/font][font=宋体][b]①前处理[/b][/font][font=宋体] [/font][font=宋体]分离纯化某种蛋白质,首先要把蛋白质从原来的组织或细胞中以溶解的状态释放出来并保持原来的天然状态,不丢失生物活性。[/font][font=宋体] [/font][font=宋体]为此,动物材料应先剔除结缔组织和脂肪组织,种子材料应先去壳甚至去种皮以免受单宁等物质的污染,油料种子最好先用低沸点的有机溶剂如乙醚等脱脂。然后根据不同的情况,选择适当的方法,将组织和细胞破碎。[/font][font=宋体] [/font][font=宋体]动物组织和细胞可用电动捣碎机或匀浆机破碎或用超声波处理破碎。植物组织和细胞一般需要用石英砂或玻璃粉和适当的提取液一起研磨的方法或用纤维素酶处理也能达到目的。细菌细胞的破碎比较麻烦,破碎细菌细胞壁的常用方法有超声波破碎,与砂研磨、高压挤压或溶菌酶处理等。[/font][font=宋体] [/font][font=宋体]组织和细胞破碎后,选择适当的缓冲液把所要的蛋白提取出来。细胞碎片等不溶物用离心或过滤的方法除去。[/font][font=宋体] [/font][font=宋体]如果所要的蛋白主要集中在某一细胞组分,如细胞核、染色体、核糖体或可溶性细胞质等,则可利用差速离心的方法将它们分开,收集该细胞组分作为下步纯化的材料。如果碰上所要蛋白是与细胞膜或膜质细胞器结合的,则必须利用超声波或去污剂使膜结构解聚,然后用适当介质提取。[/font][font=宋体] [/font][font=宋体][b]②粗分离[/b][/font][font=宋体] [/font][font=宋体]当蛋白质提取液(有时还杂有核酸、多糖之类)获得后,选用一套适当的方法,将所要的蛋白与其他杂蛋白分离开来。一般这一步的分离用超滤、盐析、等电点沉淀和有机溶剂分级分离等方法。这些方法的特点是简便、处理量大,既能除去大量杂质,又能浓缩蛋白溶液。[/font][font=宋体] [/font][font=宋体][b]③精细分离[/b][/font][font=宋体] [/font][font=宋体]样品经粗分级分离以后,一般体积较小,杂蛋白大部分已被除去。进一步纯化,一般使用层析法包括离子交换层析、亲和层析、疏水层析以及分子筛等。必要时还可选择电泳法,包括区带电泳、等电点聚焦等作为最后的纯化步骤。用于细分级分离的方法一般规模较小,但分辨率很高。[/font][font=宋体] [/font][font=宋体]结晶是[url=https://cn.sinobiological.com/resource/protein-review/protein-purification][b]蛋白质分离纯化[/b][/url]的最后步骤。尽管结晶过程并不能保证蛋白一定是均一的,但是只有某种蛋白在溶液中数量上占有优势时才能形成结晶。结晶过程本身也伴随着一定程度的纯化,而重结晶又可除去少量夹杂的蛋白。由于结晶过程中从未发现过变性蛋白,因此蛋白的结晶不仅是纯度的一个标志,也是断定制品处于天然状态的有力指标。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/recombinant-protein-expression-service][b]重组蛋白表达服务[/b][/url][/font][font=宋体],可以根据客户需求,选用不同表达[/font][font=Calibri]/[/font][font=宋体]纯化标签、表达宿主等,真正为客户实现深度私人定制。[/font][/font][font=宋体][font=宋体]蛋白纯化详情:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification[/font][/font]
[font=宋体][font=宋体]不同的蛋白具有不同的氨基酸序列和空间结构,从而导致其在物理、化学和生物学特性中存在差异。考虑到细胞提取物中重组蛋白的相对丰度较高,开发生产纯蛋白([/font][font=Calibri]SDS-PAGE[/font][font=宋体]显示单一条带)的实验室规模纯化方案应该相对简单。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]下游处理方案中的各个步骤可分离混合物中的蛋白和非蛋白部分,最终将所需的蛋白与所有其他蛋白分离,同时保留多肽的生物活性和化学完整性。分离步骤会利用粗混合物中目标蛋白与其他蛋白之间的化学[/font][font=Calibri]/[/font][font=宋体]结构[/font][font=Calibri]/[/font][font=宋体]功能特性的差异。这些性质包括大小、形状、电荷、等电点、电荷分布、疏水性、溶解性、密度、配体结合亲和力、金属结合、可逆结合、翻译后修饰以及特定的序列或结构。下面是针对蛋白分离纯化方法做了以下汇总:[/font][/font][font=宋体] [/font][font=宋体][b][font=Calibri]1.[/font][font=宋体]根据蛋白质溶解度的差别分离[/font][/b][/font][font=宋体]蛋白质的溶解度具有显著的特性,可以根据其溶解度的差异进行分离。其中,等电点沉淀法、盐析和盐溶、有机溶剂沉淀以及重金属盐沉淀是常用的方法。[/font][font=宋体] [/font][font=宋体]①等电点沉淀法:蛋白质在等电点附近溶解度最小,易沉淀析出。利用不同蛋白质等电点的不同,将蛋白质从混合溶液中分开[/font][font=宋体] [/font][font=宋体]②盐析和盐溶:[/font][font=宋体] [/font][font=宋体]盐析:大量的中性盐溶液可以降低蛋白质的溶解度,使蛋白质沉淀析出的现象[/font][font=宋体] [/font][font=宋体]盐溶:低浓度的中性盐溶液促进某些蛋白质的溶解,从而与其他组分分开[/font][font=宋体] [/font][font=宋体]③有机溶剂沉淀:亲水性有机溶剂如乙醇、丙酮等能使蛋白质在水中的溶解度降低,从而沉淀析出[/font][font=宋体] [/font][font=宋体]④重金属盐沉淀:重金属盐带正电荷,可以与蛋白质负离子结合而形成不溶性蛋白质沉淀可利用此性质以大量清蛋白抢救重金属盐中毒的人[/font][font=宋体] [/font][font=宋体][b][font=Calibri]2.[/font][font=宋体]根据蛋白质分子大小的不同分离[/font][/b][/font][font=宋体] [/font][font=宋体]①透析:利用蛋白质分子不能通过半透膜的性质,使蛋白质和其他小分子物质如无机盐、单糖等分开,本质是以浓度差为推动力的膜分离过程。主要应用是血液(人工肾)的解毒[/font][font=宋体] [/font][font=宋体]②超滤:通过加压、抽滤、离心等多种方式,使水和其他小分子溶质透过超滤膜,而蛋白质截留在膜上,以达到浓缩和脱盐的目的,本质是以静压力差为推动力的膜分离过程[/font][font=宋体] [/font][font=宋体]③密度梯度离心:蛋白质颗粒的沉降速度取决于它的大小和密度,将蛋白质颗粒在具有密度梯度的介质中离心,质量和密度大的蛋白质比质量和密度小的蛋白质颗粒沉降得快,并且每种蛋白质颗粒沉降到与自身密度相等的介质梯度时,即停止不前,最后各组分在离心管中被分离成各自独立的区带[/font][font=宋体] [/font][font=宋体]④凝胶过滤层析:当不同分子大小的蛋白质流经凝胶层析柱时,比凝胶珠孔径大的分子不能进入凝胶珠内部,只能随溶剂在凝胶珠之间的孔隙向下移动并最先流出体外;比凝胶珠孔径小的分子能不同程度的自由进出凝胶珠的内外。于是不同大小的分子所经的路径长短不同而得到分离,大分子先洗脱出来,小分子后洗脱出来[/font][font=宋体] [/font][font=宋体]⑤超速离心:蛋白质溶液在强大离心场中会逐渐沉降,各种蛋白质沉降所需离心力场不同,可用超速离心法分离蛋白质并测定其分子量[/font][font=宋体] [/font][font=宋体][b][font=Calibri]3.[/font][font=宋体]根据电荷不同的纯化方法[/font][/b][/font][font=宋体] [/font][font=宋体]①电泳:在外电场作用下,带电颗粒将向着与其电性相反的电极移动,这种现象称为电泳。利用带点颗粒净电荷的差异分离混合物[/font][font=宋体] [/font][font=宋体][font=宋体]②离子交换层析:在某一特定的[/font][font=Calibri]PH[/font][font=宋体]值,混合蛋白质溶液中各种蛋白质所带电荷数目及性质不同,事先在层析柱中装上离子交换剂,其所带电荷性质与蛋白质电荷性质相反,当蛋白质混合溶液流经层析柱时,即可被吸附于柱上,随后用与蛋白质带相同性质电荷的洗脱剂洗脱,蛋白质可被置换下来,由于各种蛋白质所带电荷不同,离子交换剂结合的紧密程度不同,带电量小的蛋白质先被洗脱下来,增加洗脱液离子强度,带电量多的也被洗脱下来,可将蛋白质分离[/font][/font][font=宋体] [/font][font=宋体][b][font=Calibri]4.[/font][font=宋体]利用选择性吸附的纯化方法[/font][/b][/font][font=宋体] [/font][font=宋体]吸附层析:利用待纯化的分子和杂质分子与吸附剂之间的吸附能力和解吸性质不同而达到分离目的[/font][font=宋体] [/font][font=宋体][b][font=Calibri]5.[/font][font=宋体]利用对配体的特异生物学亲和力的纯化方法[/font][/b][/font][font=宋体] [/font][font=宋体]亲和层析:把待纯化的某一蛋白质的特异配体通过适当的化学方法共价连接到载体分子上,当蛋白质混合物加到填有亲和介质的层析柱时,待纯化的蛋白质与配体特异性结合,而其他蛋白质则不被结合,通过洗涤除去,被特异结合的蛋白质可以用含游离的相应配体溶液把它从柱上洗脱下来[/font][font=宋体] [/font][font=宋体][b][font=Calibri]6.[/font][font=宋体]高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url][/font][font=Calibri]HPLC[/font][font=宋体]和快速蛋白质[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]层析[/font][font=Calibri]FPLC[/font][/b][/font][font=宋体] [/font][font=宋体][font=Calibri]HPLC[/font][font=宋体]:以液体为流动相,采用高压输液系统,将具有不同极性的单一溶剂或不同比例的混合溶剂、缓冲液等流动相泵入装有固定相的色谱柱,在柱内各成分被分离后,进入检测器进行检测,从而实现对试样的分析[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]FPLC[/font][font=宋体]:是由经典的液体柱层析引入[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url]理论,并对相体进行改革,配用高压输液泵,采用高灵敏检测器、梯度洗脱装置、自动收集装置和微机等发展起来的现代[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]。适用各种层析技术,专门分离和纯化各类生物分子,包括天然蛋白质,重组和融合蛋白质、肽、寡核酸、质粒、病毒、抗生素、生物碱等等,操作肽图等精确分析和小量制备应用,具有快速、高分辨率、柱容量大、回收效率高及不易使生物大分子失活等特性。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]详情可以关注义翘神州[url=https://cn.sinobiological.com/resource/protein-review/protein-purification-techniques][b]蛋白纯化技术方法[/b][/url]:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification-techniques[/font][/font]
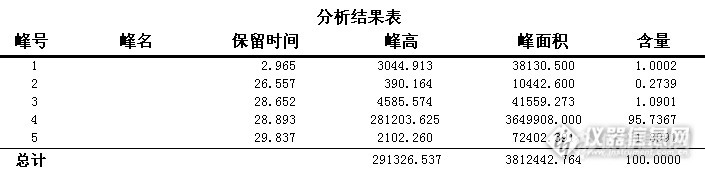
实验目的:研究化合物合成反应监测及分离纯化一般步骤。一、监测合成反应TLC-MS检测,确定是否有合成产物:1、将待测样品通过硅胶板爬板分开。http://ng1.17img.cn/bbsfiles/images/2015/08/201508212000_562106_2307604_3.png(其实板爬的不歪,只是照片上有点歪,截完图就成这样了。)2、利用TLC-MS仪器快速检测TLC板的两个点,确定目标物。http://ng1.17img.cn/bbsfiles/images/2015/08/201508212002_562107_2307604_3.png点1质谱检测图谱:http://ng1.17img.cn/bbsfiles/images/2015/08/201508212106_562110_2307604_3.png点2质谱检测图谱:http://ng1.17img.cn/bbsfiles/images/2015/08/201508212111_562115_2307604_3.png结论:经TLC-MS检测,合成反应有效,点2中含有分子量432的目标物,点1为原料。二:液相分析由于目标物极性较小,液相分析色谱柱选用C18色谱柱保留太强,因此选用保留稍弱的C8色谱柱。色谱条件如下:色谱柱: C8 5 μm 100 Å 4.6*250 mm流动相:A:水 B:乙醇流速:1.0 mL/min检测器:ELSD,65℃梯度:TimeB%0752510035100原样分析图谱:http://ng1.17img.cn/bbsfiles/images/2015/08/201508212115_562117_2307604_3.png27.448min峰为目标峰三、分离纯化:经测试:硅胶柱纯化条件不能把目标物前21-26 min杂质分离除去,C8柱纯化条件不能将26.1 min和27.9 min杂质分离除去。因此最终方案选用C18色谱柱,以甲醇和二氯甲烷为流动相,达到了很好的分离效果。纯化条件如下: 色谱柱:C18 10 μm 100 Å 30*250 mm 流动相:A:甲醇 B:二氯甲烷 流速:35 mL/min 紫外波长:210 nm(红色信号线) ELSD:65℃(浅蓝色信号线) 梯度:TimeB%053035 进样量:300 mg(10mL甲醇溶解) 分流: 流动相进紫外检测器与蒸发光散射检测器的分流比为34.5:0.5 制备图谱如下:http://ng1.17img.cn/bbsfiles/images/2015/08/201508212116_562118_2307604_3.png馏分收集:收集10.3-11.7 min和21.3-23.4 min馏分四、纯度检测(条件为液相分析条件):1、 10.3-11.7 min馏分:取200 uL馏分,氮吹干,加200 uL甲醇溶解,进样10 uL检测,检测结果如下:http://ng1.17img.cn/bbsfiles/images/2015/08/201508212117_562119_2307604_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/08/201508212118_562120_2307604_3.png2、 21.3-23.4 min馏分:取200 uL馏分,氮吹干,加100 uL甲醇溶解,进样10 uL检测,检测结果如下:http://ng1.17img.cn/bbsfiles/images/2015/08/201508212119_562121_2307604_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/08/201508212119_562122_2307604_3.png结论:1、合成反应可以利用TLC-MS设备快速监测合成反应成功与否。2、根据待分离样品的极性和硅胶板上的保留,选择合适的填料和流动相,摸索纯化条件。五、总结:1、合成反应可以利用TLC-MS设备快速监测合成反应成功与否。2、根据待分离样品的极性和硅胶板上的保留,选择合适的填料和流动相,摸索纯化条件。六、实验心得:1、利用TLC-MS检测仪,直接检测TLC板上的样品点,不需要将硅胶板上的点刮下来再处理后扫质谱。2、部分极性较小的样品可以用C18色谱柱,配二氯甲烷等弱极性试剂作为流动相进行分析或纯化。3、对于紫外吸收弱的样品,可并联蒸发光散射检测器,由于ELSD为分析型检测器,在大流速制备情况下,需要调节分流比,ELSD的分流速不能高于0.5 mL/min,以防检测器过载。4、制备条件下,由于并联检测器分流比差别大,且检测过程耗时不同,两个检测器在图谱中出现信号的时间就会有差异。这时需要提前判断两个信号的相对延迟时间,通常以流速大的紫外信号作为收集信号。5、紫外下吸收很弱的样品,放大到制备,加大上样量后,紫外下也会有吸收,也可作为制备收集的信号。6、当制备馏分溶剂为弱极性溶剂时,而检测条件的流动相为较强极性流动相,或存在溶剂不互溶问题,需要将制备馏分浓缩干,再用接近检测条件流动相极性的溶剂溶解,进行分析,避免溶剂效应。
[color=#231815]双水相萃取技术在分离、纯化中的应用[/color][color=#231815][color=#333333]双水相技术是一种新型的液-液萃取技术,由于其条件温和、易操作等特点,目前已广泛应用于物质的分离、纯化。本文综述了双水相形成原理、工艺流程和特点、体系类别、影响双水相分配的因素及其在分离纯化中的应用,并针对其未来发展趋势进行了展望。[/color][/color]
[color=#231815]生物活性蛋白质分离纯化技术研究进展[/color][color=#231815][color=#333333]生物体是天然活性蛋白质的宝库,近年来,越来越多具有生物活性的蛋白质被发现和研究,在生物制药、营养食品等方面具有广阔的应用前景。然而,分离纯化的技术与策略将影响天然蛋白的活性与功能,以及相关的经济效益。基于目前研究现状,对生物活性蛋白质的分离纯化技术进行了综述。 [/color][/color]
[color=#333333]该文建立了大孔树脂-高速逆流色谱分离中药材地黄中有效成分毛蕊花糖苷的方法。考察了4种大孔树脂对地黄粗提物中毛蕊花糖苷的静态吸附与解吸情况,其中D101大孔树脂对目标成分的吸附率与解吸率最理想,实验结果表明体积分数为10%的乙醇洗脱得到的毛蕊花糖苷含量最高,目标成分含量从4.9%提高到32.6%。最后,部分纯化的样品(165 mg)采用高速逆流色谱进一步纯化,两相溶剂系统由乙酸乙酯-正丁醇-水(1∶4∶5,v/v/v)组成,分离得到45 mg纯度为96%的毛蕊花糖苷。 [/color]
柱色谱分离纯化酶的一般操作程序
各位老师,我们单位想要购买一套蛋白质纯化系统,用于分离、纯化一个以肽类为主的动物组织样品,类似于GE公司的AKTAprime或AKTApurifier 10/100什么的。在这里想请教大家:1.用于蛋白质、肽类分离纯化的仪器,除了GE,还有些什么品牌是比较好的?具体的规格型号是什么?各品牌型号在应用和性能方面有些什么区别?(实验室到中试规模)2.考虑到我们的短期要求并不高,而GE和国产的产品价格相差近10倍,是否可以先买个国产的仪器代替并练练手(毕竟像GE这种产品太贵了)?如果用国产的,有哪些品牌和厂家比较可靠?如果只能自己组装,该怎么选材?要注意些什么?(我几乎没找到有国产成套的)3.购买的时候有哪些仪器参数和选型要点是需要注意的?4.如果是在HPLC上面分析肽类成分,有些什么具体品牌型号的柱子可以推荐一下吗?以前几乎没学过生物方面的东西,问题比较多,也比较外行,请大家海涵,不吝赐教!非常感谢大家![em0815]
分离纯化酶时,采用硫酸铵分级沉降时,离心机转速高达12000rps/min沉淀也不易沉降,而且耗时较长,请问如何分离好?沉降速度如何提高?
蛋白质分离纯化鉴定包括蛋白质样品的基本处理注意事项,蛋白质分离纯化方法的基本原理和选择,纯化后蛋白质浓度及蛋白质基本性质的研究方法。 [URL=http://www.instrument.com.cn/bbs/shtml/20081009/1522386/]http://www.instrument.com.cn/bbs/shtml/20081009/1522386/[/URL]
溶剂纯化系统http://www.zhonghuida.com/imageRepository/367772f9-d0a6-4513-ad18-97358b20c4ff.png产品特点 新型醇和胺类溶剂干燥柱及过滤设计 各种配置和尺寸 取代传统热蒸馏除水方法 完全避免蒸汽间交叉污染 可隔绝空气提取超干燥和无氧溶剂 可同时接收所有溶剂 顶部空出通风位置 可集成手套箱 带可移动支架及阻燃柜 标准 5 加仑溶剂储存罐采用惯用的防泄漏螺 旋盖子和 Swagelok 快速拆卸阀,便于操作和溶剂续装。系统通过一个可伸缩夹子接地,防止静电危害,保证安全操作环境。系统纯化柱处理容量为 800L,柱子可以再生或者更换。可选择台式、可移动式和固定式几种型号。http://www.zhonghuida.com/imageRepository/67eb511e-fa32-476d-aea6-601ddeaa72e9.gif 在低氮压力下,溶剂从储液罐中被迫进入分别装有活性铝(activated alumina)及铜(Copper)的纯化圆管进行除氧脱水,并通过过滤器除去微小颗粒。处理后的溶剂会排到已抽真空并被氮洗涤过的玻璃器皿中。 每种溶剂包含两条纯化圆管,不锈钢,经压力测试,可净化800升溶剂(再生程序需要之前)。技术参数材料框架材料:铝 处理方法:阳极化抛光 管件材料:304 不锈钢接头和阀门:Swagelok 不锈钢泄漏率氦质谱仪法未检测到有泄漏分配器不锈钢 24/40-14/20-29/24-Luer Lock 针型阀通风可选排风管气体参数内部气体压力:5 PSI 惰性气体:N2 – Ar 气体连接:只需一个气体供应点,可同时分配给不同溶剂纯化柱参数纯化柱材料:依溶剂不同而不同微粒过滤:纯化柱配备 7micron 不锈钢微粒过滤器净化能力:吸水能力为 5%重量含量 最终水氧含量水平:低PPM 级可净化溶剂芳香和脂肪族碳氢化合物:戊烷,己烷,环己烷,正庚烷,甲苯,苯 醚类:乙醚,四氢呋喃,二甲醚 含氯溶剂:二氯甲烷,氯仿,氯苯 胺类溶剂:三乙胺,吡啶,二异丙基乙基胺 醇:甲醇,乙醇其他通用溶剂:乙腈,DMF,DMSO,丙酮 其他定制溶剂阀门导向阀门:每种溶剂皆有 五通阀门以控制溶剂、气体和真空 安全阀门:歧管在外露铝质框架内,包含真空显示表,调节器及安全阀,避免玻璃器皿过分受压计量阀门:利用 计量阀门来控制输出流量 对比内容 传统蒸馏新型溶剂纯化系统纯化结果(正己烷中的水)20PPM1PPm使用安全性需要加热沸腾,有危险无须加热,密闭安全使用便利性较复杂简便,易掌握纯化所需时间几小时几分钟综合使用成本较高较低
一. 逆流色谱技术简介现代逆流色谱技术起源于上世纪50年代的逆流分溶法(Counter Current Distribution, CCD),它利用不同物质在所选择的两相溶剂中的分配系数不同而通过多次逆流分溶对物质进行分离。它采用数百个分离管进行操作,每一次操作后,上层液体被转移至盛有新的下层溶剂的分离管中,而往原分离管中加入新的上层溶剂,看起来好似两相的液体以相反的方向流动,故称为逆流分溶法。逆流分溶法存在许多缺点,如使用易破碎的玻璃仪器,分离时间长,需要连续稀释样品等。但与液相色谱相比,它无需固体作固定相,从而避免了因此而带来的一系列问题。因此,在CCD基础上发展起来的逆流色谱(Counter Current Chromatography, CCC)在采用了与液相色谱相似的连续洗脱、检测和分布收集技术后从上世纪70年代开始得到迅速的发展,并在天然和合成化合物的分离纯化中发挥了日益重要的作用。上世纪70年代出现的液滴逆流色谱(Droplet Counter Current Chromatography, DCCC)使流动相形成液滴,通过作为固定相的液柱而达到分离纯化的目的。其装置主要由输液部分、检测收集部分和玻璃管液柱部分(300-500根60cm X 1.8mm的玻璃管)组成。由于流动相形成液滴,在细的玻璃管中与液体固定相有效地接触,摩擦不断形成新的表面,促进溶质在两相溶剂中的分配,所以分离效果好,而且不产生乳化现象。对于易氧化的物质,还可用氮气驱动流动相。采用DCCC分离纯化了许多包括中草药和抗生素在内的天然产物如柴胡皂甙和短杆菌肽, 短杆菌酪素和四环素等。液滴逆流色谱解决了操作自动化的问题,但仍存在分离时间长,使用易破碎的玻璃管,分离度还不高等问题。逆流色谱技术的重大突破出现在上世纪80年代,根据被分离混合物的理化特性,选择二元或多元的两相溶剂体系,以上相或下相为固定相,将其注满色谱柱后使色谱柱作特定的高速旋转运动,并用由此产生的离心力场支撑柱内的液体固定相,然后以另相为流动相,携带溶解的混合物由输入泵推入色谱柱,穿过两个液相对流的管柱,各组分根据在两相中的分配系数不同而得到分离。根据离心力场的不同可将现代逆流色谱分为离心分配色谱(Centrifugal Partition Chromatography, CPC),也称盘管行星离心色谱(Coil Planet Centrifuge, CPC)和高速逆流色谱(High Speed Counter Current Chromatography, HSCCC),前者属流体静力平衡系统,色谱柱由一系列刻在圆盘或圆筒内的导管相联的柱体组成,通过单轴旋转产生恒定的重力场,两个旋转密封的接口分别连接流动相的进口和出口;后者属流体动力平衡系统,由聚四氟乙烯软管绕制成的色谱柱除绕离心轴旋转外,还围绕自轴旋转,产生变化的重力场,并采用无旋转密封的连接方式。分离时两相液体被剧烈振动的离心力场依其界面特征被甩成极细的微粒,样品各组分在两相微粒的表面上分配并在微粒振荡与对流的环境中有效传递,相当于把通常的溶剂萃取高效(13次/秒以上)、自动、连续地予以完成。泡沫逆流色谱(Foam Counter Current Chromatography, Foam CCC)技术是在HSCCC的基础上发展起来的。使用时,氮气和流动相同时从相反方向注入管柱中形成气体和流动相的逆流,然后从盘管中部注入的混合物根据形成泡沫的能力得到分离,易形成泡沫的的组分随[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]被洗脱收集在泡沫流出部分,而其它组分则随流动相流出。在盘管行星离心色谱基础上还发展了交叉轴盘管行星离心色谱(Cross-axis Coil Planet Centrifuge, X-axis CPC),这种仪器在使用中产生一种行星式运动,使得盘管支架在围绕离心中轴转动(公转)的同时还沿着自己的水平方向轴旋转(自转),使得部分的离心力矢量作用于盘管的半径方向,以防止因两相乳化而降低固定相保留率的现象出现。因此,X-axis CPC大大稳定了固定相的保留率,特别适用于大量制备性分离纯化。现代逆流色谱技术为化合物的分离纯化提供了一个新的手段,与HPLC等液-固色谱技术比较,由于分离原理不同,二者间存在很强的互补性。它无需固体作固定相,不存在固体对样品组分的吸附、玷污、变性、失活、拖尾等现象,能实现很高的回收率,节省昂贵的材料消耗和溶剂消耗(HPLC的1/10以下),运行使用的后续投入较低。逆流色谱在无需更换不同极性的色谱柱情况下,通过提高极性溶剂或非极性溶剂比例的方法,可以实现流动相从弱极性到强极性或相反的转化。由于色谱柱容积大,无填料,柱内空间全部是有效空间,因此,样品负载能力强,制备量大,重现性好。实验室规模的盘管总体积为100mL的逆流色谱仪一次可分离0.5-2克的粗品,而3000mL容量的制备型逆流色谱仪一次可分离15-60克的粗品。但是,与[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]和高效液相色谱等相比,逆流色谱的分离效率即理论塔板数还不高(一般在1000以下),一次分离所需时间还较长(以小时计),因此,还不宜用于组成复杂的混合物的全谱分离分析。逆流色谱技术在基本原理以及溶剂系统选择等方面还有待于进一步的普及、研究、开发与应用。目前,HSCCC等技术在生物化学、医药学、农业、环境、材料、化工、海洋生物以及无机离子等众多领域已得到成功应用,1996年美国出版的《High-Speed Countercurrent Chromatography》一书被选编为著名的分析化学丛书第132卷,2000年9月在英国Brunel大学召开了逆流色谱技术第一届国际学术会议,每年一度的国际分析化学与应用光谱学学术会议上,都设有CCC的专题组,“Journal of Chromatography” ,“Journal of Liquid Chromatography” 等重要学术刊物都有这一技术的论文发表。我国在CCC技术及其应用研究方面与国际发展同步,1980年研制出了我国第一台逆流色谱仪,并用于国产抗敌素成分的分离与分析检定,发表了一大批用HSCCC等分离制备中草药和茶叶等天然产物活性成分的论文,引起国际同行的瞩目,2002年在北京召开了逆流色谱技术的第二届国际学术会议。但是,在逆流色谱技术应用于抗生素的分离纯化方面,我国与国际上发展趋势相比还存在很大差距,相关论文甚少,因此,在我国开展高速逆流色谱技术分离纯化抗生素的工作有着广阔的应用和发展前景。二. 溶剂选择无论是用HPLC或CCC技术分离混合物,分离度(Rs)是一个很重要的参数,如下图所示,在HPLC中,提高分离度是通过使峰形变窄的方法达到的,而在CCC或CPC中,则是通过改进选择性来实现的,这种选择性主要取决于样品在两相溶剂中的分配系数。因此,溶剂系统的选择在CCC技术中尤为重要。 选择溶剂时要考虑到样品的极性、溶解度、电荷态和形成复合物的能力等,溶剂体系的沉降时间应小于30秒,以得到满意的固定相保留率。测定方法如下,各取2毫升平衡后的上相和下相液体移入一个5毫升的刻度玻璃管中,密封上下摇动5次后静置于水平面上并测定两相分层的时间即沉降时间。样品的分配系数K值(K=上相中样品浓度/下相中样品浓度,可由HPLC方法得出)最好在1左右,一般在0.2到2之间。以上相作固定相时为例,若K《《1,样品很快随流动相流出,达不到分离效果;若K》》1,样品出峰时间拉长,形成宽峰。由于CCC的理论塔板数在800左右,因此要得到高的分离度,样品各组分间的分离因子( , 各组分的K值之比)应大于1.5。此外,两相溶剂的体积应尽量相同以避免溶剂的浪费,溶剂最好挥发性强,这样完成操作后只要将洗脱液浓缩即可得到纯样品。 选择溶剂体系时,首先选出一个能使样品全部溶解的溶剂体系,然后调整各溶剂的比例使得被分离各组分满足K值和 值的要求,以提高分离度。可以采用相图来研究改变某一相的组成对另一相组成的影响,Sø rensen等人对近百种三元溶剂相图研究后,总结归纳出三类溶剂体系:乙酸乙酯—正丁醇—水(EtOAc—BuOH—H2O),适用于极性弱的样品;水—二甲亚砜—四氢呋喃(H2O—DMSO—THF),适用于极性强的难溶性样品如两性霉素B;氯仿—甲醇—水(CHCl3—MeOH—H2O),适用于大部分样品。此后又发展了其它通用的多元溶剂体系如正戊烷—乙酸乙酯—甲醇—水(Heptane—EtOAc—MeOH—H2O)体系和正戊烷—甲醇—甲基叔丁基醚—甘醇二甲醚—水(Heptane—MeOH—MtBE—Glyme—水)体系等。常用溶剂体系的选择可参考表1,首先根据样品的理化特性选出最佳溶剂,然后在左右两栏中再选择相应的数种溶剂,以组成选择性最好的多元溶剂体系。

[color=#013add]1)您所在的版面:分离/纯化/萃取2)您的管理权限:见习版主3)您的工作情况:寒窗苦读中啊。。。4)您的经历:今年26了,很多。。寒窗往事,空回首,烟霭纷纷啊~5)您的个人秀:我行我秀,我不行。。。我秀还是不秀?[/color]我的人生信条,有以下几个,现在一一展示~1.在争论中获胜的唯一方式,是避免争论~(卡耐基)2.不扯淡,不忽悠,不懂不要装懂;不折腾,不闹腾,睁眼不说瞎话;以德服人,以诚待人~(环烯醚萜)3.不是不在乎,不是不关心,而一种洒脱、一种坦然、一种释怀,“不以物喜,不以己悲”,能做到的,天下几人?(环烯醚萜)“扯淡”完毕,请查收~[img]http://ng1.17img.cn/bbsfiles/images/2010/09/201009131535_243569_1745326_3.jpg[/img]
各位好!我做实验要对紫杉醇发酵液进行分离纯化,请问用树脂怎样进行除杂?
从混杂微生物群体中获得只含有某一种或某一株微生物的过程称为微生物分离与纯化。在分子生物学的研究及应用中,不仅需要通过分离纯化技术从混杂的天然微生物群中分离出特定的微生物,而且还必须随时注意保持微生物纯培养物的“纯洁”,防止其他微生物的混入。 1、用固体培养基分离和纯化 单个微生物在适宜的固体培养基表面或内部生长、繁殖到一定程度可以形成肉眼可见的、有一定形态结构的子细胞生长群体,称为菌落。当固体培养基表面众多菌落连成一片时,便成为菌苔。不同微生物在特定培养基上生长形成的菌落或菌苔一般都具有稳定的特征,可以成为对该微生物进行分类、鉴定的重要依据。大多数细菌、酵母菌、以及许多真菌和单细胞藻类能在固体培养基上形成孤立的菌落,采用适宜的平板分离法很容易得到纯培养。所谓平板,即培养平板的简称,它是指固体培养基倒入无菌平皿,冷却凝固后,盛固体培养基的平皿。这方法包括将单个微生物分离和固定在固体培养基表面或里面。固体培养基用琼脂或其它凝胶物质固化的培养基,每个孤立的活微生物体生长、繁殖形成菌落,形成的菌落便于移植。最常用的分离、培养微生物的固体培养基是琼脂固体培养基平板。这种由Kock建立的采用平板分离微生物纯培养的技术简便易行,100多年来一直是各种菌种分离的最常用手段。 1.1 稀释倒平板法 首先把微生物悬液作一系列的稀释(如1:10、1:100、1:1000、1:10000),然后分别取不同稀释液少许,与已熔化并冷却至50℃左右的琼脂培养基混合,摇匀后,倾入灭过菌的培养皿中,待琼脂凝固后,制成可能含菌的琼脂平板,保温培养一定时间即可出现菌落。如果稀释得当,在平板表面或琼脂培养基中就可出现分散的单个菌落,这个菌落可能就是由一个细菌细胞繁殖形成的。随后挑取该单个菌落,或重复以上操作数次,便可得到纯培养。 1.2 涂布平板法 因为将微生物悬液先加到较烫的培养基中再倒平板易造成某些热敏感菌的死亡,且采用稀释倒平板法也会使一些严格好氧菌因被固定在琼脂中间缺乏氧气而影响其生长,因此在微生物学研究中常用的纯种分离方法是涂布平板法。其做法是先将已熔化的培养基倒入无菌平皿,制成无菌平板,冷却凝固后,将一定量的微生物悬液滴加在平板表面,再用无菌玻璃涂棒将菌液均匀分散至整个平板表面,经培养后挑取单个菌落。 1.3 平板划线法 最简单的分离微生物的方法是平板划线法,即用接种环以无菌操作沾取少许待分离的材料,在无菌平板表面进行连续划线(图2),微生物细胞数量将随着划线次数的增加而减少,并逐步分散开来,如果划线适宜的话,微生物能一一分散,经培养后,可在平板表面得到单菌落。有时这种单菌落并非都由单个细胞繁殖而来的,故必须反复分离多次才可得到纯种。其原理是将微生物样品在固体培养基表面多次作“由点到线”稀释而达到分离目的的。划线的方法很多,常见的比较容易出现单个菌落的划线方法有斜线法、曲线法、方格法、放射法、四格法等。
总RNA分离纯化标准操作规程(SOP)3. 关键词:RNA 分离 纯化4. 目的:建立总RNA分离纯化的操作规程,以保证制备RNA的质量和效率。5. 主体内容:5.1主要仪器研钵,恒温水浴,旋涡振荡器,冷冻台式高速离心机,超低温冰箱,紫外检测仪,电泳仪,电泳槽。5.2试剂1.Trizol试剂(购自Invitrogen公司)2.焦碳酸二乙酯(DEPC)3.氯仿(新开封)4.异丙醇(新开封)5.无RNase灭菌水:用将高温烘烤的玻璃瓶(250℃ 3小时)装蒸馏水,然后加入0.1%的DEPC(体积/体积),处理过夜后高压灭菌。6.75%乙醇:用DEPC处理后的水配制75%乙醇,(用高温灭菌器皿配制),然后装入高温烘烤的玻璃瓶中,存放于4℃冰箱。 5.3 相关器皿的预处理1.塑料制品的处理尽可能使用无菌,一次性塑料制品,已经标明RNase-Free的塑料制品,如果没有开封使用过通常没有必要再次处理。对于国产塑料制品,原则上都必须处理方可使用。处理步骤如下:1)在玻璃烧杯中注入去离子水,加入DEPC使其终浓度为0.1%。注意:DEPC为剧毒物质,活性很强,应在通风橱中小心使用。2)将需要处理的塑料制品放入一个可以高温灭菌的容器中,注入DEPC水溶液,使塑料制品的所有部分都浸泡到溶液中。3)在通分橱中室温处理过夜。4)将DEPC水溶液小心倒入废液瓶中,用铝箔封住含有已用DEPC水处理过的塑料制品的容器,高温高压蒸汽灭菌至少30 min。5)在烘箱中用合适的温度烘烤至干燥。置于干净处备用。2.玻璃和金属制品先用去离子水将器皿清洗干净,晾干,用铝箔包好,然后至烘箱中250℃烘烤3 小时以上。5.4 操作步骤第一部分 匀浆A 从组织中提取总RNA、1)液氮研磨:组织块直接放入研钵中,加入少量液氮,迅速研磨,待组织变软,再加少量液氮,再研磨,如此三次,按照每50~100mg组织加入1ml Trizol,转入离心管进行下步操作。2)匀浆:用电动匀浆器充分匀浆1~2min。注意,组织样品体积不能超过Trizol体积的10%,否则匀浆效果会不好。B 从培养细胞中提取总RNA1)粘壁培养细胞:不需蛋白酶消化,先将培养基去除,然后直接将Trizol加入到培养瓶中消化、裂解细胞,Trizol体积按10cm2/ml的比例加入。2)悬浮培养细胞:直接离心收集细胞后用Trizol重悬、裂解,每1ml Trizol可裂解5×106个动物、植物或酵母细胞,或1×107个细菌细胞。注意,在加入Trizol之前不能用其他缓冲液洗涤细胞,那样会增加mRNA降解的可能性。另外,在裂解酵母或细菌细胞时可以借助匀浆器。第二部分 相分离1.匀浆组织加入Trizol后,室温放置5min,使其充分裂解。注意:此时可以放入-70℃长期保存。[