蛋白质结构分析:制备、鉴定与微量测序

蛋白质结构分析:制备、鉴定与微...http://ng1.17img.cn/bbsfiles/images/2010/11/201011031426_256979_1641058_3.jpghttp://ng1.17img.cn/bbsfiles/images/2010/11/201011031426_256981_1641058_3.jpg
基因组(genome)包含的遗传信息经转录产生mRNA,一个细胞在特定生理或病理状态下表达的所有种类的mRNA称为转录子组(transcriptome)。很显然,不同细胞在不同生理或病理状态下转录子组包含的mRNA的种类不尽相同。mRNA经翻译产生蛋白质,一个细胞在特定生理或病理状态下表达的所有种类的蛋白质称为蛋白质组(proteome)。同理,不同细胞在不同生理或病理状态下所表达的蛋白质的种类也不尽相同。蛋白质是基因功能的实施者,因此对蛋白质结构,定位和蛋白质-蛋白质相互作用的研究将为阐明生命现象的本质提供直接的基础。生命科学是实验科学,因此生命科学的发展极大地依赖于实验技术的发展。以DNA序列分析技术为核心的基因组研究技术推动了基因组研究的日新月异,而以基因芯片技术为代表的基因表达研究技术为科学家了解基因表达规律立下汗马功劳。在蛋白质组研究中,二维电泳和质谱技术的黄金组合又为科学家掌握蛋白质表达规律再铸辉煌。蛋白质组学(proteomics)就是指研究蛋白质组的技术及这些研究得到的结果。蛋白质组学的研究试图比较细胞在不同生理或病理条件下蛋白质表达的异同,对相关蛋白质进行分类和鉴定。更重要的是蛋白质组学的研究要分析蛋白质间相互作用和蛋白质的功能。蛋白质组学的研究内容包括:1.蛋白质鉴定:可以利用一维电泳和二维电泳并结合Western等技术,利用蛋白质芯片和抗体芯片及免疫共沉淀等技术对蛋白质进行鉴定研究。2.翻译后修饰:很多mRNA表达产生的蛋白质要经历翻译后修饰如磷酸化,糖基化,酶原激活等。翻译后修饰是蛋白质调节功能的重要方式,因此对蛋白质翻译后修饰的研究对阐明蛋白质的功能具有重要作用。3.蛋白质功能确定:如分析酶活性和确定酶底物,细胞因子的生物分析/配基-受体结合分析。可以利用基因敲除和反义技术分析基因表达产物-蛋白质的功能。另外对蛋白质表达出来后在细胞内的定位研究也在一定程度上有助于蛋白质功能的了解。Clontech的荧光蛋白表达系统就是研究蛋白质在细胞内定位的一个很好的工具。4.对人类而言,蛋白质组学的研究最终要服务于人类的健康,主要指促进分子医学的发展。如寻找药物的靶分子。很多药物本身就是蛋白质,而很多药物的靶分子也是蛋白质。药物也可以干预蛋白质-蛋白质相互作用。在基础医学和疾病机理研究中,了解人不同发育、生长期和不同生理、病理条件下及不同细胞类型的基因表达的特点具有特别重要的意义。这些研究可能找到直接与特定生理或病理状态相关的分子,进一步为设计作用于特定靶分子的药物奠定基础。不同发育、生长期和不同生理、病理条件下不同的细胞类型的基因表达是不一致的,因此对蛋白质表达的研究应该精确到细胞甚至亚细胞水平。可以利用免疫组织化学技术达到这个目的,但该技术的致命缺点是通量低。LCM技术可以精确地从组织切片中取出研究者感兴趣的细胞类型,因此LCM技术实际上是一种原位技术。取出的细胞用于蛋白质样品的制备,结合抗体芯片或二维电泳-质谱的技术路线,可以对蛋白质的表达进行原位的高通量的研究。很多研究采用匀浆组织制备蛋白质样品的技术路线,其研究结论值得怀疑,因为组织匀浆后不同细胞类型的蛋白质混杂在一起,最后得到的研究数据根本无法解释蛋白质在每类细胞中的表达情况。虽然培养细胞可以得到单一类型细胞,但体外培养的细胞很难模拟体内细胞的环境,因此这样研究得出的结论也很难用于解释在体实际情况。因此在研究中首先应该将不同细胞类型分离,分离出来的不同类型细胞可以用于基因表达研究,包括mRNA和蛋白质的表达。LCM技术获得的细胞可以用于蛋白质样品的制备。可以根据需要制备总蛋白,或膜蛋白,或核蛋白等,也可以富集糖蛋白,或通过去除白蛋白来减少蛋白质类型的复杂程度。相关试剂盒均有厂商提供。蛋白质样品中的不同类型的蛋白质可以通过二维电泳进行分离。二维电泳可以将不同种类的蛋白质按照等电点和分子量差异进行高分辨率的分离。成功的二维电泳可以将2000到3000种蛋白质进行分离。电泳后对胶进行高灵敏度的染色如银染和荧光染色。如果是比较两种样品之间蛋白质表达的异同,可以在同样条件下分别制备二者的蛋白质样品,然后在同样条件下进行二维电泳,染色后比较两块胶。也可以将二者的蛋白质样品分别用不同的荧光染料标记,然后两种蛋白质样品在一块胶上进行二维电泳的分离,最后通过荧光扫描技术分析结果。胶染色后可以利用凝胶图象分析系统成像,然后通过分析软件对蛋白质点进行定量分析,并且对感兴趣的蛋白质点进行定位。通过专门的蛋白质点切割系统,可以将蛋白质点所在的胶区域进行精确切割。接着对胶中蛋白质进行酶切消化,酶切后的消化物经脱盐/浓缩处理后就可以通过点样系统将蛋白质点样到特定的材料的表面(MALDI-TOF)。最后这些蛋白质就可以在质谱系统中进行分析,从而得到蛋白质的定性数据;这些数据可以用于构建数据库或和已有的数据库进行比较分析。实际上像人类的血浆,尿液,脑脊液,乳腺,心脏,膀胱癌和磷状细胞癌及多种病原微生物的蛋白质样品的二维电泳数据库已经建立起来,研究者可以登录www.expasy.ch/www/tools.html等网站进行查询,并和自己的同类研究进行对比分析。Genomic Solution可以为研究者提供除质谱外的所有蛋白质组学研究工具,包括二维电泳系统,成像系统及分析软件,胶切割系统,蛋白质消化浓缩工作站,点样工作站等;同时还可以提供相关试剂和消耗品。LCM-二维电泳-质谱的技术路线是典型的一条蛋白质组学研究的技术路线,除此以外,LCM-抗体芯片也是一条重要的蛋白质组学研究的技术路线。即通过LCM技术获得感兴趣的细胞类型,制备细胞蛋白质样品,蛋白质经荧光染料标记后和抗体芯片杂交,从而可以比较两种样品蛋白质表达的异同。Clontech最近开发了一张抗体芯片,可以对378种膜蛋白和胞浆蛋白进行分析。该芯片同时配合了抗体芯片的全部操作过程的重要试剂,包括蛋白质制备试剂,蛋白质的荧光染料标记试剂,标记体系的纯化试剂,杂交试剂等。对于蛋白质相互作用的研究,酵母双杂交和噬菌体展示技术无疑是很好的研究方法。Clontech开发的酵母双杂交系统和NEB公司开发的噬菌体展示技术可供研究者选用。关于蛋白质组的研究,也可以将蛋白质组的部分或全部种类的蛋白质制作成蛋白质芯片,这样的蛋白质芯片可以用于蛋白质相互作用研究,蛋白表达研究和小分子蛋白结合研究。Science,Vol.293,Issue 5537,2101-2105,September 14,2001发表了一篇关于酵母蛋白质组芯片的论文。该文主要研究内容为:将酵母的5800个ORF表达成蛋白质并进行纯化点样制作芯片,然后用该芯片筛选钙调素和磷脂分子的相互作用分子。最后有必要指出的是,传统的蛋白质研究注重研究单一蛋白质,而蛋白质组学注重研究参与特定生理或病理状态的所有的蛋白质种类及其与周围环境(分子)的关系。因此蛋白质组学的研究通常是高通量的。适应这个要求,蛋白质组学相关研究工具通常都是高度自动化的系统,通量高而速度快,配合相应分析软件和数据库,研究者可以在最短的时间内处理最多的数据。
使用微量定氮法测定食品中的蛋白质,蒸馏结束后,大家一般会如何清洗反应室?是先旋开下面的塞子,还是先旋开上面进样口的塞子?理由是什莫?
蛋白质化学与蛋白质组学夏其昌 曾嵘 等编著2004年4月出版ISBN 7-03-012401-4/Q.133116开,平装,580页定价: 75.00元 本书系统论述了蛋白质化学基础理论和实验技巧,也反映了蛋白质组学研究的最新成果。内容包括:蛋白质的表征,蛋白质的组成分析和序列测定,与此相关的实验方法,包括各种色谱、电泳、质谱技术等,以及应用在蛋白质表征研究和基因工程产品的质检方面的实际范例。在蛋白质组学领域介绍了基本概念、样品制备、双向凝胶电泳的图像分析和定量分析、质谱等常规方法,并介绍了国际上最新的多维技术在研究中的应用;同时充分体现了生物信息学在蛋白质组研究中的重要性。 本书可作为生物学、医学、化学专业大学生,研究生和教学人员的参考书,也是从事生物化学、分子生物学、医学等领域中分离分析工作人员的参考书。
PS1利用基质辅助激光解吸电离-飞行时间(MALDI-TOF)技术来表征生物分子。样品溶于固定的底物中形成晶体,用激光脉冲使其离子化,离子被加速后通过飞行管时分离,所有离子均可被检测。系统包括三个组成部件:样品点样制备工作站(SymBiot 1)、生物质谱工作站(Voyager-DE PRO)和自动化分析软件(AutoMS-Fit)。SymBiot1 是一个自动样品处理系统,支持亚微升级微量点样,具有快速省时、重现性好的特点;Voyager-DE PRO是为蛋白质组研究专门设计的自动飞行时间质谱分析系统,配有AB公司之专利—延迟检测技术,具有高分辨率、质荷比宽等特点;AutoMS软件可以批处理方式或实时动态方式检索Protein Prospector蛋白数据库或您指定的蛋白数据库,查询参数可以任意设定,检索结果以Microsoft Access格式分类编号及储存。 PS 1技术平台建立伊始便受到了许多蛋白质课题研究组的关注。中国科学院上海生物化学研究所戚正武院士课题组从猪肝中提取某一活性蛋白组分,该组分理化性质不清楚,天然含量十分低,并无相关文献报道。用HPLC分离以后对活性组分的成分不能确定。上海基康生物技术有限公司运用PS 1系统对HPLC分离后的活性组分作了质谱分析,仅在一个工作日内就精确确定该组分由分子量极为相近的几种蛋白质构成,分子量精确度达到10 ppm。后经HPLC再次细分(洗脱梯度增加了2.5倍),证实了质谱的结论。此活性组分曾滤过1kD分子筛,基康的质谱数据纠正了研究人员过去对该活性组分分子量的误判,为研究人员明确实验方向、优化实验步骤提供了强有力的依据。 PS1除了可以进行生物大分子的精确分子量测定,还可用于蛋白的肽指纹图谱分析(peptide mass fingerprint,PMF),提供相关生物信息学服务,并且还可以利用源后衰变(Post Source Decay,PSD)技术来获得样品的MS/MS数据,以得到一级结构信息。PSD方法通常增加了激发激光的功率,使其超过产生一般肽指纹谱图所需功率的阈值,过剩的能量使前体离子在源内离子化之后发生裂解,产生一系列碎片离子,在反射器的作用下,最终可以得到一张连续的碎片离子图谱。经特定的软件分析后,即可在数据库中检索到肽段的氨基酸序列。利用PSD分析技术,还可以对磷酸化,糖基化等翻译后修饰进行定位分析,同样也可以鉴定产生翻译后修饰肽段的蛋白质。Neville et al.(1997)将这一方法成功的用于磷酸肽的序列分析。作为重要的蛋白质鉴定手段之一,PS1的精确度可以达到10 ppm,灵敏度为fmol,分子量检测范围可达到500 kDa,每天可自动分析40-100个样品,适用于大规模“蛋白质组学”研究。
[align=center]聚合物整体柱的制备及其在蛋白质分离中的应用[/align][align=center]摘 要[/align][align=center][color=black] [/color][/align][align=left][color=black]整体柱作为第四代分离介质,具有制备简单、通透性好、传质快等优点,在生物分离分析中发挥的作用日益增加。多孔聚合物整体柱具有高通透性和高柱空间利用率,与填充柱相比优势明显。至今已成功地用于分离科学,特别是用于分离型生物分子。本文简要综述了聚合物整体柱的制备及其在蛋白质分离中的应用,并对其应用做了展望。[/color]关键词:[color=black]聚合物整体柱;蛋白质分离;综述[/color][b]1 引言[/b]蛋白质在人体生命过程中发挥着极其重要的作用,某些蛋白质在体内的含量水平严重影响着生命的质量,这就要求对其进行定量研究,而对其实现分离分析成为首要任务。对蛋白质进行分离鉴定通常使用电泳[color=black]—[/color][color=black]质谱、液相色谱[/color][color=black]—[/color][color=black]质谱联用技术,但这些方法并不能完全满足蛋白质分子对操作环境和分析方法要求较高的要求,并且费用较高。而聚合物单体种类繁多,且其上面的官能团可以有多种修饰方法从而对不同的生物分子具有不同的作用,从而对其实现快速分离。[/color]色谱柱是色谱分离的核心,整体柱代表了色谱柱技术发展的方向[sup][color=black][/color][/sup][color=black]。整体柱[/color][color=black]( Monolithiccolumn) [/color]又称连续床层( Continuous bed) [color=black],是一种用有机或无机聚合方法在色谱柱内进行原位聚合的连续床固定相[/color][sup][color=black][/color][/sup][color=black]。[/color][color=black]整体柱具有独特的双孔结构,具有灌注色谱的特点,比填充柱的通透性更好,可实现快速分离[/color][sup][color=black][/color][/sup][color=black]。根据整体材料基质的不同,整体柱分为硅胶整体柱、有机聚合物整体柱、有机[/color][color=black]-[/color][color=black]硅胶杂化整体柱。硅胶整体柱具有良好的稳定性和机械强度,通透性好,但制备周期长,需要柱后衍生[/color][sup][color=black][/color][/sup][color=black]。有机聚合物整体柱则制备简单、[/color][color=black]pH [/color][color=black]值适用范围广,具有良好的通透性、独特的比表面积和较好的化学稳定性,并且能在玻璃毛细管、不锈钢柱管、[/color][color=black]tip [/color][color=black]头甚至是微流控芯片的通道等多种模具中制备[/color][sup][color=black][/color][/sup][color=black]。[/color][b]2 聚合物整体柱的制备[/b]多孔聚合物整体柱出现在上世纪90年代初,继而在制备和应用中得到发展[sup][/sup]。与采用溶胶凝胶技术制备的无机硅胶整体柱相比,通过自由基聚合方式制备的聚合物整体柱更容易制备。除了传统的自由基聚合,其他方法预期制备一种具有均匀结构的新型聚合物整体柱。2006年,Hosoya等人报道了一种将环氧单体与二胺类开环聚合的高性能有机聚合物整体柱,在毛细管液相色谱上,其对苯的分离塔板高度(H)可以达到小于5μm[sup][/sup]。值得注意的是,相比链生长聚合(比如自由基聚合反应)产生的球状结构,逐步聚合方式导致整体柱有完全不同的形态。[b]3 聚合物整体柱的分类[/b]多种多样的功能单体使整体柱设计变得更容易,按单体不同,聚合物整体柱可分为聚丙烯酰胺类,聚甲基丙烯酸酯类和聚苯乙烯类[sup][/sup]。单体决定其适用范围,整体柱已被广泛用于不同的色谱模式,包括反相液相色谱(RPLC)、亲水相互作用色谱(HILIC)、离子交换色谱(IEC)等[sup][/sup]。而[color=black]从制备工艺上,聚合物整体柱可分为三类:后修饰整体柱、原位合成整体柱和结合微加工技术的整体柱。[/color]原位合成整体柱是一定温度或紫外光条件下,将交联剂、单体、引发剂、致孔剂,在不锈钢色谱柱管中充分反应,再冲洗除去致孔剂和残余未反应物得到。除研究可用单体外,新的制备方法和制备工艺和的研究也取得了很好发展。通过调节交联剂、单体、致孔剂之间的比例,可以较好地控制制备的整体柱的柱效和通透性[sup][color=black][/color][/sup][color=black]。原位聚合制备的整体柱并不能满足某些特定的分离需求。原位聚合时,很多功能团被包埋在颗粒内部,暴露在表面上的并不多,这导致聚合物整体柱的性能明显下降。后修饰整体柱则会改善这一问题。聚合物整体柱的后修饰方法使用最多的是在聚合物表面接枝[/color][sup][color=black][/color][/sup][color=black]。近年来,利用甲基丙烯酸缩水甘油酯[/color][color=black]( GMA) [/color][color=black]的环氧基团的接枝方法较为流行,并成功运用到离子交换色谱、亲和色谱等色谱柱的制备中[/color][sup][color=black][/color][/sup][color=black]。相对于接枝的方法,将功能化的纳米颗粒包被在聚合物的表面的方法较为简单,也常用于制备功能化的聚合物柱。作为固定相载体,微加工整体柱是芯片色谱柱所独有的。[/color]原位合成聚合物整体柱最为便捷,根据分离要求的不同,已经开发了各种各样的单体材料和制备工艺。对于一般分离需求,是很好的选择。采用后修饰的方法在固定相表面连接功能基团可以提高柱效,而微加工整体柱仅适用于芯片色谱。[b]4 聚合物整体柱的应用[/b]一般来说,多孔聚合物整体柱具有典型球状结构,其通孔之间的聚合微球显著有利于提高聚合物整体柱的通透性,并且使其在高流速下能够有效地分离蛋白质分子。然而,聚合物整体柱对小分子的分离通常表现为低的柱效,据研究是由于表面积较硅胶整体柱小造成的。为了解决这个问题,研究者提出了几种试图增加表面积的方法,如将纳米粒子引入聚合物整体柱和制备超交联整体柱[sup][/sup],分离能力在一定程度上得到了提高。此外,斯韦克系统地阐述了各种多孔聚合物整体柱的制备技术[sup][/sup]。例如,2,2,6,6-四甲基-1-哌啶(TEMPO)介导的活性自由基聚合。Kanamori等合成的聚合物(二乙烯基苯)单体具有明确的连续形态,高的比表面积[sup][/sup]。[b]5 展望[/b][color=black]实际有机分子样品结构复杂、种类众多,而且对操作环境和分析方法要求较高。不同色谱模式的液相色谱方法不仅对特定的生物分子具有较好的选择性,且制备方法简单易得,结构可控。此外,聚合物单体的种类繁多,且其上面的官能团可以有多种修饰方法从而对不同的生物分子具有不同的作用。因此,随着液相色谱固定相的发展,聚合物整体柱以其独有的优势也会在生物分子的分离与分析中得到越来越广泛的应用。[/color][color=black] [/color][color=black] [/color][color=black] [/color][color=black] [/color][color=black] [/color][color=black] [/color][color=black] [/color][color=black] [/color][b]参考文献[/b] 杨帆, 毛劼, 何锡文. 基于巯基-烯点击反应制备有机-无机杂化硼酸亲和整体柱用于糖蛋白的选择性富集. 色谱, 2013, 31(6): 531-536. 平贵臣, 袁湘林, 张维冰等. 整体柱的制备方法及其应用.分析化学,2001,29(12):464-469. Jing Liu, Fangjun Wang, Zhenbin Zhang. Reversed phasemonolithic column based enzymereactor for proteinanalysis. Chinese Journal of Analytical Chemistry,2013, 41(1):10-14. Motokawa M, Ohira M, Minakuchi H [i]et al[/i]. Performance ofoctadecylsilylated monolithic silica capillary columns of 530μm innerdiameterin HPLC. J.Sep Sci,2006, 29(9): 2471-2477. 王超然, 王彦, 高也等. 聚(4-乙烯基苯硼酸-季戊四醇三丙烯酸酯)亲和整体柱的制备与应用. 分析化学研究报告,2012, 40(8):1207-1212. 李晶, 周琰春, 张嘉捷等. 阴离子交换聚合物整体柱的制备及其在[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]中的应用.分析测试学报,2012, 31(9):1089-1094. 张振宾, 欧俊杰, 林辉等. 有机-硅胶杂化整体柱的制备及应用研究进展.高等学校化学学报,2013,34(9):2011-2019. 刘婵, 江茜, 陈蕾等. 金纳米粒子修饰的氨基硅胶整体柱的制备及超灵敏表面增强拉曼散射检测.高等学院化学学报,2013,34(11):2488-2492. Yongqin Lv, Zhixing Lin, Frantisek Svec. Thiol-ene clickchemistry: a facile and versatile route for the functionalization of porouspolymer monoliths.Analyst,2012,137(9):4114-4118. 吕仁江, 丁会敏, 李英杰. 丙烯酰胺-β-环糊精毛细管电色谱手性整体柱的制备及应.应用化学,2012,29,(5):604-607. Frantisek Svec, Yongqin Lv. Advances and recent trends in thefield of monolithic columns for chromatography. Analytical Chemistry,2014,87(9):250-273. Zhongshan Liu, Junjie Ou, Hui Lin. Preparation of monolithic polymercolumnswithhomogeneousstructure viaphotoinitiated thiol-yne click polymerization and their application inseparation of small molecules.Analytical Chemistry,2014,86,(105):12334-12340. Trojer L, Lubbad S H, Bisjak C [i]et al[/i]. Monolithicpoly( p-methylstyrene-co-1,2-bis(p-vinylphenyl) ethane) capillary columns as novel styrene stationary phases forbiopolymer separation.J. Chromatogr. A, 2006, 1117(1): 56-66. Luo Q Z, Zou H F, Xiao X Z [i]et al[/i]. Chromatographic separation of proteins on metal immobilizediminodiacetic acid-bound molded monolithic rods of macroporous poly( glycidylmethacrylate-co-ethylene dimethacrylate) . J. Chromatogr. A,2001,926(2):255-264. 郑晖, 李秋顺, 马耀宏等. 微流控芯片上电色谱聚合物整体柱研究进展.山东科学,2013,26(1):16-21. J. Zhang, HL. Zou, Q. Qing [i]et al[/i]. Effect of chemical oxidation on the structure of singlewalled carbon nanotubes. J. Phy. Chem. B, 2003, 107(16):3712-3718. Junjie Ou, Zhongshan Liu, Hongwei Wang. Recent development ofhybrid organic-silica monolithic columns in CEC and capillary LC.Electrophoresis ,2015, 36(9):62-75. 王玺, 何健, 季一兵. 聚甲基丙烯酸酯毛细管整体柱的制备及其性能考察.中国药科学学报,2012, 67(7):78-85.[/align]
国家蛋白质科学上海设施/国家蛋白质科学中心(上海)(筹)公开招聘自动化控制系统工程师国家蛋白质科学研究上海设施是国家重大科技基础设施,是国家级蛋白质科学研究平台;在设施建设基础上,依托中国科学院上海生命科学研究院,委托生物化学与细胞生物学研究所(简称SIBCB)负责筹建成立并管理国家蛋白质科学中心(上海)(筹), 负责设施的运行管理。中心在筹建期间,办公地点设于生化与细胞所(上海市岳阳路320号);中心在建成运行期间,办公地点设于浦东新区张江高科技园区中区西部(上海市海科路333号)。中心定位于:支撑国家蛋白质上海设施建设的建设,衔接该设施的运行;聚集培养生命科学与生物技术特别 是蛋白质研究的人才,提升国家蛋白质研究能力;进而促进我国蛋白质基础研究的飞跃发展。中心将立足于国家生命科学与生物技术及相关研究领域雄厚的研究基础和创新实力,成为兼具蛋白质科学研究、技术及成果的转化、集成和应用平台的国家级的重要科学研究单元。国家蛋白质科学中心(上海)(筹)现因工作扩展的需要,公开招聘自动化控制系统工程师一名。一、岗位职责:参与国家蛋白质科学中心(上海)(筹)在上海同步辐射光源5线6站的建设、运行和管理,充分理解同步辐射光束线站的工作内容和线站用户的实际需求,完成线站自动化控制程序的设计、开发和维护。二、任职条件:1、本科以上学历,有丰富的 Unix/Linux 平台下的工作经验,熟悉 Unix/Linux 工作环境,习惯于在 Unix/Linux 平台下工作。有大量的源代码的阅读经验。2、有丰富的 C/C++ 开发经验。熟悉 Socket 编程和多线程编程。3、良好的英文表达能力。能独立完成项目调研,设计和开发工作。4、有以下背景或经验者优先考虑:有大型系统开发经验者和硬件开发经验者;有软件界面开发经验者;有网络程序开发经验者;熟悉 Tcl/Tk 语言者;有 Unix/Linux 系统管理经验者。5、具有良好的人际关系和团队协作精神,工作努力,作风踏实,责任心强。6、身体健康,能长期稳定工作。 三、招聘方式及程序 1、应聘材料:([back=whi
[size=3]选择材料及预处理 以蛋白质和结构与功能为基础,从分子水平上认识生命现象,已经成为现代生物学发展的主要方向,研究蛋白质,首先要得到高度纯化并具有生物活性的目的物质。蛋白质的制备工作涉及物理、化学和生物等各方面知识,但基本原理不外乎两方面。一是得用混合物中几个组分分配率的差别,把它们分配到可用机械方法分离的两个或几个物相中,如盐析,有机溶剂提取,层析和结晶等;二是将混合物置于单一物相中,通过物理力场的作用使各组分分配于来同区域而达到分离目的,如电泳,超速离心,超滤等。在所有这些方法的应用中必须注意保存生物大分子的完整性,防止酸、硷、高温,剧烈机械作用而导致所提物质生物活性的丧失。蛋白质的制备一般分为以下四个阶段:选择材料和预处理,细胞的破碎及细胞器的分离,提取和纯化,浓细、干燥和保存。 微生物、植物和动物都可做为制备蛋白质的原材料,所选用的材料主要依据实验目的来确定。对于微生物,应注意它的生长期,在微生物的对数生长期,酶和核酸的含量较高,可以获得高产量,以微生物为材料时有两种情况:(1)得用微生物菌体分泌到培养基中的代谢产物和胞外酶等;(2)利用菌体含有的生化物质,如蛋白质、核酸和胞内酶等。植物材料必须经过去壳,脱脂并注意植物品种和生长发育状况不同,其中所含生物大分子的量变化很大,另外与季节性关系密切。对动物组织,必须选择有效成份含量丰富的脏器组织为原材料,先进行绞碎、脱脂等处理。另外,对预处理好的材料,若不立即进行实验,应冷冻保存,对于易分解的生物大分子应选用新鲜材料制备。 蛋白质的分离纯化 一,蛋白质(包括酶)的提取 大部分蛋白质都可溶于水、稀盐、稀酸或碱溶液,少数与脂类结合的蛋白质则溶于乙醇、丙酮、丁醇等有机溶剂中,因些,可采用不同溶剂提取分离和纯化蛋白质及酶。 (一)水溶液提取法 稀盐和缓冲系统的水溶液对蛋白质稳定性好、溶解度大、是提取蛋白质最常用的溶剂,通常用量是原材料体积的1-5倍,提取时需要均匀的搅拌,以利于蛋白质的溶解。提取的温度要视有效成份性质而定。一方面,多数蛋白质的溶解度随着温度的升高而增大,因此,温度高利于溶解,缩短提取时间。但另一方面,温度升高会使蛋白质变性失活,因此,基于这一点考虑提取蛋白质和酶时一般采用低温(5度以下)操作。为了避免蛋白质提以过程中的降解,可加入蛋白水解酶抑制剂(如二异丙基氟磷酸,碘乙酸等)。下面着重讨论提取液的pH值和盐浓度的选择。[/size]
蛋白质与多肽蛋白质粉 人类的营养物质有许多种类,最为重要的为蛋白质,碳水化合物和脂肪,其它则是微量营养物质,如维生素、电解质和微量元素等。虽然每一种营养物质对人体来说都是不可或缺的,但绝大多数的营养学家都会有充分的理由认为,真正最重要的营养物质是蛋白质。一、蛋白质是构成人体的基本物质。 蛋白质是由氨基酸通过肽链相连而构成的,它是人体包括骨骼、肌肉、皮肤和脑的重要物质基础,同时氨基酸也是生成核酸的基本物质。我们知道,核酸既形成遗传密码,也是体内储存能量的基本物质。因而从根本上说,人体是由蛋白质组成的。构成人体蛋白质的生理功能概括有如下三个方面:1)人体组织的主要构成成份:如肌肉、骨骼、血液、皮肤、神经、肝、心等等。2)具有特殊生理功能:可以这样说,人类的一切生理活动都与蛋白质有关。如酶蛋白能催化机体的一切化学反应,包括蛋白质、脂肪、碳水化合物的消化等;载脂蛋白运送脂肪;血红蛋白运送氧;激素蛋白调节代谢与生理活动包括情感;血浆白蛋白调节渗透压、运输金属离子、胆红素和抗生素等。3)供给机体能量:成年人每日约需要更新400g蛋白质,每克蛋白质彻底分解能释放出约4 Kcal的热量。4)为机体提供氮原料:人体内所必需的嘧啶、嘌呤、肌酸、胆碱、肾上腺素、肉碱、牛磺酸等,都是以多肽、氨基酸为原料的。表1. 世界粮食组织(FAD)和世界卫生组织(WHO)根据中国人的体质和膳食结构推荐的中国人蛋白质的摄入量(RNLs)。年 龄蛋白质RNL(g/d) 初生—6个月 1.5-3 1岁 35 3岁 45 5岁 55 7岁 60 9岁 65 10-16岁 75-85 成年女性 65 成年男性 75 妊娠 +15 乳母 +20 根据统计资料:由于贫困、工作紧张、精神压力、减肥节食、以及肠胃疾病、癌症、贫血、肾病、各种结核病、肝硬化、腹水、烧伤、失血等,以及老龄人均不同程度地存在着蛋白质的摄入不足。 上世纪80年代以来,我国营养学家对7个省18个贫困地区,1万名学龄前儿童进行了为期4年的连续调查,发现营养不良现象非常严重,其中蛋白质的摄入量不足WHO规定的60%。近年社会医学工作调查,在发达地区由于生活节奏加快,精神压力异常增加,以及办公室白领阶层的减肥节食,也导致蛋白质摄入不足,代谢异常的人群增加。二、蛋白质缺乏的体征和临床症状 单纯的蛋白质营养不良又叫加西长病,这或许是来源于非洲的单词,单纯的能量不足时叫消瘦;临床上通常把这两种现象叫单纯性蛋白质能量营养不良症或PEM。单纯的PEM症在临床上较少见到,但在慢性消耗性疾病患者中则常见,尤其是在癌症患者和艾滋病的患者中几乎占到90%以上。 现代都市和贫困地区存在着相当数量的蛋白质营养不良族群,他们的临床表现主要是能量损失或不足,如体力不支、睡眠不安、怕冷、怕热、性冷淡、无法进行正常的体力劳动和运动,其次为肌肉组织萎缩、皮肤松驰;腿部、脸部易水肿、脂肪肝、无名皮疹、伤口愈合不良、记忆力下降、视力减弱等。再者免疫力低下易感冒、感染。在做血检时通常会发现这些族群的血浆蛋白处于正常值的下限,其中白蛋白、转铁蛋白、甲状腺素结合前体蛋白和视轴蛋白(retinol-binding protein)均处于低水平时,患者易于感染各种疾病并且出现早衰症状,如果是儿童则感染后死亡率增加30%-40%,对于这类人群WHO的专家最好的建议就是迅速补充优质(或全价)的蛋白质。三、优质蛋白质和劣质蛋白质的区别。 要弄清楚何为优质蛋白质?何为劣质蛋白质?我们要引入什么是必需氨基酸的概念。营养生理学家、生化学家发现构成人体蛋白质的氨基酸共有21种,而这些氨基酸中其中有4种是可以由体内含碳和含氮底物自己合成的,被称为非必需氨基酸,还有10个必需的氨基酸,是人类机体无法制造需要从饮食中摄取的,另有7个是介于这两者之间的被称为条件必需氨基酸。表2. 必需、条件必需和非必需氨基酸 必需氨基酸条件必需氨基酸 非必需氨基酸 亮氨酸牛黄酸 丙氨酸 异亮氨酸酪氨酸 谷氨酸 缬氨酸甘氨酸 天冬氨酸 赖氨酸丝氨酸 天冬酰胺 苯丙氨酸(酪氨酸)脯氨酸 蛋氨酸(半胱氨酸)谷氨酰酸 苏氨酸 胱氨酸 色氨酸 组氨酸 精氨酸 虽然蛋白质广泛存在于许多动物性和植物性食物中,但是必需氨基酸的构成异差很大,WHO把“蛋白质其组成恰好符合人体需要”的蛋白质称为理想蛋白质,在自然界这种理想的蛋白质普遍认为是鸡蛋蛋白,因此就把鸡蛋蛋白作为衡量蛋白质优劣的参照蛋白,科学家把它作为一把尺子来衡量各种蛋白质,并制定出标准,以4种必需氨基酸为最低限来决定其优劣,即色氨酸、苏氨酸、赖氨酸或者蛋氨酸(半胱氨酸)。 通过比较科学发现,肉、鱼、蛋、牛奶、乳酪含有优质蛋白,大豆、花生、豌豆也含有较多的高质量蛋白。进一步研究发现它们都不够完美,因而要求大家对优质的动物性蛋白和植物性蛋白进行了科学搭配才是最完美的全价蛋白质(complete protein)。表3. 部分高质量蛋白

[size=16px] 食品蛋白质检测仪通常使用一系列的化学、生物化学或物理方法来检测乳制品中的蛋白质含量。以下是一种可能的检测过程: 样品制备: 从乳制品中取得样品,通常需要将样品进行处理,以确保蛋白质在检测过程中能够充分释放和反应。 蛋白质提取: 样品中的蛋白质需要从其他成分中分离出来。这可能涉及到样品的离心、过滤和/或溶解等步骤,以获得含有蛋白质的提取物。 显色/反应: 蛋白质的浓度可以通过与特定试剂发生化学反应或形成复合物来测量。例如,比目鱼法(Bradford法)或比二巴脱酰基试剂(BCA法)都是常用于蛋白质浓度测定的方法。这些试剂与蛋白质反应后会产生颜色变化,颜色的强度可以与蛋白质的浓度成正比。 分光光度测量: 使用分光光度计来测量显色产物的吸光度,从而确定蛋白质的浓度。通常,会建立一个标准曲线,其中包含已知浓度的蛋白质标准样品,用于校准测量结果。 计算浓度: 通过比较待测样品的吸光度与标准曲线上的数据,可以计算出待测样品中蛋白质的浓度。 需要注意的是,不同类型的食品蛋白质检测仪可能会采用不同的方法和试剂,具体的步骤和操作可能会有所不同。此外,为了获得准确的结果,操作者需要在操作过程中遵循标准操作规程,并确保仪器的准确校准和维护。最终结果的准确性也可能会受到样品的处理、试剂的质量以及操作技术等因素的影响。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2023/08/202308291345517046_7349_6098850_3.png!w690x690.jpg[/img][/size]
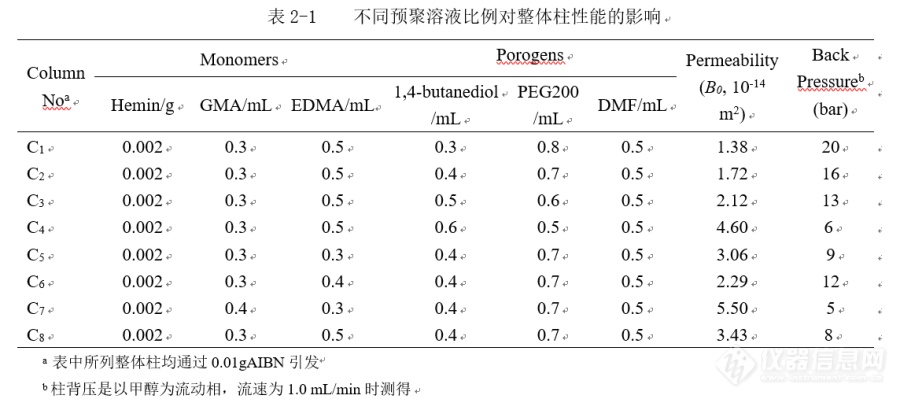
摘要:本文通过原位自由基聚合方式,以卟啉铁([color=black]Hemin[/color])和甲基丙烯酸缩水甘油酯([color=black]GMA[/color][color=black])[/color]作为二元单体,二甲基丙烯酸乙二醇酯([color=black]EDMA[/color][color=black])作为交联剂,[/color][color=black]1,4-[/color][color=black]丁二醇、聚乙二醇[/color][color=black]200[/color][color=black]和[/color][color=black]N,N-[/color][color=black]二甲基甲酰胺作为致孔剂,[/color]偶氮二异丁腈作为引发剂,经一锅法制备了聚([color=black]Hemin-co-GMA-co-EDMA[/color][color=black])整体柱。并通过扫描电子显微镜、压汞法、氮吸附法对其性能进行了表征。最后,将其作为高效液相色谱的固定相,对多种蛋白质样品进行了分离。结果表明基于卟啉铁的整体柱具有颗粒堆积的多孔结构,通透性好,柱背压低,对蛋白质具有良好的选择性。[/color]关键词:[color=black]卟啉铁;整体柱;蛋白质;高效液相色谱[/color][b]1 绪论1.1 引言[/b]蛋白质是人体的物质基础,某些蛋白质的表达水平的改变与疾病直接相关。这就要求对这些蛋白质进行细致研究,而将其从复杂的生物基质中分离出来是首要任务。对蛋白质进行分离鉴定通常使用电泳—质谱、液相色谱—质谱联用技术,但这些方法并不能完全满足蛋白质大分子对操作环境和分析方法要求较高的要求,并且费用较高。聚合物整体柱由于具有较大孔径和良好的生物兼容性,其在蛋白质大分子分离中的应用已经展现了特有的优势。此外,聚合物单体种类繁多,且其表面的官能团可以有多种修饰方法,对不同的蛋白质具有不同的选择性,从而实现分离[sup][color=black][/color][/sup][color=black]。[/color][b]1.2 聚合物整体柱[/b]整体柱又称连续床层,是一种在色谱柱管内制备的连续床固定相[sup][color=black][/color][/sup][color=black]。整体柱比颗粒填充柱的通透性更好,更易于实现快速分离[/color][sup][color=black][/color][/sup][color=black]。整体柱分为无机硅胶整体柱、有机聚合物整体柱、有机无机杂化整体柱(一般是基于硅胶的杂化整体柱)。硅胶整体柱和有机无机杂化整体柱具有良好的稳定性和机械强度,通透性好,但溶胶凝胶技术制备周期长,操作复杂,重复性差[/color][sup][color=black] [/color][/sup][color=black]。有机聚合物整体柱制备简单、适用[/color][color=black]pH[/color][color=black]范围广([/color][color=black]pH1-14[/color][color=black])。[/color]聚合物整体柱出现在上世纪90年代初,继而在制备和应用中得到发展[sup][/sup],至今已成功地用于分离科学,特别是用于分离生物大分子[sup][/sup]。多种多样的功能单体使整体柱设计变得更容易。聚合物整体柱适用范围广,已被用于不同的色谱模式,包括反相液相色谱(RPLC)、亲水相互作用色谱(HILIC)、离子交换色谱(IEC)等[sup][/sup]。多孔聚合物整体柱通常具有球形颗粒堆积结构,其大型通孔之间的聚合微球有利于显著提高聚合物整体柱的通透性,降低涡流扩散项,使其在高流速下能够有效地分离大分子。斯韦克系统地阐述了各种多孔聚合物整体柱的制备技术[sup][/sup],例如,2,2,6,6-四甲基-1-哌啶(TEMPO)介导的活性自由基聚合。Kanamori等以二乙烯基苯为单体,合成了具有明确的连续形态,高的比表面积的大孔聚合物整体柱[sup][/sup]。除了传统的自由基聚合,Hosoya等[sup][/sup]报道了一种将环氧单体与二胺类开环聚合的高性能有机聚合物整体柱,在毛细管液相色谱上,其对苯的分离塔板高度(H)可以达到小于5μm。值得注意的是,相比链生长聚合(比如自由基聚合反应)产生的球状结构,逐步聚合方式导致整体柱具有完全不同的形态[sup][color=black][/color][/sup]。[b]1.3 聚合物整体柱在生物大分子分离中的应用[/b]生物大分子样品结构复杂、种类繁多,而且需要在比较温和的条件下进行分离分析。而聚合物整体柱制备简单,分离迅速,且更易被后修饰为多种色谱模式的整体柱,对蛋白实际样品中的多种蛋白质有不同的选择性。因此,随着聚合物整体柱的进一步发展,其在大分子复杂生物样品的分离分析中将具有更为广泛的应用[sup][color=black][/color][/sup][color=black]。[/color][b]1.4 本文目的[/b][color=black]本实验欲制备一种新型液相色谱聚合物整体柱,用于蛋白质样品的分离分析。由于蛋白样品结构复杂,其中各种蛋白含量相差很大,这就要求液相色谱的固定相必须具有良好的选择性。因此,选择对目标蛋白质分子具有特异分子识别功能的材料,将其作为液相色谱固定相将会提高整体柱对蛋白质的选择性[/color][sup][color=black][/color][/sup]。[color=black]卟啉,是一类由四个吡咯环组成的吡咯衍生物,属于大分子。其母体为卟吩,卟吩被取代后称为卟啉。一定条件下,金属卟啉与某些蛋白质分子之间能够形成超分子,从而对这些蛋白质具有特异分子识别作用。正是由于金属卟啉对这些蛋白质具有特异分子识别作用,本实验以卟啉铁和甲基丙烯酸缩水甘油酯([/color][color=black]GMA[/color][color=black])作为二元单体,制备了一种新型聚合物整体柱。实验结果表明,该柱对蛋白质大分子具有分离能力。[/color][b]2 实验部分2.1 仪器与试剂[/b]Agilent 1100型高效液相色谱仪([color=black]Agilent[/color][color=black],美国);[/color][color=black]HWS-24[/color][color=black]电热恒温水浴锅(上海齐欣科学仪器有限公司);[/color][color=black]UPT- II -5T[/color][color=black]型优普系列超纯水器(成都超纯科技有限公司);[/color][color=black]BT25S[/color][color=black]型分析天平(北京赛多利斯科学仪器有限公司);[/color][color=black]KQ-500DE[/color][color=black]型超声波清洗器(昆山市超声仪器有限公司);[/color][color=black]S-430[/color][color=black]扫描型电子显微镜([/color][color=black]Hitachi[/color][color=black],日本);[/color][color=black]TriStar II3020[/color]型全自动比表面积和孔径分析仪([color=black]Micromeritics[/color][color=black],美国);[/color][color=black]AutoPore II9220 V3.04[/color]型压汞仪( Micromeritics[color=black],美国)。[/color]氯化血红素(卟啉铁,[color=black]Hemin[/color][color=black])(阿拉丁试剂有限公司);二甲基丙烯酸乙二醇酯([/color][color=black]EDMA[/color][color=black])(抚顺安信化学有限公司);甲基丙烯酸缩水甘油酯([/color][color=black]GMA[/color][color=black])、偶氮二异丁腈([/color][color=black]AIBN[/color][color=black])、[/color][color=black]N,N-[/color][color=black]二甲基甲酰胺([/color][color=black]DMF[/color][color=black])(天津市科密欧化学试剂有限公司,分析纯);[/color][color=black]1,4-[/color][color=black]丁二醇、磷酸二氢钠、磷酸氢二钠、聚乙二醇[/color][color=black]200[/color][color=black]([/color][color=black]PEG200[/color][color=black])(天津市光复精细化工研究所,分析纯);甲醇(上海星可高纯溶剂有限公司,液相色谱纯);实验用水为超纯水,进入高效液相色谱仪的所有流动相及样品均经规格为[/color][color=black]0.45μm[/color][color=black]的微孔滤膜过滤。[/color][b]2.2 聚(Hemin-co-GMA-co-EDMA)整体柱的制备[/b]按照表2-1中所[color=black]列柱[/color][color=black]C[sub]1[/sub]-C[sub]8[/sub][/color][color=black]的比例,在试管中加入[/color][color=black]Hemin[/color][color=black]、[/color][color=black]GMA[/color][color=black]、[/color][color=black]EDMA[/color][color=black]、[/color][color=black]1,4-[/color][color=black]丁二醇、[/color][color=black]PEG200[/color][color=black]、[/color][color=black]DMF[/color][color=black]、[/color][color=black]AIBN[/color][color=black],超声[/color][color=black]15min[/color][color=black]使完全溶解并混匀,通氮气。分别将预聚溶液装入一端封口的不锈钢柱管中([/color]50mm[color=black]×4.6mmi.d.[/color]),然后密封另一端,使其在[color=black]60[/color]℃[color=black]反应[/color][color=black]10[/color][color=black]小时。反应完成后,将整体柱连接于高效液相色谱系统,以甲醇在线冲洗除去整体柱中的致孔剂和其他未反应物。[/color]通过调整单体、交联剂、致孔剂的比例来考察各因素对整体柱柱压、孔径大小、通透性等的影响,最终得到优化的整体柱。[img=,690,305]https://ng1.17img.cn/bbsfiles/images/2019/07/201907241110575843_2573_3964321_3.png!w690x305.jpg[/img][b]2.3 色谱条件[/b]为了达到最佳分离效果,调节流动相磷酸盐溶液/水的比例,寻找对混合蛋白质样品具有最佳分离能力的流动相比例。[color=black]高效液相色谱仪为安捷伦[/color][color=black]1100[/color][color=black]系列,整体柱在不锈钢空色谱管柱[/color][color=black]([/color]50mm[color=black]×4.6mmi.d[/color])制得。流动相为[color=black]0.02mol/L[/color][color=black]磷酸盐溶液([/color][color=black]NaH[sub]2[/sub]PO[sub]4[/sub]+Na[sub]2[/sub]HPO[sub]4[/sub][/color][color=black])[/color][color=black]/[/color][color=black]水,流速为[/color][color=black]1.0mL/min[/color][color=black]。柱温为室温,紫外检测波长为[/color][color=black]280nm[/color][color=black]。[/color][b]3 结果与讨论3.1 聚(Hemin-co-GMA-co-EDMA)整体柱制备条件的优化[/b]以[color=black]Hemin[/color]和[color=black]GMA[/color]作为功能单体,[color=black] EDMA[/color][color=black]作为交联剂,[/color][color=black]1,4-[/color][color=black]丁二醇,[/color][color=black]PEG200[/color][color=black],[/color][color=black]DMF[/color][color=black]作为致孔剂,[/color]AIBN[color=black]作为引发剂,聚合方式为热引发的原位自由基聚合,制备[/color]聚(Hemin-co-GMA-co-EDMA)整体柱。通过改变整体柱各组分的比例,可以得到对蛋白质分离能力较好的整体柱。观察并比较整体柱各组分不同比例下制备的各聚合物整体柱的外观均匀度、贴壁情况、硬度、机械强度等,综合分析,从中获得最为理想的聚合物整体柱。[b]3.1.1致孔剂比例对聚合物整体柱制备的影响[/b]整体柱的机械强度和渗透性与致孔剂的种类及用量有很大的关系。单体用量一定的条件下,致孔剂的量越多,整体柱的背压越低而渗透性越大。选择致孔剂时,应注意所选致孔剂既要有良好的占位能力,又不至残留于柱体内而不能被冲洗溶剂洗脱出来。[color=black]Hemin[/color][color=black]在[/color][color=black]DMF[/color][color=black]中溶解性好,因此[/color][color=black]DMF[/color][color=black]被选为制备聚([/color][color=black]Hemin-co-GMA-co-EDMA[/color][color=black])整体柱的良致孔剂,与[/color][color=black]1,4[/color][color=black]丁二醇和[/color][color=black]PEG200[/color][color=black]组成致孔剂体系。表[/color][color=black]2-1[/color][color=black]中列出了典型的优化比例的过程,其中[/color][color=black]C[sub]1[/sub]-C[sub]4[/sub][/color][color=black]为采用不同比例致孔剂得到的整体柱,增[/color]加1,4丁二醇的比例,能够提高整体柱的渗透率。[color=black]结果表明:柱[/color][color=black]C[sub]2[/sub][/color][color=black]所采用的三元致孔体系比例能够得到同时具有低背压和高渗透率的整体柱。[/color][b]3.1.2单体与交联剂比例不同对聚合物整体柱制备的影响[/b]制备聚合物整体柱时,若单体与交联剂的用量占聚合物总量比例过大,则聚合物背压升高,导致渗透性下降;反之,则会导致聚合物整体柱渗透性过高,无法达到对样品的分离效果。此外,交联剂的用量比例增大则聚合物交联度增大,将致使制备的聚合物整体柱孔径减小,结构密实,在比表面积增大的同时,却会使柱压增高,通透性下降。表[color=black]2-1[/color][color=black]中,柱[/color][color=black]C[sub]5[/sub]-C[sub]8[/sub][/color][color=black]相比较,改变单体与交联剂的比例,结果表明柱[/color][color=black]C[sub]8[/sub][/color][color=black]性能最佳,机械强度适宜,渗透性良好,后续的分析分离实验均用[/color][color=black]C[sub]8[/sub][/color][color=black]号整体柱完成。[/color][b]3.2 聚(Hemin-co-GMA-co-EDMA)整体柱的表征[/b]用甲醇为流动相在线冲洗聚合物整体柱,以冲去致孔剂和未反应的单体,并以高流速将整体柱从色谱柱管内冲出,放入真空干燥箱内干燥24小时,分别用扫描电镜法、氮吸附法、压汞法对该聚合物整体柱进行表征。3.2.1聚(Hemin-co-GMA-co-EDMA)整体柱的扫描电镜图[img=,690,315]https://ng1.17img.cn/bbsfiles/images/2019/07/201907241114548185_7773_3964321_3.png!w690x315.jpg[/img]图3-1分别为柱C[sub]8[/sub]放大3,000倍和30,000倍的扫描电镜图。由图可知:整体柱内部为多孔颗粒堆积结构。[b]3.2.2聚(Hemin-co-GMA-co-EDMA)整体柱的氮吸附-脱附等温线[/b][img=,690,480]https://ng1.17img.cn/bbsfiles/images/2019/07/201907241116349175_9784_3964321_3.png!w690x480.jpg[/img][color=black]通过氮吸附法对该聚合物整体柱的孔类型进行分析,结果如图[/color][color=black]3-2[/color]所示。该等温线符合Ⅲ型等温线,[color=black]在低压区[/color][color=black]([/color]p/p[sub]0[/sub]<[color=black]0.1[/color][color=black]),[/color][color=black]曲线偏向[/color][color=black] X [/color]轴且没有拐点,氮气和柱材料之间的吸附作用很弱,且在中压段不存在回滞环,表明该材料孔结构中几乎不存在微孔和介孔;在相对压力较高时[color=black]([/color]p/p[sub]0[/sub]>[color=black]0.9[/color][color=black]),[/color][color=black]氮气和柱材料之间的吸附作用很强,吸附量呈较大上升趋势,表明该材料含有大孔结构。[/color][b]3.2.3聚(Hemin-co-GMA-co-EDMA)整体柱的压汞法分析图[/b][img=,690,350]https://ng1.17img.cn/bbsfiles/images/2019/07/201907241117438633_8238_3964321_3.png!w690x350.jpg[/img]由于该柱材料含大孔结构,故通过压汞法对其大孔结构进行了表征。由图3-3可知,整体柱的孔尺寸分布范围较窄,表明孔结构较均匀。其孔体积、众数孔径、孔隙率分别为1.40mL/g、3497 nm、57.32 %。[b]3.2.4聚(Hemin-co-GMA-co-EDMA)整体柱的机械稳定性[/b]图3-4为分别以磷酸盐缓冲液(NaH[sub]2[/sub]PO[sub]4[/sub]+Na[sub]2[/sub]HPO[sub]4[/sub])和水为流动相时柱C[sub]8[/sub]的[color=black]柱背压与流速的关系图。以磷酸盐缓冲液和水为流动相时,其相关系数[/color][color=black]r[/color][color=black]值分别为[/color][color=black]0.9992[/color][color=black]和[/color][color=black]0.9991[/color][color=black],表明柱压与流速有良好的线性关系,[/color]且高流速下整体柱稳定性依然良好,表明柱材料具有良好的机械稳定性。[img=,690,375]https://ng1.17img.cn/bbsfiles/images/2019/07/201907241119324545_1492_3964321_3.png!w690x375.jpg[/img][b]3.3 聚(Hemin-co-GMA-co-EDMA) 整体柱的色谱性能考察3.3.1整体柱对人血浆的色谱分离[/b]人血浆预处理:取新鲜人血,于4℃,4500r/min的条件下离心15min,取上清液冷藏保存,备用。以整体柱C[sub]8[/sub][color=black]为[/color][color=black]HPLC[/color][color=black]固定相,以[/color][color=black]0.02mol/L[/color]磷酸盐溶液(NaH[sub]2[/sub]PO[sub]4[/sub]+Na[sub]2[/sub]HPO[sub]4[/sub])[color=black]/[/color][color=black]水为流动相,流速为[/color][color=black]1.0mL/min[/color],对人血浆样品进行pH[color=black]和离子强度梯度洗脱,结果如图[/color]3-5[color=black]所示。表明整体柱[/color][color=black]C[sub]8[/sub][/color][color=black]对人血浆中的蛋白质具有良好的选择性和较高的分离效能。这是由于整体柱中的卟啉铁结构易于与蛋白质之间形成多种作用力,从而达到特异识别。[/color][img=,690,444]https://ng1.17img.cn/bbsfiles/images/2019/07/201907241124228955_449_3964321_3.png!w690x444.jpg[/img][b]3.3.2 整体柱对鸡卵清的色谱分离[/b][color=red] [/color]鸡卵清预处理:取市售的新鲜鸡蛋一枚,取其蛋清液并用磷酸盐缓冲液(50mmol/L,pH7.0)稀释一倍(V/V)。将稀释后的蛋清液混合均匀于4℃,4500r/min的条件下离心15min,取其上清液冷藏保存,备用。图[color=black]3-6[/color][color=black]为整体柱[/color][color=black]C[sub]8[/sub][/color][color=black]对鸡卵清的色谱分离图。结果表明,整体柱[/color][color=black]C[sub]8[/sub][/color][color=black]对鸡卵清中的多种蛋白质具有良好选择性。[/color][img=,690,407]https://ng1.17img.cn/bbsfiles/images/2019/07/201907241125286053_9665_3964321_3.png!w690x407.jpg[/img][b]3.3.3 整体柱对蜗牛酶的色谱分离[/b]蜗牛酶是一种含有[color=black]20[/color][color=black]多种酶的混合物,其主要成分有[/color][color=black]9[/color][color=black]种。图[/color][color=black]3-7[/color][color=black]为整体柱[/color][color=black]C[sub]8[/sub][/color][color=black]对蜗牛酶的色谱分离图。由图可知,整体柱[/color][color=black]C[sub]8[/sub][/color][color=black]对其中的一些酶有良好的选择性。[/color][img=,690,407]https://ng1.17img.cn/bbsfiles/images/2019/07/201907241126464743_5894_3964321_3.png!w690x407.jpg[/img]尽管聚(Hemin-co-GMA-co-EDMA)整体柱[color=black]C[sub]8[/sub][/color]对三种实际样品中的某些蛋白质有较好的选择性,但色谱峰普遍存在拖尾情况,这可能是由于卟啉铁能够与蛋白质之间形成配位从而造成拖尾。此外,分离后的蛋白质分析和鉴定工作还未完成,后续的研究需要通过色谱-质谱联用技术对蛋白质进行定性分析。[b]4 结论与展望[/b][align=left]本实验引入新的功能单体卟啉铁(Hemin),制备了聚(Hemin-co-GMA-co-EDMA)整体柱,并将其用于蛋白质的分离。该整体柱具有均匀的内部结构,高通透性和良好机械性能。其对蛋白质的色谱分离结果表明:卟啉铁的引入,能够从复杂的生物样品中分离较多数量的蛋白质,表明整体柱对蛋白质具有良好选择性。[/align]生物样品中蛋白质的分离是一项十分复杂的工作,本文中的方法还需要进一步完善分离机理,改善柱选择性,更有待续的蛋白质鉴定工作需要研究。通过本实验中的方法对蛋白质进行分离和后续的鉴定研究工作的完成将为蛋白质组学的分类、分级研究提供重要的数据支持。参考文献 Pellati F, Calo S, Benvenuti S. [color=black]High-performancechromatography analysis of polyacety and polyenes in echinacea pallida by usinga monolithic reversed-phase silica column[/color] . J. Chromatogr. A, 2007,1149(5): 56-65. Nonaka S, TsunodM, Aoyama C[i] et al[/i]. Determinationof N,N-dimethyl-arginine in rat plasmaand dimethylarginine dimethylaminohydrolase activity in rat kidney using amonolithic silica column . J. Chromatogr. B, 2006, 843(19): 170-174. Motokawa M, Ohira M, Minakuchi H[i] et al[/i].Performance of octadecylsilylated monolithic silica capillarycolumns of 530μm innerdiameter in HPLC . J. Sep Sci, 2006, 29(9):2471-2477. 王超然,王彦,高也等.聚(4-乙烯基苯硼酸-季戊四醇三丙烯酸酯)亲和整体柱的制备与应用.分析化学研究报告, 2012, 40(8): 1207-1212. 李晶, 周琰春,张嘉捷等.阴离子交换聚合物整体柱的制备及其在[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]中的应用.分析测试学报, 2012, 31(9):1089-1094. 张振宾, 欧俊杰, 林辉等.有机-硅胶杂化整体柱的制备及应用研究进展.高等学校化学学报,2013, 34(9): 2011-2019. Lv Y, Lin Z, Svec F. Thiol-ene click chemistry: a facile and versatileroute for the functionalization of porous polymer monoliths . Analyst, 2012,137(9): 4114-4118. 平贵臣, 袁湘林, 张维冰等.整体柱的制备方法及其应用.分析化学, 2001, 29(12): 464-469. Lin Z, Huang H, Sun X [i]etal[/i]. Monolithic column based on a poly(glycidylmethacrylate-co-4-vinylphenylboronic acid-co-ethylene dimetharylate) copolymerfor capillary liquid chromatography of small molecules and proteins . J.Chromatogr. A, 2012, 1246(13): 90-97. Akira N, TakeshiS. Advancein monolithic materials for sample preparation in drug and pharmaceuticalanalysis . TrAC, 2013, 45(9): 182-196. Liu J, Wang F, Zhang Z. Reversed phase monolithic column based enzymereactor for protein analysis. Chin. J. Anal. Chem, 2013, 41(1): 10-14. Frantisek S, Lv Y. Advances andrecent trends in the field of monolithic columns for chromatography. Anal. Chem,2014, 87(9): 250-273. Liu Z, Ou J, LinH. Preparation of monolithic polymercolumnswithhomogeneousstructurevia photoinitiated thiol-yne click polymerization and their application inseparation of small molecules . Anal. Chem, 2014, 86(105): 12334-12340. Jin Zhang, Huilin Zou, Qin Qing [i]et al[/i]. Effect of chemical oxidation on the structure of singlewalled carbon nanotubes . J. Phy. Chem. B, 2003, 107(16): 3712-3718. Ou J, Liu Z, Wang H. Recentdevelopment of hybrid organic-silica monolithic columns in CEC and capillary LC. Electrophoresis, 2015, 36(9): 62-75. 王玺, 何健, 季一兵.聚甲基丙烯酸酯毛细管整体柱的制备及其性能考察.中国药科大学学报,2012, 67(7): 78-85. 吕仁江, 丁会敏, 李英杰.丙烯酰胺-β-环糊精毛细管电色谱手性整体柱的制备及应.应用化学,2012, 29(5): 604-607. Trojer L, Lubbad S H, Bisjak C [i]et al[/i]. Monolithicpoly( p-methylstyrene-co-1,2-bis( p-vinylphenyl)ethane) capillary columns as novel styrene stationary phases for biopolymerseparation . J. Chromatogr. A, 2006, 1117(1): 56-66. 白立改,牛文敬,杨更亮.聚合物整体柱在生物大分子分离中的应用.色谱,2013, 9(4): 303-309. Zuo L, Zou H, Zhang X [i]et al[/i]. Chromatographicseparation of proteins on metal immobilized iminodiacetic acid-bound moldedmonolithic rods of macroporous poly(glycidyl methacrylate-co-ethylenedimethacrylate) . J. Chromatogr. A, 2001, 926(2): 255-264. 郑晖,李秋顺,马耀宏等. 微流控芯片上电色谱聚合物整体柱研究进展.山东科学,2013, 26(1): 16-21.
人类的营养物质有许多种类,最为重要的为蛋白质,碳水化合物和脂肪,其它则是微量营养物质,如维生素、电解质和微量元素等。虽然每一种营养物质对人体来说都是不可或缺的,但绝大多数的营养学家都会有充分的理由认为,真正最重要的营养物质是蛋白质。一、蛋白质是构成人体的基本物质。蛋白质是由氨基酸通过肽链相连而构成的,它是人体包括骨骼、肌肉、皮肤和脑的重要物质基础,同时氨基酸也是生成核酸的基本物质。我们知道,核酸既形成遗传密码,也是体内储存能量的基本物质。因而从根本上说,人体是由蛋白质组成的。构成人体蛋白质的生理功能概括有如下三个方面:1)人体组织的主要构成成份:如肌肉、骨骼、血液、皮肤、神经、肝、心等等。2)具有特殊生理功能:可以这样说,人类的一切生理活动都与蛋白质有关。如酶蛋白能催化机体的一切化学反应,包括蛋白质、脂肪、碳水化合物的消化等;载脂蛋白运送脂肪;血红蛋白运送氧;激素蛋白调节代谢与生理活动包括情感;血浆白蛋白调节渗透压、运输金属离子、胆红素和抗生素等。3)供给机体能量:成年人每日约需要更新400g蛋白质,每克蛋白质彻底分解能释放出约4 Kcal的热量。4)为机体提供氮原料:人体内所必需的嘧啶、嘌呤、肌酸、胆碱、肾上腺素、肉碱、牛磺酸等,都是以多肽、氨基酸为原料的。表1. 世界粮食组织(FAD)和世界卫生组织(WHO)根据中国人的体质和膳食结构推荐的中国人蛋白质的摄入量(RNLs)。年 龄 蛋白质RNL(g/d)初生—6个月 1.5-31岁 353岁 455岁 557岁 609岁 6510-16岁 75-85成年女性 65成年男性 75妊娠 +15乳母 +20根据统计资料:由于贫困、工作紧张、精神压力、减肥节食、以及肠胃疾病、癌症、贫血、肾病、各种结核病、肝硬化、腹水、烧伤、失血等,以及老龄人均不同程度地存在着蛋白质的摄入不足。上世纪80年代以来,我国营养学家对7个省18个贫困地区,1万名学龄前儿童进行了为期4年的连续调查,发现营养不良现象非常严重,其中蛋白质的摄入量不足WHO规定的60%。近年社会医学工作调查,在发达地区由于生活节奏加快,精神压力异常增加,以及办公室白领阶层的减肥节食,也导致蛋白质摄入不足,代谢异常的人群增加。二、蛋白质缺乏的体征和临床症状单纯的蛋白质营养不良又叫加西长病,这或许是来源于非洲的单词,单纯的能量不足时叫消瘦;临床上通常把这两种现象叫单纯性蛋白质能量营养不良症或PEM。单纯的PEM症在临床上较少见到,但在慢性消耗性疾病患者中则常见,尤其是在癌症患者和艾滋病的患者中几乎占到90%以上。现代都市和贫困地区存在着相当数量的蛋白质营养不良族群,他们的临床表现主要是能量损失或不足,如体力不支、睡眠不安、怕冷、怕热、性冷淡、无法进行正常的体力劳动和运动,其次为肌肉组织萎缩、皮肤松驰;腿部、脸部易水肿、脂肪肝、无名皮疹、伤口愈合不良、记忆力下降、视力减弱等。再者免疫力低下易感冒、感染。在做血检时通常会发现这些族群的血浆蛋白处于正常值的下限,其中白蛋白、转铁蛋白、甲状腺素结合前体蛋白和视轴蛋白(retinol-binding protein)均处于低水平时,患者易于感染各种疾病并且出现早衰症状,如果是儿童则感染后死亡率增加30%-40%,对于这类人群WHO的专家最好的建议就是迅速补充优质(或全价)的蛋白质。
蛋白质组学研究的一般工具与方法随着人类基因组计划取得巨大的成功和许多物种基因组测序的完成,仅仅靠基因组的序列来试图阐明生命现象是远远不够的,因此,研究重心已经开始从揭示生命的所有遗传信息转移到在分子整体水平对功能的研究上,生命科学已实质性地跨入了后基因组时代。 尽管现在已经有多个物种的基因组被测序,但这些基因组中通常有一半以上基因的功能是未知的。目前功能基因组研究中所采用的策略,如微阵列法(microarray)(Wodicka et al., 1997)、基因芯片(gene chips)(Ramsay et al., 1998)、基因表达序列分析(SAGE)(Velculescu et al., 1995)等,都是从细胞中mRNA的角度来考虑的。但事实上,从DNA、mRNA到蛋白质存在三个层次的调控,mRNA自身也存在着贮存、转运和降解等问题,从mRNA角度考虑,实际上仅包括了转录水平调控,并不能全面代表蛋白质表达水平。实验也证明,组织中mRNA丰度与蛋白质丰度的相关性并不好,尤其对于低丰度蛋白质来说,相关性更差。蛋白质复杂的翻译后修饰,蛋白质的亚细胞定位或迁移,蛋白质-蛋白质相互作用则几乎无法从mRNA水平来判断(曾嵘,夏其昌,2002)。新生肽链合成后存在多种加工、修饰过程,蛋白质间也存在类似于mRNA分子内的剪切、拼接,研究证明基本元件“intein”广泛存在于蛋白质中(Perler et al., 1997)。基因与其编码产物蛋白的线性对应关系只存在于新生肽链而不是最终的功能蛋白质中。 蛋白质是生理功能的执行者和生命现象的直接体现者,对蛋白质结构和功能的研究将直接阐明生命在生理或病理条件下的变化机制;蛋白质本身的存在形式和活动规律,如翻译后修饰、蛋白质间相互作用及蛋白质构象等问题,仍依赖于直接对蛋白质的研究来解决。因此要对生命的复杂活动有全面和深入的认识,必然要在整体、动态、网络的水平上对蛋白质进行研究(钱小红,贺福初,2003)。 蛋白质组学研究中常用的技术体系 方法学上,二维凝胶电泳-质谱仍然是目前最流行和可靠的技术平台(Rabilloud et al., 2000)。其一般过程是:细胞或组织样品——样品制备——二维凝胶电泳(2D-PAGE)分离蛋白质——计算机辅助分析2D-PAGE图象——对感兴趣的蛋白质进行酶解——质谱分析——数据库检索——蛋白质鉴定——分析蛋白质在细胞与组织中的表达情况。 2-D PAGE 样品制备 2D-PAGE 的操作流程基本上实现了程序化。但是,样品制备是一个非常关键与复杂的过程。成功的2D-PAGE取决于对样品中蛋白质有效的抽提和它的溶解性。与核酸不同,目前没有一种通用的方法适用于所有的蛋白质,来源不同的蛋白质都受到自身蛋白质制备方法的挑战。 正确的样品制备方法从收集样品开始时就要防止样品的裂解和被蛋白水解酶降解(Rabilloud et al., 2000)。要尽可能溶解更多的蛋白,并且在2D-PAGE过程中保持它的溶解性,阻止蛋白质的人为修饰。在样品制备过程中,各个实验室也通过实验建立了更为可行的方法。目前通过建立分步提取方法可以有效地提取出更多的蛋白质(兰彦等,2001)。另一种对蛋白质采用预分离的方法称为“多间隔电解法(multi-compartment-electrolyser)”,采用这种方法后,分辨率和胶的质量均明显改善(Herbert et al., 2000)。 但是,由于生物样品的多样性和复杂性,目前所采用的样品制备方法具有局限性。其它物质对蛋白质样品制备存在干扰。核酸通过与蛋白质结合,增加样品黏度而干扰等点聚焦(IEF)分离的效果。当然,通过实验探索,采取一些措施可以减轻它的干扰。例如,在样品制备过程中加入非特异性的核酸酶或RNase与DNase的混合物,在等电聚焦时将每个胶条的电流限制在50mA以内通常可以消除其影响。脂类物质的影响可以通过利用有机溶剂的方法将其去除,但是这常常会导致蛋白质的不可逆沉淀。除了蛋白质的降解之外,糖基化是蛋白质的最重要的人工修饰,样品中的尿素在这一过程中起着非常重要的作用。样品中的尿素在降解的过程中会形成能够与蛋白质的氨基反应的氰酸盐,这种结果会导致蛋白质带有更多的正电荷。所以,在2D-PAGE中要用新鲜的尿素溶液,在等电聚焦过程中要控制温度不能太高(Beranova-Giorgianni, 2003)。但是,目前还没有一种简单有效的方法来去除样品中的多糖。 样品分离和分析 样品制备完成后运用IEF和SDS-PAGE电泳对它进行分离,常采用银染和考马斯亮兰染色即可观察到具有许多蛋白质斑点的凝胶图像。等电聚焦电泳与SDS-PAGE的具体操作步骤已经实现了程序化,均有详细操作流程参考,但是由于样品的不同,不同样品的具体条件还需要试验探索。第二相SDS-PAGE运行结束,染色完毕后,利用计算机软件对凝胶图像进行分析,如PD-QUEST软件,LIPS,HERMES,GEMINI等,对凝胶图像上的蛋白质斑点进行匹配,对图像进行数字化处理等分析(贾宇峰等,2001),对感兴趣的蛋白质采用质谱分析。 低丰度蛋白质的检测 低丰度蛋白在蛋白质组学研究中常常是人们非常感兴趣的,因为细胞或组织中的一些生物活性物质,如细胞分泌的一些活性物质,受体等表达量都非常低。按照一般电泳的上样量,这些小分子是根本看不到的,但如果单纯地增加上样量,细胞或组织中的大量表达的蛋白就会将其覆盖,而且上样量过大也会影响电泳结果。所以对这些低丰度的样品可以进行富集,富集的方法可以通过层析,如亲和层析,离子交换层析等方法,还可以通过利用样品等电点性质等方法将pH范围相近的蛋白质富集(Santoni et al., 2000; Beranova-Giorgianni, 2003)。
尿微量蛋白(尿微量白蛋白/蛋白尿)试验(也称“白蛋白试验”,“尿微量白蛋白”和“蛋白尿”试验)何为尿微量白蛋白(白蛋白)试验?尿微量白蛋白试验是对尿液中的蛋白质进行测定的筛选试验。人体血液中有一种蛋白质称为白蛋白。在正常情况下,几乎无法在尿液中检测到。只有在肾脏受损,尤其是损伤早期,它可以优先于其他肾损伤标志物在尿液中被检测出,因此,尿微量白蛋白在诊断肾脏疾病、早期肾损伤等方面具有重要意义。此项试验有何目的?蛋白质是人体的基本构成“材料”,具备一些重要的功能和作用,可结合营养物质将其运输至各个组织,,并将人体中循环的体液量维持在适当水平。肾脏功能正常时,蛋白质几乎无法通过肾脏进入尿液(仅会排出血液循环产生的废料)。然而,如果人的肾功能受损或衰竭,该肾脏对蛋白质的过滤能力将有所下降,因而一些蛋白质将会透过肾脏而出现在尿液中,称为尿微量蛋白。尿微量白蛋白与蛋白尿有何不同?白蛋白是一种大量存在于血液中的典型蛋白质。因其分子个头小,当肾脏功能出现问题时,白蛋白是能够率先通过肾脏进入尿液的几种蛋白质之一。尿液中出现少量白蛋白的情况称为尿微量白蛋白。若肾脏功能受损严重,尿液中的白蛋白数量呈现出增长趋势,这种症状被改称为蛋白尿。尿微量白蛋白/蛋白尿有何症状?病症早期,并无明显症状或征兆显现。随着肾功能衰竭的加重,大量蛋白质出现在尿液中,手脚、腹部和面部可能出现肿胀。如果蛋白尿的情况加重,可能会造成永久性肾功能损伤,有些病人可能需要做透析或肾移植。不论上述症状是否存在,尿蛋白测定是确定有多少蛋白质进入尿液的唯一办法。蛋白尿还可能引发心血管疾病。血管受损除了会引发肾脏疾病外,还可能会造成窒息和心力衰竭。患蛋白尿(症)的高危人群有哪些?患有糖尿病、高血压、心血管疾病和其他类型肾脏疾病等慢性病的病人易出现蛋白尿。老年人、肥胖人群以及有肾脏疾病家族史的人群。其
蛋白质是荷兰科学家格里特在1838年发现的,它是生物体内一种极重要的高分子有机物。没有蛋白质就没有生命,它是与生命及与各种形式的生命活动紧密联系在一起的物质。人体的生长、发育、运动、遗传、繁殖等一切生命活动都离不开蛋白质,因此对于蛋白质的研究显得极其重要与急迫。AFM 对于蛋白质的研究是一个极好的工具,它可以测量蛋白质空间结构,表征蛋白质的结构与功能、了解分子间的相互作用等等。样品制备当用AFM对蛋白质进行观察时,样品制备很重要。蛋白质样品的制备原则与粉体材料基本相同,也需要固定到基片上,只是要研究一些活体蛋白时,必须为之提供一定的生理环境,如生理缓冲液,所以大多需要在溶液中进行研究,如成像,测定力曲线以研究其构形,构像转变等特性.所以应该选择合适的方法在固定蛋白质样品的同时仍能保持其生物特性。具体要求和方法如下:样品制备要求样品表面平整, 高度起伏≤10一20μm;表面有一定的硬度;基底面平滑;样品在基底表面要求相对均匀、分散等。样品制备过程蛋白质样品制备过程有两种方法蛋白质吸附固定法: 使用在中性条件下带负电云母片、玻璃及氧化硅为基底,将一定浓度的带正电的蛋白质溶液滴加于云母表面,蛋白便可很容易通过吸附固定吸附于云母表面蛋白质共价固定法: 在某些特定的条件下,蛋白分子需要通过共价吸附才能检测到。利用蛋白质分子上的氨基与疏基丙酸的羧基形成肽键连接的原理,进行蛋白质的固定。
有谁用凯式定氮法测过蛋白质的含量,有没有要特别注意的问题呀!刚进此领域不久,还望各位多多帮忙!!!!!!!!!!!!!!!!!!!!!!!!!!![em24] [em25] [em24] [em26]
一、标准曲线一般用分光光度法测物质的含量,先要制作标准曲线,然后根据标准曲线查出所测物质的含量。因此,制作标准曲线是生物检测分析的一项基本技术。二、蛋白质含量测定方法 1. 凯氏定氮法2. 双缩脲法3. Folin-酚试剂法4. 紫外吸收法5. 考马斯亮蓝法三、考马斯亮蓝法测定蛋白质含量—标准曲线制作 (一)试剂: 1. 考马斯亮蓝试剂:考马斯亮蓝G—250 100 mg溶于50 ml 95%乙醇,加入100 ml 85% H3 PO4 ,雍蒸馏水稀释至1000 ml,滤纸过滤。最终试剂中含0.01%(W/V)考马斯亮蓝G—250,4.7%(W/V)乙醇,8.5%(W/V)H3 PO4 。2. 标准蛋白质溶液:纯的牛血清血蛋白,预先经微量凯氏定氮法测定蛋白氮含量,根据其纯度同0.15 mol/LNaCl配制成100 ug/ml蛋白溶液。(二)器材: 1. 722S型分光光度计使用及原理。2. 移液管使用。(三)标准曲线制作: 1. 试管编号0123456100ug/ml标准蛋白(ml)0.00.10.20.30.40.50.60.15mol/L NaCl (ml)10.90.80.70.60.50.4考马斯亮蓝试剂 (ml)5555555摇匀,1h内以1号管为空白对照,在595nm处比色A595nm2. 以A595nm 为纵坐标,标准蛋白含量为横坐标(六个点为10ug、20 ug、30 ug、40 ug、50 ug、60 ug),在坐标轴上绘制标准曲线。(1)利用标准曲线查出回归方程。(2)用公式计算回归方程。(3)或用origin作图 ,测出回归线性方程。即A595nm =a×X( )+6;一般相关系数应过0.999以上,至少2个9以上。(4)绘图时近两使点在一条直线上,在直线上的点应该在直线两侧。(四)蛋白质含量的测定: 样品即所测蛋白质含量样品(含量应处理在所测范围内),依照操作步骤1操作,测出样品的A595nm ,然后利用标准曲线或回归方程求出样品蛋白质含量。一般被测样品的A595nm 值在0.1—0.05之间,所以上述样品如果A595nm 值太大,可以稀释后再测A595nm值,然后再计算。(五)注意事项: 1. 玻璃仪器要洗涤干净。2. 取量要准确。3. 玻璃仪器要干燥,避免温度变化。4. 对照:用被测物质以外的物质作空白对照。蛋白质含量测定实验难度系数 0共 0 人点评打分实验材料结晶牛血清清蛋白 g—球蛋白试剂(盒)Na2CO3酒石酸钾钠蒸馏水硫酸铜钨酸钠钼酸钠磷酸硫酸锂液体溴NaOH酚酞仪器耗材可见光分光光度计旋涡混合器秒表[url=http://www.biomart.cn/equipm
如果目前分离蛋白质组的最好技术是2-DE,那么随之而来的挑战是数百数千个蛋白如何被鉴定。在这里,我们不考虑传统的蛋白鉴定方法,如免疫印迹法、内肽的化学测序、已知或未知蛋白的comigration分析,或者在一个有机体中有意义的基因的过表达。并不是因为这些方法无效,而是因为它们通常耗时、耗力,不适合高流通量的筛选。目前,所选用的技术包括对于蛋白鉴定的图象分析、微量测序;进一步对肽片段进行鉴定的氨基酸组分分析和与质谱相关的技术。(1) 图象分析技术(Image analysis)。“满天星”式的2-DE图谱分析不能依靠本能的直觉,每一个图象上斑点的上调、下调及出现、消失,都可能在生理和病理状态下产生,必须依靠计算机为基础的数据处理,进行定量分析。在一系列高质量的2-DE凝胶产生(低背景染色,高度的重复性)的前提下,图象分析包括斑点检测、背景消减、斑点配比和数据库构建。首先,采集图象通常所用的系统是电荷耦合CCD(charge coupled device)照相机;激光密度仪(laser densitometers)和Phospho或Fluoro?imagers,对图象进行数字化。并成为以象素(pixels)为基础的空间和网格。其次,在图象灰度水平上过滤和变形,进行图象加工,以进行斑点检测。利用Laplacian,Gaussian,DOG(difference of Gaussians) opreator使有意义的区域与背景分离,精确限定斑点的强度、面积、周长和方向。图象分析检测的斑点须与肉眼观测的斑点一致。在这一原则下,多数系统以控制斑点的重心或最高峰来分析,边缘检测的软件可精确描述斑点外观,并进行边缘检测和邻近分析,以增加精确度。通过阈值分析、边缘检测、销蚀和扩大斑点检测的基本工具还可恢复共迁移的斑点边界。以PC机为基础的软件Phoretix-2D正挑战古老的Unix为基础的2-D分析软件包。第三,一旦2-DE图象上的斑点被检测,许多图象需要分析比较、增加、消减或均值化。由于在2-DE中出现100%的重复性是很困难的,由此凝胶间的蛋白质的配比对于图象分析系统是一个挑战。IPG技术的出现已使斑点配比变得容易。因此,较大程度的相似性可通过斑点配比向量算法在长度和平行度观测。用来配比的著名软件系统包括Quest,Lips,Hermes,Gemini等,计算机方法如相似性、聚类分析、等级分类和主要因素分析已被采用,而神经网络、子波变换和实用分析在未来可被采用。配比通常由一个人操作,其手工设定大约50个突出的斑点作为“路标”,进行交叉配比。之后,扩展至整个胶。例如:精确的PI和MW(分子量)的估计通过参考图上20个或更多的已知蛋白所组成的标准曲线来计算未知蛋白的PI和MW。在凝胶图象分析系统依据已知蛋白质的pI值产生PI网络,使得凝胶上其它蛋白的PI按此分配。所估计的精确度大大依赖于所建网格的结构及标本的类型。已知的未被修饰的大蛋白应该作为标志,变性的修饰的蛋白的PI估计约在±0.25个单位。同理,已知蛋白的理论分子量可以从数据库中计算,利用产生的表观分子量的网格来估计蛋白的分子量。未被修饰的小蛋白的错误率大约30%,而翻译后蛋白的出入更大。故需联合其他的技术完成鉴定?(2) 微量测序(microsequencing)。蛋白质的微量测序已成为蛋白质分析和鉴定的基石,可以提供足够的信息。尽管氨基酸组分分析和肽质指纹谱(PMF)可鉴定由2-DE分离的蛋白,但最普通的N-末端Edman降解仍然是进行鉴定的主要技术。目前已实现蛋白质微量测序的自动化。首先使经凝胶分离的蛋白质直接印迹在PVDF膜或玻璃纤维膜上,染色、切割,然后直接置于测序仪中,可用于subpicomole水平的蛋白质的鉴定。但有几点需注意:Edman降解很缓慢,序列以每40 min 1个氨基酸的速率产生;与质谱相比,Edman降解消耗大;试剂昂贵,每个氨基酸花费3~4$。这都说明泛化的Edman降解蛋白质不适合分析成百上千的蛋白质。然而,如果在一个凝胶上仅有几个有意义的蛋白质,或者如果其他技术无法测定而克隆其基因是必需的,则需要进行泛化的Edman降解测序。近来,应用自动化的Edman降解可产生短的N-末端序列标签,这是将质谱的序列标签概念用于Edman降解,业已成为一种强有力的蛋白质鉴定。当对Edman的硬件进行简单改进,以迅速产生N-末端序列标签达10~20个/d,序列检签将适于在较小的蛋白质组中进行鉴定.若联合其他的蛋白质属性,如氨基酸组分分析、肽质质量、表现蛋白质分子量、等电点,可以更加可信地鉴定蛋白质。选择BLAST程序,可与数据库相配比。目前,采用一种Tagldent的检索程序,还可以进行种间比较鉴定,又提高了其在蛋白质组研究中的作用。(3) 与质谱(mass spectrometry)相关的技术。质谱已成为连接蛋白质与基因的重要技术,开启了大规模自动化的蛋白质鉴定之门。用来分析蛋白质或多肽的质谱有两个主要的部分,1)样品入机的离子源,2)测量被介入离子的分子量的装置。首先是基质辅助激光解吸附电离飞行时间质谱(MALDI-TOF)为一脉冲式的离子化技术。它从固相标本中产生离子,并在飞行管中测其分子量。其次是电喷雾质谱(ESI-MS),是一连续离子化的方法,从液相中产生离子,联合四极质谱或在飞行时间检测器中测其分子量。近年来,质谱的装置和技术有了长足的进展。在MALDI-TOF中,最重要的进步是离子反射器(ion reflectron)和延迟提取(delayed ion extraction),可达相当精确的分子量。在ESI-MS中,纳米级电雾源(nano-electrospray source)的出现使得微升级的样品在30~40 min内分析成为可能。将反相液相色谱和串联质谱(tandem MS)联用,可在数十个picomole的水平检测;若利用毛细管色谱与串联质谱联用,则可在低picomole到高femtomole水平检测;当利用毛细管电泳与串联质谱连用时,可在小于femtomole的水平检测。甚至可在attomole水平进行。目前多为酶解、液相色谱分离、串联质谱及计算机算法的联合应用鉴定蛋白质。下面以肽质指纹术和肽片段的测序来说明怎样通过质谱来鉴定蛋白质。1)肽质指纹术(peptide mass fingerprint, PMF)是由Henzel等人于1993年提出。用酶(最常用的是胰酶)对由2-DE分离的蛋白在胶上或在膜上于精氨酸或赖氨酸的C-末端处进行断裂,断裂所产生的精确的分子量通过质谱来测量(MALDI-TOF-MS,或为ESI-MS),这一技术能够完成的肽质量可精确到0.1个分子量单位。所有的肽质量最后与数据库中理论肽质量相配比(理论肽是由实验所用的酶来“断裂”蛋白所产生的)。配比的结果是按照数据库中肽片段与未知蛋白共有的肽片段数目作一排行榜,“冠军”肽片段可能代表一个未知蛋白.若冠亚军之间的肽片段存在较大差异,且这个蛋白可与实验所示的肽片段覆盖良好,则说明正确鉴定的可能性较大。2)肽片段(peptide fragment)的部分测序。肽质指纹术对其自身而言,不能揭示所衍生的肽片段或蛋白质。为进一步鉴定蛋白质,出现了一系列的质谱方法用来描述肽片段。用酶或化学方法从N-或C-末端按顺序除去氨基酸,形成梯形肽片段(ladder peptide)。首先以一种可控制的化学模式从N-末端降解,可产生大小不同的一系列的梯形肽片段,所得一定数目的肽质量由MALDI-TOF-MS测量。另一种方法涉及羧基肽酶的应用,从C-末端除去不同数目的氨基酸形成肽片段。化学法和酶法可产生相对较长的序列,其分子量精确至以区别赖氨酸(128.09)和谷氨酰胺(128.06)。或者,在质谱仪内应用源后衰变(post-source decay, PSD)和碰撞诱导解离(collision-induced dissociation, CID),目的是产生包含有仅异于一个氨基酸残基质量的一系列肽峰的质谱。因此,允许推断肽片段序列。肽片段PSD的分析在MALDI反应器上能产生部分序列信息。首先进行肽质指纹鉴定。之后,一个有意义的肽片段在质谱仪被选作“母离子”,在飞行至离子反应器的过程中降解为“子离子”。在反应器中,用逐渐降低的电压可测量至检测器的不同大小的片段。但经常产生不完全的片段。现在用肽片段来测序的方法始于70年代末的CID,可以一个三联四极质谱ESI-MS或MALDI-TOF-MS联合碰撞器内来完成。在ESI-MS中,由电雾源产生的肽离子在质谱仪的第一个四极质谱中测量,有意义的肽片段被送至第二个四极质谱中,惰性气体轰击使其成为碎片,所得产物在第三个四极质谱中测量。与MALDI-PSD相比,CID稳定、强健、普遍,肽离子片段基本沿着酰胺键的主架被轰击产生梯形序列。连续的片段间差异决定此序列在那一点的氨基酸的质量。由此,序列可被推测。由CID图谱还可获得的几个序列的残基,叫做“肽序列标签”。这样,联合肽片段母离子的分子量和肽片段距N-、C?端的距离将足以鉴定一个蛋白质。(4) 氨基酸组分分析。1977年首次作为鉴定蛋白质的一种工具,是一种独特的“脚印”技术。利用蛋白质异质性的氨基酸组分特征,成为一种独立于序列的属性,不同于肽质量或序列标签。Latter首次表明氨基酸组分的数据能用于从2-DE凝胶上鉴定蛋白质。通过放射标记的氨基酸来测定蛋白质的组分,或者将蛋白质印迹到PVDF膜上,在155℃进行酸性水解1 h,通过这
蛋白质分子中,酪氨酸、苯丙氨酸和色氨酸残基的苯环含有共轭双键,使蛋白质具有吸收紫外光的性质。吸收高峰在280nm处,其吸光度(即光密度值)与蛋白质含量成正比。此外,蛋白质溶液在238nm的光吸收值与肽键含量成正比。利用一定波长下,蛋白质溶液的光吸收值与蛋白质浓度的正比关系,可以进行蛋白质含量的测定。紫外吸收法简便、灵敏、快速,不消耗样品,测定后仍能回收使用。低浓度的盐,例如生化制备中常用的(NH4)2SO4等和大多数缓冲液不干扰测定。特别适用于柱层析洗脱液的快速连续检测,因为此时只需测定蛋白质浓度的变化,而不需知道其绝对值。此法的特点是测定蛋白质含量的准确度较差,干扰物质多,在用标准曲线法测定蛋白质含量时,对那些与标准蛋白质中酪氨酸和色氨酸含量差异大的蛋白质,有一定的误差。故该法适于用测定与标准蛋白质氨基酸组成相似的蛋白质。若样品中含有嘌呤、嘧啶及核酸等吸收紫外光的物质,会出现较大的干扰。核酸的干扰可以通过查校正表,再进行计算的方法,加以适当的校正。但是因为不同的蛋白质和核酸的紫外吸收是不相同的,虽然经过校正,测定的结果还是存在一定的误差。此外,进行紫外吸收法测定时,由于蛋白质吸收高峰常因pH的改变而有变化,因此要注意溶液的pH值,测定样品时的pH要与测定标准曲线的pH相一致。1.280nm的光吸收法因蛋白质分子中的酪氨酸、苯丙氨酸和色氨酸在280nm处具有最大吸收,且各种蛋白质的这三种氨基酸的含量差别不大,因此测定蛋白质溶液在280nm处的吸光度值是最常用的紫外吸收法。测定时,将待测蛋白质溶液倒入石英比色皿中,用配制蛋白质溶液的溶剂(水或缓冲液)作空白对照,在紫外分光度计上直接读取280nm的吸光度值A280。蛋白质浓度可控制在0.1~1.0mg/ml左右。通常用1cm光径的标准石英比色皿,盛有浓度为1mg/ml的蛋白质溶液时,A280约为1.0左右。由此可立即计算出蛋白质的大致浓度。许多蛋白质在一定浓度和一定波长下的光吸收值(A1%1cm)有文献数据可查,根据此光吸收值可以较准确地计算蛋白质浓度。下式列出了蛋白质浓度与(A1%1cm)值(即蛋白质溶液浓度为1%,光径为1cm时的光吸收值)的关系。文献值A1%1cm,λ称为百分吸收系数或比吸收系数。蛋白质浓度= (A280´10 )/ A1%1cm,280nm (mg/ml)(Q 1%浓度»10mg/ml)
用半微量凯氏定氮测蛋白质时为什么用硼酸作为吸收液?
[font=宋体]蛋白质纯化系统是一种用于从混合物中纯化目标蛋白的设备和方法。它结合了多种技术和步骤,可以有效地分离和纯化蛋白质,提供高纯度和高活性的目标蛋白。蛋白质纯化系统是实现蛋白质纯化的关键装置,它结合了各种分离、富集和纯化方法,帮助科研工作者实现蛋白质的高纯度提取。[/font][font=宋体] [/font][font=宋体][b]蛋白质纯化系统的基本原理[/b][/font][font=宋体]蛋白质纯化系统主要依据蛋白质的特性利用不同的物理化学方法进行分离和纯化。下面将介绍几种常见的蛋白质纯化系统的基本原理。[/font][font=宋体] [/font][font=宋体][font=宋体]①[url=https://cn.sinobiological.com/resource/protein-review/protein-purification-by-ac][b]亲和层析[/b][/url][/font][/font][font=宋体]亲和层析是一种基于蛋白质的特异性与配体的亲和性相互作用来实现分离和纯化的方法。在亲和层析过程中,蛋白质溶液通过填充有配体的柱子,与配体结合形成复合物,而非特异性结合的其他组分被洗脱。最后,通过改变条件来破坏蛋白质与配体的结合,从而使得目标蛋白质得以纯化。[/font][font=宋体] [/font][font=宋体]②凝胶过滤层析[/font][font=宋体]凝胶过滤层析是一种基于蛋白质大小差异来进行分离的方法。在凝胶过滤层析中,待纯化的蛋白质溶液通过一系列的凝胶层析柱,大分子的蛋白质不能进入凝胶颗粒的内部,而小分子的蛋白质则可以进入凝胶颗粒内部。通过调整凝胶的孔径,可以实现对目标蛋白质的选择性分离和纯化。[/font][font=宋体] [/font][font=宋体][font=宋体]③[url=https://cn.sinobiological.com/resource/protein-review/protein-purification-by-iec][b]离子交换层析[/b][/url][/font][/font][font=宋体][font=宋体]离子交换层析是一种基于蛋白质与固定在柱子上的离子交换基的电荷相互作用来实现分离和纯化的方法。在离子交换层析中,蛋白质溶液通过带有离子交换基的柱子,与柱子上的离子交换基之间发生相互作用。通过改变溶液的离子浓度和[/font][font=Calibri]pH[/font][font=宋体]值,可以实现对蛋白质的选择性吸附和洗脱。[/font][/font][font=宋体] [/font][font=宋体]④逆流层析[/font][font=宋体]逆流层析是一种基于分子质量和电荷差异来实现蛋白质分离和纯化的方法。在逆流层析中,蛋白质溶液通过填充有逆流层析介质的柱子,溶液在反向流动的情况下通过层析柱。由于不同蛋白质之间的分子质量和电荷差异,它们在逆流层析介质中的移动速度不同,从而实现对蛋白质的分离和纯化。[/font][font=宋体] [/font][font=宋体][b]蛋白质纯化系统的应用[/b][/font][font=宋体]蛋白质纯化系统在生物医药领域有着广泛的应用,下面将介绍几个常见的应用场景。[/font][font=宋体] [/font][font=宋体]①药物研发[/font][font=宋体]蛋白质纯化系统在药物研发中起到了非常重要的作用。通过蛋白质纯化系统,科研人员可以从复杂的生物样品中高效纯化出目标蛋白质,为药物研发提供了可靠的原料和工具。蛋白质纯化系统不仅可以提高药物研发的效率,还可以确保药物的纯度和质量,从而提高药物的疗效和安全性。[/font][font=宋体] [/font][font=宋体]②生物学研究[/font][font=宋体]在生物学研究中,蛋白质纯化系统被广泛应用于蛋白质相互作用研究、蛋白质结构解析和功能分析等方面。通过蛋白质纯化系统,科研人员可以从不同的细胞和组织中提取目标蛋白质,进一步研究它们之间的相互关系和作用机制。蛋白质纯化系统还可以用于蛋白质结构解析,帮助科学家揭示蛋白质的三维结构以及其功能。[/font][font=宋体] [/font][font=宋体]③临床诊断[/font][font=宋体]蛋白质纯化系统在临床诊断中也起到了重要的作用。通过蛋白质纯化系统,医生可以从患者的生物样本中纯化出特定的蛋白质标志物,用于疾病早期诊断、病情监测和治疗评估等方面。蛋白质纯化系统在临床诊断中的应用可以帮助医生及早发现疾病,提高诊断的准确性和效率。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体]蛋白质纯化系统是实现蛋白质纯化的重要装置,它结合了多种分离、富集和纯化方法,帮助科研人员高效地提取目标蛋白质。蛋白质纯化系统的应用广泛,不仅在药物研发、生物学研究和临床诊断等领域发挥重要作用,还为科学家揭开蛋白质的结构和功能提供了有力的支持。通过不断的技术创新和优化,蛋白质纯化系统将更好地满足科研和临床的需求,推动生物医药领域的发展。[/font][font=Calibri] [/font]
介绍了不同几种来源蛋白质的提取方法以及在提取过程中的注意事项.对做蛋白研究的很有用..1.植物组织蛋白质提取方法2.植物组织蛋白质提取方法 3.组织:肠黏膜 4.lysis solution5.植物材料:水稻苗,叶鞘,根6.蛋白质样品制备7.植物根中蛋白质的抽取8.SDS extraction followed by acetone precipitation9.材料:细菌蛋白10.线粒体蛋白的提取 [img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=120198]蛋白质提取[/url]
大家有点相关常识就知道凯氏氮的缺点,不法商人也就凭这个缺点钻了空子,以至于到今天这个地步。以前是往牛奶里面加尿,发觉味道不行了又想出这个三聚氰胺。其实其他蛋白质检测方法准确灵敏简单快捷的非常多,我就想不通为什么过时的东西还在用。N年前我做毕业论文的时候也牵涉到蛋白质检测,那时用的是考马斯亮蓝G-250(Coomassie brilliant blue G-250)法。很简单很迅速啊。资料:考马斯亮蓝G-250测定蛋白质含量属于染料结合法的一种。考马斯亮蓝G-250在游离状态下呈红色,最大光吸收在488nm;当它与蛋白质结合后变为青色,蛋白质-色素结合物在595nm波长下有最大光吸收。其光吸收值与蛋白质含量成正比,因此可用于蛋白质的定量测定。蛋白质与考马斯亮蓝G-250结合在2min左右的时间内达到平衡,完成反应十分迅速;其结合物在室温下1h内保持稳定。该法是1976年Bradford建立,试剂配制简单,操作简便快捷,反应非常灵敏,灵敏度比Lowry法还高4倍,可测定微克级蛋白质含量,测定蛋白质浓度范围为0~1 000μg/mL,是一种常用的微量蛋白质快速测定方法。
蛋白质组学研究--生物质谱技术 对分离的蛋白质进行鉴定是蛋白质组研究的重要内容,蛋白质微量测序、氨基酸组成分析等传统的蛋白质鉴定技术不能满足高通量和高效率的要求,生物质谱技术是蛋白质组学的另一支撑技术。 生物质谱技术在离子化方法上主要有两种软电离技术,即基质辅助激光解吸电离(matrix—assisted laser desorption/ionization,MALDl)和电喷雾电离(electrospray ionization,ESl)。MALDI是在激光脉冲的激发下,使样品从基质晶体中挥发并离子化。ESI使分析物从溶液相中电离,适合与液相分离手段(如液相色谱和毛细管电泳)联用。MALDI适于分析简单的肽混合物,而液相色谱与ESI—MS的联用(LC—MS)适合复杂样品的分析。 软电离技术的出现拓展了质谱的应用空间,而质量分析器的改善也推动了质谱仪技术的发展。生物质谱的质量分析器主要有4种:离子阱(iontrap,IT)、飞行时间(TOF)、四极杆(quadrupole)和傅立叶变换离子回旋共振(Fourier transform ion cyclotron resonance,FTICR)。它们的结构和性能各不相同,每一种都有自己的长处与不足。它们可以单独使用,也可以互相组合形成功能更强大的仪器。 离子阱质谱灵敏度较高,性能稳定,具备多级质谱能力,因此被广泛应用于蛋白质组学研究,不足之处是质量精度较低。与离子阱相似,傅立叶变换离子回旋共振(FTICR)质谱也是一种可以“捕获”离子的仪器,但是其腔体内部为高真空和高磁场环境,具有高灵敏度、宽动态范围、高分辨率和质量精度(质量准确度可很容易地小于1mg/L),这使得它可以在一次分析中对数百个完整蛋白质分子进行质量测定和定量。FTICR—MS的一个重要功能是多元串级质谱,与通常的只能选一个母离子的串级质谱方式不同,FTICR—MS可以同时选择几个母离子进行解离,这无疑可以大大增加蛋白质鉴定工作的通量。但是它的缺点也很明显,操作复杂、肽段断裂效率低、价格昂贵等,这些缺点限制了它在蛋白质组学中的广泛应用。MALDI通常与TOF质量分析器联用分析肽段的精确质量,而ESI常与离子阱或三级四极杆质谱联用,通过碰撞诱导解离(collision—induceddissociation,CID)获取肽段的碎片信息。 1. MALDI—TOF—MS (1)MALDI—TOF—MS的技术特点:①具有分离、鉴定双重功能,可用于混合物的分析;②测量范围宽,相对分子质量可达300 000;③精度高,蛋白质相对分子质量测定精度可达0.01%;④灵敏度高,所需样品量少,可达fmol级;⑤分析时间短,5~10rain可完成一次分析;⑥样品制备简便,操作易自动化;⑦对样品要求低,能忍耐较高浓度的盐、缓冲剂和非挥发性杂质,所以特别适合于鉴定二维凝胶电泳分离的蛋白质。 (2)MALDI—TOF—MS的技术改进:近年来MALDI—TOF—MS又有许多新的技术改进,以提高其检测灵敏性和准确度,增强其蛋白质鉴定的功能。如将MALDI离子源与四极杆—飞行时间—串联质谱对接,实现了同一样品在同一质谱仪上的肽指纹图谱与肽序列标签分析同时进行,提高于蛋白质鉴定的速度和准确性。还有MALDI—TOF—TOF—MS等。但这些技术共同的缺点是仪器非常昂贵。 (3)MALDI—TOF—MS的发展方向:①寻求新的基质(如混合基质、室温离子化液体等)和新的制样方法(如超微量进样,n1级);②将新技术应用在分析中(如酶切技术、毫微升溶剂提取技术等);③对质谱仪进行改进或与其他分析仪器联用,如MALDI与傅立叶转换离子回旋共振质谱(MALDI—FTMS)联用能得到更多的蛋白结构信息;④小型化、智能化、简易化及自动化已成为趋势。 2.ESI (1)ESI的优势:①检测范围宽,生物大分子经电喷雾后质荷比大大下降,因而可测相对分子质量高达十几万甚至更高的生物样品;②分辨率和灵敏度高,可达10-15—10-12mol;③不需要特定基质,避免子基质峰的干扰;④适用于结构分析,可分析生物大分子的构象及非共价相互作用,与串联质谱结合可分析蛋白质、多肽的一级结构和共价修饰位点等;⑤自动化程度高,可与液相色谱、毛细管电泳等高效分离手段在线联用;⑥MALDI是脉冲式离子化技术,而ESI是连续离子化技术,检测所需时间更短;⑦ESI常和四极杆质谱联用,仪器价格相对便宜。 (2)ESI的局限性:①对样品中的盐类耐受性差;②对混合物图谱的解析较复杂;③受溶剂的影响和限制很大。目前ESI主要用于亲水生物大分子的分析,较少用于疏水生物样品的分析。总体来说,MALDI和ESI各有长处,有各自的适用范围,是两种互补的技术。 (3)ESI的技术发展:近年来,ESI也有许多新的技术发展。液相色谱与电喷雾质谱连用(LC—ESI—
招聘启事请见:http://www.ncpss.org/jobDetail.action?lang=cn&id=88。如有意应聘,简历请发至hr.ncpss@sibcb.ac.cn;hr@sibcb-ncpss.org。附:我单位薪资福利介绍: 我单位是上海生命科学研究院下属的事业单位,所录用员工享受事业单位有竞争力的薪酬及福利,具有事业单位编制,每月为员工缴纳五险一金、职业年金,提供交通补贴、工作餐补贴、高温补贴、取暖补贴、年终绩效奖金,享受免费班车、定期体检、职工带薪年休假、节日福利、生日慰问等福利,且有机会享受高额的住房补贴。我单位简介: 蛋白质科学研究上海设施 ——生命科学领域国之利器 蛋白质是由基因编码、多种氨基酸聚合而成的生物大分子,是所有生命形式与生命活动的主要物质基础和功能执行者。蛋白质研究的突破将促进揭示生命现象的本质;从根本上阐明人类重大疾病的机理,为临床诊治提供新的方法和途径;推动医药、生物能源、生物材料等新型生物技术产业的发展。为此,我国“中长期科技发展战略规划”将蛋白质研究列为基础研究四大科学研究计划之一,并将建设蛋白质科学研究设施纳入国家重大科技基础设施计划。蛋白质科学研究上海设施围绕蛋白质科学研究的前沿领域和我国生物医药、现代农业等产业发展需求,建设高通量、高精度、规模化的蛋白质制取与纯化、结构分析、功能研究等大型装置,实现技术与设备的集成化、通量化和信息化,成为我国蛋白质科学研究和技术创新基地,形成具有国际一流水平和综合示范作用的蛋白质科学研究支撑体系,全面提升我国蛋白质科学研究能力。 “上海设施”于 2008年11月14日批复立项,2010年12月26日正式开工,2014年3月建成。 上海设施总投资7.56亿元,主体位于上海市张江高科技园区,总建筑面积3.3万平方米。在建设过程中,上海设施通过关键技术自主创新、设备自主研制、系统优化等多种综合举措,集成了具有不同空间和时间分辨率的仪器和设备,形成了蛋白质研究的先进技术体系。 上海设施拥有用于蛋白质结构研究的9大技术系统,包括规模化蛋白质制备系统、蛋白质晶体结构分析系统、蛋白质核磁共振分析系统、集成化电镜分析系统、蛋白质动态分析系统、质谱分析系统、复合激光显微镜系统、分子影像系统和数据库与计算分析系统。上海设施自主研发了多项国内首创、国际一流的蛋白质研究技术和方法,在分析精度、检测极限和处理通量上均取得了突破。 如:规模化蛋白质制备系统实现了蛋白质制备全流程的高度集成和流水线作业,在样品处理通量上超过半自动化和传统的人工系统10-100倍,居于国际领先水平;依托 “上海光源”建设蛋白质结构分析的“五线六站”,在国内首次研制成功双插入件光束线,建成了国内首条同步辐射三代光源生物小角线站和红外线站;各光束线站的技术指标与总体性能均达到了国际同类线站的先进水平。上海设施是继上海光源后第二个落户浦东张江的国家重大科技基础设施。 上海设施2014年5月投入试运行,各系统总计运行近四万小时。已有40多家国内外单位成为设施用户,用户地域涵盖全国主要城市,包括北京、上海、杭州、广州等,执行课题210个,为包括战略性先导科技专项(B类)在内的一大批国家重大科技任务提供了重要支撑服务,用户和依托单位科研人员利用设施取得了一系列重要成果,多项研究成果发表在Nature、Cancer Cell、PNAS等高水平国际学术刊物上。 上海设施是当今全球生命科学领域首个综合性的大科学装置,集先进科学装置和大型设备之大成,是探索生命奥秘的国之利器。上海设施已成为“中科院上海大科学中心”的重要组成部分,致力于建成高效率开放共享、高水平国际合作、高质量创新服务的大科学研究中心,为中科院研究所分类改革起到了示范引领作用。上海设施的建成引起了国内外同行的高度关注;为上海率先建成世界级蛋白质科学中心奠定了良好的基础。 未来,“上海设施”将围绕蛋白质科学研究的前沿领域和国家人口健康与现代农业的战略需求,打造开放、协作、创新的国际一流蛋白质科学研究平台,充分发挥大科学装置的优势,助力国内生物医药产业, 为实现上海创新驱动发展战略并带动长三角地区经济发展、建设全球有影响力的科创中心提供强有力的科技支撑。
再传些上来[em09510][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=183555]蛋白质.doc[/url]方法3这个方法(通常称为布拉德福德法)是基于当蛋白质与酸性蓝90燃料结合时在波长470nm-595nm之间有一个吸收峰。酸性蓝90燃料很容易与蛋白质中的精氨酸和赖氨酸的残基结合导致对于不同蛋白质试验具有特异的反应。因此作为参考物的蛋白质必须测定的蛋白质相同。有相对较少的干扰物,但是最好避免试验样品中的洗涤剂和两性电解质。强碱性样品可能会干扰酸性试剂。使用标准蒸馏水来配置此方法中用到的缓冲液和试剂。试验溶液.将待测蛋白质的参考物质溶解在描述的缓冲溶液中配制成浓度在标准曲线范围内的溶液。参考溶液.用描述的缓冲溶液溶解待测蛋白质的参考物质。用相同的缓冲溶液来稀释这个蛋白质溶液制的不少于5个参考溶液,溶液的蛋白质浓度在一个合适的范围内均匀分布在0.1mg/ml和1mg/ml之间。空白.用使用的缓冲溶液来制备测试溶液和参考溶液。酸性蓝90试剂.溶解0.10g酸性蓝90标准试剂在50ml标准酒精溶液中。加入100ml磷酸标准溶液,用标准蒸馏水稀释至1000ml,混匀。过滤此溶液,室温条件下储存在棕色瓶中。储存期间,燃料发生缓慢的沉淀。使用前过滤试剂。步骤.每个测试溶液和空白的参比溶液取0.100ml,加5ml酸性蓝90试剂。倒转混匀。防止发泡,发泡会导致重复性较差。测定标准溶液和待测溶液595nm处的吸光度(2.5.25),把空白作为补偿液体。不要使用石英(二氧化硅)分光光度计比色皿,因为石英会和这些染料结合。计算.吸光度与蛋白质浓度的关系是非线性的;然而,假如,制备标准曲线的浓度范围足够小,后者将接近线性。以标准溶液的吸光度对蛋白质的浓度作图,再线性回归得到标准曲线。从标准曲线和待测溶液的吸光度来计算得到待测溶液的蛋白质浓度。方法4这个方法(通常被称为喹啉酸法或者BCA法)这个基于蛋白质与铜离子反应生成亚铜离子。喹啉酸试剂用于检测亚铜离子。很少物质会干扰这个反应。当存在干扰物质的影响时可以通过稀释来最小化干扰,但必须使得待测的蛋白质的浓度足够精确测量。或者,在方法2中给出的蛋白质凝结的的程序可能被用于去除干扰物质。因为不同的蛋白质种类可能给出不同的颜色反应强度,参考蛋白质和待测蛋白质必须相同。使用蒸馏水R来制备此法中用到的所有缓冲溶液和试剂。测试溶液.用描述的缓冲溶液溶解适宜数量的待测物质制得浓度在参考溶液浓度范围内的溶液。参考溶液.用描述的缓冲溶液溶解蛋白质的参考物质。用同一缓冲稀释部分该溶液制得不少于5个参考溶液,制的的溶液蛋白质浓度均匀分布在10μg/ml-1200μg/ml之间的合适的范围内。空白.使用缓冲溶液来制备测试溶液和参比溶液。BCA试剂.溶解10g的二钠试剂R,20g碳酸钠一水合物R,1.6g酒石酸钠R,4g氢氧化钠R,和9.5g碳酸氢钠R在蒸馏水(R)中。如果有必要,用氢氧化钠溶液R或者碳酸氢钠溶液R调节pH至11.25,用蒸馏水R稀释至1000ml,混匀。步骤.分别将0.1ml的参比溶液,待测溶液,和空白溶液与铜-BCA试剂混合。在37℃条件下反应30min,注意时间,允许混合物冷却至室温。在反应中点60min内,562nm处用石英比色杯测定参考物质和待测物质的吸光度(2.2.25),用空白溶液作为补偿溶液。待溶液冷却至室温后,颜色强度逐渐加深。计算.吸光度对蛋白质的浓度的关系不是线性的。然而,假如,制备标准曲线的浓度范围足够小,后者将接近线性。以参比溶液的吸光度对蛋白质的浓度作图,再线性回归得到标准曲线。从标准曲线和待测溶液的吸光度来计算得到待测溶液的蛋白质浓度。方法5这个方法(通过常称为缩二脲法)基于铜离子与蛋白质在碱性溶液中的反应而引起的545nm处的吸光度的变化。这个试验在IgG与白蛋白之间差异不大。氢氧化钠和缩二脲试剂的加入作为一个联合试剂,在氢氧化钠加入后不充分的混合,或者在氢氧化钠溶液的加入和缩二脲试剂的加入之间额外的时间将会使得IgG样品比白蛋白样品较高的反应。三氯酸原理用于减小干扰物质,也可以用于测定待测溶液中蛋白质的含量,在浓度小于500μg/ml的情况下。使用蒸馏水R来制备所有此试验中用到的缓冲溶液和试剂。待测溶液.用9g/l的氯化钠溶液R溶解适宜数量的待测物质制的浓度在参比溶液浓度范围内的溶液。参比溶液. 用9g/l的氯化钠溶液R溶解待测蛋白质的参比物质。用9g/l的氯化钠溶液R稀释部分此溶液制的不少于3个参比溶液,这一列溶液的蛋白质浓度均匀分布在0.5mg/ml-10mg/ml之间的适宜范围内。空白.使用9g/l的氯化钠溶液R。缩二脲试剂.用10ml的蒸馏水溶解3.46g的硫酸铜,冷却(溶液A)。用80ml的热蒸馏水溶解34.6g的柠檬酸钠R20.0g的无水碳酸钠R。冷却(溶液B)。混合溶液A和溶液B,用蒸馏水R稀释至200ml假如试剂发生浑浊或者包含任何沉淀,不要使用此试剂。步骤.在一个待测溶液中加入等体积的60g/l的氢氧化钠R,混合。立刻加入相当于0.4倍体积待测溶液的缩二脲试剂,迅速混匀。在15℃-25℃的条件下放置不少于15min。90min内加入缩二脲试剂,在最大吸收波长545nm处测定参比溶液和待测溶液的吸光度(2.2.25),用空白溶液作为补偿液体。在蛋白质浓度计算中,任何产生混浊或者沉淀的溶液都是不被接受的。计算.吸光度对蛋白质浓度的关系接近线性在参比溶液指定的蛋白质浓度范围内。以参比溶液的吸光度对蛋白质浓度作图,利用线性回归做标准曲线。计算标准曲线的相关系数,一个好的系统产生的标准曲线的相关系数不少于0.99.从标准曲线和待测溶液的吸光度来测定待测溶液中的蛋白质浓度。干扰物质.为了家少干扰物质的影响,蛋白质可以按以下步骤进行沉淀:加入0.1倍体积的500g/l三氯酸溶液R到1倍体积待测样品溶液中,取走上清液,用较小体积的0.5M的氢氧化钠溶解沉淀。用制得的溶液来制备待测溶液。方法6荧光法是基于o-邻苯二醛对蛋白质的化学衍生反应。它与蛋白质的伯胺基发生反应(N-末端氨基酸和θ-氨基的赖氨酸残基)此法的灵敏度可以通过在加o-邻苯二醛之前按水解蛋白质来增加。水解可以使组成氨基酸的α-氨基可以和邻苯二醛试剂反应。此法需要非常少量的蛋白质。伯胺,例如三(羟甲基)氨基甲烷和氨基酸缓冲溶液,与邻苯二醛反应的必须避免或者替换。高浓度的氨水与邻苯二醛反应。氨与邻苯二醛反应产生的荧光不稳定。自动化程序的使用来标准化这个程序可以增加测试的准确性和精密度。待测溶液.用9g/l氯化钠溶液R溶解适宜数量待测物质制的浓度在参比溶液浓度范围内的溶液。在加邻苯二醛试剂之前调节8-10.5。参比溶液.溶解蛋白质的参比溶液杂9g/l的氯化钠溶液R中。用9g/l氯化钠溶液R稀释部分此溶液制的不少于5个参比溶液,参比溶液蛋白质浓度均匀分布在10μg/ml和200μg/ml之间的适宜范围内。在加邻苯二醛试剂之前调节8-10.5。空白溶液. 用9g/l氯化钠溶液R。硼酸盐缓冲液.用蒸馏水R溶解61.83g的硼酸R,用氢氧化钾R调节pH10.4,用蒸馏水稀释至1000ml,混匀。邻苯二醛储备溶液.用1.5ml的甲醇溶解1.20g的邻苯二醛试剂R,加入100ml的硼酸缓冲溶液,混匀。加0.6ml300g/l 十二烷基醚聚乙二醇23溶液R,混匀。室温下储存,3星期内使用。邻苯二醛试剂.在5ml的邻苯二醛储存溶液中加入15μl的2-巯基乙醇R。至少在使用前30min内植被。24h内使用。步骤.将0.1ml的邻苯二醛试剂与10μl待测溶液和每个参比溶液混合,室温摁下放置15min。加入0.5M的氢氧化钠3ml混匀。在激发波长340nm和发射波长440和455nm处测得参比溶液和待测溶液的荧光强度(2.2.21)。因为照射荧光强度降低,对一个给定的样品的荧光强度只测定一次。计算.荧光强度与蛋白质浓度的关系是线性的。用参比溶液的荧光强度对蛋白质浓度作图,线性回归得到标准曲线,根据待测溶液的荧光强度得到待测溶液的浓度。
各位老大,BUCHI的中压制备系统可以用来纯化蛋白质吗?另外最小的BUCHI的层析柱是什么型号的,能不能买到?还有G25的填料,谢谢卖设备的人跳槽了,结果现在都推另外一家公司的,说这个设备不能用。也搞不清楚!谢谢大家!
国家蛋白质科学研究上海设施是国家重大科技基础设施,是国家级蛋白质科学研究平台;在设施建设基础上,依托中国科学院上海生命科学研究院,委托生物化学与细胞生物学研究所(简称SIBCB)负责筹建成立并管理国家蛋白质科学中心•上海(筹), 负责设施的运行管理。中心位于浦东新区张江高科技园区中区西部(上海市浦东新区海科路333号),临近上海科技大学、中国科学院药物研究所、上海高等研究院等科研机构。中心定位于:支撑国家蛋白质上海设施建设的建设,衔接该设施的运行;聚集培养生命科学与生物技术特别是蛋白质研究的人才,提升国家蛋白质研究能力;进而促进我国蛋白质基础研究的飞跃发展。中心将立足于国家生命科学与生物技术及相关研究领域雄厚的研究基础 和创新实力,成为兼具蛋白质科学研究、技术及成果的转化、集成和应用平台的国家级的重要科学研究单元。国家蛋白质科学中心•上海(筹)现因工作需要,公开招聘生物大分子晶体学线站运行管理员、冷冻电镜系统管理员、自动化控制工程师、软件工程师、流式细胞分选技术员等岗位。一、岗位详情:岗位一: 生物大分子晶体学线站工作人员 4名。(一) 岗位职责:参与蛋白质科学研究中心•上海(筹)在上海同步辐射光源参与生物大分子晶体学线站的运行、维护和管理工作,参与线站的用户服务和技术支持工作;参与5线6站相关的科学研究工作。(二) 任职条件:1、物理、光学、光学工程、结构生物学等专业背景,硕士或以上学历。2、具备基本的生物大分子晶体结构衍射数据收集和数据处理的基本知识;有同步辐射光源生物大分子晶体学线站衍射数据收集经验,束线设计和建造经验者,以及同步辐射线站其他相关工作经验者优先。3、具有良好的人际关系和团队协作精神,工作努力,作风踏实,责任心强。4、身体健康,能长期稳定工作。岗位二:自动化控制系统工程师 1名(一) 岗位职责:参与国家蛋白质科学中心(上海)(筹)在上海同步辐射光源5线6站的建设、运行和管理,充分理解同步辐射光束线站的工作内容和线站用户的实际需求,完成线站自动化控制程序的设计、开发和维护。(二) 任职条件:1、本科以上学历,有 Unix/Linux 平台下的工作经验,熟悉Unix/Linux 工作环境,习惯于在 Unix/Linux 平台下工作。有大量的源代码的阅读经验。2、有丰富的 C/C++ 开发经验.熟悉 Socket 编程和多线程编程。3、良好的英文表达能力。能独立完成项目调研,设计和开发工作。4、有以下背景或经验者优先考虑:有大型系统开发经验者和硬件开发经验者;有软件界面开发经验者;有网络程序开发经验者;熟悉 Tcl/Tk 语言者;有 Unix/Linux 系统管理经验者。5、具有良好的人际关系和团队协作精神,工作努力,作风踏实,责任心强。6、身体健康,能长期稳定工作。二、薪酬福利:我单位将为入职员工提供有竞争力的福利待遇,包括但不限于: 事业单位编制(原则上本科学历及以上) 应届毕业生上海户籍(需符合打分政策) 有竞争力的薪酬 年终奖金 五险一金、职业年金 带薪年休假 节日慰问,工会福利 免费接送班车 员工健身房、休闲设施 三、招聘方式及程序: 1、应聘材料:(1)《应聘人员登记表》(见附件);(2)应聘函,包括对应聘岗位的理解、认识及工作设想等;(3)个人简历(包括联系电话、电子邮箱);(4)有关材料:身份证复印件、学历及学位证书复印件、相关资格证书复印件、获奖证书复印件等;(5)其他应聘者认为重要的书面材料。 2、资格审查对应聘者进行资格审查,通过初审者,将另行通知面试时间和地点。 3、请将上述材料的电子版或扫描件发至hr.ncpss@sibcb.ac.cn(请在应聘材料和邮件主题栏注明应聘岗位、姓名、来源院校,按如下格式:“院校—学院/专业—姓名—应聘岗位”),本岗位招满前有效。 4、谢绝来电来访,应聘材料恕不退还,招聘单位将予以保密。有关我单位更多信息,请浏览http://www.ncpss.org5、上述岗位按照公开报名、资格审查、面试、决定聘任的程序和方法进行。附:我单位简介:蛋白质科学研究上海设施 ——生命科学领域国之利器蛋白质是由基因编码、多种氨基酸聚合而成的生物大分子,是所有生命形式与生命活动的主要物质基础和功能执行者。蛋白质研究的突破将促进揭示生命现象的本质;从根本上阐明人类重大疾病的机理,为临床诊治提供新的方法和途径;推动医药、生物能源、生物材料等新型生物技术产业的发展。为此,我国“中长期科技发展战略规划”将蛋白质研究列为基础研究四大科学研究计划之一,并将建设蛋白质科学研究设施纳入国家重大科技基础设施计划。蛋白质科学研究上海设施围绕蛋白质科学研究的前沿领域和我国生物医药、现代农业等产业发展需求,建设高通量、高精度、规模化的蛋白质制取与纯化、结构分析、功能研究等大型装置,实现技术与设备的集成化、通量化和信息化,成为我国蛋白质科学研究和技术创新基地,形成具有国际一流水平和综合示范作用的蛋白质科学研究支撑体系,全面提升我国蛋白质科学研究能力。“上海设施”于 2008年11月14日批复立项,2010年12月26日正式开工,2014年3月建成。上海设施总投资7.56亿元,主体位于上海市张江高科技园区,总建筑面积3.3万平方米。在建设过程中,上海设施通过关键技术自主创新、设备自主研制、系统优化等多种综合举措,集成了具有不同空间和时间分辨率的仪器和设备,形成了蛋白质研究的先进技术体系。上海设施拥有用于蛋白质结构研究的9大技术系统,包括规模化蛋白质制备系统、蛋白质晶体结构分析系统、蛋白质核磁共振分析系统、集成化电镜分析系统、蛋白质动态分析系统、质谱分析系统、复合激光显微镜系统、分子影像系统和数据库与计算分析系统。上海设施自主研发了多项国内首创、国际一流的蛋白质研究技术和方法,在分析精度、检测极限和处理通量上均取得了突破。如:规模化蛋白质制备系统实现了蛋白质制备全流程的高度集成和流水线作业,在样品处理通量上超过半自动化和传统的人工系统10-100倍,居于国际领先水平;依托 “上海光源”建设蛋白质结构分析的“五线六站”,在国内首次研制成功双插入件光束线,建成了国内首条同步辐射三代光源生物小角线站和红外线站;各光束线站的技术指标与总体性能均达到了国际同类线站的先进水平。上海设施是继上海光源后第二个落户浦东张江的国家重大科技基础设施。上海设施2014年5月投入试运行,各系统总计运行近四万小时。已有40多家国内外单位成为设施用户,用户地域涵盖全国主要城市,包括北京、上海、杭州、广州等,执行课题210个,为包括战略性先导科技专项(B类)在内的一大批国家重大科技任务提供了重要支撑服务,用户和依托单位科研人员利用设施取得了一系列重要成果,多项研究成果发表在Nature、Cancer Cell、PNAS等高水平国际学术刊物上。上海设施是当今全球生命科学领域首个综合性的大科学装置,集先进科学装置和大型设备之大成,是探索生命奥秘的国之利器。上海设施已成为“中科院上海大科学中心”的重要组成部分,致力于建成高效率开放共享、高水平国际合作、高质量创新服务的大科学研究中心,为中科院研究所分类改革起到了示范引领作用。上海设施的建成引起了国内外同行的高度关注;为上海率先建成世界级蛋白质科学中心奠定了良好的基础。未来,“上海设施”将围绕蛋白质科学研究的前沿领域和国家人口健康与现代农业的战略需求,打造开放、协作、创新的国际一流蛋白质科学研究平台,充分发挥大科学装置的优势,助力国内生物医药产业, 为实现上海创新驱动发展战略并带动长三角地区经济发展、建设全球有影响力的科创中心提供强有力的科技支撑。 更多信息请关注我单位网址:www.sibcb-ncpss.org。[/colo
[size=4]蛋白质含量测定的方法[/size][color=#DC143C]一、微量凯氏(Kjeldahl)定氮法[/color] 含氮有机物与浓硫酸共热,即分解产生氨(消化),氨又与硫酸作用,变成硫酸铵。经强碱碱化使之分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度可计算得样品之氮含量。若以甘氨酸为例,其反应式如下: H2NCH2COOH+ 3H2SO4 2CO2 + 3SO2 +4H2O +NH3 (1) 2NH3 + H2SO4 (NH4)2SO4 (2) (NH4)2SO4 + 2NaOH 2H2O +Na2SO4 + 2NH3 (3) 为了加速消化,可以加入CuSO4作催化剂,K2SO4以提高溶液的沸点。收集氨可用硼酸溶液,滴定则用强酸。 计算所得结果为样品总氮量,如欲求得样品中蛋白含量,应将总氮量减去非蛋白氮即得。如欲进一步求得样品中蛋白质的含量,即用样品中蛋白氮乘以6.25即得。[color=#DC143C][size=4]论文:14楼 杜马斯燃烧法与凯氏法测定饲料含氮量的比较研究15楼 用凯氏法和杜马斯法测定植物样品中的全氮16楼 乳及乳制品中蛋白质测定应注意的事项探讨17楼 杜马斯燃烧定氮法在农产品品质检测中的应用18楼 凯氏定氮法测定牛奶中蛋白质的不确定度分析19楼 消化时间对总氮测定结果的影响20楼 奶粉中蛋白质样品消化方法的改进21楼 凯氏定氮法测定食品中蛋白质的不确定度分析22楼 催化剂与浓硫酸组成比例对凯氏定氮消化时间的影响23楼 饲料酵母蛋白含量测定结果的分析24楼 微波消解—凯氏定氮法测定食品中蛋白质的方法研究25楼 Loery法和Bradford法测定玻璃酸钠中蛋白质含量的比较26楼 应用 Primacs SN总氮 蛋白质分析仪测定食品中的蛋白质[/size][/color]