[font=&][size=16px][color=#333333]点击链接查看更多:[url]https://www.woyaoce.cn/service/info-39505.html[/url]服务背景[/color][/size][/font][font=&][color=#333333][/color][/font][size=29px][color=#353535][/color][/size]透皮试验属于化妆品、药物安全风险评估中暴露评估的重要项目,根据毒代动力学的相关解释:在研究具有一定毒性剂量下的原料和/或风险物质在动物体内的吸收、分布、代谢、排泄过程和特点过程中,需要我们了解其在动物体内的分布及其靶器官情况,进而探讨其毒性的发生和发展的规律。原料和/或风险物质经过皮肤吸收后,其代谢转化可能会对其潜在毒性、体内分布和排泄造成重要影响。因此,在特定情况下,需要实施体内或体外生物转化研究,以证明或排除某些不良反应。[color=#222222]如果你是化妆品或药品研发企业,在产品备案或注册过程中,毒理学相关试验是必须提交的资料之一。但是哪些产品应该做透皮吸收试验?如何做?依据标准有哪些?相信都是很多企业疑惑的地方。透皮吸收试验有两大类一类是体外试验,一类体内试验,在官方资料不完善的情况下,如何选择官方认可的透皮吸收试验就成为企业急需了解的问题。[/color][color=#353535] [/color][font=&][size=16px][color=#333333]检测内容[/color][/size][/font][font=&][color=#333333][/color][/font][table][tr][td]服务产品[/td][td]乳膏、人工膜、乳液、药膏、贴膏、药品(甲硝唑)、凝胶、防晒霜、风湿贴、止痛贴、胰岛素[/td][td] [/td][td] [/td][td] [/td][/tr][tr][td]试验种类[/td][td=4,1]皮肤头皮吸收试验,体外透皮吸收试验,药物释放头皮吸收试验,乳膏透皮吸收试验,化妆品头皮吸收试验,水杨酸头皮吸收试验等。[/td][/tr][tr][td]试验项目[/td][td=4,1]动物实验,实验代做,方法学验证,上门实验,现场实验等[/td][/tr][tr][td=1,5]试验方法[/td][td=1,2] [/td][td=1,2] [/td][td] [/td][td] [/td][/tr][tr][td]动态扩散池法[/td][td]动态扩散池法主要是扩散介质的不断更换,可以更能模拟真实的生理条件。常用的离体皮肤有人体皮肤、动物皮肤、重组皮肤模型。目前来讲,体外扩散池法以其诸多优点仍是目前最常用的获得化妆品功效成分经皮释放曲线,及其在不同皮肤结构中分布情况的检测方法[/td][/tr][tr][td=1,3]体内试验方法[/td][td]胶带剥离技术(Tape Stripping,TS)[/td][td=2,1]胶带剥离技术(Tape Stripping,TS)主要将化学物质在皮肤的特定区域暴露一定时间后,用胶带粘贴获取角质层(SC),再用适当的分析技术确定胶带中特定物质的含量。优点是可以同时研究同一个志愿者的多个取样点,是一种用于测定人体化学物质在体透皮吸收非常有价值的工具。缺点是TS技术不适用于测定挥发性和快速穿透性的化学物质,且容易受到胶带粘贴性能、粘贴时施加的压力、溶解受试物的介质等方面的影响,对志愿者的皮肤屏障有损伤作用。[/td][/tr][tr][td]光谱法[/td][td=2,1]光谱法分为傅里叶变换衰减全反射红外光谱法、共聚焦拉曼光谱法、荧光寿命显微成像法。优点是快速、无创、实现皮肤精准深度测量甚至实时动态了解。缺点主要是这些检测设备通常较为昂贵,而且这些光谱测试方法对实验者要求较高,实验时一般要求测试部位长时间保持不能移动,具有一定挑战性。具有局限性,主要在于,一种化学物质必须有一个特定的吸收光谱,与SC 的化学物质截然不同。此外体内试验方法还有化学测试法、组织检查法、同位素示踪法、生理反应法等[/td][/tr][tr][td]其他方法[/td][td=2,1]化学测试法、组织检查法、同位素示踪法、生理反应法等[/td][/tr][tr][td]试验标准[/td][td=4,1]GB/T 27818-2011 化学品 皮肤吸收 体外试验方法GB/T 27825-201 化学品 皮肤吸收 体内试验方法[/td][/tr][/table]哪些化妆品需要或可以不做透皮吸收试验?1.无原料和/或风险物质的透皮吸收试验,可采用国际通用的透皮吸收试验方法获取相应的数据。在提供透皮吸收数据时,吸收率以100%计;2.若满足以下部分条件:分子量﹥500道尔顿,高度电离,脂水分配系数Log Pow≤-1或≥4,拓扑极性表面积120?2,熔点200℃,吸收率以10%计;3.若化学合成的由一种或一种以上结构单元,通过共价键链接,平均相对分子质量大于1000道尔顿,且相对分子质量小于1000道尔顿的低聚体含量少于10%,结构和性质稳定的聚合物(具有较高生物活性的原料除外),可不考虑透皮吸收。4.吸收率不以100%计时,需提供有关情况说明。总结来讲,功效宣称有保湿、美白、延缓衰老等的化妆品,需要建立在透皮吸收试验的基础上开展安全性评价程序。[font=&][size=16px][color=#333333]检测标准[/color][/size][/font][font=&][color=#333333][/color][/font][table][tr][td]产品名称[/td][td]检测项目[/td][td]检测标准[/td][/tr][tr][td]化学品[/td][td]皮肤吸收体外试验[/td][td]GB/T 27818-2011[/td][/tr][tr][td]化学品[/td][td]皮肤吸收体内试验[/td][td]GB/T 27825-2011[/td][/tr][/table][font=&][size=16px][color=#333333]我们的优势[/color][/size][/font][font=&][color=#333333][/color][/font][color=#222222]德检科技针对透皮吸收给药试验不断进行多方面的研究和改进,完善了许多有效评价药物透皮吸收试验的方法,可为企业提供各种产品的透皮吸收试验及研究。[/color][color=#222222][/color]
我想请教各位,是不是药物水溶性越大,极性越大,口服吸收就越差?一般情况下,是不是脂溶性较好的药物才采用大鼠灌胃给药的方式来进行药动学及组织分布实验呢?我有看到说水溶性大,极性大的药物如果分子小的话,可以通过细胞旁路被吸收,那么这个分子的大小到底是多少呢?是分子量小,还是粒径比较小?
纳米技术改善难溶性药物吸收前景光明 近日,由中国药学会和美国药学科学家协会主办、沈阳药科大学和辽宁省药学会承办的“第二届亚洲阿登制药技术研讨会暨中国药学会药剂专业委员会2010年学术年会”在沈阳召开,会议主题为“难溶药物的剂型策略”。在为期3天的研讨中,与会专家表示,改善难溶性药物的溶解度,促进药物的吸收,提高药物的生物利用度是药剂学领域亟待攻克的难题,而纳米技术这一助推器有助于加速该难题的解决,我国学者应加强相关研究。 溶解度成为制约瓶颈 药物的溶解性是影响药物生物利用度的重要因素之一,难溶性药物因在水中的溶解度小,难以被机体吸收,导致生物利用度较差。随着组合化学、基因技术、高通量筛选技术等在药物研发中的广泛应用,大量具有活性的候选药物被发现。但是,沈阳药科大学崔福德教授表示,由于存在水溶性差的缺陷,四成左右的侯选药物不能上市而限制了其在临床充分发挥疗效。据估计,全球每年约有650亿美元的药品因生物利用度差而造成治疗费用与疗效比例的严重失调。而实际上,许多难溶性药物有着很强的生物活性,在治疗肿瘤、心血管疾病等领域有着良好疗效。因此,如何提高药物的溶解度和吸收率,成为药剂学研究的热点与难点,迫切需要发展新的制剂技术和剂型来解决这一问题。 崔福德介绍,当前,在药剂学研究中提高难溶性药物的溶解度和溶解速率有多种方法,如加入助溶剂、增溶剂和亲水性介质(适用于液体制剂);制成固体分散体和包含物(适用于固体制剂);制成微粒分散系统(适用于液体和固体制剂);还可以采取减少粒径的措施,比如做成药物的纳米结晶(适用于各种剂型)。 “但是这些方法都有一定的局限性。”中国药学会药剂专业委员会主任委员、北京大学药学院张强教授具体分析说,比如成盐类的方法就只适用于一些难溶性弱酸或弱碱类药物,而不适用于所有分子结构的药物;加入助溶剂和亲水性物质的方法,可供选择的溶剂等也是有限的;增溶剂主要是表面活性剂,毒性问题也限制了其使用;包合物同样存在可供选择的品种较少和毒性问题;固体分散体也有老化现象和需要使用大量赋型剂的缺陷;而费用较高和稳定性问题又限制了微粒化方法的使用。 新技术助力难题解决 解决上述问题,纳米技术的应用优势日益显现:纳米化使药物的粒度大大减小,表面积大大增加,水溶性差的药物在纳米载体中可形成较高的局部浓度;药物的黏附性增强,在吸收部位的滞留时间延长;纳米载药系统可以提高药物的透膜能力和稳定性,也有利于提高药物的生物利用度,特别是对于生物药剂学分类体系(BCS)Ⅱ类(低溶解度、高通透性)和Ⅳ类(低溶解度、低通透性)的药物,这一技术越来越受到国内外一些研究机构、制药公司的青睐。 在药剂学领域,一般将制剂中纳米粒子的尺寸界定在1~1000纳米范围,主要包括纳米载体与纳米药物两个方面。纳米载体是指溶解或分散有药物的各种纳米粒,如纳米乳、聚合物纳米粒(纳米囊或纳米球)、脂质纳米粒等;纳米药物则是指直接将原料药物加工成的纳米粒,实质上是微粉化技术、超细粉技术的发展。 张强介绍,纳米乳/微乳是一种由水、油、表面活性剂和一些复合表面活性剂自组装成的粒径小于100纳米的半透明溶液,其易于制备、相对稳定,而且可使大多数水不溶性药物的生物利用度提高显著。自1943年被报道以来,纳米乳/微乳已经得到了广泛的研究,但上市的产品却不多,1995年诺华公司上市了环孢素A的微乳产品,在临床迅速得以推广。现在上市的同类品种还有雷帕霉素自微乳化给药系统。 纳米粒(纳米球或纳米囊)一般是指由天然或合成的高分子材料制成的、粒径在纳米级的固态胶体微粒,可用于包裹亲水性药物,也可包裹疏水性药物,具有在胃肠道中稳定、药物不易被破坏,以及能够调整药物的理化性质、释放和生物学行为等优点。自1976年Birrenbach等人首先提出了纳米粒和纳米囊的概念后,目前以合成高分子材料为聚合物的纳米粒研究得最为广泛。但张强遗憾地表示:“30多年来,这个研究领域没有取得实质性的突破,无论是口服制剂还是注射制剂都没有产品上市。”而天然聚合物的纳米粒所使用的材料包括壳多糖、白蛋白、右旋糖苷、明胶等,其中以口服壳聚糖纳米粒的研究最为广泛。值得一提的是,白蛋白结合紫杉醇纳米粒注射混悬液2005年上市,成为制剂领域的一个重大突破;但口服给药方面仍没有产品面市。 脂质纳米粒是以生物相容性良好的脂质材料为载体,将药物溶解、包裹于脂质核或是吸附于纳米粒表面的新型载药系统。第一代脂质纳米粒是固体脂质纳米粒(SLN),其性质稳定、制备较简便,具有一定的缓释作用,主要适合于难溶性药物的包裹;随后又发展了第二代纳米结构脂质载体(NCL),解决了第一代脂质纳米粒载药量不佳的问题,稳定性也更好。张强谈到,近年来,对脂质纳米粒的研究也相当广泛,特别是第二代脂质纳米粒自1999年开始研究以来,在外用领域如化妆品领域进展很快,开发程度好于脂质体,但至今还没有用于临床的产品。 在表面活性剂和水等附加剂存在下直接将药物粉碎加工成纳米微粒,可以提高药物的吸收或靶向性,特别适合于大剂量的难溶性药物的口服吸收和注射给药,能增加溶出度,提高生物利用度,增加稳定性。此外,它无需载体材料,只有少量的表面活性剂,安全性更高。此类技术分为纳米混悬剂和纳米结晶制备技术。其中,纳米结晶制备技术发展较快,目前已有5种产品利用这种技术生产并在美国上市,包括惠氏公司的Rapamune(西罗莫司)、默克公司的Emend(阿瑞吡坦)、雅培公司的Tricor(非诺贝特)以及Par公司的Megace ES(甲地孕酮)等。
[color=#0021b0][size=3][font=Times New Roman]药物的吸收是指药物由给药部位进入血液循环的过程。药物经吸收后进入血液,随血液分布到机体各组织中,在靶组织中产生药效。大多数给药途径给药(除静脉和动脉注射给药外),药物在到达在体循环之前必须通过层层半渗透性细胞膜。这些细胞膜起到生物屏障作用,有选择地抑制某些药物分子通过。细胞膜主要由一种双分子的脂质基质构成,其中主要含有胆固醇及磷脂。膜脂质使细胞膜具有稳定性,也决定了细胞膜渗透性特点。大小和组成不同的球形蛋白质埋嵌在基质中,这些膜蛋白可以参与转运过程,也可以在细胞调节机制中起到受体的作用。此外, 在膜中还存在一些孔道, 使一些小分子化合物如水、尿素等通过。常见药物跨膜转包括被动扩散、易化被动扩散、主动转运、孔道转运和胞饮作用等几种类型。[/font][/size][/color][color=#0021b0][size=3][font=Times New Roman]口服给药是最常用的给药方式,因其安全、方便及顺应性好等特点。口服给药必须经胃肠道吸收和经过门静脉到肝脏后才进入体循环。口服药物在到达体循环之前,经肠道吸收、肠壁和肝脏的代谢分解,使进入体内的相对药量降低,这种现象称之为首过效应(first-pass effect)。药物由给药部位到达血液循环中的相对量称作生物利用度(bioavailability)。口服药物的生物利用度受到胃肠道的吸收度、肠壁代谢和肝脏代谢的影响。通常来说,生物利用度低的药物,个体差异大,有时候会难以获得满意的疗效。药物在胃肠道的吸收是一个非常复杂的过程,受到许多因素的影响:药物的理化性质(如水溶性solubility,通透性permeability),生理因素(如胃排空gastric emptying、肠道通过时间intestinal transit time、pH值),药物的剂型,食物,药物相互作用,胃肠道疾病等。[/font][/size][/color][align=center][img]http://ng1.17img.cn/bbsfiles/images/2010/06/201006171029_225221_1623423_3.jpg[/img][/align]

在电影中我们都会看到喷雾式药物或则其他用品的存在。为什么瘾君子会用吸入式?为什么防爆用的胡椒也是喷发式?原因是药物的作用吸收速度与接触面积有关,喷发式的药物以小离子进入人体,肺泡是进行气-血交换的场所,也是药物在肺部吸收主要场所,总面积可达100-200平方米,毛细血管非常丰富,而且从肺泡表面到毛细血管距离近,吸收快。更是避开了肝脏的首过消除效应。也就是瞬时嗨到顶峰。所以喷雾式给药途径才能大行其道。http://ng1.17img.cn/bbsfiles/images/2015/03/201503061508_537422_1702689_3.jpg
好象药典上有,但是不集中列出,请问有人知道那里能有这方面资料或者哪位大侠曾经总结过,常用药物的紫外最大吸收波长啊[em09]
http://www.pharmogo.com/upload/GP%E7%AC%AC%E4%BA%8C%E8%BD%AE%E9%80%9A%E7%9F%A5-%E9%82%80%E8%AF%B7.png第五届GastroPlus药物吸收与药动学建模与模拟培训班(第二轮通知) 2017年4月13-15日(周四至周六)上海 张江 博雅酒店http://www.pharmogo.com/upload/2(42).png3月10日前缴费享受8折优惠http://www.pharmogo.com/upload/PDF%E4%B8%8B%E8%BD%BD1.png点击下载PDF版通知尊敬的同仁,您好!FDA, EMA 在2016年分别发布了生理药动学PBPK模型的工业指南征求意见,为制药企业提交的日益增多的PBPK模型提供支持,并提高审评的效率,包括临床在研新药申请(IND),新药申报(NDA),大分子药物申报(BLA),仿制药申报(ANDA)。与此同时,国内仿制药一致性评价正在如火如荼地开展着,高级隔室吸收与转运ACAT模型指导体外溶出预测药物的体内生物利用度,进而提高制剂处方筛选和BE成功率。为使中国用户、药物研发人员等更好地、更深入地使用软件及解决实际业务难题,第五届GastroPlus 药物吸收与药动学建模与模拟培训班将于4月在上海举办;本培训班讲师将由来自美国Simulations Plus、上海凡默谷的技术专家担任。主办方美国Simulations Plus上海凡默谷(PharmoGo)Course Instructors培训师●Viera Lukacova技术总监,美国Simulations PlusLukacova 博士2005年加入Simulations Plus公司,超过12年的药物建模与模拟实战经验,多次应邀在FDA, EMA举办的workshop上做技术报告及讨论;同时也是FDA资助的药物吸收与药动学模型优化项目的负责人;已为全球各地的法规部门及制药企业提供不同层次的技术培训,包括美国FDA、EMA、全球制药企业等。●Haiying Zhou高级技术支持,美国Simulations Plus8年的建模与模拟从业经验,2009年加入Simulations Plus公司,专注于生理药动学与吸收模型GastroPlus,制剂体外崩解与溶出模拟软件DDDPlus的开发,近期的研究方向为生物大分子的生理药动学模型(PBPK)。为多家制药企业、研究机构供技术支持。周博士2002年于华东理工大学获得学士学位,2009年获得美国Case Western Reserve University生物医学工程专业博士学位。●陈涛技术主管,上海凡默谷超过6年的药物建模与模拟从业经验;对新药及仿制药的体内吸收、释放、体外溶出模型有丰富的经验,目前,结合体内模拟软件GastroPlus、体外溶出模拟软件DDDPlus已成功建立及考察了多个药物的体内外特征,并通过模型的搭建指导制剂处方的开发、体外溶出方法的完善、体内外相关性的建立以及制剂的生物等效性考察等。从2012年开始,为多家制药企业、药检所、学术单位提供不同层次的技术培训。Overview/培训班基本信息●时间:2017年4月13-15日(周四至周六)●地点:上海博雅酒店(上海浦东张江)●限额:限学员50名Learning Objective/培训内容本次培训班将基于GastroPlus/DDDPlus软件,深入学习PK建模原理与应用,侧重于下述领域的内容:●GastroPlus软件建立PK模型的基本原理、数学公式、涉及药物体内吸收、代谢全过程的思考方式的学习及软件操作;●如何收集和准备建模的参数,为高质量的模型结果奠定基础;●基于PBPK模型的种属外推、DDI、特殊人群PK的PK预测及案例分析;●基于机制性吸收模型体内外相关性建立;仿制药的生物等效性评估以及对不同制剂的评估方法;●通过与专家讨论以及案例的学习,掌握如何搭建出一个高质量的PK模型,并将所得到的结果更好地应用到实际工作中去;●本次培训班将在之前培训的基础上,将进一步注重实际案例的操作与实现,培训内容将结合新药与仿制药的热门关注点,逐一通过具体的案例进行实现;通过每一个具体的案例的分享,学员将更加清晰地掌握从数据收集、粗加工、建模到模型调整与应用的完整思路。Who Should Attend?/培训对象●Pharma, FDC, CRO, Academia 制药企业、药检系统、CRO、医院、学术●DMPK, Formulation, Clinical pharmacology, 药代、制剂、临床药理、毒理●NDA, ANDA 新药创制、仿制药一致性评价
请问大家火焰原子吸收法测定药物中锌、铁含量的方法回收率应达多少?在论坛搜索了一下,有说85%-115%、也有95%-105%等,能不能提供权威的标准名称?谢谢
核兹共振(NMR)在体内药物分析中,可用于药物及其代谢物的结构鉴定、代谢途径归属、定量分析以及药物与内源性物质相互作用的研究等。与其它分析方法相比,具有如下优点: ①简便性:无需对样品进行繁杂的提取或衍生化, 减少了由此带来的误差; ②无损伤性:对取样量有限的生物样品经NMR分析后还可用于其它处理, 甚至可对生物整体进行无损伤分析; ③连续性:NMR可对整体生物系统进行动态监测而不扰乱生物体内的各种平衡, 实现药物的在体分析; ④高分辨性:NMR谱线为Hz量级,能提供分子水平的结构信息; ⑤多目标性:无需进行分析条件摸索,可在同一物理条件下检测药物及其多种代谢物。 1H-NMR 已广泛用于体内药物分析。已报道的有: 氨苄青霉素、布洛芬、硝苯地平、阿司匹林、美西律等的体内样品分析。Connor等用高分辨1H-NMR (400MHz) 研究了大鼠静注羟氨苄青霉素后24h内尿样中药物的代谢情况。实验用自旋回波技术, 消除内源性物质的干扰, 增强了测定的灵敏度。尿样中共振信号在0. 5~1. 7ppm 范围内的两组峰为青霉素结构噻唑环C2上的一对偕甲基信号, 分辨清晰, 测得主要代谢物为5R , 6R 和5S, 6R 青霉素与二酮哌嗪。 Murphy等用质子去偶及NOE增益19F-NMR监测接受化疗病人的肝脏中5-FU及其代谢物(FBAL)。Campbell等利用NMR无损伤特性及表面线圈技术, 测定了不同剂量抗菌素3-氟甲基青霉素V衍生物在活体SD 大鼠体内的药物浓度。将静脉注药后的麻醉鼠置于表面线圈中,用19F-NMR 测定鼠膀胱内尿样及胸内药物浓度。 Ogiso等用13C-NMR 探讨了脂肪酸对普萘洛尔透皮吸收的影响。实验结果表明: 与月桂酸酰胺及甲酯化合物相比, 月桂酸对普萘洛尔透皮吸收的增强作用显著。普萘洛尔制剂中加入月桂酸后, 血浆中普萘洛尔浓度明显提高。本文摘自冯敏,“NMR技术在体内药物分析中的应用”,药学进展,1998,22(4
求购一台透皮吸收仪 北京 有买过的人也请告诉一下哪个厂家可以买到
http://www.pharmogo.com/upload/2222%20-%20%E5%89%AF%E6%9C%AC.png第五届GastroPlus药物吸收与药动学建模与模拟培训班(第一轮通知) 2017年4月13-15日(周四至周六)上海 张江 博雅酒店http://www.pharmogo.com/upload/2(42).pnghttp://www.pharmogo.com/upload/PDF%E4%B8%8B%E8%BD%BD1.png点击下载原文PDF尊敬的同仁,您好!FDA, EMA 在2016年分别发布了生理药动学PBPK模型的工业指南征求意见,为制药企业提交的日益增多的PBPK模型提供支持,并提高审评的效率,包括临床在研新药申请(IND),新药申报(NDA),大分子药物申报(BLA),仿制药申报(ANDA)。与此同时,国内仿制药一致性评价正在如火如荼地开展着,高级隔室吸收与转运ACAT模型指导体外溶出预测药物的体内生物利用度,进而提高制剂处方筛选和BE成功率。为使中国用户、药物研发人员等更好地、更深入地使用软件及解决实际业务难题,第五届GastroPlus 药物吸收与药动学建模与模拟培训班将于4月在上海举办;本培训班讲师将由来自美国Simulations Plus、上海凡默谷的技术专家担任。主办方美国Simulations Plus上海凡默谷(PharmoGo)Course Instructors培训师●Viera Lukacova技术总监,美国Simulations PlusLukacova 博士2005年加入Simulations Plus公司,超过12年的药物建模与模拟实战经验,多次应邀在FDA, EMA举办的workshop上做技术报告及讨论;同时也是FDA资助的药物吸收与药动学模型优化项目的负责人;已为全球各地的法规部门及制药企业提供不同层次的技术培训,包括美国FDA、EMA、全球制药企业等。●Haiying Zhou高级技术支持,美国Simulations Plus8年的建模与模拟从业经验,2009年加入Simulations Plus公司,专注于生理药动学与吸收模型GastroPlus,制剂体外崩解与溶出模拟软件DDDPlus的开发,近期的研究方向为生物大分子的生理药动学模型(PBPK)。为多家制药企业、研究机构供技术支持。周博士2002年于华东理工大学获得学士学位,2009年获得美国Case Western Reserve University生物医学工程专业博士学位。●陈涛技术主管,上海凡默谷超过6年的药物建模与模拟从业经验;对新药及仿制药的体内吸收、释放、体外溶出模型有丰富的经验,目前,结合体内模拟软件GastroPlus、体外溶出模拟软件DDDPlus已成功建立及考察了多个药物的体内外特征,并通过模型的搭建指导制剂处方的开发、体外溶出方法的完善、体内外相关性的建立以及制剂的生物等效性考察等。从2012年开始,为多家制药企业、药检所、学术单位提供不同层次的技术培训,包括中检院,浙江药检所、上海药检所、湖北药检所、和记黄埔,GSK,药明康德、协和药物所,军科院等数十家制药企业和科研单位。http://www.pharmogo.com/upload/1%EF%BC%882%EF%BC%89.jpgOverview/培训班基本信息●时间:2017年4月13-15日(周四至周六)●地点:上海博雅酒店(上海浦东张江)●限额:限学员50名Learning Objective/培训内容本次培训班将基于GastroPlus/DDDPlus软件,深入学习PK建模原理与应用,侧重于下述领域的内容:●GastroPlus软件建立PK模型的基本原理、数学公式、涉及药物体内吸收、代谢全过程的思考方式的学习及软件操作;●如何收集和准备建模的参数,为高质量的模型结果奠定基础;●基于PBPK模型的种属外推、DDI、特殊人群PK的PK预测及案例分析;●基于机制性吸收模型体内外相关性建立;仿制药的生物等效性评估以及对不同制剂的评估方法;●通过与专家讨论以及案例的学习,掌握如何搭建出一个高质量的PK模型,并将所得到的结果更好地应用到实际工作中去;●本次培训班将在之前培训的基础上,将进一步注重实际案例的操作与实现,培训内容将结合新药与仿制药的热门关注点,逐一通过具体的案例进行实现;通过每一个具体的案例的分享,学员将更加清晰地掌握从数据收集、粗加工、建模到模型调整与应用的完整思路。http://www.pharmogo.com/upload/2(29).jpgWho Should Attend?/培训对象●Pharma, FDC, CRO, Academia 制药企业、药检系统、CRO、医院、学术●DMPK, Formulation, Clinical pharmacology, 药代、制剂
请问哪个厂家出售体外透皮吸收实验用竖式Franz扩散池? 请留下联系方式!
请教了,我做一个乳膏,用法是一天一次,若做体外透皮吸收的话,应该在透皮吸收仪上测定多长时间,也就是说我最长取样时间定为多少合适。[em09501]
[size=4] 喹诺酮为一类具有4一喹诺酮环结构的药物。第一代药物萘啶酸(1962),第二代药物吡哌酸和氟甲喹(1974),抗菌作用较弱,国内较少使用。第j代为氟喹诺酮类(具有6一氟一 7一哌嗪一4一诺酮环结构)。喹诺酮类药物结构相似,取代位点较多,抗菌谱较广,活性高,从其结构一活性关系上探索开发新品种己成为喹诺酮类药物的研究热点,因而发展迅速, [/size][size=4] 尤以人药领域的喹诺酮类药物发展为最陕。最近几年又推出了数十种之多的新品种,其中有些还未命名,只给出了试验编号。 [/size][size=4] 喹诺酮类药物广泛地用于畜禽的细菌、霉形体病防治,已投人使用或即将进人兽医领域的药物有10多种,主要有两类,一类从人医用移植转化而来,如诺氟沙星、环丙沙星、氧氟沙星、培氟沙星、洛美沙星等。另一类是动物专用品种,己批准上市的兽医专用喹诺酮类药物有恩诺沙星(德国拜耳公司)、沙拉沙星(美国雅培公司)、单诺沙星(美国辉瑞公司)、二氟沙星(美国雅培公司)、倍诺沙星(日本武田制药),奥比沙星(日本大日本制药)和麻保沙星(瑞士罗氏公司),其中,后三种在我国还未见上市。 [/size][size=4] 诺酮类药物与细菌DNA复制所需的DNA一~rase的亚基A(Subunit)结合而抑制DNA复制化,此外由于细菌细胞具有强烈的穿透力,故具有强大的杀菌作用。这些药物的抗菌作用与疗效可与第j代头孢菌素媲美,已成为兽用抗菌药物中最活跃的研究领域之一,随之而来的这类药物的分析分析显得十分重要,相关文章也比较多,但大多数文章,例如彭六保等从四代喹诺酮类药物分类综述了该类药物的分析进展,其针对性不强;还有一些文章,如王玉忠、张加玲等从各种分析方法进行综述,与上面存在同样的问题。所以本文仅对兽医常用的九种喹诺酮类药物分析进展综述,以期对兽药临床及生产具有一定的帮助。现将常用的分析方法方法介绍如下。 [/size]
皮肤给药。 (2)药物的理化性质。 药物的吸收不决定于其在胃肠道的总浓度,而是取决于可吸收的,即非解离的药物浓度,也就是取决于药物的pka值与吸收部位的ph值。同时,药物脂溶性愈大 则愈易吸收;溶解速率愈大愈吸收得快。对难溶性固体药物而言,其粉末愈细,粒径愈小,比表面积愈大,溶解速度愈快,药物吸收速度也愈快,吸收量愈多,药效 就愈好。 (3)赋形剂。制备药剂时,往往要用某些赋形剂,他们不仅影响到生产工艺及制剂的外观性质,如:硬度、粘度、光 泽、颜色、味道等方面,而且会改变制剂的溶出速率、生物利用度,从而影响制剂的疗效。例如:乳糖是一种比较理想的常用赋形剂,用于睾丸酮片,有加速吸收的 作用;而用于异烟肼片,其疗效完全被乳糖阻碍 药物相互作用对疗效的影响 药物的相 互作用系指一种药物的作用,被同时应用的另一种药物所改变。近年来,临床上联合应用多种药物治疗某患者的一种疾病的现象日益增多。这些药物同时服用后,由 于药物间相互作用,有的产生协同作用,增强疗效;但也有的产生拮抗作用,使疗效降低,甚至会产生毒性,带来毒副反应。例如:咖啡因与麦角胺合用时,溶解度 加大,吸收增加,疗效提高。又如,洋地黄与氯噻嗪、氯噻酮、喹噻酮、利尿酸、速尿等高效利尿药合用治疗心脏性水肿时,往往造成血钾过低,增加心脏对洋地黄 的敏感性,引起中毒反应。
[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]法在药物分析中的应用冯艳春 胡昌勤(中国药品生物制品检定所 北京 100050) 近红外(Near Infrared,NIR)光谱的波长范围是780~2526nm(12820~3959cm-1),通常又将此波长范围划分为近红外短波区(780~1100nm)和近红外长波区(1100~2526nm)。由于该区域主要是O-H,N-H,C-H,S-H等含氢基团振动光谱的倍频及合频吸收,谱带宽,重叠较严重,而且吸收信号弱,信息解析复杂,所以虽然该谱区发现较早,但分析价值一直未能得到足够的重视。近年来,由于巨型计算机与化学统计学软件的发展,特别是化学计量学的深入研究和广泛应用,使其成为发展最快、最引人注目的光谱技术[1]。而且由于该技术方便快速,无需对样品进行预处理,适用于在线分析等特点,在药物分析领域中正不断得到重视与应用。1[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]的测量根据NIR光谱的获得方式,通常有透射(Transmittance)和漫反射(DiffuseReflectance)两种[2]。透射测定法的定量关系遵从Lambert-Beer定律,主要适用于液体样品,其正常的工作波长范围是850~1050nm[3]。浙江大学的史月华等人用该原理,在93%~97.4%的浓度范围内利用维生素E在6061~5246cm-1处的近红外吸收峰面积积分值和其浓度关系建立回归方程,对已知浓度的样品进行预测,误差及相对误差均在0.79%~0.9%内[4,5]。漫反射测定法是对固体样品进行近红外测定常用的方法。当光源垂直于样品的表面,有一部分漫反射光会向各个方向散射,将检测器放在与垂直光成45o角的位置测定散射光强的方法称为漫反射法。漫反射光强度A与反射率R的关系为 式中,R1为反射光强,R0为完全不吸收的表面反射光强。国内已有人先后用漫反射技术测定了精氨酸阿司匹林[6] 、安乃近[7] 、芦丁和维生素E[8] 等的含量,并且用反射光谱法对磺胺噻唑[9]进行质量评价。 以透射和漫反射为测试基础,为适应不同物质在不同状态时直接测定其[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url],90年代以来光纤技术在NIR中得到了广泛应用。光纤不仅可方便的传输光谱信号,各式各样的光纤探头还极大地方便了NIR进行各类快速在线分析。2[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]技术在药物分析中的应用2.1应用范围[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]法在药物分析领域中的应用范围相当广泛,它不仅适用于药物的多种不同状态如原料[10]、完整的片剂、胶囊与液体等制剂[11],还可用于不同类
了解不同时间药物在血浆或血清中的浓度,对于计算一种药物的代谢动力学很有必要;反之,药物动力学也是药物吸收、分布、代谢和排泄过程的一部分。准确了解药物在体内吸收、分布、代谢和排泄的规律,便于精确地计算所需药物剂量,既能保持有效的药物浓度,同时避免用药过量致毒。预先对多屏深孔Solvinert(MultiScreen Deep Well Solvinert )和多屏Solvinert滤板进行了验证,进行血浆或血清中蛋白质的板内沉淀,以便展开总药物分析。在滤板上可以快速、细致并完整地转移滤液,这样就可以在进行总药物分析之前为样品制备提供一个自动化兼容的平台。Solvinert滤板过滤的滤液中不含蛋白质,这与质谱分析法和紫外线分析法的结果一致。使用多屏深孔和多屏Solvinert滤板可产生有复验性的结果,它是一个稳定且可靠的平台。血清中的蛋白质被这些滤板过滤并沉淀之后,得到的样本中基本上不含蛋白质,回收率很高,便于萃取。药物动力学特性可以让新药开发商更了解药物的有效性和安全性,而这在新药的注册审批中是必要的。为了更好地了解候选药物的代谢动力,金斯瑞( GenScript)建议用动物来做药物分布及其代谢的研究,分析在不同时间段、不同组织或血清中,药物及其代谢物的情况。金斯瑞进行精确的药物和药物代谢动力学研究,涉及两个主要方面:药物分布及其代谢动力研究和抗体药物的代谢动力研究。群体药代动力学研究的是个体之间药物浓度变异来源及其相关性,这些个体是指按临床上相关剂量接受候选药物的目标患者人群。患者的某些人口统计学特征、病理生理特征以及治疗方面的特征,比如体重、排泄和代谢功能、以及接受其他治疗,都能够有规律地改变药物剂量-浓度关系。例如,主要由肾脏排除的药物,在接受同样剂量的情况下,在肾功能衰竭患者体内的稳态浓度,通常高于肾功能正常的患者体内的稳态浓度。群体药代动力学的研究目的就是找出那些使剂量-浓度关系发生变化的、可测定的病理生理因素,确定剂量-浓度关系变化的程度,当这些变化与临床上有意义的治疗指数改变相关的情况下,能够恰当地调整剂量。在药品开发中使用群体PK方法,使获得完整的药代动力学资料有了可能,不但能从来自研究受试者的相对稀疏的数据中获取资料,而且还能从相对密集的数据或从稀疏数据和密集数据的组合中获取资料。群体PK方法能够分析来自各种不均衡设计的数据,也能分析因为不能按常用的药代动力学分析方式分析而通常被排除的研究数据,比如从儿科患者和老年患者获取的浓度数据,或在评价剂量或浓度与疗效或安全性之间的关系时所获取的数据。传统药代动力学研究的受试者通常是健康的志愿者或特别挑选的患者,一组成员的平均情况(即平均血浆浓度-时间曲线)一直是关注的主要焦点。许多研究将个体之间药代动力学的变异作为一个需要降到最低的因素进行观察,通常是通过复杂的研究设计和对照方案,或通过有严格限制的入选标准/排除标准,将其降到最低。事实上,这些资料对在临床应用期间可能会出现的变异至关重要,但是却被这些限制所掩盖。而且,传统药代动力学研究只关注单个变量(例如肾功能)的作法,还使其难以研究变量之间的交互作用。
饮食对部分药物的吸收有影响,或存在相互作用,必须按照各种药物的不同特性,科学地服药,才能确保药物的疗效,同时可降低不良反应发生。 单胺氧化酶抑制剂 在服用呋喃唑酮(痢特灵)、异烟肼(雷米封)、苯乙肼等单胺氧化酶抑制剂时,不宜食用动物肝脏、腌鱼、香蕉、菠萝、巧克力等富含酪胺的食物。牛奶、酵母、啤酒和葡萄酒中也含有较多的酪胺。酪胺能促进体内去甲肾上腺素的释放,在正常情况下,酪胺经肠道吸收后被单胺氧化酶氧化和分解。服用单胺氧化酶抑制剂后,体内单胺氧化酶活性降低,不能分解食物中的酪胺,引起去甲肾上腺素的大量释放,导致血压升高,出现颜面潮红、头痛头晕、恶心呕吐、心跳加快、视力模糊等症状,甚至发生高血压危象和蛛网膜下腔出血。 利尿药 在服用安体舒通、氨苯喋啶时,如果同时食用较多的鱼类、番茄、土豆、紫菜和香蕉、葡萄干等富含钾离子的食物,就可导致高血钾症的发生,出现胃肠痉挛、腹泻腹胀等症状,严重的可致心律失常。 喹诺酮类和四环素类药物 如氧氟沙星、左氧氟沙星、四环素、土霉素、强力霉素等,应避免与富含钙、镁、铁的食物同服。因为钙、镁、铁等金属离子能与这些药物发生化学反应,生成络合物,降低溶解度,影响药物吸收,从而使疗效降低。 磺胺类和氨基糖苷类抗菌药 磺胺嘧啶、磺胺甲基异�唑等磺胺药尿中浓度高,在酸性尿中,其溶解度降低,可在泌尿道内析出结晶,引起肾损害,出现结晶尿、血尿、尿痛、尿少和尿闭等症状,严重者还可致肾功能衰竭。妥布霉素、庆大霉素等氨基糖苷类药物主要经肾排泄并在肾脏皮质部蓄积,对肾脏有一定的毒性作用。在应用这些药物时,如果食用较多的肉类等能酸化尿液的食物,可能加重对肾脏的损害。因此,应多饮水,同时服用碳酸氢钠,少食肉类,多食水果和新鲜蔬菜,以碱化尿液,避免药物的不良反应。 左旋多巴 抗震颤麻痹药,服药时不能食用鱼、肉、动物肝脏、豆类、卷心菜等富含维生素B6的食物。维生素B6是多巴脱羧酶的辅基,使左旋多巴加速代谢脱羧成为多巴胺,而多巴胺不易透过血脑屏障,降低左旋多巴的疗效。同时,在外周组织形成的大量多巴胺,可导致恶心、呕吐、食欲减退、头痛、头晕、体位性低血压,甚至可引起肾功能下降和心律失常。还应避免与富含钙、镁、铁的食物同服,因为钙、镁、铁等金属离子能与左旋多巴分子结构中的两个游离酚羟基形成络合物,影响左旋多巴在胃肠道的吸收,降低药物疗效。 抗过敏药 服药期间不能食用肉制品、奶酪等富含组氨酸的食物。因为组氨酸在体内会转化为组织胺,而抗过敏药抑制组织胺分解,因此造成人体内组织胺蓄积,导致头痛、头晕、心慌等不适症状。 抗贫血药 应用硫酸亚铁片、富马酸铁片等治疗缺铁性贫血时,不宜食用豆制品、动物肝脏、海产品等。因为这些食物富含钙、镁、磷,他们可与铁离子生成不溶性的复合物而降低疗效。 助消化药 胃蛋白酶、淀粉酶、胰酶片、多酶片等助消化药的化学成分是蛋白质,服药期间忌饮茶,因茶叶中富含鞣质,会与蛋白质形成鞣质蛋白沉淀而难于吸收,降低药效。也不宜食用猪肝,猪肝含铜丰富,而铜离子易于和这些酶制剂的酸性基团结合,形成不溶性沉淀物,降低药效。 抗凝血药 服用双香豆素、华法林、硝苄丙酮香豆素等抗凝血药时,不宜食用动物肝脏、蛋黄、绿叶蔬菜等富含维生素K的食物。因为这些抗凝血药化学结构与维生素K相似,两者相互竞争与肝脏中有关的酶结合,使凝血酶原和凝血因子VII、IX、X的生成受抑制,影响药物的抗凝血作用。
以下按预计获批时间顺序列出26个药物。1.peginesatide公司:Affymax适应症:肾透析患者的贫血FDA咨询小组决定日期:2011年12月7日FDA决定是否批准日期:2012年3月27日 Peginesatide是治疗慢性肾病患者的贫血药物,每月注射一次,旨在与安进公司(Amgen)的Eppgen相竞争(Epogen 2010年销售额为25亿美元)。不过Peginesatide仅可用于严重肾病需透析的患者。最近安进公司与美国两家最大的肾透析中心签署长期供应合同。2.Inlyta (axitinib)公司:辉瑞(Pfizer)适应症:肾癌FDA咨询小组决定日期:2011年12月7日FDA决定是否批准日期:2012年2月-4月3.Adasuve公司:Alexza制药适应症:精神分裂症患者兴奋激越症状FDA咨询小组决定日期:2011年12月12日FDA决定是否批准日期:2012年2月4日 Adasuve使用了Alexza的专利Staccato吸入系统来传递抗兴奋药物洛沙平直接进入肺部,然后进入血液,迅速起效。FDA的专家小组有可能会注意该药传递到患者肺部这个过程的潜在副作用和相关的安全性问题。2010年10月FDA因担心该药物对肺部的安全性而拒绝批准这个药物。今年8月Alexza再一次提交了这个药物的上市申请。4.Qnexa公司:Vivus适应症:肥胖症FDA咨询小组决定日期:2012年一季度(具体日期未予以披露)5.lorcaserin公司:Arena制药适应症:肥胖症FDA咨询小组决定日期:2012年一季度(具体日期未予以披露)
1.原料药质量标准的确定原料药的质量标准确定一般程序,这里将它分为三大阶段:合成工艺待确定期,合成工艺确定期,稳定性试验考察期。1.1 合成工艺待确定期 一个原料药首先由药物合成部进行合成工艺的确定,在其进行工艺确定期间,就已经与药分部门有了密切的联系。 协助合成部门的工作:帮助确定反应步骤的终点控制、反应产物的纯度监控,所能提供的分析方法可能有薄层色谱、液相色谱或熔点等。做好自己的准备工作:通过各种途径搜集查阅有关该药品的各方面信息,比如该药的理化性质(性状、溶解度、熔点、旋光性质、紫外光谱、鉴别方法等)、检查项(一般杂质检查、有关物质检查)、含量测定方法和该药物的稳定性等等。1.2 合成工艺确定期合成工艺路线打通后,合成部门将会提供试制的三批样品(已确定该药物结构)供分析部门质量研究及稳定性试验用,一般来说,所提供三批样品应该是成熟的工艺条件,以一定规模制备得到样品,此时我们的质量研究工作正式开始。 1.2.1 质量研究工作理化常数:性状(外观、臭、味)、溶解度、熔点、比旋度、紫外吸收系数 鉴别:化学法、色谱法、光谱法 检查:酸碱度、溶液澄清度与颜色、干燥失重或水分、炽灼残渣、重金属、无机盐、无菌、热原或细菌内毒素、有机溶剂残留 、有关物质 含量测定:容量法、光谱法、色谱法 1.2.2 质量研究试验顺序安排1.3 稳定性试验考察期 按照中国药典稳定性研究指导原则规定,我们的稳定性研究包括三大部分—影响因素试验、加速试验和长期留样试验。考察项目:样品性状、有关物质和含量这三项必须考察(对于某些特殊药物可能无法考察有关物质),另外诸如:熔点(若质量标准中规定了熔点检查,或能测出准确熔点且熔点低于250℃的样品,稳定性研究中必须对其检查)、溶液颜色与澄清度(若为供注射用原料,稳定性研究中必须对其检查)、pH值(若为供注射用原料,稳定性研究中必须对其检查)等项目则根据各药物的性质而具体制定。上面将原料药分析工作分三大块做了简单讨论,文中所讲的多是实际试验的简单思路和一些注意事项,但对于新药研究这样一个很严肃的工作有很多法定性的规定内容在文中并未详细说明,在《中国药典2000年版二部》和《新药质量研究与质量标准指导原则》中有详细的说明。 2.药物溶解度试验1.试验溶剂的选择可参考有关文献制定,若无文献一般选择常用的水相溶剂(水、酸、碱溶液)和有机溶剂(甲醇、乙醇、乙腈、乙醚、丙酮、氯仿、冰醋酸、DMF、DMSO)。2.若按照中国药典要求的做法将用去大量的原料和溶剂一般我们都按倍数减量试验,但在做极易溶解或易溶时因溶剂量较小可适当放大原料量试验。 3.药物稳定性试验药物的有关物质检查:它是药物质量的重要指标之一,包括未反应完全的化学原料、合成副产物和药品贮存过程中产生的降解物两部分,检查方法首选HPLC检查,该方法亦是现在最常用的的有关物质检查方法,若该药物无紫外吸收则考虑用TLC检查。 4.药物的含量测定对于含量测定方法有容量法(非水滴定、酸碱滴定、络合滴定、典量滴定等)、光谱法(UV)、色谱法(HPLC、GC)等。容量法为原料含测的首选,我们一般使用非水滴定法,其优点是无需对照品即可测得样品含量;原料药中使用光谱法的较少(但也有用紫外吸收系数法或外标法测定原料含量);色谱法中主要使用的是HPLC法,一般含量测定的色谱条件与有关物质检查的色谱条件是相同的,所以样品的有关物质检查使用HPLC时,只需在该色谱条件下进行含量方法学验证试验(专属性、精密度、重现性、线性、回收率等),若符合规定则可以用于样品的含量测定。 何为完善的HPLC有关物质检查方法?分离好(与合成中间体分离、与降解杂质分离)、峰型好(无拖尾或前沿)、柱效好(理论板数能达到2000以上)、时间好(主峰保留时间在5-10分钟为宜)、线性好,有了以上“五好”的基础就可以对所选的方法进行详细的方法学研究(专属性、检测限、定量限等)。条件确定后进行方法学论证试验。有关物质检查方法论证:包括:线性、加速破坏试验、最小检测限、最小定量限含量测定要点:成盐(如盐酸左氧氟沙星)、带结晶水(如阿魏酸钠)的原料,在对此类样品测定含量时首先要搞清楚它的含量是以谁来计算的,若需要用到对照品的,应该清楚对照品是否与待测物结构一致,因为有些原料是成盐后的,但所用的对照品是未成盐的。关于对照品:对照品非常重要,可分两类,中国药品生物制品检定所标定的对照品和自己精制的对照品。若该药品已有国家标准品应以其为基准测定含量。对于自制的对照品,对其纯度的要求比样品较高,如样品规定含量限度为99.0%,有关物质限度为1%,则对照品含量一般规定为99.5%,有关物质限度为0.5%。若以外标法(或内标法)计算时不要忘记折算对照品的含量,有的要求扣除水分后计算的也不要忘记。 5.理化常数外观(注意晶型)、熔点(不能简单记录样品的熔程,应详细记录熔融时的现象,尤其是熔融同时分解的样品,对于有文献报道的熔点值,切勿因心理作用在测定时将数据往文献值中靠)、比旋度、紫外吸收系数(用对照品或精制品配制高低两个浓度的样品溶液各两份,分别在五台校准过的仪器上测定)。 一般检查酸碱度、溶液的澄清度与颜色(供注射用原料及抗生素类药需考察此项目,一般无特殊颜色的样品可不考察),干燥失重或水分、炽灼残渣、重金属、无机盐(如砷盐、氯化物检查、硫酸盐检查、铵盐检查,该类检查是合成工艺而定,如合成中使用了大量硫酸,则样品应该对硫酸盐进行检查),无菌、热原或细菌内毒素(一般只针对于供注射用的原料),有机残留溶剂(合成部门提供在药物合成工艺中所用的溶剂种类,该实验由外单位协助完成。ICH将有机溶剂按照毒性的大小分为一、二、三类,指导原则中规定合成工艺中用到的一、二类溶剂及后三步反应用到的三类溶剂均要考察)。 6.稳定性试验考察期注意事项对于那些稳定性差的药物在做影响因素试验和加速试验时可按规定降低试验强度进行考察,此时我们一般的做法是在放样影响因素高温条件时同时对60℃和40℃进行考察(不能只提供40℃的影响因素试验结果,只有当60℃的实验结果显示样品已很不稳定,如有关物质已超出标准规定时,才提供40℃的影响因素试验结果),若结果表明样品40℃影响因素试验结果已很不稳定,则加速试验中应立即放样考察30℃的实验条件,而不是将40℃加速试验条件考察到6个月后再考察30℃加速试验条件。
透皮给药系统的生产技术前已介绍多层聚合物膜固态贮库透皮给药系统的基本结构,即第四种类型中的a、b等类型,由一些高分子材料如聚乙烯醇、乙烯-蜡酸乙烯共聚物、聚氨酯、聚丙烯酸脂、硅橡胶及一些其它天然和合成的凝胶类等物质构成的骨架膜贮库系统,1993年,Cygnus公司设计的新型的7天一贴的雌二醇系统,一改早期Ciba-Geigy药厂推出的3天半的释放的系统醇液体填充密封系统,而采用第四型的结构,过去,Ciba-Geigy生产的3天半释放的系统中含的挥发性乙醇、控释膜和坚硬的背衬材料,所有这些在当时的技术条件下必须采用“液态填充密封”包装生产。在目前产品设计中第四型结构是很引人注目的技术,近些年来,市售产品中,越来越多采用第四型的固体设计,把药物溶解在压敏胶中,使压敏胶既起贮库作用,又起到粘贴皮肤的作用,这种系统称之为压敏胶膜贮库的透皮吸收系统(adhesive transdermal drug delivery,a-TDD)。它是第四型结构中很重要的一类。很多市售的医用级硅酮压敏胶、丙烯酸酯压敏胶及聚异丁烯压敏胶,都很适宜作为这一系统的材料,市售的产品如日本山之药厂生产的硝酸异山梨醇酯透皮贴剂是国外早期就开发应用的a-TDD系统;Toddywala RD报道(1991)的三种激素药物的硅橡胶压敏胶透皮给药系统也是这类系统。这些系统的生产工艺,几乎都离不开涂布工艺,本章以聚合物或压敏胶为贮库模型分别介绍其生产工艺。这种工艺基本来源于绊创膏的生产和涂布工艺,其工艺流程如下: 一、 基质溶液(matrix solution)的制备 贮库有多层的或单层的,用作多层的系统的贮库材料最好由相同的基本成分组成,其中可能包括聚合物、软化物、增粘剂、填料。而药物一般是分别加入各层的贮库基质溶液,因为多层系统的多个层中的药物浓度和饱和度是不同的,其不同之处在于从表层和主体贮库层药物的含量是增加的。设备:混料机,贮料罐及管道输送系统。基质聚合物的预处理:每种基质液都有本身特殊的处方组成,这与多层贮库系统的设计方案有关。按照设计的处方,基质液由不同数量的聚合物原料液、增粘树脂、软化剂、防老剂、填充剂等组成。活性成分通常以溶液或晶体或如同硝酸甘油吸附在惰性的固体上的形式加入基质液中。基质液或混悬液的批量大小,视所需涂布的厚度、固体材料的含量以及生产中用于涂布的胶层的面积而定。按照目前应用最广,具有代表性的橡胶系,丙烯酸系和硅系压敏胶的不同,如果原材料为固体,则选用双S型搅拌桨混合机,放入已切割或磨碎的聚合物薄片,加入有机溶媒遮盖,使其在混合前胶化,然后揉合,直到获得一均匀、无色、洁净的聚合物溶液,再将该溶液经一滤器抽入贮罐,所有这些过程必须在有效的工艺规程的控制下进行,以保证聚合物分子的完整性。基质液的终产品在进入下一生产工序之前,应检查其活性成分的含量、固体含量及粘性。要制备多层系统就需要多种不同的基质液,每一种基质液应使用单独的容器来贮藏。同样,混料机、管道系统仅仅适用于单一原辅料或原料液。一种原料液最好使用两个贮罐,当一个贮罐的原料液经化验室化验后进入生产,另一贮罐则处于贮备待检状态。要制二层系统(贮库层、表面控释层)时,就需要两种不同的基质液。(二)涂布工艺 涂布工序是在特殊设计的涂布机中完成的,涂布机基本上由三个单元组成:涂布装置、干燥隧道和成层设备,此外,还辅助有卷绕机等辅助单元。基底材料送入涂布车间前,先用压缩空气除灰尘,有的产品要涂一层背单面底胶以增加胶液在基材上的粘基力,如果是卷筒型压敏胶产品,则在压敏胶面的基材另一面上涂布防粘剂。在涂布过程中,硅纸或类似有防粘剂处理的基材,被均匀的涂布上基质液或混悬液,在加热段,有机溶媒蒸发并用强力的引风机除去。在多层涂布时,一般以接触皮肤那层开始,随后的多层依次涂布在它上面。涂布装置由精确运行的反向滚筒构成,滚筒表面抛光,两个滚筒的直径不同,其中较大的主要滚筒包绕着粘性的基材,较小的滚筒上装有刮刀,两个滚筒形成一个贮槽,槽底部具有一个可精确调节到0.01mm的开口,槽内盛基质溶液。主滚筒联轴与电机的传动同步,反向滚筒以同向但不同速的方式进行旋转,通过槽下方开口处把定量的基质溶液涂布在基底层上,基质液由于具有粘性,不会形成液滴,这样就可以得到一个均匀的薄层。如果涂布上从接触皮肤的那一层开始的话,其基底层就起到覆盖层作用,此时必须采用不粘性的硅纸或类似材料。在实践中,对于具有基底层为300g/m2的多层系统而言,其涂布误差应保持±5 g/m2.一般生产中每个涂层的重量从20 g/m2到200 g/m2不等,制备不同的涂层,都必须重新调整涂布的槽液出口。在涂布时因有机溶剂蒸发,甚至有些药物具有挥发性,因此涂布基质液应适当封闭,涂布后的胶带在密闭环境下进入干燥单元。骨架型的多层膜系统的生产过程不存在涂布基质溶液的生产过程,一般是预先制好多层胶带(其包含周边的压敏胶及防粘层),把药物骨架用适当材料(如PAV、甘油、水或硅橡胶)预先制成,当背衬层放卷进入生产线,切割机将骨架切割后放在多层胶带的适当位置,另一层覆盖层放卷,复合上成型。(三)干燥工艺 多个基质层经涂布后,要除去基质溶液中的有机溶剂,让已涂布基质的硅纸或基材通过干燥通道,经历一定长度的干燥隧道,就可能得到干燥。实际应用的有多种不同的干燥隧道,最常见的是一种高效空气喷口干燥系统其工作原理如下:经空调机净化的空气通过空气喷口吹到刚制备的涂布均匀的基质表面,夹带有机溶媒污染环境,出口的空气用燃烧的方式净化。要使基质层的最理想的干燥效果,使其粘性适合并含量准确,干燥隧道应分成几段以便能方便控制温度,干燥隧道应采用拱形结构,避免转运时涂布与机架接触。已被涂布的基材通过调整皮带轮使其拉紧,在此情况下转动通过干燥隧道。为了符合GMP的要求,隧道内部完全用不锈钢构成并易于一片片拆下清洗。在干燥隧道的每一部分,最好用自动控制和记录装置系统进行监视。应记录的参数有:温度、气流速度,有机溶剂在空气中的百分比,转轮的速率,基材的张力。干燥过程中,室内空气的有机溶剂的含量不得超过爆炸极值的50%,且干燥隧道的温度要根据药物稳定性而定,如硝酸甘油贴剂一定不能超过54℃,因其受热易挥发。(四)收卷工艺 基材先在一对辊筒间放卷,经涂布和干燥隧道到达位于干燥隧道末端的卷绕架,然后被卷紧。因为基质是粘性的,所以必须特别小心收卷以避免对基质的损害。有两种卷绕、涂布好基质的胶带的方法:(1)直接卷绕法:在基材的两个表面局长须具有不同剥离力的防粘性,以防止基材反面粘上胶粘性物质。(2)间接卷绕法:在干燥的基材上覆盖一居间防护性箔片,再进行卷绕。这种方法成本高,但防粘效果更为可靠。
实验数据中各变量的关系可表示为列表式,图示式和函数式。 列表式:将实验数据制成表格。它显示了各变量间的对应关系,反映出变量之间的变化规律。它是标绘曲线的基础。图示式:将实验数据绘制成曲线。它直观地反映出变量之间的关系。在报告与论文中几乎都能看到,而且为整理成数学模型(方程式)提供了必要的函数形式。 函数式:借助于数学方法将实验数据按一定函数形式整理成方程即数学模型。 熟悉相关和回归的定义,相关系数的定义,直线回归的最小二乘法。 熟悉药品质量标准分析方法验证中各项指标的定义和考察方法。 含量测定方法的评价 (效能指标—分析品质因数) 一般常用的分析效能评价指标包括:精密度、准确度、检测限、定量限、选择性、线性与范围、重现性、耐用性等;测定法的效能指标可评价分析测定方法,也可作为建立新的测定方法的实验研究依据。 1.精密度系指用该法测定同一匀质样品的一组测量值彼此符合的程度。它们越接近就越精密。在药物分析中,常用标准(偏)差(SD或S); 相对标准(偏)差(RSD),也称变异系数(CV),表示。 生物样品分析时,常用RSD表示精密度,并可细分为批内(或日内)精密度及批间(或日间)精密度。 批内精密度:是同一次测定的精密度。通常采用高、中、低三种浓度的同一样品各7-10份,每种浓度的样品按所拟定的分析方法操作,一次开机后,一一测定。计算每种浓度样品的SD值及RSD值。批内精密度也可视为日内精密度。所得RSD应争取达到5%以内,但不能超过10%。 批间精密度:是不同次测定的精密度。通常采用高、中、低三种浓度的同一样品,每种浓度配制7-10份,置冰箱冷冻。自配制样品之日开始,按所拟定的分析方法操作,每天取出一份测定,计算每种浓度样品的SD值及RSD值。批间精密度也可视为日间精密度。所得RSD应控制在15%以内。 2.准确度是指测得结果与真实值接近的程度,表示分析方法测量的正确性。 由于“真实值”无法准确知道,因此,通常采用回收率试验来表示。 制剂的含量测定时,采用在空白辅料中加入原料药对照品的方法作回收试验及计算RSD,还应作单独辅料的空白测定。每份均应自配制模拟制剂开始,要求至少测定高、中、低三个浓度,每个浓度测定三次,共提供9个数据进行评价。 回收率=(平均测定值M -空白值B)/ 加入量A×100% 回收率的RSD一般应为2%以内。 3.检测限(LOD)是指分析方法能够从背景信号中区分出药物时,所需样品中药物的最低浓度,无需定量测定。 LOD是一种限度检验效能指标,它既反映方法与仪器的灵敏度和噪音的大小,也表明样品经处理后空白(本底)值的高低。要根据采用的方法来确定检测限。当用仪器分析方法时,可用已知浓度的样品与空白试验对照,记录测得的被测药物信号强度S与噪音(或背景信号)强度N,以能达到S/N=2或S/N=3时的样品最低药浓为LOD;也可通过多次空白试验,求得其背景响应的标准差,将三倍空白标准差(即3δ空或3S空)作为检测限的估计值。为使计算得到的LOD值与实际测得的LOD值一致,可应用校正系数来校正,然后依之制备相应检测限浓度的样品,反复测试来确定LOD。如用非仪器分析方法时,即通过已知浓度的样品分析来确定可检出的最低水平作为检测限。 4.定量限 (LOQ)是指在保证具有一定可靠性(一定准确度和精密度)的前提下,分析方法能够测定出的样品中药物的最低浓度。 它反映了分析方法测定低药物浓度样品时具有的可靠性。它与上述的检测限的差别在于:定量限要定量测定某一药物在样品介质中的最低浓度,且定量限规定的最低浓度应该符合一定的精密度和准确度的要求。确定定量限的方法也因所用方法不同而异。当用非仪器分析方法时,与上述检测限的确定方法相同;如用仪器分析方法时,则往往将多次空白试验测得的背景响应的标准差(即空白标准差)乘以10,作为定量限的估计值,继之,再通过分析适当数量已知接近定量限或以定量限制备的样品来验证。 5.选择性是指在样品介质中有其他组分共存时该分析方法对供试物质准确而专属的测定能力。 它与专属性的含义稍有不同。专属性是指一种方法仅对一种分析成分产生唯一信号;选择性则可对多种化学成分产生不同响应,而主要成分的响应可与其它响应区分。 因此,选择性是指该法用于复杂样品分析时相互干扰程度的量度。 在药物分析中考察一个分析方法的选择性时,应着重考虑杂质、降解产物、相关化合物以及制剂辅料等其他组分是否对被测药物的测定有干扰。一般,通过添加上述物质的样品与未曾添加的样品所得分析结果进行比较而确定。 6.线性与范围 分析方法的线性是在给定范围内获取与样品中供试物浓度成正比的试验结果的能力。换句话说,就是供试物浓度的变化与试验结果(或测得的响应信号)成线性关系。 所谓线性范围是指利用一种方法取得精密度、准确度均符合要求的试验结果,而且成线性的供试物浓度的变化范围,其最大量与最小量之间的间隔,可用mg/L ~ mg/L、 ug/ml ~ ug/ml等表示。 线性与范围的确定可用作图法(响应值Y/浓度X)或计算回归方程(Y=a+bX)来研究建立。 测定样品时所有生物药物分析方法都必须同时作标准曲线。每次作标准曲线时,方法应与分析方法考核时完全一致。标准浓度应包括一定梯度的5-8个浓度(非线性者如免疫分析可适当增加),每个浓度只需测定一次(免疫分析可测定两次并取均值);标准曲线应覆盖样品可能的浓度范围,对于含量测定要求一般浓度上限为样品最高浓度的120%,下限为样品最低浓度的80% (但应高于LOQ);目前仍广泛采用相关系数(r)表示标准曲线的线性度、并控制r≥0.9900。对照品的LOQ必须包括在线性范围。 7.耐用性 是指利用相同的方法在各种正常实验条件下对同一样品进行分析所得结果的重现程度。 所谓各种正常实验条件,包括不同的实验室、不同的分析人员、不同的仪器、不同批号的试剂、不同的测试耗用时间、不同的分析温度、不同的测定日期等等。分析方法重现性的测定是通过在不同实验室由不同的实验者(操作和环境条件虽有差别但仍在规定的分析参数内)对同一样品的分别测试而获得的。 重现性 即是指在不同实验室中使用此种分析方法的精密度。是评价其保持不受参数微小变差影响的能力,并可作为正常使用的一个可靠性指标。 8. 与参比方法测得结果的相关程度的比较 由于生物样品中含有许多干扰测定的杂质,特别是与原型药物相似的代谢物常对药物的测定有影响。因此,除考察选择性外,有时还用参比方法对实际生物样品同时测定并进行比较。比较试验时,取若干份实际样品 (如病人服药后采取的血样),用一个已证明有相当专属性和可靠性的方法与新建立的方法同时进行测定,以参比方法测得的药浓为横坐标(X),以新建立方法测得的药浓为纵坐标(Y)作成散布图,并求出直线回归方程 (y=a+bx)及相关系数 (r)。r最大值为1,表示两法完全相关(结果完全吻合);r=0时,表示两法完全不相关。一般要求两法的相关系数r>0.95,而相关直线的斜率 应接近于1。 评价一种分析方法的效能,一般根据方法的使用对象区别。有以下四种情况: A.用于原料药中主要组分或制剂中有效组分含量测定的方法:除了检测限和定量限二项指标外,对精密度、准确度、选择性、线性与范围、耐用性等均应有所要求; B.用于原料药中杂质测定或制剂中降解产物测定的方法又可分为两种: ①用于含量测定;要求是:除检测限和精密度指标不必要求外,对准确度、选择性、线性与范围、定量限、耐用性等均应有所要求; ②用于限度检查。要求是:只对检测限、选择性和耐用性三项指标有所要求,其余均无需要求。 C.用于溶出度测定的方法及药物释放度测定的方法,只有精密度和耐用性有所要求,其余项目均不作要求。 D.用于生物样品中药物测定的方法,对精密度、准确度、检测限、选择性、可测线性范围、定量限、对生物样品的耐用性以及与参比方法测得结果的相关程度的比较等指标应有所要求。
我单位是做药物分析的,以后可能还会做食品和化妆品,请教各位大虾买什么样的[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]好,单位要我明天下午定下来。即要好一点的又要实用,先谢谢了哈
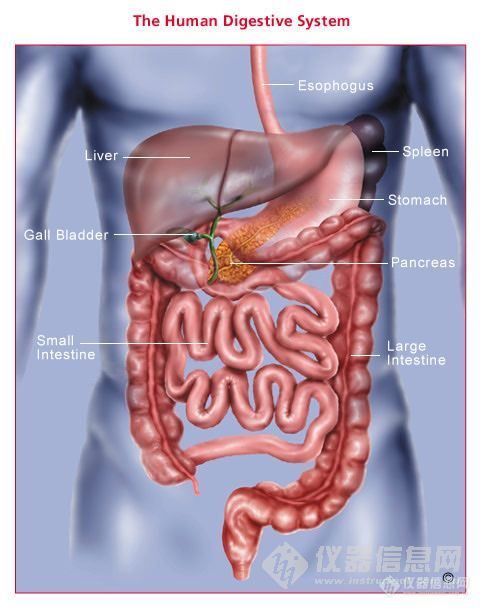
化妆品功效性原料物经皮吸收,主要是通过角质层和活性表皮浸润真皮,直接作用于靶细胞。皮肤对大多数功效性原料物是经皮给药的屏障,许多化妆品功效性原料物透皮给药后,渗透速率达不到治疗要求,所以,寻找促进化妆品功效性原料物透皮吸收的方法,是开发透皮给原科物系统的关键。它包括物理方法和化学方法。研究得最多的是化学方法是使用渗透促进剂,此外,化学方法,还有化学结构改造,如合成具有较大透皮速率的前体药物,使用微乳、脂质体等技术,对蛋白质等水溶性大分子原洲物,离子导入和超声波等物理方法应用较多。化妆品渗透促进剂常用的可分为以下几类,见表1。 【这个表格 导不进来 大家可以看看下面 23 4楼】表1 渗透促进剂一览表 类型 举例 药物 作用机制亚砜类 二甲基亚砜(DMSO)、癸基甲基亚砜(DCMS) 氢化可的松、水杨酸、溴乙啡啶、茶碱、氟灭酸、丙炎松等 角质层细胞内蛋白质变性;破坏角质层细胞间脂质的有序排列;脱去角质层脂质,脂蛋白吡咯烷酮类 2-吡咯酮、5-甲基-2-吡咯酮、1,5-二甲基-2-吡咯酮 ******、正辛醇、苯甲酸、倍他米松、甲灭酸 低浓度分配进入角蛋白,高浓度影响角质层脂质流动性并促进药物在角质层的分配;增加角质层的含水量Azone及其类似物 Azone 氯林可霉素磷酸酯、褐霉素钠、氟尿嘧啶、丙缩羟强龙、地塞米松、醋酸环戊酮缩去炎松 渗入皮肤角质层,降低细胞间脂质排列的有序性;脱去细胞间脂质形成孔道;增加角质层含水量;降低角质层脂质的相转变温度脂肪酸及其酯 油酸、肉豆蔻酸异丙酯、丙二醇二壬酸酯、癸二酸二乙酯 水杨酸、雌二醇、芬太尼、********、肝素、吲哚美辛 渗入角质层脂质,影响其有序排列;降低角质层脂质双分子层的相转变温度;引起角质层脂质固–液相分离和晶型转变;增加药物在角质层的分配表面活性剂 月桂醇硫酸钠、泊洛沙姆 氟灭酸、水杨酸 使角质层脂质排列无序化;乳化皮肤表面脂质,改善药物在角质层的分配醇类 乙醇、异丙醇、正十二醇、正辛醇 水杨酸、雌二醇、纳洛酮、左旋-18-甲基炔诺酮 作为溶剂增加药物在角质层的溶解度;脱去角质层脂质;渗入角质层脂质,影响其排列有序性多元醇类 丙二醇、丙三醇 水杨酸、5-氟尿嘧啶 使角蛋白溶剂化,占据蛋白质的氢键结合部位,减少药物-组织间的结合;增加并用的其他渗透促进剂在角质层的分配萜烯类 桉树脑、d-苎烯、橙花叔醇 普鲁卡因、吲哚美辛、5-氟尿嘧啶、肝素 促进药物在角质层的扩散;破坏角质层细胞间脂质屏障;提高组织电导率,打开角质层极性孔道;增加药物从基质向角质层的分配胺类 尿素、十二烷基-N,N-二甲基氨基乙酯 5-氟尿嘧啶 促进角质层水化,在角质层形成亲水性孔道;破坏角质层脂质结构酰胺类 二甲基甲酰胺、二甲基乙酰胺 ******、正辛醇、氢化可的松 低浓度时分配进入角蛋白区,高浓度时影响角质层脂质的流动性环糊精类 环糊精、2-羟丙基-环糊精 Liavozolel 将药物形成包合物,提高溶解度,并可把药物分子传递到皮肤表面氨基酸及其酯 L-异亮氨酸、十二烷基焦谷氨酸酯 雌二醇、左旋-18-甲基炔诺酮、茶碱 松弛皮肤的角蛋白,影响角质层脂质排列的有序性大环化合物 十五烷酮 氢化可的松 增加药物在角质层中的溶解度有机溶剂类 醋酸乙酯 水杨酸 破坏角质层脂质排列的密实性磷脂类 卵磷脂、豆磷脂、磷脂酰甘油、磷脂酰乙醇胺 二氢麦角胺、异三梨醇硝酸酯、茶碱、吲哚美辛 促进药物从基质中释放,增加药物在皮肤中的扩散;作用于角质层细胞膜脂质,改善其渗透性
药物分析实验数据处理实验数据中各变量的关系可表示为列表式,图示式和函数式。 列表式:将实验数据制成表格。它显示了各变量间的对应关系,反映出变量之间的变化规律。它是标绘曲线的基础。图示式:将实验数据绘制成曲线。它直观地反映出变量之间的关系。在报告与论文中几乎都能看到,而且为整理成数学模型(方程式)提供了必要的函数形式。 函数式:借助于数学方法将实验数据按一定函数形式整理成方程即数学模型。 熟悉相关和回归的定义,相关系数的定义,直线回归的最小二乘法。 熟悉药品质量标准分析方法验证中各项指标的定义和考察方法。 含量测定方法的评价 (效能指标—分析品质因数) 一般常用的分析效能评价指标包括:精密度、准确度、检测限、定量限、选择性、线性与范围、重现性、耐用性等;测定法的效能指标可评价分析测定方法,也可作为建立新的测定方法的实验研究依据。 1.精密度系指用该法测定同一匀质样品的一组测量值彼此符合的程度。它们越接近就越精密。在药物分析中,常用标准(偏)差(SD或S); 相对标准(偏)差(RSD),也称变异系数(CV),表示。 生物样品分析时,常用RSD表示精密度,并可细分为批内(或日内)精密度及批间(或日间)精密度。 批内精密度:是同一次测定的精密度。通常采用高、中、低三种浓度的同一样品各7-10份,每种浓度的样品按所拟定的分析方法操作,一次开机后,一一测定。计算每种浓度样品的SD值及RSD值。批内精密度也可视为日内精密度。所得RSD应争取达到5%以内,但不能超过10%。 批间精密度:是不同次测定的精密度。通常采用高、中、低三种浓度的同一样品,每种浓度配制7-10份,置冰箱冷冻。自配制样品之日开始,按所拟定的分析方法操作,每天取出一份测定,计算每种浓度样品的SD值及RSD值。批间精密度也可视为日间精密度。所得RSD应控制在15%以内。 2.准确度是指测得结果与真实值接近的程度,表示分析方法测量的正确性。 由于“真实值”无法准确知道,因此,通常采用回收率试验来表示。 制剂的含量测定时,采用在空白辅料中加入原料药对照品的方法作回收试验及计算RSD,还应作单独辅料的空白测定。每份均应自配制模拟制剂开始,要求至少测定高、中、低三个浓度,每个浓度测定三次,共提供9个数据进行评价。 回收率=(平均测定值M -空白值B)/ 加入量A×100% 回收率的RSD一般应为2%以内。 3.检测限(LOD)是指分析方法能够从背景信号中区分出药物时,所需样品中药物的最低浓度,无需定量测定。 LOD是一种限度检验效能指标,它既反映方法与仪器的灵敏度和噪音的大小,也表明样品经处理后空白(本底)值的高低。要根据采用的方法来确定检测限。当用仪器分析方法时,可用已知浓度的样品与空白试验对照,记录测得的被测药物信号强度S与噪音(或背景信号)强度N,以能达到S/N=2或S/N=3时的样品最低药浓为LOD;也可通过多次空白试验,求得其背景响应的标准差,将三倍空白标准差(即3δ空或3S空)作为检测限的估计值。为使计算得到的LOD值与实际测得的LOD值一致,可应用校正系数来校正,然后依之制备相应检测限浓度的样品,反复测试来确定LOD。如用非仪器分析方法时,即通过已知浓度的样品分析来确定可检出的最低水平作为检测限。 4.定量限 (LOQ)是指在保证具有一定可靠性(一定准确度和精密度)的前提下,分析方法能够测定出的样品中药物的最低浓度。 它反映了分析方法测定低药物浓度样品时具有的可靠性。它与上述的检测限的差别在于:定量限要定量测定某一药物在样品介质中的最低浓度,且定量限规定的最低浓度应该符合一定的精密度和准确度的要求。确定定量限的方法也因所用方法不同而异。当用非仪器分析方法时,与上述检测限的确定方法相同;如用仪器分析方法时,则往往将多次空白试验测得的背景响应的标准差(即空白标准差)乘以10,作为定量限的估计值,继之,再通过分析适当数量已知接近定量限或以定量限制备的样品来验证。 5.选择性是指在样品介质中有其他组分共存时该分析方法对供试物质准确而专属的测定能力。 它与专属性的含义稍有不同。专属性是指一种方法仅对一种分析成分产生唯一信号;选择性则可对多种化学成分产生不同响应,而主要成分的响应可与其它响应区分。 因此,选择性是指该法用于复杂样品分析时相互干扰程度的量度。 在药物分析中考察一个分析方法的选择性时,应着重考虑杂质、降解产物、相关化合物以及制剂辅料等其他组分是否对被测药物的测定有干扰。一般,通过添加上述物质的样品与未曾添加的样品所得分析结果进行比较而确定。 6.线性与范围 分析方法的线性是在给定范围内获取与样品中供试物浓度成正比的试验结果的能力。换句话说,就是供试物浓度的变化与试验结果(或测得的响应信号)成线性关系。 所谓线性范围是指利用一种方法取得精密度、准确度均符合要求的试验结果,而且成线性的供试物浓度的变化范围,其最大量与最小量之间的间隔,可用mg/L ~ mg/L、 ug/ml ~ ug/ml等表示。 线性与范围的确定可用作图法(响应值Y/浓度X)或计算回归方程(Y=a+bX)来研究建立。 测定样品时所有生物药物分析方法都必须同时作标准曲线。每次作标准曲线时,方法应与分析方法考核时完全一致。标准浓度应包括一定梯度的5-8个浓度(非线性者如免疫分析可适当增加),每个浓度只需测定一次(免疫分析可测定两次并取均值);标准曲线应覆盖样品可能的浓度范围,对于含量测定要求一般浓度上限为样品最高浓度的120%,下限为样品最低浓度的80% (但应高于LOQ);目前仍广泛采用相关系数(r)表示标准曲线的线性度、并控制r≥0.9900。对照品的LOQ必须包括在线性范围。 7.耐用性 是指利用相同的方法在各种正常实验条件下对同一样品进行分析所得结果的重现程度。 所谓各种正常实验条件,包括不同的实验室、不同的分析人员、不同的仪器、不同批号的试剂、不同的测试耗用时间、不同的分析温度、不同的测定日期等等。分析方法重现性的测定是通过在不同实验室由不同的实验者(操作和环境条件虽有差别但仍在规定的分析参数内)对同一样品的分别测试而获得的。 重现性 即是指在不同实验室中使用此种分析方法的精密度。是评价其保持不受参数微小变差影响的能力,并可作为正常使用的一个可靠性指标。 8. 与参比方法测得结果的相关程度的比较 由于生物样品中含有许多干扰测定的杂质,特别是与原型药物相似的代谢物常对药物的测定有影响。因此,除考察选择性外,有时还用参比方法对实际生物样品同时测定并进行比较。比较试验时,取若干份实际样品 (如病人服药后采取的血样),用一个已证明有相当专属性和可靠性的方法与新建立的方法同时进行测定,以参比方法测得的药浓为横坐标(X),以新建立方法测得的药浓为纵坐标(Y)作成散布图,并求出直线回归方程 (y=a+bx)及相关系数 (r)。r最大值为1,表示两法完全相关(结果完全吻合);r=0时,表示两法完全不相关。一般要求两法的相关系数r>0.95,而相关直线的斜率 应接近于1。 评价一种分析方法的效能,一般根据方法的使用对象区别。有以下四种情况: A.用于原料药中主要组分或制剂中有效组分含量测定的方法:除了检测限和定量限二项指标外,对精密度、准确度、选择性、线性与范围、耐用性等均应有所要求; B.用于原料药中杂质测定或制剂中降解产物测定的方法又可分为两种: ①用于含量测定;要求是:除检测限和精密度指标不必要求外,对准确度、选择性、线性与范围、定量限、耐用性等均应有所要求; ②用于限度检查。要求是:只对检测限、选择性和耐用性三项指标有所要求,其余均无需要求。 C.用于溶出度测定的方法及药物释放度测定的方法,只有精密度和耐用性有所要求,其余项目均不作要求。 D.用于生物样品中药物测定的方法,对精密度、准确度、检测限、选择性、可测线性范围、定量限、对生物样品的耐用性以及与参比方法测得结果的相关程度的比较等指标应有所要求。
资料来自丁香园实验数据中各变量的关系可表示为列表式,图示式和函数式。 列表式:将实验数据制成表格。它显示了各变量间的对应关系,反映出变量之间的变化规律。它是标绘曲线的基础。图示式:将实验数据绘制成曲线。它直观地反映出变量之间的关系。在报告与论文中几乎都能看到,而且为整理成数学模型(方程式)提供了必要的函数形式。 函数式:借助于数学方法将实验数据按一定函数形式整理成方程即数学模型。 熟悉相关和回归的定义,相关系数的定义,直线回归的最小二乘法。 熟悉药品质量标准分析方法验证中各项指标的定义和考察方法。 含量测定方法的评价 (效能指标—分析品质因数) 一般常用的分析效能评价指标包括:精密度、准确度、检测限、定量限、选择性、线性与范围、重现性、耐用性等;测定法的效能指标可评价分析测定方法,也可作为建立新的测定方法的实验研究依据。 1.精密度系指用该法测定同一匀质样品的一组测量值彼此符合的程度。它们越接近就越精密。在药物分析中,常用标准(偏)差(SD或S); 相对标准(偏)差(RSD),也称变异系数(CV),表示。 生物样品分析时,常用RSD表示精密度,并可细分为批内(或日内)精密度及批间(或日间)精密度。 批内精密度:是同一次测定的精密度。通常采用高、中、低三种浓度的同一样品各7-10份,每种浓度的样品按所拟定的分析方法操作,一次开机后,一一测定。计算每种浓度样品的SD值及RSD值。批内精密度也可视为日内精密度。所得RSD应争取达到5%以内,但不能超过10%。 批间精密度:是不同次测定的精密度。通常采用高、中、低三种浓度的同一样品,每种浓度配制7-10份,置冰箱冷冻。自配制样品之日开始,按所拟定的分析方法操作,每天取出一份测定,计算每种浓度样品的SD值及RSD值。批间精密度也可视为日间精密度。所得RSD应控制在15%以内。 2.准确度是指测得结果与真实值接近的程度,表示分析方法测量的正确性。 由于“真实值”无法准确知道,因此,通常采用回收率试验来表示。 制剂的含量测定时,采用在空白辅料中加入原料药对照品的方法作回收试验及计算RSD,还应作单独辅料的空白测定。每份均应自配制模拟制剂开始,要求至少测定高、中、低三个浓度,每个浓度测定三次,共提供9个数据进行评价。 回收率=(平均测定值M -空白值B)/ 加入量A×100% 回收率的RSD一般应为2%以内。 3.检测限(LOD)是指分析方法能够从背景信号中区分出药物时,所需样品中药物的最低浓度,无需定量测定。 LOD是一种限度检验效能指标,它既反映方法与仪器的灵敏度和噪音的大小,也表明样品经处理后空白(本底)值的高低。要根据采用的方法来确定检测限。当用仪器分析方法时,可用已知浓度的样品与空白试验对照,记录测得的被测药物信号强度S与噪音(或背景信号)强度N,以能达到S/N=2或S/N=3时的样品最低药浓为LOD;也可通过多次空白试验,求得其背景响应的标准差,将三倍空白标准差(即3δ空或3S空)作为检测限的估计值。为使计算得到的LOD值与实际测得的LOD值一致,可应用校正系数来校正,然后依之制备相应检测限浓度的样品,反复测试来确定LOD。如用非仪器分析方法时,即通过已知浓度的样品分析来确定可检出的最低水平作为检测限。 4.定量限 (LOQ)是指在保证具有一定可靠性(一定准确度和精密度)的前提下,分析方法能够测定出的样品中药物的最低浓度。 它反映了分析方法测定低药物浓度样品时具有的可靠性。它与上述的检测限的差别在于:定量限要定量测定某一药物在样品介质中的最低浓度,且定量限规定的最低浓度应该符合一定的精密度和准确度的要求。确定定量限的方法也因所用方法不同而异。当用非仪器分析方法时,与上述检测限的确定方法相同;如用仪器分析方法时,则往往将多次空白试验测得的背景响应的标准差(即空白标准差)乘以10,作为定量限的估计值,继之,再通过分析适当数量已知接近定量限或以定量限制备的样品来验证。 5.选择性是指在样品介质中有其他组分共存时该分析方法对供试物质准确而专属的测定能力。 它与专属性的含义稍有不同。专属性是指一种方法仅对一种分析成分产生唯一信号;选择性则可对多种化学成分产生不同响应,而主要成分的响应可与其它响应区分。 因此,选择性是指该法用于复杂样品分析时相互干扰程度的量度。 在药物分析中考察一个分析方法的选择性时,应着重考虑杂质、降解产物、相关化合物以及制剂辅料等其他组分是否对被测药物的测定有干扰。一般,通过添加上述物质的样品与未曾添加的样品所得分析结果进行比较而确定。 6.线性与范围 分析方法的线性是在给定范围内获取与样品中供试物浓度成正比的试验结果的能力。换句话说,就是供试物浓度的变化与试验结果(或测得的响应信号)成线性关系。 所谓线性范围是指利用一种方法取得精密度、准确度均符合要求的试验结果,而且成线性的供试物浓度的变化范围,其最大量与最小量之间的间隔,可用mg/L ~ mg/L、 ug/ml ~ ug/ml等表示。 线性与范围的确定可用作图法(响应值Y/浓度X)或计算回归方程(Y=a+bX)来研究建立。 测定样品时所有生物药物分析方法都必须同时作标准曲线。每次作标准曲线时,方法应与分析方法考核时完全一致。标准浓度应包括一定梯度的5-8个浓度(非线性者如免疫分析可适当增加),每个浓度只需测定一次(免疫分析可测定两次并取均值);标准曲线应覆盖样品可能的浓度范围,对于含量测定要求一般浓度上限为样品最高浓度的120%,下限为样品最低浓度的80% (但应高于LOQ);目前仍广泛采用相关系数(r)表示标准曲线的线性度、并控制r≥0.9900。对照品的LOQ必须包括在线性范围。 7.耐用性 是指利用相同的方法在各种正常实验条件下对同一样品进行分析所得结果的重现程度。 所谓各种正常实验条件,包括不同的实验室、不同的分析人员、不同的仪器、不同批号的试剂、不同的测试耗用时间、不同的分析温度、不同的测定日期等等。分析方法重现性的测定是通过在不同实验室由不同的实验者(操作和环境条件虽有差别但仍在规定的分析参数内)对同一样品的分别测试而获得的。 重现性 即是指在不同实验室中使用此种分析方法的精密度。是评价其保持不受参数微小变差影响的能力,并可作为正常使用的一个可靠性指标。 8. 与参比方法测得结果的相关程度的比较 由于生物样品中含有许多干扰测定的杂质,特别是与原型药物相似的代谢物常对药物的测定有影响。因此,除考察选择性外,有时还用参比方法对实际生物样品同时测定并进行比较。比较试验时,取若干份实际样品 (如病人服药后采取的血样),用一个已证明有相当专属性和可靠性的方法与新建立的方法同时进行测定,以参比方法测得的药浓为横坐标(X),以新建立方法测得的药浓为纵坐标(Y)作成散布图,并求出直线回归方程 (y=a+bx)及相关系数 (r)。r最大值为1,表示两法完全相关(结果完全吻合);r=0时,表示两法完全不相关。一般要求两法的相关系数r>0.95,而相关直线的斜率 应接近于1。 评价一种分析方法的效能,一般根据方法的使用对象区别。有以下四种情况: A.用于原料药中主要组分或制剂中有效组分含量测定的方法:除了检测限和定量限二项指标外,对精密度、准确度、选择性、线性与范围、耐用性等均应有所要求; B.用于原料药中杂质测定或制剂中降解产物测定的方法又可分为两种: ①用于含量测定;要求是:除检测限和精密度指标不必要求外,对准确度、选择性、线性与范围、定量限、耐用性等均应有所要求; ②用于限度检查。要求是:只对检测限、选择性和耐用性三项指标有所要求,其余均无需要求。 C.用于溶出度测定的方法及药物释放度测定的方法,只有精密度和耐用性有所要求,其余项目均不作要求。 D.用于生物样品中药物测定的方法,对精密度、准确度、检测限、选择性、可测线性范围、定量限、对生物样品的耐用性以及与参比方法测得结果的相关程度的比较等指标应有所要求。
第九章 芳酸及其酯类药物的分析掌握阿司匹林及其制剂、对氨基水杨酸钠的鉴别、杂质检查和含量测定方法。熟悉苯甲酸钠的鉴别和含量测定方法。芳酸及其酯类药物分子结构的共性:既具有苯环,又有羧基。 第一节 阿司匹林及其制剂的分析一、鉴别试验(一)三氯化铁反应本类药物水解后能产生酚羟基,可在中性或弱酸性条件下,与三氯化铁试液反应,生成紫堇色铁配位化合物。应适宜的pH值为4~6,在强酸性溶液中配位化合物分解。本反应极为灵敏,只需取稀溶液进行试验;如取样量大,产生颜色过深时,可加水稀释后观察。(二)水解反应 阿司匹林与碳酸钠试液加热水解,得水杨酸钠及醋酸钠,加过量稀硫酸酸化后,则析出白色水杨酸沉淀,并发生醋酸的臭气。沉淀物于100~105°C干燥后,熔点为156~161°C。(三)红外吸收光谱法波数(cm-1) 振动类型 归属3300~2300 υOH 羟基1760,1695 υC=O 羰基1610,1580 υC=C 苯环1310,1190 υC-O 酯基二、特殊杂质检查1.溶液的澄清度:利用溶解行为的差异,检查原料药中碳酸钠试液不溶物。阿司匹林可溶于碳酸钠试液,而杂质不溶。不溶物杂质:未反应完全的酚类,或水杨酸精制时温度过高,产生脱羧副反应的苯酚,及合成中由副反应生成的醋酸苯酯、水杨酸苯酯和乙酰水杨酸苯酯等。2.水杨酸:由生产过程中乙酰化不完全或贮藏过程中水解产生。水杨酸对人体有毒性,而且分子中酚羟基在空气中被逐渐氧化成一系列醌型有色物质,如淡黄、红棕甚至深棕色,使阿司匹林成品变色。检查原理:利用阿司匹林结构中无酚羟基,不能与高铁盐作用,而水杨酸则可与高铁盐反应生成紫堇色,与一定量水杨酸对照液生成的色泽比较,不得更深。其限量为0.1%。由于阿司匹林在制剂过程中又易水解为水杨酸,因此药典规定阿司匹林片剂和肠溶片均按上述类似方法控制杂质水杨酸的限量,限量分别为:0.3%和1.5%;阿司匹林栓(HPLC法)水杨酸限量:1.0%。3.易炭化物:检查被硫酸炭化呈色的微量有机杂质。三、含量测定 (一)酸碱滴定法 1. 直接滴定法 阿司匹林结构中的游离羧基,可采用碱滴定液直接滴定。用于阿司匹林原料药的含量测定。方法:取本品约0.4g,精密称定,加中性乙醇(对酚酞指示液显中性)20ml,溶解后,加酚酞指示液3滴,用氢氧化钠滴定液(0.1mol/L)滴定。每1ml的氢氧化钠滴定液(0.1mol/L)相当于18.02mg的C9H8O4。讨论:(1)用中性乙醇为溶剂,防止阿司匹林酯结构在滴定时水解,致使测定结果偏高,故不用水为溶剂。(2)
第五章 分光光度法第一节 可见—紫外分光光度法掌握可见--紫外分光光度法的基本原理和测定方法。掌握可见—紫外分光光度法在药物鉴别、检查和含量测定中的应用。熟悉仪器的校正和检定方法;紫外吸收光谱与物质结构的关系。了解紫外分光光度计的基本结构。一、基本原理波长200~400nm范围称为紫外光区,400~760nm称为可见光区。物质吸收紫外和可见光区电磁波而产生的吸收光谱称为紫外-可见吸收光谱。 1.光源:紫外光区通常采用氢灯或氘灯,可见光区采用钨灯。2.吸收池:玻璃池适用于370nm以上的可见光区,石英池适用于紫外、可见光区,通常仅在紫外光区使用。三、紫外吸收光谱与物质结构的关系:紫外—可见吸收光谱属分子吸收光谱,是由分子的外层价电子跃迁产生的,也称电子光谱。它与原子光谱的窄吸收带不同。每种电子能级的跃迁会伴随若干振动和转动能级的跃迁,使分子光谱呈现比原子光谱复杂得多的宽带吸收。 当分子吸收紫外—可见区的辐射后,产生价电子跃迁。这种跃迁有三种形式: (1)形成单键的σ电子跃迁。(2)形成双键的π电子跃迁。 (3)未成键的n电子跃迁。通常,未成键的孤对电子较易激发,成键电子中π电子较相应的σ电子具有较高的能量,反键电子则相反。故简单分子中n→π* 跃迁需能量最小,吸收带出现在长波方向;n→σ*及n→π* 跃迁的吸收带出现在较短波段;σ→σ*跃迁吸收带则出现在远紫外区。例题:物质分子吸收紫外光后,电子跃迁的类型为:A. n→σ* B. n→π* C. π→π* D. σ→σ* E .σ→π* 答案ABCD 四、吸收度的测定方法 1.对溶剂的要求:能充分溶解样品,与样品无相互作用,挥发性小,在测定波长处的吸收要符合要求。 2.空白对照实验:将配制溶液用溶剂(空白溶液)装入参比池里,调节仪器,使吸收度为0,去除溶剂和容器吸收、光散射。反射的影响。 3.测定波长确证:为提高测定方法灵敏度,减少测定误差,吸收度一般在λmax处测定。 4.供试品溶液浓度:使吸收度在0.3~0.7范围内。 5.仪器的狭缝宽度:以减少狭缝宽度时,供试品溶液吸收度不再增加为准。五、应用1.鉴别:(1)对比吸收光谱特征参数:核对供试品溶液λmax、 、A是否符合规定。可同时用几个峰位作为鉴别依据 (2)比较吸收度比值的一致性:吸收峰较多时,规定几个波长处吸收度比值作为鉴定标准 (3)对比吸收光谱一致性2.杂质检查 药物在紫外-可见光区有明显吸收,而杂质吸收弱;或杂质有明显吸收而药物无吸收,可通过控制吸收度限度来控制杂质量。[font=Times
数十年来,丙型肝炎病毒(HCV)感染者都不得不忍受令人饱受折磨的治疗方案,其中包括注射干扰素药物,它可以引起严重恶心及抑郁症。随着几种高效口服抗病*药物即将获得批准,以及更多药物的出现,研究人员说根除全世界的感染现在成为了一个现实的目标。不同于以往的HCV治疗采用干扰素和其他药物来寻求增强免疫系统,最新的一组口服药物可以干扰病毒的复制及蛋白质合成能力。美国食品和药物管理局(FDA)董事会已于上周提议批准两种这样的药物:由强生(Johnson & Johnson)公司生成的simeprevir,以及吉利德科学公司(Gilead Sciences)的sofosbuvir获得上市。将两种药物任一种与利巴韦林(ribavirin)组合,治疗清除了大约80%感染者的丙肝病毒。 “这是在人类历史上第一次,我们治愈了一种病毒疾病,”埃默里大学药理学家Raymond Schinazi说。来自不同药物组合试验的结果将在本周发布。一项名为COSMOS的II期研究在197名对干扰素无反应或是有晚期肝纤维化的HCV患者中,测试了sofosbuvir与simeprevir的组合。在治疗12周后,药物完全清除了超过90%参与者体内的病毒。 另一项由日本广岛大学Kazuaki Chayama医生领导的研究,采用美国百时美施贵宝公司(Bristol-Myers Squibb)的两种新药daclatasvir和asunaprevir的组合对220人进行了治疗。这种鸡尾酒治愈了85%的参与者。百时美施贵宝公司全球医疗研究人员的领导者Eric Hughes说,计划2014年呈送这些药物获取FDA批准。尽管这些结果令人鼓舞,然而将来自多个药物公司的药物组合开展更大的研究看起来不大可能。Medivir药物公司研发副总裁Charlotte Edenius说,吉利德科学公司与强生公司没有打算合作开展一项III期实验。同样,百时美施贵宝公司的发言人也说,公司没有计划与吉利德科学公司协作,针对sofosbuvir–daclatasvir联合治疗开展更大的试验,尽管今年早些时候完成的一项II期实验显示两种药物配对治愈了所有41名参与者。即便没有III期实验或是FDA批准这种做法,约翰霍普金斯大学的丙肝研究人员David Thomas期望,一些医生能够开始为某些难治病例给予这样的“标签外使用”(off-label)组合处方。他认为,临床试验中令人印象深刻的治愈率表明了,强效药物组合能够至少在理论上根除全球的HCV。这种病毒没有动物储存宿主,意味着它不会隐匿于其他的动物,除了通过血液它不易在人群间传播。提高对输血血液供应品的筛查,以及更好的患者筛查技术使得过去15年来传播率大大下降。耐药病毒株的出现可能是一个障碍,但由于最新的组合抗病*药物非常的强效,它们有可能不常发生。 宾夕法尼亚大学肝病学家Rajender Reddy看到了第二重障碍:需要它们的人们如何得到这种的治疗。全球有大约1.7亿人携带丙肝病毒,其中许多人负担不起这些药物。药物公司也缺少动力来降低成本,不同于HIV抗病毒治疗需要患者终HC治疗只需12周。 鉴别HCV携带者也是一个挑战,因为大多数人都不知道他们患有这种疾病,直到他们发展为严重的肝硬化或肝癌——在感染后这一过程有时要经历数十年。洛克菲勒大学病毒学家Charles Rice说,对老年人和吸毒者等高危人群进行强制筛查是根除努力的一个重要组成部分。即便是最有效的口服药物也不能引起持久的抗病毒免疫反应,人们可以再次感染。这就是为什么仍在继续寻找一种预防性的HCV疫苗,最有希望的一批当前进入到了II期临床试验阶段。“即便我们拥有我们所需的所有药物,让疾病消失将还需要几十年的时间,这仍是一个悬而未决的问题,”Rice说。
北京大学治疗药物监测与毒理中心(北京大学第三医院药学实验室)主要从事临床药理及治疗药物监测工作,进行体内药物及小分子生物标志物的检测方法的开发,有丰富的生物分析方法开发经验。先后获得了科技部“十一五”及“十二五”重大专项国际标准化药物临床试验研究技术平台建设——I期实验室建设项目的支持,同时获得了卫生部重点专科建设项目的支持。硬件方面,目前实验室拥有液质联用仪4台(ABSciex 5500QTrap、ABSciex 4000、API 3000、Agilent 6410)、ICP/MS 一台、液相色谱仪4台。软件方面,实验室于2009年首批通过了ISO/IEC检测与校准实验室认可,有完善的质量管理体系。国际合作方面,本实验室近年来与阿斯利康公司和美迪恩斯株式会社合作,质量管理方面得到了进一步提升,管理水平与国际接轨。 现招收进修人员若干名,时间半年以上。要求如下:1、药学或药物分析相关专业本科以上学历;2、有液相或液质相关经验者优先。http://bbs.instrument.com.cn/xheditor/xheditor_skin/blank.gif3、责任心强,踏实认真。联系人:张现化电话:133 9153 9521邮箱:zhangxianhua432@163.com北京大学治疗药物监测与毒理中心北京大学第三医院药学实验室