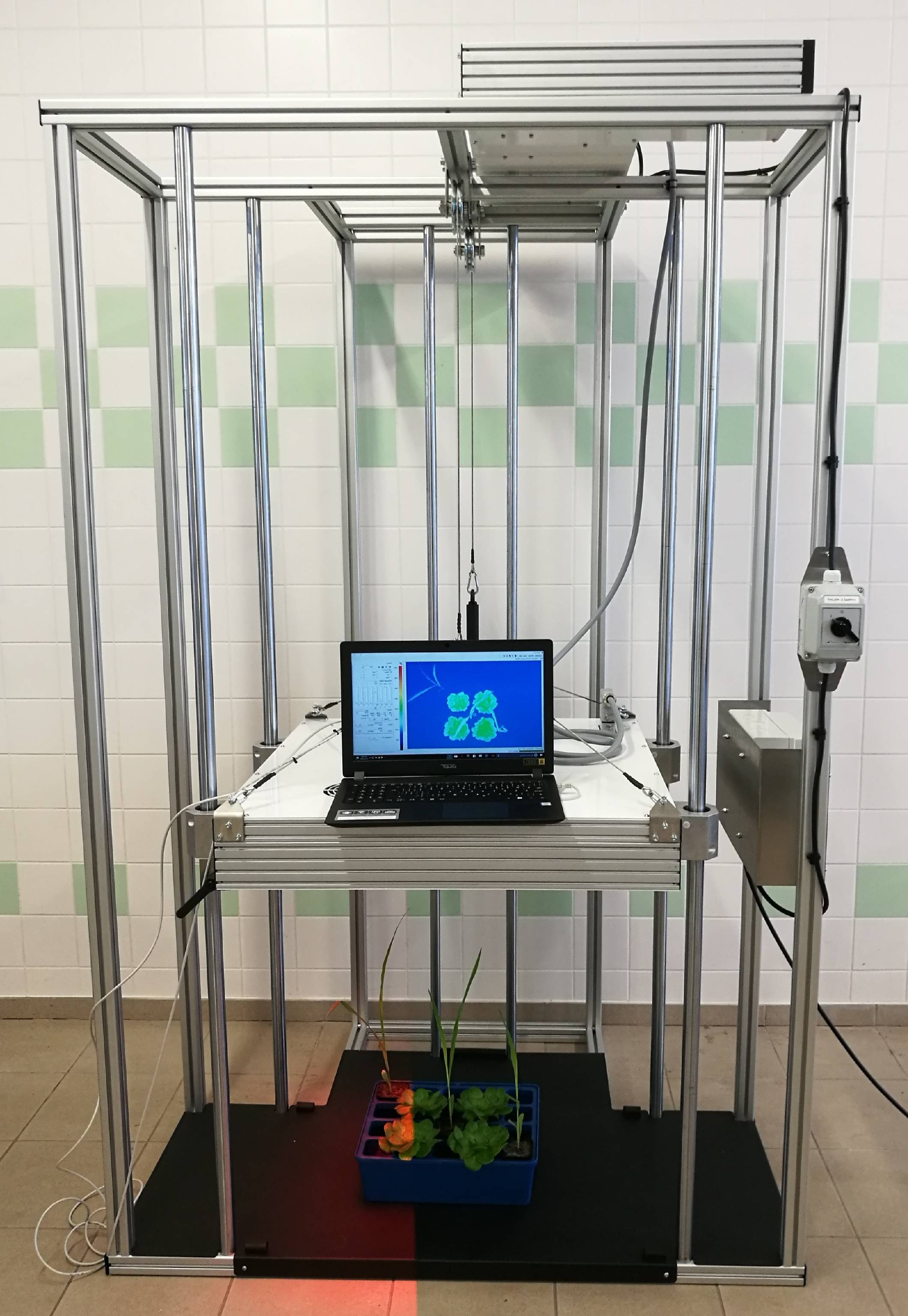
PlantScreen高通量植物表型成像分析平台由国际知名公司PSI公司研制生产,整合了LED植物智能培养、自动化控制系统、叶绿素荧光成像测量分析(可扩展多光谱荧光成像)、植物热成像分析、植物近红外成像分析、RGB真彩3D成像、高光谱成像、3D激光扫描成像分析、RhizoTron根系成像分析、自动条码识别管理、自动称重与浇灌系统等多项先进技术,以最优化的方式实现大量植物样品的全方位生理功能与形态结构自动成像分析,用于玉米、水稻、小麦、大豆及椰树等热带作物高通量表型成像分析测量、胁迫响应成像分析测量、生长分析测量、生态毒理学研究、性状识别、抗性筛选、作物遗传育种及植物生理生态分析研究等。PlantScreen技术特点:1.模块式结构,配置灵活,可选配不同的功能模块,系统具备强大的可扩展性2.全球领先的FluorCam叶绿素荧光成像技术,是作物生理生态功能性状的必备分析技术,配备独有的高灵敏度叶绿素荧光成像镜头,成像面积可选配35cm x 35cm或80cm x 80cm3.可选配不同的表型成像分析模块:1)叶绿素荧光成像单元,单幅成像面积35cm x 35cm或选配80cm x 80cm2)多激发光、多光谱荧光成像模块,包括GFP等荧光蛋白成像、多光谱荧光成像分析等3)3D RGB可见光成像分析单元,包括顶部和侧面两个高分辨率RGB镜头、0-360度旋转平台、光源灯4)高光谱成像分析单元,有VNIR高光谱和SWIR高光谱供选配5)红外热成像分析单元(标配顶部2维成像分析,可选配顶部与侧面3D成像分析),用于对植物干旱胁迫、气孔导度成像分析6)3D激光扫描单元,用于对作物3D点云模型和形态结构分析,PSI专业技术,可以把叶绿素荧光成像、高光谱成像等投射到3D点云模型上进行3D分析、作物生长模型研究等7)根系成像分析单元,RhizoTron根窗技术8)NIR(近红外)成像单元,用于对植物水分状态分析,可选配3D近红外成像9)自动称重与浇灌系统4.世界独创的智能LED光适应室,确保作物表型成像分析前稳定可比的光适应和暗适应5.Shoot & Root Phenotyping全面分析植物表型6.植物传送系统可根据客户需求定制、扩展7.客户定制智能LED温室或作物生长室(选配),可模拟昼夜节律、多云天气等,传送系统可自动将植物从生长室中传送至光适应室然后进入成像室进行成像分析,并远程在线浏览分析8.功能强大的操作系统及作物表型大数据平台,具备叶片跟踪监测功能、3D投射功能9.PSI表型研究中心专家团队技术支持,每年在美国和欧洲分别组织举办一次世界植物表型研讨会国际植物表型分析技术应用情况作为全球第一家研制生产FluorCam植物叶绿素荧光成像系统的厂家,PSI公司在植物表型成像分析领域处于全球的技术前列,其FluorCam叶绿素荧光成像系统最先应用于植物表型分析研究,代表性论文如Celine Rousseau等(High throughput quantitative phenotyping of plant resistance using chlorophyll fluorescence image analysis, Plant Methods 2013)。在FluorCam技术基础上集成RGB 3D成像分析、高光谱成像分析、近红外成像分析、红外热成像分析及激光雷达扫描分析等先进技术的PlantScreen全自动高通量植物表型成像分析平台,成为目前世界上最先进的表型组学和作物遗传育种研究设备(应用案例另附)。系统配置与工作原理:整套系统由自动化植物传送系统、光适应室、FluorCam叶绿素荧光成像、RGB成像、高光谱成像、根系成像、植物红外热成像、植物近红外成像、自动浇灌与称重系统、植物标识系统、控制系统及表型大数据平台等组成,温室或生长室内植物通过自动识别传送系统运送到光适应室内,然后进行必要的浇灌称重,再由传送带到成像室进行成像分析等,最后植物自动返回原位。系统服务器及数据分析平台在线采集分析并自动存储至数据库系统技术指标:1. 光适应室:对作物成像分析前进行均一稳定的光适应或暗适应,以确保植物表型分析数据的可靠性智能冷白LED(6500K)+远红LED(735nm)光源,对植物无辐射升温效应,光强1000 μmoles /m2/s 0-100%(步进增幅1%)可调适应室内由通风系统保持空气交流通风具备植物高度激光监测系统,以根据高度调整成像高度等具备激光定位系统,以调整控制植物移动与成像程序(imaging protocols)的同步性垂直帘门确保与环境光线及成像系统的隔离具备IP监测镜头以始终保持对系统运行和植物移动状况的监视规格容量8盆/培养托2.RGB 3D结构成像分析单元?a)2个高分辨率RGB镜头(顶部和侧面),新一代CMOS彩色传感器,分辨率12.8Mpix(4096x3000),像素大小3.45μmb)成像高度可客户定义或设置,范围0-1050mm,精确度3mmc)360度旋转平台、LED均一光源照明d)数据传输:千兆以太网e)测量参数:叶面积、植物紧实度/紧密度、叶片周长、偏心率、叶圆度、叶宽指数、植物圆直径、凸包面积、植物质心、生长高度、植物最大高度和宽度、相对生长速率等f)可进行颜色分割分析、植物适合度评价、实验生长期叶面积动态变化比较分析、绿度指数、颜色分级分析(健康绿色、亮绿色、暗绿色、其他颜色)等表型参数3.FluorCam叶绿素荧光成像单元a)成像面积:35×35cm或选配80x80cmb)橙色620nm LED脉冲调制测量光源c)双色光化学光,橙色620nm LED和冷白LED光源d)冷白LED饱和光闪,最大光强4000 μmol(photons)/m2.se)735nm LED红外光源用于测量Fo’等f)可选配蓝色光源与7位滤波轮,用于GFP稳态荧光测量g)高灵敏度叶绿素荧光成像专业CCD传感器,1.4M分辨率, A/D 16比特,具备视频模式和快照模式h)测量参数:Fo、Fm、Fv、Fo' 、Fm' 、Fv' 、Ft、Fv/Fm、Fv' /Fm' 、PhiPSII、NPQ、qN、qP、Rfd、ETR等,用于分析植物光合效率、适合度、生物与非生物胁迫及作物抗性、恢复力等i)Fv/Fm、Kautsky诱导效应、荧光淬灭分析等完备自动化测量程序(protocols)与测量参数,如Fv/Fm程序测量时间仅需10sj)叶绿素荧光数据在线分析,包括柱状图、测量参数图、数据表格等,具备自定义图像分割等功能4. 多光谱荧光成像模块不仅可以运行PAM叶绿素荧光成像,还可以进行GFP/YFP等荧光蛋白成像、多光谱荧光成像9种LED激发光源:UV(365nm)、青色光源(440nm)、蓝色光源(470nm)、绿色光源(530nm)、琥珀色光源(590nm)、橙色光源(630nm)、深红色光源(660nm)、远红光源(730nm)及冷白光源(5700K)可成像分析多酚类(黄酮醇类、花青素等)、N素指数等分辨率1360x1024像素,binning 2x2、680x512像素5. 红外热成像单元成像传感器:焦平面阵列微测热辐射计,分辨率 640×480 像素,灵敏度30mK(0.03°C),波段7.5-13μm;可选配高分辨率红外热成像,分辨率可达1024x768像素,灵敏度20mK(0.02°C)温度范围 -20 – 120℃,分辨率0.03℃@30℃/30mK专用成像光源:冷白LED光源板,用于给测量植物提供稳定热环境,6500K,最大光强 1000 μmol(photons)/m2.s,0-100%可调具备温度动态Protocols,光照强度、持续时间、热成像分布数据同步获取,以研究分析植物温度分布动态等具备温度参考传感器(reference sensors)测量参数:植物每一点的实际温度,植物表面温度分布图专业分析软件用于数据获取、分析、存储等6. NIR成像分析单元(选配):用于成像监测分析植物水分状态分布,具备假彩调色板,可以方便对比分析,快速监测脱水植物,因而可以监测评估干旱胁迫条件下植物水分的动态变化响应及水分利用效率等可与RGB成像形态结构参数及FluorCam光合效率参数进行相关分析等;可完整记录追溯干旱过程与复水过程的动态响应等通过测量水分吸收光谱和940nm参考光谱,有效避免环境光及阴影效应InGaAs传感器,有效芯片大小9.6x7.7mm,波段范围900-1700nm,分辨率638x510像素,帧频118fps,A/D 14比特可选配顶部与侧面双镜头三维成像分析选配根系成像分析单元,以对根系进行近红外成像分析7. 可见光-近红外高光谱成像单元 成像波长范围:400-950nm(或350-900nm)成像传感器:推扫式线性扫描传感器,配备专用扫描光源像素色散:0.28nm/pixel光谱分辨率0.8nm FWHM光谱带数(波段数):1920个波段空间分辨率:1000入射狭缝宽度:25μm帧频:45fpsCMOS检测器,光圈F/2.0,GigE网络接口自动参考校准,线性扫描,高度可调测量参数:每个波段的反射光谱成像图及全光谱曲线,并可自动计算以下植被指数:归一化指数NDVI、简单比值指数SR、改进的叶绿素吸收反射指数MCARI、改进的叶绿素吸收反射指数1MCARI1、最优化土壤调整植被指数OSAVI、绿度指数G、转换类胡罗卜素指数TCARI、三角植被指数TVI、ZMI指数、简单比值色素指数SRPI、归一化脱镁作用指数NPQI、光化学植被反射指数PRI、归一化叶绿素指数NPCI、Carter指数、Lichtenthaler指数、SIPI指数、Gitelson-Merzlyak指数、花青素反射指数等等8. 短波红外高光谱成像单元成像波长范围:900-1700nm成像传感器:推扫式线性扫描传感器,配备专用扫描光源光谱分辨率:2nm(FWHM)光谱带数:510个波段空间分辨率636测量参数:每个波段的反射光谱成像图及全光谱曲线,无损测量植物整体及不同部位水分含量变化(右图中蓝色越深含水量越高)9. 3D激光扫描单元:顶部与侧面激光扫描,660nm激光,用于植物精确3D模型构建,分辨率低于1mm顶部扫描距离60cm,客户定义侧面扫描距离3D点云模型,RGB成像、叶绿素荧光成像数据等可与3D模型叠加分析植物结构、生物量、叶片数量、叶面积、叶片倾斜角度、植物高度等结构形态参数10.根系成像分析RhizoTron根窗技术,全自动成像分析,标配根窗44x29.5x5.8cm(高x宽x厚度)不仅可对根系成像分析,还可对地上苗(shoot)进行成像分析,苗高最大50cm新一代CMOS传感器,分辨率12.3MP均一LED光源3层定位(顶部、中部、底部)根系浇灌系统(选配),3个水箱独立运行测量参数包括:根深(或高度)、根冠宽度、高度与宽度比值、根冠面积、根冠紧实度、根系总长、轴对称性、根尖数、根节数等11.自动浇灌与称重单元测量参数:实际重量、浇水体积、最终重量、每个培养盆的相对重量操作指令:每个培养盆浇相同量的水(绝对克数或者实际重量的百分比);保持相对重量;自定义每个培养盆的浇灌量模拟不同干旱或者内涝胁迫;称重前自动零校准,还可通过已知重量(如砝码)物品自动进行再校准每个培养盆的浇水量、日期、时间可分别程序控制记录以创建不同干旱胁迫梯度等,并且与整个系统的表型大数据无缝结合分析称重精度:大型植物±2g,小型植物±0.2g浇灌单元:流速3L/min,浇灌口高度可自动上下前后调整,保证最佳浇灌位置12.自动化植物传送系统传送植物大小:根据客户需求,最高可达200cm传送带容纳量:50盆植物(1000株小型植物),可扩展100盆、200盆、400盆等更大容量 ;表型分析通量依不同的protocol而定,100分钟可以完成整个系统载荷植物样品的表型分析,可随机传送至成像室进行成像分析、随机浇灌培养盆:防UV聚丙烯材料,标准5L(口径24cm)培养盆,可通过适配器应用3L培养盆,可360度旋转具备手动载样环(manual loading loop)以便在系统待机模式下手动载样分析实验、小组实验分析等具备激光植物高度测量监测系统和激光定位系统环形传送通道:具变速箱的三相异步马达,功率200-1000W,最大负载500kg,速度150mm/s,传送带材料为防UV高耐用PVC移动控制系统:中央处理单元CJ2M-CPU33;数字输入/输出最大2560点;输入/输出单元最大40;温度传感器Pt1000,Pt100,PTC;PLC通讯百兆以太网;OMRON MECHATROLINK-II 最大16轴精确定位RFID标签和QR植物辨识系统,自动读取每个样品托盘上的二维编码;辨识距离2-20cm;通讯RS485;可读取1维、2维和QR码;配备LED光源便于弱光下辨识环境监测传感器:温湿度传感器、PAR光合有效辐射传感器由主控制系统分别自动调控每一个样品托盘的测量时间、测量顺序、测量参数、浇灌时间和浇灌量,从测量单元到培养室的样品运转整个过程可实现完全自动控制,在无人值守情况下根据预设程序自行完成全部实验测量工作。13.主控制表型大数据平台组成:控制调度服务器、客户端应用服务器、数据服务器、可编程序逻辑控制器及专业分析软件等,数据容量12TB自动控制与分析功能:具备用户定义、可编辑自动测量程序(protocols),根据用户设定程序自动完成全部实验。数据结果自动存储并分析,分析的数据结果可自动以动态曲线的形式显示。MySQL数据库管理系统,可以处理拥有上千万条记录的大型数据库,支持多种存储引擎,相关数据自动存储于数据库中的不同表中植物编码注册功能:包括植物识别码、所在托盘的识别码等存储在数据库中,测量时自动提取自动读取条形码或RFID标签触摸屏操作界面,在线显示植物托盘数量、光线强度、分析测量状态及结果等,轻松通过软件完全控制所有的机械部件和成像工作站可用默认程序进行所有测量,也可通过开发工具创建自定义的工作过程,或者手动操作LED光源开启或关闭、RGB成像、叶绿素荧光成像、高光谱成像、红外热成像、3D激光扫描、称重及浇灌等叶片跟踪监测功能(leaf tracking)模块,可以持续跟踪监测叶片的生长、变化等等3D投射技术,可以通过高分辨率RGB镜头 或激光扫描构建3D模型,通过投射技术,将与其它传感器所得数据如叶绿素荧光、红外热成像温度数据、近红外数据、高光谱数据等投射在3D模型上一起进行对比分析等允许用户通过互联网远程访问,进行数据处理、下载及更改实验设计所测量的所有数据都是透明的、可以追溯的具备用户权限分级功能,防止其他人员误操作影响实验厂家远程故障诊断,软件终身免费升级执行标准:CE认证标准CSN EN 60529 防护等级标准CSN 33 01 65 导体侧识别标准CSN 33 2000-3 基础特性标准CSN 33 2000-4-41ed.2 电击保护标准CSN 33 2000-4-43 电源过载保护标准CSN 33 2000-5-51ed.2 通用规则标准CSN 33 2000-5-523 容许电流标准CSN 33 2000-5-54ed.2 接地与保护导体标准CSN EN 55011 工业、科学与医学设备测量电磁干扰的范围与方法2006/42/EG 机械指令标准73/23/EEG 低电压指令标准2004/108/EG 电磁相容性指令标准附:部分参考文献1.M. Sorrentino, G. Colla, Y. Rouphaelouphael, K. Panzarová, M. Trtílek. 2020. Lettuce reaction reaction to drought stress: automated high-throughput phenotyping of plant growth and photosynthetic performance. ISHS Acta Horticulturae 1268.2.Adhikari, P., Adhikari, T. B., Louws, F.F. J., & Panthee, D. R. 2020. Advances and Challenges in Bacterial Spot Resistance Breeding in Tomato (Solanum lycopersicum L.). International Journal of Molecular Sciences, 21(5), 1734.3.Yang, W., Feng, H., Zhang, X., Zhang, J., Doonan, J. H., Et Al. 2020. Crop Phenomics and High-throughput Phenotyping: Past Decades, Current rent Challenges and Future Perspectives. Molecular Plant, 13(2), 187-2144.Husi?ková, A., Humplík, J. F., Hybl, M.,M., Spíchal, L., & Lazár, D. 2019. Analysis of Cold-Developed vs. Cold-Acclimated Leaves Reveals Various Strategies of Cold Acclimation of Field Pea Cultivars. Remote Sensing, 11(24), 29645.Singh, A.K., Yadav, B.S., Dhanapal, S., Berliner, M., Finkelshtein, A., Chamovitz, D.A. 2019. CSN5A Subunit of COP9 Signalosome Temporally Buffers Response to Heat in Arabidopsis. Biomolecules 2019, 9, 805.6.Jane?ková, H., Husi?ková, A., Lazár, D., Ferretti, U., Pospí?il, P., & ?pundová, M. 2019. Exogenous application of cytokinin during dark senescence eliminates the acceleration of photosystem II impairment caused by chlorophyll b deficiency in barley. Plant Physiology and Biochemistry, 136, 43–517.Marchetti, C. F., Ugena, L., Humplík, J. F., Polák, M., et al. 2019. A Novel Image-Based Screening Method to Study Water-Deficit Response and Recovery of Barley Populations Using Canopy Dynamics Phenotyping and Simple Metabolite Profiling. Frontiers in Plant Science, 10, 1252.8.Rungrat T., Almonte A. A., Cheng R.,R., et al. 2019. A Genome-Wide Association Study of Non-Photochemical Quenching in response to local seasonal climates in Arabidopsis thaliana, Plant Direct, 3(5), e001389.Pavicic M, et al. 2019. High throughput invitro seed germination screen identifed new ABA responsive RING?type ubiquitin E3 ligases inArabidopsis thaliana. Plant Cell, Tissue and Organ Culture 139: 563-57510.Wen Z., et al. 2019. Chlorophyll fluorescence imaging for monitoring effects of Heterobasidion parviporum small secreted protein induced cell death and in planta defense gene expression. Fungal Genetics and Biology 126: 37-4911.Gao G., Tester M. A., Julkowska M. 2019. The use of high throughput phenotyping for assessment of heat stress-induced changes in Arabidopsis. Biorvix, 838102.12.Paul K., Sorrentino M., Lucini L., Rouphaelouphael Y. F., Cardarelli M., Bonini P., Begona M., Reyeynaud H.E., Canaguier R., Trtílek M., Panzarová K., Colla G. 2019. A Combined Phenotypic and Metabolomic Approach for Elucidating the Biostimulant Action of a Plant-derived Protein Hydrolysate on Tomato Grown un under Limited Water Availability. Frontiers in Plant Science, 10:49313.Wang L., Poque S., Valkonen J. P. T. 2019. Phenotyping viral infection in sweetpotato using a high-throughput chlorophyll fluorescence and thermal imaging platform. Plant Methods, 15, 11614.Paul K, Sorrentino M, Lucini L, Rouphaelouphael Y, Cardarelli M, Bonini P, Reynaud H,H, Canaguier R, Trtílek M, Panzarová K, Colla G. 2019. Understanding the Biostimulant Action of Vegetal-Derived Protein Hydrolysates by High-Throughput Plant Phenotyping and Metabolomics: A Case Study on Tomato. Frontiers in Plant Science, 10:47.15.Gonzalez-Bayon, R., Shen, Y., Groszman, M., Zhu, A., Wang, A., et al. 2019. Senescence and defense pathways contribute to heterosis. Plant Physiology, 180, 240–252.16.Julkowska, M. M., Saade, S., Agarwal Al, G., Gao, G., Pailles, Y., et al. 2019. MVApp–Multivaria analysis application for streamlined data analysis and curation. Plant Physiology, 180, 1261–1276.17.Ganguly D. R., Stone B. A B., Eichten S. E., Pogson B. J. 2019. Excess light priming in Arabidopsis thaliana genotypes with altered DNA methylomes, G3: Genes, Genomes, Genetics, 9(11), 3611-362118.Ameztoy, K., Baslam, M., Sánchez-Lópeópez, á. M., Mu?oz, F. J., et al. 2019. Plant responses to fungal volatiles involve global post-translational thiol redox proteome changes that affect photosynthesis. Plant, Cell & Environment, 42(9), 2627-2644.19.Adhikari N. D., Simko I., Mou B. 2019. Phenomic and Physiological Analysis of Salinity Effects on Lettuce. Sensors 19, 4814.20.Ugena L, Hylová A, Podle?áková K,K, Humplík J.F., Dole?al K, Diego N, Spíchal L. 2018. Characterization of Biostimulant Mode of Action Using Novel Multi-Trait High-Throughput Screening of of Arabidopsis Germination and Rosette Growth. Frontiers in Plant Science, 9:1327.21.Lyu, J. I., Kim, J. H., Chu, H., Taylor, M.M. A., Jung, S., et al. 2018. Natural allelic variation of GVS1 confers diversity in the regulation of leaf senescence in Arabidopsis. New Phytologist, 221(4), 2320-233422.Ganguly D. R., Crisp P. A., Eichten S. R., et al. 2018. Maintenance of pre-existing DNA methylation states through recurring excess-light stress. Plant Cell and Environment. 41(7), 1657-1672.23.Rouphael Y., Spíchal L., Panzarová K.,K., et al. 2018. High-throughput Plant Phenotypin ping for Developing Novel Biostimulants: From Lab to Field or FroFrom Field to Lab? Front. Plant Sci., 9:1197.24.Coe R. A., Chatterjee J., Acebron K., et al. 2018. High-throughput chlorophyll fluorescence screening of Setaria viridis for mutants with altered CO2 compensation points. Functional Plant Biology. 45(10), 1017-102525.Fichman Y., Koncz Z., Reznik N., et al. 2018. SELENOPROTEIN O is a chloroplast protein involved in ROS scavenging and its absence increases dehydration tolerance in Arabidopsis thaliana. Plant Science. 41(7), 1657-167226.Sytar O., Zivcak M., Olsovska K., Brestic M. 2018. Perspectives in High-Throughput Phenotyping of Qualitative Traits at the Whole-Plant Level. In: Sengar R., Singh A. eds Eco-friendly Agro-biological Techniques for Enhancing Crop Productivity. Springer, Singapore, 213-243.27.De Diego N., Fürst T., Humplík J. F., et al. 2017. An Automated Method for High-Throughput Screening of Arabidopsis Rosette Growth in Multi-Well Plates and Its Validation in Stress Conditions. Frontiers in Plant Science. 8.28.Lobos G. A., Camargo A. V., del Pozo A., et al. 2017. Editorial: Plant Phenotyping and Phenomics for Plant Breeding. Front. Plant Sci. 8.29.Pavicic M., Mouhu K., Wang F., et al. 2017. Genomic and Phenomic Screens for Flower Related RING Type Ubiquitin E3 Ligases in Arabidopsis. Frontiers in Plant Scienc. Volume 8.30.Rungrat T., Awlia M., Brown M. et al. 2017. Monitoring Photosynthesis by In Vivo Chlorophyll Fluorescence: Application to High-Throughput Plant Phenotyping. The Arabidopsis Book 14: e0185. 201631.Simko I., Hayes R. J. and Furbank R. T. 2017. Non-destructive Phenotyping of Lettuce Plants in Early Stages of Development with Optical Sensors. Frontiers in Plant Science. 2016 7:1985.32.Sytar O., Brestic M., Zivcak M., et al. 2017. Applying hyperspectral imaging to explore natural plant diversity towards improving salt stress tolerance. In Science of The Total Environment, 578, 90-99.33.Sytar O., Brücková K., Kovár M., et al. 2017. Nondestructive detection and biochemical quantification of buckwheat leaves using visible VIS and near-infrared NIR hyperspectral reflectanceimaging. Journal of Central European Agriculture. 184, 864-87834.Tschiersch H., Junker A., Meyer R. C., & Altmann, T. 2017. Establishment of integrated protocols for automated high throughput kinetic chlorophyll fluorescence analyses. Plant Methods, 13, 54.35.Weber J., Kunz, C., Peteinatos, G., et al. 2017. Utilization of Chlorophyll Fluorescence Imaging Technology to Detect Plant Injury by Herbicides in Sugar Beet and Soybean. Weed Technology, 1-13.36.Awlia M., Nigro A., Fajkus J., Schm?ckel S.M., Negr?o S., Santelia D., Trtílek M., Tester M., Julkowska M.M. and Panzarová K. 2016: High-throughput non-destructive phenotyping of traits contributing to salinity tolerance in Arabidopsis thaliana. Submitted Frontiers in Plant Sciences.37.Bell J. and Dee M. H. 2016. The subset-matched Jaccard index for evaluation of Segmentation for Plant Images. Front Plant Sci. 2016 7: 1985.38.Bell J. and Dee M. H. 2016. Watching plants grow – a position paper on computer vision and Arabidopsis thaliana. IET Computer Vision. Volume 11, Issue 2, March 2017, p. 113 – 121.39.Bush M.S., Pierrat O, Nibau C, et al.2016. eIF4A RNA Helicase Associates with Cyclin-Dependent Protein Kinase A in Proliferating Cells and is Modulated by Phosphorylation. Plant Physiol. 2016 Jul 7,40.Cruz J. A., Savage L. J., Zegarac R., et al. 2016. Dynamic Environmental Photosynthetic Imaging Reveals Emergent Phenotypes. Cell Systems, Volume 2, Issue 6, 2016, Pages 365-377.41.Sytar O., Brestic M., Zivcak M . 2016. Noninvasive Methods to Support Metabolomic Studies Targeted at Plant Phenolics for Food and Medicinal Use. Plant Omics: Trends and Applications.42.Humplik J.F., Lazar D., Husickova A. and Spichal L. 2015: Automated phenotyping of plant shoots using imaging methods for analysis of plant stress responses – a review. Plant Methods 11:29.43.Humplik J.F., Lazar D., Fürst, T., Husickova A., Hybl, M. and Spichal L. 2015: Automated integrative high-throughput phenotyping of plant shoots: a case study of the cold-tolerance of pea Pisum sativum L.. Plant Methods 19 11:20.44.Brown T.B., Cheng R., Sirault R.R., Rungrat T., Murray K.D., Trtilek M., Furbank R.T., Badger M., Pogson B.J., and Borevitz J.O. 2014: TraitCapture: genomic and environment modelling of plant phenomic data. Current Opinion in Plant Biology 18: pp. 73-79.45.Mariam Awlia, et.al, 2016, High-Throughput Non-destructive Phenotyping of Traits that Contribute to Salinity Tolerance in Arabidopsis thaliana, Frontiers in Plant Science, DOI: 10.3389/fpls.2016.0141446.Ivan Simko, et.al, 2016, Phenomic approaches and tools for phytopathologists, Phytopathology, DOI: 10.1094/PHYTO-02-16-0082-RVW47.Tepsuda Rungrat, et.al, 2016, Using Phenomic Analysis of Photosynthetic Function for Abiotic Stress Response Gene Discovery, The Arabidopsis Book 14: e0185, The American Society of Plant Biologists, DOI: http://dx.doi.org/10.1199/tab.018548.Jorge Marques da Silva, 2016, Monitoring Photosynthesis by In Vivo Chlorophyll Fluorescence: Application to High-Throughput Plant Phenotyping, Applied Photosynthesis - New Progress, Edition 1, Chapter 1, pp:3-22, DOI: http://dx.doi.org/10.5772/6239149.Maxwell S. Bush, et.al, 2016, eIF4A RNA Helicase Associates with Cyclin-Dependent Protein Kinase A in Proliferating Cells and is Modulated by Phosphorylation. Plant Physiol., DOI: 10.1104/pp.16.0043550.ángela María Sánchez-López, et.al, 2016, Volatile compounds emitted by diverse phytopathogenic microorganisms promote plant growth and flowering through cytokinin action, Plant, Cell and Environment, DOI: 10.1111/pce.1275951.Jan Humplík, et.al, 2015, Automated phenotyping of plant shoots using imaging methods for analysis of plant stress responses – a review, Plant Methods, 11: 2952.Jan Humplík, et.al, 2015, Automated integrative high-throughput phenotyping of plant shoots: a case study of the cold-tolerance of pea Pisum sativum L., Plant Methods, 11: 2053.Pip Wilson, et.al, 2015, Genomic Diversity and Climate Adaptation in Brachypodium, Chapter Genetics and Genomics of Brachypodium, Volume 18 of the series Plant Genetics and Genomics: Crops and Models, pp:107-12754.Tim Brown, et.al, 2014, TraitCapture: genomic and environment modelling of plant phenomic data, Current Opinion in Plant Biology, 18: 73-7955. Jan Humplík, et.al, 2014, High-throughput plant phenntyping facility in Palacky University in Olomouc, International Symposium on Auxins and Cytokinins in Plant Development附:其它表型分析平台:1、FKM多光谱荧光动态显微成像系统右图引自《Nature Plants》2016, Photonic multilayer structure of Begonia chloroplasts enhances photosynthetic efficiency by Heather M. Whitney等2、PlantScreen-R移动式表型分析平台(下左图):用于大田植物叶绿素荧光成像分析、RGB成像分析、红外热成像分析、3D激光扫描测量分析等3、PlantScreen台式及移动式植物表型分析平台(参见上右图)1)3D RGB彩色成像分析2)FluorCam叶绿素荧光成像分析3)FluorCam多光谱荧光成像分析4)高光谱成像分析5)红外热成像分析6)PAR吸收/NDVI成像分析7)近红外3D成像分析4、PlantScreen样带式表型分析平台5、PlantScreen 植物表型三维自动扫描成像分析平台
 留言咨询
留言咨询
 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询
 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转3927
400-860-5168转3927
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转3927
400-860-5168转3927
 留言咨询
留言咨询

 留言咨询
留言咨询

 400-860-5168转3927
400-860-5168转3927
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转3927
400-860-5168转3927
 留言咨询
留言咨询

 400-860-5168转4662
400-860-5168转4662
 留言咨询
留言咨询

 400-860-5168转4713
400-860-5168转4713
 留言咨询
留言咨询

 400-860-5168转4713
400-860-5168转4713
 留言咨询
留言咨询

 400-680-0997
400-680-0997
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 留言咨询
留言咨询

 400-860-5168转4713
400-860-5168转4713
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转4470
400-860-5168转4470
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转3927
400-860-5168转3927
 留言咨询
留言咨询

 400-860-5168转4713
400-860-5168转4713
 留言咨询
留言咨询

 400-860-5168转5993
400-860-5168转5993
 留言咨询
留言咨询

 400-860-5168转4470
400-860-5168转4470
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询