膜片钳实验系统配置 一个电生理配置有4个主要的需求:环境需求:保持标本的健康的手段。光学需求:显现标本以供观察的手段。机械结构需求:稳定定位微电极的手段。电子学需求:放大和测量信号的手段。我们将配置分成两种类型的“典型”配置:胞外记录和单通道膜片钳记录。胞外记录的配置 该配置主要用于记录脑片的场电位。一般目标是将一个相对粗糙的电极放置在组织的胞外空间,同时尽可能模仿体内的组织环境。因此,需要一个相当复杂的小空腔,用来对组织进行温暖、氧化、灌注。而另一方面,光学和机械结构需求则简单得多。一个显微镜,至少15cm的工作距离(配合近似垂直放置的微操纵器),通常已经可以看到切片或大体的形态学特征。由于对定位时手的震动和电极的精确放置都没有苛刻要求,微操纵器可以选用相对粗糙的机械类型。但是,在记录过程中,微操纵器不允许有一点漂移和震动。 需要使用低噪声的电压放大器。由于信号的范围可能在10 uV 到10 mV 范围内,低噪声电压放大器的增益至少要达到1000。单通道膜片钳记录配置 标准的膜片钳配置在许多方面与胞外记录恰好颠倒过来了。由于对环境的控制非常少,实验通常在室温下、一个无灌注的培养皿中进行。 光学和机械需求则根据实际的细胞的大小(10或20 um)有特殊的规定。显微镜应该有放大300或400倍的能力,并需要某种对照增强能力(Nomarski, Phase or Hoffman)。Nomarski(微分干涉)对于电极的精确放置是最好的,因为它的影像依赖于视野一个很窄的深度上,这有助于精确定位(定位不好,影像是模糊的)。Phase(相差法)用于精确定位程度要求低一些的场合,但提供了更好的对比度。Hoffman方法提供了较便宜的,稍微退化点的Nomarski版本。最好使用倒置显微镜(如奥林巴斯的倒置研究级显微镜IX71/IX81):(1) 这样能使电极顶端更容易被看到,因为物镜在chamber的下方,(2) 提供了更大更坚固的平台,用来固定微操纵器。 微操纵器应提供良好的,平滑的移动(最多每秒2um)。对震动和稳定性的需求决定于记录模式:是希望记录cell-attached- patch,还是cell-free (inside-out or outside-out) patch。 在cell-free- patch中,微操纵器只需要在形成封接过程中保持稳定,一旦离开了细胞,稳定就不是那么至关重要了。这通常不到一分钟。 单通道记录的放大器比胞外记录使用的要复杂得多。组织切片膜片钳记录配置 膜片钳技术的近来扩展,切片膜片钳技术,其配置需要是体外胞外记录和常规膜片钳配置的一个组合。例如,该技术可能需要一个chamber,需要连续对切片进行灌流和供氧。大部分的其他要求,与常规膜片钳类似。光学需求与切片的厚度有关(thick-slice or thin-slice),对thick-slice,简单的解剖显微镜就够了(如奥林巴斯的解剖SZ和SZX系列显微镜);而对thin-slice,显微镜则需要提供400倍的放大,良好的顶端聚焦和对照增强。设备放置 电生理实验人员倾向于在小房间的一角独自工作。小房间通常比较安静,震动和空气流动被削减了。 首先放置显微镜是比较明智的,然后是密切联系的附件,例如chamber,微操纵器和温度控制系统(如果安装了)。基本原则是第一要保证细胞恰当的处于静止状态,第二要确认从细胞记录信息的行为没有对细胞带来连续的致命伤害。第一原则可以通过良好的实验环境帮助实现,第二原则通过良好的光学和机械手段实现。 在显微镜周围工作,保持例如灌注阀门和微操纵器的控制要非常谨慎,避免震动。理想的情况是,它们放置在一个小架子上,该架子从防震台延伸出来,保证在通过显微镜观察细胞时,不会产生破坏的震动。 选择和放置电子仪器是个人偏好的事情。最低的要求是只有一个放大器和一台计算机,另外强调最好放置在一个仪器架上。一个示波器是重要的,因为,计算机通常不够灵活;而且,示波器常能展现在计算机屏幕上看不到的一些意外情况,例如计算机的采样率设置不合适时,就会丢失大量细节信息,而示波器则不会。 示波器应与眼睛水平,在示波器上面或下面直接放置微电极放大器,以便容易的调整和监视信号。 计算机应放置得尽可能远,但离显微镜还是应该保持在手臂来回够得着的地方。这有助于削减显示器的辐射噪声,也能确保在使用键盘匆忙记录时不至于肘部撞击显微镜。 膜片钎实验的平台---显微镜: 完成膜片钳实验最关键的前提是要有一台性能优异的显微镜为基础平台,只有在这个基础平台上才能完成膜片钳这一高技术含量的实验,例如奥林巴斯为膜片钳实验就提供了这个很好的平台,如BX51WI/BX61WI是专门为脑片膜片钳实验所提供的显微镜平台,而IX71/IX81则为单细胞膜片钎实验打下了坚实的实验基础.[em61] [em43]
【序号】:1【作者】:马宏1邢飞1项舟【题名】:干细胞膜片在骨与软骨修复中的应用【期刊】:华西医学. 【年、卷、期、起止页码】:2023,38(10)【全文链接】:https://kns.cnki.net/kcms2/article/abstract?v=Eo9-C_M6tLk9uZm4IkSK1syfkr0KDbFTcR0617hZuaOO2RfuHSxVbqaoIynt7ZcTvLJt5-3SIRpa86mQX1e7IjPPmI8GtcsVZ8ywUEJunoyVxXNl-EZ7vjp8_-Gb8KPo9lovkvfL5A4=&uniplatform=NZKPT&language=CHS
[b]活体研究智能传感技术的演进(3)现状与未来作者:许越 [url=https://mp.weixin.qq.com/s?__biz=MzA3OTE0NTI3OQ==&mid=2651820382&idx=2&sn=b59711014ab3bac4117cfe0f115a62da&chksm=844cc10eb33b48181a6e3cd18f734ae66f9059d781d54320e045b89677bd8bb7943c8bb0df6c&scene=21#wechat_redirect]点击查看作者自传[/url][b][color=#a5a5a5]许越,男,1967年生于北京。[/color][/b][/b][list][*][color=#a5a5a5][color=#888888]于[/color][color=#888888]1993[/color][color=#888888]年和[/color][color=#888888]2000[/color][color=#888888]年分别获得首都师范大学及美国麻省州立大学,植物生理学双硕士学位。[/color][/color][*][color=#a5a5a5][color=#888888]2001[/color][color=#888888]年在美国创建基于[/color][color=#888888]NMT[/color][color=#888888]技术的美国扬格公司,次年运用[/color][color=#888888]NMT[/color][color=#888888]服务于设立在美国北卡州立大学的美国航空航天局[/color]([color=#888888]NASA[/color])[color=#888888]空间植物学研究项目。[/color][/color][*][color=#a5a5a5][color=#888888]2005[/color][color=#888888]年成立旭月(北京)科技有限公司,在匡廷云院士、杨福愉院士和林克椿教授的帮助,以及各级政府的大力支持下,将非损伤微测技术引进中国大陆。[/color][/color][*][color=#a5a5a5][color=#888888]2014[/color][color=#888888]年带领旭月团队提出被誉为“第二个人类基因组计划”的“动态分离子组学([/color][color=#888888]imOmics[/color][color=#888888])”创新概念,同年成立旭月生物功能研究院。[/color][/color][*][color=#a5a5a5][color=#888888]2015[/color][color=#888888]年推出世界领先的“自动化非损伤微测系统”,并倡导建立中关村[/color][color=#888888]NMT[/color][color=#888888]产业联盟,开启以水安全、个体化精准医疗、粮食安全等民生应用为代表的[/color][color=#888888]NMT[/color][color=#888888]产业化进程。[/color][/color][*][color=#a5a5a5][color=#888888][color=#a5a5a5]截至2016年,已帮助国内400多个科研单位及实验室,利用NMT实现了科研水平的跨越式发展。[/color][/color][/color][/list]PC膜片钳与NMT非损伤微测技术虽然几乎诞生在同一历史时期,但是它们的发展和普及过程却大相径庭。[b]1) NMT的中国特色[/b]大家知道,各个国家对动物医学研究的投入通常要远远高于对其它研究领域的投入。下图是美国在医疗健康上面的投入是其它领域的5-10倍,在中国动物医学方面的投入大概是植物学研究的6倍左右(来自于个人通讯)。[align=center][img]https://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug2MvS7dCXdDYBfqrNMk6gpicChvuLDRS1569mM4NaA54xUEhEbZYcSY3w/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][/align][align=center](来自于网络)[/align]因此,在绝大多数情况下,很多生命科学的新技术,新思路,新突破,都是来自于动物医学领域,然后传导到其它科研领域,正如在本文的第一部分[url=https://mp.weixin.qq.com/s?__biz=MzA3OTE0NTI3OQ==&mid=2651820348&idx=1&sn=bd4fb10beab21b0499c233c9c6df16d5&chksm=844cc16cb33b487ae3226d4e2a4782738fe7a4203ab8a52d838ec30831ba79bf9f5d77cd0e81&scene=21#wechat_redirect](1)愿望与挑战[/url]中所叙述的那样,膜片钳技术诞生于动物神经细胞单通道离子电流(烟碱乙酰胆碱受体)的研究,90年代进入中国后,也被首先应用于动物医学研究。然而,非损伤微测技术在生命研究领域的发展,却划出了一个自己较为独特的发展轨迹。首先,大家去问问用膜片钳搞植物研究的科研人员,他们有多么羡慕用膜片钳进行动物医学研究的同行们,因为植物有细胞壁,研究植物的人必须要先用各种消化酶去除细胞壁后,才可以形成膜片钳技术必须的玻璃电极与细胞膜之间的高阻封接。[align=left]那么,大家可以想象,不用去除细胞壁就可以研究植物与外界环境的离子/分子交换信息,这对于搞植物研究的人该有多么大的吸引力呀!姑且不说,细胞壁作为植物细胞完整结构的一部分,在功能上更是不可或缺的重要环节,将其人为去除后,其结果的理论价值必然大打折扣外,单就技术上给植物学家们带来的简单、便捷和快速,就让大家兴奋不已。[/align] [img]https://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug27IT7uZGkSnBKveX2hqCR3kByLLiaCiciaGpamSXicEKMicmibyic9tTbVLPlg/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][align=center][img]data:image/gif base64,iVBORw0KGgoAAAANSUhEUgAAAAEAAAABCAYAAAAfFcSJAAAADUlEQVQImWNgYGBgAAAABQABh6FO1AAAAABJRU5ErkJggg==[/img][/align][align=center](种康在《Cell》利用NMT发表水稻植物领域文章)[/align]因此,在国际上自从NMT诞生之日起,植物研究学者们对它的追求从来没有逊色于动物医学研究的同行们。而中国自身为农业国,在植物领域的研究底子好,投入又大。可能也加之旭月公司创始人自身的植物研究出身的背景,使得非损伤微测技术在中国的发展一路走来,在植物领域的发展要远远胜于在动物医学的发展,数据显示,在中国科学家至今发表的200多篇NMT应用已发表文献里,80%以上是来自植物领域的研究(数据来自“中关村NMT产业联盟”http://nmtia.org)。[b]2) 科研应用现状[/b]膜片钳技术在这二十几年的发展使其已经深深地融入了全世界生命科研活动的各个方面。在中国也不例外,这些年我国科研人员利用该技术取得了丰硕的科研成果,尤其是植物研究领域,以武维华、种康、刘春明等为代表的科研人员利用膜片钳技术在植物生理生化方面取得了系列世界级的成果。我国的动物医学研究方面,以周专、徐涛、王世强、王立伟、陈丽新、祁金顺等科学家为代表在诸多领域也已处于世界科技前沿。但就我个人在国外多年的所见所闻来看,我国在动物医学方面没有比现在发展的更快更好一些的一个重要原因是中国这方面的人才流失比较严重。我在哈佛、耶鲁等大学见到很多国内培养的膜片钳高手。即:国内培养出来后,在就要出成果的时候,却来到国外为国外的课题所用了。想必周专老师他们对这点肯定有更深更多的感受吧。非损伤微测技术在中国的普及应用,相比膜片钳技术有两个先天不足。一是进入中国要晚近10年的时间;二是没有膜片钳那样一开始便伴随着诺贝尔奖的耀眼光环。但是,非损伤微测技术也有其自身的优势,其一是进入中国适逢国家对基础科研的投入要远远大于90年代膜片钳进入时期;二是有匡廷云、杨福愉、林克椿、叶鑫生、高荣孚、尹伟伦、赵微平、邱泽生等老一辈科学家的鼎力支持。[align=center][img]https://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug2wjQ6aFhplNcl23wiarAqicxyxVibbOMIfrP4Y6ftiaDAchOn8awoaOJ9Tg/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][/align][align=center](来源于网络)[/align]所以,尽管非损伤微测技术进入中国时间不长,但是发展十分迅速,不但以印丽萍、陈少良、沈应柏、许卫峰、罗志斌等中青年科学家,利用非损伤微测技术快速将自身科研提升至世界水平,刚才所列的武维华、王立伟等国内膜片钳技术专家也已利用NMT,并结合膜片钳技术做出了世界一流的科研成果。[b]3) 技术现状[/b]全自动膜片钳虽然已于近年面市,但是传统的膜片钳技术仍然在生理、相关基因功能验证等基础研究领域,发挥着不可替代的作用。而全自动膜片钳虽然提高了数据的单位产出量,但似乎更多地被应用于药物研发、药效评价等应用领域,其对科研基础理论的贡献和潜力还有待于观察。[align=center][img]data:image/gif base64,iVBORw0KGgoAAAANSUhEUgAAAAEAAAABCAYAAAAfFcSJAAAADUlEQVQImWNgYGBgAAAABQABh6FO1AAAAABJRU5ErkJggg==[/img][img]https://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug2aSo6YYWVabuqzRV3dKticXGNNbib3A4WMZAkVqhMibPWm0tAFjWHPPJ3Q/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][/align][align=center](来源于旭月公司网站:http://xuyue.net)[/align]智能自动化的NMT传感器制备装置,已经于2016年在中国市场有售,标志着非损伤微测技术开启了追赶膜片钳自动化的步伐。尽管数据的单位时间产出量,即:高通量并不是非损伤微测技术的优势,但是,鉴于该技术的长处之一就在于它的实时测量,即在正常生理时间尺度内,揭示生物的活体生理功能。相反,将非损伤微测技术与膜片钳技术相比,比较容易一叶障目的误区就是把非损伤微测技术的应用限制在了只是生物膜的层面。其所谓‘成也萧何,败也萧何!’,膜片钳的高阻封接成就了它的单通道测量,但同时也制约了它的测量材料的灵活性。而反观非损伤微测技术,因为不接触被测材料,所以在材料的选择上就有了极大的自由度。特别是近年的科学发现表明,如我在里所述,人类的各种疾病的答案,不在基因层面(半个多世纪寻找癌症基因努力的失败就是例证),甚至不在细胞层面,这就给组织层面的研究打开了广阔的新天地。当我们环顾实验室四周,能够帮助我们研究活体组织的技术凤毛麟角,而像非损伤微测技术这样完全近乎无损的技术更是难觅。加之进一步的研究表明,比如癌症的发生发展是和其组织微环境的改变密切相关,那么,还有什么技术比非损伤微测技术,这一能够在活体状况下检测微环境中各种离子分子活性的技术更合适的呢!山西医科大学的祁金顺教授,利用非损伤微测技术建立起的脑切片组织生理检测试验体系,就是这方面的一个很好的例证(具体描述请浏览: http://e.vhall.com/133934064或http://xbi.org/index.php?option=com_content&view=article&id=516&Itemid=907&lang=cn)。[b]4) 未来趋势[/b]每个技术都有它自己的特色,很难完全取代对方。因此,利用各自优势,膜片钳与非损伤微测技术配合使用将是一个趋势。这里已经有一些尝试,大家可以参考一下相关文献(http://xbi.org)。下面我就几个非损伤微测技术可以弥补膜片钳技术局限的地方跟大家分享一下,以便大家更好地结合两者使用。[align=center][img=,397,211]https://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug2x4Tml1DWpOIDDI3WicJ2o6tvFQYUiaJqfCwnoGdkw1nT5D3wSFghk3Dg/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][/align][align=center][img]data:image/gif base64,iVBORw0KGgoAAAANSUhEUgAAAAEAAAABCAYAAAAfFcSJAAAADUlEQVQImWNgYGBgAAAABQABh6FO1AAAAABJRU5ErkJggg==[/img][/align][align=center](来源于美国扬格公司网站:http://youngerusa.com/)[/align](a)‘零’电流问题如上图所示,当有等电荷的两种离子进出同一片细胞膜的时候,膜片钳技术将检测不到电流。而此刻科研人员可以利用非损伤微测技术的多传感器同时测量优势进行研究。(b)其它离子运输载体和方式的研究我们知道除了离子通道,生物细胞还有其它多种离子转运方式,它们与离子通道一起,共同担负着维持细胞和乃至整个生物体活性的各种生理功能。正如在[url=https://mp.weixin.qq.com/s?__biz=MzA3OTE0NTI3OQ==&mid=2651820382&idx=1&sn=156a5c79f5aba52283f147a9d4cb1e7f&chksm=844cc10eb33b48188af3c5762db8b3b21a30d311c3bbae3f85ad8fd71abbd91872704d321d35&scene=21#wechat_redirect](2)时间与空间[/url]中所说,将PC与NMT这两个跨越不同时间和空间的技术相结合使用,对于我们更加全面的了解生物现象的本质,有着不可替代的作用。(c)分子转运的研究毫无疑问,NMT非损伤微测技术在O2,H2O2,葡萄糖,乙酰胆碱等与生命活动密切相关的小分子,大分子跨膜运输方面,将极大补充PC技术在这方面的不足。(d)物理机械损伤尽管‘高阻封接’成就了PC的单通道测量,但是其巨大的机械损伤,被证明不但是的确存在的,而且的确会产生错误的结果。那么,有另外一个相对独立的技术对PC进行验证,对科学研究的准确性无疑是个巨大利好。[align=left]广州暨南大学的王立伟,陈丽新教授,利用NMT与PC结合,发现并推翻了PC过去错误的结论的故事很好地诠释了这一点。(具体描述请浏览:http://e.vhall.com/133934064[/align][align=left]或 http://xbi.org/index.php?option=com_content&view=article&id=516&Itemid=907&lang=cn)[/align][b]5)结束语[/b] [img=,280,231]https://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug26453BRepj8GYQsp578CpkibGszw4qrzbIkhsyxAH8vJxhAIACpICQjg/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][align=center][img]data:image/gif base64,iVBORw0KGgoAAAANSUhEUgAAAAEAAAABCAYAAAAfFcSJAAAADUlEQVQImWNgYGBgAAAABQABh6FO1AAAAABJRU5ErkJggg==[/img][/align][align=center](来源于网络)[/align]在一次社会名流的聚会上,当有人用略带轻蔑的口吻对发现美洲新大陆的哥伦布说到:“你发现美洲没有什么了不起的,只不过是你的运气比别人好些罢了!”。哥伦布没有马上说什么,而是让人拿来一个鸡蛋向在场的所有人发出挑战,看谁能够把这个鸡蛋立在桌子上。读者们中很多人知道这个故事的结局,就是在这些人费了九牛二虎之力失败之后,哥伦布将鸡蛋的一端击碎后立在了桌子上。Neher和Sakmann发明膜片钳“不过”是在前人电生理的基础上,略微地在玻璃电极与细胞膜接触时施加了一点点负压形成‘高阻封接’而已。同样NMT非损伤微测技术的诞生,Jaffe和Newman他们“也无非” 就是让离子/分子传感器动了起来,进行‘两点测量’而已!但就是这一看似细微的‘高阻封接’,这一看似平常的‘两点测量’,让科学家能够检测到pA(10[sup]-12[/sup])级的微弱单离子通道电流,让科学家能够检测到单个细胞离子(比如Ca[sup]2+[/sup])分子(比如O[sub]2[/sub])的10[sup]-15[/sup]级进出流速。他们就是科学界的哥伦布,帮助科学家们发现了科学世界的新大陆!同学们,老师们,朋友们,现在非损伤微测技术已经来到了你的身边,中国人在一些领域已经实现了弯道超车,能否先于他人把这个‘蛋’矗立在你们各自的研究领域,即是摆在你们面前的挑战,大家准备好了吗?![b]参考文献[/b][list][*]美国对不同研究领域的投入http://www.bu.edu/research/articles/funding-for-scientific-research/[/list][list][*]Verkhratsky, Alexei & Parpura, Vladimir. (2014). History of Electrophysiology and the Patch Clamp. Methods in molecular biology (Clifton, N.J.). 1183. 1-19. 10.1007/978-1-4939-1096-0_1.[/list][list][*]Uncoupling of K+ and Cl- transport across the cell membrane in the process of regulatory volume decrease. Linjie Yang, Linyan Zhu, Yue Xu, Haifeng Zhang, Wencai Ye, Jianwen Mao, Lixin Chen, Liwei Wang. Biochemical pharmacology 84 (3), 292-302[/list][list][*]非损伤微测技术实时检测海马脑片跨膜钙离子流。《生理学报》2017年 第4期 | 李甜 原丽 张军 焦娟娟 祁金顺[*]文中相关文献可以到旭月研究院网站下载: http://xbi.org/index.php?option=com_rsfiles&view=rsfiles&Itemid=304&lang=cn[/list][align=center][img]http://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDF6tmTJTMX4uic43l9icahVSUTxSOVWpIzWuU9op0axQeUZlOd197ib0J6kUyJDXf9MJrWibHg0hicvMCw/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][/align][align=center][/align][align=center][b]旭月版权所有,转载注明出处.[/b][/align][align=center][img=,,130]http://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDFvv5AgpUstNSuO10Yztkuqee9ozBmgmqkRl5Df8F3bvfhr0YroolbwMI0ScicdJDTJyTPYXIc1qvw/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][/align]
如何用普通生物显微镜拍清楚非小细胞肺癌细胞的细胞膜呢
除膜片钳外,能够测定膜电位的仪器及方法有?
我想用液相色谱法测定红细胞膜脂肪酸,想请教一下样品前期怎么处理?哪位高手可以提供具体的步骤,感激不尽!
细胞膜脂肪酸甲酯化要用什么作反应容器?反应液大概1.5ml,看了文献说用反应样品瓶,具体是什么容器?[img]https://ng1.17img.cn/bbsfiles/images/2019/03/201903282206509758_5524_3499435_3.png[/img]
Narishige的[url=http://www.f-lab.cn/stereotaxis/ap-14a.html][b]膜片钳探头固持器适配器AP-14A[/b][/url]用于将Axon膜片放大器连接到强大的万向节。[b]Axon膜片钳探头固持器:适配器-AP-14A[/b]* 可连接的固态万向节:UST-1, UST-2, UST-3 etc.阅读 膜片钳探头固持器汇总表了解所有组合概况。[img=膜片钳探头固持器适配器]http://www.f-lab.cn/Upload/ap-14a_.jpg[/img][b]适配器-AP-14A规格[/b][table][tr][td=1,3]尺寸大小/重量[/td][td]AP-14A[/td][td]宽58 x 深36 x 高9mm, 12g[/td][/tr][tr][td]AP-14L[/td][td]宽65 x 深39 x 高9mm, 15g[/td][/tr][tr][td]AP-14N[/td][td]宽40 x 深21 x 高9mm, 6g[/td][/tr][/table]Line [b]膜片钳探头固持器:适配器-AP-14L[/b]NARISHIGE 的AP-14L适配器用于将Line膜片放大器连接到强大的万向接头。*可连接的固态万向节: UST-1, UST-2, UST-3 etc.阅读 膜片钳探头固持器汇总表了解所有组合概况。[b]适配器-AP-14L规格[/b][table=95%][tr][td=1,3]尺寸大小/重量[/td][td]AP-14A[/td][td]宽58 x 深36 x 高9mm, 12g[/td][/tr][tr][td]AP-14L[/td][td]宽65 x 深39 x 高9mm, 15g[/td][/tr][tr][td]AP-14N[/td][td]宽40 x 深21 x 高9mm, 6g[/td][/tr][/table][b]Nihon Koden [b]膜片钳探头固持器:适配器-AP-14N[/b]NARISHIGE 的AP-14N适配器用于将Nihon Koden膜片放大器连接到强大的万向接头。*可连接的固态万向节: UST-1, UST-2, UST-3 etc.阅读 膜片钳探头固持器汇总表了解所有组合概况。[b][b]适配器-AP-14N规格[/b][/b][/b][table=95%][tr][td=1,3]尺寸大小/重量[/td][td]AP-14A[/td][td]宽58 x 深36 x 高9mm, 12g[/td][/tr][tr][td]AP-14L[/td][td]宽65 x 深39 x 高9mm, 15g[/td][/tr][tr][td]AP-14N[/td][td]宽40 x 深21 x 高9mm, 6g[/td][/tr][/table][b]膜片钳探头固持器适配器[/b]:[url]http://www.f-lab.cn/stereotaxis/ap-14a.html[/url][b][/b]
细胞膜脂肪酸甲酯化要用什么反应容器?反应液大概有1.5ml,有文献说用反应样品瓶,具体是指什么容器?[img]https://ng1.17img.cn/bbsfiles/images/2019/03/201903291023427595_5464_3499435_3.png[/img]
将在药物开发进程中发挥重要作用2011年03月26日 来源: 科技日报 作者: 常丽君 本报讯 据每日科学网近日报道,美国范德堡大学研究人员开发出一种新型激光技术,可检测细胞膜上的蛋白质和其它多种生物分子之间的相互反应。这种检测将在药物开发进程中发挥重要作用。 人类细胞中约有7000种蛋白质,其中30%在细胞膜上,控制细胞分子运作机制的信号有60%—70%由这些膜蛋白产生,因此当前市场上约一半的药物都是瞄准细胞膜蛋白。但因为膜蛋白很难提纯,科学家在研究它们的结构时面临很多困难。现有的检测膜手段大多是将膜蛋白从其所处环境中分离,或用不同方式如荧光标签加以修改,以分析它们的活性。这些方法不仅昂贵耗时,还可能会影响目标膜蛋白的功能。 范德堡大学化学生物研究院化学教授达里尔·波恩霍普领导的研究小组和斯克里普斯研究院合作,开发了一种名为“后向散射干涉仪”(BSI)的新型激光技术,能精确检测出膜蛋白和自然界中各种分子之间的结合力。 BSI操作起来很简单,只要把两种分子混合装入一个充满液体的显微镜小盒中,用一束类似于条形码扫描仪的红色激光照射,就能测出它们之间的结合力。小盒的几何形状调整合适后,激光就会产生干涉图案,而这种干涉图案对分子之间的反应非常敏感。如果分子开始互相作用,图案就开始变换。 为了检验BSI的准确性,研究人员制造了一种含有GM1小蛋白质的合成膜,霍乱毒素要进入细胞,主要结合对象就是这种小蛋白质。他们把霍乱毒素B和这些膜混合,检测出的结合力结果与用其他方法所得到的结果一致。为了进一步确认,他们还用了一种和胸腺癌相关的天然分离膜和3种分别与疼痛、发炎和神经传导素GABA(用于放松、睡眠和调节紧张)相关的蛋白质膜进行检验,把包含这些蛋白质的膜和对应结合分子相混合,用BSI技术测得的值也和用其他方法得到的结果一样。 此外,该技术进入商业化也前景广阔,范德堡大学对新型激光检测技术已申请了专利,并已获得3项批准。他们还专门成立了一家分子传感公司对新技术进行独家开发。
测红细胞膜表面DHA DHA的分离度不是很好 怎么解决?
有人用过美国Axopatch 200B膜片钳没啊?最近在文献中查到美国Axopatch 200B膜片钳,我是做nanopore检测的,想问一下这个价格大概多少~谢谢~
请问有没有人做过红细胞膜脂肪酸的检测啊?例如检测其中反式脂肪酸,用什么方法比较好?可以用液相色谱么?
用[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]气质联用仪[/color][/url]测红细胞膜脂肪酸,参考文献里有20种脂肪酸,我只测出了7种脂肪酸,是不是甲酯化方法不好?我用的甲酯化方法是:取分离好的红细胞样本各50μL,依次加入已用BHT乙醇溶液抗氧化处理过的具塞玻璃试管中;在具塞玻璃试管中加入400μL3N盐酸-甲醇溶液,充分混匀3分钟,然后放置于90℃烘箱中避光反应3小时,反应完毕后取出冷却至室温;加入正己烷800μL到具塞玻璃试管中,充分混匀5分钟,4000rpm/min,2-8℃离心5min;将离心后的上层正己烷溶液尽量完全转移至另一个1.5ml离心管中,室温环境下,用氮气吹干仪吹干;在氮气吹干后的离心管中加入正己烷400μL溶解脂肪酸甲酯产物,充分混匀3分钟,然后转移100μL至样品瓶中,待测。
求购二手膜片钳Axon 200B,二手的能用就可以~~~有闲置的,打算卖的,可留言微信号,加微信详聊,谢谢~
细胞转染获得了解活体大脑神经元内部运作机制的途径可为我们提供大量有用的信息:它的电活动模式,甚至在某个指定时刻基因的开关图谱。然而达到这一目标却是一个极其艰苦的任务,它被认为是掌握一门艺术;由于非常难于学习当前世界上只有少数实验室能够对其进行实践操作。然而这一情况将很快会得到改变:来自麻省理工学院和佐治亚理工学院的研究人员开发出一种新方法实现了在活体大脑中自动化寻找和记录来自神经元的信息。研究人员利用单细胞检测计算机运算控制单个机器手臂,以相比人类试验操作人员更高的精确度和速度鉴别和记录下了活体小鼠大脑中的神经元。相关论文发布在5月6日的《自然方法》(Nature Methods)杂志上。新的自动化程序无需数月的培训,质粒构建提供了长期以来寻求的关于活细胞活动的信息。利用这一技术,科学家们能够鉴别出大脑中数千种不同的细胞类型,绘制出它们相互联系的图谱,并找出疾病细胞与正常细胞的差异。这一项目是由麻省理工学院生物工程学和大脑与认知科学副教授Ed Boyden与佐治亚理工学院机械工程学院助理教授Craig Forest协作完成。“我们的研究团队从开始就一直从事跨学科研究,这使得我们能够将精密机械设计的原理带到活体大脑研究中,”Forest说。他的研究生Suhasa Kodandaramaiah是文章的主要作者,作为访问学者已在麻省理工学院开展了两年的研究工作。这一技术尤其适用于研究诸如精神分裂症、帕金森氏症、自闭症和癫痫等大脑疾病。Boyden说:“在所有这些情况下,对单个细胞的电及回路特征进行分子描述……一直难以实现。如果我们真的能够描述活体大脑特异细胞中疾病改变分子的机制,就有可能发现更好的药物靶点。”Kodandaramaiah、Boyden 和 Forest着手于研究让一种已有30年历史的技术——全细胞膜片钳(whole-cell patch clamping)自动化。全细胞膜片钳技术是通过将一个微小的空心玻璃吸管与神经元细胞膜接触,然后打开细胞膜上一个小孔来记录细胞中电活动的方法。通常一个研究生或博士后需要数月的时间才能学习掌握这项技术。 Kodandaramaiah花了大约四个月的时间学习手动膜片钳技术,这让他认识到这一技术非常难以掌握。“当我相当出色地掌握了这一技术时,我感到虽然它是一种艺术形式,也可将其变为一套定型任务,并通过机器人执行决策。”为此,Kodandaramaiah通过动物实验,可以微米精确度将一个玻璃吸管置入麻醉小鼠大脑。随着移动,吸管监测了细胞的电阻抗性——测量电流出吸管的难度。如果周围没有细胞,电流动且阻抗低。一旦吸管尖头接触到细胞,电流将无法流动,阻抗会升高。
[b][url=http://www.f-lab.cn/cell-analyzers/puncher.html][b]单细胞转移分离系统[/b][/url]是可用于单细胞转移,单细胞分离和单细胞隔离,单细胞成像应用的多功能单细胞分离操作仪器,它可以实现从微孔芯片转移单细胞到细胞收集管中。单细胞转移分离系统[/b][color=#666666]集单细胞成像,单细胞隔离,单细胞选择功能于一体,自动聚焦成像。[/color][b]单细胞转移分离系统转移单细胞到Eppendorf微管,PCR微孔板或其它反应微管中,[/b][color=#666666]在隔离单细胞后,它可以对选定收集的细胞进行扫描并成像。[/color][b]单细胞转移分离系统[/b][color=#666666]采用Nikon Ti-2倒置荧光显微镜,配备自动扫描显微镜载物台,自动聚焦器件,高灵敏度荧光CCD相机和LED激发光源组建而成。[/color][img=单细胞转移分离系统]http://www.f-lab.cn/Upload/single-cell-isolation.JPG[/img][b]单细胞转移分离系统[/b]特点完全自动化,步进系统高质量单细胞荧光成像单细胞分离的效率超过90% 超过70%分离的细胞增殖 分离后兼容所有的单细胞的WGA工具包(放大器的‐1,picoplex,复制‐G)实惠微Wells基于硅微孔微腔。由薄膜封闭70µ m,井底直径(1µ m),包含一个单孔。样品流体进入威尔斯并从底部的孔隙中流出。单个细胞被拖着走。一旦单个细胞降落到孔隙上,流动停止,其他细胞就不会进入井内。有用的细胞被识别出来。选定的细胞穿孔从微孔到384孔PCR板或离心管等等。单细胞转移分离系统:[url]http://www.f-lab.cn/cell-analyzers/puncher.html[/url]
原标题 “纳米生物间谍”技术能进入活细胞取样 可用于深入揭示线粒体基因组变异的重要性 科技日报讯 据物理学家组织网近日报道,美国加利福尼亚大学圣克鲁兹分校(UCSC)研究人员开发出一种机器人式的“纳米生物间谍”系统,能从单个活细胞内提取出微量样本,进行RNA或DNA测序,而不会杀死细胞。研究人员表示,这种单细胞“纳米生物间谍”技术是一种了解活细胞内部动态过程的有力工具。相关论文发表在最近出版的美国化学协会《纳米》杂志上。 “我们能从活细胞中拿走一个‘生物间谍’,再把它送回该细胞,在几天内这样重复多次而不会杀死细胞。如果用其他技术,你不得不牺牲这个细胞才能分析它。”该生物传感与生物电技术小组负责人、UCSC巴斯金工程学院生物分子工程教授内德·波曼德说。 “纳米生物间谍”平台是研究小组用纳米吸液管开发的最新设备。纳米吸液管是一种小玻璃管,取液端越来越细,至尖端直径仅50到100纳米。波曼德说:“我能在实验室造出纳米吸液管,这不需要昂贵的纳米制造设备。但要进入一个细胞,问题是即使在高倍显微镜下,你也看不见吸液管尖端,不知道它偏离了细胞有多远。” 实验室博士后研究员亚当·赛格尔解决了这一问题。他基于在一台改造过的扫描离子电导显微镜(SICM),开发出一种反馈控制系统。该系统能利用通过纳米吸液管尖端的离子流作为反馈信号,在尖端接近细胞表面时探测其中的液滴。在尖端进入细胞之前,一种自动控制系统能定位它在细胞上面的位置,然后尖端很快插入穿透细胞膜,通过操控电压有控制地提取一小点细胞内物质。由于吸液管尖端极精细,对细胞造成的损害极微小。 研究小组用这种系统从活细胞中提取的微量细胞物质,估计只有50毫微微升(千万亿分之一升),约一个人体细胞百分之一的量。他们从单个人体癌细胞中提取物质并进行RNA测序,还从人类成纤维细胞中提取了线粒体并对其进行了DNA测序。“人们已经知道,线粒体和多种神经退化疾病有关。该技术可用于深入揭示线粒体基因组变异的重要性。”波曼德说。 该技术应用前景广阔。波曼德希望能与其他研究人员合作,探索其更多用途。“对于癌症生物学家、干细胞生物学家等想要了解细胞内部情况的科学家来说,这是一种多功能的平台。”(常丽君)来源:中国科技网-科技日报 2014年01月20日
美国科学家彼得阿格雷博士因找到了允许水分子出入的细胞膜蛋白“水通道”,而荣获2003年度诺贝尔化学奖,但该通道的具体工作机制却一直是未解之谜。记者近日从中科院上海应用物理研究所获悉,我国科学家在此基础上续写下文,发现这种纳米级水通道上具有两把“锁”,分别通过力学和电学开关机制控制着水分子进出。该研究成果已发表在国际权威学刊《美国科学院院刊》(PNAS)在线版上。 在生物体内,蛋白水通道和周围的水溶液中都存在电荷。在纳米和分子尺度上,这些通道因为热噪音效应引起力学形变和电荷移位,这会否影响水通道的开或关?上海应用物理所方海平课题组与浙大、浙江师大、IBM公司研究所和哥伦比亚大学科研人员合作,采用纳米级“碳管”作为生物膜蛋白水通道的简化模型开展研究,结果发现,水分子在通过水通道时,不仅对作用在水通道管壁上的力学响应具有开关特性,对管壁上的电荷响应也有极好的开关特性。研究表明:有效力学信号会导致管壁产生足够大的形变,由此带来开或关的状态变化;而只有在水分子与外界电荷的作用距离非常接近时,通道才会响应,迅速开或关。 专家认为,这一新发现的机制不仅对生物化学有意义,对设计人工分子机器也具有一定启示性。来源:解放网-解放日报
细胞是如何出口和嵌入蛋白于细胞膜Grenoble, 12 December 2010 How cells export and embed proteins in the membraneEMBL scientists first to visualise crucial stephttp://www.embl.de/aboutus/communication_outreach/media_relations/2010/101212_Grenoble/index.htmlLike an overprotective parent on the first day of school, a targeting factor sometimes needs a little push to let go of its cargo. Scientists at the European Molecular Biology Laboratory (EMBL) in Grenoble, France, have visualised one such hand-over. They were the first to determine the structure of a ribosome-protein complex involved in carrying nascent proteins out of the cell. Their work, published online today in Nature Structural and Molecular Biology, could increase understanding of illnesses such as cystic fibrosis and some forms of Parkinson’s disease, in which improper protein targeting leads proteins to harmfully accumulate inside cells.In most organisms, proteins destined to cross or be embedded in a membrane contain a polypeptide sequence that is recognized during translation by a targeting factor known as the signal recognition particle (SRP). SRP binds to the ribosome synthesizing the polypeptide, and subsequently also binds an SRP receptor, located next to the machinery that transfers proteins across the membrane and out of the cell. EMBL scientists have now generated the first-ever structural image of this important step in the process.“The SRP receptor acts as a switch between the cargo binding and the release,” says Christiane Schaffitzel, who led the research at EMBL, “Now we have seen for the first time how the release can happen at a molecular level.”Schaffitzel’s group is taking structural snapshots of entire pathways by which proteins are synthesized and targeted to their final positions. To capture this hand-over step, the scientists had to overcome the fact that the link between SRP and its receptor is usually transient, chemically unstable. They engineered the SRP receptor so that it would bind more stably to SRP, then introduced ribosomes and observed the resulting complexes using cryo-electron microscopy (cryo-EM).Cryo-EM can be performed in roughly physiological conditions, providing a picture that closely resembles what happens in living cells. This picture can then be combined with higher-resolution crystallography data and biochemical studies – an exciting hybrid approach the EMBL scientists will further exploit to follow protein targeting all the way from start to finish.A particular asset for success in this project was the close collaboration with Guy Schoehn at the Institut de Biologie Structurale (IBS). IBS and EMBL are part of the Partnership for Structural Biology (PShttp://i.0dxy.cn/images_new/smiles/smile_blackeye.gif in Grenoble, France.Source ArticleEstrozi, L.F., Boehringer, D., Shan, S., Ban, N., Schaffitzel, C.. Cryo-EM structure of the E. coli translating ribosome in complex with SRP and its receptor. Nature Structural and Molecular Biology, Advance Online Publication 12 December 2010. DOI: 10.1038/nsmb.1952.
中国科技网讯 据物理学家组织网近日报道,美国麻省理工学院和佐治亚理工学院研究人员开发出利用机器人操纵来自动发现和记录活体大脑中神经元信息的方法,即用一种全细胞膜片钳制动一个微小的空心玻璃针,在神经细胞的膜上开孔,以记录其内部电活性。该研究成果刊登在5月6日《自然·方法》期刊上。 这种深入大脑中神经元内部运作的方式可提供大量有用的信息,如电活性模式、细胞内部状况、甚至基因在某一时刻被闭合的剖面。然而,能够实现这个入口非常困难,目前世界上只有极少数实验室在进行尝试,这种自动发现和记录活体大脑中神经元信息的最新方法有望改变该领域研究现状。研究人员证明,在一个细胞检测的计算机程序的引导下,与人工相比,该自动装置识别和记录活老鼠大脑中的神经元信息具有更好的精度和速度。 采用新型自动化装置消除了对活体细胞的活动进行数月定向和长期搜索的需要。采用这种技术,科学家可将大脑中数千个细胞划分成不同类型,还可绘制其彼此之间的连接,并从正常细胞中找出病变细胞。 研究人员称,该方法在研究大脑疾病方面将会尤其有用,如精神分裂症、帕金森氏症、自闭症和癫痫。科学家们一直难以描述这些疾病中一个细胞与其具有电活回路和性能的分子集成。描绘出疾病如何改变活体大脑内特定细胞分子,将会更好地发现药物的靶标。 如果通过人工对这种精密仪器进行操作,需花上4个月的训练时间,最终还可能不是很精准,于是研究人员将这项任务交与机器人来操作,其机械手臂由计算机程序做指导。研究人员说,在神经科学中使用机器人来研究有生命的动物还仅仅是个开始,而像这样的机器人可能被用于在大脑中有目标点地注入药物,或提供基因治疗载体,希望新方法也能激励神经学家追求各类机器人自动化,例如在光遗传学方面,利用光有针对性地干扰神经回路和确定神经元在大脑功能中发挥的因果作用。(记者 华凌) 《科技日报》(2012-05-11 二版)
[align=left][b]活体研究智能传感技术的演进(2)[b]时间与空间[/b][/b][/align][align=left]作者:许越 [url=https://mp.weixin.qq.com/s?__biz=MzA3OTE0NTI3OQ==&mid=2651819860&idx=1&sn=0c4df0710b0519d9dc4a43b08c9cbd23&chksm=844cdf04b33b5612eb56793dba3143bbd3597a25facb5fe6be07588a611c9c2239f313cec201&scene=21#wechat_redirect]“点击查看作者自传”[/url][/align][b][b][b][color=#a5a5a5]许越,男,1967年生于北京。[/color][/b][/b][/b][list][*][color=#a5a5a5][color=#888888]于[/color][color=#888888]1993[/color][color=#888888]年和[/color][color=#888888]2000[/color][color=#888888]年分别获得首都师范大学及美国麻省州立大学,植物生理学双硕士学位。[/color][/color][*][color=#a5a5a5][color=#888888]2001[/color][color=#888888]年在美国创建基于[/color][color=#888888]NMT[/color][color=#888888]技术的美国扬格公司,次年运用[/color][color=#888888]NMT[/color][color=#888888]服务于设立在美国北卡州立大学的美国航空航天局[/color]([color=#888888]NASA[/color])[color=#888888]空间植物学研究项目。[/color][/color][*][color=#a5a5a5][color=#888888]2005[/color][color=#888888]年成立旭月(北京)科技有限公司,在匡廷云院士、杨福愉院士和林克椿教授的帮助,以及各级政府的大力支持下,将非损伤微测技术引进中国大陆。[/color][/color][*][color=#a5a5a5][color=#888888]2014[/color][color=#888888]年带领旭月团队提出被誉为“第二个人类基因组计划”的“动态分离子组学([/color][color=#888888]imOmics[/color][color=#888888])”创新概念,同年成立旭月生物功能研究院。[/color][/color][*][color=#a5a5a5][color=#888888]2015[/color][color=#888888]年推出世界领先的“自动化非损伤微测系统”,并倡导建立中关村[/color][color=#888888]NMT[/color][color=#888888]产业联盟,开启以水安全、个体化精准医疗、粮食安全等民生应用为代表的[/color][color=#888888]NMT[/color][color=#888888]产业化进程。[/color][/color][*][color=#a5a5a5][color=#888888][color=#a5a5a5] 截至2016年,已帮助国内400多个科研单位及实验室,利用NMT实现了科研水平的跨越式发展。[/color][/color][/color][/list]时间分辨率和空间分辨率,指的是一个检测技术能够在时间和空间上提供的最小分辨单位或数值。列文虎克(Anthony Von Leeuwenhoek)发明的能够看到活细胞的显微镜,就是在人类观察世界的空间分辨率上的一次大的提升。膜片钳技术之所以能够在90年代获得诺贝尔奖,一个很重要的原因就是它将人类对世界的感知能力,在时间分辨率上提升到毫秒级别,在空间分辨率上细小到微米级以下(请见下表),而且是对生物活体进行检测。[b][b] [img=,694,274]https://mmbiz.qpic.cn/mmbiz_png/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug2kotPNzq90MdWicyeLWDCA6AciawYPkflWchjSDjbjQHRqAb4dgq9kjibw/640?wx_fmt=png&wxfrom=5&wx_lazy=1[/img][/b][/b][align=center](非损伤微测技术与膜片钳及荧光等化学技术在时间空间分辨率上的区别。来源于旭月研究院 http://xbi.org)[/align][b][b][/b][/b][align=center][/align][color=#ff0000]1)时间[/color][align=center][img]https://mmbiz.qpic.cn/mmbiz_png/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug2fQATMY9iagCFuceSqsLf75Y9sdE4M3jGIVucKibMiaxHJ4Bjler2JvQhg/640?wx_fmt=gif&wxfrom=5&wx_lazy=1[/img][img]data:image/gif base64,iVBORw0KGgoAAAANSUhEUgAAAAEAAAABCAYAAAAfFcSJAAAADUlEQVQImWNgYGBgAAAABQABh6FO1AAAAABJRU5ErkJggg==[/img][/align][align=center](膜片钳技术典型数据图。来源于网络)[/align]膜片钳技术可以轻而易举地捉捕到毫秒级(ms)的离子通道的开放和关闭。这点让依靠反应时间最快也需要秒级的NMT离子分子传感器的非损伤微测技术望尘莫及。即使有的NMT分子传感器,比如O2传感器反应速度可以达到0.8秒(800ms),但面对离子通道的开关研究也无能为力。[b][b] [img]https://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug29icHHJJDnWFQCqa882XZvLda0XsvxbptGC2nVsWbfAaUDr1cnyLVbSQ/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][/b][/b][align=center][img]data:image/gif base64,iVBORw0KGgoAAAANSUhEUgAAAAEAAAABCAYAAAAfFcSJAAAADUlEQVQImWNgYGBgAAAABQABh6FO1AAAAABJRU5ErkJggg==[/img][/align][align=center](非损伤微测技术典型数据图。来源于网络)[/align][align=center][/align]然而,如果我们的科研需要几十分钟,几小时,甚至几十小时地跟踪研究活体材料的离子/分子活动,非损伤微测技术的时间方面的优势就体现了出来。因为只要科研人员有办法保持样品的活性,由于NMT传感器不和被测材料进行接触,所以时间上对非损伤微测技术就不是一个制约因素。有时即使NMT流速传感器在实验过程中失效了,或不小心损坏了,没有关系,马上换上一个好的传感器就是了,只要你的样品还正常就没有问题。[b][b][color=#ff0000]2)空间[/color][/b][/b]膜片钳技术通过全细胞等多种灵活的记录方式(见下图),极大地丰富了膜片钳与被测材料之间的空间关系,但是由于该技术对玻璃电极与材料之间高阻封接的必须要求,使得膜片钳技术对于大于微米材料的操作显得力不从心。[b][b][/b][/b][align=center][img]https://mmbiz.qpic.cn/mmbiz_png/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug2TO5xCab6Y9ibT4BYkgUWvyxZBlkp6gRiboialWGSUCB2FcOSeiaWFPBKHw/640?wx_fmt=gif&wxfrom=5&wx_lazy=1[/img][img]data:image/gif base64,iVBORw0KGgoAAAANSUhEUgAAAAEAAAABCAYAAAAfFcSJAAAADUlEQVQImWNgYGBgAAAABQABh6FO1AAAAABJRU5ErkJggg==[/img][/align][align=center](膜片钳技术的多种测量构形。来源于网络)[/align]非损伤微测技术由于不需要接触被测材料,因此在被测材料的选择,特别是材料大小上面,相比膜片钳就有了非常大的自由度(见下图)。比如,最近面市的‘NMT活体生理检测仪’可以检测从微生物群体,一直到小型个体(如斑马鱼)的各种大小材料离子/分子的进出情况。[b][b][/b][/b][align=center][img]data:image/gif base64,iVBORw0KGgoAAAANSUhEUgAAAAEAAAABCAYAAAAfFcSJAAAADUlEQVQImWNgYGBgAAAABQABh6FO1AAAAABJRU5ErkJggg==[/img][img]https://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug2ef0ibeIqFdGZicpq4C1ONkWPjTS1gTCZ1krZPnbqYqSOsyQ2uXQcPibTA/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][/align][align=center][img]https://mmbiz.qpic.cn/mmbiz_png/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug284zhs9Mj1EIHaLMza2ZdqKc1ZYoDpMe00zm4GRnQyic0Czia471m22hQ/640?wx_fmt=png&wxfrom=5&wx_lazy=1[/img][/align][align=center][img]data:image/gif base64,iVBORw0KGgoAAAANSUhEUgAAAAEAAAABCAYAAAAfFcSJAAAADUlEQVQImWNgYGBgAAAABQABh6FO1AAAAABJRU5ErkJggg==[/img][/align][align=center][img]https://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug2PgibOksfsIs4g0yEKg3Auqktj24lT28aePO0icUdaBT9Ev8cXBUbbQvA/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][img]data:image/gif base64,iVBORw0KGgoAAAANSUhEUgAAAAEAAAABCAYAAAAfFcSJAAAADUlEQVQImWNgYGBgAAAABQABh6FO1AAAAABJRU5ErkJggg==[/img][/align][align=center][img]https://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug2iaqt0YIY3kYSX2dMRpnso6GtKTWicI47ibx5hvP36UIM4rCgkoZYl4Jiag/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][/align][align=center][img]https://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug2OauXy22ibCp4ngxtUhxEwYhdhdYrfmeVSvboKw8npbGgXUiceoibma0Tw/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][/align][align=center][img]https://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug2naZOUCNBiae6CyDnnbGqsWZ3LFYjM2QssLibjleWxicg6ptrp7BzxdbZA/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][/align][align=center][img]https://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug20rJ8SDnjW63vh60Bd3kiaiaia60Xufia65HF2Tviaf6rruxYs4eKI9XEt3Q/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][img]data:image/gif base64,iVBORw0KGgoAAAANSUhEUgAAAAEAAAABCAYAAAAfFcSJAAAADUlEQVQImWNgYGBgAAAABQABh6FO1AAAAABJRU5ErkJggg==[/img][/align][align=center][img]data:image/gif base64,iVBORw0KGgoAAAANSUhEUgAAAAEAAAABCAYAAAAfFcSJAAAADUlEQVQImWNgYGBgAAAABQABh6FO1AAAAABJRU5ErkJggg==[/img][/align][align=center][img]data:image/gif base64,iVBORw0KGgoAAAANSUhEUgAAAAEAAAABCAYAAAAfFcSJAAAADUlEQVQImWNgYGBgAAAABQABh6FO1AAAAABJRU5ErkJggg==[/img][/align][align=center][/align][align=center][img]https://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug21up5ZK2Sz8hPbubNosQh0ibic6CjicRt8sMJG6wwLD5evRa84CbHt9TAg/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][/align][align=center][img]https://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug2l1RKX0xF7x1e7nRFwlPufwgKnXXL68sorpFCHiaiamqp775HRnyyqfUw/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][/align][align=center][img]https://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDEbuf6P7NZBiavESu2yf2ug29ibs6mxnicDhpfXFgZYPePFKj2V5iayNpvDsyntbnWjOFSML74rgEjYHA/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][/align][align=center](非损伤微测技术可以测试的各种活体材料举例。来源于旭月研究院htt://xbi.org )[/align]膜片钳与非损伤微测技术在时间和空间分辨率上面各有千秋,可以根据科研需要进行合理选择。有时也可以联合应用则能够更加说明问题,不但两者在时间和空间上可以相互印证,而且非损伤微测技术所测得的离子信号是除离子通道在内,还包含有离子载体和转运体等多种离子运输载体的共同贡献。同时还有多糖吸附,细胞或组织表面的电化学作用,以及各种离子分子相互影响的物理,生物和化学的综合作用的结果。因此也是更加贴近真实的生理状态的结果。还有就是我们可以人为设计这些样品的检测环境,使其更加接近它们真正的活体状态。别忘了,毕竟您手中握有的是非损伤微测技术![b][b][color=#ff0000]3)引发其他联想[/color][/b][/b]这里有很多时候没有引起生命科学工作者足够重视的两个地方:1.生物体是多维的立体空间结构,生命活动和生理现象发生在不同的时间尺度2.每一项技术都有其在时间分辨率和空间分辨率上的特色或极限 具体而言:1.生物体是多维的立体空间结构,生命活动和生理现象发生在不同的时间尺度随着60年代DNA概念的提出,80年代生物化学的迅速崛起,90年代分子生物学的风靡全球,到近些年各种组学的盛行,科学界一部分人似乎认为只要搞定生命的各种组成成份,就可以解决人类的生老病死等等一切问题了。然而,半个世纪之后,人们终于承认人类寻找癌症等病魔的开关基因是不存在的。前一段时间,某些企业想通过基因序列为社会提供疾病/健康预测的服务尝试,也被以美国FDA为首的各国医药管理部门叫停,原因就是这些静态成份数据不足以支持建立基因组成与各种疾病之间的必然联系。也就是说,忽视生物体的在时间和空间上多维度的特点,所得到的结果也必然不能够反映生命活动的根本真实面目,其衍生的各类实际应用也必然是空中楼阁。2.每一项技术都有其在时间分辨率和空间分辨率上的特色或极限也正是由于相当一段时间以来,以生物化学,分子生物学和现在的各种组学为代表的,在生物体成份研究为主导的学科教育和科研大环境下,使得很多从事生命科学研究工作的朋友们,对于某一项技术的时间和空间分辨率定位不是很敏感。现实是,如图5所示,当NMT非损伤微测技术告诉你,它所涵盖的时间和空间分辨率既不同于膜片钳技术,也有别于其它荧光和放射性物质技术的时候,你的眼睛是否豁然一亮,因为在你面前出现了一个崭新的、宽阔无垠的科研蓝海!道理很简单,就是你将揭示前人从未涉足的生命现象领域,就像当年的列文虎克一样。参考文献1)旭月研究院网站 http://xbi.org2)美国扬格公司网站:http://youngerusa.com3)印莉萍, 上官宇, 许越. 非损伤性扫描离子选择电极技术及其在高等植物研究中的应用. 自然科学进展. 2006, 16(3):262-266.4)丁亚男,许越.非损伤微测技术及其在生物医学研究中的应用.物理. 2007, 36(7): 548-558.[align=center][img]http://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDF6tmTJTMX4uic43l9icahVSUTxSOVWpIzWuU9op0axQeUZlOd197ib0J6kUyJDXf9MJrWibHg0hicvMCw/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][/align][align=center][b]旭月版权所有,转载注明出处.[b][/b][/b][/align][align=center][b][b][img=,,130]http://mmbiz.qpic.cn/mmbiz_jpg/iaFShJzBuGDFvv5AgpUstNSuO10Yztkuqee9ozBmgmqkRl5Df8F3bvfhr0YroolbwMI0ScicdJDTJyTPYXIc1qvw/640?wx_fmt=jpeg&wxfrom=5&wx_lazy=1[/img][/b][/b][/align]
[size=15px][color=#333333]细胞的机械特性对其生物学功能(如增殖、分化和凋亡)和形态状态(如迁移、附着和病理状态)至关重要。目前常用的细胞弹性模量测量技术包括原子力显微镜、微管吮吸、光镊和磁镊等。这些技术可以有效测量单个细胞的机械性质,但是通量低,限制了其实际应用。[/color][/size][size=15px][color=#333333]近年来,微流控芯片因其在小体积液体操控方面的独特优势,也被用于测量细胞弹性模量。现有的微流控芯片主要侧重于平台开发,虽然通量大幅提高,但很少将测量后的细胞进一步收集以实现后续分析。[/color][/size][size=15px][color=#333333]单细胞分析技术的发展要求能够准确地打印单个细胞。传统单细胞打印技术包括荧光激活细胞分选、有限稀释和手动细胞挑选,这些方法打印效率较低且难以实现自动化。[/color][/size][font=mp-quote, -apple-system-font, BlinkMacSystemFont, &][size=15px][color=#333333]近年来,各种微流控技术被开发用于高通量精确打印单个细胞,如喷墨打印、精确分配、双阀门筛选和移液管式单细胞分离等。这些技术可以根据目标细胞的荧光、形态等特征进行识别并打印,但是大多技术难以获得单细胞的机械信息。[/color][/size][/font][font=mp-quote, -apple-system-font, BlinkMacSystemFont, &][size=15px][color=#333333]因此,本研究报道了一款基于 U 型阵列的微流控系统,集成了单细胞连续捕获,弹性测量和可寻址打印。该装置在研究细胞力学与其他生物学特性的关系方面具有强大的应用潜力。[/color][/size][/font][b]研究内容[/b][size=15px]近日,哈尔滨工业大学(深圳)[color=#004976][b]陈华英课题组[/b][/color]在英国皇家化学会(RSC)期刊[color=#004976][b] Lab on a chip[/b][/color] 上发表题为“Continuous trapping, elasticity measuring and deterministic printing of single cells using arrayed microfluidic traps” ([color=#007aaa]《单细胞连续捕获、弹性模量测量和可寻址分选打印》[/color])的研究论文,报道了一款创新的微流控芯片,实现了基于精确调节的压力对微球/细胞进行捕获和逐个打印,并将已知弹性模量的单细胞确定性地打印到孔板中(图 1)。[/size][size=15px]该论文第一作者是哈工大(深圳)在读硕士研究生[color=#004976][b]蔡逸珂[/b][/color]和硕士毕业生[color=#004976][b]余恩[/b][/color]。[color=#004976][b]陈华英副教授[/b][/color]为通讯作者。[/size][img=图片]https://img1.17img.cn/17img/images/202403/uepic/b3ebc9a4-6d42-4ef1-bfd0-c7cf1f5c3a15.jpg[/img]微流控芯片(图 1A)由冲洗入口、样品入口、打印入口、压力维持口和两个平行的主通道组成,下游有打印出口。在所有入口通道中设计了宽度从 200μm 减小到 25μm 的微通道阵列,以过滤介质中较大的颗粒/细胞碎片。如图 1A 和 B 所示,在每个主通道的一侧有 16 个 U 型捕获陷阱,且吮吸通道的高度比分流通道的高度低 15 μm,以保证细胞停留在 U 型陷阱中并诱导其微小变形。[img=图片]https://img1.17img.cn/17img/images/202403/uepic/b3ee5e4c-b99c-4b5e-8904-b5a6d2817633.jpg[/img][table=677][tr][td=1,1,5]▲[/td][td=1,1,549][b]图1[/b] 单细胞连续捕获、弹性测量和可寻址打印系统。(A)微流控芯片连接到压力泵,将单细胞精确分配到孔板中;(B)通过调节打印压力(Po)捕获(Pi-Po0)和释放(Pi-Po0)单个细胞的机制;(C)用于捕获和分离细胞的吮吸通道;(D)用于捕获和分离微球的分流通道。[/td][/tr][/table][来源:陈华英团队 RSC英国皇家化学会][align=right][/align]
[b]活体研究智能传感技术的演进(4)优势对比[/b]作者:许越 [url=https://mp.weixin.qq.com/s?__biz=MzA3OTE0NTI3OQ==&mid=2651820382&idx=2&sn=b59711014ab3bac4117cfe0f115a62da&chksm=844cc10eb33b48181a6e3cd18f734ae66f9059d781d54320e045b89677bd8bb7943c8bb0df6c&scene=21#wechat_redirect]点击查看作者自传[/url][align=center][/align][b][color=#a5a5a5]许越,男,1967年生于北京。[/color][/b][list][*][color=#a5a5a5][color=#888888]于[/color][color=#888888]1993[/color][color=#888888]年和[/color][color=#888888]2000[/color][color=#888888]年分别获得首都师范大学及美国麻省州立大学,植物生理学双硕士学位。[/color][/color][*][color=#a5a5a5][color=#888888]2001[/color][color=#888888]年在美国创建基于[/color][color=#888888]NMT[/color][color=#888888]技术的美国扬格公司,次年运用[/color][color=#888888]NMT[/color][color=#888888]服务于设立在美国北卡州立大学的美国航空航天局[/color]([color=#888888]NASA[/color])[color=#888888]空间植物学研究项目。[/color][/color][*][color=#a5a5a5][color=#888888]2005[/color][color=#888888]年成立旭月(北京)科技有限公司,在匡廷云院士、杨福愉院士和林克椿教授的帮助,以及各级政府的大力支持下,将非损伤微测技术引进中国大陆。[/color][/color][*][color=#a5a5a5][color=#888888]2014[/color][color=#888888]年带领旭月团队提出被誉为“第二个人类基因组计划”的“动态分离子组学([/color][color=#888888]imOmics[/color][color=#888888])”创新概念,同年成立旭月生物功能研究院。[/color][/color][*][color=#a5a5a5][color=#888888]2015[/color][color=#888888]年推出世界领先的“自动化非损伤微测系统”,并倡导建立中关村[/color][color=#888888]NMT[/color][color=#888888]产业联盟,开启以水安全、个体化精准医疗、粮食安全等民生应用为代表的[/color][color=#888888]NMT[/color][color=#888888]产业化进程。[/color][/color][*][color=#a5a5a5][color=#888888][color=#a5a5a5]截至2016年,已帮助国内400多个科研单位及实验室,利用NMT实现了科研水平的跨越式发展。[/color][/color][/color][*][b]膜片钳优势[/b]、[*][align=left][b][color=#ff0000]时间分辨率高[/color][/b][/align][align=left]适合如“钙火花”等极短暂生理过程的检测[/align][align=left][/align][align=left][b][color=#ff0000]可检测单离子通道[/color][/b][/align][align=left]可以观察到单个离子通道的信号传递[/align][align=left][/align][align=left]如果以上两点膜片钳的优势,并非是你的必要需求,建议您考虑[b]非损伤微测技术(Non-invasive Micro-test Technology, NMT)[/b],因为……[/align][b]NMT优势[/b][*][b][/b][align=left][color=#ff0000][b]不损伤样品——活体[/b][/color][/align][align=left]检测细胞时,无需钳住细胞,不接触细胞,检测到真正的“生理信号”[/align][/list][img=,369,263]http://ng1.17img.cn/bbsfiles/images/2018/06/201806081338019601_5316_3037344_3.png!w369x263.jpg[/img][align=left][url=https://v.qq.com/x/page/o0549h86ank.html][b]视频案例1(大鼠腿部肌肉在体检测)[/b][/url][/align][align=left][url=https://v.qq.com/x/page/d0614xx44yk.html][b]视频案例2(斑马鱼鱼腮离体检测)[/b][/url][/align][align=left][color=#ff0000][b]还可以检测分子[/b][/color][/align][align=left]NMT检测的是化学信号,非典信号。所以不带电的分子(O[sub]2[/sub]、H[sub]2[/sub]O[sub]2[/sub]、IAA等)、生理过程均可检测。[/align][align=left][/align][align=left][color=#ff0000][b]可同时检测两种指标[/b][/color][/align][img=,363,246]http://ng1.17img.cn/bbsfiles/images/2018/06/201806081343238734_5888_3037344_3.png!w363x246.jpg[/img][align=left][url=https://mp.weixin.qq.com/s?__biz=MzA3OTE0NTI3OQ==&mid=2651819879&idx=2&sn=cad9c88683a9ff8c61cecca28181361a&chksm=844cdf37b33b5621fc921786b5680fb5784c2e32bafb9300b94f3c261fb079dc87522220abad&mpshare=1&scene=21&srcid=0529bXlPBtk62quQGP6gHI0j#wechat_redirect][b]视频案例(人乳腺肿瘤组织H[sup]+[/sup]、O[sub]2[/sub]同时检测)[/b][/url][/align][align=left][/align][align=left][color=#ff0000][b]可直接分辨出具体的离子/分子,无需通道抑制剂[/b][/color][/align][align=left]不同离子/分子,对应不同的传感器,一一对应。即Ca[sup]2+[/sup]传感器,识别的就是Ca[sup]2+[/sup]信号,不识别Na[sup]+[/sup]、K[sup]+[/sup]等其它信号。[/align][align=left][/align][align=left][color=#ff0000][b]一支传感器可检测多个样品[/b][/color][/align][align=left]因不接触样品,每检测完一个样品后,传感器无需更换。一支传感器平均可检测30个样品。[/align][b]旭月版权所有,转载注明出处.[/b]
单细胞凝胶电泳步骤:1. 分离制备单细胞悬液:(1) 体外培养的细胞株:用胰酶消化,最后用PBS悬浮吹打成单细胞悬液,细胞要计数,具体的量我前边已经说过。(2) 体内脏器细胞:处死动物,取出脏器,于Hanks’液中制备成单个细胞悬液。2. 胶板制备:(1) 取100μl于45℃水浴中保温的0.5%NMA,铺于磨沙载玻片上,形成底胶。盖玻片推匀,不能有气泡,4度凝固5至8分钟。(2) 水平取下盖片,取100μl于37℃水浴中保温的0.5%LMA与20μl细胞悬液(约400个细胞)混匀,立即铺片,加上盖玻片,4度凝固5至8分钟。3. 细胞裂解与电泳:(1) 将制备好的胶板去掉盖玻片后,浸于4℃预冷的细胞裂解液中,在4℃下裂解2.5到3小时。(2) 取出胶板,用双蒸水浸没漂洗后放入电泳槽中,浸泡在4℃预冷的电泳液中解旋20分钟。(3) 玻片水平放置阳极端附近,4℃电泳20到25分钟(25V,300mA)。可在电泳槽周围加冰块以保持低温。4. 中和与染色:(1) 电泳结束,将胶板浸泡于中和液中,每次10分钟,共中和3次,每次要更换中和液。最后晾干。(2) 取出胶板,置于染色缸中,在2μg/ml的EB染色液中,暗处染色5到10分钟。(3) 蒸馏水漂洗2次,每次5分钟。稍晾干,滤纸吸去多余水分,尽快在荧光显微镜下观察。从胶板制备开始到最后都应该在暗光下操作。先讲这些,你们可以先开始摸索,真正做了才能发现具体的问题,到时我们再探讨。
关键词:单细胞凝胶电泳目的:为便于各室单细胞凝胶电泳试验结果的可比性背景知识:略原理:在细胞核中,DNA是环状附着在核基质上,细胞裂解过程中,核基质被溶解、抽提,DNA的结构则未发生变化。如果DNA链上存在缺口,则使DNA超螺旋变的松弛,DNA环向外展,同时由于暴露了阴电荷,在电场力的作用下,松动的DNA环向阳极迁移,但是由于这种松动的DNA环一端仍附着于核DNA,其迁移距离受到限制,因此尾长并不总是真实反映链缺口的多少。实际应当依靠尾长与尾部的荧光强度同时来进行分析。主体内容:操作步骤见下文主要参考文献:略操作步骤:1. 分离制备单细胞悬液:(1) 体外培养的细胞株:用胰酶消化,吹打成单细胞悬液(2) 体内脏器细胞:处死动物,取出脏器,于Hanks’液中制备成单个细胞悬液。2. 胶板制备:(1) 取20~50μl于56℃水浴中保温的0.5%普通熔点琼脂糖,铺于磨沙载玻片上,形成底胶。(2) 取100~150μl 0.5%普通熔点琼脂糖加在底胶上,再于其上加盖玻片,4℃冷凝10分钟。(3) 取下盖片,取50~100μl于37℃水浴中保温的1.0%的低熔点琼脂糖与50~100μl细胞悬液(105个细胞/ml)混匀,立即铺片,加上盖玻片,4℃冷凝10分钟。(4) 去掉盖玻片,取70~100μl于37℃水浴中保温的0.5%的低熔点琼脂糖铺片,加盖玻片,4℃冷凝。3. 细胞裂解与电泳:(1) 将制备好的胶板去掉盖玻片后,浸于4℃预冷的细胞裂解液中,4℃裂解1小时。(2) 取出胶板,放入电泳槽中,浸泡在电泳液中解旋20分钟。(3) 4℃电泳20分钟(25V,300mA)。4. 中和与染色:(1) 电泳结束,将胶板浸泡于中和液中,每次15分钟,共中和两次,注意更换中和液。(2) 取出胶板,置于染色架上,滴加5μg/ml的PI,暗处染色20分钟。(3) 蒸馏水脱色15分钟。5. 镜检和分析:(1) 在荧光显微镜下观察,绿光激发吸收滤片590nm。必要时照相记录。(2) 记数观察的细胞,记录彗星细胞出现的频率,用目镜测微尺测头长与全长,计算核DNA迁移距离。* * * * *使用两层凝胶法,经裂解、DNA解旋、电泳和中和得到湿琼脂糖凝胶片。将湿琼脂糖凝胶片置于冰冷无水乙醇中脱水10分钟,后置于空气中自发干燥。每人制备2张琼脂糖凝胶片。全部操作在采血后8小时内完成,操作过程中注意避光。脱水干燥的琼脂糖凝胶片装于含有干燥剂的载片盒中运回实验室。使用50μl 30μM的溴乙锭溶液染色、照相。使用单细胞凝胶电泳软件分析所有照片,每人随机测量100个以上细胞的尾长和olive尾矩,以尾长和olive尾矩的算术均数代表个体DNA损伤情况。
定义:单细胞研究,就是针对单个细胞的研究,这是相对于群体细胞的研究。研究意义:细胞是生命活动的基本单位,研究细胞的结构功能及行为,有利于揭示复杂生命体的生命活动规律,探究生理生化现象,获得统计平均结果。然而,现代研究表明,单个细胞内的成分存在巨大差异,平均分析结果不能反映单个细胞内成分的真实情况,会带来误导信息。癌症等疾病总是从个别细胞的变异开始,极少量异常细胞信号会被群体信号所掩盖,不能及时获得有关病变的信息。另外,细胞间的信号传导,应激反应等活动在细胞内迅速发生,传统方法无法做到实时监测。对于数量较少且较为珍贵的细胞样本,如干细胞、元祖细胞及患者样本,传统分析方法需要大量的细胞样本,并不适宜。关于物质在细胞内的空间分布,亚细胞结构如细胞器的分析,传统方法也不能满足。这些都要求我们在一定范围内从单细胞水平研究细胞的生命活动。单细胞分析方法:毛细管电泳、微流控芯片、图像分析、动力学分析及纳米技术等。目前单细胞分析存在的难点:首先无论是针对一个特异性大分子,还是在OMIC水平上进行分子分析,都存在单细胞提取物数量少,难以分析的困难,这甚至可以说是不可能完成的,因此增加灵敏度势在必行。除此之外高通量分析也是一个瓶颈,要想获得单细胞分析确切的分析结果,研究人员必须快速而准确的分析多个细胞,这并不容易。另外单细胞分析也常常需要进行多种方式分析,这不仅是由于细胞存在于一种异质性环境汇总,而且也在同一时间,也需要测量多个参数。
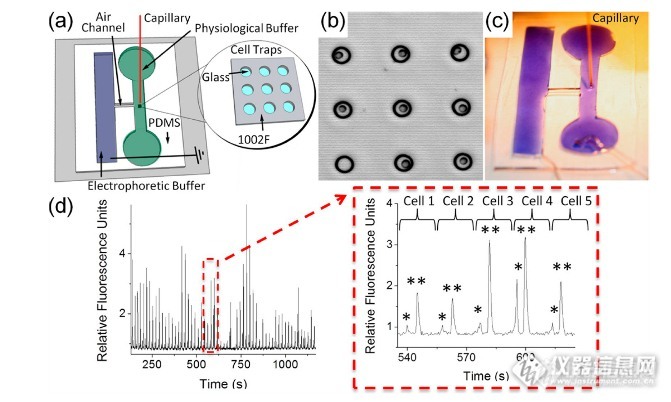
题名:自动化毛细管电泳的快速单细胞分析(Automated Capillary Electrophoresis System for Fast Single-Cell Analysis)作者:Alexandra J. Dickinson , Paul M. Armistead , andNancy L. Allbritton (一群美国滴家伙)杂志:Analytical Chemistry年卷页: 2013, 85 (9), pp 4797–4804 正文:毛细管电泳在单细胞分析上显示了其独特而强有力的优势,这是HPLC和UPLC等难望其项背的优势之一。以下就给大家介绍一个该项技术在单细胞分析上的应用,很牛很强大~ 为了介绍全面一点,我把整段摘要给翻译了。毛细管电泳用于单细胞分析是一种非常有前景的技术,但是在生物研究上其具有低通量的局限性。本文提出了一个微型细胞捕获器和三通道体系的自动化分析平台,在该系统上可进行快速缓冲液交换以进行快速单细胞分析。导入的细胞跟荧光素和俄勒冈绿一起被分离分析,通量为3.5 细胞/分,荧光素和俄勒冈绿的分离度为2.3±0.6。细胞蛋白激酶B(PKB)的活性是通过检测免疫荧光染色后的二氧膦基-PKB来检测的。结果显示,PKB在并没有变化,说明在CE分析过程中应激活化蛋白酶没有被上调,而且在细胞溶膜之前基底细胞的生理机能也没有被扰乱。在癌细胞中鞘氨醇激酶(SK)通常情况下是会被上调的。在此实验中,通过将神经胺-荧光黄(SF)基底引入细胞中而对SK进行检测。SF、神经胺-1-磷酸荧光黄(S1PF)和1/3荧光种类在单细胞中得到分析。219个细胞中,单细胞通量为2.1细胞/分钟。虽然这些亚种群细胞(此类细胞SK活性差异很大,这些差异跟种群均值有关)很容易被测定到,但88%的细胞具有上调SK的活性。该系统稳定,重现性好,可用于上百个贴壁和非贴壁细胞的生物组分的分离分析;还可用于检测非表征的生物学现象。生物方面的知识翻译起来颇费功夫,有些地方翻译得不一定地道。不过生物知识在这里不是重点,亮点在仪器上。比如微型细胞捕获器,这个装置至于毛细管入口端上面50微米处,那个三通道系统也一副牛掰哄哄的样子。如下图: http://ng1.17img.cn/bbsfiles/images/2014/01/201401202053_488354_1624715_3.png其他参数:溶膜方式:激光脉冲生理盐水和分离缓冲液的控制方式:接地电位进样方式:电动进样(-5kV,1s),此时横跨毛细管的电压设为0,1s,毛细管被从air gap移动到分离缓冲溶液中。结语:如果没有多年的科研积累和强大的平台是做不出这样的实验的。纵观这两年发到AC上的文章,动则CE-MS,剩下的就是类似这种:需要很多电化和物化知识外加搞技术难度的仪器创新。革命尚未成功,同志们需多努力啊~~~~~~~
各位朋友: 您们好! 我最近在使用Renishaw公司的拉曼光谱仪,是共聚焦的,来测试单细胞的拉曼光谱,采用785nm光源,但每次测试的效果都非常不好! 我是将细胞种在盖波片上,或者直接将细胞溶液滴在载波片上,直接用显微镜看到细胞之后,再打光测试,但每次总是打在载物台上,而且基本上测不到细胞的拉曼光谱... 请问有哪位朋友能为在下指点迷津啊,我这也试了许多次了,但总是没有效果...
该文该文汇总了单细胞代谢的研究方法,包括质谱 (MS),质谱成像( MS imaging), 毛细管电泳(CE)(其中主要是chip ce), 光谱学(optical spectroscopy),和荧光生物传感器等多种技术手段分析了几百个单细胞,对单细胞进行大分子层面上的表征,以此阐述细胞代谢的表型异质性(phenotypic heteroge-neity)。大概就这个意思吧,大牛的东西,读起来反正就是半懂不懂。