[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405280917103142_1865_5604214_3.jpg!w690x690.jpg[/img] 光合作用测定仪是一款重要的科学仪器,它主要用于测量植物的光合作用过程。通过精确测量植物在光照条件下的气体交换,光合作用测定仪能够帮助科研人员深入理解植物的生长机制,评估环境因素对植物生长的影响,以及优化农业生产的条件。 首先,光合作用测定仪在植物生理学研究中发挥着不可替代的作用。科研人员可以利用该仪器,实时监测植物在不同光照、温度、湿度等条件下的光合速率、呼吸速率等生理指标,从而揭示植物对环境的适应机制和生理响应。 其次,在生态学领域,光合作用测定仪也发挥着重要的作用。通过测量不同生态系统中植物的光合作用效率,可以评估生态系统的生产力和稳定性,为生态系统的保护和恢复提供科学依据。 此外,光合作用测定仪在农业生产实践中也具有广泛的应用价值。通过测量作物在不同生长阶段的光合作用性能,农民和农业科研人员可以制定更为合理的种植管理策略,如调整灌溉、施肥和种植密度等,以提高作物产量和品质。 最后,随着全球气候变化问题的日益严重,光合作用测定仪在气候变化研究领域也展现出了巨大的潜力。通过长期监测植物的光合作用性能,可以揭示气候变化对植物生长的影响,为应对气候变化提供科学依据。 总之,光合作用测定仪具有广泛的用途,它在植物生理学、生态学、农业生产和气候变化研究等领域都发挥着重要的作用。随着科学技术的不断进步,光合作用测定仪的性能和应用范围还将不断拓展,为人类认识自然、保护生态和推动可持续发展提供有力支持。
中国科技网讯 据物理学家组织网6月5日(北京时间)报道,一个由瑞典、德国等多国人员组成的小组,利用短脉冲X射线分析看到了植物进行光合作用的分子结构,发现钙在水分解过程中极为重要,是构建人工光合系统的关键“建材”。这一方法为理解自然界植物的光合作用、光合系统结构与反应机制并最终实现人工光合作用提供了新途径。论文发表在近日出版的《美国国家科学院学报》上。 光合作用可分两步进行:第一步为光反应,由阳光提供能量分解水分子,放出氧气,为下一步暗反应供应能量;第二步为暗反应,利用第一步的能量与CO2反应,生成各种碳水化合物。而光合作用中心的两种不同的光合蛋白复合色素体系,分别进行光合系统Ⅰ(PSⅠ)和光合系统Ⅱ(PSⅡ)两种光化学反应。其中,PSⅡ在光反应过程中激发高能电子、分解水分子、释放氧和推动电子传递,并启动第一步光反应,在该过程中地位非常重要。 瑞典奥默大学化学系教授约翰尼斯·梅辛杰领导的团队试图以“人造树叶”项目模拟植物利用太阳能的方法,开发人工光合作用。但其必须先清楚,光合作用中哪些分子是分解水必不可少的,以及这些分子如何发挥作用。为此,团队设计了一种工具来研究植物在进行光合作用时的光合系统。 此前研究发现,放氧复合物(Mn4O5Ca)是PSⅡ的组成部分,去除钙离子则导致无法放氧。梅辛杰团队从PSⅡ中分离出放氧复合物分子,设法去除了其中的钙离子,再用美国斯坦福大学的X射线自由电子激光设备发出的超短X射线脉冲对分子结构进行了分析,记录下原子50飞秒(1飞秒=10-15秒)的运动过程。 “放氧复合物中5个氧原子将4个锰离子联合在一起,去除了钙离子后,这种结构没有变化,说明钙离子一定在水分解反应中起着极为重要的作用。”梅辛杰解释说,由于实验所用的X射线脉冲极短暂,所以探测时不会扰乱光合系统。“利用这一新工具,我们最终能够探求水在被分解时,氧原子怎样形成了氧络桥最后产生氧分子的。以往要从细节上研究这一阶段是不可能的。”(记者 常丽君) 总编辑圈点 如果要评选地球上最重要的化学反应,光合作用毫无疑问排在第一,它是目前已知的绝大多数生命的基础。19世纪后半期人们才发现光合作用的存在,而直到今天,科学家也没有完全把握其实质。欧洲科学家此次利用新的光学手段,窥测到转瞬即逝的化学迹象,从而将光合作用的机制还原到了分子级尺度。如此一来,人们就有望模仿自然界,造出高效率的“光合机器”。 《科技日报》(2012-06-06 一版)
光合作用测定仪是一款集高精度、智能化、便捷性于一体的科学仪器,专门用于测定植物叶片的光合作用相关参数。通过精确测量,研究人员能够深入了解植物的光合作用过程,进而为农业生产和生态研究提供有力支持。 光合作用测定仪具备多种功能,能够全面、准确地反映植物光合作用的各个方面。首先,它能够测量叶片的净光合速率,即植物在光照条件下吸收二氧化碳并释放氧气的速度。这一指标对于评估植物的生长状态、光合效率以及抗逆性具有重要意义。 其次,光合作用测定仪还能够测定叶片的蒸腾速率。蒸腾作用是植物通过气孔排放水分的过程,与植物的光合作用密切相关。通过测量蒸腾速率,研究人员可以了解植物的水分利用效率和抗旱能力,为制定合理的灌溉和施肥方案提供依据。 此外,该仪器还能测量叶片的叶绿素含量。叶绿素是植物进行光合作用的关键色素,其含量的多少直接影响植物的光合效率。通过测定叶绿素含量,研究人员可以判断植物的光合能力,为植物育种和栽培提供指导。 光合作用测定仪还具有智能化的特点。它采用先进的传感器技术和数据处理算法,能够实时、准确地记录测量数据,并通过软件界面进行直观展示。用户可以通过简单的操作,轻松获取所需数据,并进行进一步的分析和处理。 总之,光合作用测定仪是一款功能强大、操作简便的科学仪器,能够为植物生理生态研究提供有力的支持。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/06/202406041010323380_5237_5604214_3.jpg!w690x690.jpg[/img]
[font=-apple-system, BlinkMacSystemFont, &][color=#05073b][size=18px] 光合作用测定仪在实验课程中有哪些应用,光合作用测定仪在实验课程中有多种应用,主要体现在以下几个方面: 植物生理实验课程:光合作用测定仪是植物生理实验课程中常用的检测仪器。利用它,学生可以开展植物光合作用、呼吸作用、蒸腾作用的相关课题研究以及教学。 测定光合作用参数:在实验过程中,学生可以将植物样品放入光合作用仪中,调节光源的强度和波长,使其符合实验要求。然后,通过CO2供应系统向光合作用仪中注入一定浓度的CO2,以模拟植物在自然环境中的CO2浓度。在此过程中,学生可以测定光合作用的净速率、光补偿点和CO2补偿点等指标,从而了解植物光合作用的效率。 测定环境参数:光合作用测定仪还可以测定CO2浓度、叶片温度、光合有效辐射和叶室温湿度等环境参数。通过科学计算,可以得出叶片的光合速率、叶片蒸腾速率、细胞间CO2浓度、气孔导度、水分利用率等光合作用指标,从而更全面地了解植物的生长状况。 科学研究与指导农业生产:光合作用测定仪的应用不仅限于教学和实验,还可以在科研和生产方面发挥积极作用。例如,在农业生产和农业科研中,可以利用光合作用测定仪来科学指导农业生产,提高作物产量和品质。 总的来说,光合作用测定仪在实验课程中的应用广泛,是植物生理实验、科研和生产中不可或缺的工具。通过使用该仪器,学生可以更深入地了解植物光合作用的原理和过程,为未来的科研和农业生产奠定坚实的基础。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405210944478055_8620_6098850_3.jpg!w690x690.jpg[/img][/size][/color][/font]
[font=-apple-system, BlinkMacSystemFont, &][color=#05073b][size=16px] 光合作用测定仪传感器是进口的吗,光合作用测定仪的传感器是否进口,取决于具体的仪器品牌和型号。参考文章中的信息,不同品牌和型号的光合作用测定仪可能采用不同的传感器。 进口传感器:有些光合作用测定仪确实采用了进口传感器,光合作用测定仪,其强调使用了“进口传感器”。但具体是哪个国家或地区的进口传感器,文章并未提及。 国产传感器:其他品牌的光合作用测定仪可能使用国产传感器。光合作用检测仪,虽然文章没有直接说明其传感器是否进口,但考虑到其产地为山东,且未特别强调进口传感器,可以推测其可能使用了国产传感器。 传感器类型:无论是进口还是国产传感器,光合作用测定仪通常都用于测量与植物光合作用相关的参数,如CO2浓度、叶片温度、光合有效辐射等。这些传感器通常具有高精度和稳定性,以确保测量结果的准确性。 综上所述,光合作用测定仪的传感器是否进口取决于具体的仪器品牌和型号。一些品牌可能采用进口传感器,而另一些品牌则可能使用国产传感器。无论采用哪种传感器,光合作用测定仪都旨在提供准确、可靠的测量数据,以支持植物生理学、生态学等领域的研究和应用。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/06/202406131140373957_9631_6098850_3.jpg!w690x690.jpg[/img][/size][/color][/font]
[font=-apple-system, BlinkMacSystemFont, &][size=15px][color=#05073b] 植物光合作用测定仪反应灵敏度高吗,植物光合作用测定仪的反应灵敏度通常是非常高的,这主要得益于其先进的传感器技术和设计。以下是一些关于植物光合作用测定仪反应灵敏度的详细信息和特点: 传感器技术: 植物光合作用测定仪配备了高精度的传感器,用于测量与光合作用相关的关键参数,如二氧化碳浓度、空气温湿度、叶片温度、光照强度等。 这些传感器通常具有快速响应能力,能够迅速捕捉到微小的环境变化,并准确地转化为数据输出。 测量精度: 由于采用了高精度的传感器和先进的测量技术,植物光合作用测定仪能够提供非常准确的测量数据。 例如,一些光合作用测定仪的二氧化碳测量精度不会受到温度变化的影响,并且具备稳定、高精度、反应灵敏等特性,可以在一秒钟以内完成二氧化碳差值收集。 智能化系统: 许多植物光合作用测定仪配备了智能化系统,能够实时显示、储存和传输测量数据。 这种智能化系统可以大大提高测量的便捷性和效率,同时也能够确保数据的准确性和可靠性。 稳定性: 光合作用测定仪通常具有良好的稳定性,能够在长时间连续测量中保持高灵敏度。 这对于需要进行长时间监测或连续监测的研究项目来说尤为重要。 多功能性: 植物光合作用测定仪可以同时测量多个参数,如光合速率、蒸腾速率、细胞间二氧化碳浓度、气孔导度等。 这种多功能性使得它能够满足不同研究项目的需求,并提供全面的数据支持。 综上所述,植物光合作用测定仪的反应灵敏度通常是非常高的。它采用了高精度的传感器技术、先进的测量技术、智能化系统和稳定的设计,能够迅速、准确地捕捉到与光合作用相关的微小环境变化,并提供准确的测量数据。这些特点使得植物光合作用测定仪在植物生理学、生态学、农业科学等领域的研究中具有重要的应用价值。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/06/202406131144468576_457_6098850_3.jpg!w690x690.jpg[/img][/color][/size][/font]
我们实验室准备购一台价格30万左右的光合作用测定仪,哪位大侠对光合作用测定仪价格和功能了解,能不能给一些这方面的资料或者是信息啊,有劳了。

http://ng1.17img.cn/bbsfiles/images/2011/02/201102122310_277471_2193245_3.jpg新型太阳能电池能像植物体内天然的光合作用系统那样自我修复
我们实验室想买叶面积指数仪和光合作用仪,请大家帮忙推荐一下,国产的就可以了。谢谢各位!
[align=center][size=16px][/size][/align][size=16px] 光合作用是地球上最重要的化学反应,植物、藻类及光合细菌等吸收光能、将[/size][size=16px]CO[/size][font='calibri'][sub][size=16px]2[/size][/sub][/font][size=16px]和水转化为有机物并释放[/size][size=16px]O[/size][font='calibri'][sub][size=16px]2[/size][/sub][/font][size=16px]。获得光能的叶绿素分子从基态跃迁到激发态,激发态的叶绿素分子可通过三种途径释放能量回到基态:推动光化学反应、以热的形式耗散、释放光子产生荧光。这三种途径的总和是一定的,因此叶绿素荧光的变化反映了光化学效率和热耗散能力的变化。叶绿素荧光成像是[/size][size=16px]广泛应用[/size][size=16px]的[/size][size=16px]光合生理研究的重要探针[/size][size=16px],[/size][size=16px]叶绿素荧光显微成像又将研究尺度进一步拓展到细胞、亚细胞水平。叶绿素荧光技术发展出了很多不同的测量程序,以慢诱导荧光动力学曲线为例,通过测量光([/size][size=16px]ML[/size][size=16px])、作用光([/size][size=16px]AL[/size][size=16px])、饱和脉冲光([/size][size=16px]SP[/size][size=16px])激发样品,记录动力学曲线并计算叶绿素荧光参数[/size][size=16px],[/size][size=16px]可以用于反映植物光合作用机理和光合生理状况([/size][size=16px]朱新广[/size][size=16px],[/size][size=16px]2021[/size][size=16px])。[/size][size=16px][/size][size=16px] 叶绿素荧光成像技术能记录整个叶片、植株等样品不同区域的荧光动力学分布变化,实现从宏观到微观的光合机理研究。叶绿素荧光成像由于其无损、高通量的技术特征,在光合作用相关突变体筛选领域成为了广泛应用的重要技术,为光合作用机理及抗[/size][size=16px]逆研究[/size][size=16px]提供了强大的技术支持。叶绿素荧光显微成像技术最早出现于[/size][size=16px]2000[/size][size=16px]年,[/size][size=16px]K[/size][size=16px]ü[/size][size=16px]pper[/size][size=16px]等人将叶绿素荧光脉冲调制式激发光源与显微镜结合,首次获得了显微尺度的叶绿素荧光图像([/size][size=16px]K[/size][size=16px]ü[/size][size=16px]pper[/size][size=16px] [/size][size=16px]et al.[/size][size=16px], 2000[/size][size=16px])。叶绿素荧光显微成像技术在国外已经展开多方面研究应用,[/size][size=16px]目前国内的叶绿素荧光成像显微研究尚处于起步阶段,多个课题组都[/size][size=16px]正[/size][size=16px]在[/size][size=16px]探索[/size][size=16px]这项技术[/size][size=16px]在[/size][size=16px]不同研究领域中[/size][size=16px]的[/size][size=16px]应用。[/size][size=16px][/size][size=16px] 叶绿素荧光技术[/size][size=16px]适用研究样品微观结构上光[/size][size=16px]合功能[/size][size=16px]的空间差异,例如叶片横截面栅栏组织与海绵组织的差异,[/size][size=16px]C[/size][size=16px]4[/size][size=16px]植物花环结构[/size][size=16px]中维管束鞘细胞与叶肉细胞的差异[/size][size=16px],藻类中有差异的单个细胞、异形胞[/size][size=16px]等。我们多年来与[/size][size=16px]吉林师范大学、四川省农业科学研究院[/size][size=16px]等[/size][size=16px]单位[/size][size=16px]合作[/size][size=16px],[/size][size=16px]目前已合作发表的[/size][size=16px]3[/size][size=16px]篇相关论文是国内该领域[/size][size=16px]开创性[/size][size=16px]的应用成果,[/size][size=16px]以叶绿素荧光显微成像的特色优势技术[/size][size=16px]为光合作用的微观[/size][size=16px]探究提供有力支撑[/size][size=16px]。[/size][size=16px][/size][size=16px] Yu[/size][size=16px]等[/size][size=16px]发现[/size][size=16px]狗枣猕猴桃[/size][size=16px]([/size][size=16px]A[/size][size=16px]ctinidia [/size][size=16px]kolomikta[/size][size=16px])[/size][size=16px]的白化[/size][size=16px]叶片[/size][size=16px]通过调整叶片结构及基因表达调控,仍然保持了相对较高的光合能力[/size][size=16px]。[/size][size=16px]应用[/size][size=16px]叶绿素荧光显微成像技术[/size][size=16px]比较了[/size][size=16px]白化和绿色叶片栅栏组织、海绵组织的叶绿素荧光参数,[/size][size=16px]揭示了白化叶片海绵组织光[/size][size=16px]合能力[/size][size=16px]增强的机理[/size][size=16px]。[/size][size=16px]绿叶中栅栏组织[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]v[/size][/sub][/size][/font][size=16px]/[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]m[/size][/sub][/size][/font][size=16px](最大光化学效率)[/size][size=16px]更高,而白叶中海绵组织[/size][size=16px]显著增厚,[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]v[/size][/sub][/size][/font][size=16px]/[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]m[/size][/sub][/size][/font][size=16px]更高[/size][size=16px],[/size][size=16px]光[/size][size=16px]合能力[/size][size=16px]增强,补偿[/size][size=16px]了[/size][size=16px]白化的影响,成为叶片光合作用主力组织[/size][size=16px]([/size][size=16px]Yu [/size][size=16px]et al.[/size][size=16px], 2022[/size][size=16px])[/size][size=16px]。[/size][size=16px]接下来[/size][size=16px]Chen[/size][size=16px]等又比较了两种猕猴桃白化叶片的光保护策略差异[/size][size=16px],狗枣猕猴桃的白叶[/size][size=16px]主要通过反射实现光保护,强光下花青素[/size][size=16px]积累,叶片[/size][size=16px]转变为粉色[/size][size=16px],更有效地保护叶片[/size][size=16px];[/size][size=16px]而[/size][size=16px]葛[/size][size=16px]枣猕猴桃([/size][size=16px]A[/size][size=16px]ctinidia[/size][size=16px] [/size][size=16px]polygama[/size][size=16px])[/size][size=16px]强光下[/size][size=16px]仍为白色[/size][size=16px],[/size][size=16px]具[/size][size=16px]有更[/size][size=16px]强[/size][size=16px]的叶绿[/size][size=16px]素荧光参数,说明[/size][size=16px]它[/size][size=16px]具有更高的强光适应能力[/size][size=16px]([/size][size=16px]Chen[/size][size=16px] [/size][size=16px]et al.[/size][size=16px], 202[/size][size=16px]3[/size][size=16px])。[/size][size=16px]Liu[/size][size=16px]等比较了干旱处理下的玉米叶肉细胞和维管束鞘细胞,发现这两种细胞具有不同的不同光保护策略[/size][size=16px]。对玉米[/size][size=16px]完整叶片的分析显示,[/size][size=16px]随着干旱处理程度增强,[/size][size=16px] [/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]v[/size][/sub][/size][/font][size=16px]/[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]m[/size][/sub][/size][/font][size=16px]、[/size][size=16px]Φ[/size][font='calibri'][size=14px][sub][size=16px]PSII[/size][/sub][/size][/font][size=16px](实际光化学效率)[/size][size=16px]降低,[/size][size=16px]NPQ[/size][size=16px](非光化学猝灭[/size][size=16px]系数[/size][size=16px])[/size][size=16px]显著升高[/size][size=16px]。进一步应用[/size][size=16px]叶绿素荧光显微成像[/size][size=16px]的分析结果[/size][size=16px]与完整叶片[/size][size=16px]相符合,并且发现[/size][size=16px]与叶肉细胞相比,维管束鞘细胞[/size][size=16px] [/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]v[/size][/sub][/size][/font][size=16px]/[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]m[/size][/sub][/size][/font][size=16px]、[/size][size=16px]Φ[/size][font='calibri'][size=14px][sub][size=16px]PSII[/size][/sub][/size][/font][size=16px]更低,干旱胁迫后[/size][size=16px]NPQ[/size][size=16px]升高更显著[/size][size=16px],[/size][size=16px]不同细胞的变化趋势[/size][size=16px]差异[/size][size=16px]表明它们[/size][size=16px]具有不同的光保护策略[/size][size=16px],[/size][size=16px]维管束鞘细胞中可能具有更强的热耗散能力[/size][size=16px]([/size][size=16px]Liu [/size][size=16px]et al.[/size][size=16px], 2022[/size][size=16px])。[/size][size=16px][/size][size=16px] 叶绿[/size][size=16px]素[/size][size=16px]荧光显微成像技术在光合作用的微观研究领域具有独特的技术优势,在[/size][size=16px]光合作用机理研究、环境及毒理胁迫与抗性筛选、优良品系选育等领域[/size][size=16px]具[/size][size=16px]有广阔的应用前景。目前多家单位的科研人员[/size][size=16px]都[/size][size=16px]在[/size][size=16px]探索该技术[/size][size=14px][size=16px]的新应用,我们也正在[/size][size=16px]将该技术拓展到[/size][size=16px]多个新的领域,例如对[/size][size=16px]原生质体[/size][size=16px]以及[/size][size=16px]种子、茎秆等非叶片器官的[/size][size=16px]研究[/size][size=16px]。[/size][/size][font='黑体']参考文献:[/font][font='calibri'][size=13px][1] [/size][/font][font='calibri'][size=13px]朱新广[/size][/font][font='calibri'][size=13px], [/size][/font][font='calibri'][size=13px]许大全主编[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]光合作用研究技术[/size][/font][font='calibri'][size=13px], [/size][/font][font='calibri'][size=13px]上海科学技术出版社[/size][/font][font='calibri'][size=13px], 2021[/size][/font][font='calibri'][size=13px][2] [/size][/font][font='calibri'][size=13px]H[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]Küpper[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]I[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]?etlík[/size][/font][font='calibri'][size=13px], [/size][/font][font='calibri'][size=13px]M[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Trtílek[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] et al. [/size][/font][font='calibri'][size=13px]Photosynthetica[/size][/font][font='calibri'][size=13px], 2000, 38, s553-570 [/size][/font][font='calibri'][size=13px][3] [/size][/font][font='calibri'][size=13px]M[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Yu, [/size][/font][font='calibri'][size=13px]L[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]Chen, [/size][/font][font='calibri'][size=13px]D[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] H[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]Liu[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] et al. [/size][/font][font='calibri'][size=13px]Front. Plant Sci.[/size][/font][font='calibri'][size=13px], 2022, 13: 856732 [/size][/font][font='calibri'][size=13px][4] [/size][/font][font='calibri'][size=13px]L[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] Chen[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] D[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]Q[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] Wen[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] G[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]L[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] Shi[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]et al.[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Physiol. Plant.[/size][/font][font='calibri'][size=13px], 2023, [/size][/font][font='calibri'][size=13px]175:[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]e13880[/size][/font][font='calibri'][size=13px][5] [/size][/font][font='calibri'][size=13px]W[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] J[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Liu, [/size][/font][font='calibri'][size=13px]H[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Liu, [/size][/font][font='calibri'][size=13px]Y[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] E[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Chen[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] et al. [/size][/font][font='calibri'][size=13px]Front. Plant Sci.[/size][/font][font='calibri'][size=13px], 2022, 13: 885781[/size][/font]
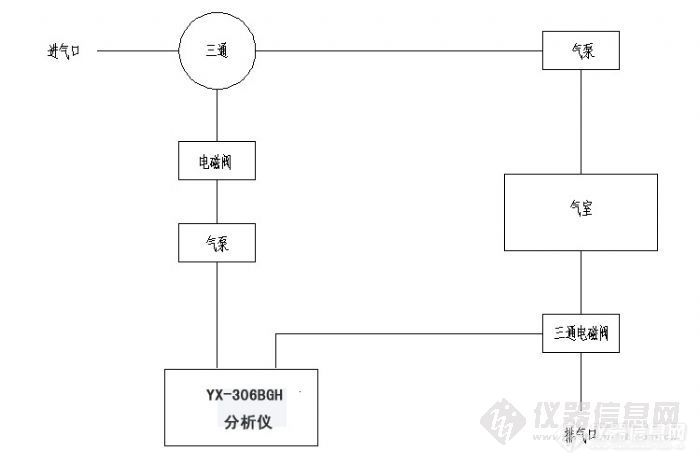
光合速率是指单位时间、单位叶面积吸收CO2的量或放出O2的量。一般测定光合速率的方法都没有把叶片的呼吸作用考虑在内,所以测定的结果实际是光合作用减去呼吸作用的差数,称为表观光合速率或净光合速率。如果把表观光合速率加上呼吸速率,则得到总(真正)光合速率。本文介绍一种经典的光合作用的测定方法:气体测量法。[b]气体测量法[/b]:通过测量单位CO2量的变化,或O2 量的变化来确定光合作用速率。CO2量的变化:红外气体分析仪测定 。O2 量的变化:电化学。我们应该设计遮阴和不遮阴两种情况下CO2或O2 的变化量。采用气体交换法测定光合作用原理YX-306BGH光合作用测定仪采用气体交换法来测量植物光合作用,通过测量流经叶室的空气中的CO2浓度的变化来计算叶室内植物叶片光合速率,其测量CO2浓度的变化的方法也是采用红外CO2气体法。其原理是利用CO2对于红外线在4.26μm处的吸收特性来直接测得气体CO2浓度开路系统的净光合速率P(μmolm-2s-1)闭路系统的净光合速率Pn(μmolm-2s-1)W:空气的质量流量(molm-2s-1) Ci:初始时CO2浓度(μL/L,待测)Co:终止时CO2浓度(μL/L,待测) V:体积流速(0.6 L/min)Ta:空气温度(K,待测) A:叶面积(叶室面积)(6.5 cm2)P:大气压力 (bar,一般认为1标压即1.013 bar) (1 bar=105 Pa)除同时测量流经气室的CO2浓度外,还测量流经气室O2的浓度,光照强度,温度,湿度。[b]测量气路图[/b][img=342,321]http://ng1.17img.cn/bbsfiles/images/2012/11/201211030928_401043_1912882_3.jpg[/img]
[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405280924434083_7887_5604214_3.jpg!w690x690.jpg[/img] 光合速率测定仪是一种专门用于测量植物光合作用的仪器,它能够精确、快速地测定植物的光合速率,为植物生理学、生态学以及农业生产等领域的研究提供有力的支持。 光合速率测定仪基于光合作用的基本原理,通过测量植物叶片在光照条件下的气体交换过程,来推算出光合速率。仪器一般包含光源、叶片夹持器、气体分析器以及数据记录系统等部分。光源用于模拟自然环境中的光照条件,叶片夹持器则负责固定被测叶片,气体分析器则用于测定叶片在光照条件下的二氧化碳吸收和氧气释放量,最后数据记录系统将这些数据记录下来,并经过计算得出光合速率。 光合速率测定仪的应用范围非常广泛。在植物生理学研究中,它可以用来研究不同植物品种、不同生长环境下光合速率的差异,为优化植物生长条件、提高产量提供理论依据。在生态学研究中,光合速率测定仪有助于了解不同生态系统中的光合作用特性,揭示生态系统的能量流动和物质循环规律。此外,在农业生产中,光合速率测定仪也可以用于评估农作物的生长状况,指导农民合理施肥、灌溉和修剪,提高农作物的产量和品质。 随着科学技术的不断发展,光合速率测定仪的性能也在不断提高。未来,我们可以期待更加精确、便携、智能化的光合速率测定仪问世,为植物科学研究和农业生产带来更多的便利和突破。
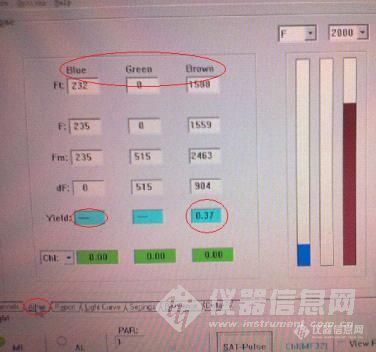
光合活性分析仪在环境监测中的应用前言植物作为光合生物,无论是陆生的花草树木还是水生的挺水植物(如荷花、香蒲)、浮水植物(如绿萍、满江红)、浮游植物(如微囊藻、甲藻),都是靠光合作用提供自身生长所需的能量的。换句话说,光合作用是植物生长最基本的生命特征指标。目前分析光合作用的仪器主要有两大类,一类是分析光合放氧或CO2感知的,另一类是利用叶绿素荧光分析植物光合活性。前者常用于农业上农作物或大型植物的分析,在水中由于O2和CO2除藻类外还存在很多影响因子(如温度变化,风力元素等等),其数据应用时偏差非常大。而光合活性由于是直接测试叶绿素荧光,所以有效避免了这个缺点。由于植物在不同环境状态下的光量子产率(光合活性)不同,这使得光合活性成为研究植物生长条件和影响因子的有力工具。一、光合活性分析仪原理http://ng1.17img.cn/bbsfiles/images/2012/10/201210181638_397663_1653274_3.jpg☆这个是光合作用的原理图(光合活性主要是分析光反应阶段(PSII)的情况) 光合活性一般采用叶绿素荧光的变化来反映。打开饱和脉冲时,本来处于开放态的电子门将该用于光合作用的能量转化为了叶绿素荧光和热,F(荧光值)达到最大值。 经过充分暗适应后,所有电子门均处于开放态,打开测量光得到Fo,此时给出一个饱和脉冲,所有的电子门就都将该用于光合作用的能量转化为了荧光和热,此时得到的叶绿素荧光为Fm。根据Fm和Fo可以计算出PS II的最大量子产量Fv/Fm=(Fm-Fo)/Fm,它反映了植物的潜在最大光合能力。 在光照下光合作用进行时,只有部分电子门处于开放态。如果给出一个饱和脉冲,本来处于开放态的电子门将该用于光合作用的能量转化为了叶绿素荧光和热,此时得到的叶绿素荧光为Fm’。根据Fm’和F可以求出在当前的光照状态下PS II的实际量子产量Yield=ΦPSII=ΔF/Fm’=(Fm’-F)/Fm’,它反映了植物目前的实际光合效率。二、市售光合活性仪类型 目前,市售的可以测定光合活性的仪器大致可以分为探头型、实验室型、便携型三类。已有产品以WALZ公司的PAM系列最为成熟,当然强大如中国的研发团队也有自己的“自主研发”产品(如中科院最新研制的藻类光合作用活性原位测量仪)。http://ng1.17img.cn/bbsfiles/images/2012/10/201210181638_397664_1653274_3.jpg☆PAM荧光成像仪(可以做每个点的光合作用和荧光成像,理论上用这个就能分辨藻的死活)http://ng1.17img.cn/bbsfiles/images/2012/10/201210181639_397665_1653274_3.jpg☆这款是朗石的叶绿素荧光探头,一个原理的(能实时读水下的叶绿素荧光信息,了解不同 水层的情况,不过由于探头大,很难放进小的容器里,也就不能测多个地点的样品了,除非你跑到当地去)[
[font=-apple-system, BlinkMacSystemFont, &][color=#05073b][size=16px] 便携式光合测定仪适用于什么植物,便携式光合测定仪是一种现代化的科研工具,因其小巧轻便、易于携带、智能化程度高以及稳定性强等特点,在植物生理生态学研究中有着广泛的应用。以下是关于便携式光合测定仪适用的植物类型及相关信息: 适用植物类型: 便携式光合测定仪可广泛应用于各种植物,包括但不限于大田作物、果蔬、蔬菜、牧草、观赏植物等。该仪器主要用于测量不同植物的叶片光合速率、蒸腾速率、气孔导度等关键参数。 具体应用场景: 农林业:科研人员可利用该仪器对农作物叶片的光合速率、气孔导度、胞间二氧化碳浓度等参数进行精确测量,评估不同品种的适应性、抗逆性以及产量潜力。同时,通过测定不同生长环境下的光合参数,为优化农作物的种植管理提供科学依据。 生态学:生态学家可利用该仪器研究不同生态系统中植物的光合作用特性,了解生态系统对气候变化的响应机制。例如,通过测定不同海拔、纬度或土壤类型下的植物叶片光合参数,揭示生态系统结构、功能以及生物多样性的变化规律。 园艺和草地科学:该仪器可用于研究观赏植物和牧草的光合作用特性,为品种改良和种植管理提供理论依据。 测量参数: 便携式光合测定仪能够测量的参数非常丰富,包括但不限于CO2浓度、H2O浓度、空气温度、叶片温度、相对湿度、蒸汽压亏缺、露点温度、大气压、内置光强、外置光强、净光合速率、蒸腾速率、胞间CO2浓度、气孔导度等。这些参数能够全面反映植物的光合作用状况,为科研工作者提供宝贵的数据支持。 特点: 该仪器具有便携性、智能化程度高、稳定性强等特点,适用于野外试验、现场监测等多种环境。同时,它支持活体、离体测量,并且室内外两用,满足了科研工作的多样化需求。 综上所述,便携式光合测定仪适用于多种类型的植物,包括但不限于大田作物、果蔬、蔬菜、牧草等,能够为科研人员提供全面、准确的光合作用相关参数数据,对于植物生理生态学研究具有重要意义。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/06/202406131145594548_7165_6098850_3.jpg!w690x690.jpg[/img][/size][/color][/font]
[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405280926503608_6367_5604214_3.jpg!w690x690.jpg[/img] 便携式光合仪是一种先进的科学仪器,主要用于测定植物叶片的光合作用、蒸腾作用、呼吸作用等生理过程。它不仅能够提供关于植物生理状态的重要数据,而且有助于科研人员深入理解植物的生长机制,进而优化农业生产和生态环境管理。 首先,便携式光合仪的核心功能之一是测量植物叶片的光合速率。通过精确测量叶片在一定时间内对二氧化碳的吸收量,仪器能够计算出光合速率,从而评估植物的光合作用效率。此外,光合仪还能够测量叶片的蒸腾速率,即植物通过叶片散失水分的速度,这对于了解植物的水分利用效率和抗旱性具有重要意义。 除了基本的生理参数测量,便携式光合仪还具有多项扩展功能。例如,它能够测量环境温湿度、叶片温度以及光合有效辐射强度等环境因素,这些因素对植物的光合作用过程具有显著影响。通过综合考虑这些因素,科研人员可以更准确地分析植物的光合作用响应机制。 此外,现代便携式光合仪通常配备先进的数据处理和分析功能。仪器能够自动记录并保存测量数据,支持数据导出和可视化展示。用户可以通过电脑或手机等终端设备远程查看和管理数据,进行实时分析和比较。这大大提高了科研工作的效率和准确性,使得科研人员能够更便捷地获取和分析植物生理数据。 总的来说,便携式光合仪是一种功能强大、操作简便的科学仪器。它在农业、生态和环境科学等领域具有广泛的应用前景,对于推动相关领域的科学研究和技术创新具有重要意义。
哪位同学有 姜闯道 植物光合作用对高温的响应 2002 这篇文章,发给我一份吧,谢谢了!
生态系统就是生物之间的相互影响绿色植物吸收光的能量,8%被光合作用固定住,而这8%有一半被呼吸作用损耗掉,而碳元素又被植物损耗掉,剩下的50%能量被叶子和茎杆储存在根部或果实,有部分存在生殖系统里,植物能量的传输有4种。细菌寄生在植物的根部,被植物所供养。碳在大气中以一种无机气体分子的形式存在。CO2经过光合作用,地球上生命赖以生存的基本物质是碳,碳才能以化合物的形态存在。光合作用是植物和一些微生物独有的功能,却造福地球上几乎所有的生命。光合作用,植物用这些简单的运作,保证生命的基础。光合作用的如何进行:——空气渗入树叶间,把树叶表面整个包住,在树叶组织内部循环,慢慢地渗透,内部包含绿色植物叶绿素的微小颗粒,这是利用太阳能,把水中的氢和CO2结合,产出碳水化合物—糖和淀粉的关键过程。空气先溶于叶管中,然后,从叶子进入植物叶皮,尽管在晚上叶工厂会关闭休息,但黎明到来,太阳会出来,光合作用又会开始,所以光合作用是生态系统中生产资料循环的基本过程。光、水营养和CO2,所有这些都是促进生产力发展的关键物质,
[b][size=3]目前最流行的测定光合速率的方法[/size][/b][size=2]光合作用是地球上最重要的生命现象,它是唯一能把太阳能转化为稳定的化学能贮藏在有机物中的过程,是维持地球上物质循环的关键环节,也是农作物产量形成的决定性因素。因此,提高光合作用对于提高作物产量具有十分重要的意义。在植物生理学、生态学、作物栽培学、育种学等研究工作中,经常需要测定光合速率,研究者们总想创造出一种快速、准确而又简便的光合速率测定方法,以满足研究工作的要求。[/size][size=2] 根据光合作用的总反应式 [/size][size=2] [b]CO[sub]2[/sub] [/b]+ 2H[sub]2[/sub]O[sup]* [/sup]+ 4.69kJ → (CH[sub]2[/sub]O) +[b] O[sup]*[/sup][sub]2 [/sub][/b]+ H[sub]2[/sub]O[sup][/sup][/size][align=left][size=2] [/size][/align][align=left][size=2] 原则上我们可以测定任一反应物的消耗速率或产物的生成速率来表示光合速率。常用方法的是测定CO[sub]2[/sub]的吸收、O[sub]2[/sub]的释放和有机物的积累三个方面,即通过测定干物质的积累表示光合速率的改良半叶法、通过测定CO[sub]2[/sub]吸收的红外线CO[sub]2[/sub]气体分析仪法(光合仪)以及通过测定O[sub]2[/sub]释放的氧电极法。[/size][/align][align=left][size=2] 改良半叶法只能测得植物叶片的光合速率,而无法测得与光合速率有关的其它参数,如气孔导度、蒸腾速率、细胞间隙CO[sub]2[/sub]浓度、CO[sub]2[/sub]补偿点、光补偿点等,并且该方法所用的实验时间较长(4~5h),如果遇到阴雨天气,则无法进行测定。因此,该方法用于科学研究有很大的局限性,已经慢慢退出了历史舞台。因此,现在最流行的测定光合速率的方法是通过[b]测定CO[sub]2[/sub]吸收的红外线CO[sub]2[/sub]气体分析仪法(光合仪)[/b]以及[b]通过测定O[sub]2[/sub]释放的氧电极法(氧电极)[/b]。[/size][/align]
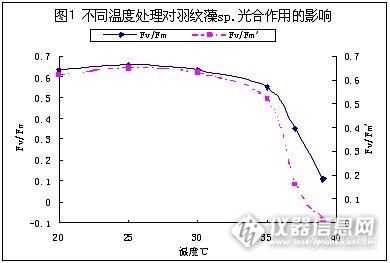
高温热胁对Achnanthes sp.光合影响再探 在11月的原创中,我已经对Achnanthes sp.的高温热胁的响应进行了初步分析,感谢各位专家对本人作品的肯定。本文为此作品的续作,仍以春秋季常见的水华种Achnanthes sp.为受试生物,深入研究高温热胁对藻类光系统影响的作用机制(之前没人说是这个影响主要是作用于哪个亚显微结构的)1.实验材料和仪器http://ng1.17img.cn/bbsfiles/images/2012/12/201212311715_417720_1653274_3.jpg Achnanthes sp.(2012.5.4采自宁波某水库),这个是实验用的藻种,纯度在99%以上吧。http://ng1.17img.cn/bbsfiles/images/2012/12/201212311715_417721_1653274_3.jpg PHYYTO-PAM调制叶绿素荧光仪(德国WALZ公司), 光照培养箱(宁波江南仪器厂),用于藻类的扩培和温度光照条件控制。PS:藻液培养条件20℃,2000LX光照强度,光暗比16:8。 ☆还是这台仪器,还是这个藻。培养条件也一致。这样有可比性。2.实验方法: 实验主要以有效光量子产量Fv/Fm’与最大光量子产量Fv/Fm为分析指标,具体的操作步骤我在这里就不赘述了,上一个原创中有图文介绍 废话不说,直接看实验结果吧。3.实验结果与讨论http://ng1.17img.cn/bbsfiles/images/2012/12/201212311715_417723_1653274_3.jpg 如图所示,当温度高于35℃时,实际光量子产量Fv/Fm’与有效光量子产量Fv/Fm存在较大差异,测量Fv/Fm得出的T50要高于Fv/Fm’。 暗适应样品光系统II不受参与Calvin循环的酶被热破坏的影响,因此Fv/Fm反映的是光系统II的状态,而不受整个光合作用影响。测量Fv/Fm得出的T50要高于Fv/Fm’,因为热胁对光合作用的破坏首先发生在暗反应所需的酶,而开始光系统II不受影响。 Ps:T50是实际光量子产量Fv/Fm’[
以色列PhyTechs PTM-48A植物光合生理及环境监测系统是目前正常环境条件下植物状态分析中更复杂的系统。系统可以利用叶片温度、茎流速率、茎杆微变化、茎杆与果实生长传感器等,来连续监测并记录完整的植物光合与蒸腾速率。 PTM-48M植物光合生理及环境监测系统的特点:12传感器通道设计 1)其中四个输入通道用于自动开合的叶室,测量叶片的光合与蒸腾速率; 2)另外的八个通道用于其他传感器,用于环境(PAR、空气温湿度、土壤湿度)与植物(叶片温度、茎流速率、茎杆微变化、果实生长、茎杆测量仪)监测。植物光合生理及环境监测系统特点: ·可长期、自动循环、同时测量四个叶片的CO2交换情况与光合速率 ·可长期、自动循环、同时测量四个叶片的H2O交换情况与蒸腾速率 ·可长期同时测量植株不同茎杆的茎流量 ·可长期同时测量植物所处的环境因子(空气温湿度、土壤湿度、PAR) ·可长期同时测量植物或者果实的微变化(茎杆微变化、果实生长、茎杆测量仪)植物光合生理及环境监测系统应用: ·4通道植物光合作用与蒸腾作用研究 ·作物的长期监测:实验室、温室和植物生长室中的植物生理学研究 ·野外长期生态监测研究,作物环境条件的变化与CO2的气体交换过程的相互关系等 PTM-48A植物光合生理及环境监测系统系统配置: 下面是系统的一些参数、用户可以根据自己的研究需要可选的传感器以及一般的系统构成可选传感器 ·PIR-1 光合作用辐射传感器 ·TIR-4 总辐射传感器 ·ATH-2 空气温湿度传感器 ·SMS-2 土壤湿度传感器 ·LT-2M 叶片温度传感器 ·SF-4M SF-5M 茎流速率传感器 ·SD-5M 或 SD-6M 茎杆微变化传感器 ·DE-1M 树木生长计 ·FI-LM,FI-MM,FI-SM和FI-XSM果实生长传感器 ·SA-20 茎杆生长计PTM-48A植物光合生理及环境监测系统性能参数 ·叶室数: 4个 ·叶室面积: 20 cm2 ·连接气体管路的标准长度: 6m ·叶室通道的正常空气流速范围: 0.8-1.0L/Min ·CO2浓度测量范围: 0-1000ppm ·CO2交换的额定测量范围: -20到20 μmolCO2m-2s-1 ·H2O交换的额定测量范围: 0-50mgH20m-2s-1 ·可选输入传感器数: 11 ·可选传感器输入范围: 0-10Vdc(12 bit) ·电源需求: 可选 220/110/100 VAC ; 50/60 Hz,150W ·连接串口: RS232 和 RS485(可选) ·终端软件要求系统为 Windows 98, 2000,ME 和 XP ·环境保护指标: IP51
[font=-apple-system, BlinkMacSystemFont, &][color=#05073b][size=18px] 光合速率测定仪户外检测时注意事项 当使用光合速率测定仪在户外进行检测时,需要注意以下几个事项: 天气条件:光合作用是光依赖性的,因此选择晴朗的天气进行实验是很重要的。尽量避免在阴天或多云天气下进行实验,因为这会降低光照强度,影响光合速率的测定结果。 光照强度:确保光源(如太阳光)的强度适中并保持稳定。如果可能的话,使用遮荫网或调整光源距离来避免过强的光照对植物叶片造成热伤害。 植物选择:选择健康、无病虫害、处于相同发育阶段的植物叶片作为测定对象。避免使用室内观赏性植物或一年常绿的植物,因为它们的光合特性可能与户外植物有所不同。 仪器校准:在开始实验之前,确保光合速率测定仪已经校准过,以确保测量结果的准确性。这通常包括零点校准和跨度校准。 仪器连接:确保光合速率测定仪与手柄、光源等辅助设备正确连接,并且连接牢固可靠。避免因连接不稳造成的数据误差或设备损坏。 叶片安装:使用手柄夹住待测的植物叶片,并将其放置在测定仪的检测位置上。确保叶片摆放位置正确,避免叶片移动或摆放不当影响数据准确性。 测试环境:在户外测试时,要注意环境的稳定性。尽量避免风、温度变化等因素对实验结果的干扰。可以使用挡风板、温度控制器等设备来保持测试环境的稳定。 数据记录:连续记录各种参数,如温度、湿度、光照强度、CO2浓度等,并妥善保存数据以供后续分析和建模。 仪器保养:在户外使用时要轻拿轻放,避免碰撞和摔落。测试完毕后及时关闭仪器,并进行必要的清洁和维护工作。 安全注意事项:在户外进行实验时,要注意个人安全。避免在危险的地方进行实验,并遵守相关的安全规定和操作规程。 通过注意以上事项,可以确保光合速率测定仪在户外检测时能够准确、可靠地工作,为科研和教学提供有力的支持。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405241058401418_5252_6098850_3.jpg!w690x690.jpg[/img][/size][/color][/font]
[font=-apple-system, BlinkMacSystemFont, &][color=#05073b][size=16px] 便携式光合测定仪准确率多少,便携式光合测定仪的准确率主要取决于其技术指标和测量方式。以下是关于便携式光合测定仪准确率的详细说明: 一、技术指标 CO?分析器: 类型:绝对开路式非色散红外分析器 量程:0~3100 μmol/mol 准确度:最大误差为±5 μmol/mol(在0~1500 μmol/mol范围内) ±10 μmol/mol(在1500~3100 μmol/mol范围内) H?O分析器: 类型:绝对开路式非色散红外分析器 量程:0~75 mmol/mol,或40℃露点 准确度:最大误差为±1.0 mmol/mol 二、测量方式与准确率 便携式光合测定仪采用闭路测量方法,这种方法通过创建一个封闭的测量环境,使得气体CO?浓度、空气温湿度、植物叶片温度、光强以及气体流量等要素在测量过程中保持稳定和可控,从而确保测量结果的准确性。 具体来说,便携式光合测定仪可以准确测定以下要素: 气体CO?浓度:通过内置的CO?分析仪来测量环境中的CO?浓度,这是评估植物光合作用效率的关键参数之一。 空气温湿度:仪器配备温湿度传感器,以实时监测和记录环境空气的温度和湿度,这些参数对植物的光合作用和蒸腾作用都有显著影响。 植物叶片温度:通过红外测温技术或其他温度测量手段,便携式光合测定仪可以准确测定植物叶片的表面温度,这有助于了解植物叶片对环境的热响应。 光强:仪器配备光强传感器来测量不同波长的光强,从而了解植物对不同光谱的响应。 气体流量:通过气体流量计,仪器可以测量通过植物叶片的气体流量,这有助于计算光合速率和蒸腾速率等参数。 三、总结 便携式光合测定仪的准确率主要取决于其技术指标和闭路测量方法。通过高精度的传感器和精确的测量技术,它能够准确、快速地测定多种与植物光合作用相关的参数,并为植物生理学、生态学、农业生产和环境科学等领域的研究提供有力的工具。然而,由于测量环境、操作方式等因素的影响,实际测量中可能存在一定的误差,因此在使用时需要注意操作规范和数据解读的准确性。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/06/202406071117138857_8471_6098850_3.jpg!w690x690.jpg[/img][/size][/color][/font]
[font=-apple-system, BlinkMacSystemFont, &][color=#05073b][size=18px] 便携式光合仪如何同化CO2的叶片面积,便携式光合仪在测定同化CO?的叶片面积时,主要是通过测量植物光合速率,并结合叶片面积来估算的。以下是一个清晰的步骤说明和归纳: 步骤说明 植物光合速率的测定: 使用便携式光合仪,在精确控制环境因子的条件下,通过红外线气体分析仪检测二氧化碳的消耗速率来测定植物的光合速率。 这个过程基于红外光被二氧化碳分子吸收的原理,通过测量透射光能量的减少来推算二氧化碳的消耗速率。 叶片面积的测量: 可以使用标准方格纸或其他测量工具来测量叶片的实际面积。对于大于或等于半格的部分算作一格,小于半格的部分可以舍去。 例如,如果使用边长为1厘米的透明方格纸来测量,可以计算出叶片的近似面积。 同化CO?的叶片面积估算: 根据测定的光合速率和叶片面积,可以估算出同化CO?的叶片面积。这通常是一个相对值,表示在给定的时间和条件下,叶片同化CO?的能力。 需要注意的是,这个估算值受到多种因素的影响,如光照、温度、水分等环境因子以及植物本身的生理状态等。 归纳 便携式光合仪通过测量植物的光合速率和叶片面积,可以估算出同化CO?的叶片面积。这个过程结合了光合作用的基本原理和叶片面积的测量方法,提供了一种方便、快捷的方式来评估植物的光合作用效率。然而,需要注意的是,这个估算值受到多种因素的影响,因此在实际应用中需要结合具体情况进行综合考虑。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405301144376028_9059_6098850_3.jpg!w690x690.jpg[/img][/size][/color][/font]
ToxY-PAM 水质毒性分析荧光仪 用于水样(如饮用水或食品工业用水等)中有毒物质的检测,也可用于光合作用、环境胁迫等的研究。敌草隆(Diuron,DCMU)可以抑制光合作用的电子传递,从而使色素吸收的光能不能用于进行光合作用,而是产生叶绿素荧光。根据对照水样和测试水样的光合作用有效光量子产量(Y)的差异,可以换算出水样中敌草隆的含量。水体中的有毒物质(重金属、农药、多氯联苯等)通过影响浮游植物的代谢会直接或间接的降低光合作用活性,从而影响光合作用有效量子产量。利用单细胞微藻(如硅藻)或(冷冻保存的)类囊体,通过检测水样中的有毒物质对光合作用有效量子产量的影响,可以得出水样中有毒物质含量,只不过有毒物质的含量是已Diuron当量表示的
本人上周刚写了几篇关于叶绿素,微囊藻,光合作用的论文,请问高手往哪儿投比较好?题目和内容如下:EM菌对微囊藻光合作用的抑制(机理和不同条件效果)不同生长阶段微囊藻924的光合活性研究(侧重水华预警方面)叶绿素自然降解速率研究(对以往方程模型的修正)PHYTO-PAM分类测定水体中叶绿素(仪器性能,常规比对)此外,还有目前正在研究的关于胁迫与光系统II的一些光照强度对微囊藻光合作用的影响光照强度对羽纹硅藻光合作用的影响温度对微囊藻光合作用的影响温度对羽纹硅藻光合作用的影响等等请问,这些分别往哪儿发比较好?由于本人能力有限,那几篇文章也是在仓促之间完成的,SCI之类的就不想了,希望各位大虾分别为上述论文推荐下命中率高的杂志,谢谢有从事相关研究工作的大虾请和我联系QQ:54943110
叶绿素测定仪是一种用于测量植物或其他生物样品中叶绿素含量的仪器。叶绿素是植物中的关键色素之一,它在光合作用中扮演着重要的角色,将光能转化为化学能。测定叶绿素含量可以用来评估植物的生长状况、健康状态以及光合作用效率。 叶绿素测定仪在许多领域都有广泛的应用,主要涉及到植物生长、生态系统研究、环境监测和农业等。以下是叶绿素测定仪的一些主要应用范围: 植物生长与健康评估: 叶绿素测定仪可以用于评估植物的健康状况和生长状态。通过测量叶绿素含量,可以推断出植物的光合作用活性、养分吸收能力以及受到的环境影响。 农业领域: 叶绿素测定仪在农业中被用来监测作物的生长情况和健康状态。这有助于决定适宜的施肥、灌溉和其他农业管理措施,以提高农作物产量和质量。 生态学研究: 叶绿素测定仪在生态系统研究中非常有用。通过对植物叶片和水体中叶绿素的测量,可以了解生态系统的光合作用活动、能量流动和生态链的结构。 水质监测: 叶绿素测定仪可用于评估水体中的藻类和蓝藻数量,从而判断水体的富营养化程度和水质。这对于保护水体生态平衡和提供饮用水质量至关重要。 环境污染监测: 叶绿素测定仪可以用于检测污染物对植物生长和光合作用的影响。它们可以帮助监测工业排放、空气污染和土壤污染等对环境的影响。 生物学研究: 叶绿素测定仪在生物学领域中用于研究不同生物体中叶绿素的含量和分布,如藻类、植物、海洋生物等。 教育与科普: 叶绿素测定仪也可用于教育和科普活动,帮助人们理解光合作用的基本原理以及叶绿素在生态系统中的作用。 总之,叶绿素测定仪在植物学、生态学、环境科学、农业和生物学等多个领域中都发挥着重要作用,帮助人们更好地了解和评估生态系统、植物健康和环境状况。

[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2023/10/202310091014209568_2916_5604214_3.jpg!w690x690.jpg[/img] 叶绿素检测仪是用于测量叶绿素含量的仪器,叶绿素是植物和藻类等生物体中的绿色色素,用于光合作用过程中捕获太阳能并进行光合反应。这些检测仪广泛应用于多个领域,包括: 农业:叶绿素检测仪在农业领域中用于监测作物的生长和健康状态。通过测量叶绿素含量,可以评估植物的养分吸收、光合作用效率和生长速度,有助于农民和农业专业人员制定施肥和灌溉策略,提高农作物产量。 植物生态学:在生态学研究中,叶绿素检测仪用于评估不同植被类型的叶绿素含量,以了解生态系统的健康状况、光合作用活性和生产力。这对于生态学家来说是重要的工具,可用于监测自然环境的变化和生态系统的恢复。 水质监测:叶绿素是水体中藻类和浮游植物的主要色素之一,因此叶绿素检测仪用于监测水体的叶绿素含量,以评估水体质量、水生生物生态系统的健康和藻类水华的风险。 海洋研究:在海洋科学领域,叶绿素检测仪被用来研究海洋生态系统的光合作用活动和生物量。它们可以用于检测浮游植物的分布和季节性变化,有助于理解海洋生态系统的动态。 生物学研究:叶绿素检测仪也在生物学研究中广泛应用,用于测量叶绿素含量以研究植物和藻类的生长、发育和生理过程。 总之,叶绿素检测仪在农业、生态学、环境科学、海洋学、生物学和水资源管理等多个领域都有重要的应用。它们帮助研究人员和专业人员监测植物和水体的叶绿素含量,提供了有关生态系统和环境健康状况的关键信息。
用DS5测试鱼塘或水库的水,溶解氧数值有时会去到十几,同时测其它水体,有时又会去到2或3。测试环境1、鱼塘正在开增氧机。溶解氧升高是正常的,但能高到哪个程度呢?测试环境2、水库水底有水草,正值6月高温烈日天气。是否水草光合作用释放导致溶解氧升高? 本人查过各网站也没找到相关文献,请各位大神帮忙解答。
功能:1) 可对蓝藻、绿藻和硅/甲藻自动分类(定性)2) 可自动测量水样中蓝藻、绿藻和硅/甲藻的叶绿素含量(定量)和总叶绿素含量3) 可同时测量水样中蓝藻、绿藻和硅/甲藻的光合作用和总光合活性4) 可测量光合作用的量子产量和相对电子传递速率5) 可自动记录量子产量和相对电子传递速率的快速光响应曲线6) 用户可做自己的参考光谱7) 可连接记录仪或示波器记录原始荧光诱导动力学曲线应用领域: 多用于水生生物学、水域生态学、海洋学、湖沼学、水质监测和预警、微藻生理学、微藻抗逆性、环境科学、生态毒理学、极地藻类(冰藻)研究等领域,对于了解自然水体中藻类种群的动态变化、水华/赤潮预警、野外水体中光合作用的时空变化、校正初级生产力的计算等有较大帮助。
據日本京都大學網站報道,該校和日本海洋研究開發機構組成的聯合研究小組在調查了9處不同的海域和湖沼之后,發現在這些地方的海底和湖底的沉積物中都存在大量葉綠素D的蹤■,從而證實過去只被少量發現的葉綠素D其實在地球海洋與湖泊中廣泛存在,很有可能是地球上碳循環的驅動力之一。該研究成果發表在8月1日出版的美國《科學》雜志上。 葉綠素是一種能利用光合作用將水和二氧化碳合成為有機物的化學物質,一共有A、B、C、D四種,其中A、B、C三種在可見光的條件下進行光合作用,特別是葉綠素A,廣泛存在于原始微生物藍藻到高等植物中。而葉綠素D則是葉綠素中的“變種”,1943年人們第一次發現了葉綠素D的存在,這種葉綠素只在近紅外線照射下才能進行光合作用,而過去人們僅在紅藻中發現過這一物質,由于含量很少,一直以來人們都認為其光合作用對大氣中的二氧化碳含量影響極小,幾乎可以忽略不計。 此次日本研究人員從北冰洋、日本的相模灣和琵琶湖到南極水域,包括海洋、淡水湖、鹽水湖等9處溫度、鹽分濃度各不相同的水域采集水底堆積物,從中發現了大量葉綠素D存在的蹤■。據研究人員估計,重新計算下的葉綠素D可能會占所有葉綠素總量的3%至4%,這樣光葉綠素D每年吸收的二氧化碳量就相當于近年二氧化碳年均增加量的約四分之一,證實先前的結論有誤,葉綠素D的光合作用效果一直被低估。研究人員稱,既然證實自然界中存在著如此多數量的葉綠素D,那么含有葉綠素D的植物就不應該只有紅藻一種,今后他們將會把目光放在尋找含有葉綠素D的新植物上,以促使葉綠素D在減少二氧化碳含量方面能夠發揮更大的作用。