自动电位滴定法测定铜的含量[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=42510]自动电位滴定法测定铜的含量[/url]
【篇名】 自动电位滴定法测定润滑油及添加剂的碱值【作者】 孟葵花. 【刊名】 润滑油 2005年05期【机构】 中国石油大连润滑油研究开发中心 辽宁大连116032. 【关键词】润滑油. 自动电位滴定. 添加剂. 碱值. 【摘要】 依据SH/T0251-93方法,采用自动电位滴定法测定新、旧润滑油及添加剂的碱值,并与人工滴定法测得的碱值进行比较,实验结果均符合SH/T0251-93误差要求,同时进行自动电位滴定法测定碱值的精密度实验,相对标准偏差均小于3.1%。 [img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=18479]自动电位滴定法测定润滑油及添加剂的碱值.pdf[/url]
电位滴定法测定氯离子和碘离子 1.实验目的 (1)用电位滴定法测定氯离子和碘离子的含量。 (2)掌握电位滴定法终点的确定方法和实验技术。2.实验原理电位滴定法利用电极电位的“突跃”指示滴定终点。电位滴定终点的确定,不必知道终点电位的确定值。只要测得电位值的变化,就可通过作图法或二阶微商法确定滴定终点。氯化银、碘化银的溶度积分别为AgCl: Ksp = 1×10-10 mol2.L-2 AgI: Ksp = 1×10-16 mol2.L-2用硝酸银进行滴定含氯离子和碘离子的试液时,先生成碘化银沉淀,当碘化银沉淀完全后,开始生成氯化银沉淀。本实验以硝酸银为滴定剂,基于银离子与碘离子和银离子分步沉淀原理进行测定。以银-氯化银电极为指示电极,玻璃电极为参比电极,通过测量滴定过程中电位的变化,测定待测溶液中碘离子和银离子的浓度。滴定过程中,溶液pH不发生变化,pH玻璃电极可作为参比电极。滴定过程中,有两个电位“突跃”。每次滴定下1.0 mL;在终点附近的量,电位值变化较大时,每次可滴下0.10 mL,以便于微商法的计算和获得准确的测定结果。3.仪器与试剂高输入阻抗电位计(或pH记,或离子计,或ZD-2型自动电位滴定仪),银-氯化银电极;pH玻璃电极。200 mL烧杯;10 mL移液管。0.10 mol.L-1AgNO3标准溶液:准确称取110℃干燥的AgNO3(GR)8.6 g于500 mL烧杯中,用约200 mL不含Cl-的蒸馏水溶解,转入500 mL容量瓶中,再用不含Cl-的蒸馏水定容。计算其浓度。配制的溶液装入棕色瓶中暗处保存。电位滴定时,稀释成0.050 mol.L-1 AgNO3标准溶液。含氯离子和碘离子的试液(各含约0.01 mol.L-1)。4.实验步骤移取10.00 mL含氯离子和碘离子的试液于200 mL烧杯中,放入搅拌子,加入80 mL蒸馏水,将电极浸入试液中,以银-氯化银电极为指示电极,pH玻璃电极为参比电极①,用0.050 mol.L-1 AgNO3标准溶液进行滴定,大概估计滴定终点。记录消耗AgNO3标准溶液的体积和电位测定值。平行测定三次。5.数据处理(1)以消耗AgNO3标准溶液的体积(V)为横坐标,以测得的电位(E)为纵坐标,绘制E-V曲线,再绘制一次微分 曲线和 曲线,确定终点体积。(2)计算试液中氯离子和碘离子的浓度和测定结果的相对平均偏差。注释①参比电极也可使用双盐桥电极(外套管内装1 mol.L-1 KNO3溶液)或用内含1 mol.L-1 KNO3溶液的盐桥连接的饱和甘汞电极。思考题1.银电极、银离子选择电极或氯离子选择电极可否用作指示电极?为什么?2.pH玻璃电极为什么可用作参比电极?3.用本实验的方法可否连续测定氯离子、溴离子和碘离子? 陕西师范大学分析化学研究所
最近想用电位滴定法测定食品中的氯化钠,初步想法是加一个银电级和一个参比电极,但不知曲线做出后怎样计算,请哪位老师教教,我们用的是普通的pH电极带mv的
请哪位老师帮忙告诉我电位滴定法(非水滴定)测定苏氨酸的终点电位值
求助下载《氟离子电极作指示电极自动电位滴定法测定氟》 谢谢http://www.cnki.com.cn/Article/CJFDTotal-FXHX197805006.htm
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=98397]电位滴定法测定玉米脂肪酸值[/url]
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=97807]非水体系电位滴定法测定聚酯端羧基[/url]
电位滴定法快速测定糠醛* 刘俊峰 易平贵 金一粟 摘 要 试验用改良硫酸法由稻草(或麦杆)制取糠醛,用电位滴定法测定糠醛蒸馏液中糠醛的含量及产品的纯度,给出了滴定终点的选择依据.方法简便易行,准确度达到工业分析的要求.图2,表3,参5.关键词 糠醛 电位滴定 条件分类号 TQ201THE QUICK METHOD TO DETERMINE FURFURAL BY ELECTROMETRIC TITRATION Liu Junfeng Yi Pinggui Jin Yisu(Dept. of Chemical Eng. of Xiangtan Mining Institute,Xiangtan ,Hunan,China,411201)ABSTRACT The electrometric titration to determine furfural has been discussed. It also studied the determination method ,the principle, the procedure, the cause for selecting the titration end to determine the pure level of the product and the content of furfural in the distillation liquid produced from straw of rice(or straw of wheat) by the modified sulfuric acid catalytic method. The results show that the method is simple and convenient and its accuracy reaches to the industrial analysis standard.2figs.,3tabs.,5refs.Key words electrometric titration, furfural,conditionSynopsis of the author Liu Junfeng, male, born in 1957, M.E., associate professor, original chemical technology and industrial catalyst. 羰基化合物的测定常见的方法主要有羟胺法、亚硫酸氢钠加成法和2,4-二硝基苯腙重量法[1].上述测定方法有的操作繁杂,有的终点褪色迅速,准确度较差.电位滴定法在羟基苯甲醛产品的分析测定中具有简单、快速、干扰较小等优点[2,3].本文讨论了改良硫酸法制取糠醛产品的测试方法,结果表明,用电位滴定法测定馏出液中糠醛的含量和产品的纯度,结果准确、方法简便易行.1 试验1.1 测定原理[4] 先用NaOH部分中和盐酸羟胺,生成的游离羟胺部分与羰基化合物形成肟,剩余的游离羟胺用盐酸标准溶液回滴,由空白和试样溶液滴定之差值计算试样中糠醛的百分含量.反应如下: 1.2 主要仪器、试剂和溶液 1) 主要仪器 自动电位滴定仪(精度pH=0.01),饱和甘汞电极,玻璃指示电极. 2) 氢氧化钠乙醇溶液( CNaOH=0.75 mol/L) 加入42.0g氢氧化钠(质量分数50%)溶液于688mL乙醇(质量分数95%)中. 3) 羟胺溶液 溶解40.0g盐酸羟胺(NH2OH.HCl)于160mL水中,用95%乙醇溶液稀释至1 L,再加入400 mL浓度为0.75 mol/L氢氧化钠溶液,混匀. 4) 盐酸标准溶液(CHCl=0.250 mol/L) 配制与标定按GB6014.2条进行.1.3 测定步骤与结果计算 称取2.0g(准确至0.0002g)试样于干燥的150mL烧杯中,加入10.0mL含量为95%乙醇,溶解后再加入13mL水,准确吸取25.00mL羟胺溶液至试样中,搅拌反应20min.放入玻璃电极和甘汞电极,在已校正好的酸度计上用0.2500mol/L的盐酸标准溶液滴定至溶液pH值为3.55时终止滴定,消耗体积为V1;除不加试样外,以同样的方法测定25.00mL羟胺溶液空白,消耗体积为V0,计算结果如下: 式中:w糠醛,糠醛的质量分数,%;V0,空白试液消耗盐酸标准溶液体积,mL;V1,被测试样滴定消耗盐酸标准溶液体积,mL;C,盐酸标准溶液浓度,mol/L;m,试样质量,g;系数0.096 09为糠醛的毫摩尔质量,g.2 结果与讨论2.1 测定方法的选择 试验结果发现,对于改良硫酸法制取糠醛产物中醛含量的分析,用亚硫酸氢钠法终点褪色迅速;如用羟胺法直接滴定则无明显滴定突跃,使得终点判断相当困难.唯有羟胺法的间接滴定法终点突跃较为明显,但样品本身的颜色对此法干扰较大,对于颜色较深的样品不适用. 如采用仪器检测法测定样品中的糠醛,由于试样中存在的无机离子和水分在[url=https://insevent.instrument.com.cn/t/Mp]气相色谱仪[/url]FID检测器上无响应,故归一化结果均偏高.因试样(特别是久置后)本身具有颜色,用可见或紫外吸收光谱仪测定均存在不同程度的干扰而造成结果准确度较差.所以最终选择了电位滴定法.2.2 滴定终点的确定 试验了不同量羟胺溶液滴定后终点pH值的变化,结果如图1. 由图1可知终点pH值分别为3.70、3.58、3.50.根据取样量计算,当试样反应完全后,羟胺剩余量大于15 mL,因此选择pH为3.55时作为滴定终点.计算得此条件下的终点误差约为0.02 mL. 盐酸标准溶液体积/mLa.5mL羟胺溶液滴定曲线(终点pHo 3.70)b.15mL羟胺溶液滴定曲线(终点pHo 3.58)c .25mL羟胺溶液滴定曲线(终点pHo 3.50)图1 羟胺溶液滴定曲线Fig.1 Curve of determining hydroxy amine2.3 滴定反应时间的选择 羰基化合成肟反应一般需30min方能完全,少数情况要在70 ℃以上水浴中进行.本法采用搅拌方式以加快反应速度.测定了室温条件下不同反应时间分析结果的稳定性,如图2.由图2可见,在室温搅拌反应20 min即能满足要求. 图2 不同反应时间糖醛测定含量Fig.2 Content of furfural according different reaction time2.4 测定方法的准确度 采用含量为99.00%的糠醛样品进行准确度试验.在所给试验条件下,测得其含量为99.02%,回收率为100.2%.然后用99.00%含量的糠醛配置标准样品,标样含量为55.26%,实测结果为55.13%,回收率99.76%(见表1),相对误差均符合工业分析公差[5]. 表1 分析方法准确度测定结果 Tab.1 Results of accuracy of the analysis method样品含量/%测定值/%平均值/%回收率/%平均误差/%相对误差/%样品含量/%测定值/%平均值/%回收率/%平均误差/%相对误差/%99.0099.1599.2599.1899.2299.20100.20.0350.2055.2655.1655.1255.1155.1399.760.0200.242.5 试样测定 1) 馏出液糠醛含量的测定 按本试验得出的测定条件,对8批蒸出液先用NaOH中和至pH值与空白试液相同,然后进行糠醛含量的测定,结果见表2. 表2 试样平行测定结果 Tab.2 Results of determination of parallel samples样品号测定值/%平均值/%相对偏差/%样品号测定值/%平均值/%相对偏差/%12.18 2.222.200.0251.561.491.530.0321.961.991.980.0261.641.541.590.0531.881.841.860.0271.411.321.370.0441.721.651.690.0381.361.271.320.04 由表2可见,采用本法两次平行测定结果差值不大于0.2%,相对偏差在0.1%以下. 2) 糠醛产品测定 用上述同样的方法,对连续10批产品进行测定,结果如表3. 表3 产品中糠醛含量测定结果 Tab.3 Determining results of furfural content in products 样品号测定值/%平均值/%相对偏差/%样品号测定值/%平均值/%相对偏差/%196.84 96.8096.820.02696.7296.9096.960.06297.3297.4197.370.05799.3699.2099.280.08395.1695.1095.130.03897.0296.9096.960.06498.2198.1298.170.05997.8297.7697.790.03599.1099.0199.060.041097.7697.5897.670.09 由表3可见,采用本法平行测定结果差值、相对偏差均符合工业分析标准. 3 结论 本法操作简便、仪器简单、准确度、精密度均能满足工业分析要求,可用于糠醛产品质量检测和改良硫酸法生产中糠醛蒸馏液醛含量的分析. *湖南省“八五”科技攻关项目(编号:01-942-57)第一作者简介 刘俊峰 男 42岁 硕士 副教授 有机化工与工业催化剂作者单位:湘潭矿业学院化学工程系,湖南湘潭,411201参考文献 1 西北师院等校编.有机分析教程.北京:人民教育出版社,1978.306~309 2 刘俊峰,易平贵,李晓湘.电位滴定法测定间羟基苯甲醛.分析化学,1996,24(9):1111 3 魏玉鹏.电位滴定法测定对羟基苯甲醛.江苏化工,1992,20(2):45~46 4 兰州大学化学系等编.有机微量定量分析.北京:科学出版社,1978.306~309 5 田景君.分析化学.北京:化学工业出版社,1979.113收稿日期:1998-10-25
电位滴定法快速测定糠醛* 刘俊峰 易平贵 金一粟 摘 要 试验用改良硫酸法由稻草(或麦杆)制取糠醛,用电位滴定法测定糠醛蒸馏液中糠醛的含量及产品的纯度,给出了滴定终点的选择依据.方法简便易行,准确度达到工业分析的要求.图2,表3,参5.关键词 糠醛 电位滴定 条件分类号 TQ201THE QUICK METHOD TO DETERMINE FURFURAL BY ELECTROMETRIC TITRATION Liu Junfeng Yi Pinggui Jin Yisu(Dept. of Chemical Eng. of Xiangtan Mining Institute,Xiangtan ,Hunan,China,411201)ABSTRACT The electrometric titration to determine furfural has been discussed. It also studied the determination method ,the principle, the procedure, the cause for selecting the titration end to determine the pure level of the product and the content of furfural in the distillation liquid produced from straw of rice(or straw of wheat) by the modified sulfuric acid catalytic method. The results show that the method is simple and convenient and its accuracy reaches to the industrial analysis standard.2figs.,3tabs.,5refs.Key words electrometric titration, furfural,conditionSynopsis of the author Liu Junfeng, male, born in 1957, M.E., associate professor, original chemical technology and industrial catalyst. 羰基化合物的测定常见的方法主要有羟胺法、亚硫酸氢钠加成法和2,4-二硝基苯腙重量法[1].上述测定方法有的操作繁杂,有的终点褪色迅速,准确度较差.电位滴定法在羟基苯甲醛产品的分析测定中具有简单、快速、干扰较小等优点[2,3].本文讨论了改良硫酸法制取糠醛产品的测试方法,结果表明,用电位滴定法测定馏出液中糠醛的含量和产品的纯度,结果准确、方法简便易行.1 试验1.1 测定原理[4] 先用NaOH部分中和盐酸羟胺,生成的游离羟胺部分与羰基化合物形成肟,剩余的游离羟胺用盐酸标准溶液回滴,由空白和试样溶液滴定之差值计算试样中糠醛的百分含量.反应如下: 1.2 主要仪器、试剂和溶液 1) 主要仪器 自动电位滴定仪(精度pH=0.01),饱和甘汞电极,玻璃指示电极. 2) 氢氧化钠乙醇溶液( CNaOH=0.75 mol/L) 加入42.0g氢氧化钠(质量分数50%)溶液于688mL乙醇(质量分数95%)中. 3) 羟胺溶液 溶解40.0g盐酸羟胺(NH2OH.HCl)于160mL水中,用95%乙醇溶液稀释至1 L,再加入400 mL浓度为0.75 mol/L氢氧化钠溶液,混匀. 4) 盐酸标准溶液(CHCl=0.250 mol/L) 配制与标定按GB6014.2条进行.1.3 测定步骤与结果计算 称取2.0g(准确至0.0002g)试样于干燥的150mL烧杯中,加入10.0mL含量为95%乙醇,溶解后再加入13mL水,准确吸取25.00mL羟胺溶液至试样中,搅拌反应20min.放入玻璃电极和甘汞电极,在已校正好的酸度计上用0.2500mol/L的盐酸标准溶液滴定至溶液pH值为3.55时终止滴定,消耗体积为V1;除不加试样外,以同样的方法测定25.00mL羟胺溶液空白,消耗体积为V0,计算结果如下: 式中:w糠醛,糠醛的质量分数,%;V0,空白试液消耗盐酸标准溶液体积,mL;V1,被测试样滴定消耗盐酸标准溶液体积,mL;C,盐酸标准溶液浓度,mol/L;m,试样质量,g;系数0.096 09为糠醛的毫摩尔质量,g.2 结果与讨论2.1 测定方法的选择 试验结果发现,对于改良硫酸法制取糠醛产物中醛含量的分析,用亚硫酸氢钠法终点褪色迅速;如用羟胺法直接滴定则无明显滴定突跃,使得终点判断相当困难.唯有羟胺法的间接滴定法终点突跃较为明显,但样品本身的颜色对此法干扰较大,对于颜色较深的样品不适用. 如采用仪器检测法测定样品中的糠醛,由于试样中存在的无机离子和水分在[url=https://insevent.instrument.com.cn/t/Mp]气相色谱仪[/url]FID检测器上无响应,故归一化结果均偏高.因试样(特别是久置后)本身具有颜色,用可见或紫外吸收光谱仪测定均存在不同程度的干扰而造成结果准确度较差.所以最终选择了电位滴定法.2.2 滴定终点的确定 试验了不同量羟胺溶液滴定后终点pH值的变化,结果如图1. 由图1可知终点pH值分别为3.70、3.58、3.50.根据取样量计算,当试样反应完全后,羟胺剩余量大于15 mL,因此选择pH为3.55时作为滴定终点.计算得此条件下的终点误差约为0.02 mL. 盐酸标准溶液体积/mLa.5mL羟胺溶液滴定曲线(终点pHo 3.70)b.15mL羟胺溶液滴定曲线(终点pHo 3.58)c .25mL羟胺溶液滴定曲线(终点pHo 3.50)图1 羟胺溶液滴定曲线Fig.1 Curve of determining hydroxy amine2.3 滴定反应时间的选择 羰基化合成肟反应一般需30min方能完全,少数情况要在70 ℃以上水浴中进行.本法采用搅拌方式以加快反应速度.测定了室温条件下不同反应时间分析结果的稳定性,如图2.由图2可见,在室温搅拌反应20 min即能满足要求. 图2 不同反应时间糖醛测定含量Fig.2 Content of furfural according different reaction time2.4 测定方法的准确度 采用含量为99.00%的糠醛样品进行准确度试验.在所给试验条件下,测得其含量为99.02%,回收率为100.2%.然后用99.00%含量的糠醛配置标准样品,标样含量为55.26%,实测结果为55.13%,回收率99.76%(见表1),相对误差均符合工业分析公差[5]. 表1 分析方法准确度测定结果 Tab.1 Results of accuracy of the analysis method样品含量/%测定值/%平均值/%回收率/%平均误差/%相对误差/%样品含量/%测定值/%平均值/%回收率/%平均误差/%相对误差/%99.0099.1599.2599.1899.2299.20100.20.0350.2055.2655.1655.1255.1155.1399.760.0200.242.5 试样测定 1) 馏出液糠醛含量的测定 按本试验得出的测定条件,对8批蒸出液先用NaOH中和至pH值与空白试液相同,然后进行糠醛含量的测定,结果见表2. 表2 试样平行测定结果 Tab.2 Results of determination of parallel samples样品号测定值/%平均值/%相对偏差/%样品号测定值/%平均值/%相对偏差/%12.18 2.222.200.0251.561.491.530.0321.961.991.980.0261.641.541.590.0531.881.841.860.0271.411.321.370.0441.721.651.690.0381.361.271.320.04 由表2可见,采用本法两次平行测定结果差值不大于0.2%,相对偏差在0.1%以下. 2) 糠醛产品测定 用上述同样的方法,对连续10批产品进行测定,结果如表3. 表3 产品中糠醛含量测定结果 Tab.3 Determining results of furfural content in products 样品号测定值/%平均值/%相对偏差/%样品号测定值/%平均值/%相对偏差/%196.84 96.8096.820.02696.7296.9096.960.06297.3297.4197.370.05799.3699.2099.280.08395.1695.1095.130.03897.0296.9096.960.06498.2198.1298.170.05997.8297.7697.790.03599.1099.0199.060.041097.7697.5897.670.09 由表3可见,采用本法平行测定结果差值、相对偏差均符合工业分析标准. 3 结论 本法操作简便、仪器简单、准确度、精密度均能满足工业分析要求,可用于糠醛产品质量检测和改良硫酸法生产中糠醛蒸馏液醛含量的分析. *湖南省“八五”科技攻关项目(编号:01-942-57)第一作者简介 刘俊峰 男 42岁 硕士 副教授 有机化工与工业催化剂作者单位:湘潭矿业学院化学工程系,湖南湘潭,411201参考文献 1 西北师院等校编.有机分析教程.北京:人民教育出版社,1978.306~309 2 刘俊峰,易平贵,李晓湘.电位滴定法测定间羟基苯甲醛.分析化学,1996,24(9):1111 3 魏玉鹏.电位滴定法测定对羟基苯甲醛.江苏化工,1992,20(2):45~46 4 兰州大学化学系等编.有机微量定量分析.北京:科学出版社,1978.306~309 5 田景君.分析化学.北京:化学工业出版社,1979.113收稿日期:1998-10-25

电位滴定法测定化肥中的有效氮摘要: 采用自动电位滴定法,检测复合肥中总氮量。实验结果表明,此法快速、简便、分析条件易于控制,而且准确度和精确度都较为理想。关键词: 复合肥;电位滴定;氮含量 A Potentiometric Titration to Determination of the Effective Nitrogen Content in Compound Fertilizer Abstract: A new analysis method is presented for determination of the Effective Nitrogen in compound fertilizer with auto-potentiometric titrator.The experiment results show that the method has fast,simple and accurate characteristics,compared with the conventional analysis method.Key words:compound fertilizer;autopotentiometrie titrator;nitrogen content化学肥料在很大程度上补充和替代了农家肥,对农业、园艺业、畜牧业、养殖业的迅速发展起到了不可估量的推动作用。为了便于使用,复合肥料的包装上通常要注明养分含量,如30-5-5 表示含N 30%;P2O5 5%;K2O 5%,其他肥料依此类推。但是市售的复合肥种类繁多商家不一,产品品质良莠不齐,有些复合肥的实际含氮量可能与标示含量不符。目前氮的测定方法有凯氏定氮法(又称蒸馏法)和甲醛法。经典的凯氏法,运用范围广,但分析繁琐、费时、耗样量大;甲醛法变色不敏锐,终点难判断,常引起较大的偏差;而自动电位滴法选择性好、操作简单、不受样品混浊及颜色的影响[siz
请问电位滴定法测定土壤中氯离子含量为啥要加溴酚蓝(3.1-4.6)?我初步的理解是控制溶液的pH值。以免生成Ag2O. 好像AgOH的溶度积为2.0*10的-8次方。这样的话要是这样的话其他的指示剂应该也可行啊如甲基橙3.1-4.4, 溴钾酚绿3.1-4.6.不知你们是怎么理解的?
维权声明:本文为zengzhengce163 原创作品,本作者是该作品合法使用者,该作品未经授权不对外转载。摘要:采用电位滴定仪测定了油脂的皂化值,利用电位滴定仪能够识别多个滴定终点的特点,采用分步滴定法用盐酸分别滴定皂化液中过量的碱和生成的皂,根据滴定皂消耗的盐酸的量计算出样品的皂化值。分别采用全自动电位滴定法和国标GB/T5534-2008规定的方法对3个不同菜籽油样品各平行测定6次,前者测定结果的精密度优于国标方法测定结果的相对标准偏差。关键词:电位滴定,皂化值,油脂,自动皂化值是指皂化1g油脂所需的氢氧化钾的毫克数。油脂皂化值的测定一般都是按照GB/T5534-2008《动植物油脂 皂化值的测定》规定的方法进行,该方法经典,结果准确,但对深色样品不太适合。随着仪器技术和经济的发展,电位滴定仪在分析中的应用日益广泛,黄忠东等用电位滴定法测定了深色油脂的皂化值获得满意结果,但仍需要按标准做空白试验。文章所述方法充分利用全自动电位滴定仪能自动识别多个终点的特点,应用分步滴定方法,在不做空白的情况下,通过一次滴定即测出样品的皂化值,简化操作过程,提高测定结果的精密度和准确度。
我用瑞士万通的自动电位滴定仪测定30%单氰胺中单氰胺的含量,效果特别好。把检测方法介绍给大家。电位滴定法测定30%工业单氰胺中单氰胺的含量关键词:检测方法电位滴定法单氰胺Keyword:method ; Cyanamide ;electric titrimetryThe content of Industrial Cyanamide工业单氰胺中主含量的分析一般为化学法:酸性条件下加入过量的硝酸银,使样品中的氯离子转化为氯化银沉淀,过滤溶液;滤液中加入过量氨水,使得样品中的单氰胺与硝酸银生成氰化银沉淀,再次过虑溶液,滤液用硝酸酸化后,用硫氰酸钾滴定剩余的硝酸银,据此计算出样品中单氰胺含量。本文分析原理与化学法基本相同,利用电位滴定仪进行沉淀滴定,在有效保证分析结果准确性的前提下,简便了操作步骤,缩短分析时间。1 实验方法1.1 原理在酸性介质中,以复合银电极为指示,用硝酸银滴定样品溶液,使其中的氯离子生成氯化银沉淀;在碱性介质中,以复合银电极为指示,用硝酸银滴定样品溶液,使其中的氰根和氯离子生成沉淀。据此计算出单氰胺的含量。1.2 试剂和溶液1.2.1 硝酸溶液25%:量取308毫升硝酸,稀释至1000毫升。1.2.2 硼酸钠缓冲溶液:A液:称取30.92克硼酸溶于2500毫升水中;B液:称取10克氢氧化钠溶于2500毫升水中。A液+B液=1+1,混匀。1.2.3 硝酸银标准滴定溶液:C(AgNO3)=0.1mol/L,按GB/T601规定配制和标定。1.3 仪器1.3.1 自动电位滴定仪1.3.2 复合银电极1.3.3 磁力搅拌器1.3.4 磁力搅拌子1.4 分析步骤1.4.1 游离氯测定称取约2克样品(精确到0.0002克),记作m1,置于150毫升烧杯中,加水60毫升,放上搅拌子置于磁力搅拌器上搅拌溶解,用硝酸(1.2.1)溶液调至PH1,,插入复合银电极,用硝酸银标准滴定溶液(1.2.3)电位滴定,终点消耗硝酸银的体积记作V1。1.4.2 沉淀总量测定称取样品0.09~0.13克(精确到0.0002克)之间,记作m2,置于150毫升烧杯中,加硼酸钠(1.2.2)80毫升,放上搅拌子置于磁力搅拌器上搅拌溶解,插入复合银电极,用硝酸银标准滴定溶液(1.2.3)电位滴定,终点消耗硝酸银的体积记作V2。同时做空白试验,空白试验消耗的硝酸银体积数记为V0.1.4.3 计算单氰胺%= C(V2-M2*V1/M1-V0)*0.02102*100/M2式中:C—硝酸银标准滴定溶液浓度的准确值,单位mol/L;V0
目前一般实验室滴定分析采用的是人工滴定法,它是根据指示剂的颜色变化指示滴定终点,然后目测标准溶液消耗体积,计算分析结果。自动电位滴定法是通过电位的变化,由仪器自动判断终点。为了比较仪器和人工滴定方法的测定结果,我们选用了酸价和过氧化值两个指标,分别用自动电位滴定法和人工滴定法进行样品分析。 1 实验部分 1.1 自动电位滴定法的实验仪器 瑞士万通(METROHM)751GPD自动电位滴定仪 727磁力搅拌滴定台 10ml交换单元 6.0431.100Pt电极 6.0133.100pH玻璃电极 6.0729.100Ag/AgCl参比电极 6.0331.0Pt辅助电极 1.2 人工滴定法 按照GB/T5009.37—1996的方法测定样品中的酸价和过氧化值。 2 实验结果与讨论 2.1 两种滴定方法的测定结果对照 自动电位滴定法和人工滴定法测定植物油的酸价和过氧化值结果无显著性差异,表明自动电位滴定仪测定植物油酸价和过氧化值,与现行的国家卫生标准滴定方法结果相近。 2.2 两种滴定方法的精密度比较 选用酸价值较高的样品,分别用自动电位滴定法和人工滴定法平行测定5次,自动电位滴定法测定的相对标准偏差1.1%,人工滴定法为1.6% 平行测定酸价值较低的样品5次,自动电位滴定法测定的相对偏差为2.1%,而人工滴定法的相对标准偏差高达11.4%,表明自动电位滴定法的精密度优于人工滴定法。综上所述,自动电位滴定法测定结果与国标法无异,精密度达到检验要求。由于自动电位滴定法是根据滴定曲线的一阶导数确定终点,等当点与终点的误差非常小,准确度高,避免了人工滴定法由于要加指示剂可能因加入量、指示终点与等当量间、操作者对颜色判断等的误差 电动定位滴定法无须使用指示剂,故对有色溶液、浑浊度以及没有适合指示剂的溶液均可测定 Metrohm自动电位滴定仪可判断多达9个等当点,可以连续滴定溶液中的多个成分,如连续滴定水样中Ca2+、Mg2+,滴定混合酸。自动电位滴定仪还能对滴定分析的各种测定参数,例如测定日期、仪器型号、滴定用标准溶液的消耗量、滴定曲线作自动记录,并自动计算打印出测定结果作为原始记录保存,减少了分析者原始记录数据处理的工作量和运算差错,提高了实验室间分析结果的可比性,有利于实验室管理,因此适于理化分析实验室用作代替人工操作的分析仪器。

电位滴定法测定番茄酱pH值和总酸pH和总酸检测是番茄酱检测的两个重要指标,pH是生命体的基本属性,生命体本身是一个稳定的缓冲体系,所以pH相对是稳定的。总酸体现出酸碱性的强弱,而且变酸意味着东西有可能腐烂,生命体的腐朽过程中各种有机酸会随机产生!本实验室利用瑞士万通的702 SM Titrino 和728 stirrer进行检测。所引用标准为罐头食品的检验方法(GB/T 10786-2006)和食品中总酸的测定(GB/T 12456-2008)。http://ng1.17img.cn/bbsfiles/images/2013/10/201310020959_468942_2428063_3.jpg仪器和材料702 SM Titrino 728 stirrer Atago Rx-5000a 折光仪塑料烧杯,玻璃烧杯各一个本实验中使用水为蒸馏水实验方法在玻璃烧杯中称取4.0克番茄酱,加入100毫升水,搅拌均匀测总酸;在塑料烧杯中称取80克番茄酱,加入150毫升水,调到可溶性固形物为12.5%(Brix),进行pH测定;测定过程:pH值直接测定;总酸以标定的NaOH进行滴定,待滴定终点为8.10时,记下NaOH消耗的体积;以下是我实验室所做几批番茄酱的相关参数:http://ng1.17img.cn/bbsfiles/images/2013/10/201310020959_468943_2428063_3.jpg结果与讨论根据番茄酱检测的相关标准,GB/T14215-2008的规定,番茄酱的pH应该小于4.6,符合相关的国家标准。总酸含量也符合相关要求。本实验中,使用了电位滴定法检测番茄酱罐头中的总酸和pH。有时候我不禁感叹,属于电分析化学的时代已经过去了。电化学的灵敏度而言和滴定分析差不多,比滴定分析好的一点是不需要指示剂,减少了指示剂对滴定剂量的消耗。但是随着光谱色谱技术的发展,属于经典分析的空间已经很小了。本文与其说是对电位分析的描述,不如说是对经典分析的致敬!献给即将消亡的电化学分析!
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=162266]微波溶样-自动电位滴定法测定铁矿石中全铁量[/url]

[align=center][font='黑体'][size=29px]电位滴定法测定[/size][/font][font='黑体'][size=29px]可口[/size][/font][font='黑体'][size=29px]可乐中的磷酸含量[/size][/font][/align][size=12px]摘要:[/size][size=12px]介绍[/size][size=12px]了一种采用电位滴定[/size][size=12px]法[/size][size=12px]测定可乐中磷酸含量的[/size][size=12px]方法。[/size][size=12px]本科生即可完成实验,简单易行有效[/size][size=12px]。[/size][size=12px]选用电位滴定[/size][size=12px]技术[/size][size=12px]有效[/size][size=12px]解决[/size][size=12px]了[/size][size=12px]可口可乐有颜色,滴定终点不易判断的问题[/size][size=12px],同时[/size][size=12px]避免[/size][size=12px]了[/size][size=12px]传统滴定法在[/size][size=12px]滴定[/size][size=12px]终点判断上的主观性,[/size][size=12px]还[/size][size=12px]实现[/size][size=12px]了[/size][size=12px]自动化测定,[/size][size=12px]以提高测定[/size][size=12px]准确度。[/size][size=12px]运用[/size][size=12px]该方法测定[/size][size=12px]出[/size][size=12px]可口可乐中的磷酸含量为[/size][size=12px]0.196 g/L[/size][size=12px]。[/size][font='宋体'][size=12px]关键词:[/size][/font][size=12px]电位滴定法[/size][size=12px];[/size][size=12px]可口[/size][size=12px]可乐[/size][size=12px];[/size][size=12px]磷酸含量;含量测定[/size][font='仿宋'][size=18px]引[/size][/font][font='仿宋'][size=18px]言[/size][/font]碳酸饮料可乐已风靡世界百余年,受到很多人的喜爱。然而,可乐中含有磷酸。一般认为,过多饮用可乐会使得人体磷摄入过多,血磷增高,与血钙反应降低其浓度,从而破坏了骨钙与血钙之间的平衡,为保持血钙浓度的稳定,人体会动用骨钙来补充血钙损失,骨盐溶解,钙从骨骼中的溶解和脱出增加,进而造成人体骨质软化与骨质疏松[font='calibri'][sup][size=13px][1][/size][/sup][/font]。正因此,对可乐中的磷酸含量进行测定是非常有意义的,笔者选取可口可乐进行了探索。对于可口可乐中磷酸含量的测定,目前已有多个团队采用不同测定方法进行了探索,但所得结果不一,相差较大。江桐等采用酸碱(传统)滴定法测定可口可乐中的磷酸含量为0.36 g/L[font='calibri'][sup][size=13px][2][/size][/sup][/font];卢爱民等采用核磁共振磷谱法测定含量为0.8462 g/L[font='calibri'][sup][size=13px][3][/size][/sup][/font];陈清爱等基于MoS[font='calibri'][sub][size=13px]2[/size][/sub][/font]模拟酶测定含量为1.345 g/L;陈清爱等采用钼蓝比色法测定含量为1.336 g/L[font='calibri'][sup][size=13px][4][/size][/sup][/font];张帆等采用高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法测定含量为0.00449 g/L[font='calibri'][sup][size=13px][5][/size][/sup][/font];M. A. Bello等报道可口可乐中的磷酸含量为0.530 g/L[font='calibri'][sup][size=13px][[/size][/sup][/font][font='calibri'][sup][size=13px]1][/size][/sup][/font]。故而笔者对测定可口可乐中的磷酸含量进行了探索,试图设计一种本科生所能进行的简单易行的实验方法对可口可乐中的磷酸含量进行测定。1. [font='仿宋'][size=18px]实验部分[/size][/font]1.1 [font='黑体']实验[/font][font='黑体']设计[/font][font='黑体']讨论(实验中主要面临的困难与解决方案)[/font]1.1.1 [font='仿宋']可口可乐中物质成分较为复杂,可能存在磷酸以外的物质与滴定剂[/font]NaOH[font='仿宋']反应[/font]经查阅可口可乐包装,其配料为水、果葡糖浆、白砂糖、食品添加剂(二氧化碳、焦糖色、磷酸、咖啡因)、食用香精。易知,可口可乐中酸性物质仅含CO[font='calibri'][sub][size=13px]2[/size][/sub][/font](与水反应生成不稳定的碳酸)和磷酸。故,除去CO[font='calibri'][sub][size=13px]2[/size][/sub][/font]即可排除干扰,使用NaOH滴定可口可乐中的磷酸[font='calibri'][sup][size=13px][2][/size][/sup][/font]。1.1.2 [font='仿宋']可[/font][font='仿宋']口可[/font][font='仿宋']乐[/font][font='仿宋']有颜色,滴定终点[/font][font='仿宋']不易[/font][font='仿宋']判断[/font]配料中的焦糖色使得可口可乐为有色溶液,传统滴定法中确定滴定终点的指示剂变色后不易观察,难以判断是否到达终点。因此江桐等加入活性炭用以吸附可乐中的着色剂焦糖色,但无法排除活性炭可能吸附磷酸的干扰[font='calibri'][sup][size=13px][2][/size][/sup][/font]。而电位滴定法利用电极电位在化学计量点附近的突变来代替指示剂的颜色变化确定滴定终点,利于对有颜色或浑浊的待测溶液滴定。同时,选用电位滴定法不仅可避免传统滴定法在终点判断上的主观性,还可实现自动化和连续测定,灵敏度和准确度高。其也因此被广泛应用于食品、药学、冶金等领域的样品分析[font='calibri'][sup][size=13px][6][/size][/sup][/font]。故而笔者选用电位滴定法测定可口可乐中的磷酸含量,以解决可口可乐有颜色,滴定终点不易判断的问题。1.2 [font='黑体']实验试剂、材料和仪器[/font]试剂:NaOH、可口可乐(三瓶不同批次的)、去离子水仪器:电子天平、小烧杯(100mL)、玻璃棒、容量瓶(500mL)、滴管、油浴锅、烧瓶、冷凝管、电位滴定仪、滤纸、移液管(50mL)1.3 [font='黑体']实验步骤[/font](各步骤具体操作请见实验指导书)(1)配制0.05 mol/L NaOH溶液;(2)100℃回流加热20分钟除去可口可乐样品中的CO[font='calibri'][sub][size=13px]2[/size][/sub][/font];(3)润洗电位滴定仪滴定管;(4)NaOH电位滴定可口可乐中的磷酸;(5)计算可口可乐中的磷酸含量。[size=18px]2[/size][size=18px].[/size][font='仿宋'][size=18px]结果[/size][/font][font='仿宋'][size=18px]与讨论[/size][/font]2.1 实验[font='黑体']数据及数据处理[/font][align=center][size=12px]表[/size][size=12px]1[/size][size=12px] [/size][size=12px]实验数据及数据处理[/size][/align][table][tr][td][align=right][size=9px][color=#000000]NaOH[/color][/size][font='calibri'][size=9px][color=#000000]浓度[/color][/size][/font][/align][/td][td][align=left][font='calibri'][size=9px][color=#000000]([/color][/size][/font][size=9px][color=#000000]mol/L[/color][/size][font='calibri'][size=9px][color=#000000])[/color][/size][/font][/align][/td][td=6,1][align=center][size=9px][color=#000000]0.05[/color][/size][/align][/td][/tr][tr][td][align=right][font='calibri'][size=9px][color=#000000]样品体积[/color][/size][/font][/align][/td][td][align=left][font='calibri'][size=9px][color=#000000]([/color][/size][/font][size=9px][color=#000000]mL[/color][/size][font='calibri'][size=9px][color=#000000])[/color][/size][/font][/align][/td][td=6,1][align=center][size=9px][color=#000000]50.00[/color][/size][/align][/td][/tr][tr][td][align=right][font='calibri'][size=9px][color=#000000]样品批次[/color][/size][/font][/align][/td][td][align=left][font='calibri'][size=9px][color=#000000]【生产日期】[/color][/size][/font][/align][/td][td=3,1][align=center][size=9px][color=#000000]0307[/color][/size][/align][/td][td=3,1][align=center][size=9px][color=#000000]0321[/color][/size][/align][/td][/tr][tr][td][align=right][font='calibri'][size=9px][color=#000000]平行滴定[/color][/size][/font][/align][/td][td][align=left][font='calibri'][size=9px][color=#000000]【第几次】[/color][/size][/font][/align][/td][td][align=center][size=9px][color=#000000]1[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]2[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]3[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]1[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]2[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]3[/color][/size][/align][/td][/tr][tr][td][align=right][size=9px][color=#000000]NaOH[/color][/size][font='calibri'][size=9px][color=#000000]用量[/color][/size][/font][/align][/td][td][align=left][font='calibri'][size=9px][color=#000000]([/color][/size][/font][size=9px][color=#000000]mL[/color][/size][font='calibri'][size=9px][color=#000000])[/color][/size][/font][/align][/td][td][align=center][size=9px][color=#000000]5.903[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]5.927[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]5.920[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]5.933[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]6.051[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]6.250[/color][/size][/align][/td][/tr][tr][td][align=right][font='calibri'][size=9px][color=#000000]磷酸含量[/color][/size][/font][/align][/td][td][align=left][font='calibri'][size=9px][color=#000000]([/color][/size][/font][size=9px][color=#000000]g/L[/color][/size][font='calibri'][size=9px][color=#000000])[/color][/size][/font][/align][/td][td][align=center][size=9px][color=#000000]0.193[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]0.194[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]0.193[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]0.194[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]0.198[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]0.204[/color][/size][/align][/td][/tr][tr][td][align=right][font='calibri'][size=9px][color=#000000]磷酸各批次平均含量[/color][/size][/font][/align][/td][td][align=left][font='calibri'][size=9px][color=#000000]([/color][/size][/font][size=9px][color=#000000]g/L[/color][/size][font='calibri'][size=9px][color=#000000])[/color][/size][/font][/align][/td][td=3,1][align=center][size=9px][color=#000000]0.193[/color][/size][/align][/td][td=3,1][align=center][size=9px][color=#000000]0.199[/color][/size][/align][/td][/tr][tr][td][align=right][font='calibri'][size=9px][color=#000000]绝对偏差[/color][/size][/font][/align][/td][td][align=left][font='calibri'][size=9px][color=#000000]([/color][/size][/font][size=9px][color=#000000]g/L[/color][/size][font='calibri'][size=9px][color=#000000])[/color][/size][/font][/align][/td][td][align=center][size=9px][color=#000000]0.000[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]0.001[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]0.000[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]-0.005[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]-0.001[/color][/size][/align][/td][td][align=center][size=9px][color=#000000]0.005[/color][/size][/align][/td][/tr][tr][td][align=right][font='calibri'][size=9px][color=#000000]平均偏差[/color][/size][/font][/align][/td][td][align=left][font='calibri'][size=9px][color=#000000]([/color][/size][/font][size=9px][color=#000000]g/L[/color][/size][font='calibri'][size=9px][color=#000000])[/color][/size][/font][/align][/td][td=3,1][align=center][size=9px][color=#000000]0.000[/color][/size][/align][/td][td=3,1][align=center][size=9px][color=#000000]0.004[/color][/size][/align][/td][/tr][tr][td][align=right][font='calibri'][size=9px][color=#000000]相对平均偏差[/color][/size][/font][/align][/td][td][align=left][font='calibri'][size=9px][color=#000000]([/color][/size][/font][size=9px][color=#000000]%[/color][/size][font='calibri'][size=9px][color=#000000])[/color][/size][/font][/align][/td][td=3,1][align=center][size=9px][color=#000000]0[/color][/size][/align][/td][td=3,1][align=center][size=9px][color=#000000]2[/color][/size][/align][/td][/tr][tr][td][align=right][font='calibri'][size=9px][color=#000000]磷酸总平均含量[/color][/size][/font][/align][/td][td][align=left][font='calibri'][size=9px][color=#000000]([/color][/size][/font][size=9px][color=#000000]g/L[/color][/size][font='calibri'][size=9px][color=#000000])[/color][/size][/font][/align][/td][td=6,1][align=center][size=9px][color=#000000]0.196[/color][/size][/align][/td][/tr][tr][td][align=right][font='calibri'][size=9px][color=#000000]绝对偏差[/color][/size][/font][/align][/td][td][align=left][font='calibri'][size=9px][color=#000000]([/color][/size][/font][size=9px][color=#000000]g/L[/color][/size][font='calibri'][size=9px][color=#000000])[/color][/size][/font][/align][/td][td=3,1][align=center][size=9px][color=#000000]-0.003[/color][/size][/align][/td][td=3,1][align=center][size=9px][color=#000000]0.003[/color][/size][/align][/td][/tr][tr][td][align=right][font='calibri'][size=9px][color=#000000]平均偏差[/color][/size][/font][/align][/td][td][align=left][font='calibri'][size=9px][color=#000000]([/color][/size][/font][size=9px][color=#000000]g/L[/color][/size][font='calibri'][size=9px][color=#000000])[/color][/size][/font][/align][/td][td=6,1][align=center][size=9px][color=#000000]0.003[/color][/size][/align][/td][/tr][tr][td][align=right][font='calibri'][size=9px][color=#000000]相对平均偏差[/color][/size][/font][/align][/td][td][align=left][font='calibri'][size=9px][color=#000000]([/color][/size][/font][size=9px][color=#000000]%[/color][/size][font='calibri'][size=9px][color=#000000])[/color][/size][/font][/align][/td][td=6,1][align=center][size=9px][color=#000000]2[/color][/size][/align][/td][/tr][/table]2.2 各试样电位滴定(E-V)图像[align=center][img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310251312436947_148_6193225_3.png[/img][/align][align=center][size=12px]图[/size][size=12px]1[/size][size=12px] [/size][size=12px]试样[/size][size=12px]0307-1[/size][font='宋体'][size=12px]电位滴定([/size][/font][size=12px]E-V[/size][font='宋体'][size=12px])图像[/size][/font][/align][align=center][img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310251312436707_6327_6193225_3.png[/img][/align][align=center][size=12px]图[/size][size=12px]2 [/size][size=12px]试样[/size][size=12px]0307-2[/size][font='宋体'][size=12px]电位滴定([/size][/font][size=12px]E-V[/size][font='宋体'][size=12px])图像[/size][/font][/align][align=center][img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310251312438994_4194_6193225_3.png[/img][/align][align=center][size=12px]图[/size][size=12px]3 [/size][size=12px]试样[/size][size=12px]0307-3[/size][font='宋体'][size=12px]电位滴定([/size][/font][size=12px]E-V[/size][font='宋体'][size=12px])图像[/size][/font][/align][align=center][img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310251312442874_1765_6193225_3.png[/img][/align][align=center][size=12px]图[/size][size=12px]4 [/size][size=12px]试样[/size][size=12px]0321-1[/size][font='宋体'][size=12px]电位滴定([/size][/font][size=12px]E-V[/size][font='宋体'][size=12px])图像[/size][/font][/align][align=center][img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310251312444029_5777_6193225_3.png[/img][/align][align=center][size=12px]图[/size][size=12px]5 [/size][size=12px]试样[/size][size=12px]0321-2[/size][font='宋体'][size=12px]电位滴定([/size][/font][size=12px]E-V[/size][font='宋体'][size=12px])图像[/size][/font][/align][align=center][img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310251312442594_8974_6193225_3.png[/img][/align][align=center][size=12px]图[/size][size=12px]6 [/size][size=12px]试样[/size][size=12px]0321-3[/size][font='宋体'][size=12px]电位滴定([/size][/font][size=12px]E-V[/size][font='宋体'][size=12px])图像[/size][/font][/align][size=18px]3.[/size][font='仿宋'][size=18px]结论[/size][/font]电位滴定法测定可口可乐中的磷酸含量为0.196 g/L。[size=18px]4[/size][size=18px].[/size][size=18px]创新点[/size]第一,采用电位滴定技术设计了一种新的可乐中磷酸含量的测定方法,本科生即可完成实验,简单易行有效;第二,得到了采用电位滴定法测定出的可口可乐中的磷酸含量数据。[align=left][font='黑体'][color=#000000]参考文献[/color][/font][/align][size=12px][color=#000000][1][/color][/size][size=12px][color=#000000]张琳娜[/color][/size][size=12px][color=#000000].[/color][/size][size=12px][color=#000000]“可乐”与磷酸[/color][/size][size=12px][color=#000000][J].[/color][/size][size=12px][color=#000000]卫生职业教育[/color][/size][size=12px][color=#000000],2004(10):107.[/color][/size][size=12px][color=#000000][[/color][/size][size=12px][color=#000000]2[/color][/size][size=12px][color=#000000]][/color][/size][size=12px][color=#000000]江桐[/color][/size][size=12px][color=#000000],[/color][/size][size=12px][color=#000000]王奕聪[/color][/size][size=12px][color=#000000].[/color][/size][size=12px][color=#000000]利用酸碱滴定法测定可乐中的磷酸含量的探究[/color][/size][size=12px][color=#000000][J].[/color][/size][size=12px][color=#000000]实验教学与仪器[/color][/size][size=12px][color=#000000],2019,36(06):70-71.[/color][/size][size=12px][color=#000000][[/color][/size][size=12px][color=#000000]3[/color][/size][size=12px][color=#000000]][/color][/size][size=12px][color=#000000]卢爱民[/color][/size][size=12px][color=#000000],[/color][/size][size=12px][color=#000000]李小龙[/color][/size][size=12px][color=#000000],[/color][/size][size=12px][color=#000000]陈敏[/color][/size][size=12px][color=#000000],[/color][/size][size=12px][color=#000000]杨春龙[/color][/size][size=12px][color=#000000].[/color][/size][size=12px][color=#000000]核磁共振[/color][/size][size=12px][color=#000000]磷谱快速[/color][/size][size=12px][color=#000000]测定可乐饮料中磷酸根[/color][/size][size=12px][color=#000000][J].[/color][/size][size=12px][color=#000000]分析试验室[/color][/size][size=12px][color=#000000],2018,37(05):604-606.[/color][/size][size=12px][color=#000000][[/color][/size][size=12px][color=#000000]4[/color][/size][size=12px][color=#000000]][/color][/size][size=12px][color=#000000]陈清爱[/color][/size][size=12px][color=#000000],[/color][/size][size=12px][color=#000000]钟良双[/color][/size][size=12px][color=#000000],[/color][/size][size=12px][color=#000000]庞杰[/color][/size][size=12px][color=#000000],[/color][/size][size=12px][color=#000000]郭良洽[/color][/size][size=12px][color=#000000].[/color][/size][size=12px][color=#000000]基于[/color][/size][size=12px][color=#000000]MoS[/color][/size][font='calibri'][sub][size=12px][color=#000000]2[/color][/size][/sub][/font][size=12px][color=#000000]模拟酶检测可口可乐饮料中的磷酸根[/color][/size][size=12px][color=#000000][J].[/color][/size][size=12px][color=#000000]福州大学学报[/color][/size][size=12px][color=#000000]([/color][/size][size=12px][color=#000000]自然科学版[/color][/size][size=12px][color=#000000]),2016,44(01):124-128.[/color][/size][size=12px][color=#000000][[/color][/size][size=12px][color=#000000]5[/color][/size][size=12px][color=#000000]][/color][/size][size=12px][color=#000000]张帆[/color][/size][size=12px][color=#000000],[/color][/size][size=12px][color=#000000]贺学锋[/color][/size][size=12px][color=#000000],[/color][/size][size=12px][color=#000000]汪学楷[/color][/size][size=12px][color=#000000].[/color][/size][size=12px][color=#000000]高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法测定可乐饮料中食品添加剂的含量[/color][/size][size=12px][color=#000000][J].[/color][/size][size=12px][color=#000000]四川大学学报[/color][/size][size=12px][color=#000000]([/color][/size][size=12px][color=#000000]工程[/color][/size][size=12px][color=#000000]科学版[/color][/size][size=12px][color=#000000]),2000(04):56-58.[/color][/size][size=12px][color=#000000][[/color][/size][size=12px][color=#000000]6[/color][/size][size=12px][color=#000000]][/color][/size][size=12px][color=#000000]白颖[/color][/size][size=12px][color=#000000],[/color][/size][size=12px][color=#000000]陶成艳[/color][/size][size=12px][color=#000000],[/color][/size][size=12px][color=#000000]周芝兰[/color][/size][size=12px][color=#000000],[/color][/size][size=12px][color=#000000]袁[/color][/size][size=12px][color=#000000]小宝[/color][/size][size=12px][color=#000000],[/color][/size][size=12px][color=#000000]万军[/color][/size][size=12px][color=#000000].[/color][/size][size=12px][color=#000000]电位滴定法在中药化学分析中的应用[/color][/size][size=12px][color=#000000][J].[/color][/size][size=12px][color=#000000]化学工程师[/color][/size][size=12px][color=#000000],2021,35(09):45-47+28.[/color][/size]
自动电位滴定法测定铬矿中三氧化二铬含量的不确定度评定1 技术规范1.1 检测依据:FB 01:2010电位滴定法测定铬矿中三氧化二铬含量1.2 环境条件:室温1.3 仪器、器具与试剂METTLET AE240电子天平、METTLET DL55 自动电位滴定仪、250ml容量瓶、25ml滴定管;重铬酸钾(基准试剂)、重铬酸钾标准溶液(1.5900g/250ml)1.4 测定原理和方法将样品用过氧化钠熔融分解,熔块用水浸出,酸化、煮沸,加入硫磷混酸后,用电位滴定仪滴定。刚玉坩埚中加入2g过氧化钠,称取试样0.2000g置于刚玉坩埚中,充分搅拌混匀,表面再覆盖1g过氧化钠,加盖后,放入马弗炉中,从低温升至700℃并熔融10分钟,取出后轻微摇动10s,重新放入马弗炉中再熔融10-20min,取出后稍冷却,放入500mL烧杯中,加入热水,盖上表面皿,待激烈反应停止后,称热滴加硫酸(1+1)淋洗出坩埚,再放入硫酸(1+1)30mL,加入玻璃珠煮沸10分钟,取下放置,冷却后加入硫磷混酸(15:15:70)10mL,用水稀释至约300mL,使用电位滴定仪用硫酸亚铁铵标准溶液滴定。1.5 评定结果的使用 符合上述条件的测量,一般可参照使用本不确定度的评定结果以考察结果的准确性。在日常测定中,重复性试验的单次测量标准不确定度可以直接使用本评估报告的数据。1.6 本评估报告中包含了一个近似取值,实验室环境温度因为能使用空调可以近似认为在20℃左右。1.7 评估依据JJF1059-1999《测量不确定度评定与表示》1.8 建立数学模型C=V*T*rep/m式中:C为测定铬矿中三氧化二铬含量的质量分数,%; T为1mL硫酸亚铁铵标准溶液相当于三氧化二铬的克数,g/mL; V-滴定消耗硫酸亚铁铵的毫升数,mL;m为试样重量,g;rep为样品处理的一致性。2 不确定度来源的确定和分析2.1 m此过程受天平和称重测量带来的影响。天平校准的影响来源于天平的灵敏度和线性影响。2.2 T2.2.1 V1移液管校准误差的影响。 实际温度与校准时温度不一致的影响。2.2.2 V2容量瓶校准误差的影响 实际温度与校准时温度不一致的影响。2.2.3 C m1称样带来的影响。 [/size
电位滴定法与永停滴定法电位滴定法与永停滴定法是容量分析中用以确定终点或选择核对指示剂变色域的方法。选用适当的电极系统可以作氧化还原法、中和法(水溶液或非水溶液)、沉淀法、重氮化法或水分测定法等的终点指示。 电位滴定法选用2支不同的电极。1支为指示电极,其电极电势随溶液中被分析成分的离子浓度的变化而变化;另1支为参比电极,其电极电势固定不变。在到达滴定终点时,因被分析成分的离子浓度急剧变化而引起指示电极的电势突减或突增,此转折点称为突跃点。 永停滴定法采用2支相同的铂电极,当在电极间加一低电压(例如50mV)时,若电极在溶液中极化,则在未到滴定终点前,仅有很小或无电流通过;但当到达终点时,滴定液略有过剩,使电极去极化,溶液中即有电流通过,电流计指针突然偏转,不再回复。反之,若电极由去极化变为极化,则电流计指针从有偏转回到零点,也不再变动。仪器装置 电位滴定可用电位滴定仪、酸度计或电位差计,永停滴定可用永停滴定仪或按图示装置。 电流计的灵敏度除另有规定外,测定水分时用10A/格,重氮化法用10A/格。所用电极可按下表选择。 ────────┬──────────┬────────────── 方 法 │ 电 极 系 统 │ 说 明 ────────┼──────────┼────────────── 水溶液氧化还原法│ 铂-饱和甘汞 │铂电极用加有少量三氯化铁的硝 │ │酸或用铬酸清洁液浸洗 ────────┼──────────┼────────────── 水溶液中和法 │玻璃-饱和甘汞 │ ────────┼──────────┼────────────── 非水溶液中和法 │玻璃-饱和甘汞 │饱和甘汞电极套管内装氯化钾的 │ │饱和无水甲醇溶液。玻璃电极用 │ │过后应即清洗并浸在水中保存 ────────┼──────────┼────────────── 水溶液银量法 │ 银-玻璃 │银电极可用稀硝酸迅速浸洗 ├──────────┼────────────── │银-硝酸钾盐桥-饱和甘│ │汞 │ ────────┼──────────┼────────────── -C≡CH中氢置换法│玻璃-硝酸钾盐桥-饱和│ │甘汞 │ ────────┼──────────┼────────────── 硝酸汞电位滴定法│铂-汞-硫酸亚汞 │铂电极可用10%(g/ml)硫代硫酸 │ │钠溶液浸泡后用水清洗。汞-硫 │ │酸亚汞电极可用稀硝酸浸泡后用 │ │水清洗。────────┼──────────┼──────────────永停法 │铂-铂 │铂电极用加有少量三氯化铁的硝 │ │酸或用铬酸清洁液浸洗 ────────┴──────────┴──────────────滴定法 (1)电位滴定法 将盛有供试品溶液的烧杯置电磁搅拌器上,浸入电极,搅拌,并自滴定管中分次滴加滴定液;开始时可每次加入较多的量,搅拌,记录电位;至将近终点前,则应每次加入少量,搅拌,记录电位;至突跃点已过,仍应继续滴加几次滴定液,并记录电位。 滴定终点的确定 用坐标纸以电位(E)为纵坐标,以滴定液体积(V)为横坐标,绘制E-V曲线,以此曲线的陡然上升或下降部分的中心为滴定终点。或以△E/△V(即相邻两次的电位差和加入滴定液的体积差之比)为纵坐标,以滴定液体积(V)为横坐标,绘制(△E/△V)-V曲线,与△E/△V的极大值对应的体积即为滴定终点。也可采用二阶导数确定终点。根据求得的△E/△V值,计算相邻数值间的差值,即为△E/△V,绘制(△E/△V)-V曲线,曲线过零时的体积即为滴定终点。 如系供指示剂变色域的选择核对,滴定前加入指示剂,观察终点前至终点后的颜色变化,以选定该品种终点时的指示剂颜色。 (2)永停滴定法 用作重氮化法的终点指示时,调节R使加于电极上的电压约为50mV。取供试品适量,精密称定,置烧杯中,除另有规定外,可加水40ml与盐酸溶液(1→2)15ml,而后置电磁搅拌器上,搅拌使溶解,再加溴化钾2g,插入铂-铂电极后,将滴定管的尖端插入液面下约2/3处,用亚硝酸钠滴定液(0.1mol/L或0.05mol/L)迅速滴定,随滴随搅拌,至近终点时,将滴定管的尖端提出液面,用少量水淋洗尖端,洗液并入溶液中,继续缓缓滴定,至电流计指针突然偏转,并不再回复,即为滴定终点。用作水分测定的终点指示时,可调节R使电流计的初始电流为5~10μA,待滴定到电流突增至50~150μA,并持续数分钟不退回,即为滴定终点。
求助:电势滴定法测定苯巴比妥钠的含量/氧化还原滴定法测定磺胺嘧啶含量2个方法wzwl@163.com
滴定法测定含有Na2S的样品时,应采用( )。 (A)EDTA配位滴定法 (B)莫尔法 (C)碘量法 (D)佛尔哈德法
电位滴定法和永停滴定法有何联系和区别?两者的使用范围有何不同呢?哪种方法更为实用呢?
GB/T 223.11-2008 钢铁及合金 铬含量的测定 可视滴定或电位滴定法[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=190508]GBT 223.11-2008 钢铁及合金 铬含量的测定 可视滴定或电位滴定法.pdf[/url]
电位滴定法的优点:电位滴定法一般具有较高的准确度和精密度,但分析时间较长。由于电位滴定法测量的是随滴定剂加入而引起的电池电动势的变化,而不是电动势的绝对值,即使电极的斜率少有变化,也不影响测量结果。而其液接电位和活度系数的变化很小,等当点附近电位突跃较大,容易准确测定终点。电位滴定法的缺点:电位滴定的运用也有一定的局限性:其灵敏度受低浓度时电极电位测量准确度的限制,浓度低于10[sup]-5[/sup] mol/L时,残余电流成为零电流电位法中的干扰因素。因此,若溶液浓度低于10[sup]-3[/sup] mol/l时,就需要采用其他滴定方法,才能保证一定准确度。[em0910]
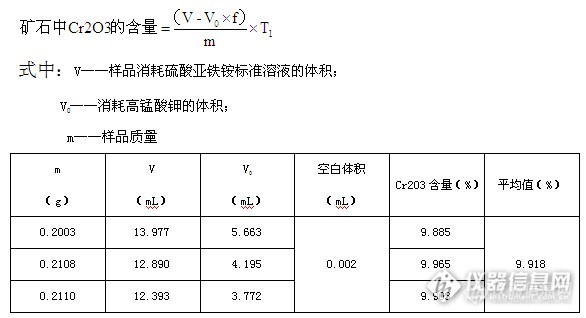
微波消解—电位滴定法测定铬矿石中Cr2O3含量 摘要:本文采用硫酸-磷酸-氟硼酸作为消解试剂用微波消解仪进行消解,电位滴定仪测定铬矿石中的Cr2O3含量。测定结果均在合理的允差范围之内。与传统方法相比具有简单、快速、污染小等优点。关键词:铬矿石;Cr2O3;微波消解;电位滴定仪引言我国是一个铬铁矿资源严重短缺的国家,也是全球最大的铬矿石进口国,矿石中Cr2O3的含量对铬矿石的烧结和冶炼都有直接影响,在贸易合同中均会规定Cr2O3的含量。常规消解方法采用过氧化钠碱熔法来处理铬矿石样品,但该方法消解时间较长,处理过程中会引入杂质,且会给实验人员和环境造成伤害和污染。近年来微波消解作为一种快速前处理手段被越来越多的分析工作者采用,微波消解结合电位滴定法测定铬矿石中Cr2O3含量大大缩短了分析时间,节约了检测成本,节省人力。1.实验部分1.1仪器与试剂微波消解仪;全自动电位滴定仪1.2主要试剂浓硫酸(AR);浓磷酸(AR);氟硼酸(AR);硫酸锰溶液(1g/L)硝酸银溶液(1g/L)氯化钠溶液(50g/L);过硫酸铵溶液(500g/L)亚硝酸钾(10g/L)硫酸亚铁铵标准溶液(0.1mol/L)高锰酸钾标准溶液1.3实验过程1.3.1 样品前处理将样品置于烘箱于105[font='Times New
名称:ASTM D 664-06 电位滴定法测定石油产品酸值的标准试验方法阿拉山口检验检疫局技术中心 赵晶晶 中哈管道石油公司 常健辉 译本标准使用固定的名称D 664发行;名称后的数字表示第一次采用的年份或最后一次修订的年份。括号里的数字表示最后一次采用的年份。上标表示最后一次修订或采用的版本改变。1. 使用范围1.1本测试方法详述了在甲苯和异丙醇的混合物中可溶或微溶的石油产品和润滑油中酸性成分的测定步骤。它适用于所测的酸在水中的电离常数大于10-9;水解常数小于10-9的弱酸不干扰测定。水解常数大于10-9的盐会发生反应。包括在此精密度酸值范围是0.1mg/g KOH到150mg/g KOH。注1:新油或使用过的油品中,被认为酸性的组分包括有机酸、无机酸、酯类、酚类化合物、内酯、树脂以及重金属盐类、胺盐和其他弱碱的盐类、多元酸的酸式盐,以及某些抗氧和清洁添加剂。1.2本方法可以用来表示发生在油品使用过程中,被氧化条件下的相对变化,在此不考虑油品的颜色和其他的特性的变化。尽管滴定是在明确的平衡条件下进行,但本方法不是用来测定能够预示在操作条件下油品性能的绝对酸性的。酸值与承受腐蚀之间无确定关系。注2:用这种方法测得的酸值与用D974和D3339测得的酸值可能一样,也可能不一样。没有尝试做过此方法和其他非滴定方法的关联。1.3认为以国际单位制表示的数值是标准的。括号里的数值仅作为参考。1.4本标准并未对相关的所有的安全问题都提出建议。因此,在使用本标准之前应建立相应的安全和健康防护措施并制定出相关制度及使用范围。2. 参考文献2.1美国标准:D974用颜色指示剂滴定法测定酸碱值的标准试验方法D1193试剂水的规格D3339Semi-Micro半微量颜色指示剂滴定法测定石油产品酸值的试验方法D4057 石油和石油产品的手工取样法D4177 石油和石油产品的自动取样法3.术语3.1 定义:3.1.1总酸值,n---碱量,表示为滴定每克样品到指定终点所消耗的氢氧化钾的毫克数。3.1.1.1讨论—本方法以每克样品消耗的氢氧化钾的毫克数表示酸值。要求滴定加入了少量的水的混合甲苯和异丙醇的样品,,从伏特计上最初的毫伏读数到方法中规定的毫伏读数。方法中要求的毫伏读数是指新配置的碱性缓冲水溶液的电位值,或曲线上有明显拐点时对应的毫伏读数。3.1.1.2讨论—本方法提供了附加信息。表示以每克样品消耗的氢氧化钾的毫克数表示酸值。要求滴定溶剂中的样品从伏特计上最初的毫伏读数到方法中规定的毫伏读数。方法中要求的毫伏读数是指新配置的酸性缓冲水溶液的电位值,或曲线上有明显拐点时对应的毫伏读数。此值被定义为强酸值。3.1.1. 讨论—所谓的强酸值与其他酸值所造成的影响是不同的,因此,本方法的使用者如果发现这种现象,必须加以区分和注明。4.试验方法概要:4.1试样溶解在含有少量水的甲苯和异丙醇的混合物中,在使用玻璃指示电极和甘汞电极的电位滴定仪上,用KOH异丙醇溶液滴定。用电位计读数,分别和手动、自动滴定所消耗的滴定剂的体积作图,以曲线的突跃点作为滴定终点,当所得的曲线无明显突跃点时,终点为碱性水溶液和酸性缓冲溶液在电位计上相应的电位值读数。5用途及重要性5.1新的或使用后的油品,由于氧化生成的加成和分解产物,含有酸或碱性组分。本方法可以测定其相对变化。总酸值是在油品一直处于测定条件下这些酸性物质的总值。该酸值可用于控制润滑油质量,有时也可用于润滑油使用过程中消耗的计量。但作为润滑油报废指标仍是经验值。5.2由于氧化产物会引起酸值的增长,同时又引起有机酸的腐蚀性变化,所以本方法不能用于预测在使用过程中油的腐蚀性。酸值与油品腐蚀金属的程度两者之间无一定关系。6仪器设备6.1手动滴定装置:6.1.1仪表,伏特计或电位计,当电位计与6.1.2和6.1.3中所述电极一同使用时,并且当电阻范围在0.2~20MΏ时,电位计的精度为±0.005V,灵敏度为±0.002V,测量范围是±0.5V。仪表应远离杂散电场,以免因为一些接触使仪表的读数产生永久性的变化。这些接触包括与接地导线,与暴露在外的玻璃电极表面,玻璃电极导线,滴定台,或仪表的接触。注3—一个合适的测定装置应该在输
【前言】:现行硫酸根离子测定的方法有:重量法,电位滴定法,光度法,离子色谱法。重量法:样品溶液调至弱酸性,加入氯化钡溶液生成硫酸钡沉淀,沉淀经过滤、洗涤、烘干、称重,计算硫酸根含量。该方法实验过程繁琐,人工操作步骤多,而且耗时较长,一个样品需要几个小时才能完成。电位滴定法:氯化钡与样品中硫酸根生成难溶的硫酸钡沉淀,过剩的钡离子用EDTA标准溶液滴定,间接测定硫酸根。该方法虽然效率高,但对于基质复杂的样品,例如金属离子含量多,干扰因素多,造成结果不准确,电极需要定期维护。光度法:样品溶液中加入铬酸钡悬浮液生成硫酸钡沉淀,硫酸根离子置换的铬酸根离子以分光光度法测定,间接求出硫酸根离子含量。该法对于高含量的样品需要多次稀释,容易造成误差,而且试剂需要专用试剂,仪器运行成本高。离子色谱法:通过离子色谱柱分离出硫酸根离子,电导检测器检测其含量。该方法测定时间长,而且不适于高含量硫酸根的检测。【网络会议】:第五种硫酸根离子测定方法——温度滴定法测定硫酸根含量【讲座时间】:2015年07月10日 14:00【主讲人】:龚雁(国家纳米技术与工程研究院清华平台色谱组:开展硕士研究生课题的研究工作; 清华大学分析测试中心: 开展硕士研究生课题的研究工作;北京化工大学分析化学专业 硕士毕业;全国产品经理,有丰富的理论和客户实操经验。)【会议介绍】您样品中的硫酸根是如何测定的?还在用复杂而又耗时的重量分析法吗?日常分析中,您使用电位滴定时,遇到过下面的情况吗?----电位电极维护复杂,寿命短、分析人员希望不同滴定只用一个传感器??NOW,瑞士万通859 tiamo 温度滴定系统解决您上面所有问题!本次讲座主要内容:1、温度滴定简要介绍;2、硫酸根离子常见测定方法;3、温度滴定测定硫酸根离子的方法以及检测限;4、温度滴定测定硫酸根离子的方法优势;5、该应用涉及行业: 测定钒电池电解液中的硫酸根含量 检测硫酸铝铵溶液中铝离子、铵离子和硫酸根 测定电镀 Cr 溶液中SO42-含量 测定复合肥中硫酸根含量 检测火电厂脱硫浆液中的硫酸根含量 测定复合肥中硫酸根含量 测定化工产品中硫酸根含量 测定酯化反应液中的硫酸根 -------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名参加。2、报名并参会用户有机会获得100元手机充值卡一张哦~3、报名截止时间:2015年07月10日 14:004、报名参会网址:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/15145、报名及参会咨询:QQ群—379196738http://ng1.17img.cn/bbsfiles/images/2015/04/201504071009_540886_2507958_3.jpg
求助:标准GB/T 18609-2011 原油酸值的测定 电位滴定法;求2011年新颁布的,2001年的本人有。
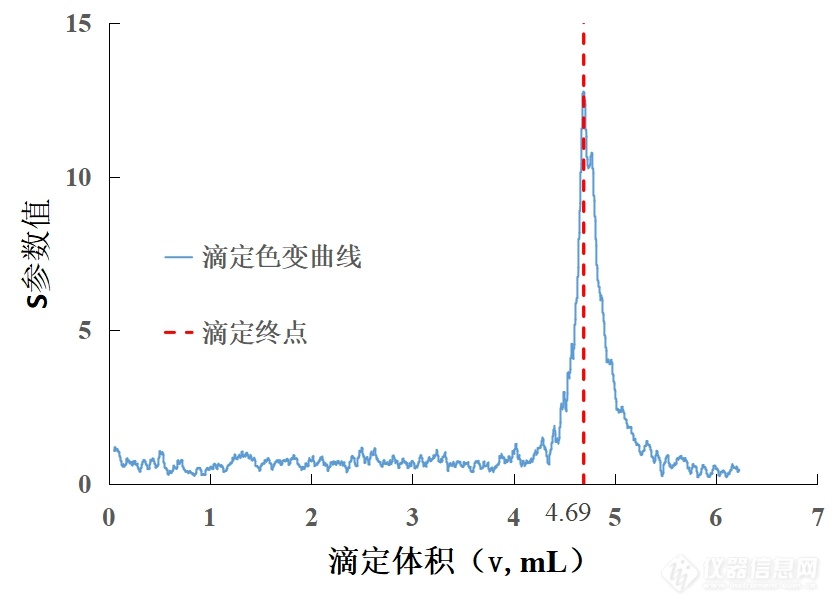
光谱滴定法测定水中总硬度[align=center]汪海波1,吕萍萍1,关朝亮1,宋清超1,宋喜臣1,王飞2*[/align][align=center](1.绥芬河海关技术中心,绥芬河 157300;2.秦皇岛海关技术中心,秦皇岛 066004)[/align]摘要:[font=times new roman]可见光光谱滴定技术(Visible Spectral Titration Technology,VSTT)可以克服感官滴定存在色评价条件不统一、操作人员的个体生理条件不一致、无法量值溯源等困难。可实现滴定终点判定的数字化、图形化,是一种好的测定方法,值得大力推广。用VSTT测定水中的总硬度,与手工滴定做对比实验。VSTT测定结果的相对标准偏差在0.7%~1.8%,加标回收率在97.1%~103.3%。在α=0.05水平,t检验结果表明VSTT的结果与手工滴定结果无显著性差异。[/font]关键词:[font=times new roman]光谱滴定,VSTT,总硬度,EDTA[/font]中图分类号:[font=times new roman][color=black]O657.39[/color][/font][font=楷体][color=black] [/color][/font][color=black]文献标识码:[/color][font=times new roman][color=black]A[/color][/font]作者简介:[font=宋体]汪海波([/font][font=times new roman]1982-)[/font][font=宋体],工程师,主要从事食品理化检验工作,E-mail:[/font][email=hhciq@163.com][font=times new roman]156108201@qq[/font][font=宋体].[/font][font=times new roman]com[/font][/email][font=宋体]。[/font]*通讯作者:[font=宋体]王飞([/font][font=times new roman]1964-)[/font][font=宋体],研究员,光谱滴定技术的创立与应用推广,E-mail:[/font][email=hhciq@163.com][font=times new roman]hhciq@163[/font][font=宋体].[/font][font=times new roman]com[/font][/email][font=宋体]。[/font]课题支持:[font=宋体]基于光谱滴定理论的进出口商品快速检验技术及装备研发([/font]海关总署[font=times new roman]2020HK215[/font][font=宋体])。[/font][align=center]Determination of Total Hardness in Water by Spectral Titration[/align][align=center]Wang Hai-bo1,Lv Ping-ping1,Guan Chao-liang 1,Song Qing-chao 1,Song Xi-chen1,Wang Fei2*[/align][align=center](1.Suifenhe customs Technology Center,[font=arial][color=#333333] [/color][/font]Suifenhe 157300,China 2.Qinhuangdao customs Technology Center,Qinhuangdao 066004,China )[/align]Abstract:[size=16px] [/size][size=12px]Visible Spectral Titration Technology (VSTT) can overcome the difficulties of sensory titration, such as the disunity of color evaluation conditions, the inconsistency of individual physiological conditions of operators, and the inability to trace the value. It can realize the automation of measurement, which is a good measurement method and worth popularizing.The total hardness of water was determined by spectral titration and compared with manual titration. The relative standard deviations of spectral titration were in the range of 0.7%~1.8%, and the recoveries were in the range of 97.1%~103.3%. At the α=0.05 level, the t-test results showed that there was no significant difference between the results of spectral titration and manual titration. [/size][size=16px] [/size]Key words: [size=12px]visible spectral titration, VSTT, total hardness, EDTA [/size]可见光光谱滴定技术[1-2]是近2、3年逐步成型的新技术,继承手工滴定的指示剂原理,在整个滴定过程采用颜色真实测量体系替代人的感官判定,建立了光谱计量参数与试剂量的色变滴定曲线,用曲线上的突变峰标识滴定终点或结构变化点,从而使传统的滴定方法建立的体系获得了新的拓展应用。该方法反应灵敏、测量无延迟、无接触性传感器、不受温度影响、不干扰被测定反应、应用面广等诸多优点,具有非常大的应用优势和发展潜力。水总硬度是指水中Ca2+、Mg2+的总量,是水质的一个重要监测指标。水中总硬度的测定方法主要有EDTA络合滴定法[3-4]、分光光度法[5]、电位滴定法[6]、[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]法[7-8]、快速检测试剂盒法[9]、[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法[10]等。分光光度法应用较少,试剂盒法测定准确度不高,[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]法和[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法均需较昂贵的仪器且分析时间较长,电位滴定法需用对应的电极且电极为消耗品,这些方法的原理与滴定法原理不同存在体系误差。EDTA络合滴定法是国家标准GB 5750.4、GB 8538中采用的方法,测定数据准确可靠,为普遍采用的方法,但手工滴定存在色评价条件不统一、人的生理条件不一致、无法量值溯源等包括终点颜色判定等诸多问题而影响判定结果。为克服这些缺陷,采用光谱滴定法对水中总硬度进行探讨研究,与手工滴定法数据进行比对分析,验证光谱滴定法的可行性、准确性。1材料与方法1.1仪器与试剂光谱滴定仪SX-Z-3.3(秦皇岛水熊科技有限公司与秦皇岛海关技术中心合作研制);梅特勒托利多电子天平XP205;德国宾德恒温干燥箱M53等。水质总硬度标准物质GSB 07-3163-2014。EDTA-2Na(优级纯):0.01 mol/L。氨缓冲溶液(pH=10):将67.5g氯化铵(NH4Cl)溶于300 mL 蒸馏水中,加570 mL 氢氧化铵(ρ20=0.90 g/mL),用水稀释至1000 mL。铬黑T(分析纯):10 g/L。1.2实验方法1.2.1光谱滴定法光谱滴定方法是依据物体色的测量方法[11-13] ,对滴定过程中溶液的颜色变化进行计算,以数字化、图形化的曲线表示滴定终点。在总硬度测定实验中,VSTT[font=宋体][color=black]色变曲线[/color][/font][color=black]S[/color][font=宋体][color=black]的参数选择以红-绿色品指数[/color][/font][color=black]a[/color][color=black]*[/color][font=宋体][color=black]和加入试剂体积[/color][/font][color=black]v[/color][font=宋体][color=black]参数为计量单位:[/color][/font][color=black]S[/color][color=black]a[/color][color=black]*-v[/color][color=black] =│([/color][color=black]a[/color][color=black]*[/color][color=black]x[/color][color=black]-[/color][color=black]a[/color][color=black]*[/color][color=black]y[/color][color=black])[/color][color=black]n[/color][color=black]/△v[/color][color=black]m[/color][color=black]│[/color]式中,Sa*-v—VSTT的色变曲线S参数;n—1,2,3…;m—1,2,3…;x—1,2,3…;y—2,3,4…;a*—CIELAB彩色均匀空间的色度值的红-绿色品指数a*;v—加入试剂体积,单位mL。绘制[color=black]S[/color][color=black]a[/color][color=black]*-v[/color]-v滴定曲线,见下图1。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111270906504955_3436_1722582_3.jpg[/img][/align][align=center]图1 光谱滴定曲线[/align][align=center]Fig.1 Spectral titration curve[/align][color=black]图1[/color][font=times new roman]获得一呈现尖峰的曲线,曲线上的峰最大值所对应的v值即为滴定终点体积。[/font]光谱滴定仪器条件:光谱范围波长380 nm~780 nm,△λ5 nm,测量周期100 ms,积分时间100 ms,光程10.0 mm,搅拌速度200 转/min,靴型反应器体积180 mL。测定方法:准确量取50 mL样品于靴型反应器中,再依次加入2 mL缓冲溶液、0.5 mL铬黑T,将反应器放入自动样品盘中,按光谱滴定仪器条件用EDTA-2Na标准溶液进行测定,同时做空白实验。在仪器控制界面选定[font=宋体][color=black]色变曲线[/color][/font][color=black]S[/color][font=宋体][color=black]的参数选择以红-绿色品指数[/color][/font][color=black]a[/color][color=black]*[/color][font=宋体][color=black]和加入试剂体积[/color][/font][color=black]v[/color][font=宋体][color=black]参数为计量单位[/color][/font]建立滴定变色曲线,根据VSTT色变曲线来读取滴定终点体积并记录。1.2.2手动滴定法准确量取50 mL样品于250 mL锥形瓶中,依次加入2 mL缓冲溶液和0.5 mL铬黑T溶液,用EDTA二钠标准溶液滴定至终点,并记录体积。同时做空白实验。2结果与分析2.1对有证标准物质进行测定的标准偏差对总硬度标准样品(GSB 07-3163-2014,批号:200748)按VSTT法进行测定,测定结果见表1。[align=center]表1 标准样品的测定结果[/align][align=center]Tab.1 Determination results of standard samples[/align][table][tr][td][align=center]样品名称[/align][/td][td=5,1][align=center]平行测定结果[/align][align=center](mg/L)[/align][/td][td][align=center]标准值[/align][align=center](mg/L)[/align][/td][td][align=center]标准品扩展不[/align][align=center]确定度(k=2)[/align][align=center](mg/L)[/align][/td][/tr][tr][/tr][tr][td=1,2][align=center]标准样品[/align][align=center](GSB07-3163-2014)[/align][/td][td][align=center]280.1[/align][/td][td][align=center]279.9[/align][/td][td][align=center]282.2[/align][/td][td][align=center]277.0[/align][/td][td][align=center]280.8[/align][/td][td=1,2][align=center]281.3[/align][/td][td=1,2][align=center]8[/align][/td][/tr][tr][td][align=center]289.0[/align][/td][td][align=center]285.0[/align][/td][td][align=center]282.9[/align][/td][td][align=center]281.0[/align][/td][td][align=center]280.2[/align][/td][/tr][/table]由表1可知测定值均在标准样品的给定值的扩展不确定度范围之内,偏差小于标准样品的扩展不确定度,准确性较好。2.2精密度试验按VSTT法和手动滴定方法对三种不同水体中的总硬度分别进行平行测定6次,测定结果见表2。[align=center]表2 光谱滴定法测定三种不同水样的平行结果[/align][align=center]Tab.2 Parallel results of spectral titration for determination of three different water samples[/align][table][tr][td][align=center]样品名称[/align][/td][td=3,1][align=center]光谱滴定结果[/align][align=center](mg/L)[/align][/td][td][align=center]精密度RSD[/align][align=center](%)[/align][/td][td=3,1][align=center]手动滴定结果[/align][align=center](mg/L)[/align][/td][td][align=center]精密度RSD[/align][align=center](%)[/align][/td][/tr][tr][td=1,2][align=center]水样1[/align][/td][td][align=center]27.5[/align][/td][td][align=center]27.1[/align][/td][td][align=center]27.5[/align][/td][td=1,2][align=center]1.8 [/align][/td][td][align=center]28[/align][/td][td][align=center]28.4[/align][/td][td][align=center]28.6[/align][/td][td=1,2][align=center]3.8 [/align][/td][/tr][tr][td][align=center]27.6[/align][/td][td][align=center]26.5[/align][/td][td][align=center]27.9[/align][/td][td][align=center]26.3[/align][/td][td][align=center]26.5[/align][/td][td][align=center]26.6[/align][/td][/tr][tr][td=1,2][align=center]水样2[/align][/td][td][align=center]51.9[/align][/td][td][align=center]50.7[/align][/td][td][align=center]51.4[/align][/td][td=1,2][align=center]1.0 [/align][/td][td][align=center]51.6[/align][/td][td][align=center]52.7[/align][/td][td][align=center]51.4[/align][/td][td=1,2][align=center]1.4 [/align][/td][/tr][tr][td][align=center]52.2[/align][/td][td][align=center]51.4[/align][/td][td][align=center]51.7[/align][/td][td][align=center]51[/align][/td][td][align=center]52.1[/align][/td][td][align=center]50.7[/align][/td][/tr][tr][td=1,2][align=center]水样3[/align][/td][td][align=center]104.2 [/align][/td][td][align=center]104.3[/align][/td][td][align=center]102.9[/align][/td][td=1,2][align=center]0.7 [/align][/td][td][align=center]101.5[/align][/td][td][align=center]103.9[/align][/td][td][align=center]102.9[/align][/td][td=1,2][align=center]1.1 [/align][/td][/tr][tr][td][align=center]102.3[/align][/td][td][align=center]103.1[/align][/td][td][align=center]103.4[/align][/td][td][align=center]104.1[/align][/td][td][align=center]103.9[/align][/td][td][align=center]102.1[/align][/td][/tr][/table]由表2可知三种不同浓度样品的VSTT法相对标准偏差为1.8%,1.0%,0.7%;三种不同浓度样品的手动滴定方法相对标准偏差为3.8%,1.4%,1.1%,光谱滴定法的精密度好于手动滴定方法。2.3加标回收率测定对三种不同水体添加一定量的配制好的锌标准溶液,用VSTT法进行测定,结果见表3。[align=center]表3 光谱滴定法测定三种不同水样的加标回收结果[/align][align=center]Tab.3 The recovery results of three different water samples were determined by spectral titration[/align][table][tr][td][align=center]样品名称[/align][/td][td=3,1][align=center]加标测定结果[/align][align=center](mg/L)[/align][/td][td][align=center]本底值[/align][align=center](mg/L)[/align][/td][td][align=center]加标量[/align][align=center](mg/L)[/align][/td][td=3,1][align=center]回收率[/align][align=center](%)[/align][/td][/tr][tr][td=1,2][align=center]水样1[/align][/td][td][align=center]63.3[/align][/td][td][align=center]64.5[/align][/td][td][align=center]63.4[/align][/td][td=1,2][align=center]27.4 [/align][/td][td=1,2][align=center]36.78 [/align][/td][td][align=center]97.6 [/align][/td][td][align=center]100.9 [/align][/td][td][align=center]97.9 [/align][/td][/tr][tr][td][align=center]65.4[/align][/td][td][align=center]65[/align][/td][td][align=center]65.4[/align][/td][td][align=center]103.3 [/align][/td][td][align=center]102.2 [/align][/td][td][align=center]103.3 [/align][/td][/tr][tr][td=1,2][align=center]水样2[/align][/td][td][align=center]89.1[/align][/td][td][align=center]88.3[/align][/td][td][align=center]87.9[/align][/td][td=1,2][align=center]51.6 [/align][/td][td=1,2][align=center]36.78 [/align][/td][td][align=center]102.0 [/align][/td][td][align=center]99.8 [/align][/td][td][align=center]98.7 [/align][/td][/tr][tr][td][align=center]87.8[/align][/td][td][align=center]89.5[/align][/td][td][align=center]87.3[/align][/td][td][align=center]98.4 [/align][/td][td][align=center]103.0 [/align][/td][td][align=center]97.1 [/align][/td][/tr][tr][td=1,2][align=center]水样3[/align][/td][td][align=center]178.7 [/align][/td][td][align=center]178.8[/align][/td][td][align=center]176.6[/align][/td][td=1,2][align=center]103.4 [/align][/td][td=1,2][align=center]73.56 [/align][/td][td][align=center]102.4 [/align][/td][td][align=center]102.5 [/align][/td][td][align=center]99.5 [/align][/td][/tr][tr][td][align=center]176.8[/align][/td][td][align=center]176.4[/align][/td][td][align=center]176.8[/align][/td][td][align=center]99.8 [/align][/td][td][align=center]99.2 [/align][/td][td][align=center]99.8 [/align][/td][/tr][/table]由表3可知,三种不同浓度的水体的加标回收率分别为97.6%~103.3%、97.1%~103.0%、99.2%~102.5%,回收率较好,满足GB/T 27404-2008的附录F.1,可以代替手工滴定用于日常检验。2.4两种方法测定结果差异性比较对8种不同浓度水体按VSTT法和手动滴定方法测定。对两种方法测定的结果统计分析,进行配对t检验,结果见表4。[align=center]表4 光谱滴定法和手工方法测定八种不同水样的结果[/align][align=center]Tab.4 Results of spectral titration and manual determination of eight different water samples[/align][table][tr][td][align=center]样品名称[/align][/td][td][align=center]光谱滴定结果[/align][align=center](mg/L)[/align][/td][td][align=center]手动滴定结果[/align][align=center](mg/L)[/align][/td][/tr][tr][td][align=center]水样1[/align][/td][td][align=center]27.4[/align][/td][td][align=center]27.4[/align][/td][/tr][tr][td][align=center]水样2[/align][/td][td][align=center]51.6[/align][/td][td][align=center]51.6[/align][/td][/tr][tr][td][align=center]水样3[/align][/td][td][align=center]103.4[/align][/td][td][align=center]103.1[/align][/td][/tr][tr][td][align=center]水样4[/align][/td][td][align=center]78.6[/align][/td][td][align=center]78.1[/align][/td][/tr][tr][td][align=center]水样5[/align][/td][td][align=center]200.5[/align][/td][td][align=center]201.4[/align][/td][/tr][tr][td][align=center]水样6[/align][/td][td][align=center]250.6[/align][/td][td][align=center]248.9[/align][/td][/tr][tr][td][align=center]水样7[/align][/td][td][align=center]300.2[/align][/td][td][align=center]297.6[/align][/td][/tr][tr][td][align=center]水样8[/align][/td][td][align=center]402.4[/align][/td][td][align=center]404.1[/align][/td][/tr][/table]由表4结果计算t=0.651,在α=0.05水平,查表可得t0.05/2,7=2.365,证明两种方法的结果无显著性差异。3结论与讨论本文通过光谱滴定法和手工滴定法分别对水中总硬度进行测定,结果表明:光谱滴定法测定水中总硬度试验的准确性、精密度、回收率等方面效果较好,符合标准要求,此方法测定水中总硬度是可行的。对两种方法测定结果进行t检验,不存在显著性差异,光谱滴定法可代替人工滴定法对水中总硬度进行测定。光谱滴定法可自动测定,实现了滴定终点的数字化、图形化,避免了人员的主观影响,兼具操作简便、检测快速、可溯源性等优点,是一种值得推广的新方法。本研究将光谱滴定技术首次运用到测定水中总硬度,相信随着研究的深入,光谱滴定技术一定也可以在其他检测领域有所应用。参考文献[1] 王飞.化学光谱滴定技术.[M].北京:中国标准出版社,2019. [2] 王飞,邹明强,张昂,艾连峰,等.201910636634.9.化学反应用光谱-电位-温度多维滴定分析仪及滴定方法[P].北京:国家知识产权局,2019.[3] GB/T 5750.4-2006 生活饮用水标准检验方法 感官性状和物理指标[s]北京:中国标准出版社,2006.[4] GB 8538-2016 食品安全国家标准 饮用天然矿泉水检验方法[s]北京:中国标准出版社,2016.[5] 吴丹,胡莹露.EDTA滴定法测水总硬度实验方法[J].实验室研究与探索,2021,40(06):59-63+123.[6] 茹婕.自动电位滴定法在水的总硬度测定中的应用[J].山西水利,2019,35(07):39-41.[7] 陈峰,杨梅桂,杨清华,平文卉.[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]分光光度法间接测定海水中的总硬度[J].医学动物防制,2017,33(05):589-591.[8] 马兴,张静,于尧,郑文杰.ICP-OES法测定饮用天然矿泉水中总硬度[J].食品研究与开发,2016,37(20):167-168.[9] 叶小园.测定总硬度的三种方法的验证分析[J].广东化工,2021,48(03):186-187.[10] 任妍冰,刘云,王学建.[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法测定水中总硬度[J].环境监测管理与技术,2015,27(04):58-60.[11] GB/T 3979-2008 物体色的测量方法[s]北京:中国标准出版社,2008.[12] GB/T 3977-2008 颜色的表示方法[s]北京:中国标准出版社,2008.[13] GB/T 7921-2008 均匀色空间和色差公式[s]北京:中国标准出版社,2008.[/s][/s][/s][/s][/s]