摘要:本文介绍了在对含量测定所用的分析方法进行方法学验证时,各项指标的可接受标准,以利于判断该分析方法的可行性。 关键词:含量测定 分析方法验证 可接收标准 在进行质量研究的过程中,一项重要的工作就是要对质量标准中所涉及到的分析方法进行方法学验证,以保证所用的分析方法确实能够用于在研药品的质量控制。为规范对各种分析方法的验证要求,我国已于2005年颁布了分析方法验证的指导原则。该指导原则对需要验证的分析方法及验证的具体指标做了比较详细的阐述。但是文中未涉及各具体指标在验证时的可接受标准,国际上已颁布的指导原则中也未发现相关的要求。另一方面,大多数药品研发单位在进行质量研究时,已逐步认识到分析方法验证的必要性与重要性,大都也在按照指导原则的要求进行分析方法验证,但验证完后却因没有一个明确的可接受标准,而难以判断该分析方法是否符合要求。本文结合国外一些大型药品研发企业在此方面的要求,提出了在对含量测定方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=106891]含量测定分析方法验证的可接受标准[/url]
在进行质量研究的过程中,一项重要的工作就是要对质量标准中所涉及到的分析方法进行方法学验证,以保证所用的分析方法确实能够用于在研药品的质量控制。为规范对各种分析方法的验证要求,中国药典2005年版附录规定了分析方法验证的指导原则。该指导原则对需要验证的分析方法及验证的具体指标做了比较详细的阐述。但是文中未涉及各具体指标在验证时的可接受标准,国际上已颁布的指导原则中也未发现相关的要求。另一方面,大多数药品研发单位在进行质量研究时,已逐步认识到分析方法验证的必要性与重要性,大都也在按照指导原则的要求进行分析方法验证,但验证完后却因没有一个明确的可接受标准,而难以判断该分析方法是否符合要求。本文提出了在对HPLC含量测定方法进行验证时的可接受标准,供大家讨论。1.准确度 该指标主要是通过回收率来反映。验证时一般要求分别配制浓度为80%、100%和120%的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率。 可接受的标准为:各浓度下的平均回收率均应在98.0%-102.0%之间,9个回收率数据的相对标准差(RSD)应不大于2.0%。 2.线性 线性一般通过线性回归方程的形式来表示。具体的验证方法为: 在80%至120%的浓度范围内配制5份浓度不同的供试液,分别测定其主峰的面积,计算相应的含量。以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。 可接受的标准为:回归线的相关系数(R)不得小于0.998,Y轴截距应在100%响应值的2%以内,响应因子的相对标准差应不大于2.0%。 3.精密度 1)重复性 配制6份相同浓度或分别配制浓度为80%、100%和120%的供试品溶液各三份的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于2.0%。 2)中间精密度 配制6份相同浓度的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于2.0%。 4.专属性 可接受的标准为:空白对照应无干扰,主成分与各有关物质应能完全分离,分离度不得小于2.0。以二极管阵列检测器进行纯度分析时,主峰的纯度因子应大于980。 5.检测限 主峰与噪音峰信号的强度比应不得小于3。 6.定量限 主峰与噪音峰信号的强度比应不得小于10。另外,配制6份最低定量限浓度的溶液,所测6份溶液主峰的保留时间的相对标准差应不大于2.0%。 7.耐用性 分别考察流动相比例变化±5%、流动相pH值变化±0.2、柱温变化±5℃、流速相对值变化±20%时,仪器色谱行为的变化,选择至少三个不同厂家或不同批号的同类色谱柱,每个条件下各测试两次。可接受的标准为:主峰的拖尾因子不得大于2.0,主峰与杂质峰必须达到基线分离,分离度应大于1.5;各条件下的含量数据(n=6)的相对标准差应不大于2.0%。 8、系统适应性 配制6份相同浓度的供试品溶液进行分析,主峰峰面积的相对标准差应不大于2.0%,主峰保留时间的相对标准差应不大于1.0%。另外,主峰的拖尾因子不得大于2.0,主峰与杂质峰必须达到基线分离,分离度应大于1.5,供试品主峰的理论塔板数应取耐用性试验不同厂家或不同批号的同类色谱柱的平均值的100%-120%。
有关物质分析方法验证的可接受标准简介摘要:本文介绍了在对有关物质检查所用的分析方法进行方法学验证时,各项指标的可接受标准,以利于判断该分析方法的可行性。 关键词:有关物质检查 分析方法验证 可接收标准 药品中的有关物质泛指在药品的生产与储存过程中产生的工艺杂质或降解产物。由于这些有关物质的存在会影响到药品的纯度,进而可能会产生毒副作用,所以有关物质的控制是药品研发的一个重要方面,也是我们在药品审评中一直重点关注的要点之一。而要对有关物质进行严格的控制,就离不开专属性强、灵敏度高的分析方法,这就涉及到分析方法的筛选与验证。从现有的申报资料看,药品研发单位已基本上意识到分析方法验证的重要性,但是对验证时各具体指标是否可行尚没有一个明确的可接受标准,从而难以对验证结果进行评判。为解决这一问题,本文结合国外一些大型药品研发企业在此方面的要求,提出了在对有关物质检查方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。 1.准确度 该指标主要是通过回收率来反映。验证时一般要求根据有关物质的定量限与质量标准中该杂质的限度分别配制三个浓度的供试品溶液各三份(例如某杂质的限度为0.2%,则可分别配制该杂质浓度为0.1%、0.2%和0.3%的杂质溶液),分别测定其含量,将实测值与理论值比较,计算回收率,并计算9个回收率数据的相对标准差(RSD)。该项目的可接受的标准为:各浓度下的平均回收率均应在80%-120%之间,如杂质的浓度为定量限,则该浓度下的平均回收率可放宽至70%-130%,相对标准差应不大于10%。 2.线性 线性一般通过线性回归方程的形式来表示。具体的验证方法为:在定量限至一定的浓度范围内配制6份浓度不同的供试液,分别测定该杂质峰的面积,计算相应的含量。以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。可接受的标准为:回归线的相关系数(R)不得小于0.990,Y轴截距应在100%响应值的25%以内,响应因子的相对标准差应不大于10%。 3.精密度 1)重复性 配制6份杂质浓度(一般为0.1%)相同的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于15%。 2)中间精密度 配制6份杂质浓度(一般为0.1%)相同的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于20%。 4.专属性 可接受的标准为:空白对照应无干扰,该杂质峰与其它峰应能完全分离,分离度不得小于2.0。 5.检测限 杂质峰与噪音峰信号的强度比应不得小于3。 6.定量限 杂质峰与噪音峰信号的强度比应不得小于10。另外,配制6份最低定量限浓度的溶液,所测6份溶液杂质峰保留时间的相对标准差应不大于2.0%,峰面积的相对标准差应不大于5.0%。 7.耐用性 分别考察流动相比例变化±5%、流动相pH值变化±0.2、柱温变化±5℃、检测波长变化±5nm、流速相对值变化±20%以及采用三根不同批号的色谱柱进行测定时,仪器色谱行为的变化,每个条件下各测试两次。可接受的标准为:各杂质峰的拖尾因子不得大于2.0,杂质峰与其他成分峰必须达到基线分离;各条件下的杂质含量数据(n=6)的相对标准差应不大于2.0%,杂质含量的绝对值在±0.1%以内。 8、系统适应性 配制6份相同浓度的杂质溶液进行分析,该杂质峰峰面积的相对标准差应不大于2.0%,保留时间的相对标准差应不大于1.0%。另外,杂质峰的拖尾因子不得大于2.0,理论塔板数应符合质量标准的规定。 9.溶液稳定性 按照分析方法分别配置对照品溶液与供试品溶液,平行测定两次主成分与杂质的含量,然后将上述溶液分别贮存在室温与冰箱冷藏室(4℃)中,在1、2、3、5和7天时分别平行测定两次主成分与杂质的含量。 可接受的标准为:主成分的含量变化的绝对值应不大于2.0%,杂质含量的绝对值在±0.1%以内,并不得出现新的大于报告限度的杂质。含量测定分析方法验证的可接受标准简介摘要:本文介绍了在对含量测定所用的分析方法进行方法学验证时,各项指标的可接受标准,以利于判断该分析方法的可行性。关键词:含量测定 分析方法验证 可接收标准在进行质量研究的过程中,一项重要的工作就是要对质量标准中所涉及到的分析方法进行方法学验证,以保证所用的分析方法确实能够用于在研药品的质量控制。为规范对各种分析方法的验证要求,我国已于2005年颁布了分析方法验证的指导原则。该指导原则对需要验证的分析方法及验证的具体指标做了比较详细的阐述。但是文中未涉及各具体指标在验证时的可接受标准,国际上已颁布的指导原则中也未发现相关的要求。另一方面,大多数药品研发单位在进行质量研究时,已逐步认识到分析方法验证的必要性与重要性,大都也在按照指导原则的要求进行分析方法验证,但验证完后却因没有一个明确的可接受标准,而难以判断该分析方法是否符合要求。本文结合国外一些大型药品研发企业在此方面的要求,提出了在对含量测定方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。1.准确度该指标主要是通过回收率来反映。验证时一般要求分别配制浓度为80%、100%和120%的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率。可接受的标准为:各浓度下的平均回收率均应在98.0%-102.0%之间,9个回收率数据的相对标准差(RSD)应不大于2.0%。2.线性线性一般通过线性回归方程的形式来表示。具体的验证方法为:在80%至120%的浓度范围内配制6份浓度不同的供试液,分别测定其主峰的面积,计算相应的含量。以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。可接受的标准为:回归线的相关系数(R)不得小于0.998,Y轴截距应在100%响应值的2%以内,响应因子的相对标准差应不大于2.0%。3.精密度1)重复性配制6份相同浓度的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于2.0%。2)中间精密度配制6份相同浓度的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于2.0%。4.专属性可接受的标准为:空白对照应无干扰,主成分与各有关物质应能完全分离,分离度不得小于2.0。以二极管阵列检测器进行纯度分析时,主峰的纯度因子应大于980。5.检测限主峰与噪音峰信号的强度比应不得小于3。6.定量限主峰与噪音峰信号的强度比应不得小于10。另外,配制6份最低定量限浓度的溶液,所测6份溶液主峰的保留时间的相对标准差应不大于2.0%。7.耐用性分别考察流动相比例变化±5%、流动相pH值变化±0.2、柱温变化±5℃、流速相对值变化±20%时,仪器色谱行为的变化,每个条件下各测试两次。可接受的标准为:主峰的拖尾因子不得大于2.0,主峰与杂质峰必须达到基线分离;各条件下的含量数据(n=6)的相对标准差应不大于2.0%。8、系统适应性配制6份相同浓度的供试品溶液进行分析,主峰峰面积的相对标准差应不大于2.0%,主峰保留时间的相对标准差应不大于1.0%。另外,主峰的拖尾因子不得大于2.0,主峰与杂质峰必须达到基线分离,主峰的理论塔板数应符合质量标准的规定。本文为转帖!
药品中的有关物质泛指在药品的生产与储存过程中产生的工艺杂质或降解产物。由于这些有关物质的存在会影响到药品的纯度,进而可能会产生毒副作用,所以有关物质的控制是药品研发的一个重要方面,也是我们在药品审评中一直重点关注的要点之一。而要对有关物质进行严格的控制,就离不开专属性强、灵敏度高的分析方法,这就涉及到分析方法的筛选与验证。从现有的申报资料看,药品研发单位已基本上意识到分析方法验证的重要性,但是对验证时各具体指标是否可行尚没有一个明确的可接受标准,从而难以对验证结果进行评判。为解决这一问题,本文结合国外一些大型药品研发企业在此方面的要求,提出了在对有关物质检查方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。 1.准确度 该指标主要是通过回收率来反映。验证时一般要求根据有关物质的定量限与质量标准中该杂质的限度分别配制三个浓度的供试品溶液各三份(例如某杂质的限度为0.2%,则可分别配制该杂质浓度为0.1%、0.2%和0.3%的杂质溶液),分别测定其含量,将实测值与理论值比较,计算回收率,并计算9个回收率数据的相对标准差(RSD)。该项目的可接受的标准为:各浓度下的平均回收率均应在80%-120%之间,如杂质的浓度为定量限,则该浓度下的平均回收率可放宽至70%-130%,相对标准差应不大于10%。 2.线性 线性一般通过线性回归方程的形式来表示。具体的验证方法为:在定量限至一定的浓度范围内配制6份浓度不同的供试液,分别测定该杂质峰的面积,计算相应的含量。以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。可接受的标准为:回归线的相关系数(R)不得小于0.990,Y轴截距应在100%响应值的25%以内,响应因子的相对标准差应不大于10%。 3.精密度 1)重复性 配制6份杂质浓度(一般为0.1%)相同的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于15%。 2)中间精密度 配制6份杂质浓度(一般为0.1%)相同的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于20%。 4.专属性 可接受的标准为:空白对照应无干扰,该杂质峰与其它峰应能完全分离,分离度不得小于2.0。 5.检测限 杂质峰与噪音峰信号的强度比应不得小于3。 6.定量限 杂质峰与噪音峰信号的强度比应不得小于10。另外,配制6份最低定量限浓度的溶液,所测6份溶液杂质峰保留时间的相对标准差应不大于2.0%,峰面积的相对标准差应不大于5.0%。 7.耐用性 分别考察流动相比例变化±5%、流动相pH值变化±0.2、柱温变化±5℃、检测波长变化±5nm、流速相对值变化±20%以及采用三根不同批号的色谱柱进行测定时,仪器色谱行为的变化,每个条件下各测试两次。可接受的标准为:各杂质峰的拖尾因子不得大于2.0,杂质峰与其他成分峰必须达到基线分离;各条件下的杂质含量数据(n=6)的相对标准差应不大于2.0%,杂质含量的绝对值在±0.1%以内。 8、系统适应性 配制6份相同浓度的杂质溶液进行分析,该杂质峰峰面积的相对标准差应不大于2.0%,保留时间的相对标准差应不大于1.0%。另外,杂质峰的拖尾因子不得大于2.0,理论塔板数应符合质量标准的规定。 9.溶液稳定性 按照分析方法分别配置对照品溶液与供试品溶液,平行测定两次主成分与杂质的含量,然后将上述溶液分别贮存在室温与冰箱冷藏室(4℃)中,在1、2、3、5和7天时分别平行测定两次主成分与杂质的含量。 可接受的标准为:主成分的含量变化的绝对值应不大于2.0%,杂质含量的绝对值在±0.1%以内,并不得出现新的大于报告限度的杂质。
含量测定分析方法验证摘要:本文介绍了在对含量测定所用的分析方法进行方法学验证时,各项指标的可接受标准,以利于判断该分析方法的可行性。关键词:含量测定 分析方法验证 可接收标准 在进行质量研究的过程中,一项重要的工作就是要对质量标准中所涉及到的分析方法进行方法学验证,以保证所用的分析方法确实能够用于在研药品的质量控制。为规范对各种分析方法的验证要求,我国已于2005年颁布了分析方法验证的指导原则。该指导原则对需要验证的分析方法及验证的具体指标做了比较详细的阐述。但是文中未涉及各具体指标在验证时的可接受标准,国际上已颁布的指导原则中也未发现相关的要求。另一方面,大多数药品研发单位在进行质量研究时,已逐步认识到分析方法验证的必要性与重要性,大都也在按照指导原则的要求进行分析方法验证,但验证完后却因没有一个明确的可接受标准,而难以判断该分析方法是否符合要求。本文结合国外一些大型药品研发企业在此方面的要求,提出了在对含量测定方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。1.准确度 该指标主要是通过回收率来反映。验证时一般要求分别配制浓度为80%、100%和120%的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率。 可接受的标准为:各浓度下的平均回收率均应在98.0%-102.0%之间,9个回收率数据的相对标准差(RSD)应不大于2.0%。2.线性 线性一般通过线性回归方程的形式来表示。具体的验证方法为: 在80%至120%的浓度范围内配制6份浓度不同的供试液,分别测定其主峰的面积,计算相应的含量。以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。 可接受的标准为:回归线的相关系数(R)不得小于0.998,Y轴截距应在100%响应值的2%以内,响应因子的相对标准差应不大于2.0%。3.精密度1)重复性 配制6份相同浓度的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于2.0%。2)中间精密度 配制6份相同浓度的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于2.0%。4.专属性 可接受的标准为:空白对照应无干扰,主成分与各有关物质应能完全分离,分离度不得小于2.0。以二极管阵列检测器进行纯度分析时,主峰的纯度因子应大于980。5.检测限 主峰与噪音峰信号的强度比应不得小于3。6.定量限 主峰与噪音峰信号的强度比应不得小于10。另外,配制6份最低定量限浓度的溶液,所测6份溶液主峰的保留时间的相对标准差应不大于2.0%。7.耐用性 分别考察流动相比例变化±5%、流动相pH值变化±0.2、柱温变化±5℃、流速相对值变化±20%时,仪器色谱行为的变化,每个条件下各测试两次。可接受的标准为:主峰的拖尾因子不得大于2.0,主峰与杂质峰必须达到基线分离;各条件下的含量数据(n=6)的相对标准差应不大于2.0%。8、系统适应性 配制6份相同浓度的供试品溶液进行分析,主峰峰面积的相对标准差应不大于2.0%,主峰保留时间的相对标准差应不大于1.0%。另外,主峰的拖尾因子不得大于2.0,主峰与杂质峰必须达到基线分离,主峰的理论塔板数应符合质量标准的规定
在进行质量研究的过程中,一项重要的工作就是要对质量标准中所涉及到的分析方法进行方法学验证,以保证所用的分析方法确实能够用于在研药品的质量控制。为规范对各种分析方法的验证要求,我国已于2005年颁布了分析方法验证的指导原则。该指导原则对需要验证的分析方法及验证的具体指标做了比较详细的阐述。但是文中未涉及各具体指标在验证时的可接受标准,国际上已颁布的指导原则中也未发现相关的要求。另一方面,大多数药品研发单位在进行质量研究时,已逐步认识到分析方法验证的必要性与重要性,大都也在按照指导原则的要求进行分析方法验证,但验证完后却因没有一个明确的可接受标准,而难以判断该分析方法是否符合要求。本文结合国外一些大型药品研发企业在此方面的要求,提出了在对含量测定方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。1.准确度 该指标主要是通过回收率来反映。验证时一般要求分别配制浓度为80%、100%和120%的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率。 可接受的标准为:各浓度下的平均回收率均应在98.0%-102.0%之间,9个回收率数据的相对标准差(RSD)应不大于2.0%。2.线性 线性一般通过线性回归方程的形式来表示。具体的验证方法为:在80%至120%的浓度范围内配制6份浓度不同的供试液,分别测定其主峰的面积,计算相应的含量。以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。 可接受的标准为:回归线的相关系数(R)不得小于0.998,Y轴截距应在100%响应值的2%以内,响应因子的相对标准差应不大于2.0%。3.精密度 1)重复性 配制6份相同浓度的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于2.0%。 2)中间精密度 配制6份相同浓度的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于2.0%。4.专属性 可接受的标准为:空白对照应无干扰,主成分与各有关物质应能完全分离,分离度不得小于2.0。以二极管阵列检测器进行纯度分析时,主峰的纯度因子应大于980。5.检测限 主峰与噪音峰信号的强度比应不得小于3。6.定量限 主峰与噪音峰信号的强度比应不得小于10。另外,配制6份最低定量限浓度的溶液,所测6份溶液主峰的保留时间的相对标准差应不大于2.0%。7.耐用性 分别考察流动相比例变化±5%、流动相pH值变化±0.2、柱温变化±5℃、流速相对值变化±20%时,仪器色谱行为的变化,每个条件下各测试两次。可接受的标准为:主峰的拖尾因子不得大于2.0,主峰与杂质峰必须达到基线分离;各条件下的含量数据(n=6)的相对标准差应不大于2.0%。8、系统适应性 配制6份相同浓度的供试品溶液进行分析,主峰峰面积的相对标准差应不大于2.0%,主峰保留时间的相对标准差应不大于1.0%。另外,主峰的拖尾因子不得大于2.0,主峰与杂质峰必须达到基线分离,主峰的理论塔板数应符合质量标准的规定。
含量测定分析方法验证摘要:本文介绍了在对含量测定所用的分析方法进行方法学验证时,各项指标的可接受标准,以利于判断该分析方法的可行性。关键词:含量测定 分析方法验证 可接收标准 在进行质量研究的过程中,一项重要的工作就是要对质量标准中所涉及到的分析方法进行方法学验证,以保证所用的分析方法确实能够用于在研药品的质量控制。为规范对各种分析方法的验证要求,我国已于2005年颁布了分析方法验证的指导原则。该指导原则对需要验证的分析方法及验证的具体指标做了比较详细的阐述。但是文中未涉及各具体指标在验证时的可接受标准,国际上已颁布的指导原则中也未发现相关的要求。另一方面,大多数药品研发单位在进行质量研究时,已逐步认识到分析方法验证的必要性与重要性,大都也在按照指导原则的要求进行分析方法验证,但验证完后却因没有一个明确的可接受标准,而难以判断该分析方法是否符合要求。本文结合国外一些大型药品研发企业在此方面的要求,提出了在对含量测定方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。1.准确度 该指标主要是通过回收率来反映。验证时一般要求分别配制浓度为80%、100%和120%的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率。 可接受的标准为:各浓度下的平均回收率均应在98.0%-102.0%之间,9个回收率数据的相对标准差(RSD)应不大于2.0%。2.线性 线性一般通过线性回归方程的形式来表示。具体的验证方法为: 在80%至120%的浓度范围内配制6份浓度不同的供试液,分别测定其主峰的面积,计算相应的含量。以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。 可接受的标准为:回归线的相关系数(R)不得小于0.998,Y轴截距应在100%响应值的2%以内,响应因子的相对标准差应不大于2.0%。3.精密度1)重复性 配制6份相同浓度的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于2.0%。2)中间精密度 配制6份相同浓度的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于2.0%。4.专属性 可接受的标准为:空白对照应无干扰,主成分与各有关物质应能完全分离,分离度不得小于2.0。以二极管阵列检测器进行纯度分析时,主峰的纯度因子应大于980。5.检测限 主峰与噪音峰信号的强度比应不得小于3。6.定量限 主峰与噪音峰信号的强度比应不得小于10。另外,配制6份最低定量限浓度的溶液,所测6份溶液主峰的保留时间的相对标准差应不大于2.0%。7.耐用性 分别考察流动相比例变化±5%、流动相pH值变化±0.2、柱温变化±5℃、流速相对值变化±20%时,仪器色谱行为的变化,每个条件下各测试两次。可接受的标准为:主峰的拖尾因子不得大于2.0,主峰与杂质峰必须达到基线分离;各条件下的含量数据(n=6)的相对标准差应不大于2.0%。8、系统适应性 配制6份相同浓度的供试品溶液进行分析,主峰峰面积的相对标准差应不大于2.0%,主峰保留时间的相对标准差应不大于1.0%。另外,主峰的拖尾因子不得大于2.0,主峰与杂质峰必须达到基线分离,主峰的理论塔板数应符合质量标准的规定。
[size=3] 在进行质量研究的过程中,一项重要的工作就是要对质量[/size][url=javascript: ][u][b][color=#000000][size=3]标准[/size][/color][/b][/u][/url][size=3]中所涉及到的[/size][url=javascript: ][u][b][color=#000000][size=3]分析[/size][/color][/b][/u][/url][size=3]方法进行方法学验证,以保证所用的分析方法确实能够用于在研药品的质量控制。 为规范对各种分析方法的验证要求,我国已于2005年颁布了分析方法验证的指导原则。该指导原则对需要验证的分析方法及验证的具体指标做了比较详细的阐述。 但是文中未涉及各具体指标在验证时的可接受标准,国际上已颁布的指导原则中也未发现相关的要求。 另一方面,大多数药品研发单位在进行质量研究时,已逐步认识到分析方法验证的必要性与重要性,大都也在按照指导原则的要求进行分析方法验证,但验证完后却因没有一个明确的可接受标准,而难以判断该分析方法是否符合要求。 在此结合国外一些大型药品研发企业在此方面的要求,提出了在对[/size][url=javascript: ][u][b][color=#000000][size=3]含量[/size][/color][/b][/u][/url][url=javascript: ][u][b][color=#000000][size=3]测定[/size][/color][/b][/u][/url][size=3]方法进行验证时的可接受标准。 1.准确度 该指标主要是通过回收率来反映。验证时一般要求分别配制浓度为80%、100%和120%的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率。 可接受的标准为:各浓度下的平均回收率均应在98.0%-102.0%之间,9个回收率数据的相对标准差(RSD)应不大于2.0%。 2.线性 线性一般通过线性回归方程的形式来表示。具体的验证方法为:在80%至120%的浓度范围内配制6份浓度不同的供试液,分别测定其主峰的面积,计算相应的含量。以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。 可接受的标准为:回归线的相关系数(R)不得小于0.998,Y轴截距应在100%响应值的2%以内,响应因子的相对标准差应不大于2.0%。 [/size]
在进行质量研究的过程中,一项重要的工作就是要对质量标准中所涉及到的分析方法进行方法学验证,以保证所用的分析方法确实能够用于在研药品的质量控制。为规范对各种分析方法的验证要求,我国已于2005年颁布了分析方法验证的指导原则。该指导原则对需要验证的分析方法及验证的具体指标做了比较详细的阐述。但是文中未涉及各具体指标在验证时的可接受标准,国际上已颁布的指导原则中也未发现相关的要求。另一方面,大多数药品研发单位在进行质量研究时,已逐步认识到分析方法验证的必要性与重要性,大都也在按照指导原则的要求进行分析方法验证,但验证完后却因没有一个明确的可接受标准,而难以判断该分析方法是否符合要求。本文结合国外一些大型药品研发企业在此方面的要求,提出了在对含量测定方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。 1.准确度 该指标主要是通过回收率来反映。验证时一般要求分别配制浓度为80%、100%和120%的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率。 可接受的标准为:各浓度下的平均回收率均应在98.0%-102.0%之间,9个回收率数据的相对标准差(RSD)应不大于2.0%。 2.线性 线性一般通过线性回归方程的形式来表示。具体的验证方法为:在80%至120%的浓度范围内配制6份浓度不同的供试液,分别测定其主峰的面积,计算相应的含量。以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。 可接受的标准为:回归线的相关系数(R)不得小于0.998,Y轴截距应在100%响应值的2%以内,响应因子的相对标准差应不大于2.0%。 3.精密度 1)重复性 配制6份相同浓度的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于2.0%。 2)中间精密度 配制6份相同浓度的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于2.0%。 4.专属性 可接受的标准为:空白对照应无干扰,主成分与各有关物质应能完全分离,分离度不得小于2.0。以二极管阵列检测器进行纯度分析时,主峰的纯度因子应大于980。 5.检测限 主峰与噪音峰信号的强度比应不得小于3。 6.定量限 主峰与噪音峰信号的强度比应不得小于10。另外,配制6份最低定量限浓度的溶液,所测6份溶液主峰的保留时间的相对标准差应不大于2.0%。 7.耐用性 分别考察流动相比例变化±5%、流动相pH值变化±0.2、柱温变化±5℃、流速相对值变化±20%时,仪器色谱行为的变化,每个条件下各测试两次。可接受的标准为:主峰的拖尾因子不得大于2.0,主峰与杂质峰必须达到基线分离;各条件下的含量数据(n=6)的相对标准差应不大于2.0%。 8、系统适应性 配制6份相同浓度的供试品溶液进行分析,主峰峰面积的相对标准差应不大于2.0%,主峰保留时间的相对标准差应不大于1.0%。另外,主峰的拖尾因子不得大于2.0,主峰与杂质峰必须达到基线分离,主峰的理论塔板数应符合质量标准的规定。
摘要:本文介绍了在对有关物质检查所用的分析方法进行方法学验证时,各项指标的可接受标准,以利于判断该分析方法的可行性。 关键词:有关物质检查 分析方法验证 可接收标准 药品中的有关物质泛指在药品的生产与储存过程中产生的工艺杂质或降解产物。由于这些有关物质的存在会影响到药品的纯度,进而可能会产生毒副作用,所以有关物质的控制是药品研发的一个重要方面,也是我们在药品审评中一直重点关注的要点之一。而要对有关物质进行严格的控制,就离不开专属性强、灵敏度高的分析方法,这就涉及到分析方法的筛选与验证。从现有的申报资料看,药品研发单位已基本上意识到分析方法验证的重要性,但是对验证时各具体指标是否可行尚没有一个明确的可接受标准,从而难以对验证结果进行评判。为解决这一问题,本文结合国外一些大型药品研发企业在此方面的要求,提出了在对有关物质检查方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。
在本论坛中看到关于含量测定分析方法验证:在对含量测定方法进行验证时的可接受标准全是关于HPLC测定含量时的标准。谁有关于非水溶液滴定法测含量分析方法验证的标准及样例?希望能共享lm3412@163.COM
如何制定分析方法验证各项目的可接受标准
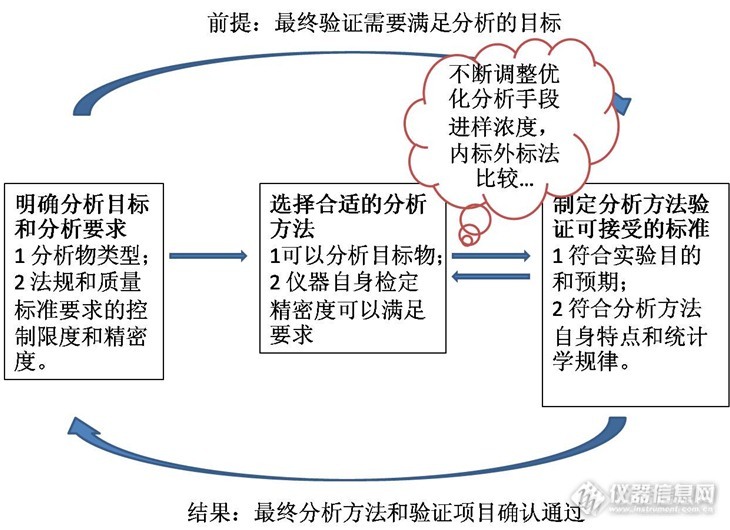
分析方法验证的可接受限度制定 在进行分析方法验证的时候,一般会预先制定的可接受限度,在制定这些验证标准可接受限度的时候需要注意哪些问题呢?我们需要避免哪些“作茧自缚”的不切合实际的限度呢?首先我们从制定分析指标的接受限度联系说起。 1各个验证项目之间的RSD有关联吗? 以液相色谱分析为例,依次要验证的项目是进样精密度、溶液稳定性、重复性和中间精密度。当你设定进样精密度数据要求RSD为5%的时候,重复性验证的标准应该不小于5%。为什么呢?在这里不进行严格的统计证明,通俗的讲的任何一个处理步骤的加入都会引入误差,这些误差是传递和累积的。如: 进样精密度RSD%=仪器检测和进样误差ε; 溶液稳定性RSD%=仪器检测和进样误差ε+检测物溶液稳定误差ε; 重复性误差RSD%=仪器检测和进样误差ε+检测物溶液稳定误差ε+称样误差ε; 中间精密度误差RSD%=仪器检测和进样误差ε+检测物溶液稳定误差ε+称样误差ε+不同操作人员误差ε+不同检测器误差ε+… …… 所以为了符合事实和验证要求,这些验证指标从理论上是逐渐增加的或者至少不变。再次强调一点,我想说的是制定这些指标的应该考虑他们的之间的误差传递情况,考虑验证项目之间的联系,明确验证实验的顺序,不是否定实际实验中真实数据重复性RSD小于进样精密度RSD的情况。统计分析从理论上是考虑的是误差逐渐增大的大多数情况(统计一直考虑大多数),现实情况可能会出现仪器分析带来的误差是正误差,而你称样误差是负误差这种很少见的特殊情况。 2怎样确定进样精密度RSD%? 接上节内容,在明白了验证项目的内在联系和接受标准的误差传递关系后,我们在想:怎样确定进样精密度RSD?其实进样精密度是针对色谱分析方法来说,对所有的分析方法。我们需要知道怎样确定第一个精密度。这第一个精密度简单的来说是量具精密度和仪器检定精密度。 选择合适的量具是保证实验数据准确的前提。天平、移液管、容量瓶等量具是实验的第一步,它们的误差水平是实验误差的开始,一般来说,合适配套的量具使用过程可以控制分析实验(比如常见的滴定实验)的误差在0.3%,高于仪器分析的精密度。 现代药物分析常用的分析手段是仪器分析。仪器检定精密度(仪器性能指标)是各个厂家争相向用户宣传的重要指标,最近的原创大赛很多帖子(在此声明:我不是在做广告)讲了气相色谱,液相色谱和离子色谱的检定过程,检定的指标既是仪器接受和仪器状态评估的重要依据,也是分析方法验证的第一步,在USP和EP中有明确的仪器验证要求,可以根据仪器检定过程确定验证项目的第一个精密度RSD。 仪器检定的精密度是针对系统的,换用不同系统时候这些精密度是需要调整的。以液相色谱为例:紫外的线性和精密度最好(一般可以达到2%),荧光的线性范围较窄,而蒸发光散射检测器(ELSD)精密度达到5%就很吃力,建议设置为7%,我想这也是在欧美药典没有采用ELSD检测器原因之一。除了检测器,同一种仪器采用不同的分析过程也会影响精密度,采用内标法避免了进样过程和信号放大过程的随机误差,一般来说,方法进样精密度比外标法高,严格的气相色谱和LC-MS分析方案一般采用内标法。 3不同数值的RSD有什么不同? 不同数值是什么意思?先看下面两组数据: 数据1514547504851数据2251245247250248251 数据2是在数据1上加200形成的,两组数据的标准误差SD均为2.21,但是数据1的RSD为4.54%,数据2的RSD为0.89%。很多时候一个分析过程的SD是一定的,就是说信号因为系统的干扰变化是一定的。要想数据的变化更多的体现是分析物的变化就必须选择适当的数据输出值,这个数据输出值会影响RSD。调节分析物的绝对含量(称取量、进样浓度体积等)会改变分析的数值。对于液相色谱,一般“调整峰高至满量程的三分之一或者二分之一”,对于滴定分析,20ml的滴定管,一般滴定体积在12-18ml比较合适。如果有的时候输出数值不能调整的合适值怎么办?比如:在用色谱分析有关物质的时候,有关物质色谱峰面积非常小。这个时候你制定可接受的范围就要适当放大,一般来说,低于5个定量限峰高的色谱峰,RSD可以放宽到20%附近。 系统科学的制定分析方法验证的可接受范围[font=宋
请教各位你们做含量测定专属性实验时接受标准是什么呀?我现在做一个蛋白质的含量测定方法验证。碱破坏和氧化破坏之后的杂峰与主峰分离度达不到要求。药典也没明确规定只是说在有别的杂质存在的情况下能检测出你要的物质就行,这怎么理解呀?急。
原料药中元素杂质含量检测方法验证,查看药典,没有具体接受标准,,这个哪里可以查?
用标准加入法测定药物含量,方法学验证中就不需要做线性和线性范围这两个项目了吧?还有用标准加入法做加样回收率的验证是不是特别麻烦?因为标准加入法测一个样品的含量就需要准备4-5个同等样品进行测定,加样回收率至少要有6组数据,所以总共要准备24-30个同样的样品测定,甚至更多,不知道我理解的对不对。
[font=&]原料药中元素杂质含量检测方法验证,查看药典,没有具体接受标准,,这个哪里可以查?[/font]
各位老师好,我最近在做采用药典检验方法的确认工作,其中有些困惑,期待您的解答。1、分析方法的确认,根据GMP指南,可以只做含量、鉴别、限量检查,制剂中还有溶出度。做的方法就是,让两个人做,然后对比结果。那么问题来了,含量、限量的判定依据是什么?就是说,我怎么去根据这两个人做出的结果来确认方法是否适用?不同的测定方法,他的判定依据也该不同吧?比如液相、气相、紫外或者滴定,他们各自的标准是什么?能否提供依据出处?2、方法确认中的鉴别,是否就是两个人做出来现象一致就可以了?3、最后一个与确认无关的事,关于气液相的保留时间,同一台仪器,先进一针标准品,保留时间为a,再进样品,保留时间为b。那么,a、b之间要满足什么条件,可以认为标准品和样品的保留时间是相同的?能否有标准可依?谢谢各位老师!!

15%,≤0.3g/100g; 脂肪含量5-- 15%,≤0.2g/100g; 脂肪含量小于5%,≤0.1g/100gl 回收率回收率在95%到105%间可接受6 参考参照GB5413.3-20107 历史信息第N次验证:2013年11月8 验证/确认实验与结果 8.1 精确度http://ng1.17img.cn/bbsfiles/images/2013/11/201311081600_475946_2227357_3.png最大的重复性符合分析要求8.2 准确度/回收率-与标准值比较http://ng1.17img.cn/bbsfiles/images/2013/11/201311081600_475947_2227357_3.png通过与标准值比较的方法确定回收率在95-105%之间,与目标范围无明显差异,准确度可接受9 附加信息及附录 附加信息http://ng1.17img.cn/bbsfiles/images/2013/11/201311081600_475948_2227357_3.pnghttp://ng1.17img.cn/bbsfiles/images/2013/11/201311081600_475949_2227357_3.png
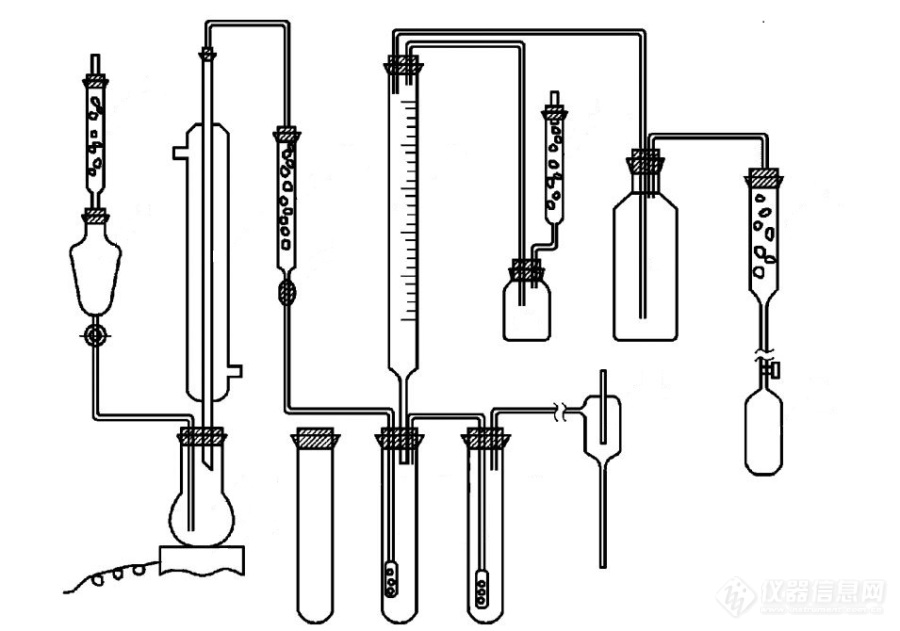
[align=center] 山西省产品质量监督检验研究院王锦明 [/align] 硫化钠又称硫化碱,广泛用于制造染料或染料中间体、冶金工业、皮革工业以及造纸行业。硫化碱典型工艺是煅烧热熔法,由于此法在煅烧过程中有碳参与方应,残留物中有碳酸钠,含量一般是2~3%,所以碳酸钠含量的高低与品质直接相关,因此,最早的硫化钠产品标准的技术要求中有碳酸钠含量技术要求。现今硫化钠生产方法多样,如:氯化钡或硫酸钡生产过程中也有副产品硫化钠,这些副产方法由于是化学反应法,碳酸钠含量用标准方法的结果,几乎测不到的。 硫化钠产品标准最早是在1984年起草的,当时方法有两种选择,一种是原苏联的装置法(见下图1),[img=,690,484]https://ng1.17img.cn/bbsfiles/images/2018/10/201810091725105936_8428_2345874_3.jpg!w690x484.jpg[/img] 图1 标准中的碳酸钠测定装置一种是滴定法,两种方法讨论的结果大家都觉得装置法还是比较理想,数据理论上要精确一些。需要注意的是由于装置复杂,过去的滴定台去支撑这一套装置几乎不可能,也就谈不上方法验证了,就是这个方法,目前的标准这个方法还在沿用。我们在近期研究了一套新的装置(见图2),[img=,690,518]https://ng1.17img.cn/bbsfiles/images/2018/10/201810091728060603_7486_2345874_3.jpg!w690x518.jpg[/img] 图2 自制的碳酸钠测定装置可以把试验用到的器皿统一到一个支架上来,解决了装置安装问题,并且我们近期做了两种方法的验证比对工作,特将方法摘要和结果汇报如下:一、实验试剂的制备 1.配制Na[sub]2[/sub]CO[sub]3[/sub]标准溶液,其浓度为0.03973 mol/L。 2.标定KOH标准滴定溶液 (1)空白的标定; (2)KOH标准滴定溶液的标定 在碳酸钠测定装置的250mL圆底烧瓶中依次加入25mLNa[sub]2[/sub]CO[sub]3[/sub]标准溶液、75mL蒸馏水和10ml(1+3)H[sub]2[/sub]SO[sub]4[/sub]溶液,用装置进行吸收,最终测出消耗KOH标准滴定溶液15.5ml,减去装置的空白消耗量,得出共消耗KOH标准滴定溶液14.5ml。[b] 二、装置的Na[sub]2[/sub]CO[sub]3[/sub]溶液的测定[/b] 分别配制0.1%,0.2%,0.3%,0.4%,0.5%的Na[sub]2[/sub]CO[sub]3[/sub]溶液,并用装置测定配制溶液的碳酸钠含量,具体结果见表1. 表1 不同浓度的碳酸钠装置测定后的结果[table][tr][td]0.1%[/td][td]结果%[/td][td]0.036[/td][td]不变色[/td][td]不变色[/td][td]0.036[/td][td]0.036[/td][td] [/td][td] [/td][td] [/td][/tr][tr][td]0.2%[/td][td]结果%[/td][td]0.25[/td][td]0.22[/td][td]0.11[/td][td]0.22[/td][td]0.33[/td][td]0.25[/td][td]0.25[/td][td]0.29[/td][/tr][tr][td]0.3%[/td][td]结果%[/td][td]0.38[/td][td]0.39[/td][td]0.37[/td][td]0.40[/td][td]0.41[/td][td]0.38[/td][td]0.38[/td][td]0.36[/td][/tr][tr][td]0.4%[/td][td]结果%[/td][td]0.48[/td][td]0.50[/td][td]0.49[/td][td]0.51[/td][td]0.49[/td][td] [/td][td] [/td][td] [/td][/tr][tr][td]0.5%[/td][td]结果%[/td][td]0.59[/td][td]0.62[/td][td]0.61[/td][td]0.60[/td][td]0.63[/td][td] [/td][td] [/td][td] [/td][/tr][/table][b]三、滴定的Na[sub]2[/sub]CO[sub]3[/sub]溶液的测定[/b] 装置测定用0.3%生物Na[sub]2[/sub]CO[sub]3[/sub]溶液,用滴定法的具体结果见表2 表2 浓度为0.3%的碳酸钠滴定测定后的结果[table=706][tr][td]0.3%[/td][td]结果%[/td][td] [align=center]0.36[/align] [/td][td] [align=center]0.34[/align] [/td][td] [align=center]0.31[/align] [/td][td] [align=center]0.36[/align] [/td][td] [align=center]0.34[/align] [/td][td] [align=center]0.33[/align] [/td][td] [align=center]0.34[/align] [/td][td] [align=center]0.33[/align] [/td][/tr][/table][b]四、结论[/b] 1、标准的装置法在0.3%以上的结果可以用,符合标准中平行测定结果的绝对值不大于0.2%的要求。 2、滴定法与吸收法比较,吸收法结果高于滴定法结果。[b]五、结束语 [/b] 通过我们的验证试验,一定程度上说明在1984年标准讨论会上的结论是正确的。

http://ng1.17img.cn/bbsfiles/images/2012/03/201203311441_358505_1835694_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/03/201203311442_358508_1835694_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/03/201203310920_358448_1641137_3.jpgβ-胡萝卜素的含量测定方法验证【CNW的色谱柱:Athena C18-WP;4.6*150mm,5μm】,分离效果良好。β-胡萝卜素的含量测定方法验证仪器:Shimadzu-20A型高效液相色谱仪;TGL-10C型离心机;KQ-500E型超声仪。试剂试药:甲醇(色谱纯);乙腈(色谱纯);石油醚(分析纯,沸程30℃~60℃);三氯甲烷(分析纯);β-胡萝卜素对照品(来源:Dr;批号:00817;含量:97.0%);分析方法及条件:(HPLC法)色谱条件色谱柱:厂家:CNW,Athena C18-WP;4.6*150mm,5μm流动相:甲醇:乙腈=90:10流速:1.2ml/min 柱温:28℃ 进样量:50µl检测器:紫外检测器448nm运行时间:20min1、线性范围确认:1.1试验方法:对照品贮备液的配制:精确称取β-胡萝卜素约12 mg于100mI容量瓶中,用约50mI三氯甲烷溶解后,再用石油醚(沸程30℃~60℃)定容至刻度,超声10分钟,使β-胡萝卜完全溶解,放冷至室温,摇匀,浓度约为120μg /mL,放在-18℃的冰箱中储存备用。1.2标准工作曲线绘制:精密吸取β-胡萝卜素标准贮备液2.00mL于50mL容量瓶中,加流动相至刻度,超声10分钟,使β-胡萝卜完全溶解,放冷至室温,摇匀,即得β-胡萝卜素标准使用液(浓度约为4.8μ[siz
国家卫生计生委发布白酒塑化剂的风险评估结果。结果显示,绝大多数白酒的塑化剂含量处于可接受水平。2012年12月以来,白酒中塑化剂问题引起关注。国家食品安全风险评估中心根据国际通用原则和方法及我国居民食物消费量和主要食品中塑化剂含量数据,对成人饮酒者的健康风险进行了评估。邻苯二甲酸二(2-乙基己基)酯(D EH P)和邻苯二甲酸二丁酯(DBP)是目前塑料制品中常用的增塑剂(俗称塑化剂)。对现有数据进行分析发现,绝大多数白酒产品的D EH P和DBP量低于本次风险评估结果。台湾塑化剂事件发生后,原卫生部规定,食品、食品添加剂中的DEHP和DBP最大残留量分别为1 .5m g/kg和0 .3m g/kg。这次风险评估的数值为何比前述数字高?风险评估中心解释,1.5m g/kg和0 .3m g/kg仅用作排查违法添加行为。若白酒中DEHP和DBP含量高于1.5m g/kg和0 .3m g/kg,但排除了违法添加行为,则只要含量分别低于5mg/kg和1.0mg/kg,对饮酒者的健康风险处于可接受水平。风险评估中心指出,鉴于DEHP和DBP是一种环境污染物,建议企业改善工艺,进一步减低白酒中DEHP和DBP含量
紫外测定含量的方法验证中,准确度试验的接受范围是怎么定的?以什么为依据啊?
药品质量标准分析方法验证的目的是证明采用的方法适合于相应检测要求。在建立药品质量标准时,分析方法需经验证;在药品生产工艺变更、制剂的组分变更、原分析方法进行修订时,则质量标准分析方法也需进行验证。方法验证理由、过程和结果均应记载在药品标准起草说明或修订说明中。 需验证的分析项目有:鉴别试验,杂质定量检查或限度检查,原料药或制剂中有效成分含量测定,以及制剂中的其他成分(如防腐剂等)的测定。药品溶出度、释放度等功能检查中,其溶出量等的测试方法也应作必要验证。 验证内容有:准确度、精密度(包括重复性、中间精密度和重现性)、专属性、检测限、定量限、线性、范围和耐用性。视具体方法拟订验证的内容。附表中列出的分析项目和相应的验证内容可供参考。 方法验证内容如下。一、准确度准确度系指用该方法测定的结果与真实值或参考值接近的程度,一般用回收率(%)表示。准确度应在规定的范围内测试。 1.含量测定方法的准确度 原料药可用已知纯度的对照品或样品进行测定,或用本法所得结果与已知准确度的另一个方法测定的结果进行比较。制剂可用含已知量被测物的各组分混合物进行测定。如不能得到制剂的全部组分,可向制剂中加入已知量的被测物进行测定,或用本法所得结果与已知准确度的另一个方法测定结果进行比较。 如该分析方法已经测试并求出了精密度、线性和专属性,在准确度也可推算出来的情况下,这一项可不必再做。 2.杂质定量测定的准确度 可向原料药或制剂中加入已知量杂质进行测定。如不能得到杂质或降解产物,可用本法测定结果与另一成熟的方法进行比较,如药典标准方法或经过验证的方法。在不能测得杂质或降解产物的响应因子或对原料药的相对响应因子情况下,可用原料药的响应因子。应明确表明单个杂质和杂质总量相当于主成分的重量比(%)或面积比(%)。 3.数据要求 在规定范围内,至少用9个测定结果进行评价,例如,设计3个不同浓度,每个浓度各分别制备3份供试品溶液,进行测定。应报告已知加入量的回收率(%),或测定结果平均值与真实值之差及其相对标准偏差或可信限。 (意见3:是否对所设定的浓度范围作出要求,如:该方法用于药品的含量测定,回收率试验的样品浓度应设定于含量100%的±20%之间;用于溶出(释放)曲线考察时,回收率试验的样品浓度应设定于全曲线范围的上、中、下部位。)二、精密度 精密度系指在规定的测试条件下,同一个均匀样品,经多次取样测定所得结果之间的接近程度。精密度一般用偏差、标准偏差或相对标准偏差表示。 在相同条件下,由一个分析人员测定所得结果的精密度称为重复性;在同一个实验室,不同时间由不同分析人员用不同设备测定结果之间的精密度,称为中间精密度;在不同实验室由不同分析人员测定结果之间的精密度,称为重现性。 含量测定和杂质的定量测定应考虑方法的精密度。 1.重复性 在规定范围内,至少用9个测定结果进行评价,例如,设计3个不同浓度,每个浓度各分别制备3份供试溶液,进行测定。或100%的浓度水平,用至少测定6次的结果进行评价。 2.中间精密度 为考察随机变动因素对精密度的影响,应设计方案进行中间精密度试验。变动因素为不同日期、不同分析人员、不同设备。 3.重现性 当分析方法将被法定标准采用,应进行重现性试验,例如,建立药典分析方法时通过协同检验得出重现性结果。协同检验的目的、过程和重现性结果均应记载在起草说明中。应注意重现性试验用的样品本身的质量均匀性和贮存运输中的环境影响因素,以免影响重现性结果。 4.数据要求 均应报告标准偏差、相对标准偏差和可信限。三、专属性 专属性系指在其他成分(如杂质、降解产物、辅料等)可能存在下,采用的方法能正确测定出被测物的特性。鉴别反应、杂质检查、含量测定方法均应考察其专属性。如方法不够专属,应采用多个方法予以补充。 1.鉴别反应 应能与可能共存的物质或结构相似化合物区分。不含被测成分的样品,以及结构相似或组分中的有关化合物,应均呈负反应(不呈正反应?)。2.含量测定和杂质测定 色谱法和其他分离方法,应附代表性图谱,以说明方法的专属性,并应标明诸成分在图中的位置。色谱法中的分离度应符合要求。 在杂质可获得的情况下,对于含量测定,试样中可加入杂质或辅料,考察测定结果是否受干扰,并可与未加杂质或辅料的试样比较测定结果。对于杂质测定也可向试样中加入一定量的杂质,考察杂质能否得到分离。 在杂质或降解产物不能获得的情况下,可将含有杂质或降解产物的试样进行测定,与另一个经验证了的或药典方法比较结果。用强光照射,高温,高湿,酸、碱水解或氧化的方法进行加速破坏,以研究可能的降解产物和降解途径。含量测定方法应比对二法的结果,杂质检查应比对检出的杂质个数,必要时可采用二极管阵列检测和质谱检测,进行峰纯度检查。四、检测限 检测限系指试样中被测物能被检测出的最低量。药品的鉴别试验和杂质检查方法,均应通过测试确定方法的检测限。常用的方法如下。 1.非仪器分析目视法用已知浓度的被测物,试验出能被可靠地检测出的最低浓度或量。 2.信噪比法 用于能显示基线噪声的分析方法,即把已知低浓度试样测出的信号与空白样品测出的信号进行比较,算出能被可靠地检测出的最低浓度或量。一般以信噪比为3∶1或2∶1时相应浓度或注入仪器的量确定检测限。 3.数据要求 应附测试图谱,说明测试过程和检测限结果。五、定量限 定量限系指样品中被测物能被定量测定的最低量,其测定结果应具一定准确度和精密度。杂质和降解产物用定量测定方法研究时,应确定方法的定量限。 常用信噪比法确定定量限。一般以信噪比为10∶1时相应浓度或注入仪器的量确定定量限。六、线性 线性系指在设计的范围内,测试结果与试样中被测物浓度直接呈正比关系的程度。 应在规定的范围内测定线性关系。可用一贮备液经精密稀释,或分别精密称样,制备一系列供试样品的方法进行测定,至少制备5份供试样品。以测得的响应信号作为被测物浓度的函数作图,观察是否呈线性,再用最小二乘法进行线性回归。必要时,响应信号可经数学转换,再进行线性回归计算。 数据要求:应列出回归方程、相关系数和线性图。(意见4:“线性”、“范围”中,如测定方法用于溶出(释放)曲线考察时,是否规定样品浓度的范围应涵盖整条曲线。)七、范围 范围系指能达到一定精密度、准确度和线性,测试方法适用的高低限浓度或量的区间。 范围应根据分析方法的具体应用和线性、准确度、精密度结果和要求确定。原料药和制剂含量测定,范围应为测试浓度的80%~120%;制剂含量均匀度检查,范围应为测试浓度的70%~130%,根据剂型特点,如气雾剂、喷雾剂,范围可适当放宽;溶出度或释放度中的溶出量测定,范围应为限度的±20%,如规定了限度范围,则应为下限的-20%至上限的+20%;杂质测定,研究时,范围应根据初步实测,拟订为规定限度的±20%。如果含量测定与杂质检查同时进行,用百分归一化法,则线性范围应为杂质规定限度的-20%至含量限度(或上限)的+20%。八、耐用性 耐用性系指在测定条件有小的变动时,测定结果不受影响的承受程度,为把方法用于常规检验提供依据。开始研究分析方法时就应考虑其耐用性。如果测试条件要求苛刻,则应在方法中写明。典型的变动因素有:被测溶液的稳定性,样品的提取次数、时间等。液相色谱法中典型的变动因素有:流动相的组成和pH值,不同厂牌或不同批号的同类型色谱柱,柱温,流速等。气相色谱法变动因素有:不同厂牌或批号的色谱柱、固定相,不同类型的担体,柱温,进样口和检测器温度等。 经试验,应说明小的变动能否通过设计的系统适用性试验,以确保方法有效。 附表 检验项目和验证内容 项目 鉴别 杂质测定 含量测定及溶出量测定 内容 定量 限度 准确度 - + - + 精密度 - - - + 重复性 - + - + 中间精密度- +① - +① 专属性② + + + + 检测限 - -③ + - 定量限 - + - - 线性 - + - + 范围 - + - + 耐用性 + + + + ① 已有重现性验证,不需验证中间精密度。 ② 如一种方法不够专属,可用其他分析方法予以补充。 ③ 视具体情况予以验证。
化学药 含量测定分析方法验证的可接受标准简介,审评四部,黄晓龙,20060120)含量测定分析方法验证总结1、准确度(加样回收实验)该指标主要是通过回收率来反映。验证时一般要求分别配制浓度为80%、100%和120%的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率。可接受的标准为:各浓度下的平均回收率均应在98.0%-102.0%之间,9个回收率数据的相对标准差(RSD)应不大于2.0%。中药一般情况下加样回收率在95%~105%,RSD要求:TLCS0.99,B<100%响应值的2%(如采用浓度由低到高分别为C1,C2,C3,C4,C5五个浓度点作标准曲线,其中C3为中间浓度(即100%响应值),其对应的峰面积为A3,则B<2%A3③一般遵守截距与斜率至少差两个数量级才有效。y=ax+b,如果a〉100倍b,可以用外标一点法;a100b,用外标两点法采用外标一点法的前提是,忽略截距,对测量结果造成的误差小于1%,因此截距与斜率的比值并没有具体规定,只要在你的线性范围内,忽略截距造成的误差符合规定就可以,可以利用线性中最小浓度代入公式,计算有和没有截距是的值,看其误差有多大就可以了④作标准曲线时(无论你是内标法、还是外标法都是如此的),只需要作一份对照品就可以了(当然,一般测定含量都用两份对照品,这样还可以避免对照品称量的误差)。⑤响应因子的相对标准差应不大于2.0%响应因子=峰面积/浓度 校正因子=浓度/峰面积一般液相用外标法进行定量,是采用两点做标准曲线,取两点的平均响应因子,计算其相对标准偏差,不得大于23.精密度精密度有三种内容:重复性、中间精密度和重现性,我们一般必须做重复性,可以做中间精密度,不需做重现性。1、仪器的精密:指同一样品溶液连续进样6-9次所得结果,对照或样品均可;2、重复性:在相同的条件下,由一人取同一均匀样品,平行测定所得的结果;3、中间精密度:不同时间或不同人员或用不同设备测定同一均匀样品,所得的结果;4、重现性:类似药检所复核,但我认为也是必须要做的。如果申报材料时不做,你怎么知道方法是否能重现呢,万一重现不出来,不是晚了吗。5、稳定性:主要是考察溶液放置时间的稳定性,故只做供试液即可;精密度主要考察检验仪器的稳定性;重复性是考察方法的稳定性,它包含从样品处理到仪器检测的全过程密度跟重复性是不一样的 1).联系精密度包括重复性,另外还有中间精密度、重现性。2).区别精密度 指在规定的测试条件下,同一均匀供试品,经多次取样进行一系列检测所得的结果之间的接近程度(离散程度)。重现性 指在同样的操作条件下,在较短时间间隔内,由同一分析人员测定所得结果的精密度。可以看看精密度试验的目的,我们只作只作供试品的,从来没有因为这个药审中心给发补,我觉得可以说明问题。说说我的中间精密度设计:我是取三批供试品在不同时间,用不同的试验仪器,同一个试验人(因为若不同试验人,原是记录也是要两个人写,很麻烦,方法规定是三个变量中的任意变动,所以我认为不必三个变量都改变,这里我只改变时间和仪器)测定两次,分别为中间精密度1和中间精密度2,我将其中一次测定结果作为零天三批测定值。还有人的做法是不做三批,只作一批。1)重复性配制6份相同浓度或分别配制浓度为80%、100%和120%的供试品溶液各三份的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于2.0%。重复性测定可在规定范围内,至少用9 次测定结果进行评价,如制备3 个不同浓度的样品,各测定3 次,或采用同一批样品(把被测物浓度当作100%),用至少测定6 次的结果进行评价。2)中间精密度配制6份相同浓度的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于2.0%。①中间精密度在同一实验室,不同时间由不同分析人员用不同设备测定结果的精密度。重现性实验是否在申报新药时要做,药典会的人明确说不要做,因为在药检所复核你的质量标准时就做了重现性,因此在申报时不需要做。重复性(repeatability)与重现性(再现性,reproducibility),二者都是用来评价分析结果的精密度。大多数人都不作严格区分,有的文献中还常常混用。但是二者的实际意义是不一样的。重复性是指同一分析人员在同一条件下所得分析结果的精密度,重现性是指不同分析人员或不同实验室在各自的条件下所得分析结果的精密度。也就是说,重现性比重复性提出了更高的要求。重复性好,重现性未必好。而重现性好,重复性肯定好。二者都是用多次分析结果的RSD来表示。对现代仪器分析而言,重复性是容易实现的,而重现性是更重要的,也是方法验证必须考察的。方法的重现性包括连续多次进样分析的重复性、不同天数间的重复性、不同型号仪器间的重现性和不同实验室间的重现性。②方法开发人员,首先应测定重复性。即在相同条件下连续进样5-10次,一般要求保留时间的RSD不大于1%,峰面积的RSD不大于5%。如果样品要经过预处理,还应测同一样品多次处理的重复性。即同一样品取3-5份作平行处理,测定结果的RSD不应大于5%。某些工业分析要求不大于10%。至于天与天之间的重复性也不应大于10%。当上述重复性满足要求后,说明该方法在你的实验室是可靠的。要将此方法推广使用,还必须测定不同仪器、不同分析人员、不同实验室之间的重现性。当这些重现性都能满足要求时,这一方法的的可靠性就得到较为满意的验证。
[align=center][b]浅谈药典中高效液相色谱法测定中药材含量方法学验证的方法[/b][/align][align=center]西安国联质量检测技术股份有限公司[/align][align=center]食品事业部:任阳阳[/align]药典中关于方法学验证有相应的指导原则,指导原则上写的内容较宽泛和笼统,但对于大多数检测人员来说根本不知道如何下手,本文是根据自己的理解和经验来阐述如何做好药典中高效液相色谱的方法学验证。首先要了解做好药典中高效液相色谱的方法学验证,要好好的理解两部分的内容:第一,要熟悉0512高效液相色谱法这部分的内容;第二是理解9101药品质量标准分析方法验证指导原则,结合这两部分内容,做好方法学验证。1. 确定本实验室要使用的仪器和配件能否满足本次验证的色谱提交,包括色谱柱、检测器和流动相。2. 0512方法中验证系统适用性实验首先要了解色谱的适用性实验包括5个参数:理论塔板数、分离度、灵敏度、拖尾因子和重复性。2.1理论塔板数和分离度在已调试好的色谱条件下,分析目标物质,根据分析结果计算此方法的理论塔板数和分离度。一般待测物质色谱峰与相邻色谱峰之间的分离度不大于1.5。2.2 灵敏度通过一系列浓度的对照品确定信噪比,其灵敏度要求定量测定时信噪比≥10;若为定性鉴别其信噪比要求≥3。2.3拖尾因子T拖尾因子是评价色谱峰的对称性结果,以T表示,对对照品进行进样,分析色谱结果,以峰高作定量参数时,T值应在0.95~1.05之间。2.4 重复性 一般采用外标法,取对照品溶液连续进样5次,计算5次进样的峰面积的相关标准偏差,要求≤2.0%以上5点是0512方法内容中需要验证的5点内容,已对方法进行了简单的验证,但这些不够,还得结果9101的内容进行详细的进一步的验证。3. 9101验证的指标主要有准确度、精密度、专属性、检出限、定量限、线性和耐用性,其中精密度可以参考0512中已验证的重复性的检测结果;检出限和定量限也可参考0512中验证的结果。3.1准确度准确度是指该方法测定结果与真实值或参考值的接近程度,常用回收率进行验证。一般选择高、中、低三个浓度进行测定,也就是说,对照品加入量与待测供试品含量的比值为1.5:1,1:1和0.5:1进行加标实验,分析加标结果,计算回收率和回收率的相对标准偏差,结果必须满足药典要求。3.2 专属性向试样中加入杂质或辅料,与杂质和辅料的结果进行比较,确定测定结果是否受干扰。3.3 线性根据待测成分的含量大小,选择至少5份合适的浓度范围进行分析,以测得的响应信号(峰高或峰面积)对被测物的浓度作图,求出线线方程和相关系数。3.4耐用性一般经过变动流动相的比例、流动相的pH、不同类型的色谱柱。柱温以及流速来进行验证,验证测定条件发生微小变化时,测定结果不受影响的程度,从而确保方法的可靠性。综上所述,以上是高效液相色谱法测定中药材含量的方法学验证的所有指标,通过以上指标的完善和验证,才能做出一套完成的方法学验证。

苯酚试剂含量的技术验证方法 苯酚试剂不属于我们常用试剂,但也是是实验室某些化学分析中必用的分析试剂之一,就比如纺织纤维中聚酯纤维的定量分析,因聚酯纤维在强酸强碱中都不溶,要用到这个试剂配制溶液,才能溶解,那么我们新采购的苯酚试剂,也应该按试剂相关标准要求对试剂进行验收,验收的目的就是验证其含量是否达到我们的分析试验要求。能否用于正常的试验分析。http://ng1.17img.cn/bbsfiles/images/2013/11/201311132004_477036_2154459_3.jpg 苯酚试剂具有腐蚀性,在使用操作中要注意自身的保护,要佩戴防毒口罩,最好是防毒面具,防护眼镜,防护服,以免发生伤害或意外事故 低浓度苯酚被人体吸收后,肝脏组织的解毒功能将使其失去大部分毒性,并随尿排出。但可能会造成慢性中毒,如出现不同程度的头昏、头痛等神经症状,以及食欲不振、吞咽困难、呕吐和腹泻等消化道症状 苯酚试剂的技术指标主要就是苯酚的含量的测定,那么我们看看苯酚的含量测定。1.测试程序1.1.苯酚含量检测——化学法1.2.原理:采用碘量法,利用苯酚与溴反应生成三溴苯酚,过量的溴与碘化钾反应生成碘,用硫代硫酸钠标准溶液滴定,计算出苯酚的含量。1.3.仪器及设备(1)碱式滴定管,50ml;(2)三角烧瓶,500ml;(3)分析天平,准确至0.0001g。1.4.试剂(1)溴标准溶液,0.1mol/L;(2)硫代硫酸钠标准溶液,0.1mol/L;(3)淀粉指示液,2%;(4)碘化钾,分析纯;(5)盐酸,分析纯;(6)三氯乙烷,分析纯。1.5.检测步骤准确称取约0.1g试样,放入500ml碘量瓶中,加水30ml水,精密加入溴标准溶液40ml,加入5ml盐酸,封口,振荡30分钟,静至15分钟,加2g碘化钾,立即封口。充分振摇后,加入三氯乙烷1ml,用硫代硫酸钠标准液滴定至近终点时加3ml淀粉指示液,继续滴定至蓝色消失为终点。1.6.含量计算苯酚的含量按下式进行计算: ×0.01596 X= ───── ×100% M式中 X:苯酚含量(m/m),%N1:溴标准溶液的浓度,mol/L;V1:加入溴标准溶液的体积,ml;N2:硫代硫酸钠标准液的浓度,mol/L;V2:滴定时消耗的硫代硫酸钠标准液的体积,ml;M:苯酚样品的称样量,g0.01596:苯酚的毫摩尔当量。1.7.允许误差苯酚的两次平行测定结果之绝对差值应不大于0.2%,取其算术平均值作为检测结果。2.水分测定按《微量水分检测方法-卡尔·费休法》中的规定进行,两次平行测定结果的绝对差值应不大于0.005%,取其算术平均值作为检测结果。3.质量指标指标名称指标[/
大家有做过含量及有关物质的EP标准分析方法验证的吗?分享下经验吧
[align=center][b]溴铵灵 苯扎溴铵溶液中苯扎溴铵含量的测定方法验证报告[/b][/align][align=center][b]《消毒产品技术规范》(2002版)2.2.1.2.13[/b][/align][align=center][b]国联质检:宋小莉[/b][/align]一、方法概述 [color=#0000ff] [/color]适量样品加氢氧化钠和溴酚蓝指示液与氯仿,振摇后用四苯硼钠滴定溶液滴定,待蓝色消失,记录四苯硼钠滴定液用量,计算得苯扎溴铵含量。二、试剂1.氯仿;2.氢氧化钠试液:4.3g氢氧化钠加蒸馏水溶解稀释至100ml。3.溴酚蓝指示液:0.5g/L。4.四苯硼钠滴定液:0.02mol/L。三、仪器一般实验室仪器碱式滴定管分析天平四、分析步骤 精密称取样品适量,使其相当于苯扎溴铵约0.25g,置于250ml碘量瓶中,用蒸馏水50ml与氢氧化钠试液1ml,摇匀。再加溴酚蓝指示液0.4ml与氯仿10ml,用四苯硼钠滴定液(装入50ml滴定管中)滴定,边滴定边摇匀,接近终点时需强力振摇,待氯仿层蓝色消失,记录四苯硼钠滴定液用量,同时做空白试验。取平均测定值为结果。五、结果计算[align=center][img=,232,85]http://ng1.17img.cn/bbsfiles/images/2018/07/201807152210577337_7606_2904018_3.png!w232x85.jpg[/img][/align]上述两式中X为苯扎溴铵含量,%或g/L;c为四苯硼钠滴定液的浓度,mol/L;Vstp滴定时试样与空白消耗的碘酸钾滴定液体积之差,ml;m为试样质量,g;V为原液体积,ml;0.3984为1mol/L四苯硼钠滴定液1ml相当于0.3984g苯扎溴铵。六、验证精密度连续测定报告编号为LBC180700072单子中的样品5次,测定结果如下:[table][tr][td]测定次数[/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td]苯扎溴铵含量,%[/td][td][align=center]4.992[/align][/td][td][align=center]5.023[/align][/td][td][align=center]5.015[/align][/td][td][align=center]5.024[/align][/td][td][align=center]4.998[/align][/td][/tr][tr][td]苯扎溴铵平均含量,%[/td][td=5,1][align=center]5.010[/align][/td][/tr][tr][td]苯扎溴铵的重复性,%[/td][td=5,1][align=center]0.032[/align][/td][/tr][/table]本方法中苯扎溴铵含量的重复性为:0.032%,符合标准要求。七、验证准确度对报告编号为LBC180700072的样品进行实验室人员之间比对测试,比对结果如下:[table][tr][td][align=center]测定次数[/align][/td][td][align=center]测定结果(%)[/align][/td][td][align=center]不同人员测定结果(%)[/align][/td][td][align=center]相对误差,%[/align][/td][/tr][tr][td][align=center]1[/align][/td][td][align=center]4.992[/align][/td][td=1,6][align=center]5.017[/align][/td][td=1,6][align=center]0.007[/align][/td][/tr][tr][td][align=center]2[/align][/td][td][align=center]5.023[/align][/td][/tr][tr][td][align=center]3[/align][/td][td][align=center]5.015[/align][/td][/tr][tr][td][align=center]4[/align][/td][td][align=center]5.024[/align][/td][/tr][tr][td][align=center]5[/align][/td][td][align=center]4.998[/align][/td][/tr][tr][td][align=center]平均值[/align][/td][td][align=center]5.010[/align][/td][/tr][/table]本方法中苯扎溴铵含量的相对误差为:0.007%;小于15%,符合标准要求。八、总结本方法中苯扎溴铵含量的重复性为:0.032%,符合标准要求。比对检测苯扎溴铵含量的相对误差为:0.007%,小于15%符合标准要求。通过对苯扎溴铵含量测定方法精密度和准确度的评价,本方法测定溴铵灵 苯扎溴铵溶液中苯扎溴铵含量数据准确,结果可信。此方法的准确性好,测定结果真实可靠。