各位老师好,本人这几天参照gb/t20769做菠菜粉中农残,具体步骤如下:1.称取5.00g菠菜粉准确加入50ml乙腈匀浆提取2分钟后离心,再准确移取出25ml溶液,水浴旋蒸浓缩,然后净化。2.根据标准净化步骤进行净化,现象如下图3.净化液旋蒸浓缩近干后加入2ml甲醇,涡旋混匀,滤膜过滤上机检测。现在遇到的问题就是:一、2ml的甲醇待测样,颜色很深,呈墨绿色,这不是不是过柱效果不好?二、我的标曲浓度范围是1.75-44;菠菜样品有两个不同浓度,应该是一个高一个低,高浓度测得的结果为43,我认为这个浓度太高,应该稀释一倍让其位于标曲中间,数值才比较可靠,但是稀释一倍之后发现,稀释前和稀释后两个测到的数值居然是一样的;然后将低浓度(检测值为14)也稀释一倍之后再检测,发现低浓度稀释前后检测到的数值为13,变化不大。综上,这是什么原因引起的呢?请各位有经验老师指点一下,谢谢[img]https://ng1.17img.cn/bbsfiles/images/2022/06/202206091051346415_846_3972820_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2022/06/202206091051346444_2349_3972820_3.png[/img]
我们做样品不稀释的话一般是按照标准上的检测限,但是如果样品色谱法测定多组分要稀释做那么原始记录里检测限如何写呢?要经过稀释倍数换算吗? 就是测定样品中A、B 组分,检测限都是1ng。样品中如果B很大超过标线5倍了,而A又很小。这时候把样品稀释10倍可以算出B 浓度,那么A浓度可能会小于检测限了,这时候原始记录里A 、B的检测限写1ng 还是10ng?
石墨炉原子吸收法测硝酸镉溶液中镉的含量,样品稀释不同的倍数,检测结果相差很大!具体操作如下:取1ml浓度1mg/ml的硝酸镉置100ml容量瓶,以纯净水定容(硝酸用完了,因为是预试验,所以没用2%硝酸定容),再取1ml置100ml容量瓶,以纯净水定容,得测试样品溶液(1)。仪器:AAS ZEENIT700石墨炉条件:(升温速率略)干燥 75度20秒干燥 90度20秒干燥 110度10秒灰化 300度20秒AZ 300度4秒原子化 900度3秒除残 2300度3秒标准曲线浓度系列 0 0.8 2.00 4.00 6.00 8.00校正公式:ABS=(0.006120+0.059021X)/(1+0.039427X)为非线性X表示镉浓度,单位为ng/ml样品溶液(1)初测的浓度为117.2ng/ml,超出标线,故让仪器自动稀释5倍后(应直接稀释10倍看看),再测结果为166.8ng/ml,故进行手动稀释。取1ml样品溶液(1)置25ml容量瓶,以纯净水定容,得测试样品溶液(2)。样品溶液(2)的检测结果为1.679ng/ml。我的样品溶液(1)中的镉浓度是1mg/ml(1上下0.2左右),最初测试还算接近,但稀释5倍后反差更远了,再稀释25更对不上了(117.2/25=4.688或166.8/25=6.672,即使超出标线,也应该不会差得太远吧),请问这是为什么稀释25倍后差这么多?谢谢(我只是送样,管理仪器的老师代测)
我们在测土壤k时,发现abs测量范围在1.2左右,超过仪器范围0.75后高浓度标线无法跑直,r值只能在0.91左右。然后就想把样品(abs值在1.2左右)稀释,稀释一倍左右发现,abs值在1.0左右,值和稀释后倍数相差很大,然后又稀释到10倍,发现abs值在0.4左右。值和稀释后倍数仍然相差很大。这个问题如何解决?求助!
假设有一个样品由于某种原因必须稀释后才可以使用仪器做样 稀释十倍后作出结果低于检测线(检测限为1ppb),请问最后的结果应该报告多少合适?<1ppb 还是<10ppb 还是另有这方面的规定? 希望高人能帮我找下依据,比如说国标阿,规章啊之类的 谢谢
对于样品超出标线范围,需要稀释,大家是稀释后多长时间进行上机测定呢?我今天测试膨润土中的总砷,样品浓度超出标线最高点5倍,我对样品稀释了10倍,然后放置5分钟后上机测定,但是稀释后的结果和不稀释是不成倍数,原先超出标线最高点时测得浓度为100ng/ml,但是稀释10倍后的样品浓度为4.5ng/ml,是放置的时间不够,硫脲没有将砷还原吗?望各位专家和版友给与帮助,解答,十分感谢!!
样品稀释20倍得出结果后在乘以20,和样品不稀释直接做有区别么?
我是水系的GFC,主要做环境水样的分子量分布。流动相是水,样品也是水。用的是示差检测器。我想问的是:常常会有比较脏的样品(比如说过完滤膜的城市污水),因为怕污染柱子,常稀释样品10倍,100倍的,发现稀释前后得到的分子量分布是很不相同的。我很疑惑,是这样的吗?如果稀释完进样不能反应原样品的分子量分布,难道我能把那么脏的水直接进柱子?
如题。用空白基质(如血浆、尿液等)稀释样品后测定,在标准曲线范围内,但是在建方法时稀释比怎么做,要怎么考查?
用国标测钙时发现一个问题,想看看各位老师在日常实际中是如何处理的:我们日常检测的含钙样品的钙含量在12.5%左右,根据国标曲线钙标准曲线为0.5-6ug/mL,样品取样量为0.2g时,样品上机需要稀释的倍数为25X20X20,样品加5mL硝酸微波消解后赶酸至剩下1mL时,根据国标的规定,用水定容至25mL,现在的问题是:后面的稀释液是“用水含1g/L的澜溶液稀释”,还是“用硝酸溶液(5+95)含1g/L的澜溶液稀释”?1.旧国标的稀释液写明用20g/L澜溶液作为稀释剂,就很明确。2.但是新国标没有写的特别清楚,只是笼统的写了“再根据实际测定需要稀释,并在稀释液中加入一定体积的镧溶液(20g/L),使其在最终稀释液中的浓度为1g/L,”3.新国标在配曲线的时候是用“硝酸溶液(5+95)含1g/L的澜溶液稀释”,但是到样品就没写详细,现在的情况是用“水含1g/L的澜溶液稀释”,检测结果会比用“硝酸溶液(5+95)含1g/L的澜溶液稀释”的检测结果高20%。所以,想问下各位老师,日常检测钙时,需要稀释时稀释液是用的“用水含1g/L的澜溶液稀释”,还是“用硝酸溶液(5+95)含1g/L的澜溶液稀释”?
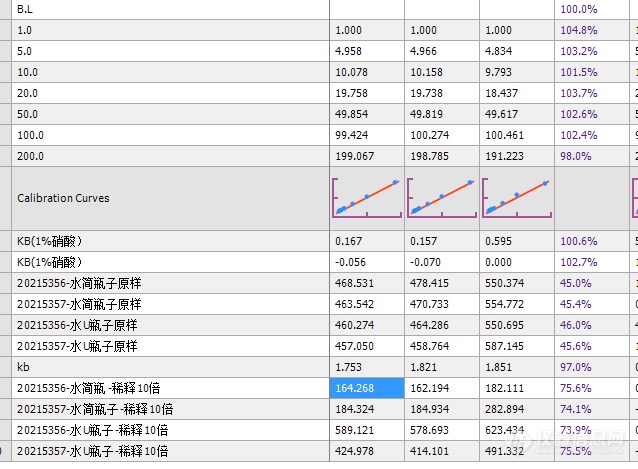
有个问题想向各位老师请教一下。就是我们采的测水铀的水样,同一个样品同时采了两份,一份做水铀(硝酸酸化),一份做水简(未加酸)。,现在是用[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]测水里铀含量。用原样测(硝酸酸化样和水简未加酸),两份结果差不多,450多ug/L,但内标40%左右,所以对样品进行了稀释了,稀释之后,水铀瓶子的稀释结果一个提高了一些,另一个基本没变化,但是水简的瓶子稀释后的结果却降到了200左右。一百多ug/L。难道同一个水样加酸与不加酸进行稀释后的结果会有这么大差别吗?(图片的选取了U的三个质量数)[img=,638,469]https://ng1.17img.cn/bbsfiles/images/2021/10/202110051519429341_7010_3315514_3.png!w638x469.jpg[/img]
我们平时做食品样和水样的时候,因为做的比较多了,大致了解了待测元素的浓度范围,所以消化后一般定容到25ml即直接进样了。前几天做水源水中的铁锰的时候突然发现所测值超出我线性范围好几倍。心疼我的检测器啊!若有所思:这还是不容易残留的元素,如果是B、Hg这些易于残留的元素,那可真惨了。所以,以后不熟悉的样品还是先稀释1000倍后,在正常分析吧。战友们碰到过这种问题吗?
现测试一样品,测试工具箱或测试仪器上显示超出范围。这时,将5mL去离子水加入到5mL样品中,重新测定。用稀释后的样品测定得到的结果是1.9mg/L,则稀释前样品的浓度为 ,即3.8mg/L。 如果二倍稀释后的样品浓度仍然超过量程,则需要增大稀释倍数。例如,在1体积样品中加入2体积去离子水,做三倍稀释(测定结果乘以3),或者在1体积样品中加入3体积的去离子水,做四倍稀释(测定结果乘以4),以此类推。如果在你的测试中要用待测样品作为空白样,那么就把稀释后的样品作为空白样。 在进行稀释时,准确地量取样品以及去离子水的体积是非常重要的。量取的错误将导致测定结果的错误,而且这个错误的结果还会被乘以稀释倍数。因此,按照最低要求,应用量筒量取样品和去离子水。为了得到更好的结果,可使用移液管移取样品至容量瓶(A级)中,再加去离子水定标至刻线。测试前将其充分混合摇匀。 测试者可根据需要,使用适当的移液管和容量瓶来配制一定体积的稀释溶液。比如,做20倍稀释时,可以移取1mL样品到19mL去离子水中,也可以移取5mL样品到95mL去离子水中(或在100mL容量瓶中稀释至刻线),这样所得溶液的稀释倍数是相同的。如果测试时只需要10mL稀释后的样品,则使用10mL进行测定,剩余的稀释溶液视测试者需要可作空白样品或重复测定之用
本人新手,向大家请教个问题,请大家帮忙分析:检测未知金属样品中杂质Ca的含量,搞不清楚到底Ca含量有多少。检测结果:称取量0.15g,原液检测:Ca为0.0021~0.0022%;稀释100倍,Ca检测值为0.0527~0.0606%。两者差别太大~做了基体匹配;标准溶液中Ca含量暂选为0.05、0.5、5ug/ml;样品空白Ca为-0.0481%。请问大家哪方面因素对结果的影响大,请大家不吝赐教!谢谢!!!
现在我们用气相色谱仪来检测酸气中硫化氢,有机硫含量,由于气样中硫化氢等含量太大,出峰是平头峰,需要稀释。我们的色谱仪很老了,没有分流不分流进样口,用的还是微机处理机。具体气体样品的稀释操作是什么样的,有哪些注意事项吗
[font=SimSun, STSong, &]做微生物试验,例如大肠杆菌和霉菌,检样过程中必须是25g样品+225稀释液吗?可以换成其他等比例稀释吗?[/font]
最近做铅,标液最高30ppb(吸光度0.1247),样品为41,47(吸光度0.1685,0.1940)。稀释两倍后,测得结果乘以稀释倍数为:46,57(吸光度0.0975,0.1185)。稀释5倍后回算结果:61,76(吸光度0.0528和0.0645),怎么越稀释值越高呢?
今天做胶囊中铬检测,发现结果超出线性范围,又从新稀释上机,检测,最后关于计算出现点疑惑:我定容体积是50ml,检测超出线性范围后又从50ml中取1ml稀释至50ml,最后检测结果为4.51ppb,样品空白1.77ppb(没有稀释),样品质量0.2761g,那么最后结果怎么计算呢?有2个方法,不知道那个对,1是用(4.51-1.77)x2500÷0.2761÷1000=24.8ppm 2是 (4.54x50-1.77)x50÷0.2761÷1000=40.8ppm究竟那个对?还是都不对?
样品为含氯有机物的乙醇溶液,量比较少,很难实现萃取分离,用气相ECD检测溶液中的含氯化合物,ECD一般不能用乙醇作溶剂,用什么溶剂能把样品溶解(稀释样品)做ECD? 请教ECD高手,万分感谢!
2.3.1液体样品 2.3.1.1水溶性的液体样品,可量取10ml加到90ml灭菌生理盐水中,如样品不少于10ml.仍按10倍稀释法进行。如为5ml则加45ml灭菌生理盐水,混匀后,制成1:10稀释液。, 2.3.1.2油性液体。取样品10ml,先加5ml来菌液体石蜡混匀,再加10ml灭菌的吐温80,在40~44℃水浴中振荡混合10min,加入灭菌的生理盐水75ml(在44~44℃水浴中预温),在40~44℃水浴中乳化,制成1:10的悬液。 2.3.2膏、霜、乳剂半固体状样品 2.3.2.1亲水性的样品,称取10g,加到灭菌的带玻璃珠加有90ml灭菌生理盐水的锥形瓶中,充分振荡混匀,放32℃水浴静置15min.用其上青液作为1:10的稀释液。 2.3.2.2疏水性的样品,称取10g,放到灭菌的研钵中,加10ml灭菌液体石蜡,研磨成粘稠状,再加10ml灭菌吐温80,研磨待溶解后,加70ml灭菌生理盐水,在40~44℃水浴充分混合,制成1:10稀释液。 2.3.2.3固体样品,称取10g,加到灭菌的生理盐水稀释瓶中,振荡混匀,使其分散混悬后,放30~32℃水浴中,15min后取出,充分振荡混合,再放到30~32℃水浴中静置15min,取上清液作为1:10的稀释液。 如有均质器,上述水溶性膏、霜、粉剂等,可称10g样品加到90ml灭菌生理盐水,均质1~2min;疏水性膏、霜及眉笔、口红等,称10g样品加到90MLSCDLP液体培养基,或1g样品加1ml灭菌液体石蜡、1ml灭菌吐温80、7ml灭菌生理盐水,均质3~5min。 上面是GB7918.1 化妆品微生物标准检验方法总则中样品的稀释方法,太复杂,样品多的时候根本没法做,我相信没人会完全按照上面所述的研磨、均值、恒温去操作的吧。但所有的标准《化妆品规范2007》、GB、SN方法样品稀释都是参照上述标准。请问大家都是用什么方法或仪器?有没有更简便又实用的?例如:JT-C匀浆仪(均质器)有没人用?据说是药典推荐,不会损伤细菌吗?http://www.lhjtyq.com/product/pics/20110514/1305368089.jpg拍击式均质器有没人用?说明中好像没有说化妆品适用.http://www.qqma.com/cpimagenew/2011/06/28-h2009122-64735.jpg漩涡混匀器?小厂用的很多。http://a24399465.myhichina.cn/_m_gw_Hnlh6C5-u1VSNDZRDpdEOKMNq_fkWYWjJ6ICos_7ZHRgG_qe8rnGhDC0izbyKY1cNUYvABeI8Eb8EsNxiTax7ng8WkFToaD2.jpg大家谁用过发表点意见,希望版主支持讨论,谢谢。
问题描述:最近在做硫化物的考核样。用GB/T 16489-1966亚甲基蓝分光光度法,标准溶液是购买的,浓度为 100mg/L,直接用水稀释成 10mg/L;标准样品也是从安瓿瓶中取 10ml 直接用水稀释至250ml 待测。标线绘制和标样测定时,都先在比色管中加入 20ml 的乙酸锌-乙酸钠溶液,再加入适量的标准溶液和标样,再加水和其他试剂。做出的标准样品结果偏低。求助论坛的兄弟姐妹们:a、做硫化物的时候,应该用什么稀释?用水还是用一定量加入乙酸锌-乙酸钠的水稀释?水是用去 CO2水,还是按照国标上用碱性水?b、实验是按照国标 GB/T 16489-1996,还是按《水和废水监测分析方法》第四版书进行的?c、如果是用加入少量乙酸锌-乙酸钠的水稀释,标准使用液是配成 10mg/L好还是 5mg/L好,因为由于加入混合液,稀释成高浓度的标准溶液沉淀明显,使得最后两点偏低。我用 GB/T16489-1996 方法,做出的标准曲线为 y=0.00994X+0.002,相关系数为 0.9999,线性很好,我觉得可能是斜率偏高,导致所做的标准样品值偏低。空白实验加入乙酸锌-乙酸钠混合液,空白值吸光度为 0.016,纯水做吸光度为 0.008。解答:a、标样介质要看证书上的相关说明,另外,稀释的时候可以考虑与标准曲线一致。一般中国计量院卖的辽宁环境监测站出的标准是用氢氧化钠稀释,环保部出的质控样品采用乙酸锌-乙酸钠溶液为介质。最重要的就是曲线和盲样的处理方法就是一定要一致,曲线盲样都用乙酸锌乙酸钠处理也行。b、硫化物的检测不止这两个方法,还有 GB/T 5750.5-2006 中 N,N-二乙基对苯二胺分光光度法等测定方法,可以根据样品来源确定方法。c、样品加乙酸锌目的是生成硫化锌沉淀固定,测定要加酸释放富集再来做。使用也的浓度需要根据自己样品的浓度,也就是具体的检测需求来定,并不固定。
对于纯的香料来说,我在用GC-MS检测含量时直接进样或用溶剂稀释后进样,请问对于这种样品来说检测塑化剂时是否可以直接进样或稀释后进样呢?如果可以的话,是否要用分流模式呢?附:很多香料可以和正己烷互溶另外,对于含三乙酸甘油酯或辛癸酸甘油酯这类香精,可否用正己烷提取后直接进样?很急,在线等大家的意见,谢谢
石墨炉分析污水中的锰含量,样品空白高于被测水样用AA PE700石墨炉检测污水中锰的含量,未加基改剂,校准空白用的纯水,校准曲线为0.999855,分析试样时样品空白和被测水样同时稀释50倍(用纯水稀释)得出样品空白为2.2ppb,被测水样含量为2.0ppb,样品空白高于被测水样。之后改为不稀释进样得出样品空白为1.1ppb,被测水样为19.8ppb,系统提示超出标准浓度。不知道是哪的问题,请大家帮忙指导一下,另外样品空白和被测水样稀释倍数是否一定要一致,样品空白不稀释可以吗?
请问各位,正相色谱法检测样品含量所用的样品稀释剂是否可以改变。比如,大豆油含量测定时样品稀释第一步用的是正已烷和异丙醇(1:1)混合溶液,第二步稀释是用流动相。我可以把第二步的流动相换成1:1的混合液吗?如果换了,对测定结果及色谱系统是否会有影响。各位如果没有检测过,可以从理论上帮助我分析一下吗?非常感谢!
检测水中汞时,可以稀释后第二天再测吗?
我是做水质分析工作的,今天遇到一个数据处理的问题,向专业人员请教请教。 样品稀释后,在计算样品浓度时是应该用平行的平均值乘以稀释倍数呢,还是该乘以稀释倍数后在算平均值呢?另外在原始记录上记录时中间步骤中是应该记录没有稀释的浓度,还是应该算上稀释倍数呢? 希望同行和我多多联系,相互交流经验
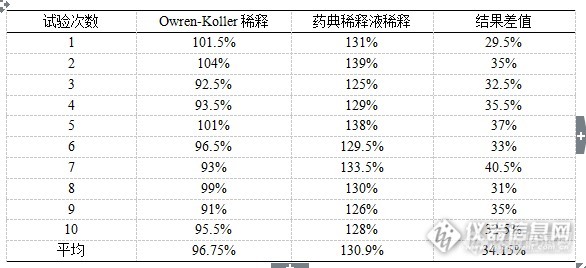
[align=center][/align][align=left][b] 摘要:目的 [/b]确立不同稀释液对凝血因子效价检测的影响,研究因子效价检测的稀释方法,从而完善因子类血液制品效价检测的方法。 [b]方法 [/b]对同一批和连续生产的10批人凝血因子Ⅷ、人凝血酶原复合物样品进行全自动血凝仪法的效价检测,分别选用全自动血凝仪稀释液和含1%人血白蛋白稀释液进行检测,统计10次以上的检测结果以确定不同稀释液之间的差别。 [b]结果 [/b]本实验确定了在人凝血因子Ⅷ的效价检测中,采用不同的稀释液对每1 ml约含1.00 IU人凝血因子Ⅷ的样品进行稀释,无论是对同一批质控品的测定还是对连续批次样品的测定,检测结果之间存在较大的差别。而在人凝血酶原复合物人凝血因子Ⅸ的效价检测中,采用不同的稀释液对每1 ml约含1.00 IU人凝血因子Ⅸ的样品进行稀释,同一批质控品和连续批次样品检测结果之间差别较小。[b]结论 [/b]因子类血液制品效价检测时,同一样品采用不同的稀释液进行稀释检测结果可能存在较大差别,应对血凝仪是否可用于因子类血液制品进行评估,并应建立起正确的检测操作规程。[/align][b] 关键词: [/b]凝血因子; 稀释液; 效价测定 目前国内血液制品的生产是以健康人血浆为原料,经过分离纯化和病毒灭活制成,主要分为三大类,人血白蛋白、人免疫球蛋白类产品、人凝血因子类产品。国内已上市或在研的人凝血因子类产品主要有人凝血因子Ⅷ、人凝血酶原复合物、人纤维蛋白原、人纤维蛋白粘合剂、人凝血因子Ⅸ、人抗凝血酶Ⅲ等。人凝血因子Ⅷ主要用于防治甲型血友病和获得性凝血因子Ⅷ缺乏而致的出血症状病人的手术治疗。人凝血酶原复合物主要有效成分为人凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ,主要用于治疗主要用于乙型血友病、 维生素K依赖的凝血因子缺乏症等病症的治疗。 人凝血因子Ⅸ主要用于防治乙型血友病和获得性凝血因子Ⅸ缺乏而致的出血症状病人的手术治疗。因子类血液制品是血液中凝血因子的高纯度浓缩物,在进行效价测定时需要对样品进行稀释,而稀释液中蛋白含量的不同对其检测结果有着影响。因子效价测定方法有一期法、二期法和发色底物法。一期法是目前应用最广泛的检测方法,系用人凝血因子缺乏血浆为基质,在APTT试剂和氯化钙的参与下,根据凝血因子国家标准品和供试品的凝集时间来计算供试品中的人凝血因子效价,实际检测过程中将基于一期法原理的人凝血因子效价测定法分为三种方法,即手工法、半自动血凝仪法、全自动血凝仪法。全自动血凝仪只是对一期法中各反应试剂的加入顺序进行了修订以便实现仪器的自动操作。相对于手工法检测,消除了很多主观因素。在日常工作中,当使用不同种类的稀释剂而采用相同的检测原理和方法进行效价测定应不会对测定结果产生影响,但实际工作中发现使用不同种类的稀释剂对效价测定结果有一定的影响。在人凝血因子Ⅷ效价检测过程中,采用手工法、半自动血凝仪法、全自动血凝仪法进行人凝血因子Ⅷ效价的比对试验,发现手工法、半自动血凝仪法检测结果一致,这两种方法比全自动血凝仪法的检测结果高20%以上。血液制品的原料来源于人血浆,受原料限制,一直较为稀缺,尤其是当前人凝血因子Ⅷ的生产量远远无法满足血友病患者的需求[sup][[/sup][sup]1-5[/sup][sup]][/sup],不同检测方法间20%以上的检测差别可能影响20%的产品收率,所以建立起因子类产品效价准确的检测至关重要。[b][b]1 实验仪器与试剂1.1 仪器[/b][/b]Stago-compact全自动血凝仪(法国Diagnostica Stago公司),漩涡振荡器(美国Thermo Scientific公司)。[b][b]1.2 试剂[/b][/b]人凝血因子Ⅷ缺乏血浆(法国Diagnostica Stago公司),人凝血因子Ⅸ缺乏血浆(法国Diagnostica Stago公司),APTT试剂(法国Diagnostica Stago公司),Owren-Koller(稀释液)(法国Diagnostica Stago公司),0.025 mol/L氯化钙溶液(法国Diagnostica Stago公司),Desorb U(清洗液)(法国Diagnostica Stago公司),人凝血因子Ⅷ国家标准品(批号20100101),人凝血酶原复合物国家标准品(批号20130306),生理氯化钠溶液(石家庄四药有限公司),咪唑(天津市巴斯夫化工有限公司),氯化钠(天津市巴斯夫化工有限公司),枸橼酸钠(台山新宁制药有限公司),人血白蛋白(公司自产)。[b][b]2 方法2.1 人凝血因子Ⅷ不同稀释液稀释效价测定2.1.1 人凝血因子Ⅷ供试品Owren-Koller(稀释液)稀释效价测定方法[/b][/b] 人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.1.2 人凝血因子Ⅷ供试品药典稀释液稀释效价测定方法[/b][/b] 人凝血因子Ⅷ国家标准品的定标同2.1.1人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用药典稀释液(取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合,加适量20%人血白蛋白至终浓度为1%配制而成)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.2 人凝血酶原复合物人凝血因子Ⅸ不同稀释液稀释效价测定2.2.1 人凝血酶原复合物供试品Owren-Koller(稀释液)稀释效价测定方法[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《STAGO Compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]2.2.2 人凝血酶原复合物供试品药典稀释液稀释效价测定方法[/b][/b] 人凝血因子Ⅸ国家标准品的定标同2.1.1。人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用药典稀释液(取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合,加适量20%人血白蛋白至终浓度为1%配制而成)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]3 结果3.1 人凝血因子Ⅷ不同稀释液稀释效价测定结果[/b][/b] 2015ZK0801批人凝血因子Ⅷ为泰邦公司人凝血因子Ⅷ产品的质控品,取自正常生产的产品,用国家标准品标定后用作工作质控品。在进行人凝血因子Ⅷ效价测定时,分别用Owren-Koller(稀释液)和药典稀释液(取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合,加适量20%人血白蛋白至终浓度为1%配制而成)对每1 ml约含1.00 IU人凝血因子Ⅷ进行再稀释。检验结果见表1,效价检测结果为效价标示量的百分比。[align=center]表1 FⅧ质控品两种稀释液检测结果对比[/align][align=center][img=,586,268]http://ng1.17img.cn/bbsfiles/images/2017/09/201709141920_02_1626619_3.png[/img][/align]用柱形图表示,如图1:[align=center][img=,488,300]http://ng1.17img.cn/bbsfiles/images/2017/09/201709141921_02_1626619_3.png[/img][/align][align=center]图1 FⅧ质控品两种稀释液检测结果对比[/align] 选取泰邦公司生产的连续10个批次的人凝血因子Ⅷ产品,进行人凝血因子Ⅷ效价测定,分别用Owren-Koller(稀释液)和药典稀释液(取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合,加适量20%人血白蛋白至终浓度为1%配制而成)对每1 ml约含1.00 IU人凝血因子Ⅷ进行再稀释。检验结果见表2,效价检测结果为效价标示量的百分比。[align=center]表2 连续10批FⅧ两种稀释液检测结果对比[/align][align=center][img=,580,273]http://ng1.17img.cn/bbsfiles/images/2017/09/201709141921_03_1626619_3.png[/img][/align]用柱形图表示,如图2:[align=center][img=,499,310]http://ng1.17img.cn/bbsfiles/images/2017/09/201709141922_01_1626619_3.png[/img][/align][align=center]图 2 连续10批FⅧ两种稀释液检测结果对比[/align][b][b]3.2 人凝血酶原复合物不同稀释液稀释效价测定结果[/b][/b] 2015ZK0901批人凝血酶原复合物为泰邦公司人凝血酶原复合物产品的质控品,取自正常生产的产品,用国家标准品标定后用作工作质控品。在进行人凝血酶原复合物人凝血因子Ⅸ效价测定时,分别用Owren-Koller(稀释液)和药典稀释液(取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合,加适量20%人血白蛋白至终浓度为1%配制而成)对每1 ml约含1.00 IU人凝血因子Ⅸ进行再稀释。检验结果见表3,效价检测结果为效价标示量的百分比。[align=center]表3 PCC质控品两种稀释液检测结果对比[/align][align=center][img=,580,269]http://ng1.17img.cn/bbsfiles/images/2017/09/201709141923_01_1626619_3.png[/img][/align]用柱形图表示,如图3:[align=center][img=,548,288]http://ng1.17img.cn/bbsfiles/images/2017/09/201709141923_02_1626619_3.png[/img][/align][align=center]图3 PCC质控品两种稀释液检测结果对比[/align] 选取泰邦公司生产的连续10个批次的人凝血酶原复合物产品,进行人凝血酶原复合物人凝血因子Ⅸ效价测定,分别用Owren-Koller(稀释液)和药典稀释液(取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合,加适量20%人血白蛋白至终浓度为1%配制而成)对每1 ml约含1.00 IU人凝血因子Ⅸ进行再稀释。检验结果见表4,效价检测结果为效价标示量的百分比。[align=center]表4 连续10批PCC两种稀释液检测结果对比[/align][align=center][img=,573,259]http://ng1.17img.cn/bbsfiles/images/2017/09/201709141947_01_1626619_3.png[/img][/align]用柱形图表示,如图4:[align=center][img=,548,327]http://ng1.17img.cn/bbsfiles/images/2017/09/201709141947_03_1626619_3.png[/img][/align][align=center]图4 连续10批PCC两种稀释液检测结果对比[/align][b][b]4 讨论[/b][/b] 本实验确定了在人凝血因子Ⅷ的效价检测中,采用不同的稀释液对每1 ml约含1.00 IU人凝血因子Ⅷ的样品进行稀释,无论是对同一批质控品的测定还是对连续批次样品的测定,检测结果之间存在较大的差别,另外对FⅧ质控品两种稀释液检测结果运用软件SPSS17.0进行均值单因素ANOVA比较,计算P值,P<0.05表明两种方法的结果有显著性差异,含有蛋白的稀释液的检测结果明显高于不含蛋白的稀释液。而在人凝血酶原复合物人凝血因子Ⅸ的效价检测中,采用不同的稀释液对每1 ml约含1.00 IU人凝血因子Ⅸ的样品进行稀释,同一批质控品和连续批次样品检测结果之间差别较小,另外对PCC质控品两种稀释液检测结果运用软件SPSS17.0进行均值单因素ANOVA比较,计算P值,P>0.05表明两种方法的结果无显著性差异。在使用全自动血凝仪进行人凝血因子Ⅷ和人凝血酶原复合物等因子类血液制品效价检测时,一般按照仪器的使用说明书和配套试剂进行稀释检测,但是忽视了血凝仪的开发目的是用于临床血浆样品的检测,而血浆与高纯度的血液制品浓缩物是不同的,用检测血浆样品的方法进行因子类血液制品的效价检测可能影响检测结果。因子类血液制品效价检测时,同一样品采用不同的稀释液进行稀释检测结果可能存在较大差别,应对血凝仪是否可用于因子类血液制品进行评估,并应建立起正确的检测操作规程。因子类血液制品采用不同的稀释液进行稀释检测结果可能存在较大差别可能跟产品本身的性质有关,因子类血液制品经过分离、纯化,去除了众多的杂质蛋白,为高纯度的浓缩物,活性较高,但蛋白质含量较低,人凝血因子Ⅷ的蛋白质含量约为0.1%,人凝血酶原复合物的蛋白质含量约为2.3%,而临床血浆样本的蛋白质含量约为5%,, 人凝血因子Ⅷ加入含1%人血白蛋白的稀释液后对FⅧ效价测定影响较大,PCC中加入含1%人血白蛋白的稀释液后对FⅨ效价测定影响较小,可能是人凝血因子Ⅷ的蛋白质含量远小于血凝仪设计用于检测的血浆样本的蛋白含量,故建立不同蛋白质浓度梯度的稀释液对因子效价进行测定,从而确认蛋白质浓度对因效价测定的影响。[b]参考文献:[/b]Cheng E, Jinzenji D, Lorthiois AP, et al. Purification of coagulation factorⅧ using chromatographic methods. Direct chromatography of plasma in anion exchange resins . Biotechnol Lett, 2010, 32(9):1207-1214.李策生, 周志军, 胡勇, 等. 人凝血因子Ⅷ中试纯化工艺的质量控制 .中国生物制品学杂志, 2013, 26(10):1508-1512.冉曙光, 刘文芳, 赵辉. 凝血因子Ⅷ浓缩物的制备及安全性和有效性 .中国输血杂志, 2008, 21(2):156-159.倪道明, 朱威. 血液制品 . 北京: 人民卫生出版社, 2013:21.王卓, 赵雄, 吕茂民, 等. 血液制品的现状与展望 . 生物工程学报, 2011, 27(5):730-746.[b] [/b]
刚接触有机磷项目不久就接到了考核样,这个项目平时做的也不多,很多问题想问。 随样品下发的作业指导书上说;“本次计划要求参加实验室对检测浓样用纯水稀释100倍后参加测试”,取的是1ml考核样用纯水定容至100ml后进行萃取。 但是我现在依据的实验作业指导书是“水四版”,要求进行样品预处理的水量为500ml,然后进行萃取浓缩和定容。 现在样品量都不够,我该怎么进行测试啊? 作业指导书要求最后报出的考核样结果是按稀释100倍以后的浓度报,或者,那我是不是可以直接将标准和考核样用甲醇稀释100倍然后进行测试,最后报出浓度就可以了?
请教大家梯度的空白和样品稀释的问题我走梯度,流动相为A和B混合,A是乙酸铵调pH后的水与乙腈的混合液体,B为乙腈,那我走的空白是A?是B?还是两个的混合呢? 稀释样品用什么呢?A?是B?还是两个的混合呢?
仪器 日立Z-2000(石墨炉) 检测指标: Cd样品:水样标样系列:0 1 2 3 4 (ppb)其中某一样品检测值为27ppb 进行稀释10倍 结果为0.0182ppb这明显不太对啊稀释2倍 检测结果为 0.0406ppb求解释啊上午测试其他的指标都很正常不知道是不是有其他的元素跟Cd是同一个检测波长或者波长接近啊